14.0 g铜银合金与足量某浓度的硝酸反应,将放出的气体与1.12 L(标准状况)氧气混合,
 bluelyon2022-10-04 11:39:541条回答
bluelyon2022-10-04 11:39:541条回答
14.0 g铜银合金与足量某浓度的硝酸反应,将放出的气体与1.12 L(标准状况)氧气混合,
14 g铜银合金与足量的某浓度的硝酸反应,将放出的气体与1.12 L(标准状况下)氧气混合,通入水中恰好全部被吸收,则合金中铜的质量为( )
A.9.6 g B.6.4 g C.3.2 g D.1.6 g
从表面看,铜、银的质量分数未知,硝酸的浓度未知,似乎条件不足.但仔细观察可以发现,硝酸中的氮元素在整个过程中实际上化合价并未发生改变.由此,设铜的物质的量、银的物质的量分别为x、y,结合得失电子守恒可以得到:
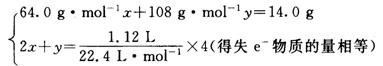
解得所以铜的质量为3.2 g.C
我的问题是:第二个式子后面为什么乘以4?
14 g铜银合金与足量的某浓度的硝酸反应,将放出的气体与1.12 L(标准状况下)氧气混合,通入水中恰好全部被吸收,则合金中铜的质量为( )
A.9.6 g B.6.4 g C.3.2 g D.1.6 g
从表面看,铜、银的质量分数未知,硝酸的浓度未知,似乎条件不足.但仔细观察可以发现,硝酸中的氮元素在整个过程中实际上化合价并未发生改变.由此,设铜的物质的量、银的物质的量分别为x、y,结合得失电子守恒可以得到:
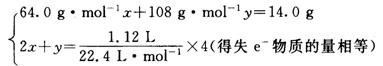
解得所以铜的质量为3.2 g.C
我的问题是:第二个式子后面为什么乘以4?

已提交,审核后显示!提交回复
共1条回复
 aqlq2005 共回答了17个问题
aqlq2005 共回答了17个问题 |采纳率88.2%- 第二个式子,意图是 电子守恒
因为Cu、Ag失去的电子,最终被O2全部得到.
左边是Cu、Ag失去的电子数2x+y,右边是O2得到的电子数1.12/22.4 * 4(物质的量×4)
1 mol O2得到4 mol 电子(0 → -2.有2个O) - 1年前
相关推荐
大家在问
- 1乡村挂红灯的阅读答案
- 2下列判断正确的是 A.含有共价键的化合物一定是共价化合物 B.晶体中一定存在化学键 C.含有离子键的化合物一定是离子化合
- 3严复晚年给门生的信中说:不佞垂老,亲见脂那七年之民国与欧罗巴四年亘古未有之血战,觉彼族三百年之进化,只做到“利己杀人,寡
- 4英语翻译1.All that is needed is a continuous supply of the basic
- 5我非常非常非常喜欢你用英语怎么说?
- 6化简x根号1/32x^3要快,今天的作业,急急急急急。
- 7设随机变量X、Y满足:X+2Y=1,则X与Y的相关系数等于?
- 8若一个正多边形的每个内角的度数是中心角的三倍,则正多边形的边数是多少,
- 9大正方体的棱长是3cm,小正方体的棱长是2cm,大小两个正方体表面积的最简比是(),体积了?
- 10图11-3-14中虚线AB右侧是磁感应强度为B1的匀强磁场,左侧是磁感应强度为B2的匀强磁场.已知B1/B2=2 .磁场
- 11(2010•扬州)已知⊙O1、⊙O2的半径分别为5cm、8cm,且它们的圆心距为8cm,则⊙O1与⊙O2的位置关系为(
- 12“2003年7月10日”用英语怎么读?美语呢?
- 13[D52] Go in quietly ________ wake the boy.
- 14谋事在人,成事在天所体现的哲学道理是什么?
- 15属予作文以记之中哪个字为通假字
