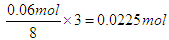在20ml0.30mol.lNaHCO3溶液中加入0.20mol.lNaCO3溶液后,溶液的PH
 mmfhy12022-10-04 11:39:542条回答
mmfhy12022-10-04 11:39:542条回答
在20ml0.30mol.lNaHCO3溶液中加入0.20mol.lNaCO3溶液后,溶液的PH
10.00,求加入Na2CO3的体积
10.00,求加入Na2CO3的体积

已提交,审核后显示!提交回复
共2条回复
 杨元浩 共回答了16个问题
杨元浩 共回答了16个问题 |采纳率100%- Ka1=4.30x10-7,Ka2=5.61x10-11
Kb1=Kw/Ka2,0.20mol/LNa2CO3溶液的pH值
pOH=1/2(pKb1-log0.2)=1/2(3.75+0.7)=2.23,cOH-=10^-2.23
0.50mol/LNaHCO3溶液的pH
pH=1/2(pKa1+pKa2)=1/2(6.38﹢10.25)=8.315=8.32 cOH-=10^-5.86
PH=10 cOH=10^-4
x10^-2.23 + 10^-5.86x0.03 / x+0.03 =10^-4
x=5.1ml - 1年前
 保卢斯 共回答了1个问题
保卢斯 共回答了1个问题 |采纳率- HCO3^的弱电离:HCO3^-——H+ + CO3^2-
下列关系存在:Ka2=[H+]*[CO3^2-]/[HCO3^-]
则有:PH=PKa2+lg[CO3^2-]/[HCO3^-]
已知PKa2=10.25
则:10.00=10.25+lg[CO3^2-]/[HCO3^-]
[CO3^2-]/[HCO3^-]=0.56
假设需要加入V毫升0.20mol/L的碳酸钠
0.20*V/0.30*20=0.56
V=16.8ml - 1年前
相关推荐
- 1.某一分解反应,当反应物浓度为0.20mol.L-1时反应速率为0.30mol.L-1.s-1.若该反应为二级反应,当
1.某一分解反应,当反应物浓度为0.20mol.L-1时反应速率为0.30mol.L-1.s-1.若该反应为二级反应,当反应物浓度为0.60 mol.L-1时,反应速率是
A.0.30mol.L-1.s-1
B.0.60mol.L-1.s-1
C.0.90mol.L-1.s-1
D.2.7mol.L-1.s-1
2.下列化合物中,所有碳原子共平面的是
A.2,3-二甲基-2-丁烯
B.3-己炔
C.叔丁基苯
D.1-丁烯
3.在一绝热箱中装有水,水中有一电阻丝,由蓄电池供电,通电后水及电阻丝的温度均略升高,若以水和电阻丝作为系统,其余为环境,则有
A.Q0
D.Q=0,W>0,ΔU0,ΔU>0
4.已知下列反应在标准态下均正向自发进行Cu2+ + Sn2+ = Cu + Sn4+;2Fe3+ + Cu = 2Fe2+ + Cu2+ 设 (Cu2+/ Cu)=(1),E0(Sn4+/ Sn2+)=(2),E0(Fe3+/ Fe2+)=(3),则由大到小顺序为
A..(3)>(2)>(1)
B..(2)>(1)>(3)
C..(3)>(1)>(2)
D..(1)>(3)>(2) 雨径清幽1年前2
雨径清幽1年前2 -
 xwx1238888 共回答了19个问题
xwx1238888 共回答了19个问题 |采纳率89.5%v=kcA^2,0.3=k(0.2)^2,k=7.5,v'=kcA'^2=7.5x(0.6)^2=2.7选D,2选A,3选C,4选B1年前查看全部
- 0.30mol/LHAc溶液与0.25mol/L NaAc 等体积混合,计算混合溶液的pH值.(已知K(HAc)=1.8
0.30mol/LHAc溶液与0.25mol/L NaAc 等体积混合,计算混合溶液的pH值.(已知K(HAc)=1.8*10-5)
 qepwq111年前1
qepwq111年前1 -
 origin1006 共回答了11个问题
origin1006 共回答了11个问题 |采纳率81.8%混合后浓度分别为0.15mol/L,0.125mol/L.
HAc=H++Ac-
K=[H+]*[Ac-]/[HAc],1.8*10^-5=[H+]*[0.125+x]/[0.15-x],因为电离度很小,可以简化计算,0.125+x=0.125,0.15-x=0.15,[H+]=1.8*10^-5*0.15/0.125=2.16*10^-5.
PH=4.67.1年前查看全部
- 硝酸的计算将0.30molCu2S与足量稀硝酸混合,在加热条件下反应,生成的产物有Cu(NO3)2、H2SO4、NO、和
硝酸的计算
将0.30molCu2S与足量稀硝酸混合,在加热条件下反应,生成的产物有Cu(NO3)2、H2SO4、NO、和H2O,则被还原的硝酸的物质的量是多少mol gaara6101年前2
gaara6101年前2 -
 D版KELLY 共回答了24个问题
D版KELLY 共回答了24个问题 |采纳率87.5%第一种方法可以配平方程式
3Cu2S + 22HNO3=6Cu(NO3)2+3H2SO4+10NO↑+8H2O
3 22
0.3mol x
解的x=2.2mol
被还原的HNO3的物质的量2.2 *10/22 =1.0mol
第二种方法是根据得失电子守恒
+1 +2
Cu Cu 失去0.3*2*1=0.6mol 电子
-2 +6
S S 失去0.3*8=2.4mol电子
共失去3.0 mol的电子
+5 +2
N N 被还原的硝酸的物质的量*3 =30.mol
则被还原的硝酸的物质的量=1.0mol1年前查看全部
- 在某100mL混合液中,HNO 3 和H 2 SO 4 的物质的量浓度分别是0.30mol·L -1 和0.15mol·
在某100mL混合液中,HNO 3 和H 2 SO 4 的物质的量浓度分别是0.30mol·L -1 和0.15mol·L -1 。向该混合液中加入3.20g铜粉,加热,待充分反应后,所得溶液中的Cu 2+ 的物质的量浓度(mol·L -1 )是
A.0.225 B.0.25 C.0.45 D.0.50  tangyanxia1年前1
tangyanxia1年前1 -
 梦断了dd 共回答了29个问题
梦断了dd 共回答了29个问题 |采纳率93.1%1年前查看全部
大家在问
- 1一元八角 不用陈述语气,而是感叹语气,是什么原因
- 2学校美术组有18人,书法组的人数比美术组多6人,合唱组的人数是美术组、书法组总人数的2倍.合唱组有多少人?
- 3生物膜在生命活动中发挥着非常重要的作用.如图所示的过程不能体现生物膜( )
- 4一件商品按成本价提高40%后标价,再打8折(标价的80%)销售,每件可获利18元,问这种商品每件成本价是多少元?
- 5我通常在中午睡午觉用英语怎么说
- 6应用一元一次方程——————打折销售
- 7已知A(4,1,3)B(2,-5,1),C是线段AB上一点,且AC/AB=1/3,则C点的坐标为?
- 8根据所给的汉语翻译句子。1.这是你的学校身份卡。 ____________________________ 2. 谢谢你
- 9英语:it is very rarely that one comes across a dead body 这里的ve
- 10a^+b^+c^-4(a+b+c)+12=0 求:4a+3b-5c的值 其中^为平方
- 11爱护环境,人人有责。首先,我们要节约用水,因为水是人类的源泉。然后,我们应该多植树,现在的沙漠化很严重。再一个,就是交通
- 1224个点一笔连起来,只能横线和竖线不能重复
- 13孔子的教育思想主张
- 14圆的一般方程和标准方程的差别与特点分别是什么?谢谢了
- 150+8+4+5等于?拜托各位大神