皓矾结晶水的测定一道实验探究题测定方法:称取28.7g皓矾晶(ZnSo4·xH2O)体置于C装置的硬质玻璃管中加热至完全
 慧自在2022-10-04 11:39:541条回答
慧自在2022-10-04 11:39:541条回答一道实验探究题
测定方法:称取28.7g皓矾晶(ZnSo4·xH2O)体置于C装置的硬质玻璃管中加热至完全失去结晶水,冷却至常温后,称量玻璃管中固体的质量为16.1g .请计算皓矾晶体结晶水的X值为___
为什么要通入CO2?


已提交,审核后显示!提交回复
共1条回复
 可曼 共回答了21个问题
可曼 共回答了21个问题 |采纳率85.7%- 皓矾晶体(ZnSo4·xH2O)加热至完全失去结晶水的方程式为 ZnSo4·xH2O==ZnSo4+xH2O
161+18x 161
28.7g 16.1g
列比例(161+18x):161 = 28.7:6.1 解得 x=7
通CO2是为了将水蒸气带出,避免水蒸气在C管内冷凝残留,以免影响称量玻璃管中固体质量. - 1年前
相关推荐
- 生产出皓矾(ZnSO4*7H2O)工艺中的后期流程如下框图,经前期处理后,在所得溶液A中含有的主要例子有Fe^3+.Zn
生产出皓矾(ZnSO4*7H2O)工艺中的后期流程如下框图,经前期处理后,在所得溶液A中含有的主要例子有Fe^3+.Zn^2+.SO4^2-
 没人评我来评1年前1
没人评我来评1年前1 -
 爱的跨越 共回答了17个问题
爱的跨越 共回答了17个问题 |采纳率88.2%没有图啊,题目不全.1年前查看全部
- (2013•丹徒区模拟)图1某兴趣小组回收废旧锌锰电池制备皓矾晶体(ZnSO4•xH2O),请回答下列问题:
(2013•丹徒区模拟)图1某兴趣小组回收废旧锌锰电池制备皓矾晶体(ZnSO4•xH2O),请回答下列问题:
(1)操作 I、II依次为图2中的(填字母)______.
(2)对图2中A图蒸发皿中所盛液体的量要求是______.
(3)图2中B图中的玻璃棒作用是______.
 kvkv00421年前1
kvkv00421年前1 -
 ebu8e0fo 共回答了12个问题
ebu8e0fo 共回答了12个问题 |采纳率83.3%解题思路:(1)由图1某兴趣小组回收废旧锌锰电池制备皓矾晶体,则可推测操作 I、II依次为过滤和蒸发操作;
(2)根据实验基本技能进行分析,进行蒸发时,液体不能超过蒸发皿容积的三分之二,要使用玻璃棒不断搅拌,以防液体溅出,出现大量固体时即停止加热,转移热的蒸发皿需要使用坩埚钳.
(3)图2中B图为过滤,则图中的玻璃棒作用是引流.(1)由图1某兴趣小组回收废旧锌锰电池制备皓矾晶体,则可推测操作I、II依次为过滤、蒸发操作,故答案为:B、A.
(2)进行蒸发时,液体不能超过蒸发皿容积的三分之二;
(3)图2中B图为过滤,则图中的玻璃棒作用是引流.
故答案为:
(1)B、A.
(2)液体不能超过蒸发皿容积的三分之二.
(3)引流.点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;蒸发与蒸馏操作.
考点点评: 本题考查了实验操作,完成此题,可以依据已有的知识进行.1年前查看全部
- (2014•镇江模拟)某兴趣小组回收废旧锌锰电池制备皓矾晶体(ZnSO4•xH2O).
(2014•镇江模拟)某兴趣小组回收废旧锌锰电池制备皓矾晶体(ZnSO4•xH2O).
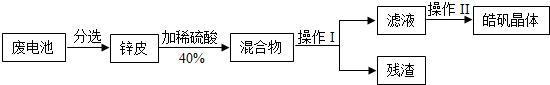
请回答下列问题:
(1)操作 I中的玻璃棒作用是______.
(2)操作Ⅱ的过程是先给滤液加热浓缩、______、过滤.
(3)配制40%的稀硫酸的步骤有:①稀释 ②计算 ③装瓶并贴标签 ④量取,其正确的顺序为______(填序号).配制过程中,需要的玻璃仪器有量筒、烧杯、玻璃棒及______. shihengwei1年前1
shihengwei1年前1 -
 oo观首席女oo 共回答了23个问题
oo观首席女oo 共回答了23个问题 |采纳率87%解题思路:(1)根据操作Ⅰ的名称和过程来分析玻璃棒的作用;
(2)根据操作过程是将溶质从溶液中分离出来的原理来分析;
(3)根据配制溶质质量分数一定的溶液的基本步骤进行分析解答.实验室配制氢氧化钠溶液操作步骤分别是:计算、量取、溶解,根据各操作所需要使用的仪器进行分析解答.(1)操作Ⅰ是分离难溶性固体与液体的一种操作,是过滤,在过滤操作中玻璃棒的作用是引流;
(2)操作Ⅱ是浓缩结晶的过程,因为硫酸锌的溶解度受温度影响比较大,故采取降温结晶的方法;
(3)用浓硫酸配制40%的稀硫酸,先计算出所需浓硫酸和水的质量和体积,再量取浓硫酸和水的体积,然后进行溶解,最后进行装瓶并贴标签.需要用到烧杯、玻璃棒、量筒、胶头滴管等玻璃仪器.
故答案为:(1)引流; (2)降温结晶; (3)②④①③;胶头滴管.点评:
本题考点: 物质的相互转化和制备;一定溶质质量分数的溶液的配制;过滤的原理、方法及其应用;蒸发与蒸馏操作;金属的化学性质.
考点点评: 本题难度不大,明确配制一定溶质质量分数的溶液实验步骤、所需仪器等是正确解答本题的关键.1年前查看全部
- (2009•浙江模拟)某化工厂生产皓矾(ZnSO4•7H2O),结晶前的饱和溶液(呈酸性)中含有少量Cu2+、Fe3+、
(2009•浙江模拟)某化工厂生产皓矾(ZnSO4•7H2O),结晶前的饱和溶液(呈酸性)中含有少量Cu2+、Fe3+、Fe2+等杂质.已知0.01mol/L的Fe3+开始沉淀到完全沉淀的pH范围是2.7~3.7;ZnSO4饱和溶液(0.34mol/L)中Zn2+开始沉淀到完全沉淀的pH范围是5.7~8.0;当pH<5.7时,Na2CO3、ZnCO3发生酸解生成CO2.该厂除杂及生产的工艺流程如图所示:

(1)加入的试剂②最好是______(填名称),其主要作用是______.
(2)为了调整溶液的pH,加入试剂③,供选用的试剂有NaOH、Na2CO3、ZnCO3、NH3•H2O、Ca(OH)2等,应当选用______,理由是______.
(3)从溶液中获得皓矾的操作依次是______. aa4634901年前1
aa4634901年前1 -
 叮叮乡 共回答了12个问题
叮叮乡 共回答了12个问题 |采纳率100%解题思路:要除去溶液中的杂质,在步骤①中加入过量的铁粉,发生反应:Fe+2Fe3+=3Fe2+和Fe+Cu2+=Fe2++Cu,过滤,除去置换出来的铜和剩余的铁粉,所得滤液中含有的金属离子是Fe2+和Zn2+.根据题干中所给出的信息可知,需先将Fe2+氧化为Fe3+,然后再将Fe3+转化为Fe(OH)3沉淀除去,在选择氧化剂时,既要能氧化Fe2+又不引入新的杂质,不宜选用Cl2、KMnO4、HNO3等氧化剂,加入的试剂②为双氧水(H2O2的水溶液)最适宜.只要调整溶液的pH在2.7~5.7的范围内,Fe3+可以完全沉淀而除去,Zn2+不会沉淀,加入的试剂③可以是ZnCO3,能控制pH在5.7附近,且不引入杂质离子.(1)需先将Fe2+氧化为Fe3+,然后再将Fe3+转化为Fe(OH)3沉淀除去,在选择氧化剂时,既要能氧化Fe2+又不引入新的杂质,不宜选用Cl2、KMnO4、HNO3等氧化剂,加入的试剂②为双氧水(H2O2的水溶液)最适宜,
故答案为:过氧化氢; 将Fe2+氧化成Fe3+;
(2)只要调整溶液的pH在2.7~5.7的范围内,Fe3+可以完全沉淀而除去,Zn2+不会沉淀,加入的试剂③是ZnCO3,能控制pH在5.7附近,且不引入杂质离子,
故答案为:ZnCO3; 能控制pH在5.7附近,且不引入杂质离子;
(3)从溶液中获得皓矾,应先将溶液进行蒸发浓缩,冷却后进行结晶,然后过滤,由于固体具有吸附能力,固体表面吸附溶液中的离子,最后要进行洗涤.
故答案为:蒸发、冷却、过滤、洗涤.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查物质的制备、分离流程,题目难度中等,注意把握相关实验操作,易错点为(2),注意加入碳酸锌的目的是调节溶液的pH,有利于铁离子的水解.1年前查看全部
- 将28.7克皓矾加热到质量不再变化,冷却,称量(ZnSO4*XH2O)加热到质量不再变化,冷却,称量却发现剩余固体的质量
将28.7克皓矾加热到质量不再变化,冷却,称量(ZnSO4*XH2O)加热到质量不再变化,冷却,称量却发现剩余固体的质量是16.1克,求皓矾的化学式
 juhgfthghhfg1年前3
juhgfthghhfg1年前3 -
 沙丘夕阳线 共回答了18个问题
沙丘夕阳线 共回答了18个问题 |采纳率94.4%16.1g ZnSO4 0.1mol
12.6g H2O 0.7mol
ZnSO4:XH2O=1:7
所以,X=71年前查看全部
- 硫酸钡是唯一的无毒的钡盐,工业上以硫酸钡等为原料通过下列流程反应可以制备锌钡白(BaSO4+ZnS)和过氧化氢.(皓矾为
硫酸钡是唯一的无毒的钡盐,工业上以硫酸钡等为原料通过下列流程反应可以制备锌钡白(baso4+zns)和过氧化氢.(皓矾为znso4•7h2o)

(1)上述流程***有7个化学反应,其中有______个属于氧化还原反应.
(2)写出过氧化氢和物质c的电子式:______,______.
(3)写出f、g的化学式:f______、g______.
(4)写出下列化学反应方程式:反应③______.反应⑦______.
(5)取锌钡白固体16.5g溶于100ml 1mol/l的h2so4 溶液中,放出h2s 气体1008ml(已折算成标准状况)
①不计溶液体积变化,所得溶液中氢硫酸的物质的量浓度为______mol/l;
②加热驱尽溶液中h2s 后,为使锌离子刚好完全沉淀,应加入 1mol/l的naoh溶液______ml. fjfcvvf551年前1
fjfcvvf551年前1 -
 didididd 共回答了23个问题
didididd 共回答了23个问题 |采纳率91.3%解题思路:重晶石是BaSO4,黑色单质A通常是碳.由BaSO4和单质碳高温生成气体B,B燃烧生成气体C,可知B是CO,C是CO2.有臭鸡蛋气味的气体E是H2S,而H2S是由D溶于H2O通入CO2所得,则D中含S2-.BaSO4和单质碳高温生成气体CO,同时生成白色固体D,则D是BaS.BaS溶于H2O,与皓矾(ZnSO4•7H2O)反应生成锌钡白(BaSO4和ZnS的混合物).BaS溶于H2O 通入CO2产生H2S,同时生成白色沉淀F,可知F是BaCO3.进一步推出G是BaO,H是BaO2,BaO2与稀H2SO4反应生成BaSO4沉淀和H2O2.
(1)元素化合价在反应前后发生变化的反应属于氧化还原反应;
(2)H2O2属于共价化合物,分子中氧原子与氢原子之间形成1对共用电子对,氧原子之间形成1对共用电子对;
C是CO2,属于共价化合物,分子中碳原子与氧原子之间形成2对共用电子对;
(3)由分析可知,F是BaCO3,G是BaO;
(4)根据上述分析可知各反应中反应物与产物,配平书写方程式;
(5)①锌钡白固体中n(ZnS)=n(BaSO4),计算16.5g锌钡白固体中n(ZnS)=n(BaSO4)=0.05ml,1008mLH2S气体的物质的量为[1.008L/22.4L/mol]=0.045mol,所以溶液中氢硫酸的物质的量为0.05mol-0.045mol=0.005mol,再根据c=[n/V]计算硫化氢的浓度;
②加热驱尽溶液中H2S 后,为使锌离子刚好完全沉淀,形成的溶液为硫酸钠溶液,根据硫酸根守恒可知,n(Na2SO4)=n(H2SO4),由钠离子守恒可知,n(NaOH)=2n(Na2SO4)=2n(H2SO4),再根据V=[n/c]计算.重晶石是BaSO4,黑色单质A通常是碳.由BaSO4和单质碳高温生成气体B,B燃烧生成气体C,可知B是CO,C是CO2.有臭鸡蛋气味的气体E是H2S,而H2S是由D溶于H2O通入CO2所得,则D中含S2-.BaSO4和单质碳高温生成气体CO,同时生成白色固体D,则D是BaS.BaS溶于H2O,与皓矾(ZnSO4•7H2O)反应生成锌钡白(BaSO4和ZnS的混合物).BaS溶于H2O 通入CO2产生H2S,同时生成白色沉淀F,可知F是BaCO3.进一步推出G是BaO,H是BaO2,BaO2与稀H2SO4反应生成BaSO4沉淀和H2O2.
(1)流程中7个化学反应,反应①BaSO4+4C=BaS+4CO↑,碳元素的化合价由0价升高为+2价,硫元素化合价由+6价降低为-2价,属于氧化还原反应;反应②是CO的燃烧,碳元素、氧元素化合价发生变化,属于氧化还原反应;反应③BaS+ZnSO4=ZnS↓+BaSO4↓,各元素化合价未发生变化,属于复分解反应;反应④BaS+H2O+CO2=BaCO3↓+H2S,各元素化合价未发生变化,属于复分解反应;反应⑤为BaCO3
高温
.
Ba+CO2↑,各元素化合价未发生变化,属于分解反应;反应⑥为2BaO+O2
△
.
2BaO2,氧元素化合价发生变化,属于氧化还原反应;反应⑦BaO2+H2SO4=BaSO4↓+H2O2,各元素化合价未发生变化,属于复分解反应.所以7个反应中①②⑥属于氧化还原反应,故答案为:3;
(2)H2O2属于共价化合物,分子中氧原子与氢原子之间形成1对共用电子对,氧原子之间形成1对共用电子对,电子式为 ;
;
C是CO2,属于共价化合物,分子中碳原子与氧原子之间形成2对共用电子对,电子式为 ,
,
故答案为: ;
; ;
;
(3)由分析可知,F是BaCO3,G是BaO,故答案为:BaCO3;BaO;
(4)由分析可知,反应③:BaS+ZnSO4=ZnS↓+BaSO4↓.反应⑦:BaO2+H2SO4=BaSO4↓+H2O2,
故答案为:BaS+ZnSO4=ZnS↓+BaSO4↓;BaO2+H2SO4=BaSO4↓+H2O2;
(5)①由工艺流程,反应③:BaS+ZnSO4=ZnS↓+BaSO4↓可知,锌钡白固体中n(ZnS)=n(BaSO4),所以n(ZnS)×97g/mol+=n(BaSO4)×233g/mol=16.5g,解得n(ZnS)=n(BaSO4)=0.05ml,1008mLH2S气体的物质的量为[1.008L/22.4L/mol]=0.045mol,所以溶液中氢硫酸的物质的量为0.05mol-0.045mol=0.005mol,溶液中氢硫酸的物质的量浓度为[0.005mol/0.1L]=0.05mol/L,
故答案为:0.05;
②加热驱尽溶液中H2S 后,为使锌离子刚好完全沉淀,形成的溶液为硫酸钠溶液,根据硫酸根守恒可知,n(Na2SO4)=n(H2SO4),由钠离子守恒可知,n(NaOH)=2n(Na2SO4)=2n(H2SO4)=2×0.1L×1mol/L=0.2mol,故需要1mol/L的NaOH溶液体积为[0.2mol/1mol/L]=0.2L=200mL,故答案为:200.点评:
本题考点: 制备实验方案的设计;难溶电解质的溶解平衡及沉淀转化的本质;含硫物质的性质及综合应用.
考点点评: 本题以制备锌钡白和过氧化氢为载体,考查物质推断、氧化还原反应、化学用语、化学计算等,难度中等.是对所学知识的综合运用与能力的考查,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力.1年前查看全部
大家在问
- 1英语翻译这是我的舞台,我静静的等待着,等待着那一刻的到来.
- 2Every morning punctually .the hotel lobby.
- 3求y=x²+2在x=1和x=a时的导数
- 4半圆周长是直径的多少倍写出算式,解释算式的意思.答案清晰一些,过程要完整,
- 5在做观察鲫鱼的实验时,往往已捉到手的鱼又让它挣脱,这是其体表具有黏液的缘故。鱼体表黏液的主要作用是 [
- 6将自然数按以下规律排列,则2012所在的位置是第 行第 &
- 720#材质、常温下、内径65mm无缝钢管承压3Mpa压力需要多大壁厚
- 8高气压的到来预示着什么天气的到来
- 9《我对老师有礼貌》作文大约100字.
- 10糖类和脂肪不一定有,蛋白质也不应定有,而核酸一定有的的元素()
- 11诸葛亮是分几步实施“空城计”的?
- 12买3千克茶叶和5千克糖需要420元,买同样的5千克茶叶和5千克糖,需要640元.每千克茶叶和每千克糖各多少元?
- 13两个小队植树,红队植的棵树的四分之一等于绿队的五分之一,两队共植树216棵,每个队各植树多少棵?
- 14回忆 作文
- 15为什么我那么喜欢星星呢?
