电镀厂一般一月需要多少硫酸用量
 shang322022-10-04 11:39:544条回答
shang322022-10-04 11:39:544条回答
已提交,审核后显示!提交回复
共4条回复
 去年时 共回答了10个问题
去年时 共回答了10个问题 |采纳率100%- 根据镀种、工艺、产品、产量不同硫酸用量不同.
- 1年前
 缘尽情了 共回答了1个问题
缘尽情了 共回答了1个问题 |采纳率- 再补充一下你的问题。
一般一百个平米消耗硫酸60升这样子。当然还要相关人员做到很好的控制。不然消耗也是很多的。 - 1年前
 宝贝蓝熙 共回答了1个问题
宝贝蓝熙 共回答了1个问题 |采纳率- 你的问题就像一家人一个月需要多少生活用水一样模糊。
电镀厂也是有规模的,
做的产品多用酸也就多了 - 1年前
 mofo 共回答了1个问题
mofo 共回答了1个问题 |采纳率- 我厂150人左右,大概要用十几吨的样子。
- 1年前
相关推荐
- 某工业园区有相邻的两家工厂:一家是造纸厂,另一家是电镀厂.造纸的第一道程
某工业园区有相邻的两家工厂:一家是造纸厂,另一家是电镀厂.造纸的第一道程
序是制取纸浆,这个过程是将原材料通过氢氧化钠来处理,其原理是利用氢氧化钠的__▲__性;电镀的第一道程序是酸洗,将用稀盐酸来除去零件表面的铁锈,这个过程的化学反应方程式:___▲__.这两家工厂的废液都有可能造成环境污染,请你给他们提供一条合理化建议:__▲__. luoluo50651年前1
luoluo50651年前1 -
 mxh625 共回答了14个问题
mxh625 共回答了14个问题 |采纳率85.7%氢氧化钠的腐蚀性
Fe2O3+6HCl=2Fecl3+3H2O
可以将两厂的废液混合,形成Nacl和Fe(OH)3沉淀1年前查看全部
- (2012•哈尔滨)电镀是金属防锈的方法之一.某电镀厂有三个分别给金属表面镀锌、镀铜、镀银的车间,每个车间电
(2012•哈尔滨)电镀是金属防锈的方法之一.某电镀厂有三个分别给金属表面镀锌、镀铜、镀银的车间,每个车间电镀液的溶质中只含有易溶的锌盐、铜盐和银盐中的一种物质.现取三个车间的电镀液于烧杯中,标为1、2、3号,某小组同学通过实验对三种电镀液中溶质成分进行探究.
[提出问题]三种电镀液中溶质的成分是什么?
[探究实验1]
[表达与交流]甲同学认为2号电镀液中的溶质一定不是硫酸铜,你认为他的结论(1)
正确
正确
(填“正确”或“不正确”).
[探究实验2]
[反思与评价]乙同学认为3号电镀液中的溶质一定是硫酸锌,请你对乙同学的结论给予评价(2)
不正确;3号电镀液中加入氯化钡溶液出现白色沉淀,溶液中可能含有硫酸锌,硫酸锌与氯化钡反应生成硫酸钡是白色沉淀,也可能含硝酸银,硝酸银与氯化钡反应生成氯化银是白色沉淀(或产生白色沉淀只能证明3号溶液中含有硫酸根离子或银离子),因此乙同学认为3号电镀液中的溶质一定是硫酸锌是不正确的
不正确;3号电镀液中加入氯化钡溶液出现白色沉淀,溶液中可能含有硫酸锌,硫酸锌与氯化钡反应生成硫酸钡是白色沉淀,也可能含硝酸银,硝酸银与氯化钡反应生成氯化银是白色沉淀(或产生白色沉淀只能证明3号溶液中含有硫酸根离子或银离子),因此乙同学认为3号电镀液中的溶质一定是硫酸锌是不正确的
.
[探究实验3]根据上述实验,丙同学取少量的1号电镀液与少量的2号电镀液混合,立即出现有(3)
白色沉淀
白色沉淀
生成的明显现象,由此小组同学确定了三种电镀液中分别含有的溶质的成分.
解释与结论:探究实验3中发生反应的化学方程式为(4)
CuCl2+2AgNO3=2AgCl↓+Cu(NO3)2
CuCl2+2AgNO3=2AgCl↓+Cu(NO3)2
,请帮助他们将三种电镀液中溶质成分的化学式填写在烧杯的标签上(5) doxqt1n1年前1
doxqt1n1年前1 -
 3岁已经好帅 共回答了27个问题
3岁已经好帅 共回答了27个问题 |采纳率77.8%1)对于清除氧混合浓硫酸,氧气,水蒸汽,瓶子可以从A-边传中被传唱成;
2)当使用排水法收集氢瓶首先充满水,气,从终端B的访问.
3)CO排放一瓶水实验,水应该传递到A-.
4)收集氧气排空气法,气体传递到A-.
5)要删除的混合气体通入CO,CO2,第一次安装NaOH溶液的瓶子,从A-.
希望采用手工制作的码字1年前查看全部
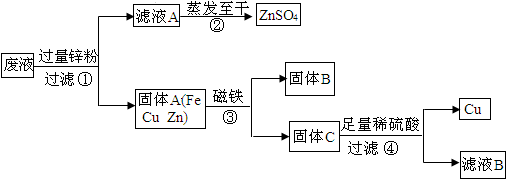
- (2013•大兴区二模)如图,某电镀厂排放的污水中含有CuSO4、FeSO4和ZnSO4,为减少水污染及节约成本,回收重
(2013•大兴区二模)如图,某电镀厂排放的污水中含有CuSO4、FeSO4和ZnSO4,为减少水污染及节约成本,回收重要物质硫酸锌、金属铁和铜,设计如图流程.下列说法不正确的是( )

A.固体b为铁
B.操作①、②中玻璃棒的作用不同
C.滤液a中含有3种溶质
D.除污水外,含锌元素的有:固体a、b,滤液a、b fkcqi1年前1
fkcqi1年前1 -
 rxnews 共回答了15个问题
rxnews 共回答了15个问题 |采纳率86.7%解题思路:在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,氢前的金属能与酸发生置换反应生成氢气,可以根据金属与酸的反应和金属与盐溶液的反应来进行固体的分离;
向污水中加入过量锌,锌和硫酸铜反应生成硫酸锌和铜,锌和硫酸亚铁反应生成硫酸锌和铁,过滤得到固体a,其中含有铜、铁和锌,滤液b是硫酸锌溶液;
向铜、铁和锌中加入过量稀硫酸,铜不能反应,铁和锌与稀硫酸反应分别生成硫酸亚铁和氢气、硫酸锌和氢气,过滤得到铜,滤液a中含有硫酸亚铁、硫酸锌和稀硫酸;
向滤液a中加入适量的锌,锌和硫酸亚铁反应生成硫酸锌和铁,和稀硫酸反应生成硫酸锌和氢气,过滤得到固体b--铁;
蒸发硫酸锌溶液可以得到硫酸锌固体.A、由流图可知固体b为铁,故A正确.
B、操作①中玻璃棒的作用是引流,②中玻璃棒的作用是搅拌.故B正确.
C、滤液a中含有硫酸亚铁、硫酸锌和硫酸3种溶质,故C正确.
D、固体a中含有锌,c是硫酸锌,滤液a中含有硫酸锌,b中含有硫酸锌.故D错误.
故选:D.点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;蒸发与蒸馏操作;金属的化学性质.
考点点评: 根据金属的活动性,排在氢前面的金属都可把酸中的氢置换出来而得到氢气;活动性强的金属可把活动性弱的金属从其盐溶液中置换出来.1年前查看全部
- 某电镀厂排放的污水中含有CuSO4、ZnSO4、FeSO4,为减少水污染及节约成本,回收重要物质硫酸锌及有关金属,设计如
某电镀厂排放的污水中含有CuSO4、ZnSO4、FeSO4,为减少水污染及节约成本,回收重要物质硫酸锌及有关金属,设计如下所示流程.

该回收流程中:固体A的成分是______;含铁元素的物质(污水除外)有______(填字母序号),试写出滤液C与适量的甲发生的化学反应方程式______. Doraemon1年前1
Doraemon1年前1 -
 -寒曦- 共回答了21个问题
-寒曦- 共回答了21个问题 |采纳率81%解题思路:在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,氢前的金属能与酸发生置换反应生成氢气,可以根据金属与酸的反应和金属与盐溶液的反应来进行固体的分离;向污水中加入过量锌,锌和硫酸铜反应生成硫酸锌和铜,锌和硫酸亚铁反应生成硫酸锌和铁,过滤得到固体A,其中含有铜、铁和锌,滤液B是硫酸锌溶液;向铜、铁和锌中加入过量稀硫酸,铜不能反应,铁和锌与稀硫酸反应分别生成硫酸亚铁和氢气、硫酸锌和氢气,过滤得到铜,滤液中含有硫酸亚铁、硫酸锌和稀硫酸;向滤液中加入适量的锌,锌和硫酸亚铁反应生成硫酸锌和铁,和稀硫酸反应生成硫酸锌和氢气,过滤得到固体D--铁;向污水中加入过量锌,锌和硫酸铜反应生成硫酸锌和铜,锌和硫酸亚铁反应生成硫酸锌和铁,过滤得到固体A,其中含有铜、铁和锌,滤液B是硫酸锌溶液;
向铜、铁和锌中加入过量稀硫酸,铜不能反应,铁和锌与稀硫酸反应分别生成硫酸亚铁和氢气、硫酸锌和氢气,过滤得到铜,滤液中含有硫酸亚铁、硫酸锌和稀硫酸;
向滤液中加入适量的锌,锌和硫酸亚铁反应生成硫酸锌和铁,和稀硫酸反应生成硫酸锌和氢气,过滤得到固体D--铁;
滤液C为硫酸亚铁、硫酸锌和稀硫酸的混合液,与适量的甲(锌)发生的化学反应方程式为:Zn+H2SO4═ZnSO4+H2↑;Zn+FeSO4═ZnSO4+Fe
故答案为:
Cu、Fe、Zn;A、滤液C和D;Zn+H2SO4═ZnSO4+H2↑;Zn+FeSO4═ZnSO4+Fe点评:
本题考点: 金属的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 根据金属的活动性,排在氢前面的金属都可把酸中的氢置换出来而得到氢气;活动性强的金属可把活动性弱的金属从其盐溶液中置换出来.1年前查看全部
- (5分)某电镀厂排放的污水中含有CuSO4、ZnSO4和FeSO4,为减少水污染及节约成本,回收重要原料硫酸锌和有关金属
(5分)某电镀厂排放的污水中含有CuSO4、ZnSO4和FeSO4,为减少水污染及节约成本,回收重要原料硫酸锌和有关金属,设计如下图所示流程。

请回答:
(1)步骤①的操作是 ,步骤③使用的方法是 。
(2)固体A的成分是 ,固体B的成分是 。
(3)步骤④中反应的化学方程式是 。 龙鱼_aa1年前1
龙鱼_aa1年前1 -
 gdwwei 共回答了12个问题
gdwwei 共回答了12个问题 |采纳率91.7%(1)过滤用磁铁吸引
(2)ZnSO4 Fe、Zn、Cu
(3)Zn + H2SO4 =" ZnSO4" + H2↑ (或Zn + CuSO4 =" ZnSO4" + Cu)
分析:在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,氢前的金属能与酸发生置换反应生成氢气,铁能被磁铁吸引,可以根据金属与酸的反应和金属与盐溶液的反应来进行固体的分离.(1)由实验过程图可判断,操作1完成后原混合物分成了固体和滤液两部分;利用这一特点可判断操作1为过滤操作;锌、铁、铜三种金属单质中,只有铁能被磁铁所吸起,因此使用磁铁吸引后,三种上金属分为两组,一组为铁粉另一组为铜粉和锌粉的混合物;根据后面的实验可判断固体C为铁粉;过量锌粉与CuSO 4 、ZnSO 4 、FeSO 4 混合溶液反应后所得溶液为ZnSO 4 溶液,铜粉与锌粉的混合物与足量稀硫酸反应后,所得溶液为ZnSO 4 溶液;
(3)过量锌粉与CuSO 4 、ZnSO 4 、FeSO 4 混合溶液中的CuSO 4 、FeSO 4 都可以发生置换反应;加入足量稀硫酸,金属混合粉末中的锌粉可与稀硫酸发生置换反应.
(1)操作1把混合物分离成固体和滤液,所以,操作1为过滤操作;利用磁铁可以吸引铁的特点,可判断固体B、C为铁粉或铜粉与锌粉的混合物之一;由于固体B能与足量稀硫酸反应后可得到铜粉,可确定固体B为铜粉与锌粉的混合物,而固体C为铁粉.故答案为:过滤,用磁铁吸引;
根据金属活动性锌>铁>铜,向含有CuSO 4 、ZnSO 4 、FeSO 4 的废液加入过量的锌粉,铁、铜被置换出来,因此过滤后所得固体A中含有铁、铜和未反应的锌;
(2)固体B的成分是Fe、Zn、Cu,根据金属的活动性锌>铁>氢>铜,向CuSO 4 、ZnSO 4 、FeSO 4 混合溶液中加入过量锌粉后过滤,所得滤液为ZnSO 4 溶液;把铜粉与锌粉的混合物放入足量稀硫酸中充分反应后过滤,所得滤液为ZnSO 4 溶液;故答案为:ZnSO 4 ,Fe、Zn、Cu;
(3)过量的锌粉与混合溶液中的硫酸铜反应,可置换出铜同时生成硫酸锌;与混合溶液中的硫酸亚铁反应,可置换出铁同时生成硫酸锌;铜粉与锌粉的混合物中的锌粉能与稀硫酸发生置换反应生成硫酸锌和氢气;故答案为:Zn+CuSO 4 =ZnSO 4 +Cu(或Zn+FeSO 4 =ZnSO 4 +Fe);Zn+H 2 SO 4 =ZnSO 4 +H 2 .1年前查看全部
- 电镀 工艺流程 英语在电镀厂做的朋友(知道电镀英语的更好)我客户想要知道挂白颜色是怎么电镀的。原句如下:after th
电镀 工艺流程 英语
在电镀厂做的朋友(知道电镀英语的更好)我客户想要知道挂白颜色是怎么电镀的。原句如下:after the material is taken out from the nickle bath a coating is applied on the material that is calledPU Laquer
i want to know what they call the product which thy put after the material is taken out from the nickle bath. 422227223222241年前1
422227223222241年前1 -
 夜黑嘿 共回答了28个问题
夜黑嘿 共回答了28个问题 |采纳率82.1%你所说的产品应该是电完光镍后做电泳漆的.工艺流程应该是 镀铜--镀镍--电泳漆.
在镍镀槽出来的镀层应该叫光镍,镀出来的是哑的叫哑镍1年前查看全部
- 我市某电镀厂为减少水污染又节约成本,从含有CuSO4、ZnSO4、FeSO4的废水中回收重要原料ZnSO4和有关金属,实
我市某电镀厂为减少水污染又节约成本,从含有CuSO4、ZnSO4、FeSO4的废水中回收重要原料ZnSO4和有关金属,实验过程如下:

请回答:
(1)固体A中含有______;
(2)滤液A和滤液B含有相同的溶质是______. 明月依旧在1年前1
明月依旧在1年前1 -
 justzhu 共回答了14个问题
justzhu 共回答了14个问题 |采纳率92.9%解题思路:(1)根据过量的锌粉分析;
(2)由题意可知:②中蒸发至干,得硫酸锌;因为滤液A和滤液B含有相同的溶质,所以步骤④中加入的稀硫酸,得硫酸锌;(1)锌的活动性大于铜和铁,所以过量的锌粉会置换CuSO4、FeSO4中的铜和铁,并且有剩余;
(2)由题意可知:②中蒸发至干,得硫酸锌;因为滤液A和滤液B含有相同的溶质硫酸锌,化学式为ZnSO4;
故答案为:(1)铜、铁和锌;(2)ZnSO4点评:
本题考点: 金属的化学性质.
考点点评: 仔细审题,有题意可知一些信息,根据信息推导做题;利用金属活动性顺序,回收工业重要原料硫酸锌和有关金属.1年前查看全部
- 某电镀厂每天排出含1%氯化铜的废水135t.如果不经处理而直接排入不但造成水质污染而且浪费金属资源.学校化学兴趣小组向厂
某电镀厂每天排出含1%氯化铜的废水135t.如果不经处理而直接排入不但造成水质污染而且浪费金属资源.学校化学兴趣小组向厂方提出用废铁屑处理废水的建议.
(1)计算每天用含铁80%的铁屑处理废水,最少需要铁屑多少吨?理论上可得到铜多少吨?
(2)得到的铜中混有铁,除出铁的方法是______. xuedong12121年前1
xuedong12121年前1 -
 赌坊gg办 共回答了27个问题
赌坊gg办 共回答了27个问题 |采纳率96.3%解题思路:(1)根据铁和氯化铜反应的方程式,利用氯化铜的质量求出需要铁屑的质量和可得到铜的质量;
(2)根据金属活动性顺序的意义进行分析.(1)设最少需要铁屑的质量为x,理论上可得到铜的质量为y
Fe+CuCl2═FeCl2+Cu
56 135 64
x 135t×1% y
[56/135=
x
135t×1%]
x=0.56t
[135/64=
135t×1%
y]
y=0.64t
(2)得到的铜中混有铁,除出铁的方法是加足量的稀盐酸,过滤.
答案:
(1)最少需要铁屑的质量为0.56吨,理论上可得到铜的质量为0.64吨
(2)加足量的稀盐酸,过滤点评:
本题考点: 根据化学反应方程式的计算;金属的化学性质.
考点点评: 本题考查了金属活动性顺序的应用,化学方程式的计算,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- 某小电镀厂时常排出一些带颜色的废水,废水所到之处寸草不生,周围环境污染很大.学校科技兴趣小组的同学为了弄清污水的主要污染
某小电镀厂时常排出一些带颜色的废水,废水所到之处寸草不生,周围环境污染很大.学校科技兴趣小组的同学为了弄清污水的主要污染物,取样品进行下列实验:
①、将样品倒在4支试管A、B、C、D中,溶液显蓝绿色,没有沉淀物;
②、在试管A中,滴入几滴烧碱溶液,有红褐色絮状沉淀和蓝色絮状沉淀产生.
③、在试管B中,滴入几滴硝酸银溶液,有白色沉淀产生,再滴入稀硝酸,沉淀不溶解;
④、在试管C中,滴入几滴氯化钡溶液,没有沉淀产生.
⑵、写出实验②中相应的化学方程式:
、 ;
.
 一辈子的十年1年前1
一辈子的十年1年前1 -
 CP控uu 共回答了17个问题
CP控uu 共回答了17个问题 |采纳率94.1%肯定没有硫酸钠,碳酸钠,不然氯化钡怎么会不沉淀.1,溶液蓝绿色可能是铜离子,镍离子,亚铁例子2,加烧碱有红褐色和蓝色沉淀,表示有为氢氧化铜和氢氧化铁,而3价铁为黄色,因此为亚铁,也就是溶液中含有亚铁例子和铜离子,因为氢氧化镍为白色偏绿沉淀,故无镍离子,3加硝酸银有白色不溶于硝酸的沉淀为氯离子,加氯化钡没沉淀说明没有硫酸根和碳酸跟,也就是该废水中含有铜离子,亚铁例子,氯离子
至于2号实验方程式就是亚铁离子与氢氧根生成氢氧化亚铁,然后被空气中氧气氧化生成氢氧化铁沉淀1年前查看全部
- 电镀是金属防锈的方法之一.某电镀厂有三个分别给金属表面镀锌、镀铜、镀银的车间,每个车间电镀液的溶质中只含有易溶的锌盐、铜
电镀是金属防锈的方法之一.某电镀厂有三个分别给金属表面镀锌、镀铜、镀银的车间,每个车间电镀液的溶质中只含有易溶的锌盐、铜盐和银盐中的一种物质.现取三个车间的电镀液于烧杯中,标为1、2、3号,某小组同学通过实验对三种电镀液中溶质成分进行探究.
【提出问题】三种电镀液中溶质的成分是什么?
【探究实验1】如图1
【表达与交流】甲同学认为2号电镀液中的溶质一定不是硫酸铜,你认为他的结论______(填“正确”或“不正确”).
【探究实验2】如图2
【反思与评价】乙同学认为3号电镀液中的溶质一定是硫酸锌,请你对乙同学的结论给予评价______.
【探究实验3】根据上述实验,丙同学取少量的1号电镀液与少量的2号电镀液混合,立即出现有______生成的明显现象,由此小组同学确定了三种电镀液中分别含有的溶质的成分.
【解释与结论】请帮助他们将三种电镀液中溶质成分的化学式填写在烧杯的标签上. goolit1年前1
goolit1年前1 -
 ξИīъуп 共回答了19个问题
ξИīъуп 共回答了19个问题 |采纳率89.5%解题思路:【表达与交流】硫酸铜和氯化钡反应会生成白色沉淀;
【反思与评价】可溶性的银盐、硫酸盐均和氯化钡反应生成白色沉淀;
【探究实验3】银盐中只有硝酸银是易溶的,氯化银是常见的难溶性白色沉淀,硝酸银和氯化铜反应会生成白色沉淀;
【解释与结论】根据实验现象来判断具体的物质.【表达与交流】2号电镀液中的溶质如果是硫酸铜,则硫酸铜和氯化钡反应会生成白色沉淀,和题中的无现象矛盾,所以2号电镀液中的溶质一定不是硫酸铜,故答案为:正确;
【反思与评价】3号电镀液中加入氯化钡溶液出现白色沉淀,溶液中可能含有硫酸锌,也可能含硝酸银,因为硫酸锌与氯化钡反应生成硫酸钡是白色沉淀,硝酸银与氯化钡反应生成氯化银是白色沉淀;故答案为:不正确;3号电镀液中加入氯化钡溶液出现白色沉淀,溶液中可能含有硫酸锌,硫酸锌与氯化钡反应生成硫酸钡是白色沉淀,也可能含硝酸银,硝酸银与氯化钡反应生成氯化银是白色沉淀(或产生白色沉淀只能证明3号溶液中含有硫酸根离子或银离子),因此乙同学认为3号电镀液中的溶质一定是硫酸锌是不正确的;
【探究实验3】根据题目中的实验现象,2号电镀液一定含有铜离子,3号电镀液一定含有硫酸根离子,1号电镀液是可溶的银盐,即硝酸银,则2号电镀液为氯化铜,3号电镀液为硫酸锌,1号电镀液与少量的2号电镀液混合,会生成白色沉淀,故答案为:白色沉淀;
【解释与结论】1号电镀液是硝酸银,则2号电镀液为氯化铜,3号电镀液为硫酸锌,贴上标签后为: ,故答案为:
,故答案为: .
.点评:
本题考点: 实验探究物质的组成成分以及含量;盐的化学性质;化学式的书写及意义.
考点点评: 本题是一道化学综合试验知识题目,要求学生具有分析和解决问题的能力,难度较大.1年前查看全部
- 初中化学,急!有图,但是目前发不上来,口述.某电镀厂的废液中含有AgNO3,Cu(NO3)2,Ba(NO3)2,若随意排
初中化学,急!
有图,但是目前发不上来,口述.
某电镀厂的废液中含有AgNO3,Cu(NO3)2,Ba(NO3)2,若随意排放会造成环境污染.某活动小组设计实验从该废液中回收银和铜.实验方案如下:
废液+适量A→溶液甲+Ag.
溶液甲+过量B→溶液乙+固体丙
固体丙+适量C溶液→Cu+FeSO4溶液.
问:(1)B是________.
(2)C→FeSO4的化学方程式是___________.
要有过程!最好教如何思考 Q香糖1年前1
Q香糖1年前1 -
 5cvkveg 共回答了14个问题
5cvkveg 共回答了14个问题 |采纳率85.7%(1).B是Cu
(2).Fe+CuSO4==FeSO4+Cu
分析:除杂最忌讳引入新的杂质,Ba显然不能作为加入物质(成本他高,在工业上不现实),(1)不上若加入Fe,则Cu也会析出,无法达到目的,故应该先加入Cu,Cu之后还可以在析出,即加入Fe.完成.1年前查看全部
- 某电镀厂每天排出含1%氯化铜的废水135t,计算每天用含80%的铁屑处理废水,最少需铁屑多少吨
 4n4e1年前3
4n4e1年前3 -
 张张a 共回答了18个问题
张张a 共回答了18个问题 |采纳率77.8%CuCl2+ Fe= FeCl2+Cu
135 56
135t*1% x
135/56=135t*1%/x
x=0.56t
0.56t/80%=0.7t
需要含量80%的铁屑0.7吨1年前查看全部
- 研究性学习小组的同学在某电镀厂排水口采集重金属污染液1000mL。利用以下实验材料和器材设计实验,探究不同浓度重金属污染
研究性学习小组的同学在某电镀厂排水口采集重金属污染液1000mL。利用以下实验材料和器材设计实验,探究不同浓度重金属污染液对水稻种子萌发和生长的影响。
实验材料和器材:水稻种子;试管;培养皿;纱布;尺子(100mm);蒸馏水;恒温光照培养箱,温度设定为28℃,光强度为2000Lux);(实验材料和器材的数量不限)
根据给出的实验材料和器材,请设计实验方法和步骤,预测实验结果并作出分析。
(1)方法和步骤:___________________________________。
(2)结果预测和分析:___________________________________。 fuzouren1年前1
fuzouren1年前1 -
 zz一个 共回答了19个问题
zz一个 共回答了19个问题 |采纳率89.5%(1)方法和步骤:
①.用蒸馏水将重金属污染液逐级稀释10、10 2 、10 3 、10 4 倍(稀释过程中pH值的变化可不作考虑),获得4种不同浓度的污染液;
②.挑选籽粒饱满、大小一致的水稻种子250粒,随机分成5组,50粒/组;
③.取5只培养皿,垫上纱布;其中4只培养皿加入等体积的不同浓度重金属污染液(浸润纱布即可),另1只培养皿加入等体积的蒸馏水作为对照;
④.在每只培养皿的纱布上,均匀放置50粒水稻种子;
⑤.将5只培养皿置于恒温光照培养箱培养;每天实验组补充等量的相应浓度重金属污染液,对照组补充等体积的蒸馏水,以保持纱布的湿润;
⑥.1周后统计各组的发芽率;用尺子测量幼芭株高(或根长),计算其平均值。
(2)结果预测和分析:不同浓度的重金属污染液对水稻种了的萌发均有抑制作用,随着浓度的增加,萌发率逐渐降低;不同浓度的重金属污染液对水稻幼苗的生长均有抑制作用,随着浓度的增加,株高(或根长)逐渐降低。1年前查看全部
- 电镀厂污水处理系统塑料管道要用什么材料 和阀门要用什么材料
 by1002001年前1
by1002001年前1 -
 stella_denden 共回答了22个问题
stella_denden 共回答了22个问题 |采纳率86.4%ABS工程塑料,耐酸碱和高温性能还不错,性价比好些.阀门也用类似材料或不锈钢等.1年前查看全部
- (2011•怀柔区二模)某电镀厂排出的废水中含有较多的硫酸铜(CuSO4).若要从硫酸铜中获得金属铜,以减少废水对环境的
(2011•怀柔区二模)某电镀厂排出的废水中含有较多的硫酸铜(CuSO4).若要从硫酸铜中获得金属铜,以减少废水对环境的污染,可选择下列物质中的( )
A.稀盐酸
B.氢氧化钠
C.铁粉
D.银粉 ihqtqt1年前1
ihqtqt1年前1 -
 Derek_wang 共回答了23个问题
Derek_wang 共回答了23个问题 |采纳率87%解题思路:根据金属活动性顺序的意义进行分析,在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.废水中含有较多的CuSO4,所加入的物质需要能与硫酸铜反应生成铜,
A、稀盐酸和硫酸铜不反应,故A错误;
B、氢氧化钠溶液能与硫酸铜反应,但是不能生成铜,故B错误;
C、铁粉能与硫酸铜反应,能将硫酸铜中的铜置换出来,故C正确;
D、银粉和硫酸铜不反应,故D错误.
故选C.点评:
本题考点: 金属的回收利用及其重要性;水资源的污染与防治;金属活动性顺序及其应用.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- 电镀厂对大气以及水质的污染和危害
电镀厂对大气以及水质的污染和危害
麻烦分别讲一下.不要全是水体污染,也不要全是大气污染 165401年前1
165401年前1 -
 阿克四七 共回答了19个问题
阿克四七 共回答了19个问题 |采纳率89.5%大气:打磨工艺中的粉尘、颗粒物.危害:影响范围内的空气质量下降,受影响人群易发呼吸道疾病.
水质:重金属Cd、Cr、Ni、Zn、Cu等.危害:影响地表水、甚至饮用水;污染水体的流经区域内土壤或沉积物也可能受到污染.重金属可沿食物链传递,最终影响到人体健康.1年前查看全部
- 【化学与技术】电镀厂镀铜废水中含有CN - 和Cr 2 O 7 2- 离子,需要处理达标后才能排放。该厂拟定下列流程进行
【化学与技术】
电镀厂镀铜废水中含有CN - 和Cr 2 O 7 2- 离子,需要处理达标后才能排放。该厂拟定下列流程进行废水处理,回答下列问题:
(1)上述处理废水流程中主要使用的方法是______。
(2)②中反应后无气体放出,该反应的离子方程式为 。
(3)步骤③中,每处理0.4mol Cr 2 O 7 2- 时转移电子2.4mol,该反应离子方程式为 。
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na 2 S溶液,蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因 。
(5)目前处理酸性Cr 2 O 7 2- 废水多采用铁氧磁体法。该法是向废水中加入FeSO 4 ·7H 2 O将Cr 2 O 7 2- 还原成Cr 3+ ,调节pH,Fe、Cr转化成相当于Fe II [FeCr]O 4 (铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr 2 O 7 2- ,需加入a mol FeSO 4 •7H 2 O,下列结论正确的是_______。A.x ="0.5" ,a =8 B.x =0.5,a = 10 C.x =" 1.5" ,a =8 D.x =" 1.5" ,a = 10  Xerious1年前1
Xerious1年前1 -
 另一块傻瓜 共回答了20个问题
另一块傻瓜 共回答了20个问题 |采纳率90%(1)氧化还原法
(2)CN - +ClO - =CNO - +Cl -
(3)3S 2 O 3 2- +4Cr 2 O 7 2- +26H + =6SO 4 2- +8Cr 3+ +13H 2 O
(4)Cu 2+ +2OH - =Cu(OH) 2 ↓ Cu(OH) 2 (s)+S 2- (aq)=CuS(s)+2OH - (aq)
因为:K SP (CuS)SP [Cu(OH) 2 ]
(5)D
(1)由图可知,将废水中的离子实现上述转化时,利用了氧化还原反应,则主要使用的方法为氧化还原法;
(2)碱性条件下,CN-离子与NaClO发生氧化还原反应,无气体放出,则生成CNO - 、Cl - 离子,离子反应为CN - +ClO - ═CNO - +Cl - ,
(3)每0.4molCr 2 O 7 2- 转移2.4mol的电子,设还原后Cr元素的化合价为x,则0.4mol×2×(6-x)=2.4mol,解得x=+3,则离子反应为:
3S 2 O 3 2- +4Cr2O 7 2- +26H + ═6SO 4 2- +8Cr 3+ +13H 2 O。
(4)因铜离子与氢氧根离子反应生成氢氧化铜沉淀,CuS比Cu(OH) 2 更难溶,则加入Na 2 S溶液能发生沉淀的转化,故答案为:待检水样中还有Cu 2+ ,加碱发生Cu 2+ +2OH - ═Cu(OH) 2 ↓,再加入Na 2 S溶液,CuS比Cu(OH) 2 更难溶,则发生Cu(OH) 2 (s)+S 2- (aq)═CuS(s)+2OH - (aq)。
(5)设最终生成了ymol混合物,由于Cr元素量不变,则有(2-x)y=2,Fe元素不变,则有(1-x)y=a,铁失去的电子物质的量等于Cr得到的电子的物质的量相等,有x=1.5,y=4,a=10。答案选D。1年前查看全部
- 如图,某电镀厂排放的污水中含有CuSO4、FeSO4和ZnSO4,为减少水污染及节约成本,回收重要物质硫酸锌、金属铁和铜
如图,某电镀厂排放的污水中含有CuSO4、FeSO4和ZnSO4,为减少水污染及节约成本,回收重要物质硫酸锌、金属铁和铜,设计如图流程.下列说法不正确的是( )

A. 固体b为铁
B. 操作①、②中玻璃棒的作用不同
C. 滤液a中含有3种溶质
D. 除污水外,含锌元素的有:固体a、b,滤液a、b 小白宝贝2121年前2
小白宝贝2121年前2 -
 pantom 共回答了15个问题
pantom 共回答了15个问题 |采纳率86.7%解题思路:在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,氢前的金属能与酸发生置换反应生成氢气,可以根据金属与酸的反应和金属与盐溶液的反应来进行固体的分离;
向污水中加入过量锌,锌和硫酸铜反应生成硫酸锌和铜,锌和硫酸亚铁反应生成硫酸锌和铁,过滤得到固体a,其中含有铜、铁和锌,滤液b是硫酸锌溶液;
向铜、铁和锌中加入过量稀硫酸,铜不能反应,铁和锌与稀硫酸反应分别生成硫酸亚铁和氢气、硫酸锌和氢气,过滤得到铜,滤液a中含有硫酸亚铁、硫酸锌和稀硫酸;
向滤液a中加入适量的锌,锌和硫酸亚铁反应生成硫酸锌和铁,和稀硫酸反应生成硫酸锌和氢气,过滤得到固体b--铁;
蒸发硫酸锌溶液可以得到硫酸锌固体.A、由流图可知固体b为铁,故A正确.
B、操作①中玻璃棒的作用是引流,②中玻璃棒的作用是搅拌.故B正确.
C、滤液a中含有硫酸亚铁、硫酸锌和硫酸3种溶质,故C正确.
D、固体a中含有锌,c是硫酸锌,滤液a中含有硫酸锌,b中含有硫酸锌.故D错误.
故选:D.点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;蒸发与蒸馏操作;金属的化学性质.
考点点评: 根据金属的活动性,排在氢前面的金属都可把酸中的氢置换出来而得到氢气;活动性强的金属可把活动性弱的金属从其盐溶液中置换出来.1年前查看全部
- 初中化学化学课外活动小组的同学在实验室测定某电镀厂所用CuSO4溶液中溶质质量分数。现有该厂CuSO4的溶液50g,向其
初中化学
化学课外活动小组的同学在实验室测定某电镀厂所用CuSO4溶液中溶质质量分数。现有该厂CuSO4的溶液50g,向其中加入某未知溶质质量分数NaOH溶液40g,二者恰好完全反应,生成Cu(OH)2沉淀4.9g
计算CuSO4溶液中溶质质量分数
 lwq29001年前3
lwq29001年前3 -
 skfo242_nz5afe 共回答了20个问题
skfo242_nz5afe 共回答了20个问题 |采纳率90%其中铜离子全部转为沉淀,沉淀中含铜64/98 X4.9=3.2 由此计算硫酸铜的质量:3.2除以硫酸铜中铜的质量分数,然后所得结果除以50即可1年前查看全部
- 某电镀厂排放的污水中含有CuSO4、ZnSO4和FeSO4,为减少水污染及节约成本,回收重要原料硫酸锌和有关金属,设计如
某电镀厂排放的污水中含有CuSO4、ZnSO4和FeSO4,为减少水污染及节约成本,回收重要原料硫酸锌和有关金属,设计如图所示流程.

请回答:
(1)步骤①的操作是______,步骤③使用的方法是______.
(2)固体A的成分是______,固体B的成分是______.
(3)步骤④中反应的化学方程式是______. francoischen1年前1
francoischen1年前1 -
 陶克7707 共回答了32个问题
陶克7707 共回答了32个问题 |采纳率93.8%解题思路:在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,氢前的金属能与酸发生置换反应生成氢气,铁能被磁铁吸引,可以根据金属与酸的反应和金属与盐溶液的反应来进行固体的分离.(1)由实验过程图可判断,操作1完成后原混合物分成了固体和滤液两部分;利用这一特点可判断操作1为过滤操作;锌、铁、铜三种金属单质中,只有铁能被磁铁所吸起,因此使用磁铁吸引后,三种上金属分为两组,一组为铁粉另一组为铜粉和锌粉的混合物;根据后面的实验可判断固体C为铁粉;过量锌粉与CuSO4、ZnSO4、FeSO4混合溶液反应后所得溶液为ZnSO4溶液,铜粉与锌粉的混合物与足量稀硫酸反应后,所得溶液为ZnSO4溶液;
(3)过量锌粉与CuSO4、ZnSO4、FeSO4混合溶液中的CuSO4、FeSO4都可以发生置换反应;加入足量稀硫酸,金属混合粉末中的锌粉可与稀硫酸发生置换反应.(1)操作1把混合物分离成固体和滤液,所以,操作1为过滤操作;利用磁铁可以吸引铁的特点,可判断固体B、C为铁粉或铜粉与锌粉的混合物之一;由于固体D能与足量稀硫酸反应后可得到铜粉,可确定固体D为铜粉与锌粉的混合物,而固体C为铁粉.故答案为:过滤,用磁铁吸引;
根据金属活动性锌>铁>铜,向含有CuSO4、ZnSO4、FeSO4的废液加入过量的锌粉,铁、铜被置换出来,因此过滤后所得固体A中含有铁、铜和未反应的锌;
(2)固体B的成分是Fe、Zn、Cu,根据金属的活动性锌>铁>氢>铜,向CuSO4、ZnSO4、FeSO4混合溶液中加入过量锌粉后过滤,所得滤液为ZnSO4溶液;把铜粉与锌粉的混合物放入足量稀硫酸中充分反应后过滤,所得滤液为ZnSO4溶液;故答案为:ZnSO4,Fe、Zn、Cu;
(3)过量的锌粉与混合溶液中的硫酸铜反应,可置换出铜同时生成硫酸锌;与混合溶液中的硫酸亚铁反应,可置换出铁同时生成硫酸锌;铜粉与锌粉的混合物中的锌粉能与稀硫酸发生置换反应生成硫酸锌和氢气;故答案为:Zn+CuSO4=ZnSO4+Cu(或Zn+FeSO4=ZnSO4+Fe);Zn+H2SO4=ZnSO4+H2.点评:
本题考点: 金属的回收利用及其重要性;物质的鉴别、推断.
考点点评: 根据金属的活动性,排在氢前面的金属都可把酸中的氢置换出来而得到氢气;活动性强的金属可把活动性弱的金属从其盐溶液中置换出来.1年前查看全部
- 某环保活动小组,到一个扔向河里排放无色酸液的电镀厂检查.请应用酸的两个不同性质,用两种快捷的小实验证明该厂排放的污水中含
某环保活动小组,到一个扔向河里排放无色酸液的电镀厂检查.请应用酸的两个不同性质,用两种快捷的小实验证明该厂排放的污水中含有酸.
实验1:______
实验2:______. 程左超1年前1
程左超1年前1 -
 blueKID331 共回答了16个问题
blueKID331 共回答了16个问题 |采纳率87.5%(1)酸能使石蕊试液变红色,所以要检验废水仍显酸性,就可以向废水样品中滴加石蕊试液,若溶液变红色,则说明废水显酸性.
(2)酸能和锌粒反应生成氢气,所以我们可以向废水样品中加入锌,如果有气体产生,则说明废水显酸性.
故答案为:
(1)用试管取污水少许,滴入石蕊试液,试液变红;
(2)用试管取污水少许,加入锌粒,有气体生成.1年前查看全部
- 某电镀厂排放的污水中含有CuSO 4 、FeSO 4 和ZnSO 4 ,为减少水污染及节约成本,回收重要物质硫酸锌、金属
某电镀厂排放的污水中含有CuSO 4 、FeSO 4 和ZnSO 4 ,为减少水污染及节约成本,回收重要物质硫酸锌、金属铁和铜,设计如下图所示流程。

下列说法不正确的是A.固体b为铁 B.操作①、②中玻璃棒的作用不同 C.滤液a中含有3种溶质 D.除污水外,含锌元素的有:固体a、c,滤液a、b  情书米1年前1
情书米1年前1 -
 ppuj幽灵 共回答了10个问题
ppuj幽灵 共回答了10个问题 |采纳率90%C
1年前查看全部
- (2011•玄武区二模)我市某电镀厂为减少水污染及节约成本,从含有CuSO4,ZnSO4、FeSO4的废水中回收重要原料
(2011•玄武区二模)我市某电镀厂为减少水污染及节约成本,从含有CuSO4,ZnSO4、FeSO4的废水中回收重要原料硫酸锌和有关金属,实验过程如下:

结合以上提纯过程,下列分析完全正确的是( )
A.A
B.B
C.C
D.D WIND-RING1年前1
WIND-RING1年前1 -
 hetaiji 共回答了15个问题
hetaiji 共回答了15个问题 |采纳率86.7%由题意“从含有CuSO4,ZnSO4、FeSO4的废水中回收重要原料硫酸锌和有关金属”,结合金属活动性顺序,由此图可知:滤液A硫酸锌,则经过蒸发,的硫酸锌固体;固体A为过量的锌、铜和铁,磁铁吸铁;则可推测固体B为铁;则固体C为铜、锌;固体D为不与硫酸反应的铜、滤液B为锌与硫酸反应生成硫酸锌溶液.
故选C.1年前查看全部
- 计算题:化学小组的同学在实验室测定某电镀厂所用CuSO 4 溶液中溶质的质量分数。取该
计算题:化学小组的同学在实验室测定某电镀厂所用CuSO 4 溶液中溶质的质量分数。取该
CuSO 4 溶液50g 向其中加入某未知溶质质量分数的NaOH 溶液40g ,二者恰好完全反应。生成沉淀4.9g 。
计算:1 、CuSO 4 溶液中溶质的质量分数;
2 、求所得溶液的溶质质量分数。 doks480191年前1
doks480191年前1 -
 我和你的人影 共回答了19个问题
我和你的人影 共回答了19个问题 |采纳率89.5%(1 )16%
(2 )8.3%1年前查看全部
- (2013•河西区二模)电镀是金属防锈的方法之一.某兴趣小组同学用标为A、B、C的三只试剂瓶,从电镀厂取来ZnSO4、C
(2013•河西区二模)电镀是金属防锈的方法之一.某兴趣小组同学用标为A、B、C的三只试剂瓶,从电镀厂取来ZnSO4、Cu(NO3)2和AgNO3三种电镀液.由于忘记每瓶中装的是何种溶液,所以分别取出三种电镀液进行了实验.

根据以上实验回答:
(1)写出B瓶中电镀液的名称:______.
(2)茜茜同学提出只需选择一种金属单质放入上述三种电镀液中的两种,就可探究出三种电镀液中所含金属的活动性,得到大家一致认可.该金属最好选用______.
(3)林林同学通过查阅资料可知,AgNO3需避光保存,否则会分解生成单质银、NO2和一种助燃的气体.该该反应的化学方程式为2AgNO3
2Ag+2NO2↑+O2↑光 .2AgNO3.
2Ag+2NO2↑+O2↑光 .
(4)把铁粉加入ZnSO4、Cu(NO3)2和AgNO3的混合溶液中,充分反应后,过滤,叙述正确的是______(选填序号)
A.若滤渣中含有金属Cu,则Fe粉肯定已完全反应
B.若铁粉部分溶解,则滤渣中肯定含有Fe、Ag、Cu、Zn
C.若滤液中只含有Fe(NO3)2、Zn(NO3)2,则滤渣中可能含有Fe
D.若铁粉完全溶解,则混合溶液中只含有溶质Fe(NO3)2、Zn(NO3)2. micky_03141年前1
micky_03141年前1 -
 ynmsmoon20 共回答了18个问题
ynmsmoon20 共回答了18个问题 |采纳率94.4%解题思路:根据已有的知识进行分析,硝酸钡能与硫酸锌反应产生硫酸钡沉淀,在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,据此解答.(1)硝酸铜溶液为蓝色,故A中是硝酸铜溶液,硝酸钡能与硫酸锌反应产生硫酸钡沉淀,故B中是硫酸锌,C中是硝酸银,故填:硫酸锌;
(2)在金属活动性顺序中,锌>铜>银,选择一种金属单质放入上述三种电镀液中的两种,就可探究出三种电镀液中所含金属的活动性,可以选用活动居于中间的铜,故填:铜丝;
(3)硝酸银见光能分解生成银、二氧化氮和氧气,故填:2AgNO3
光
.
2Ag+2NO2↑+O2↑;
(4)在金属活动性顺序中,锌>铁>铜>银,铁能与硝酸银反应生成银和硝酸亚铁,铁能与硝酸铜反应生成硝酸亚铁和铜,铜能与硝酸银反应生成硝酸铜和银,故当硝酸铜和硝酸银同时存在时,铁首先与硝酸银反应,当硝酸银全部参加反应,硝酸铜再反应,由于锌的活动性比铁强,铁不能与硝酸锌反应;
A、若加入的铁粉过量,当硝酸铜全部反应,铁仍然有剩余,所以铁粉不一定完全反应,故A错误;
B、铁不能与硫酸锌反应,故滤渣中不会含有锌,故B错误;
C、滤液中只含有Fe(NO3)2、Zn(NO3)2,说明硝酸银和硝酸铜已经全部参加反应,若铁粉过量,则铁粉会剩余,故C正确;
D、若加入的铁粉量少,铁粉完全溶解,硝酸银和硝酸铜不一定全部参加反应,故D错误;
故填C.点评:
本题考点: 酸、碱、盐的鉴别;金属的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了常见物质的推断以及金属活动性顺序的应用,完成此题,可以依据已有的知识进行.1年前查看全部
- 电镀是金属防锈的方法之一.某电镀厂有三个分别给金属表面镀锌、镀铜、镀银的车间,每个车间电镀液的溶质中只含有易溶的锌盐、铜
电镀是金属防锈的方法之一.某电镀厂有三个分别给金属表面镀锌、镀铜、镀银的车间,每个车间电镀液的溶质中只含有易溶的锌盐、铜盐和银盐中的一种物质.现取三个车间的电镀液于烧杯中,标为1、2、3号,某小组同学通过实验对三种电镀液中溶质成分进行探究.
[提出问题]三种电镀液中溶质的成分是什么?
[探究实验1]
[表达与交流]甲同学认为2号电镀液中的溶质一定不是硫酸铜,你认为他的结论(1) (填“正确”或“不正确”).
[探究实验2]
[反思与评价]乙同学认为3号电镀液中的溶质一定是硫酸锌,请你对乙同学的结论给予评价(2) .
[探究实验3]根据上述实验,丙同学取少量的1号电镀液与少量的2号电镀液混合,立即出现有(3) 生成的明显现象,由此小组同学确定了三种电镀液中分别含有的溶质的成分.
解释与结论:探究实验3中发生反应的化学方程式为(4) ,请帮助他们将三种电镀液中溶质成分的化学式填写在烧杯的标签上(5). 厦忆1年前1
厦忆1年前1 -
 垂裳 共回答了14个问题
垂裳 共回答了14个问题 |采纳率100%(1)正确;(2)不正确;3号电镀液中加入氯化钡溶液出现白色沉淀,溶液中可能含有硫酸锌,硫酸锌与氯化钡反应生成硫酸钡是白色沉淀,也可能含硝酸银,硝酸银与氯化钡反应生成氯化银是白色沉淀(或产生白色沉淀只能证明3号溶液中含有硫酸根离子或银离子),因此乙同学认为3号电镀液中的溶质一定是硫酸锌是不正确的;
(3)白色沉淀;(4)CuCl 2 +2AgNO 3 =2AgCl↓+Cu(NO 3 ) 2 ;(5)
(1)2号电镀液中的溶质如果是硫酸铜,则硫酸铜和氯化钡反应会生成白色沉淀,和体重的无现象矛盾,,所以2号电镀液中的溶质一定不是硫酸铜,故答案为:正确;
(2)3号电镀液中加入氯化钡溶液出现白色沉淀,溶液中可能含有硫酸锌,也可能含硝酸银,因为硫酸锌与氯化钡反应生成硫酸钡是白色沉淀,硝酸银与氯化钡反应生成氯化银是白色沉淀,故答案为:不正确;3号电镀液中加入氯化钡溶液出现白色沉淀,溶液中可能含有硫酸锌,硫酸锌与氯化钡反应生成硫酸钡是白色沉淀,也可能含硝酸银,硝酸银与氯化钡反应生成氯化银是白色沉淀(或产生白色沉淀只能证明3号溶液中含有硫酸根离子或银离子),因此乙同学认为3号电镀液中的溶质一定是硫酸锌是不正确的;
(3)根据题目中的实验现象,2号电镀液一定含有铜离子,3号电镀液一定含有硫酸根离子,1号电镀液是可溶的银盐,即硝酸银,则2号电镀液为氯化铜,3号电镀液为硫酸锌,1号电镀液与少量的2号电镀液混合,会生成白色沉淀,故答案为:白色沉淀;
(4)氯化铜和硝酸银发生复分解反应,即CuCl 2 +2AgNO 3 =2AgCl↓+Cu(NO 3 ) 2 ,故答案为:CuCl 2 +2AgNO 3 =2AgCl↓+Cu(NO 3 ) 2 ;
(5)1号电镀液是硝酸银,则2号电镀液为氯化铜,3号电镀液为硫酸锌,故答案为: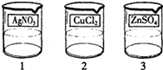 .
1年前查看全部
.
1年前查看全部
- 用化学方程式说明下列事实1.电镀厂常用稀硫酸除去铁锈2.锅炉中的水垢(主要成分为CaCO3)可用稀盐酸来清除3.医药用的
用化学方程式说明下列事实
1.电镀厂常用稀硫酸除去铁锈
2.锅炉中的水垢(主要成分为CaCO3)可用稀盐酸来清除
3.医药用的氢氧化铝乳剂可用来治疗胃酸(盐酸)过多
4.酸碱灭火器的化学原理 破烂流丢一口钟1年前1
破烂流丢一口钟1年前1 -
 哈姆宝贝 共回答了20个问题
哈姆宝贝 共回答了20个问题 |采纳率90%H2SO4+Fe=FeSO4+H2
CaCO3+2HCl=CaCl2+H2O+CO2
3HCl+Al(OH)3=AlCl3+3H2O (也可生成偏铝酸)
OH~+H*=H2O 或伴随另一半的反应生成其他灭火物质1年前查看全部
- (2012•哈尔滨)电镀是金属防锈的方法之一.某电镀厂有三个分别给金属表面镀锌、镀铜、镀银的车间,每个车间电镀液的溶质中
(2012•哈尔滨)电镀是金属防锈的方法之一.某电镀厂有三个分别给金属表面镀锌、镀铜、镀银的车间,每个车间电镀液的溶质中只含有易溶的锌盐、铜盐和银盐中的一种物质.现取三个车间的电镀液于烧杯中,标为1、2、3号,某小组同学通过实验对三种电镀液中溶质成分进行探究.
[提出问题]三种电镀液中溶质的成分是什么?
[探究实验1]
[表达与交流]甲同学认为2号电镀液中的溶质一定不是硫酸铜,你认为他的结论(1)______(填“正确”或“不正确”).
[探究实验2]
[反思与评价]乙同学认为3号电镀液中的溶质一定是硫酸锌,请你对乙同学的结论给予评价(2)______.
[探究实验3]根据上述实验,丙同学取少量的1号电镀液与少量的2号电镀液混合,立即出现有(3)______生成的明显现象,由此小组同学确定了三种电镀液中分别含有的溶质的成分.
解释与结论:探究实验3中发生反应的化学方程式为(4)______,请帮助他们将三种电镀液中溶质成分的化学式填写在烧杯的标签上(5). hh帮你顶1年前1
hh帮你顶1年前1 -
 5016021 共回答了14个问题
5016021 共回答了14个问题 |采纳率85.7%解题思路:(1)硫酸铜和氯化钡反应会生成白色沉淀;
(2)可溶性的银盐、硫酸盐均和氯化钡反应生成白色沉淀;
(3)银盐中只有硝酸银是易溶的,氯化银是常见的难溶性白色沉淀,硝酸银和氯化铜反应会生成白色沉淀;
(4)硝酸银和氯化铜之间发生复分解反应,会生成白色沉淀;
(5)根据实验想先来判断具体的物质.(1)2号电镀液中的溶质如果是硫酸铜,则硫酸铜和氯化钡反应会生成白色沉淀,和题中的无现象矛盾,所以2号电镀液中的溶质一定不是硫酸铜,故答案为:正确;
(2)3号电镀液中加入氯化钡溶液出现白色沉淀,溶液中可能含有硫酸锌,也可能含硝酸银,因为硫酸锌与氯化钡反应生成硫酸钡是白色沉淀,硝酸银与氯化钡反应生成氯化银是白色沉淀,故答案为:不正确;3号电镀液中加入氯化钡溶液出现白色沉淀,溶液中可能含有硫酸锌,硫酸锌与氯化钡反应生成硫酸钡是白色沉淀,也可能含硝酸银,硝酸银与氯化钡反应生成氯化银是白色沉淀(或产生白色沉淀只能证明3号溶液中含有硫酸根离子或银离子),因此乙同学认为3号电镀液中的溶质一定是硫酸锌是不正确的;
(3)根据题目中的实验现象,2号电镀液一定含有铜离子,3号电镀液一定含有硫酸根离子,1号电镀液是可溶的银盐,即硝酸银,则2号电镀液为氯化铜,3号电镀液为硫酸锌,1号电镀液与少量的2号电镀液混合,会生成白色沉淀,故答案为:白色沉淀;
(4)氯化铜和硝酸银发生复分解反应,即CuCl2+2AgNO3=2AgCl↓+Cu(NO3)2,故答案为:CuCl2+2AgNO3=2AgCl↓+Cu(NO3)2;
(5)1号电镀液是硝酸银,则2号电镀液为氯化铜,3号电镀液为硫酸锌,贴上标签后为: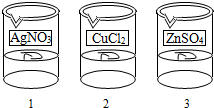 ,故答案为:
,故答案为: .
.点评:
本题考点: 实验探究物质的组成成分以及含量;盐的化学性质;常见离子的检验方法及现象;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题是一道化学综合试验知识题目,要求学生具有分析和解决问题的能力,难度较大.1年前查看全部
- (2014•海沧区模拟)某电镀厂为减少水污染及节约成本,从含有CuSO4、ZnSO4、FeSO4的废水中回收硫酸锌和有关
(2014•海沧区模拟)某电镀厂为减少水污染及节约成本,从含有CuSO4、ZnSO4、FeSO4的废水中回收硫酸锌和有关金属,实验过程如下:

(1)“操作1”和“操作2”的名称是______.
(2)固体A的成分是______.
(3)写出废液中加入过量锌粉后发生反应的化学方程式(写一个即可):______.
(4)滤液1和滤液2含有相同的溶质,该溶质是______.
(5)若加锌粉量不足,则滤液1中的溶质可能是______(填字母).
A.ZnSO4和FeSO4B.ZnSO4和 CuSO4C.CuSO4和 FeSO4D.ZnSO4、CuSO4和FeSO4. 尘埃落定-j1年前1
尘埃落定-j1年前1 -
 Probation 共回答了20个问题
Probation 共回答了20个问题 |采纳率100%解题思路:在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,氢前的金属能与酸发生置换反应生成氢气,铁能被磁铁吸引,可以根据金属与酸的反应和金属与盐溶液的反应来进行固体的分离.
(1)由实验过程图可判断,操作1和操作2完成后原混合物分成了固体和滤液两部分;利用这一特点可判断操作1和2都为过滤操作;
(2)根据锌和硫酸铜反应生成铜和硫酸锌;锌和硫酸亚铁反应生成铁和硫酸锌并且锌过量解答;
(3)过量锌粉与CuSO4、ZnSO4、FeSO4混合溶液中的CuSO4、FeSO4都可以发生置换反应;
(4)锌、铁、铜三种金属单质中,只有铁能被磁铁所吸起,因此使用磁铁吸引后,三种上金属分为两组,一组为铁粉另一组为铜粉和锌粉的混合物;根据后面的实验可判断固体C为铁粉;过量锌粉与CuSO4、ZnSO4、FeSO4混合溶液反应后所得溶液为ZnSO4溶液,铜粉与锌粉的混合物与足量稀硫酸反应后,所得溶液为ZnSO4溶液;
(5)根据锌先和硫酸铜反应再和硫酸亚铁反应,锌和硫酸铜反应生成硫酸锌和铜,所以溶液中一定含有硫酸锌,可能含有硫酸铜和硫酸亚铁解答.(1)操作1把混合物分离成固体和滤液,所以,操作1为过滤操作;利用磁铁可以吸引铁的特点,可判断固体B、C为铁粉或铜粉与锌粉的混合物之一;由于固体D能与足量稀硫酸反应后可得到铜粉,可确定固体D为铜粉与锌粉的混合物,而固体C为铁粉.故答案为:过滤,用磁铁吸引;
根据金属活动性锌>铁>铜,向含有CuSO4、ZnSO4、FeSO4的废液加入过量的锌粉,铁、铜被置换出来,因此过滤后所得固体A中含有铁、铜和未反应的锌;
(2)锌和硫酸铜反应生成铜和硫酸锌;锌和硫酸亚铁反应生成铁和硫酸锌并且锌过量,所以过滤得到的金属中含有铜、铁和锌,故答案:铜、铁、锌;
(3)过量的锌粉与混合溶液中的硫酸铜反应,可置换出铜同时生成硫酸锌;与混合溶液中的硫酸亚铁反应,可置换出铁同时生成硫酸锌;铜粉与锌粉的混合物中的锌粉能与稀硫酸发生置换反应生成硫酸锌和氢气;故答案为:Zn+CuSO4=ZnSO4+Cu(或Zn+FeSO4=ZnSO4+Fe);Zn+H2SO4=ZnSO4+H2.
(4)固体B的成分是Fe、Zn、Cu,根据金属的活动性锌>铁>氢>铜,向CuSO4、ZnSO4、FeSO4混合溶液中加入过量锌粉后过滤,所得滤液为ZnSO4溶液;把铜粉与锌粉的混合物放入足量稀硫酸中充分反应后过滤,所得滤液为ZnSO4溶液;故答案为:ZnSO4;
(5)锌先和硫酸铜反应再和硫酸亚铁反应,锌和硫酸铜反应生成硫酸锌和铜,所以溶液中一定含有硫酸锌,可能含有硫酸铜和硫酸亚铁,故答案:D.点评:
本题考点: 金属的化学性质;过滤的原理、方法及其应用;常见金属的特性及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 根据金属的活动性,排在氢前面的金属都可把酸中的氢置换出来而得到氢气;活动性强的金属可把活动性弱的金属从其盐溶液中置换出来.1年前查看全部
- 电镀是金属防锈的方法之一.某电镀厂有三个分别给金属表面镀锌、镀铜、镀银的车间,每个车间电镀液的溶质中只含有易溶的锌盐、铜
电镀是金属防锈的方法之一.某电镀厂有三个分别给金属表面镀锌、镀铜、镀银的车间,每个车间电镀液的溶质中只含有易溶的锌盐、铜盐和银盐中的一种物质.现取三个车间的电镀液于烧杯中,标为1、2、3号,某小组同学通过实验对三种电镀液中溶质成分进行探究.
[提出问题]三种电镀液中溶质的成分是什么?
[探究实验1]
[表达与交流]甲同学认为2号电镀液中的溶质一定不是硫酸铜,你认为他的结论(1)______(填“正确”或“不正确”).
[探究实验2]
[反思与评价]乙同学认为3号电镀液中的溶质一定是硫酸锌,请你对乙同学的结论给予评价(2)______.
[探究实验3]根据上述实验,丙同学取少量的1号电镀液与少量的2号电镀液混合,立即出现有(3)______生成的明显现象,由此小组同学确定了三种电镀液中分别含有的溶质的成分.
解释与结论:探究实验3中发生反应的化学方程式为(4)______,请帮助他们将三种电镀液中溶质成分的化学式填写在烧杯的标签上(5). toproad1年前1
toproad1年前1 -
 ziweixing 共回答了15个问题
ziweixing 共回答了15个问题 |采纳率80%解题思路:(1)硫酸铜和氯化钡反应会生成白色沉淀;
(2)可溶性的银盐、硫酸盐均和氯化钡反应生成白色沉淀;
(3)银盐中只有硝酸银是易溶的,氯化银是常见的难溶性白色沉淀,硝酸银和氯化铜反应会生成白色沉淀;
(4)硝酸银和氯化铜之间发生复分解反应,会生成白色沉淀;
(5)根据实验想先来判断具体的物质.(1)2号电镀液中的溶质如果是硫酸铜,则硫酸铜和氯化钡反应会生成白色沉淀,和题中的无现象矛盾,所以2号电镀液中的溶质一定不是硫酸铜,故答案为:正确;
(2)3号电镀液中加入氯化钡溶液出现白色沉淀,溶液中可能含有硫酸锌,也可能含硝酸银,因为硫酸锌与氯化钡反应生成硫酸钡是白色沉淀,硝酸银与氯化钡反应生成氯化银是白色沉淀,故答案为:不正确;3号电镀液中加入氯化钡溶液出现白色沉淀,溶液中可能含有硫酸锌,硫酸锌与氯化钡反应生成硫酸钡是白色沉淀,也可能含硝酸银,硝酸银与氯化钡反应生成氯化银是白色沉淀(或产生白色沉淀只能证明3号溶液中含有硫酸根离子或银离子),因此乙同学认为3号电镀液中的溶质一定是硫酸锌是不正确的;
(3)根据题目中的实验现象,2号电镀液一定含有铜离子,3号电镀液一定含有硫酸根离子,1号电镀液是可溶的银盐,即硝酸银,则2号电镀液为氯化铜,3号电镀液为硫酸锌,1号电镀液与少量的2号电镀液混合,会生成白色沉淀,故答案为:白色沉淀;
(4)氯化铜和硝酸银发生复分解反应,即CuCl2+2AgNO3=2AgCl↓+Cu(NO3)2,故答案为:CuCl2+2AgNO3=2AgCl↓+Cu(NO3)2;
(5)1号电镀液是硝酸银,则2号电镀液为氯化铜,3号电镀液为硫酸锌,贴上标签后为: ,故答案为:
,故答案为: .
.点评:
本题考点: 实验探究物质的组成成分以及含量;盐的化学性质;常见离子的检验方法及现象;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题是一道化学综合试验知识题目,要求学生具有分析和解决问题的能力,难度较大.1年前查看全部
- 我在电镀厂做事十年,经常与硫酸`盐酸`硝酸这些化学药品接触,这对身体会造成什么样的
 风信子3号1年前3
风信子3号1年前3 -
 在c807 共回答了19个问题
在c807 共回答了19个问题 |采纳率94.7%因为电镀厂涉及到很多的重金属,所以常年在电镀一线工作的话,有可能造成重金属在体内的富集,由此会对身体的很多脏器产生不可逆转的损害.特别是6价铬酸盐,据专家分析,长期接触,可能会增加致癌率.
至于你所提到的三种酸,硫酸还好只要不是直接接触没什么关系,因为其不挥发的.盐酸挥发性强,极易造成肺粘膜损伤,以及很多的肺部呼吸道疾病.所以要注意必须佩带防毒面具.
以上是个人意见,因为我接触电镀才一年,有些不详尽.1年前查看全部
- 电镀是金属防锈的方法之一.某电镀厂有三个分别给金属表面镀锌、镀铜、镀银的车间,每个车间电镀液的溶质中只含有易溶的锌盐、铜
电镀是金属防锈的方法之一.某电镀厂有三个分别给金属表面镀锌、镀铜、镀银的车间,每个车间电镀液的溶质中只含有易溶的锌盐、铜盐和银盐中的一种物质.现取三个车间的电镀液于烧杯中,标为1、2、3号(如图1),某小组同学通过实验对三种电镀液中溶质成分进行探究.
【提出问题】三种电镀液中溶质的成分是什么?
【探究实验1】如图2: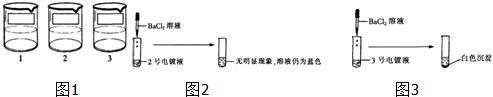
【表达与交流】甲同学认为2号电镀液中的溶质一定不是硫酸铜,你认为他的结论(1)______(填“正确”或“不正确”).
【探究实验2】如图3:
【反思与评价】乙同学认为3号电镀液中的溶质一定是硫酸锌,请你对乙同学的结论给予评价且说明理由(2)______.
【探究实验3】根据上述实验,丙同学取少量的1号电镀液与少量的2号电镀液混合,立即出现有(3)______生成的明显现象,由此小组同学确定了三种电镀液中分别含有的溶质的成分.3号电镀液中的溶质是(4)______.
【解释与结论】探究实验3中发生反应的化学方程式为(5)______. BLF123451年前1
BLF123451年前1 -
 hot555 共回答了17个问题
hot555 共回答了17个问题 |采纳率94.1%解题思路:(1)向2号电镀液中滴加BaCl2溶液,无明显现象,溶液仍为蓝色,说明该溶液中含有铜离子,不含硫酸根离子;
(2)向3号电镀液中滴加BaCl2溶液,有白色沉淀,由此仅能判断3号电镀液中的溶质可以是硫酸锌,也可以是硝酸银;
(3)若1号电镀液为锌盐,取少量的1号电镀液与少量的2号电镀液混合,不会立即出现有明显现象;
(4)由分析(3)可推出3号电镀液中的溶质只能是硫酸锌(ZnSO4);
(5)依据实验中存在的反应事实书写化学方程式.(1)向2号电镀液中滴加BaCl2溶液,无明显现象,溶液仍为蓝色,说明该溶液中含有铜离子,不含硫酸根离子;故填正确;
(2)向3号电镀液中滴加BaCl2溶液,有白色沉淀,由此仅能判断3号电镀液中的溶质可以是硫酸锌,也可以是硝酸银;故填不正确,也有可能溶质是硝酸银;
(3)若1号电镀液为锌盐,取少量的1号电镀液与少量的2号电镀液混合,不会立即出现有明显现象;故1号电镀液溶质为硝酸银,故填白色沉淀;(4)由分析(3)可推出3号电镀液中的溶质只能是硫酸锌(ZnSO4);故填硫酸锌(ZnSO4);
(5)依据实验中存在的反应事实书写化学方程式:CuCl2+2AgNO3═2AgCl↓+Cu(NO3)2
故答案为:
(1)正确;
(2)不正确,也有可能溶质是硝酸银;
(3)白色沉淀;
(4)硫酸锌(ZnSO4);
(5)CuCl2+2AgNO3═2AgCl↓+Cu(NO3)2点评:
本题考点: 实验探究物质的组成成分以及含量;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 通过实验现象判断反应事实,一定要联想各种可能性,防止挂一漏万,判断失误.1年前查看全部
- (2006•南京)某电镀厂在对金属镀件表面除锈、除污过程中,使用了盐酸、硫酸、氢氧化钠、碳酸钠等试剂.该厂经处理后排放的
(2006•南京)某电镀厂在对金属镀件表面除锈、除污过程中,使用了盐酸、硫酸、氢氧化钠、碳酸钠等试剂.该厂经处理后排放的废水,仍含有 H+、OH-、Na+、Fe3+、Cu2+、CO32-、Cl-、SO42-中的几种离子.某中学生环保志愿者小组对该废水中部分成分进行检测.实验步骤及现象如下表所示.请你填写下表中每步实验现象所对应的实验结论.
根据以上信息综合分析,你推测该废水中除H2O外,还含有的物质是______(写化学式,下同),不能确定的物质是______.实验步骤及现象 实验结论(填离子符号) 取废水样品观察,呈无色 废水中不含______ 测所取废水样品的pH,pH=13 废水中含较多的______ 向废水样品中加入过量的稀盐酸,没有气泡产生 废水中不含______  星火石1年前1
星火石1年前1 -
 liu_air 共回答了20个问题
liu_air 共回答了20个问题 |采纳率90%解题思路:本题考查利用复分解反应的条件来判断物质能否共存的问题,若物质在水中解离成的离子重新结合生成水或气体或沉淀时,物质就不能共存;本题还要注意废水为无色透明溶液,则应注意常见离子在水中的颜色.①取废水样品观察,呈无色,说明废水中不含Cu2+、Fe3+;
②测废水的pH=13,说明废水呈碱性,含有OH-,因H+与OH-反应生成水,所以废水中不含H+,溶液中一定有阳离子,所以废水中一定含有Na+;
③向废水样品中加入过量的稀盐酸,没有气泡产生,说明一定没有CO32-;不能确定废水中是否含有Cl-、SO42-.
根据以上信息综合分析,你推测该废水中除H2O外,还含有的物质是NaOH,不能确定的物质是NaCl、Na2SO4.
故答案为:Cu2+、Fe3+; OH-、Na+;CO32-; NaOH;NaCl、Na2SO4.点评:
本题考点: 常见离子的检验方法及现象.
考点点评: 本题考查了常见离子的共存问题,完成此题,可以依据复分解反应的条件进行.1年前查看全部
- (2014•房山区一模)某电镀厂排放的污水中含有CuSO4、ZnSO4、FeSO4,为减少水污染及节约成本,回收重要物质
(2014•房山区一模)某电镀厂排放的污水中含有CuSO4、ZnSO4、FeSO4,为减少水污染及节约成本,回收重要物质硫酸锌及有关金属,设计如下所示流程.

该回收流程中:固体A的成分是______;含铁元素的物质(污水除外)有______(填字母序号). blue-ff1年前1
blue-ff1年前1 -
 luoli25 共回答了23个问题
luoli25 共回答了23个问题 |采纳率78.3%解题思路:在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,氢前的金属能与酸发生置换反应生成氢气,可以根据金属与酸的反应和金属与盐溶液的反应来进行固体的分离;
向污水中加入过量锌,锌和硫酸铜反应生成硫酸锌和铜,锌和硫酸亚铁反应生成硫酸锌和铁,过滤得到固体A,其中含有铜、铁和锌,滤液B是硫酸锌溶液;
向铜、铁和锌中加入过量稀硫酸,铜不能反应,铁和锌与稀硫酸反应分别生成硫酸亚铁和氢气、硫酸锌和氢气,过滤得到铜,滤液中含有硫酸亚铁、硫酸锌和稀硫酸;
向滤液中加入适量的锌,锌和硫酸亚铁反应生成硫酸锌和铁,和稀硫酸反应生成硫酸锌和氢气,过滤得到固体D--铁;向污水中加入过量锌,锌和硫酸铜反应生成硫酸锌和铜,锌和硫酸亚铁反应生成硫酸锌和铁,过滤得到固体A,其中含有铜、铁和锌,滤液B是硫酸锌溶液;
向铜、铁和锌中加入过量稀硫酸,铜不能反应,铁和锌与稀硫酸反应分别生成硫酸亚铁和氢气、硫酸锌和氢气,过滤得到铜,滤液中含有硫酸亚铁、硫酸锌和稀硫酸;
向滤液中加入适量的锌,锌和硫酸亚铁反应生成硫酸锌和铁,和稀硫酸反应生成硫酸锌和氢气,过滤得到固体D--铁;
答案:
Cu、Fe、Zn A 滤液C D点评:
本题考点: 金属的化学性质;过滤的原理、方法及其应用.
考点点评: 根据金属的活动性,排在氢前面的金属都可把酸中的氢置换出来而得到氢气;活动性强的金属可把活动性弱的金属从其盐溶液中置换出来.1年前查看全部
- (2010•南安市质检)我市某电镀厂为减少水污染及节约成本,从含有CuSO4,ZnSO4、FeSO4的废水中回收重要原料
(2010•南安市质检)我市某电镀厂为减少水污染及节约成本,从含有CuSO4,ZnSO4、FeSO4的废水中回收重要原料硫酸锌和有关金属,实验过程如下:
请回答:
(1)滤液A和滤液B含有相同的溶质是______.
(2)写出步骤①其中一个反应的化学方程式:______.
(3)固体A中含Fe、Cu、Zn三种金属,将其活动性填入下列空格中:
______,______,______.
(4)步骤①加入的锌粉为什么要过量,请你简要说明理由______.
(5)固体B的物质是______. anteaus1年前1
anteaus1年前1 -
 dsfdsf 共回答了22个问题
dsfdsf 共回答了22个问题 |采纳率95.5%解题思路:可以根据物质之间相互作用时能否发生反应及其反应时生成物是什么等方面进行分析、考虑,从而得出正确的结论,在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.因为锌比铜和铁活泼,所以能把硫酸铜、硫酸亚铁中的铜、铁置换出来.铁能被磁铁吸引,从而把铁分离出来.锌能和稀硫酸反应生成硫酸锌,铜不能和稀硫酸反应,从而把铜分离出来.硫酸锌溶液经过蒸发得到硫酸锌固体.
(1)滤液A和滤液B含有相同的溶质是硫酸锌.故填:ZnSO4
(2)锌能与硫酸铜反应生成硫酸锌和铜,锌能与硫酸亚铁反应生成硫酸锌和铁,故填:Zn+CuSO4=ZnSO4+Cu或Zn+FeSO4=ZnSO4+Fe
(3)在金属活动性顺序中,锌>铁>氢>铜,活动性由强到弱的顺序为:锌、铁、铜.
(4)加入过量锌的原因是将废液中的FeSO4和CuSO4完全反应掉.故填:将废液中的FeSO4和CuSO4完全反应掉.
(5)由图中信息可知,固体B的物质是铁,故填:Fe.点评:
本题考点: 金属的化学性质;金属活动性的探究;金属活动性顺序及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查了化学方程式的书写及其正确分析实验方面的内容,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- 某电镀厂排放的污水中含有CuSO4、FeSO4和ZnSO4,为减少水污染及节约成本,回收重要物质硫酸锌、金属铁和铜,设计
某电镀厂排放的污水中含有CuSO4、FeSO4和ZnSO4,为减少水污染及节约成本,回收重要物质硫酸锌、金属铁和铜,设计如图所示流程.

下列说法不正确的是( )
A.固体b为铁
B.操作①、②中玻璃棒的作用不同
C.滤液a中含有3种溶质
D.除污水外,含锌元素的有:固体a、b,滤液a、b 因为9411年前1
因为9411年前1 -
 tammu 共回答了15个问题
tammu 共回答了15个问题 |采纳率86.7%解题思路:在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,氢前的金属能与酸发生置换反应生成氢气,可以根据金属与酸的反应和金属与盐溶液的反应来进行固体的分离;向污水中加入过量锌,锌和硫酸铜反应生成硫酸锌和铜,锌和硫酸亚铁反应生成硫酸锌和铁,过滤得到固体a,其中含有铜、铁和锌,滤液b是硫酸锌溶液;向铜、铁和锌中加入过量稀硫酸,铜不能反应,铁和锌与稀硫酸反应分别生成硫酸亚铁和氢气、硫酸锌和氢气,过滤得到铜,滤液a中含有硫酸亚铁、硫酸锌和稀硫酸;向滤液a中加入适量的锌,锌和硫酸亚铁反应生成硫酸锌和铁,和稀硫酸反应生成硫酸锌和氢气,过滤得到固体b--铁;蒸发硫酸锌溶液可以得到硫酸锌固体.A、由流图可知固体b为铁,故A正确.
B、操作①中玻璃棒的作用是引流,②中玻璃棒的作用是搅拌.故B正确.
C、滤液a中含有硫酸亚铁、硫酸锌和硫酸3种溶质,故C正确.
D、固体a中含有锌,c是硫酸锌,滤液a中含有硫酸锌,b中含有硫酸锌.故D错误.
故选:D.点评:
本题考点: 金属的化学性质;过滤的原理、方法及其应用;蒸发与蒸馏操作.
考点点评: 根据金属的活动性,排在氢前面的金属都可把酸中的氢置换出来而得到氢气;活动性强的金属可把活动性弱的金属从其盐溶液中置换出来.1年前查看全部
- (4分)某电镀厂排放的污水中含有CuSO 4 、ZnSO 4 、FeSO 4 ,为减少水污染及节约成本,回收重要物质硫酸
(4分)某电镀厂排放的污水中含有CuSO 4 、ZnSO 4 、FeSO 4 ,为减少水污染及节约成本,回收重要物质硫酸锌及有关金属,设计如下所示流程。

该回收流程中:固体A的成分是 ;含铁元素的物质(污水除外)有 (填字母序号),试写出滤液C与适量的甲发生的化学反应方程式 。 雨挹轻尘1年前1
雨挹轻尘1年前1 -
 笑书神侠001 共回答了19个问题
笑书神侠001 共回答了19个问题 |采纳率94.7%Cu、Fe、Zn(或铜、铁、锌) ACD FeSO 4 +Zn ZnSO 4 +Fe
1年前查看全部
- 电镀厂含铬废水的来源 电镀工艺流程的哪几个阶段会产生含铬废水 全面一些
电镀厂含铬废水的来源 电镀工艺流程的哪几个阶段会产生含铬废水 全面一些
镀哪几种金属(如金、银、铜、铁、镍、锌、锡)的过程中会有含铬废水产生,只是在钝化后这一个阶段会产生含铬废水吗 尽管曾经1年前1
尽管曾经1年前1 -
 flywangi 共回答了21个问题
flywangi 共回答了21个问题 |采纳率85.7%电镀槽里面电镀液需要定期更换,应该作为危险废物处理处置,如果管理不当,可能进入废水.
镀件需要多级清洗,会产生含铬清洗废水1年前查看全部
- 某电镀厂排放的废水中含有大量的有毒重金属盐Ba(NO3)2、Cu(NO3)2、 AgNO3,
某电镀厂排放的废水中含有大量的有毒重金属盐Ba(NO3)2、Cu(NO3)2、 AgNO3,
该厂想用氢氧化钾溶液、盐酸、硫酸三种试剂,将所排废水的重金属离子逐一变成沉淀回收,最后得到只含一种可做化肥的中性溶液.假设每种试剂只用一次,每部恰好完全反应.所加试剂中第二种试剂的阴离子是 硫酸根离子 请问为什么是硫酸根离子呢? 路思思1年前1
路思思1年前1 -
 kelly0213 共回答了21个问题
kelly0213 共回答了21个问题 |采纳率100%首先加入盐酸,除去银离子(银离子与氢氧根离子和硫酸根离子都会形成沉淀)
然后加入硫酸除去钡离子,最后加入氢氧化钾溶液 除去铜离子和前两步反应生成的酸中的氢离子,最后就得到只含一种可做化肥的中性溶液(硝酸钾溶液).1年前查看全部
- (2011•玄武区二模)我市某电镀厂为减少水污染及节约成本,从含有CuSO4,ZnSO4、FeSO4的废水中回收重要原料
(2011•玄武区二模)我市某电镀厂为减少水污染及节约成本,从含有CuSO4,ZnSO4、FeSO4的废水中回收重要原料硫酸锌和有关金属,实验过程如下:
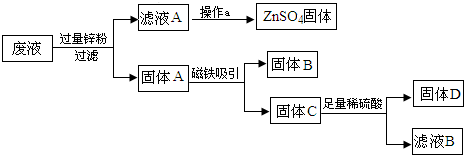
结合以上提纯过程,下列分析完全正确的是( )
固体A 操作a 固体C 滤液B(溶质) A Cu、Fe 过滤 Cu ZnSO4、H2SO4 B Cu、Fe、Zn 蒸发 Cu ZnSO4、H2SO4 C Cu、Fe、Zn 蒸发 Cu、Zn ZnSO4 D Cu、Fe 加入金属锌 Cu、Zn ZnSO4、FeSO4
A.A
B.B
C.C
D.D ml_love1年前1
ml_love1年前1 -
 以安为安 共回答了19个问题
以安为安 共回答了19个问题 |采纳率100%解题思路:由题意“从含有CuSO4,ZnSO4、FeSO4的废水中回收重要原料硫酸锌和有关金属”,结合金属活动性顺序,锌能与CuSO4,FeSO4发生置换反应生成单质铜和铁,根据实验过程的流程图可知:滤液A硫酸锌,固体A为过量的锌、铜和铁,磁铁吸铁;则可推测固体B、C;因为锌与硫酸反应,则可知固体D、滤液B.由题意“从含有CuSO4,ZnSO4、FeSO4的废水中回收重要原料硫酸锌和有关金属”,结合金属活动性顺序,由此图可知:滤液A硫酸锌,则经过蒸发,的硫酸锌固体;固体A为过量的锌、铜和铁,磁铁吸铁;则可推测固体B为铁;则固体C为铜、锌;固体D为不与硫酸反应的铜、滤液B为锌与硫酸反应生成硫酸锌溶液.
故选C.点评:
本题考点: 金属的回收利用及其重要性;物质的鉴别、推断.
考点点评: 了解金属的回收利用及其重要性;掌握化学实验的方法和评价方法;根据题目中的信息,掌握物质的鉴别与推断的方法.1年前查看全部
- 电镀厂用的硫酸一般是多少浓度?
 yxl22835091年前1
yxl22835091年前1 -
 y406057653 共回答了27个问题
y406057653 共回答了27个问题 |采纳率88.9%那要看电镀何种金属了,据我所知电镀镍使用98%硫酸调整PH用.电镀锡镀浴内硫酸含量为10%所使用的为98%.但在前处理段酸洗使用的为50%硫酸!控制体积比为10-14%.1年前查看全部
- 如图,某电镀厂排放的污水中含有CuSO4、FeSO4和ZnSO4,为减少水污染及节约成本,回收重要物质硫酸锌、金属铁和铜
如图,某电镀厂排放的污水中含有CuSO4、FeSO4和ZnSO4,为减少水污染及节约成本,回收重要物质硫酸锌、金属铁和铜,设计如图流程.下列说法不正确的是( )

A. 固体b为铁
B. 操作①、②中玻璃棒的作用不同
C. 滤液a中含有3种溶质
D. 除污水外,含锌元素的有:固体a、b,滤液a、b ananyyllj1年前1
ananyyllj1年前1 -
 紫伊表妹 共回答了24个问题
紫伊表妹 共回答了24个问题 |采纳率75%解题思路:在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,氢前的金属能与酸发生置换反应生成氢气,可以根据金属与酸的反应和金属与盐溶液的反应来进行固体的分离;
向污水中加入过量锌,锌和硫酸铜反应生成硫酸锌和铜,锌和硫酸亚铁反应生成硫酸锌和铁,过滤得到固体a,其中含有铜、铁和锌,滤液b是硫酸锌溶液;
向铜、铁和锌中加入过量稀硫酸,铜不能反应,铁和锌与稀硫酸反应分别生成硫酸亚铁和氢气、硫酸锌和氢气,过滤得到铜,滤液a中含有硫酸亚铁、硫酸锌和稀硫酸;
向滤液a中加入适量的锌,锌和硫酸亚铁反应生成硫酸锌和铁,和稀硫酸反应生成硫酸锌和氢气,过滤得到固体b--铁;
蒸发硫酸锌溶液可以得到硫酸锌固体.A、由流图可知固体b为铁,故A正确.
B、操作①中玻璃棒的作用是引流,②中玻璃棒的作用是搅拌.故B正确.
C、滤液a中含有硫酸亚铁、硫酸锌和硫酸3种溶质,故C正确.
D、固体a中含有锌,c是硫酸锌,滤液a中含有硫酸锌,b中含有硫酸锌.故D错误.
故选:D.点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;蒸发与蒸馏操作;金属的化学性质.
考点点评: 根据金属的活动性,排在氢前面的金属都可把酸中的氢置换出来而得到氢气;活动性强的金属可把活动性弱的金属从其盐溶液中置换出来.1年前查看全部
- 酸性镀铜液失效原因真正电镀厂中的酸性光亮镀铜液的一般配方是什么?什么原因会使镀铜液不能继续使用而废弃掉?是产生某些物质影
酸性镀铜液失效原因
真正电镀厂中的酸性光亮镀铜液的一般配方是什么?
什么原因会使镀铜液不能继续使用而废弃掉?是产生某些物质影响了电流效率还是别的原因?请尽量详细的回答, dx201年前1
dx201年前1 -
 冰封佳人 共回答了15个问题
冰封佳人 共回答了15个问题 |采纳率86.7%酸性光亮镀铜液 主要成分为 CuSO4 和 H2SO4 少量氯化铜 表面活性剂
导致镀铜液不能继续使用而废弃掉的原因
1 硫酸铜消耗过多未补充
2 有害杂质进入槽内 硝酸银 铬酸根等阴离子对镀液性能会产生不良的影响
硝酸根的带入将使镀液的分散能力更坏 铬酸根的带入将导致结合不牢和镀
层脱皮 特别是氯离子 20~40mL/L可使表面光亮 超过则有害
3 有机杂质和铁过多
4 镀件未处理 直接进行电镀
5 未加入表面活性剂
除了1以外 杂质会导致镀层不牢固或不光亮 未处理镀件则会使镀液无法使用1年前查看全部
- 某造纸厂排放的碱性废水和电镀厂排放的酸性废水中各含有以下八种离子中不同的四种.CO32-,CI-,OH-,NO3-,NA
某造纸厂排放的碱性废水和电镀厂排放的酸性废水中各含有以下八种离子中不同的四种.CO32-,CI-,OH-,NO3-,NA+,CU2+,H+,Ag+,则电镀厂排放的废水中含有的离子是
 david2031年前8
david2031年前8 -
 忧伤的男人 共回答了23个问题
忧伤的男人 共回答了23个问题 |采纳率100%因为是酸性废水,所以不存在OH- ,而是H+ .
再,因为H+和 CO32-不能共存,所以CO32-也不存在.
那么剩余的离子就是Cl- NO3- Na+ Cu2+ Ag+
而碱性废水里有OH-,所以Cu2+不能共存,否则会生成氢氧化铜沉淀.
即Cu2+在酸性废水里.
又因为碱性废水里有OH- 所以银离子不存在.
因为废水电中性,所以阴阳离子需要兼而有之才能中和电荷.
所以剩余阴离子NO3-在酸性废水里.
综上,电镀厂排放的废水中含有的离子是H+ Cu2+ NO3- Ag+ .1年前查看全部
- 铁和盐酸反应产生杂质怎么处理掉我是做超声波设备的现在有个问题想请教一下希望大家帮帮忙,一个客户电镀厂的铁的工件先用碱性去
铁和盐酸反应产生杂质怎么处理掉
我是做超声波设备的现在有个问题想请教一下希望大家帮帮忙,一个客户电镀厂的铁的工件先用碱性去油剂把油去干净了(超声波清洗)用纸巾搽试了肯定干净,用清水冲洗干净后放到盐酸里十来分钟拿出来后表面一层黑色的脏东西(用手一摸就掉),现在不知道怎么能处掉(快捷方便的办法)希望大家帮帮忙,也可以拨打我的电话谢谢大家 都市种地的1年前2
都市种地的1年前2 -
 耍吼人 共回答了19个问题
耍吼人 共回答了19个问题 |采纳率89.5%这种现象在电镀上叫“挂灰”,是你酸洗过度造成的.酸洗时间不要太长,最好在酸里加点缓蚀剂.出现挂灰,可以试试下面的方法除去:1.在电解除油槽中阳极电解处理;2.硝酸20-30L/L,双氧水5-15L/L室温浸30秒.1年前查看全部
- 某电镀厂排放的污水中含有较多的Cu2+(假设是以硫酸铜的形式存在的),并呈较强酸性,为处理该厂的废水并回收铜,应选择的试
某电镀厂排放的污水中含有较多的Cu2+(假设是以硫酸铜的形式存在的),并呈较强酸性,为处理该厂的废水并回收铜,应选择的试剂是
A铝和熟石灰 B氢氧化钠和镁 C锌和硫酸 D铁和熟石灰
单选
请说明理由 _枯藤老树昏鸦1年前9
_枯藤老树昏鸦1年前9 -
 兜兜梨97号 共回答了19个问题
兜兜梨97号 共回答了19个问题 |采纳率89.5%D铁和熟石灰
因为熟石灰显碱性,能中和污水的酸性,铁能将Cu2+转换成单质铜
Fe + CuSO4 === FeSO4 + Cu
A铝和熟石灰------------也可以达到目的,但是AI3+ 对人体有害,
B氢氧化钠和镁-----------用氢氧化钠成本太高
C锌和硫酸-----------加入硫酸,使溶液酸性更强,1年前查看全部
- 2013房山一模化学(4)某电镀厂排放的污水中含有硫酸铜、硫酸锌和硫酸亚铁,某化学小组将一定量的锌加入到一定量的该污水中
2013房山一模化学
(4)某电镀厂排放的污水中含有硫酸铜、硫酸锌和硫酸亚铁,某化学小组将一定量的锌加入到一定量的该污水中,充分反应后过滤,向滤渣中加入盐酸,有气泡产生.滤渣和滤液中一定含有的物质是 jwv20001年前1
jwv20001年前1 -
 cpbckfx88 共回答了14个问题
cpbckfx88 共回答了14个问题 |采纳率92.9%加入盐酸后有气泡冒出一定有铁可能有锌,而且锌先与氧化性强的铜离子反应置换出铜,所以滤渣中一定有铜和铁,滤液中一定有硫酸锌可能有硫酸亚铁,一定没有硫酸铜1年前查看全部
- (2009•道外区一模)电镀厂的废水中含有AgNO3和Cu(NO3)2为回收金属Cu和Ag.有下列操作.试回答:
(2009•道外区一模)电镀厂的废水中含有AgNO3和Cu(NO3)2为回收金属Cu和Ag.有下列操作.试回答:
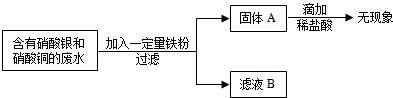
(1)固体A中一定含______
(2)确定滤液B中溶质化学式有多种情况.你认为有(填化学式):______. mrfish_111年前1
mrfish_111年前1 -
 超级女生牌nn 共回答了18个问题
超级女生牌nn 共回答了18个问题 |采纳率94.4%解题思路:根据回收流程图,过滤后固体A滴加稀盐酸无现象,说明固体中不含铁粉,即铁全部反应;废水为AgNO3和Cu(NO3)2混合溶液,由于金属铜的活动性大于银,铁粉先与AgNO3反应置换出银,银全部置换后再与Cu(NO3)2反应置换铜.(1)铁全部反应时固体A有四种可能:
①铁粉恰好与废水中的AgNO3和Cu(NO3)2完全反应,固体A为Cu、Ag混合物;
②铁粉恰好只与废水中的AgNO3完全反应,固体A为Ag;
③铁粉未能完全反应废水中的AgNO3,固体A为Ag;
④铁粉未能完全反应废水中Cu(NO3)2而完全反应的AgNO3,固体A为Cu、Ag.综合以上分析,固体A中一定含有金属Ag;
故选Ag;
(2)若Fe粉恰好与混合溶液完全反应,则AgNO3和Cu(NO3)2全部反应,滤液中不含这两种物质,滤液为Fe(NO3)2溶液;若Fe粉不足且恰好与混合溶液中的AgNO3完全反应,滤液中不含这种物质,滤液为Cu(NO3)2、Fe(NO3)2溶液;若Fe粉不足且未能把混合溶液中的AgNO3完全反应,滤液中仍含这种物质,滤液为AgNO3、Cu(NO3)2、Fe(NO3)2溶液;
故答:Fe(NO3)2,Cu(NO3)2、Fe(NO3)2,AgNO3、Cu(NO3)2、Fe(NO3)2.点评:
本题考点: 金属的化学性质;金属活动性顺序及其应用.
考点点评: 金属与盐的混合溶液或盐与酸的混合溶液发生反应时,根据金属活动性从小到的大顺序依次反应.1年前查看全部
- 科学化学题啊 啊 啊啊 啊 啊科学课外活动小组的同学在实验室测定某电镀厂所用硫酸铜溶液中溶质的质量分数。通过向该硫酸铜溶
科学化学题啊 啊 啊啊 啊 啊
科学课外活动小组的同学在实验室测定某电镀厂所用硫酸铜溶液中溶质的质量分数。通过向该硫酸铜溶液加入某未知溶质质量分数的氢氧化钠溶液的方法来分析测定,甲、乙、丙、丁四位同学分别进行实验,他们的实验数据如下表,请分析数据回答下列问题:
甲 乙 丙 丁
所取CuSO4溶液质量/g 80 50 50 50
加人Na()H溶液的质量/g 40 40 50 20
反应后所得沉淀物质量/g m m m 2.45
(1)m的值是 克;
(2)计算硫酸铜溶液中溶质的质量分数;
(3)在四位同学的实验中,哪位同学的实验是刚好完全反应?并计算刚好完全反应后所得溶液中溶质的质量分数。
 123456161年前3
123456161年前3 -
 sakuraxiu 共回答了14个问题
sakuraxiu 共回答了14个问题 |采纳率92.9%1、m=4.9;2、16%; 3、第二组完全反应反应后溶液浓度为8.34% 。分析:由题前三组数据分析:由1、2组数据可知第1组反应中硫酸铜过量,但第2组中氢氧化化钠是否过量不确定;由2、3组数据可知第3组反应中氢氧化钠过量,硫酸铜不足。结合题意可知第2组反应完全。由第4组数据可知第2组的沉淀量应为第4组的2倍。反应后的溶液为Na2SO4溶液,用反应前溶液的质量减去反应后沉淀量即为溶液质量M,溶质...1年前查看全部
大家在问
- 1大树公公也请她到别处去安家,这句话的意思
- 2小明和爸爸围这圆形水池跑,小明每步长30cm,爸爸每步长50厘米.跑一圈后有1099个脚印,这圆形水池周长?
- 3FeSO4和NaOH的反应
- 4MY LEG WAS BROKEN这句话对吗?
- 5求解物理题高中练习本上的在天花板上 挂着弹劲系数为k1和k2的两弹簧,弹簧下面用一动滑轮连着,动滑轮下挂着质量为g的物体
- 6-Fιηа|︴Ч ι'|︴_ διε.
- 7王之涣的《凉州词》“黄河远上白云间”赏析
- 8please his this 几个单词中的s的读音哪个与其他不同?
- 9手上罗的个数代表什么
- 10将来学医学,高中该选物理、化学,还是物理、生物.
- 11(2010•云阳县)如图露出的是三角形的一个角,这个三角形一定是锐角三角形.______.
- 12对号入座。膀大腰粗 巧舌如簧 点头哈腰 精神抖擞 1.在贾母面前,王熙凤真是(
- 13甲乙两人骑车从A地出发同向而行甲先出发,半小时后乙以80km/h的速度追赶甲,若乙行进3.5h后追上甲
- 14句子“她认为他是一个会关爱他家人的男士.”缺少的句子成分?
- 15mike wants to take some photos he would like( )
