铁铝合金与稀硝酸反应有哪些化学方程式
 shine8092022-10-04 11:39:544条回答
shine8092022-10-04 11:39:544条回答
已提交,审核后显示!提交回复
共4条回复
 镜泊风 共回答了20个问题
镜泊风 共回答了20个问题 |采纳率95%- HNO3过量,Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
Fe过量,3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O
稀硝酸与铝反应的化学方程式为:
Al+4HNO3===Al(NO3)3+ NO↑+2H2O - 1年前
 侬哪能 共回答了175个问题
侬哪能 共回答了175个问题 |采纳率- Fe+4HNO3=Fe(NO3)3+NO+2H2O
Al+4HNO3=Al(NO3)3+NO+2H2O - 1年前
 破阿飛 共回答了16个问题
破阿飛 共回答了16个问题 |采纳率- 1.Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O Fe过量,3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O
2.Al+4HNO3===Al(NO3)3+ NO↑+2H2O - 1年前
 Evaagain 共回答了26个问题
Evaagain 共回答了26个问题 |采纳率- 2Al+6HNO3==3H2+2Al(NO3)3
Fe+2HNO3==H2+Fe(NO3)2 - 1年前
相关推荐
- 把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH 溶液.过滤出沉淀,经洗涤、干燥、灼烧,得到红棕
把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH 溶液.过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g,则原合金中铁的质量分数为( )
A. 70%
B. 52.4%
C. 47.6%
D. 30% 花仙子的机箱1年前1
花仙子的机箱1年前1 -
 kiddof1208 共回答了18个问题
kiddof1208 共回答了18个问题 |采纳率94.4%解题思路:a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH 溶液,沉淀为氢氧化铁,则经洗涤、干燥、灼烧,得到红棕色粉末为氧化铁,利用组成可知氧化铁中氧元素的质量等于合金中铝的质量,以此来解答.由铁铝合金粉末溶于足量盐酸中,加入过量NaOH 溶液,沉淀为氢氧化铁,则经洗涤、干燥、灼烧,得到红棕色粉末为氧化铁,
则agFe、Al→agFe2O3,
合金中铝的质量等于氧化铁中氧元素的质量,
则合金中铁的质量分数等于氧化铁中铁的质量分数,
原合金中铁的质量分数为[56×2/56×2+16×3]×100%=70%,
故选A.点评:
本题考点: 铁的化学性质;铝的化学性质.
考点点评: 本题考查计算,明确发生的反应找出合金与氧化物的关系是解答本题的关键,注意铁元素的守恒即可解答,难度不大.1年前查看全部
- 把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH 溶液.过滤出沉淀,经洗涤、干燥、灼烧,得到红棕
把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH 溶液.过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g,则原合金中铁的质量分数为( )
A. 70%
B. 52.4%
C. 47.6%
D. 30% 珍惜对方1年前1
珍惜对方1年前1 -
 低焦油cc 共回答了26个问题
低焦油cc 共回答了26个问题 |采纳率92.3%解题思路:a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH 溶液,沉淀为氢氧化铁,则经洗涤、干燥、灼烧,得到红棕色粉末为氧化铁,利用组成可知氧化铁中氧元素的质量等于合金中铝的质量,以此来解答.由铁铝合金粉末溶于足量盐酸中,加入过量NaOH 溶液,沉淀为氢氧化铁,则经洗涤、干燥、灼烧,得到红棕色粉末为氧化铁,
则agFe、Al→agFe2O3,
合金中铝的质量等于氧化铁中氧元素的质量,
则合金中铁的质量分数等于氧化铁中铁的质量分数,
原合金中铁的质量分数为[56×2/56×2+16×3]×100%=70%,
故选A.点评:
本题考点: 铁的化学性质;铝的化学性质.
考点点评: 本题考查计算,明确发生的反应找出合金与氧化物的关系是解答本题的关键,注意铁元素的守恒即可解答,难度不大.1年前查看全部
- 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量铁铝合金与100m
 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0).试回答下列问题:
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0).试回答下列问题:
(1)写出反应过程中的离子反应方程式:OC段______,DE段______,EF段______.
(2)硝酸溶液的物质的量浓度为______mol•L-1
(3)B的值为______mol,C的值为______mL. goldsun01231年前1
goldsun01231年前1 -
 ykama 共回答了17个问题
ykama 共回答了17个问题 |采纳率82.4%解题思路:(1)O→C 之间没有沉淀生成,说明硝酸过量,O→C之间发生的反应酸碱中和反应;D与E一段沉淀的量没有发生变化,为NH4NO3和NaOH反应;
(2)根据氮元素守恒n(HNO3)=n(H+)+2n(NH4NO3)+2n(Mg(NO3)2)+3n(Al(NO3)3)结合金属镁和金属铝的量的情况来计算;
(3)B为沉淀的最大值,根据图象确定C点消耗氢氧化钠的量.(1)OC之间没有沉淀生成,说明硝酸过量,OC之间发生的反应酸碱中和反应,离子方程式为H++OH-═H2O;DE一段沉淀的量没有发生变化,为NH4NO3和NaOH反应,反应的离子方程式为NH4++OH-═NH3•H2O,EF段为氢氧化铝溶于氢...
点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查金属与硝酸的反应、离子方程式的书写、氧化还原反应、化学计算等知识点,属于中等难度试题.解答此题关键是判断出硝酸的还原产物以及电子转移守恒的运用.1年前查看全部
- 金属及其化合物某一份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NAOH溶液,同温同压下产生的气体体积比为3
金属及其化合物
某一份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NAOH溶液,同温同压下产生的气体体积比为3:2,则样品中铁,铝物质的量之比为多少?
1MOL 钠与足量O2反应,为什么产生NA2O 或NA2O2均失去NA个电子?
而不是2NA个电子?不用乘2吗? 珠小丫1年前2
珠小丫1年前2 -
 daimonabc 共回答了24个问题
daimonabc 共回答了24个问题 |采纳率95.8%加盐酸是有铁和铝参与反应,方程式为 Fe+2HCl=FeCl2+H2 2Al+6HCl=2AlCl3+3H2
加氢氧化钠只有铝参加反应,方程式为 2Al+2NaOH+2H2O=2NaAlO2+3H2
如果铁和铝的比例为x:y 可得方程组 x+1.5y=3 1.5y=2
所以x:y=3:4
生成NA20的方程式为:4NA+O2=2NA20 1MOL钠失去1MOL电子
生成NA2O2的方程式为:2NA+O2=NA2O2 1MOL钠失去1MOL电子
主要是以为钠不足量而氧气足量,所以有多少钠就会转移多少电子1年前查看全部
- 1.把a克铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液.过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a克
1.把a克铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液.过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a克,则原合金中铁的质量分数为( )
A.70% B.52.4% C.47.6% D.30%
2、 200mL氯化镁和氯化铝的混合液,其中c(Mg2+)为0.2mol/L,c(cl-)为1.3mol/L.要使Mg2+全部转化为沉淀分离出来,至少需加4mol/LNaOH溶液的体积为( )
A.40mL B.72mL C.80Ml D.128mL chaoranh1年前1
chaoranh1年前1 -
 夏天1020 共回答了13个问题
夏天1020 共回答了13个问题 |采纳率100%1.选A.因为原合金粉末为a克,其中的铁全部转化为了Fe(OH)3,也为a克.因此可知,Fe(OH)3中的铁的质量分数就是原合金粉末中铁的质量分数.所以p%=56/(56+17*3)=70%
2.选C.此题的原理就是先让镁离子和铝离子都沉淀下来,再溶解氢氧化铝即可分离.
因此所加氢氧化钠最少的量应为使得镁离子和铝离子都沉淀后再恰好溶解所有氢氧化铝的量.
镁离子的物质的量为0.2*0.2=0.04mol,氯离子物质的量为1.3*0.2=0.26mol.
所以铝离子物质的量为(0.26-0.04*2)/3=0.06mol.
因为Mg2+~2OH- Al3+~3OH- Al(OH)3~OH-
所以n(OH-)=2n(Mg2+)+4n(Al3+)=2*0.04+4*0.06=0.32mol.
所以V(NaOH)=n(OH-)/c=0.32/4=0.08L=80mL.1年前查看全部
- 向一定量的铁铝合金加入足量的稀盐酸,充分反应后,生成标况下的H2672mL,将等量的合金投入到足量的稀硝酸中,完全反应后
向一定量的铁铝合金加入足量的稀盐酸,充分反应后,生成标况下的H2672mL,将等量的合金投入到足量的稀硝酸中,完全反应后,被还原的HNO3的物质的量为(假设还原产物是NO)( )
A.0.03mol
B.0.02mol
C.大于0.02mol
D.小于0.02mol whj10121年前1
whj10121年前1 -
 xiaodouzi999 共回答了23个问题
xiaodouzi999 共回答了23个问题 |采纳率87%解题思路:根据n=
计算氢气的物质的量,根据电子转移守恒计算合金与盐酸反应时提供电子的物质的量,合金与足量的稀硝酸反应,Fe被氧化为三价铁,合金提供电子电子物质的量大于与盐酸反应时失去的电子物质的量,据此计算.V Vm 氢气物质的量为[0.672L/22.4L/mol]=0.03mol,故与盐酸反应是合金失去电子为0.03mol×2=0.06mol,合金与足量的稀硝酸反应,Fe被氧化为三价铁,合金提供电子电子物质的量大于0.06mol,根据电子转移守恒可知生成NO的物质的量大于[0.06mol/5−2]=0.02mol,即被还原的HNO3的物质的量为0.02mol,
故选C.点评:
本题考点: 化学方程式的有关计算;有关混合物反应的计算.
考点点评: 本题考查氧化还原反应有关计算,难度中等,关键是清楚Fe与盐酸反应生成二价铁,而与足量的稀硝酸反应生成三价铁.1年前查看全部
- 怎么证明铁铝合金的熔融物中有金属铝的存在?试剂是什么?离子方程式.
 万雪401年前1
万雪401年前1 -
 ablb67 共回答了20个问题
ablb67 共回答了20个问题 |采纳率75%加入NaOH,看是否产生气体
2Al+2NaOH+2H2O==2NaAlO2+3H21年前查看全部
- 将wg铁铝合金完全溶于稀盐酸再向所得溶液中加入足量NaOH溶液过滤将所得沉淀至于蒸发皿中加热至质量不再变
将wg铁铝合金完全溶于稀盐酸再向所得溶液中加入足量NaOH溶液过滤将所得沉淀至于蒸发皿中加热至质量不再变
将wg铁铝合金完全溶于稀盐酸,再向所得溶液中加入足量NaOH溶液,过滤,将所得沉淀至于蒸发皿中加热至质量不再变化,取出蒸发皿中的红棕色物质称量,仍为wg,求合金中铝的质量分数.
 小白真好1年前1
小白真好1年前1 -
 amenra 共回答了23个问题
amenra 共回答了23个问题 |采纳率82.6%此合金发生以下反应
Fe + 2HCl = FeCl2
Al + 3HCl = AlCl3
FeCl2 + NaOH = Fe(OH)2
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl Na[Al(OH)4] 溶于水
Fe(OH)2---FeO--Fe2O3
最后的红棕色物质为Fe2O3 也为wg 由合金中的全部Fe转化而成
可知合金中铝质量与Fe2O3中的O的质量分数相等
合金中铝质量分数为 (12*3)/(56*2+12*3)=30%1年前查看全部
- 用定量方法进行实验测定某铁铝合金中铝的质量分数.实验操作过程如下:称取该合金试样1.0g,放入烧杯中加足量盐酸,盖上表面
用定量方法进行实验测定某铁铝合金中铝的质量分数.实验操作过程如下:称取该合金试样1.0g,放入烧杯中加足量盐酸,盖上表面皿,使其充分反应.反应停止,经冷却后向其中加入过量NaOH溶液,充分放置后过滤,对滤出的沉淀经洗涤后在空气中加热灼烧至恒重,得到固体物1.2g.请回答:
⑴实验中用玻璃片盖烧杯的原因是
⑵加入过量NaOH溶液的作用是
⑶加入NaOH溶液后充分放置的作用是
⑷在空气中将沉淀灼烧的目的是
⑸合金中铝的质量分数为 tata991年前1
tata991年前1 -
 最佳拖鞋 共回答了23个问题
最佳拖鞋 共回答了23个问题 |采纳率95.7%Fe---FeCl2--加入氢氧化钠-------Fe(OH)2---加入氢氧化钠过量充分放置---Fe(OH)3--------Fe2O3
56 160
x 1.2g
Al----AlCl3----加入氢氧化钠-----Al(OH)3-----加入氢氧化钠过量-----------NaAlO2---------过滤
按照这个思路那么最后的固体是Fe2O3 1.2g 解得x=0.42g,那么铁铝合金中铝的质量为1.0-0.42=0.58g
⑴实验中用玻璃片盖烧杯的原因是
可能是避免产生的H2吧盐酸里的HCl带出来,一方面减少了HCl的量导致反应不完全,另一方面保护环境以及实验人员.(仅供参考)
⑵加入过量NaOH溶液的作用是
就是要和Al(OH)3反应生产NaAlO2溶解在溶液中.Al(OH)3+NaOH=NaAlO2+2H2O
⑶加入NaOH溶液后充分放置的作用是
使Fe(OH)2充分氧化成Fe(OH)3 ,4Fe(OH)2+2H2O+O2=4Fe(OH)3
⑷在空气中将沉淀灼烧的目的是
一方面,过滤后的物质可能有水,充分灼烧干燥水分,减少误差,令一方面是Fe(OH)3
完全转化成Fe2O3.2Fe(OH)3=加热=Fe2O3+3H2O
⑸合金中铝的质量分数为
0.58/1*100%=58%1年前查看全部
- 把一块铁铝合金溶于足量盐酸中,通入足量氯气,再加入过量NAOH溶液,过滤,灼烧滤渣,得到的固体残留物的质量恰好跟原来合金
把一块铁铝合金溶于足量盐酸中,通入足量氯气,再加入过量NAOH溶液,过滤,灼烧滤渣,得到的固体残留物的质量恰好跟原来合金质量相等.则合金中Fe 、Al质量比是:( )
向200mL0.1mol/L的Fe(NO3)2溶液中加入适量的NaOH溶液,使Fe2+恰好完全沉淀,加热混合物,直到水分蒸干,然后灼烧至质量不再变化为止,此时固体的质量为( ) 白狼tequila1年前1
白狼tequila1年前1 -
 反方向游走 共回答了15个问题
反方向游走 共回答了15个问题 |采纳率100%第一题,加入过量氢氧化钠,最后剩余沉淀氢氧化铁灼烧滤渣得到三氧化二铁.质量相等说明Al的量恰好对应三氧化二铁中的氧元素的量,所以质量比为56*2=112(二铁):16*3=48(三氧)最后结果为7:3
第二题n(Fe)=0.1*0.2=0.02mol最后的固体全部为三氧化二铁,其物质的量为0.01mol质量为0.01*160=1.6g.
注意:经过灼烧之后一定是三氧化二铁同时注意守恒法的使用1年前查看全部
- 把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH 溶液.过滤出沉淀,经洗涤、干燥、灼烧,得到红棕
把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH 溶液.过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g,则原合金中铁的质量分数为( )
A. 70%
B. 52.4%
C. 47.6%
D. 30% 陶爱筠1年前1
陶爱筠1年前1 -
 rockrong 共回答了22个问题
rockrong 共回答了22个问题 |采纳率86.4%解题思路:a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH 溶液,沉淀为氢氧化铁,则经洗涤、干燥、灼烧,得到红棕色粉末为氧化铁,利用组成可知氧化铁中氧元素的质量等于合金中铝的质量,以此来解答.由铁铝合金粉末溶于足量盐酸中,加入过量NaOH 溶液,沉淀为氢氧化铁,则经洗涤、干燥、灼烧,得到红棕色粉末为氧化铁,
则agFe、Al→agFe2O3,
合金中铝的质量等于氧化铁中氧元素的质量,
则合金中铁的质量分数等于氧化铁中铁的质量分数,
原合金中铁的质量分数为[56×2/56×2+16×3]×100%=70%,
故选A.点评:
本题考点: 铁的化学性质;铝的化学性质.
考点点评: 本题考查计算,明确发生的反应找出合金与氧化物的关系是解答本题的关键,注意铁元素的守恒即可解答,难度不大.1年前查看全部
- 有铜铁铝合金共10克放入到足量的盐酸中完全反应后有4.5克固体多余并且收集到气体共4.48升的氢气(已知此时的氢气密度是
有铜铁铝合金共10克放入到足量的盐酸中完全反应后有4.5克固体多余并且收集到气体共4.48升的氢气(已知此时的氢气密度是0.089286克/升)
计算1.原混合物中铜的质量 2.氢气的物质的量 3.原混合物中铁、铝的质量分别是多少
急 cg72121年前1
cg72121年前1 -
 病毒入侵 共回答了18个问题
病毒入侵 共回答了18个问题 |采纳率83.3%铜4.5g
0.2mol
2.8g和2.7g
铜和盐酸不反应,所以4.5g.放出氢气的物质的量为4.48L/22.4L/mol=0.2mol,设铁的物质的量为X,铝的物质的量为Y,根据氧化还原反应2X+3Y=0.2×2,56X+27Y=10-4.5,X=0.05,Y=0.1,铁的质量=0.05×56=2.8g,铝的质量=0.1×27=2.7g.1年前查看全部
- 一定质量的铁铝合金完全溶于过量的稀硝酸中,反应过程中共产生4.48L NO(标准状况下测定),若在反应后的溶液
一定质量的铁铝合金完全溶于过量的稀硝酸中,反应过程中共产生4.48L NO(标准状况下测定),若在反应后的溶液中加入足量的氢氧化钠溶液,则生成沉淀的质量不可能是( )
A. 21.4 g
B. 18.7 g
C. 15.6 g
D. 7.8 g selinaliu_sc1年前1
selinaliu_sc1年前1 -
 断少 共回答了18个问题
断少 共回答了18个问题 |采纳率100%解题思路:一定质量的铁铝合金完全溶于过量的稀硝酸,反应生成Fe(NO3)3、Al(NO3)3,向反应后的溶液中加入足量的氢氧化钠溶液生成的沉淀为Fe(OH)3,假设全为Al,最终没有沉淀生成,假设金属全为Fe,最终得到沉淀质量增大,根据n=
计算NO的物质的量,利用电子转移守恒计算金属的物质的量,进而计算沉淀的最大质量,据此确定沉淀质量范围.V Vm 标况下4.48L NO的物质的量为[4.48L/22.4L/mol]=0.2mol,反应生成Fe(NO3)3、Al(NO3)3,金属都为+3价,根据电子转移守恒,可知金属的总物质的量为
0.2mol×(5−2)
3=0.2mol,
向反应后的溶液中加入足量的氢氧化钠溶液生成的沉淀为Fe(OH)3,假设全为Al,最终没有沉淀生成,假设金属全为Fe,最终得到沉淀质量增大,根据Fe原子守恒,可知生成0.2molFe(OH)3,Fe(OH)3的质量为0.2mol×107g/mol=21.4g,由于金属为Al、Fe的混合物,故沉淀的质量范围为:0g<m(沉淀)<21.4g,
故选:A.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查混合物的有关计算,难度中等,注意利用守恒思想与极限法进行的解答.1年前查看全部
- 把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH 溶液.过滤出沉淀,经洗涤、干燥、灼烧,得到红棕
把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH 溶液.过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g,则原合金中铁的质量分数为( )
A. 70%
B. 52.4%
C. 47.6%
D. 30% shanxiaoyy11年前1
shanxiaoyy11年前1 -
 moto266 共回答了22个问题
moto266 共回答了22个问题 |采纳率90.9%解题思路:a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH 溶液,沉淀为氢氧化铁,则经洗涤、干燥、灼烧,得到红棕色粉末为氧化铁,利用组成可知氧化铁中氧元素的质量等于合金中铝的质量,以此来解答.由铁铝合金粉末溶于足量盐酸中,加入过量NaOH 溶液,沉淀为氢氧化铁,则经洗涤、干燥、灼烧,得到红棕色粉末为氧化铁,
则agFe、Al→agFe2O3,
合金中铝的质量等于氧化铁中氧元素的质量,
则合金中铁的质量分数等于氧化铁中铁的质量分数,
原合金中铁的质量分数为[56×2/56×2+16×3]×100%=70%,
故选A.点评:
本题考点: 铁的化学性质;铝的化学性质.
考点点评: 本题考查计算,明确发生的反应找出合金与氧化物的关系是解答本题的关键,注意铁元素的守恒即可解答,难度不大.1年前查看全部
- 为什么铝热反应所得到的熔融物是铁铝合金
 nixingyu1年前1
nixingyu1年前1 -
 霸气小猪 共回答了16个问题
霸气小猪 共回答了16个问题 |采纳率93.8%应该是Al在加热刚开始温度不高就先氧化成Al2O3 而Al2O3的熔点比Fe(铁好象不会这样氧化 就算氧化熔点就跟低了)高 当Al2O3融化时 Fe(Fe2O3)会先融化 所以就是合金了.1年前查看全部
- 铁铝合金M克和足量的硫酸反应生成氢气2克则M可能是 A 15 B 75 C 30 D 58
 风中de泪1年前2
风中de泪1年前2 -
 本华莱士1147 共回答了18个问题
本华莱士1147 共回答了18个问题 |采纳率94.4%C 30
生成2克氢气,那么铁和铝合金的质量必须在56-18克之间,只有30克符合要求.1年前查看全部
- (2013•安庆二模)研究发现,硝酸越稀,还原产物中氮元素的化合价越低.某同学取适量的铁铝合金与足量很稀的硝酸充分反应,
 (2013•安庆二模)研究发现,硝酸越稀,还原产物中氮元素的化合价越低.某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出.在反应结束后的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.分析上述图形,下列说法不正确的是( )
(2013•安庆二模)研究发现,硝酸越稀,还原产物中氮元素的化合价越低.某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出.在反应结束后的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.分析上述图形,下列说法不正确的是( )
A.欲测定F点沉淀的质量,实验步骤是:过滤、洗涤、干燥、称量
B.溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+
C.溶液中n(NH4+)=0.012mol
D.OC段离子反应方程式:H++OH-=H2O 员儿1年前1
员儿1年前1 -
 半疯荷 共回答了23个问题
半疯荷 共回答了23个问题 |采纳率95.7%解题思路:铁铝合金与足量很稀HNO3充分反应,被氧化为Al3+、Fe3+,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,由于硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由+5变成了-3价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应,则随着NaOH的滴加,发生的反应依次有:
①H++OH-=H2O,②Fe3++3OH-=Fe(OH)3↓,Al3++3OH-=Al(OH)3↓,③NH4++OH-═NH3•H2O,④Al(OH)3 +OH-=AlO2-+2H2O,
A.欲测定F点沉淀的质量,应将互不相溶的固体与液体分离,并洗涤沉淀附着的杂化,再干燥称量;
B.根据发生反应的顺序,可以判断结合OH-能力的强弱;
C.根据DE段消耗氢氧化钠的体积,结合发生反应计算溶液中n(NH4+);
D.OC段为剩余的硝酸与氢氧化钠反应.铁铝合金与足量很稀HNO3充分反应,被氧化为Al3+、Fe3+,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,由于硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由+5变成了-3价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应,则随着NaOH的滴加,发生的反应依次有:
①H++OH-=H2O,②Fe3++3OH-=Fe(OH)3↓,Al3++3OH-=Al(OH)3↓,③NH4++OH-═NH3•H2O,④Al(OH)3 +OH-=AlO2-+2H2O,
A.欲测定F点沉淀的质量,应将互不相溶的固体与液体分离,并洗涤沉淀附着的杂化,再干燥称量,故实验步骤是:过滤、洗涤、干燥、称量,故A正确;
B.根据发生反应的顺序可知,结合OH-能力最强的离子是H+,最弱的离子是NH4+,故B错误;
C.由图可知DE段消耗氢氧化钠的体积为3mol,由NH4++OH-═NH3•H2O可知溶液中n(NH4+)=n(OH-)=0.003L×4mol/L=0.012mol,故C正确;
D.由上述分析可知,OC段为剩余的硝酸与氢氧化钠反应,离子反应方程式:H++OH-=H2O,故D正确,
故选B.点评:
本题考点: 有关混合物反应的计算;硝酸的化学性质.
考点点评: 本题以图象形式考查金属与硝酸的反应、混合物计算等,难度中等,判断图中各阶段发生的反应是解题关键.1年前查看全部
- 铝热反应所得到的熔融是铁铝合金,这种推测有一定的道理是为什么?
铝热反应所得到的熔融是铁铝合金,这种推测有一定的道理是为什么?
并且设计一个实验,证明块状熔融物中含有金属铝.该试验所用试剂是? 当观察到什么现象是说明熔融物中含有铝? 刘琤1年前0
刘琤1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 把一块铁铝合金溶于足量盐酸中,通入足量氯气,再加入过量NAOH溶液,过滤,灼烧滤渣,得到的固体残留物的质量恰好跟原来合金
把一块铁铝合金溶于足量盐酸中,通入足量氯气,再加入过量NAOH溶液,过滤,灼烧滤渣,得到的固体残留物的质量恰好跟原来合金质量相等.则合金中Fe 、Al质量比是:( )
向200mL0.1mol/L的Fe(NO3)2溶液中加入适量的NaOH溶液,使Fe2+恰好完全沉淀,加热混合物,直到水分蒸干,然后灼烧至质量不再变化为止,此时固体的质量为( ) 小和尚211年前1
小和尚211年前1 -
 penzai45 共回答了25个问题
penzai45 共回答了25个问题 |采纳率100%1、由题意知 m(Fe)+ m(Al) = m(Fe2O3),由质量守恒定律知,反应前后铁元素质量应相等,
所以,铝元素的质量等于Fe2O3中氧元素的质量.
所以m(Fe):m(Al)= m(Fe):m(O)=56*2:16*3=7:3
2、 Fe(NO3)2 + 2NaOH = Fe(OH)2 + 2NaNO3
灼烧时发生反应: 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
2Fe(OH)3 = Fe2O3 + 3H2O
2 NaNO3 = 2NaNO2 + O2↑
最后的质量就是氧化铁 和 亚硝酸钠的质量和
氧化铁0.1*0.2 / 2 *(48+112)=1.6g
亚硝酸钠 0.1*0.2*2=0.04*(23+14+32)=2.76g
一共4.36g1年前查看全部
- 铜铁铝合金中加入过量氢氧化钠过滤后,一部分是含铝的钠盐,另一部分是固体铁 铜.为什么会这样
 喜欢黑夜静1年前2
喜欢黑夜静1年前2 -
 市长dd 共回答了16个问题
市长dd 共回答了16个问题 |采纳率81.3%因为只有Al和NaOH反应
2Al+2NaOH+H2O==2NaAlO2 +3H2
Cu和Fe不反应,就是固体了
Al变成了 NaAlO21年前查看全部
- 把一块铁铝合金熔于足量的盐酸中,通入足量氯气,在加入过量氢氧化钠溶液,过滤,把滤渣充分灼烧,得到的固体残留物恰好跟原来的
把一块铁铝合金熔于足量的盐酸中,通入足量氯气,在加入过量氢氧化钠溶液,过滤,把滤渣充分灼烧,得到的固体残留物恰好跟原来的合金质量相等.则此合金中,铁,铝的质量之比约为( )
 mudheaven1年前1
mudheaven1年前1 -
 basgjggy 共回答了10个问题
basgjggy 共回答了10个问题 |采纳率80%把一块铁铝合金熔于足量的盐酸中,通入足量氯气,在加入过量氢氧化钠溶液,过滤,把滤渣充分灼烧,得到的固体残留物恰好跟原来的合金质量相等.则此合金中,铁,铝的质量之比约为( )1年前查看全部
- 将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3:2,则样品中
将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3:2,则样品中铁、铝物质的量之比为( )
A. 3:2
B. 2:1
C. 3:4
D. 4:3 香笑风中1年前2
香笑风中1年前2 -
 wxq0004 共回答了15个问题
wxq0004 共回答了15个问题 |采纳率100%解题思路:不管是金属铝和酸反应还是和碱反应,产生的氢气的量是相等的,所以只要铁和盐酸反应产生的氢气的量与铝和氢氧化钠反应产生的氢气的体积比为3:2就行了,根据反应的关系式计算二者的量的关系.不管是和酸反应还是和碱反应,铝产生的氢气的量是相等的,可以假设只要铁和盐酸反应产生的氢气的量与金属铝和氢氧化钠反应产生的氢气的物质的量分别是1mol和2mol就行了,根据化学方程式可以知道:
Fe~H2,当生成1mol氢气时,消耗金属铁1mol,
2Al~3H2,当生成2mol的氢气时,消耗金属铝的物质的量为[4/3]mol,
所以铁与铝的物质的量比为1:[4/3]=3:4,
故选C.点评:
本题考点: 铝的化学性质;化学方程式的有关计算;铁的化学性质.
考点点评: 本题考查混合物的计算,题目难度不大,本题注意从生成氢气的质量相等判断铁与铝的质量关系.1年前查看全部
- 把ag 铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液,过滤出沉淀,经洗涤干燥、灼烧,得到红色粉末的质量仍然为ag.求
把ag 铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液,过滤出沉淀,经洗涤干燥、灼烧,得到红色粉末的质量仍然为ag.求原混合物中Fe的质量分数.
 清晨的小雪1年前1
清晨的小雪1年前1 -
 deerbones 共回答了20个问题
deerbones 共回答了20个问题 |采纳率90%解题:因为铁元素还在沉淀里,红色粉末与合金质量等,所以红色粉末里铁的质量分数即为所求的合金中铁的质量分数,56X2/160=70%.也可推出,红色粉末里M(0)=合金中M(AL)1年前查看全部
- 将ag的铁铝合金粉末同于足量盐酸中,加入足量的NaOH充分反应后,
将ag的铁铝合金粉末同于足量盐酸中,加入足量的NaOH充分反应后,
过滤出沉淀,经洗涤,干燥,灼烧,得到的红棕色的粉末质量仍为ag,则原合金中的铁的质量为? a981581年前5
a981581年前5 -
 就是喜欢金牛座 共回答了7个问题
就是喜欢金牛座 共回答了7个问题 |采纳率85.7%红棕色的粉末质量仍为ag就是Fe2O3的质量
根据原子守恒:
2Fe------2FeCl3------2Fe(OH)2------2Fe(OH)3------Fe2O3
所以Fe2O3中氧的质量分数就是Al的质量分数:
2Fe-------------Fe2O3
112 160
x=112a/160 a
原合金中的铁的质量为:112a/160g1年前查看全部
- 欲测定某铁铝合金的含量,将样品溶于盐酸,然后加入足量的烧碱溶液,待沉淀全部转化为红褐色时,滤液,将沉淀灼烧,最后得到红褐
欲测定某铁铝合金的含量,将样品溶于盐酸,然后加入足量的烧碱溶液,待沉淀全部转化为红褐色时,滤液,将沉淀灼烧,最后得到红褐色粉末.经称量恰好跟原合金质量相等,则合金中铝的质量为数为________
 blue_bonnie1年前2
blue_bonnie1年前2 -
 骑田红枫 共回答了20个问题
骑田红枫 共回答了20个问题 |采纳率80%因为最后得到红褐色粉末为Fe2O3
所以合金中铝的质量为数为(3*16)/(2*56+3*16)=30%1年前查看全部
- 【急】铁铝合金中铅占总体积的1/5其余是铁,求该合金的密度
【急】铁铝合金中铅占总体积的1/5其余是铁,求该合金的密度
用物理p=m/v的方式写一下, 闪啦1年前1
闪啦1年前1 -
 非谈21 共回答了18个问题
非谈21 共回答了18个问题 |采纳率94.4%铁铝合金中这么有铅呢?是铝吧?
M铝=五分之一乘以P铝
M铁=五分之四乘以P铁
P总=M铝+M铁1年前查看全部
- 一定质量的铁铝合金完全溶于过量的稀硝酸中,反应过程中共产生4.48L NO(标准状况下),若在反应后的溶液中
一定质量的铁铝合金完全溶于过量的稀硝酸中,反应过程中共产生4.48L NO(标准状况下),若在反应后的溶液中
足量的氢氧化钠溶液,则生成沉淀的质量不可能是
A 21.4g B 18.7g C 15.6g D 7.8g
这题纠结了好久. llll我爱你1年前1
llll我爱你1年前1 -
 shanqf 共回答了15个问题
shanqf 共回答了15个问题 |采纳率86.7%NO3-中的N是+5价的,NO中的N是+2价,
生成0.2 mol NO,所以转移电子0.6mol,
而铁和铝溶于稀硝酸全部转化为+3价的离子,且过量的稀硝酸,Fe3+不会转化为Fe2+,
所以共溶解0.2 mol的铁和铝,
当加入过量NaOH溶液时,AI3+全部转化为AIO2-,不产生沉淀,所以沉淀中只有Fe(OH)3,
①沉淀最小:
当铁铝合金中溶解的全部为AI时,加入NaOH,AI3+全部转化为AIO2-,沉淀量为0,
②沉淀最大:
当铁铝合金中溶解的全部为Fe时,加入NaOH,Fe3+全部转化为Fe(OH)3沉淀,
又因为共溶解0.2mol合金,所以Fe(OH)3物质的量为0.2mol,质量为0.2*(56+17*3)=21.4g,
因为是合金同时含有Al、Fe,所以m不可能是0,也不可能是21.4 g
因此沉淀质量 m满足 0<m<21.4 g,
选A1年前查看全部
- 一定质量的铁铝合金完全溶于过量的稀硝酸中,反应过程中产生4.48LNO(标准状况下),若在反应后的溶液中加
一定质量的铁铝合金完全溶于过量的稀硝酸中,反应过程中产生4.48LNO(标准状况下),若在反应后的溶液中加
足量的氢氧化钠溶液,则生成沉淀的质量不可能是:答案是21.4g
对此题有几个问题,因为想用Al来解题:
1 之前过量的稀硝酸会对后来加入的足量NaOH有影响吗?
2 所谓的足量NaOH 是指Al和NaOH 刚好反应生成Al(OH)3沉淀?还是会继续反应生成NaAl02 那稀硝酸不会与NaAl02反应吗? 爱婷一辈子1年前2
爱婷一辈子1年前2 -
 lamy1 共回答了26个问题
lamy1 共回答了26个问题 |采纳率96.2%1、没有影响.因为稀硝酸和NaOH都是足量的.
2、所谓的足量NaOH 是指会继续反应生成NaAl02 ,我给你说一下啊::::当你加入足量NaOH 时,HNO3先与NaOH 反应,因为是足量的,所以铝离子再与NaOH反应生成NaAl02,酸碱中和反应的反应速率更快一些.
如果还有问题欢迎再问.1年前查看全部
- 铁铝合金与稀硝酸反应0.04mol铁和0.02mol铝与适量稀硝酸溶液反应,生成0.05mol一氧化氮
 huahuadan8031年前1
huahuadan8031年前1 -
 lxiia7516 共回答了19个问题
lxiia7516 共回答了19个问题 |采纳率100%产生0.02molAl3+ 0.03molFe2+ 0.01molFe3+1年前查看全部
- (2009•湖南模拟)某学生用电子天平和必要的化学实验仪器测定铁铝合金中各组分含量,其实验装置如图所示:实验时,取一块铁
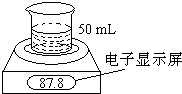 (2009•湖南模拟)某学生用电子天平和必要的化学实验仪器测定铁铝合金中各组分含量,其实验装置如图所示:实验时,取一块铁铝合金,将其切成碎块后全部加入到盛有50mL 5.0mol•L-1 NaOH溶液的烧杯中.试回答下列问题:
(2009•湖南模拟)某学生用电子天平和必要的化学实验仪器测定铁铝合金中各组分含量,其实验装置如图所示:实验时,取一块铁铝合金,将其切成碎块后全部加入到盛有50mL 5.0mol•L-1 NaOH溶液的烧杯中.试回答下列问题:
(1)合金表面反应的离子方程式为:______.
(2)合金表面会形成原电池,其负极的电极反应为:______.
(3)不同时间电子天平的读数如下表所示:
则合金中铁的质量分数为______(保留三位有效数字,下同).实验操作过程 时间/min 电子天平的读数/g 烧杯+NaOH溶液 80.0 烧杯+溶液+样品 0 87.8 1 87.5 2 87.3 3 87.2 4 87.2
(4)上述50mL NaOH溶液中最多可溶解的铁铝合金样品质量为______. tc1234567891年前1
tc1234567891年前1 -
 春开江岸 共回答了13个问题
春开江岸 共回答了13个问题 |采纳率84.6%解题思路:(1)合金是铁和铝,依据物质性质可知,放入氢氧化钠溶液中 反应的是铝,依据铝和氢氧化钠反应写出离子方程式;
(2)铁和铝在氢氧化钠溶液中形成原电池反应,铁做正极,铝做负极失电子生成铝离子,在氢氧化钠溶液中反应变化为偏铝酸钠,依据电子守恒和电荷守恒写出电极反应;
(3)分析图表数据,计算加入的合金质量=87.8g-80.0g=7.8g;取3、4的称量值计算得到烧杯+溶液+样品,减去烧杯+NaOH溶液质量为反应生成氢气的质量,结合化学方程式计算反应的铝的质量得到铁的质量分数;
(4)依据铝和氢氧化钠溶液反应的化学方程式计算所需要最多铝的质量,结合合金铝和铁的质量比计算含有的铁,得到合金质量.(1)合金是铁和铝,由物质性质可知,放入氢氧化钠溶液中 反应的是铝,铝和氢氧化钠反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)铁和铝在氢氧化钠溶液中形成原电池反应,铁做正极,铝做负极失电子生成铝离子,在氢氧化钠溶液中反应变化为偏铝酸钠,依据电子守恒和电荷守恒写出电极反应为:Al-3e-+4OH-=AlO2-+2H2O,
故答案为:Al-3e-+4OH-=AlO2-+2H2O;
(3)分析图表数据,计算加入的合金质量=87.8g-80.0g=7.8g;称量质量不变时,反应生成氢气的质量=87.8g-87.2g=0.6g,物质的量为0.3mol,50mL 5.0mol•L-1 NaOH溶液中物质的量=0.05L×5mol/L=0.25mol,结合化学方程式计算反应的铝的质量
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2×272 3
m0.2mol0.3mol
铝的质量=5.4g,
氢氧化钠过量,铝全部反应;
得到铁的质量分数=[7.8g−5.4g/7.8g]×100%=30.8%,
故答案为:30.8%;
(4)合金中铁和铝质量比=2.4:5.4,
NaOH溶液中物质的量=0.05L×5mol/L=0.25mol,依据化学方程式计算,2Al+2NaOH+2H2O=2NaAlO2+3H2↑
最多溶解铝物质的量0.25mol,质量=0.25mol×27g/mol=6.75g,铁和铝质量比=2.4:5.4=铁的质量:6.75,得到铁的质量=3g,则合金质量=3g+6.75g=9.75g,
故答案为:9.75g.点评:
本题考点: 化学方程式的有关计算;常见金属元素的单质及其化合物的综合应用;探究物质的组成或测量物质的含量.
考点点评: 本题考查了实验数据分析判断的应用,物质称量质量到质量不再变化时,得到的质量最准确,主要是铝的性质分析应用和实验数据应用,掌握分析方法是关键,题目难度中等.1年前查看全部
- 将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3:2,则样品中
将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3:2,则样品中铁、铝物质的量之比为( )
A. 3:2
B. 2:1
C. 3:4
D. 4:3 etyulisnh1年前1
etyulisnh1年前1 -
 ailingbaobao 共回答了16个问题
ailingbaobao 共回答了16个问题 |采纳率93.8%解题思路:不管是金属铝和酸反应还是和碱反应,产生的氢气的量是相等的,所以只要铁和盐酸反应产生的氢气的量与铝和氢氧化钠反应产生的氢气的体积比为3:2就行了,根据反应的关系式计算二者的量的关系.不管是和酸反应还是和碱反应,铝产生的氢气的量是相等的,可以假设只要铁和盐酸反应产生的氢气的量与金属铝和氢氧化钠反应产生的氢气的物质的量分别是1mol和2mol就行了,根据化学方程式可以知道:
Fe~H2,当生成1mol氢气时,消耗金属铁1mol,
2Al~3H2,当生成2mol的氢气时,消耗金属铝的物质的量为[4/3]mol,
所以铁与铝的物质的量比为1:[4/3]=3:4,
故选C.点评:
本题考点: 铝的化学性质;化学方程式的有关计算;铁的化学性质.
考点点评: 本题考查混合物的计算,题目难度不大,本题注意从生成氢气的质量相等判断铁与铝的质量关系.1年前查看全部
- 将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3:2,则样品中
将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3:2,则样品中铁、铝物质的量之比为( )
A. 3:2
B. 2:1
C. 3:4
D. 4:3 yyxw20051年前2
yyxw20051年前2 -
 awa吴 共回答了21个问题
awa吴 共回答了21个问题 |采纳率90.5%解题思路:不管是金属铝和酸反应还是和碱反应,产生的氢气的量是相等的,所以只要铁和盐酸反应产生的氢气的量与铝和氢氧化钠反应产生的氢气的体积比为3:2就行了,根据反应的关系式计算二者的量的关系.不管是和酸反应还是和碱反应,铝产生的氢气的量是相等的,可以假设只要铁和盐酸反应产生的氢气的量与金属铝和氢氧化钠反应产生的氢气的物质的量分别是1mol和2mol就行了,根据化学方程式可以知道:
Fe~H2,当生成1mol氢气时,消耗金属铁1mol,
2Al~3H2,当生成2mol的氢气时,消耗金属铝的物质的量为[4/3]mol,
所以铁与铝的物质的量比为1:[4/3]=3:4,
故选C.点评:
本题考点: 铝的化学性质;化学方程式的有关计算;铁的化学性质.
考点点评: 本题考查混合物的计算,题目难度不大,本题注意从生成氢气的质量相等判断铁与铝的质量关系.1年前查看全部
- 将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3:2,则样品中
将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3:2,则样品中铁、铝物质的量之比为( )
A. 3:2
B. 2:1
C. 3:4
D. 4:3 wanghui1391551年前1
wanghui1391551年前1 -
 Ghhkkq 共回答了23个问题
Ghhkkq 共回答了23个问题 |采纳率82.6%解题思路:不管是金属铝和酸反应还是和碱反应,产生的氢气的量是相等的,所以只要铁和盐酸反应产生的氢气的量与铝和氢氧化钠反应产生的氢气的体积比为3:2就行了,根据反应的关系式计算二者的量的关系.不管是和酸反应还是和碱反应,铝产生的氢气的量是相等的,可以假设只要铁和盐酸反应产生的氢气的量与金属铝和氢氧化钠反应产生的氢气的物质的量分别是1mol和2mol就行了,根据化学方程式可以知道:
Fe~H2,当生成1mol氢气时,消耗金属铁1mol,
2Al~3H2,当生成2mol的氢气时,消耗金属铝的物质的量为[4/3]mol,
所以铁与铝的物质的量比为1:[4/3]=3:4,
故选C.点评:
本题考点: 铝的化学性质;化学方程式的有关计算;铁的化学性质.
考点点评: 本题考查混合物的计算,题目难度不大,本题注意从生成氢气的质量相等判断铁与铝的质量关系.1年前查看全部
- 将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3:2,则样品中
将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3:2,则样品中铁、铝物质的量之比为( )
A. 3:2
B. 2:1
C. 3:4
D. 4:3 抱璞_rr1年前2
抱璞_rr1年前2 -
 tcdnn10507 共回答了23个问题
tcdnn10507 共回答了23个问题 |采纳率91.3%解题思路:不管是金属铝和酸反应还是和碱反应,产生的氢气的量是相等的,所以只要铁和盐酸反应产生的氢气的量与铝和氢氧化钠反应产生的氢气的体积比为3:2就行了,根据反应的关系式计算二者的量的关系.不管是和酸反应还是和碱反应,铝产生的氢气的量是相等的,可以假设只要铁和盐酸反应产生的氢气的量与金属铝和氢氧化钠反应产生的氢气的物质的量分别是1mol和2mol就行了,根据化学方程式可以知道:
Fe~H2,当生成1mol氢气时,消耗金属铁1mol,
2Al~3H2,当生成2mol的氢气时,消耗金属铝的物质的量为[4/3]mol,
所以铁与铝的物质的量比为1:[4/3]=3:4,
故选C.点评:
本题考点: 铝的化学性质;化学方程式的有关计算;铁的化学性质.
考点点评: 本题考查混合物的计算,题目难度不大,本题注意从生成氢气的质量相等判断铁与铝的质量关系.1年前查看全部
- 某中学化学兴趣小组用含有铁铝合金的工业废料,制备FeSO 4 ·7H 2 O和硫酸铝晶体。具体实验操作步骤如下:
某中学化学兴趣小组用含有铁铝合金的工业废料,制备FeSO 4 ·7H 2 O和硫酸铝晶体。具体实验操作步骤如下:
① 将5%Na 2 CO 3 溶液加入到盛有一定量废合金的烧杯中,加热数分钟,用倾析法除去Na 2 CO 3 溶液,然后将废合金用蒸馏水洗涤2至3遍;
② 取洗涤后废合金,加入足量的NaOH溶液中,反应完全后过滤;
③ 向滤液中边搅拌边滴加稀硫酸至溶液的pH为8—9,静置,过滤,洗涤;
④ 将③中固体溶于足量的稀硫酸,将得到的溶液蒸发浓缩,冷却,结晶,过滤,干燥,得到硫酸铝晶体;
⑤ 将②得到的固体洗涤后加入过量的稀硫酸,至铁溶解完全;
⑥ 将得到的溶液转入密闭容器中,静置,冷却结晶;
⑦ 待结晶完毕后,滤出晶体,用少量冰水洗涤2至3次,再用滤纸将晶体吸干,得到FeSO 4 ·7H 2 O晶体。 (1)实验步骤①的目的是_____________ 。
(2)步骤②发生的离子反应方程式为___________ 。
(3)步骤③中,溶液中pH难控制,可改用_____________ 。
(4) 步骤⑤明显不合理,理由是 _________________。
(5)用少量冰水洗晶体,其目的是 __________________。
(6)FeSO 4 ·7H 2 O晶体在高温下可以分解生成Fe 2 O 3 ,SO 2 和H 2 SO 4 ,写出该反应的化学方程式_____________ 。 小疼_20991年前1
小疼_20991年前1 -
 wenkeshanew 共回答了19个问题
wenkeshanew 共回答了19个问题 |采纳率100%(1)除去油污
(2)2Al + 2OH - +6H 2 O = 2[Al(OH) 4 ] - + 3H 2 ↑
(3)通入CO 2 气体
(4)应该Fe过量,否则溶液中可能有Fe 3+
(5)洗涤除去晶体表面附着的硫酸等杂质
(6)2FeSO 4 ·7H 2 O == Fe 2 O 3 +SO 2 ↑+ H 2 SO 4 +13H 2 O1年前查看全部
- 1、一块铁铝合金与足量盐酸反应,加入过量NaOH溶液后,最终产物是( )A、Fe(OH)2和Al(OH)3 B、Fe(O
1、一块铁铝合金与足量盐酸反应,加入过量NaOH溶液后,最终产物是( )A、Fe(OH)2和Al(OH)3 B、Fe(OH)3和Al(OH)3 C.Fe(OH)3和NaAlO2 D.Fe(OH)2和NaAlO2答案C
 hismsc1年前5
hismsc1年前5 -
 似猫乃虎 共回答了18个问题
似猫乃虎 共回答了18个问题 |采纳率94.4%铁铝合金与足量盐酸反应:
Fe + 2 HCl = FeCl2 + H2↑
2 Al + 6 HCl = 2 AlCl3 + 3 H2↑
加入 过量 NaOH
FeCl2 + 2 NaOH = Fe(OH)2 ↓ + 2 NaCl
4 Fe(OH)2 +O2 + 2 H2O = 4 Fe(OH)3(氢氧化亚铁不稳定,极易氧化)
AlCl3 + 3 NaOH = Al(OH)3 ↓ + 3 NaCl
Al(OH)3 + NaOH = NaAlO2 + 2 H2O
选择C1年前查看全部
- 把ag铁铝合金粉末荣誉足量稀盐酸中,再加入过量NaOH溶液
把ag铁铝合金粉末荣誉足量稀盐酸中,再加入过量NaOH溶液
过滤出沉淀,经洗涤,干燥,灼烧,得到红色粉末质量仍为ag,则原合金中铁的质量分数为 goingsure1年前1
goingsure1年前1 -
 zrben 共回答了19个问题
zrben 共回答了19个问题 |采纳率84.2%铁和铝都和稀盐酸反应 再和过量氢氧化钠反应 Fe2+生成Fe(OH)3 (
空气中氧化) Al3+生成NaAlO2 )这不用我说了吧?)
红色粉末为Fe2O3 过滤之后只剩这个了 这是Fe(OH)3灼烧之后的产物
而Fe2O3为ag,则Fe2O3中的Fe的质量分数即为原铁铝合金中Fe的质量分数
70%1年前查看全部
- 有一个铁铝合金,密度是5克每立方厘米,两种物体的体积之比是多少
 yxtfeilong1年前1
yxtfeilong1年前1 -
 空白像的我 共回答了20个问题
空白像的我 共回答了20个问题 |采纳率75%铁密度按7.8算 铝按2.7算 比 铝铁体积比是28比231年前查看全部
- 铁铝合金溶于足量盐酸中,通足量氯气,加过量NaoH溶液,过滤,
铁铝合金溶于足量盐酸中,通足量氯气,加过量NaoH溶液,过滤,
把一块铁铝合金溶于足量盐酸中,通入足量氯气,再加入过量NaoH溶液,过滤,把滤渣充分灼烧,得到的固体残留物恰好跟原来合金的质量相等,则此合金中铁铝质量的比约为多少? 陈不不1年前2
陈不不1年前2 -
 一波才动 共回答了18个问题
一波才动 共回答了18个问题 |采纳率83.3%因为Fe+2HCl===FeCl2+H2
2FeCl2+Cl2===2FeCl3
FeCl3+3NaOH===Fe(OH)3+3NaCl
2Fe(OH)3====Fe2O3+3H2O
2Al+6HCl===2AlCl3+3H2
AlCl3+4NaOH===NaAlO2+2H2O
所以al变成AlO2-存在于溶液,得到Fe(OH)3固体,
加热生成Fe2O3
由于铁的质量不变,所以氧的质量等于铝的质量
所以m(Al):m(Fe)==m(O):m(Fe)=16*3:56*2=3:71年前查看全部
- 将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3:2,则样品中
将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3:2,则样品中铁、铝物质的量之比为( )
A. 3:2
B. 2:1
C. 3:4
D. 4:3 ytgbj1221年前1
ytgbj1221年前1 -
 wdswllwza 共回答了24个问题
wdswllwza 共回答了24个问题 |采纳率91.7%解题思路:不管是金属铝和酸反应还是和碱反应,产生的氢气的量是相等的,所以只要铁和盐酸反应产生的氢气的量与铝和氢氧化钠反应产生的氢气的体积比为3:2就行了,根据反应的关系式计算二者的量的关系.不管是和酸反应还是和碱反应,铝产生的氢气的量是相等的,可以假设只要铁和盐酸反应产生的氢气的量与金属铝和氢氧化钠反应产生的氢气的物质的量分别是1mol和2mol就行了,根据化学方程式可以知道:
Fe~H2,当生成1mol氢气时,消耗金属铁1mol,
2Al~3H2,当生成2mol的氢气时,消耗金属铝的物质的量为[4/3]mol,
所以铁与铝的物质的量比为1:[4/3]=3:4,
故选C.点评:
本题考点: 铝的化学性质;化学方程式的有关计算;铁的化学性质.
考点点评: 本题考查混合物的计算,题目难度不大,本题注意从生成氢气的质量相等判断铁与铝的质量关系.1年前查看全部
- 欲测定某铁铝合金的含量,将样品溶于盐酸,然后加入足量的烧碱溶液,待沉淀全部转化为红褐色时...
欲测定某铁铝合金的含量,将样品溶于盐酸,然后加入足量的烧碱溶液,待沉淀全部转化为红褐色时...
欲测定某铁铝合金的含量,将样品溶于盐酸,然后加入足量的烧碱溶液,待沉淀全部转化为红褐色时,滤液,将沉淀灼烧,最后得到红褐色粉末.经称量恰好跟原合金质量相等,则合金中铝的质量为数为________
(3*16)/(2*56+3*16)=30%
为啥分子上是3*16? wdymny1年前1
wdymny1年前1 -
 pyxdg 共回答了28个问题
pyxdg 共回答了28个问题 |采纳率100%红褐色粉末是Fe2O3,经称量恰好跟原合金质量相等,说明Fe2O3中氧的质量与合金中铝的质量相等,在Fe2O3中氧的质量分数就是合金中铝的质量分数,即3*16)/(2*56+3*16)=30%1年前查看全部
大家在问
- 1外界对物体做功时,物体本身是否吸收热量
- 2装订一本书,如果每页排500个字,可以排180页,如果改为每页排600个字,可以少排多少页?(用比例解)
- 3装订一本书,如果每页排500个字,可以排180页,如果改为每页排600个字,可以少排多少页?(用比例解)
- 41兆焦耳等于多少千瓦?
- 5lim ln(sinx/x)的极限.x趋向于0
- 6达尔文提出人类与现代类人猿的共同祖先是一类古猿还是森林古猿?
- 7怎样判断一个英语句子中谁是主句谁是从句
- 8物体温度升高,内能一定增大.这句话对吗.不用考虑物体对外做功吗 物体吸收热量是,内能一定增大吗
- 9分不清内能,温度,热量,做功的关系和区别
- 10请问纬度多少是北极圈?多少是南极圈?
- 11数学界七大世纪难题是什么?最好能给出命题~
- 12“如痴如醉”中“痴”的意思
- 13南极、北极、南半球、北半球的纬度分别是多少度
- 14球面镜对光的反射是漫反射还是镜面反射
- 15南极和北极的纬度?456
