称取6.0 g含H2C2O4•2H2O、KOH、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液
 wishinwater2022-10-04 11:39:542条回答
wishinwater2022-10-04 11:39:542条回答②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由__变为__.该溶液中还原剂的物质的量为___mol.
为什么是无色变紫红

已提交,审核后显示!提交回复
共2条回复
 michael_guye 共回答了23个问题
michael_guye 共回答了23个问题 |采纳率91.3%- 楼主,既然混合溶液是过量的,那么一开始滴定的时候,是不是KMnO4的量是不是足的呢?所以一开始就是无色的,随着混合溶液被消耗,直到消耗完全,所以当溶液显紫红色是相当于是滴定的终点;最后一空根据得失电子守恒来做就是5n(KMnO4)=2n(C2O42-),还原剂的物质的量就为:0.1*0.016*5/2=0.004mol
- 1年前
 tinycheng 共回答了2139个问题
tinycheng 共回答了2139个问题 |采纳率- ② 无色 ,紫红色 0.004
原溶液无色,而KMnO4为紫红色,
所以当溶液中的H2C2O4和KHC2O4反应完全时,溶液呈紫红色。
(实际这时候,KMnO4稍微过量,才能呈现紫红色)
2MnO4- + 5C2O42- + 16H+ == 2Mn2+ + 10CO2 +84H2O
2 5
0.1*0.016 ... - 1年前
相关推荐
- 某科学兴趣小组通过查阅资料得知,用固体草酸(化学式为H2C2O4•2H2O)可以制取CO,方程式可写成H2C2O4•2H
 某科学兴趣小组通过查阅资料得知,用固体草酸(化学式为H2C2O4•2H2O)可以制取CO,方程式可写成H2C2O4•2H2O
某科学兴趣小组通过查阅资料得知,用固体草酸(化学式为H2C2O4•2H2O)可以制取CO,方程式可写成H2C2O4•2H2O
CO↑+CO2↑+3H2O,该课题小组的同学设计了如图所示的装置并进行了实验,收集一瓶CO,请回答:△ .
(1)为证明分解产物中有水,装置A中的物质应该是______;
(2)装置B的作用是______;
(3)实验中采用“压水法”收集CO(装置C);从CO的物理性质考虑,是因为______;
(4)若要验证二氧化碳有无生成,则应在______之间加一个装置,该装置中盛放的物质是______. 天堂的红叶1年前1
天堂的红叶1年前1 -
 yxiang546 共回答了23个问题
yxiang546 共回答了23个问题 |采纳率100%解题思路:(1)根据无水硫酸铜常用来检验水的存在,遇水变蓝色进行分析;
(2)根据氢氧化钠和二氧化碳会生成碳酸钠和水进行分析;
(3)根据一氧化碳的物理性质进行分析;
(4)根据检验二氧化碳常用澄清石灰水检验进行分析.(1)无水硫酸铜遇水变蓝,常用来检验水的存在,所以装置A中的物质应该是:无水硫酸铜;
(2)氢氧化钠溶液常用来除去二氧化碳气体,氢氧化钠和二氧化碳会生成碳酸钠和水,所以装置B的作用是:吸收二氧化碳;
(3)采用“压水法”收集CO实质上是排水法,可以采用此法收集的气体需具备不易或难溶于水的性质,所以从CO的物理性质考虑,是因为:一氧化碳难溶于水;
(4)实验室检验二氧化碳常用澄清石灰水检验,所以要验证二氧化碳有无生成,需要在除去二氧化碳之前检验,则应在AB之间加一个装置,该装置中盛放的物质是:氢氧化钙溶液.
故答案为:(1)无水硫酸铜;
(2)吸收二氧化碳;
(3)一氧化碳难溶于水;
(4)AB,氢氧化钙溶液.点评:
本题考点: 物质的相互转化和制备;常见气体的检验与除杂方法;二氧化碳的检验和验满;一氧化碳的物理性质.
考点点评: 进行物质检验或除杂时,要根据物质的性质进行,所以要求同学们在平时的学习中加强基础知识的储备,以便能够灵活应用.1年前查看全部
- (2010•宝鸡一模)已知草酸晶体(分子式为H2C2O4•2H2O)与浓硫酸混合加热时,会发生如下反浓硫酸应:
(2010•宝鸡一模)已知草酸晶体(分子式为H2C2O4•2H2O)与浓硫酸混合加热时,会发生如下反浓硫酸应:
H2C2O4•2H2O
CO↑+CO2↑+3H2O,浓硫酸 △
试用下列所给各装置设计一个实验,要求能够一次性验证上述反应的各生成物(如图,除装置①外,其它装置均只用1次).
(1)这些装置的连接顺序是(按气体由左至右流向填装置编号):⑥→______→①.
(2)验证生成物中有一氧化碳气体的实验现象是______.
(3)装置③中所加的固体药品是______,可验证的产物是______,确定装置③在整套装置中位置的理由是______.
(4)装置⑤中所盛溶液是______,该装置在此实验中的作用是______.
(5)本实验从最后一个装置出来的气体是否需要处理?如需处理,请回答如何处理;如不需处理,请说明理由______. marrun1年前1
marrun1年前1 -
 kbwti 共回答了17个问题
kbwti 共回答了17个问题 |采纳率94.1%解题思路:(1)需要检验的气体为一氧化碳、二氧化碳和水,根据三种气体的性质合理设计仪器连接顺序;
(2)检验一氧化碳利用的是还原红棕色的氧化铁实验,根据实验现象分析;
(3)根据装置③是用于检验水的实验分析;根据避免混合气体通过溶液时带出水,干扰检验结果分析;
(4)根据装置⑤用于干燥一氧化碳分析;
(5)根据一氧化碳有毒、污染大气及一氧化碳能够燃烧判断.(1)需要检验的是CO、CO2、H2O三种气体,需要先检验水蒸气,利用③无水硫酸铜,然后检验二氧化碳,利用①澄清石灰水,然后检验一氧化碳,利用一氧化碳的还原性完成检验,所以需要除去混合气体中二氧化碳,使用装置...
点评:
本题考点: 常见气体的检验.
考点点评: 本题考查了常见气体的检验,涉及了水、二氧化碳、一氧化碳的检验,要求学生熟练掌握常见气体的检验方法.1年前查看全部
- (2)称取6.0g含H2C2O4・2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL 溶
(2)称取6.0g含H2C2O4・2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL 溶液.量取两份此溶液各25 mL,分别置于两个锥形瓶中.
①第一份溶液中加入2滴酚酞试液,滴加0.25 mol/L NaOH 溶液至20mL时,溶液由无色变为浅红色.该溶液被中和的H的物质的量为 mol.
②第二份溶液滴加0.10 mol/L 酸性KMnO4溶液至16mL时反应完全,此时溶液颜色由 变为___________.该溶液中还原剂的物质的量为___________mol.
③原试样中H2C2O4・2H2O的质量分数为______________________,KHC2O4的质量分数为______________________.
1、(1)5 ,2,16 ,10 ,2 ,8
(2)① 0.005 ② 无色 ,紫红色 0.004 ③ 0.21; 0.64
只问第③小题谢谢! TAZ20081年前1
TAZ20081年前1 -
 mmmmmmqp 共回答了20个问题
mmmmmmqp 共回答了20个问题 |采纳率95%设xmol H2C2O4・2H2O ymolKHC2O4
2x+y=0.25*0.02 这条方程是根据与NaOH得出的
(x+y)=0.1*0.016 *2.5 这条是根据与MnO4-反应得出的
解出x y就行.1年前查看全部
- 某化学兴趣小组通过查阅资料得知:固体草酸(H2C2O4•2H2O)受热可分解其化学方程式为 H2C2O4•2H
某化学兴趣小组通过查阅资料得知:固体草酸(H2C2O4•2H2O)受热可分解其化学方程式为 H2C2O4•2H2O
CO↑+CO2↑+3H2O,该课题小组的同学在实验室分别进行了如下实验,请回答下列问题:△ .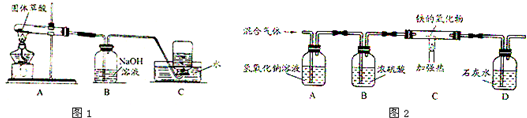
(1)甲同学利用图1装置制取并收集CO:
①B装置的作用______.
②CO集满后,将集气瓶由水槽中加盖取出,为防止产生倒吸,应先______(选填“a.先把导管从水槽中移出”或“b.断开A、B之间的连接”)
(2)乙同学为了验证草酸的分解产物,设计了四个方案,分别将混合气体(包括水蒸气)依次通过足量的下列试剂:
A.石灰水、灼热的氧化铜、无水硫酸铜、氢氧化钠溶液
B.无水硫酸铜、氢氧化钠溶液、灼热的氧化铜、石灰水
C.石灰水、无水硫酸铜、灼热的氧化铜、石灰水
D.无水硫酸铜、石灰水、氢氧化钠溶液、灼热的氧化铜、石灰水
你认为其中正确的方案是______.
(3)丙同学按图2装置利用草酸分解产生的CO测定某种铁的氧化物的组成.
①样品的质量是23.2g,当C装置中铁的氧化物全部被还原后,称量剩余的质量为16.8g,则该铁的氧化物的化学式为______.
②丁同学认为去掉A装置,对测定铁的氧化物的化学式结果______影响(填“有”或“无”) 空谷明月1年前1
空谷明月1年前1 -
 雪色纱衣 共回答了19个问题
雪色纱衣 共回答了19个问题 |采纳率100%解题思路:(1)根据草酸分解的产物及实验目的,判断各装置的作用及操作注意事项;二氧化碳与氢氧化钠溶液可反应;
(2)根据所设计方案中试剂在验证混合气体中的作用,设计正确的顺序对混合气体的每一成分进行验证;
(3)①根据对所测装置质量的分析(C装置减少的质量就是氧化物中氧元素的质量),计算铁的氧化物中所含铁元素与氧元素的质量,根据铁的氧化物中铁元素和氧元素的质量比求出氧化物的化学式;
②分析为测定铁的氧化物的组成各装置的作用,对各装置进行评价,并判断对测定结果所产生的影响.(1)①利用氢氧化钠溶液吸收分解产物中的二氧化碳气体,从而收集到较为纯净的一氧化碳;
②收集完毕,为防止产生倒吸,应先把导管从水槽中移出,再断开A、B之间的连接,然后熄灭酒精灯;
(2)检验二氧化碳气体要把混合气体通入澄清石灰水,气体再出来时带来水蒸气,影响混合气体中水的检验,因此在检验二氧化碳、一氧化碳气体应首先使用无水硫酸铜检验混合气体中的水;然后利用澄清石灰水检验二氧化碳,而不能使用与二氧化碳反应无明显现象的氢氧化钠溶液;检验二氧化碳完毕要通过氢氧化钠溶液除掉二氧化碳,防止对一氧化碳反应产物的干扰,即在检验一氧化碳前要既检验二氧化碳又完全吸收二氧化碳;接下来把气体通过灼热氧化铜和澄清石灰水,检验一氧化碳;故正确方案应选D方案;
(3)①完全反应后,装置C中剩余固体质量16.8g,即铁的氧化物中铁的质量;而装置C减少的质量为氧化物中氧元素的质量,23.2g-16.8g=6.4g;
设则该铁的氧化物化学式为FexOy,氧化物中铁元素和氧元素的质量比为:[56x/16y]=[16.8g/6.4g],整理得[x/y]=[3/4],所以该铁的氧化物的化学式是Fe3O4;
②装置A是除去混合气体中的二氧化碳,对C装置的质量变化并无影响,所以对测定铁的氧化物的化学式结果无影响;
故答案为:
(1)①除去二氧化碳(CO2);
②a;
(2)D;
(3)①Fe3O4;
②无.点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;常见气体的检验与除杂方法;根据化学反应方程式的计算.
考点点评: 根据实验目明确所设计的实验装置的作用,是解答好此类题的基础与关键,检验混合气体中含有水蒸气,通常放在第一步.1年前查看全部
- (2)称取6.0g含H2C2O4・2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL 溶
(2)称取6.0g含H2C2O4・2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL 溶液.量取两份此溶液各25 mL,分别置于两个锥形瓶中.
①第一份溶液中加入2滴酚酞试液,滴加0.25 mol/L NaOH 溶液至20mL时,溶液由无色变为浅红色.该溶液被中和的H的物质的量为 mol.
②第二份溶液滴加0.10 mol/L 酸性KMnO4溶液至16mL时反应完全,此时溶液颜色由 变为___________.该溶液中还原剂的物质的量为___________mol.
② 无色 ,紫红色
2为什么变为紫红的,MNO42-不是变为MN2-了吗 mila1年前1
mila1年前1 -
 mm 共回答了16个问题
mm 共回答了16个问题 |采纳率93.8%①中和的H+等于OH-.所以=0.25*0.02=0.005mol
②的确是由无色变紫红色.
2MnO4- + 5C2O42- + 16H+ == 2Mn2+ + 10CO2 +84H2O
2 5
0.1*0.016 x
解得x=0.0041年前查看全部
大家在问
- 1如图所示,水平放置的A、B两平行板相距h,上板A带正电,现有质量为m、带电量为+q的小球在B板下方距离B板为H处,以初速
- 2云梯消防车的梯架一般有几节梯节构成?一节梯节的长度、宽度、厚度大概为多少?
- 3汉译英:那个婴儿出生时三公斤重 That baby was 3 kilos ______ _______
- 41.Ich moechte bitte ...sprechen.“...”处是第三格吗?为什么?
- 5再提问一遍吧 65 37 17 下一个是什么?智力题,
- 6函数f(x)=(x+a)(x+4)为偶函数,则实数a=
- 7一个三位小数,精确到百分位约是3.50,这个数最大是多少?最小是多少?两个数相差多是
- 8因式分解36*1.6^2 - 16*1.4^2
- 9数学选择题的常用解题方法
- 10我的英语阅读理解较弱怎么办?应该怎样提高呀?要看什么书吗?
- 11李老师走进教室,手里拿着一本书。 翻译
- 12判断是不是广义积分sin x/x在-1到2上是不是广义积分
- 13谈谈这几个成语与从客观实际出发的哲学观点的关系.自知之明,不自量力,量力而行,妄自菲薄.
- 14九比x=三分之一比四分之一等于多少,
- 15可以用哪些成语来概括罗丹工作的描写
