1)Zn+2HNO3=Zn(NO3)2+H2O2)Cu+2hcl=CuCL3+H2O3)Mg+HCL=MgCL+H2O4
 alexander_fv2022-10-04 11:39:543条回答
alexander_fv2022-10-04 11:39:543条回答
1)Zn+2HNO3=Zn(NO3)2+H2O2)Cu+2hcl=CuCL3+H2O3)Mg+HCL=MgCL+H2O4)2Fe+6HCL=2FeCL3+3H2O判断下列化学方程式是否正确,并改正!

已提交,审核后显示!提交回复
共3条回复
 ypkonig 共回答了17个问题
ypkonig 共回答了17个问题 |采纳率94.1%- 都不对.1)3Zn+8HNO3(稀)==3Zn(NO3)2+2NO+4H2O2)Cu与HCl不反应3)Mg+2HCl==MgCl2+H24)Fe+2HCl==FeCl2+H2
- 1年前
 yangchengzhong 共回答了20个问题
yangchengzhong 共回答了20个问题 |采纳率80%- 1)Zn+2HNo3=zn(No3)2+H22)Cu+2hcl=CuCl2+H23)Mg+2HCl=MgCl2+H24)Fe+2Hcl=FeCl2+H2
- 1年前
 整个名字真费劲 共回答了23个问题
整个名字真费劲 共回答了23个问题 |采纳率87%- 第一条错误具体要看硝酸是稀的还是浓的 Zn+2HNO3(稀)=Zn(NO3)2+H2↑第二条错误 Cu不与HCl反应 Cu0+2HCl=CuCl2+H20第三条错误 Mg离子是正二价 Mg+2HCl=MgCl2+H2↑第四条错误 Fe单质反应是生成正二价的亚铁离子 Fe+2HCl=FeCl2+H2↑
- 1年前
相关推荐
- 向AgNO3、Cu(NO3)2、Zn(NO3)2混合溶液中,加入一定量的铁粉,分反应后过滤,向滤出的固体中滴加稀硫酸,有
 kkwtre21年前3
kkwtre21年前3 -
 sunny330 共回答了13个问题
sunny330 共回答了13个问题 |采纳率76.9%向滤出的固体中滴加稀硫酸,有气泡产生,说明铁有剩余,铁先置换银,置换完银后,再置换铜,铜也被置换完了,铁不能置换锌.1年前查看全部
- 已知Zn(NO3)2分解的化学方程式为:2Zn(NO3)2→2ZnO+4NO2+O2↑.将硝酸锌和金属锌的混合物在空气中
已知Zn(NO3)2分解的化学方程式为:2Zn(NO3)2→2ZnO+4NO2+O2↑.将硝酸锌和金属锌的混合物在空气中充分灼烧后冷却,发现灼烧前后质量没有改变.求混合物中金属锌的质量百分含量.
 gaogao11071年前9
gaogao11071年前9 -
 hsij 共回答了24个问题
hsij 共回答了24个问题 |采纳率91.7%硝酸锌分解方程式为:
2Zn(NO3)2 =2ZnO + 4NO2 + O2↑
锌氧化方程式为:
2Zn + O2 = 2ZnO
由上述反应式得,硝酸锌分解产生的氧化锌和金属锌在空气中被氧化的量是一样的,生成的O2的量和与Zn反应消耗的O2的两相等.二者单位比是1:1.于是可以直接用其分子量计算质量百分比.
金属锌的质量百分含量 = Zn的分子量 / 〔Zn(NO3)2分子量+Zn分子量〕
设2Zn(NO3)2的质量为x,Zn的质量为y.
184x/378+32x/378=32y/130 解的得x/y=2.32
所以锌的质量分数为 y/(x+y)=0.6989 即69.89%
不知道我表述清楚了没有
换一种说法:
硝酸锌的分子量是189,氧化锌的分子量是81,锌的原子量是65,则在反应中,锌和硝酸锌都转化为氧化锌它们的化学式量分别由65升至81和由189降至81,1mol锌增加了16.1mol硝酸锌降低了108,16/108=4/27,若混合物中有27mol的锌和4mol硝酸锌,则在空气中加热时,锌增加的质量和硝酸锌降低的质量是相等的所以,这样的混合物加热后质量不变.所以混合物中金属锌的质量分数=(27*65)/(27*65+189*4)*100% = 69.89%1年前查看全部
- Zn(NO3)2与NaOH反应的离子方程式,写出这两种形式Zn(OH)4-,ZnO2 2-,
 过河的卒子ff不回1年前1
过河的卒子ff不回1年前1 -
 青青竹林 共回答了20个问题
青青竹林 共回答了20个问题 |采纳率90%Zn2+ +4OH-=Zn(OH)42-
Zn2+ +4OH-=ZnO2 2-+2H2O1年前查看全部
- 往AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一定量的铁粉,充分反应后,发现有少量金属析出,过滤后往滤
往AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一定量的铁粉,充分反应后,发现有少量金属析出,过滤后往滤
液滴加盐酸有白色沉淀生成,则析出少量金属一定是
A.CU B.Ag C.CU和Ag D无法判断 simleyao1年前4
simleyao1年前4 -
 春熙大盗 共回答了21个问题
春熙大盗 共回答了21个问题 |采纳率95.2%首先有置换反应,然后加入盐酸,溶液里也有了硝酸,强氧化性,此时还有沉淀,那只能是氯化银,说明银离子没被置换出来完,所以产生的固体就只能有银,而不可能有铜,也没有铁.1年前查看全部
- 在Cu(NO3)2和Zn……在Cu(NO3)2和Zn(NO3)2的混合溶液中加入一定量铁粉,充分反应后过滤,想滤除的固体
在Cu(NO3)2和Zn……
在Cu(NO3)2和Zn(NO3)2的混合溶液中加入一定量铁粉,充分反应后过滤,想滤除的固体中滴加稀硫酸,有气泡产生,则滤出的固体中一定含有----------------,滤液中一定含有的溶质的化学式为-----------------. 还_可以1年前2
还_可以1年前2 -
 么高 共回答了17个问题
么高 共回答了17个问题 |采纳率94.1%在Cu(NO3)2和Zn(NO3)2的混合溶液中加入一定量铁粉,充分反应后过滤,想滤除的固体中滴加稀硫酸,有气泡产生,则滤出的固体中一定含有---铁,滤液中一定含有的溶质的化学式为-------Fe(NO3)2和Zn(NO3)2.1年前查看全部
- 将洁净的铜丝浸入含有AgNO3和Zn(NO3)2和电镀废水中,一段时间后取出
将洁净的铜丝浸入含有AgNO3和Zn(NO3)2和电镀废水中,一段时间后取出
铜丝表面覆盖了一层物质,这层物质是-----------,写出发生反应的化学方程式-------------.反应类型是 --------- . 8703291年前1
8703291年前1 -
 euh7rd 共回答了17个问题
euh7rd 共回答了17个问题 |采纳率88.2%应该是含有AgNO3和Zn(NO3)2的电镀废水吧
生成银单质
硝酸锌不和铜发生反应
铜和硝酸银反应,生成的单质银
化学方程式:2AgNO3+Cu==Cu(NO3)2+2Ag
这个反应中一种化合物和一种单质反应生成另一种化合物和另一种单质,故反应类型是置换反应.1年前查看全部
- 4Zn 10HNO3=4Zn(NO3)2 NH4NO3 3H2O还原产物和氧
4Zn 10HNO3=4Zn(NO3)2 NH4NO3 3H2O还原产物和氧
还原产物是什么?被还原和未还原硝酸的质量比是什么?还原产物和氧化产物物质的量之比是什么?反应中有四摩尔发生转移时生成NH4NO3的物质量是多少摩尔.只要答案 dd200081年前2
dd200081年前2 -
 说怿女 共回答了16个问题
说怿女 共回答了16个问题 |采纳率87.5%4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
还原剂 氧化剂 氧化产物 还原产物
+5 -3
HNO3 NH4NO3 转移电子数为8
10个硝酸中仅有1个作氧化剂,所以被还原和未还原硝酸的质量比是1:9
还原产物和氧化产物物质的量之比是1:4
反应中有四摩尔 电子 发生转移时生成NH4NO3的物质量是 0.5 摩尔1年前查看全部
- 某化工厂排出的废液中含有AgNO3、Zn(NO3)2和Cu(NO3)2,3种物质.为了分离并回收金属银和铜,化学课外小组
某化工厂排出的废液中含有AgNO3、Zn(NO3)2和Cu(NO3)2,3种物质.为了分离并回收金属银和铜,化学课外小组的同学设计了如下方案:如图
1.所加物质a是?b是?c是?
2.生成物X是?Y是?Z是?B是?
越快分越多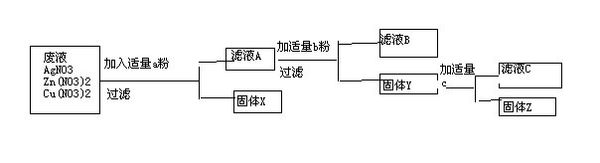
 lyyzzhang1年前1
lyyzzhang1年前1 -
 xiaojinmm 共回答了21个问题
xiaojinmm 共回答了21个问题 |采纳率90.5%Cu,Zn,HNO3
Ag,Cu,Zn(NO3)2;Zn(NO3)21年前查看全部
- 向含有Cu(NO3)2,Zn(NO3)2,Fe(NO2)3,AgNO3各0.1mol的混合溶液中加入0.1molFe,充
向含有Cu(NO3)2,Zn(NO3)2,Fe(NO2)3,AgNO3各0.1mol的混合溶液中加入0.1molFe,充分搅拌后Fe 溶解,溶液中
不存在Fe3+ 同时析出0.1molAg 下列结论错误的是 A氧化性Zn2+>Cu2+>Fe3+>Ag+ B Fe3+的氧化性大于Cu2+ C 溶液中Cu2+与Fe2+的物质的量比为1:2 D1molFe可还原2molFe3+ 为什么选A zhou78zh1年前1
zhou78zh1年前1 -
 无缘001 共回答了24个问题
无缘001 共回答了24个问题 |采纳率91.7%假如A对的话那么反映顺序就应该和A一样了,就应当至少生成Zn了.与题不符
希望我的回答帮助到了你~1年前查看全部
- 在Cu(NO3)2 ,AgNO3 Zn(NO3)2 的混合溶液中加入……
在Cu(NO3)2 ,AgNO3 Zn(NO3)2 的混合溶液中加入……
在Cu(NO3)2 ,AgNO3 Zn(NO3)2 的混合溶液中加入一定量的铁粉,充分反应.请填空:
(1) .若铁粉过量,则反应后溶液中所含的金属阳离子是( ).
(2) .若铁粉不足,将反应后的混合物过滤,则固体物质中一定有( )
(3) .写出一个上述反应中的化学方程式( ). jiro3651年前3
jiro3651年前3 -
 659395216 共回答了14个问题
659395216 共回答了14个问题 |采纳率100%1.亚铁离子,锌离子
2.银
3.2AgNO3+Fe=Fe(NO3)2+2Ag1年前查看全部
- 用Fe置换出Zn(NO3)2的化学方程式
 色素性荨麻疹1年前1
色素性荨麻疹1年前1 -
 maggiezhou117 共回答了25个问题
maggiezhou117 共回答了25个问题 |采纳率92%Fe是不会与Zn(NO3)2反应的,不能置换出Zn
因为Fe的活泼性比Zn弱1年前查看全部
- 帮我解决一道化学计算题已知Zn(NO3)2分解的化学方程式为:2Zn(NO3)2==2ZnO+4NO2+O2.将硝酸锌和
帮我解决一道化学计算题
已知Zn(NO3)2分解的化学方程式为:2Zn(NO3)2==2ZnO+4NO2+O2.将硝酸锌和金属锌的混合物在空气中充分灼烧后冷却,发现灼烧前后质量没有改变.99求混合物中金属锌的质量百分含量.这道题我完全懵了,不然我完全看不懂! 芾宁1年前2
芾宁1年前2 -
 feizhiye 共回答了23个问题
feizhiye 共回答了23个问题 |采纳率91.3%2Zn(NO3)2==2ZnO+4NO2+O2,2molZn(NO3)2反应前后质量减少216g(气体逸出)
2Zn+O2==2ZnO,2molZn反应前后质量增加32g
216:32=27:4
所以混合物中Zn(NO3)2摩尔数:Zn=4:27
Zn质量百分含量=27×65/(27×65+4×251)=63.6%1年前查看全部
- 1.Zn和Zn(NO3)2的混合物在空气中灼烧,至质量不再改变为止,冷却后称其质量与原混合物相等.求原混合物中两种成分的
1.Zn和Zn(NO3)2的混合物在空气中灼烧,至质量不再改变为止,冷却后称其质量与原混合物相等.求原混合物中两种成分的质量比.
2.把4.48L二氧化碳通过一定量的氧化钠后,收集到3.36L的气体,求3.36L气体是什么气体?气体的体积比怎么样?
3.量筒里有一氧化氮和二氧化氮的混合气体100mL,将量筒倒立在水中
1)充分反应后,若量筒里的气体体积减少50mL 求原混合气体中一氧化氮和二氧化氮的体积各多少mL
2)充分反应后,若发现溶液的质量增加108mg,求原混合气体中二氧化氮的质量为多少g?
4.将氢氧化钾和碳酸钾的混合物25.6g于250摄氏度在一密闭容器中充分煅烧,冷却后若混合物质量损失4.9g,求原混合物各物质的质量.
5.在一密闭容器中盛有标准情况下一氧化碳和氧气的混合气体共4.48L 一定条件下充分反应后,恢复到标准情况,体积变为3.36L 将这些其他通过盛有碱石灰的干燥管后,体积变为1.12L 求原混合气体中两种气体的体积. 无心石头1年前2
无心石头1年前2 -
 爵士9991 共回答了17个问题
爵士9991 共回答了17个问题 |采纳率100%1.Zn(NO3)2=2ZnO+4NO2↑+O2↑
2Zn+O2=2ZnO
最后剩余ZnO
由m(Zn)*81/65+m(Zn(NO3)2)*81/189=m(Zn)+m(Zn(NO3)2)
所以m(Zn):Zn(NO3)2=65:28
2.氧化钠?那就CO2
应该是过氧化钠吧
2CO2---O2 体积差为1
所以V(O2)=1.12L V(CO2)=2.24L
3.(1)NO不反应,3NO2+H2O=NO+2HNO3 体积差为2
所以生成V(NO)=50/2=25ml 原有V(NO2)=25*3=75ml
所以原来NO2 75ml NO 25ml
(2)3NO2+H2O=NO+2HNO3 质量差为108
所以m(NO2)=3*46=138mg
4.碳酸钾?应该是碳酸氢钾吧
两者的物质的量之比会影响最终质量KOH+KHCO3=K2CO3+H2O
如果KHCO3过量,会继续分解2KHCO3=K2CO3+H2O+CO2↑
如果KOH过量,就不会有别的改变了
先假设n(KOH):n(KHCO3)=1:1
那么56*n(KOH)+100*n(KHCO3)=25.6
n(KOH)=n(KHCO3)=0.164mol
所以质量减少m(H2O)=0.164*18=2.952g小于4.9g,所以一定是KHCO3过量
所以56*n(KOH)+100*n(KHCO3)=25.6
18*n(KOH)+62*(n(KHCO3)-n(KOH))/2=4.9
所以n(KOH)=0.1mol n(KHCO3)=0.2mol
所以原混合物KOH 5.6g KHCO3 20g
5.通过碱石灰减少的体积为CO2,所以V(CO2)=3.36-1.12=2.24L 所以反应2CO+O2=2CO2得到CO2 2.24L,所以消耗一氧化碳2.24L,氧气1.12L,如果剩余气体为O2,则O2原来是2.24L;剩余CO,原来为3.36L
所以CO 2.24L,O2 2.24L或CO 3.36L O2 1.12L1年前查看全部
- 向AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一些铁粉,充分反应后过滤,再向
向AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一些铁粉,充分反应后过滤,再向
滤出的固体中加入稀盐酸,有气体产生,则滤出的固体中一定有
A.ag cu zn B.cu zn fe C.ag zn fe D.ag cu fe asxiagang1年前2
asxiagang1年前2 -
 godsea 共回答了17个问题
godsea 共回答了17个问题 |采纳率76.5%选D,因为 Zn 的活动顺序在 Fe 之前,所以 Fe 不能将 Zn 从它的盐溶液中置换出来,所以滤出的固体中一定不含 Zn ,而 Fe 与 Ag .Cu 均可发生置换反应,当然,现在还不能准确地说溶液中就一定有 Ag 和 Cu 两种固体,由于 Ag 的活动性顺序在 Cu 之后,所以 Ag 会先被置换出来,至于 Cu ,会在 Ag 完全置换出来之后,才被置换出来,在加入稀盐酸后,如果生成气泡,则一定证明滤出的固体中含有 Fe ,因为只有 Fe 才可以和盐酸反应生成气体(氢气) ,而 Ag 和 Cu 因为活动性都在 H(氢) 之后,所以不与稀盐酸反应,所以选D.1年前查看全部
- Zn(NO3)2【Cu(NO3)2】 括号内是杂质,去除杂质用什么试剂 化学方程式是
 zzhnetcom1年前1
zzhnetcom1年前1 -
 pass_over 共回答了19个问题
pass_over 共回答了19个问题 |采纳率89.5%加入过量的锌粒后过滤.Zn+Cu(NO3)2=Cu+Zn(NO3)21年前查看全部
- 在Cu(NO3)2、AgNO3、Zn(no3)2、的混合溶液中加一定量的铜粉.
在Cu(NO3)2、AgNO3、Zn(no3)2、的混合溶液中加一定量的铜粉.
在Cu(NO3)2、AgNO3、Zn(no3)2、的混合溶液中加一定量的铜粉,过滤后在加入适量铁粉,再次过滤.过滤后的溶液中的溶质有______________.原因! jiaxin20021年前2
jiaxin20021年前2 -
 修颜 共回答了18个问题
修颜 共回答了18个问题 |采纳率100%Cu粉加入后,会置换出Ag,溶液中 的溶质有 Cu(NO3)2、AgNO3(可能有)、Zn(NO3)2 加入Mg粉后,溶质一定有Mg(NO3)2,可能有AgNO3,Cu(NO3)2,Zn(NO3)2,有前面的,必然有后面的,因为没有说Mg 的量 是否过量1年前查看全部
- 实验室废水随意排放会造成环境污染.某校实验室的废水中含有大量AgNO3、Zn(NO3)2和Fe(NO3)2,该校实验小组
实验室废水随意排放会造成环境污染.某校实验室的废水中含有大量AgNO3、Zn(NO3)2和Fe(NO3)2,该校实验小组设计实验从该废水中回收银,并得到副产品硫酸亚铁晶体.实验方案如下所示.(实验过程中未引入其他的金属元素)
操作一得名称,该操作需要使用的仪器有
2.固体甲中含有的物质是
3.步骤一想废水中加入过量的A,检验A是否过量的方法 tangyaohan1年前1
tangyaohan1年前1 -
 casey公主 共回答了18个问题
casey公主 共回答了18个问题 |采纳率88.9%A是锌粉.
废水中含有锌、铁、银三种金属元素,在不引入新的元素前提下,加入一种金属单质,从溶液中置换出来,加入锌或铁,如果加入铁,固体甲是银和铁(因为铁是过量的),那么再加入硫酸亚铁就没有意义.如果加入锌,固体甲是银、锌、铁,加入硫酸亚铁后,(为除去过量的锌)固体丙是银和铁,加入适量硫酸后,硫酸和铁反应,生成硫酸亚铁,剩下不与硫酸反应的银.
溶液乙是硝酸锌,溶液丁是硫酸亚铁和硫酸锌的混合物.
固体甲:Zn、Ag、Fe
乙:ZnNO3
丙:Fe、Ag
丁:FeSO4、ZnSO41年前查看全部
- 铁铜等一些离子的氧化还原问题在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3各0.01mol的混合液中加入铁粉
铁铜等一些离子的氧化还原问题
在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3各0.01mol的混合液中加入铁粉0.01mol,经充分搅拌后产生的变化是什么?
A 铁溶解,但没有其他金属生成,溶液中的阳离子Cu2+、Zn2+、Fe2+
B 铁溶解,析出了0.01molCu
C 铁只溶解了0.005mol
D铁溶解,析出了0.005molCu
这里的硝酸根是否可因为溶液的弱酸性体现出氧化性? ruby0201年前4
ruby0201年前4 -
 abc84846 共回答了26个问题
abc84846 共回答了26个问题 |采纳率96.2%选D1年前查看全部
- 原电池中的盐桥更换为石墨有两个烧杯,一个装的是Zn(NO3)2溶液,其中有锌片作负极,一个装的是AgNO3溶液,其中有银
原电池中的盐桥更换为石墨
有两个烧杯,一个装的是Zn(NO3)2溶液,其中有锌片作负极,一个装的是AgNO3溶液,其中有银片作正极,中间是盐桥连接,外电路就只接了一个电流计...总之就是一个最简单的Zn-Ag原电池+电流计.那么把盐桥换成石墨棒是否能够继续供电(反应)?
参答说可以反应,觉得很奇怪:如果反应,那么生成了什么?Zn(NO3)2溶液中多的Zn2+怎么办?又没有AgNO3溶液中的(NO3)-补充,没有盐桥了嘛...难道生成氢氧化锌?更何况如果这样都可以,那还费那么大劲做盐桥干嘛?万望高手解答! liaoyunying111年前1
liaoyunying111年前1 -
 ZP1129 共回答了17个问题
ZP1129 共回答了17个问题 |采纳率94.1%其实是可以的,盐桥只不过是一个导电的装置,导电性能要比其他物质导电性能要好.在原电池反应中,实质上盐桥中的液体并没有进入到溶液中,只有电子发生了转移,带电的离子是不能通过盐桥的.常用于原电池试验,材料:琼脂+饱和氯化钾溶液
作用:
在两种溶液之间插入盐桥以代替原来的两种溶液的直接接触,减免和稳定液接电位(当组成或活度不同的两种电解质接触时,在溶液接界处由于正负离子扩散通过界面的离子迁移速度不同造成正负电荷分离而形成双电层,这样产生的电位差称为液体接界扩散电位,简称液接电位),使液接电位减至最小以致接近消除.
防止试液中的有害离子扩散到参比电极的内盐桥溶液中影响其电极电位.盐桥内液体是不会流出的.1年前查看全部
- Zn(NO3)2和Fe反应的现象
Zn(NO3)2和Fe反应的现象
Fe 是铁钉
溶液会有什么变化吗? 绮绮猪1年前6
绮绮猪1年前6 -
 懿米 共回答了23个问题
懿米 共回答了23个问题 |采纳率87%Fe和Zn(NO3)2不反应
要是说铁把锌置换出来,这就不符合置换反应的原理:Fe不如Zn活泼
在目前的认识来看,还没有实验证实铁和硝酸锌能反映.
那么,把铁钉放到硝酸锌溶液中就没有明显现象1年前查看全部
- 在AgNO3、Cu(NO3)2和Zn(NO3)2混合溶液中,加入一定量的铁粉,充分反应后过滤,在滤渣中加入稀盐酸,
在AgNO3、Cu(NO3)2和Zn(NO3)2混合溶液中,加入一定量的铁粉,充分反应后过滤,在滤渣中加入稀盐酸,
求 (1)滤渣成分
(2)写出相应方程式 一叶千花1年前1
一叶千花1年前1 -
 潇潇a风雨 共回答了20个问题
潇潇a风雨 共回答了20个问题 |采纳率90%1、Fe、Cu、Ag
2、2AgNO3+Fe=Fe(NO3)2+2Ag
Cu(NO3)2+Fe=Fe(NO3)2+Cu1年前查看全部
- Zn与稀HNO3反应生成Zn(NO3)2、NH4NO3和H2O怎么配平
Zn与稀HNO3反应生成Zn(NO3)2、NH4NO3和H2O怎么配平
不要最后结果.要的是过程. 爬在墙上的蚂蚁1年前2
爬在墙上的蚂蚁1年前2 -
 xcfgfgfg 共回答了15个问题
xcfgfgfg 共回答了15个问题 |采纳率93.3%4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O1年前查看全部
- 在AgNO3、Cu(NO3)2和Zn(NO3)2混合溶液中,加入一定量的铁粉,充分反应后过滤,在滤渣中加入稀盐酸,
在AgNO3、Cu(NO3)2和Zn(NO3)2混合溶液中,加入一定量的铁粉,充分反应后过滤,在滤渣中加入稀盐酸,
为什么有气体产生就说明铁有剩余? allen05771年前4
allen05771年前4 -
 6624871 共回答了20个问题
6624871 共回答了20个问题 |采纳率95%1、如果铁很不足,过滤只能得到银,因为铁先置换银.但是滤渣银不能和盐酸反应
2、如果铁不足,过滤可以得到银和铜,因为置换完银还可以置换铜.这时滤渣是银和铜,也都不能和盐酸反应.
3、如果铁足量,即使置换完银和铜有剩余也不能置换锌,此时滤渣是铁,可以和盐酸反应生成氢气.
以上三种情况只有第三种有气体1年前查看全部
- Zn(NO3)2颜色溶液溶液~不好意思忘写了~
 1912021年前7
1912021年前7 -
 法拉利拖拉机 共回答了24个问题
法拉利拖拉机 共回答了24个问题 |采纳率95.8%溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,凡含MnO4-的溶液呈紫色,其余溶液一般不无色.1年前查看全部
- 在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1 mol的混合溶液中加入0.1 mol铁粉
在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1 mol的混合溶液中加入0.1 mol铁粉,充分搅拌后,Fe溶解,溶液中不存在Fe3+离子,同时析出0.1 mol Ag.求证:C.溶液中Cu2+与Fe2+物质的量比为1∶2D.1 mol Fe可还原2 mol Fe3+
 monkeywife1年前2
monkeywife1年前2 -
 哈ff学子 共回答了11个问题
哈ff学子 共回答了11个问题 |采纳率100%首先进行判断,Fe能和硝酸铜,硝酸铁,硝酸银溶液反应,不合硝酸锌反应.所以首先可以忽略硝酸锌这一溶质
把所有物质列出来:
Cu2+=0.1mol Fe3+=0.1mol Ag+=0.1mol Fe=0.1mol Fe2+=0mol
析出0.1mol Ag,说明硝酸锌完全反应
2Ag+ + Fe == 2Ag + Fe2+
这里消耗了0.1mol的Ag+,所以消耗的Fe是消耗Ag+的一半,就是0.05mol,生成的Fe2+也是0.05mol
这时
Cu2+=0.1mol Fe3+=0.1mol Ag+=0mol Fe=0.05mol Fe2+=0.05mol
根据题意,溶液不含三价铁离子,所以剩余的Fe继续和Fe3+反应
2Fe3+ + Fe == 3Fe2+
这里Fe3+完全反应,消耗了0.1mol,所以消耗的Fe是0.05mol,生成的Fe2+是0.15mol
这时Fe单质也恰好消耗完全(这里已经可以证明D:1molFe可以还原2mol Fe3+了)
前后两步生成的Fe2+总量是0.2mol
即Cu2+=0.1mol Fe3+=0mol Ag+=0mol Fe=0mol Fe2+=0.2mol
显然C:溶液中铜离子:亚铁离子=1:2也证明出来了1年前查看全部
- 完成下列化学方程式 ZnCl2 + () = Zn(NO3)2 +()
 默然回首21年前1
默然回首21年前1 -
 无尘009 共回答了16个问题
无尘009 共回答了16个问题 |采纳率87.5%1年前查看全部
- AgNO3、Zn(NO3)2、Fe(NO3)2如何回收银?
AgNO3、Zn(NO3)2、Fe(NO3)2如何回收银?
先加过量A,得沉淀甲;沉淀甲再加过量FeSO4溶液,得沉淀乙;沉淀乙加适量稀硫酸,生成Ag沉淀 裤cc里的仙人掌1年前1
裤cc里的仙人掌1年前1 -
 wangxinkai 共回答了23个问题
wangxinkai 共回答了23个问题 |采纳率82.6%问题:先加过量A,得沉淀甲;沉淀甲再加过量FeSO4溶液,得沉淀乙;沉淀乙加适量稀硫酸,生成Ag沉淀.
则A是Mg,加过量Mg,可以置换得Zn、Fe、Ag,这就是沉淀甲;
沉淀甲(含Zn、Fe、Ag)中加入过量FeSO4溶液,发生反应
Zn + FeSO4 = ZnSO4 + Fe ,则剩余沉淀就是Fe、Ag,这就是沉淀乙;
沉淀乙(含Fe、Ag)中加适量稀硫酸,Fe + H2SO4 = FeSO4 + H2↑,
Fe被反应完了,最后剩余沉淀就是Ag.1年前查看全部
- 氧化还原反应配平方法HNO3+ZN=NH4NO3+ZN(NO3)2+H2O详细解析如何配平.我就是不会观察法啊……怎么观
氧化还原反应配平方法
HNO3+ZN=NH4NO3+ZN(NO3)2+H2O
详细解析如何配平.
我就是不会观察法啊……
怎么观察?
物质前的系数不会配啊 Lin6226961年前1
Lin6226961年前1 -
 能说不 共回答了24个问题
能说不 共回答了24个问题 |采纳率91.7%10HNO3+4Zn=NH4NO3+4Zn(NO3)2+3H2O
首先先标出变化了的元素的化合价 包括反应前后.(化合价无变化的不标,如本例中的H和O元素)
+5 0 -3 +5 +2 +5
H N O3 + Zn = N H4 N O3 + Zn ( N O3 ) + H2 O
可以看到只有N的化合价降低了 也只有Zn的化合价上升了.
化合价上升多少可看作是失去多上电子 同样化合价降低多少可认为得到多少电子.
由电子守恒即可配平 变化的元素 再利用观察法即可将整个式子配平
10HNO3+4Zn=NH4NO3+4Zn(NO3)2+3H2O
观察法:就是在原来的基础上(系数比例不变),观察一种元素保证其前后的量一致在该题中 就是现配平剩余的氧或者氢在配平剩下的一种
详细说明
第一步,跟据化合价的升降来配平化合价有变化的元素
HNO3+4Zn _ NH4NO3+Zn(NO3)2+H2O
第二步,根据锌守恒在Zn(NO3)前配4
HNO3+4Zn _ NH4NO3+4Zn(NO3)2+H2O
第三步,根据N守恒在HNO3前配10(可看作一个N化合价变化了的HNO3+9个未变化的HNO3)
10HNO3+4Zn _ NH4NO3+4Zn(NO3)2+H2O
第四步,根据氧守恒在H2O前配3
10HNO3+4Zn _ NH4NO3+4Zn(NO3)2+3H2O
第五步,根据H验证是否配平衡(既反应前等于反应后),相等后短线改为等号
10HNO3+4Zn=NH4NO3+4Zn(NO3)2+3H2O
所谓观察法就是利用元素守恒(反应前后元素的总数量不会改变)来配平1年前查看全部
- 某工厂排出的废液中含有AgNO3、Zn(NO3)2、Cu(NO3)2,为了从中回收金属银和金属铜,(我只要知道第三问就好
某工厂排出的废液中含有AgNO3、Zn(NO3)2、Cu(NO3)2,为了从中回收金属银和金属铜,(我只要知道第三问就好
某工厂排出的废液中含有AgNO3、Zn(NO3)2、Cu(NO3)2,为了从中回收金属银和金属铜,设计了如下的操作: Ag
滤液-----过量A(操作一)------- Zn(NO3)2
滤液----过量B------
固体
(1)过量的试剂A为( )
A、铜丝 B、锌丝C、铁丝 D、银丝
(2)操作①为:---------用到的玻璃仪器有-----------.
(3)最后得到的固体含有:----------,要想得到纯净的铜还要进行的操作是----------;
如何确定得到的固体中只剩铜:--------------------.
 miss1314_251年前1
miss1314_251年前1 -
 wood_dress 共回答了15个问题
wood_dress 共回答了15个问题 |采纳率86.7%1)过量的试剂A为( A )
A、铜丝 B、锌丝C、铁丝 D、银丝
(2)操作①为:过滤 用到的玻璃仪器有 漏斗,烧杯,玻棒.
(3)最后得到的固体含有:Cu和Fe,要想得到纯净的铜还要进行的操作是 滴加稀盐酸;
如何确定得到的固体中只剩铜:滴加盐酸,看是否有气泡.1年前查看全部
- 某废液中含有Zn(NO3)2,Cu(NO3)2和AgNO3向该溶液加入一定量的铁粉,充分反应后过滤
某废液中含有Zn(NO3)2,Cu(NO3)2和AgNO3向该溶液加入一定量的铁粉,充分反应后过滤
1、若在滤液中低价稀盐酸有白色沉淀产生则过滤后得到的滤渣是?滤液中的溶质?
2、若在滤渣中低价盐酸,有气泡产生,那么滤出的滤渣为?滤液中的溶质? 南山路1号1年前1
南山路1号1年前1 -
 汪鹿原 共回答了21个问题
汪鹿原 共回答了21个问题 |采纳率90.5%1.向滤液中加入稀盐酸有白色沉淀生成,表明绿叶中有银离子.可得到一下结论:一.fe只与Cu离子反应置换出了Cu,滤渣为CU(滤液情况有2中,一个是Fe恰好完全置换了Cu,另一个是溶液最后个还有Cu存在);二.fe将Cu完全置换出来,还置换了部分银离子,滤渣为CU,Ag;前者,反应:Fe+Cu2+=Fe2++Cu,Ag++Cl-=AgCl;后者:在前者基础上多一个,Fe+2Ag+=Fe2++2Ag
2有气泡产生表明滤渣中有Fe,铜离子和银离子完全置换出来,反应Fe+Cu2+=Fe2++Cu,Fe+2Ag+=Fe2++2Ag,2H++Fe=H2+Fe2+1年前查看全部
- 将一定量的铁粉加入到一定量的AgNO3,Cu(NO3)2,Zn(NO3)2的混合溶液中,讨论过滤后所得滤液,滤渣中物质存
将一定量的铁粉加入到一定量的AgNO3,Cu(NO3)2,Zn(NO3)2的混合溶液中,讨论过滤后所得滤液,滤渣中物质存在情况!
 打放屁的人1年前4
打放屁的人1年前4 -
 tuohang 共回答了22个问题
tuohang 共回答了22个问题 |采纳率90.9%首先当铁粉加入到混合溶液中去的时候,铁是会和AgNO3,Cu(NO3)2,反应的,是不会跟Zn(NO3)2反应的
铁和AgNO3反应生成Fe(NO3)2,还有单质银
铁和 Cu(NO3)2反应生成Fe(NO3)2,还有单质铜
但是铁粉先和谁反应呢,是先和AgNO3,还是先和Cu(NO3)2反应,这就要看金属活动性强弱的排序了,在金属活动性强弱顺序表(钾钙钠镁铝锌铁锡铅氢铜汞银铂金)中,铜是排在银前面的,也就是说铜的金属活动性比银强,那么
当铁粉进入混合溶液的时候先和AgNO3反应,当铁和AgNO3反应把银离子全部置换出来之后,如果这时铁粉还有多余,才会继续和溶液中的硝酸铜Cu(NO3)2反应,当铁把铜离子全部置换出来之后,就算铁粉还有多余,剩下的铁粉是不会继续和硝酸锌反应的,那么这个时候滤渣中就含有铁粉了
综上所述,可以讨论出以下五种情况
第一种情况,铁粉不够把硝酸银中的银离子全部置换出来,那么铁粉完全反应光,滤渣中只含有单质银,滤液中含有硝酸银,硝酸铜,硝酸锌,还有硝酸亚铁
滤渣:单质银(Ag)
滤液:AgNO3,Cu(NO3)2,Zn(NO3)2,Fe(NO3)2
第二种情况,铁粉刚好够把硝酸银中的银离子全部置换出来,那么铁粉完全反应光,而溶液中的硝酸银也完全反应,滤渣中还只有单质银,滤液中含有硝酸铜,硝酸锌,还有硝酸亚铁,这时硝酸银已经不存在于溶液中了,已经全部被铁单质置换出去了
滤渣:单质银(Ag)
滤液:Cu(NO3)2,Zn(NO3)2,Fe(NO3)2
第三种情况,铁粉比第二种情况多一点,也就是能够把硝酸银中银离子全部置换出去,而不够把硝酸铜的铜离子全部置换出去,那么最后单质铁全部反应光,硝酸银也反应光,硝酸铜反应一部分,这样滤渣中含有单质银和单质铜,滤液中含有硝酸铜,硝酸亚铁,硝酸锌
滤渣:单质银(Ag),单质铜(Cu)
滤液:Cu(NO3)2,Zn(NO3)2,Fe(NO3)2
第四种情况,铁粉的量刚好够把硝酸银和硝酸铜全部置换出去,那么最后铁粉反应光,滤渣中含有单质银和单质铜,滤液中含有硝酸亚铁和硝酸锌,这时候溶液中的硝酸银和硝酸铜已经不存在了
滤渣:单质银(Ag),单质铜(Cu)
滤液:Zn(NO3)2,Fe(NO3)2
第五种情况,也就是最初讨论整个过程的那种情况,铁粉的量能够把铜离子和银离子全部置换出去之后还有多余,那么这个时候滤渣中含有单质银单质铜和单质铁,滤液中含有硝酸锌和硝酸亚铁
滤渣:单质银(Ag),单质铜(Cu)单质铁(Fe)
滤液:Zn(NO3)2,Fe(NO3)2
总体来说,就是当单质铁的量逐渐增多的时候,里面的银和铜会依次被逐渐置换出来,当最后全部被置换出来之后,铁粉就多余了1年前查看全部
- ZN + HNO3 = N20 + ZN(NO3)2 + H20 有何配平良策 方法详细
 xk82871年前1
xk82871年前1 -
 tclua 共回答了18个问题
tclua 共回答了18个问题 |采纳率94.4%利用化合价升降守恒,Zn化合价升高2价;N元素化合价从+5降为+1,下降4价,升降要守恒的话,应该是2Zn~1HNO3(被还原的);在观察N2O中有两个+1价的N原子,因此再扩大两倍,所以关系式为4Zn~2HNO3(被还原的)~4Zn(NO3)2~8H...1年前查看全部
- 向含有AgNO3,Cu(NO3)2和Zn(NO3)2的混合液中加入金属铁反应
向含有AgNO3,Cu(NO3)2和Zn(NO3)2的混合液中加入金属铁反应
分析:_________________涉及的化学反应是①__________________
____________________有先后顺序②_____________________
之后分两种情况分析,
①如果向反应后的滤液中加入盐酸,产生白色沉淀,则原反应中________物质是剩余的,涉及的化学方程式是______________________(写序号),此时_________________.第一部反映后 滤液中溶质是_________________;滤渣是____________________.
②如果向反应后的滤渣中加入盐酸,产生大量气泡,则原反应中_________物质是剩余的,
涉及的化学方程式是________________________,此时____________________,
第一部反映后,滤液中溶质为______________
滤渣为_________________ smallmin19831年前1
smallmin19831年前1 -
 colin-tianyabbs 共回答了23个问题
colin-tianyabbs 共回答了23个问题 |采纳率87%铁能置换银和铜,但不能置换锌
涉及的化学反应是①__2AgNO3+Fe==Fe(NO3)2+2Ag Cu(NO3)2+Fe=Fe(NO3)2+Cu
有先后顺序②___先置换银,再置换铜_____
①如果向反应后的滤液中加入盐酸,产生白色沉淀,则原反应中__AgNO3__物质是剩余的,涉及的化学方程式是__2AgNO3+Fe==Fe(NO3)2+2Ag __(写序号),此时__HCl+AgNO3==AgCl↓+HNO3___.第一部反映后 滤液中溶质是___Cu(NO3)2和Zn(NO3)2,Fe(NO3)2___;滤渣是____Ag____.
铁要先把银置换完后,有多余的铁,再置换铜.所以根本不可能有Cu+2AgNO3=Cu(NO3)2+2Ag
这个反应呀1年前查看全部
- 在含有 Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3 各 0.01mol 的混合溶液中,加入0.01
在含有 Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3 各 0.01mol 的混合溶液中,加入0.015mol的铁粉
在含有 Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3 各 0.01mol 的混合溶液中,加入 0.015mol 的铁粉,经充分搅拌后,产生的变化是
A.铁溶解,没任何金属 B.铁溶解,不再含Fe3+ C.析出0.01mol Ag和0.01mol Cu D.析出0.01molAg 0.05mol Cu gaosuzhigong1年前1
gaosuzhigong1年前1 -
 听说章子怡vv了 共回答了18个问题
听说章子怡vv了 共回答了18个问题 |采纳率94.4%d,因为任何反应第一时间都会生成最稳定的物质,首先会和银离子反应,反应比例是2比1,用掉0.005的铁,再与三价铁反应,按照离子式比例,又用掉0.005铁,剩下0.005和铜反应1年前查看全部
- 实验室的废水中含有大量AgNO3,Zn(NO3)2和Fe(NO3)2,课外小组同学欲从
实验室的废水中含有大量AgNO3,Zn(NO3)2和Fe(NO3)2,课外小组同学欲从
实验室的废水中含有大量AgNO3,Zn(NO3)2和Fe(NO3)2,课外小组同学欲从该废液中回收银,并得到副产品硫酸亚铁晶体.实验方案如下:(图片)

 kits881年前1
kits881年前1 -
 Typicala 共回答了22个问题
Typicala 共回答了22个问题 |采纳率90.9%(1)过滤;Fe、Ag;Zn(NO3)2、Fe(NO3)2
(2)Fe+2AgNO3==2Ag+Fe(NO3)2
(3)取少量固体甲于试管中,加入稀硫酸,有气泡冒出,则加入的铁过量.1年前查看全部
- 在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.0l mol的酸性混合溶液中加入0.01 m
在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.0l mol的酸性混合溶液中加入0.01 mol铁粉,经搅拌后发生的
A.铁溶解;析出0.01 mol Ag和0.005 mol Cu B.铁溶解,析出0.0l mol Ag并放出H2C.铁溶解,析出0.01 mol Ag,溶液中不再有Fe3+ D.铁溶解,析出0.0lmolAg,溶液中不再有Cu2+. 浅色高梁1年前2
浅色高梁1年前2 -
 pizzaprince 共回答了9个问题
pizzaprince 共回答了9个问题 |采纳率77.8%根据活动性顺序,显然我们可以得出0.005mol铁置换了0.01摩尔的银
剩下的0.005摩尔铁与0.01摩尔三铁发生氧化还原反应
显然这道题选C
这是高三的题吧?我是高一的,不大确定1年前查看全部
- 大学无机化学题往0.01mol.L-1 Zn(NO3)2 溶液中通入H2S 至饱和,当溶液PH≥ 1 时,就可析出ZnS
大学无机化学题
往0.01mol.L-1 Zn(NO3)2 溶液中通入H2S 至饱和,当溶液PH≥ 1 时,就可析出ZnS 沉淀,但若往含1.0 mol.L-1 CN- 离子的 0.01 mol.L-1 Zn(NO3)2 溶液中通入H2S 饱和时,则需在PH ≥ 9 条件下,才可析出ZnS沉淀.试计算Zn(CN)42- 的不稳定常数.(注意,计算中并不需要未给出的其它数据.) wang_zg061年前1
wang_zg061年前1 -
 LZB_ty 共回答了16个问题
LZB_ty 共回答了16个问题 |采纳率93.8%往0.01mol.L-1 Zn(NO3)2 溶液中通入H2S 至饱和,当溶液pH≥ 1 时,就可析出ZnS 沉淀,设为过程1,
含1.0 mol.L-1 CN-离子的 0.01 mol.L-1 Zn(NO3)2 溶液中通入H2S 饱和时,则需在pH ≥9条件下,才可析出ZnS沉淀,设为过程2,则有:
Ksp(ZnS)=[Zn2+]1[S2-]1=[Zn2+]2[S2-]2 .(1)
[Zn2+]1 =0.01mol.L-1;
[S2-]1=0.1*Ka1*Ka2/[H+]1 2(平方) (设H2S的1级和2级解离常数为Ka1和Ka2),pH=1时,[H+]1=10-1,(饱和H2S的浓度为0.1或设为[H2S]饱和均可,求[S2-]时可约去)
[S2-]2=0.1*Ka1*Ka2/[H+]2 2(平方) ,pH=9时,[H+]2=10-9
从(1)式中,可求出过程2中析出ZnS沉淀时的[Zn2+]2=0.01*[H+]2 2/[H+]1 2=0.01*10-18/10-2=10-18
因此,可得出Zn(CN)42-的不稳定常数:
Kd==[Zn2+]2[CN-]4/ [Zn(CN)42-]=10-18*1 4(4次方)/0.01=1.0*10-161年前查看全部
- Zn与稀HNO3反应怎么配平?生成Zn(NO3)2和N2O,为什么系数比是4:不是锌升高二价,氮降低四价系数比是2:
 谈何20101年前2
谈何20101年前2 -
 pyxia 共回答了19个问题
pyxia 共回答了19个问题 |采纳率94.7%氮的确降低四价,但是仍有一部分氮元素是以硝酸根离子的形式存在,所以在配硝酸的系数时不仅要看化合价变化的部分,还要综合考虑元素守恒1年前查看全部
- 某工厂排出的废液中主要含有Zn(NO3)2和AgNO3,为了回收硝酸锌和金属银,设计了如下步骤.
某工厂排出的废液中主要含有Zn(NO3)2和AgNO3,为了回收硝酸锌和金属银,设计了如下步骤.
液(加入过量X,过滤)→固体A和滤液B
固体A(加入过量Y,过滤)→金属Ag和滤液C,滤液C加适量Ba(NO3)2溶液可变为滤液B
滤液B(操作Z)→硝酸锌固体
问:x和y分别是什么?A B C 的主要成分是什么
 妞崽1年前1
妞崽1年前1 -
 豆包4 共回答了15个问题
豆包4 共回答了15个问题 |采纳率93.3%X=Zn,Y=H2SO4;A:Ag B:Zn(NO3)2 C:ZnSO4、Zn(NO3)只有加入Zn才不会带入其他金属杂质,Zn+2AgNO3=Zn(NO3)2+2Ag↓因为要把Ba离子分离出去,滤液C中要有SO4离子,同时,Y还要把过量的固体Zn从金属Ag的固体中分离,...1年前查看全部
- 在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入0.1mol铁粉,充
在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入0.1mol铁粉,充分搅拌后,Fe溶解,溶液中不存在Fe3+离子,同时析出0.1molAg.下列结论错误的是( )
A.Fe3+的氧化性大于Cu2
B.1molFe可还原2molFe3+
C.反应后溶液中Cu2+与Fe2+物质的量比为1:2
D.氧化性:Zn2+>Cu2+>Fe3+>Ag+ heihei11231年前3
heihei11231年前3 -
 江郎才劲 共回答了19个问题
江郎才劲 共回答了19个问题 |采纳率94.7%错误的答案是D.
A:Fe3+的氧化性大于Cu2+.正确
B:将2molFe3+还原成还原2molFe2+需要2mol电子,这可由1molFe提供.正确
C:反应后溶液中Cu2+与Fe2+物质的量比为1:2.原来Cu和Fe比为1:1,又加入了0.1mol铁粉.正确
D:氧化性:Ag+>Fe3+>Cu2+>Zn2+,所以错误.1年前查看全部
- 化学与环境和人们的生活密切相关.某校化学兴趣小组从摄影店收集到一些废弃的定影液[主要成分为Zn(NO3)2和
化学与环境和人们的生活密切相关.某校化学兴趣小组从摄影店收集到一些废弃的定影液[主要成分为Zn(NO3)2和
AgNO3],并对定影液进行处理回收金属银和硝酸锌固体.设计实验步骤如下
定影液加过量X/操作1(分两个箭头)
(第一箭头)固体A(第二箭头)溶液B
固体+A适量Y/操作1(分两个箭头)
(第一箭头)金属银(第二箭头)溶液C+加适量的Ba(NO3)2=溶液B
溶液B(一个箭头)Zn(NO3)2
(1)操作1和2的名称分别是
(2)X为 ,Y为 .
(3)加入适量的Ba(NO3)2的目的是 . 批11年前1
批11年前1 -
 hfx28 共回答了20个问题
hfx28 共回答了20个问题 |采纳率90%操作一:过滤 操作二:过滤、蒸发(似乎有俩)
X:Zn Y:硫酸
目的:除去杂质硫酸锌
可能不对.自己做的,我学校的破高端1年前查看全部
- Zn(NO3)2 + NaOH 能反应吗,为什么,生成什么?
 sdfsdf2w0981年前1
sdfsdf2w0981年前1 -
 秋落无情 共回答了17个问题
秋落无情 共回答了17个问题 |采纳率94.1%能反应
因为反应后 有沉淀物Zn(OH)2生成
综合反应只要有水,沉淀物或气泡生成 都可以进行的1年前查看全部
- 向AgNO3 Mg(NO3)2 Zn(NO3)2的混合溶液中加入一定量的锌粉和铁粉的混合物,充分反应后过滤
向AgNO3 Mg(NO3)2 Zn(NO3)2的混合溶液中加入一定量的锌粉和铁粉的混合物,充分反应后过滤
得到滤渣A和滤液B,如果向滤液B中加入稀盐酸,无现象(溶液中无Ag+),则证明溶液B中一定含有的金属离子是—— dreamtrue491年前2
dreamtrue491年前2 -
 小小白 共回答了15个问题
小小白 共回答了15个问题 |采纳率100%溶液中一定含有Zn2+和Mg2+
原溶液中含有Ag+,Mg2+,Zn2+
加入锌粉铁粉混合物后得到的滤液B必然一定Mg2+,Zn2+,可能含有Ag+,Fe2+
滤液B中加入稀盐酸无现象,说明不含有Ag+,
所以B中一定含有Zn2+和Mg2+,可能含有Fe2+1年前查看全部
- 某化工厂排出的废液中含有AgNO3、Zn(NO3)2和Cu(NO3)2三种物质.请你设计方案回收金属银、铜和硝酸锌.注
 薄荷花茶1年前1
薄荷花茶1年前1 -
 luyufeng 共回答了25个问题
luyufeng 共回答了25个问题 |采纳率84%先加Cu后加Zn1年前查看全部
- 写出下列化学物质的名称FeCl3 ,Ag2S ,Na2SO4 ,K2CO3 ,Zn(NO3)2 ,CaSO4 ,FeSO
写出下列化学物质的名称
FeCl3 ,Ag2S ,Na2SO4 ,K2CO3 ,Zn(NO3)2 ,CaSO4 ,FeSO4 ,Ba(NO3)2,Al2S3 歌武升平1年前1
歌武升平1年前1 -
 seven12321 共回答了12个问题
seven12321 共回答了12个问题 |采纳率91.7%FeCl3 氯化铁,或者三氯化铁,Ag2S硫化银 ,Na2SO4硫酸钠 ,K2CO3碳酸钾 ,Zn(NO3)2硝酸锌 ,CaSO4硫酸钙 ,FeSO4硫酸亚铁 ,Ba(NO3)2硝酸钡,Al2S3硫化铝或者三硫化二铝.1年前查看全部
- 某工厂排出的废液中主要含有Zn(NO3)2和AgNO3,为了回收硝酸锌和金属银,设计了如下步骤.
某工厂排出的废液中主要含有Zn(NO3)2和AgNO3,为了回收硝酸锌和金属银,设计了如下步骤.
废液(加入过量X,过滤)→固体A和滤液B
固体A(加入过量Y,过滤)→金属Ag和滤液C,滤液C加适量Ba(NO3)2溶液可变为滤液B
滤液B(操作Z)→硝酸锌固体
XYABC各是什么?我总觉得多了一步,为什么固体A还要再加Y咧? 我爱蔓蔓1年前1
我爱蔓蔓1年前1 -
 散游 共回答了12个问题
散游 共回答了12个问题 |采纳率83.3%X是铁
B是硝酸锌溶液
C是硫酸亚铁
固体A还要再加Y是出去第一步中过量的铁,使得到的银是纯的1年前查看全部
- 制取硝酸锌为什么不能用金属置换反应制得硝酸锌?Zn + 2HNO3 == Zn(NO3)2 + H2 |
 标题教教主1年前2
标题教教主1年前2 -
 wzt0504 共回答了15个问题
wzt0504 共回答了15个问题 |采纳率86.7%其实可以但是
1一般不出氢气,你写的反应不对
2用浓酸的话太危险,稀酸有可能产生硝酸铵,引入杂质
3反应产生氮氧化物,污染太大
4可以先灼烧锌粉,得到氧化锌,再溶于硝酸1年前查看全部
- 在含有Cu(NO3)2,Zn(NO3)2,Fe(NO3)3,AgNO3各0.01mol的混合溶液中加入0.015mol铁
在含有Cu(NO3)2,Zn(NO3)2,Fe(NO3)3,AgNO3各0.01mol的混合溶液中加入0.015mol铁粉,经充分搅拌,产生的变化是( )
A.铁溶解,没有任何金属生成
B.铁溶解,析出银,且溶液中不再含有Fe3+
C.析出0.01molAg和0.01molCu
D.析出0.01molAg和0.005molCu tonyzgrw1年前4
tonyzgrw1年前4 -
 永远的阿木兰 共回答了27个问题
永远的阿木兰 共回答了27个问题 |采纳率88.9%氧化性Ag+>Fe3+>Cu2+,因此,可能发生的反应依此为:
2Ag+ + Fe = Fe2+ + 2Ag
2Fe3+ + Fe = 3Fe2+
Cu2+ + Fe = Fe2+ + Cu
根据反应计算可知,析出0.01molAg和0.005molCu,且Fe3+ 已完全反应
综上所述,选D1年前查看全部
- 锌与很稀的硝酸化学方程式的配平4Zn+ 10HNO3(稀)==== 4Zn(NO3)2 + NH4NO3 + 5H2O
锌与很稀的硝酸化学方程式的配平
4Zn+ 10HNO3(稀)==== 4Zn(NO3)2 + NH4NO3 + 5H2O 这个方程式 我自己配平不了 像这种比较复杂的方程式要怎样迅速地配平好 捏你迷迷1年前2
捏你迷迷1年前2 -
 SZ豆腐佬 共回答了21个问题
SZ豆腐佬 共回答了21个问题 |采纳率90.5%首先你写错哦,生成3个水!
这样就是有一部分化合价变化,一部分不变的,一般有产物这边配平,
1.首先标出化合价的升降
Zn+ HNO3(稀)==== Zn(NO3)2 + NH4NO3 + H2O
0 +5 +2 -3
升2 降8
2.配平化合价的升降,即电子转移个数
化学式 Zn+ HNO3(稀)==== 4 Zn(NO3)2 + 1 NH4NO3 + H2O
3.在由zn 和N配平产物
4Zn+10 HNO3(稀)==== 4 Zn(NO3)2 + 1 NH4NO3 + H2O
4.最后配平水
4Zn+ 10HNO3(稀)==== 4 Zn(NO3)2 + 1 NH4NO3 + 3 H2O
5. 省略硝酸铵前面的1
4Zn+ 10HNO3(稀)==== 4 Zn(NO3)2 + NH4NO3 + 3H2O1年前查看全部
大家在问
- 1微分方程2xydy-(x^2+2y^2)dx=0通解
- 2廖承志致蒋经国先生信全文英文翻译
- 3(5分之4)的2008次方*(-4分之5)的2009次方
- 41.一家服装店出售两种服装,一种新款每件48元,可以赚20%.另一种处理品赔本20%出售,每件售价也是48元.这两中服装
- 5做10节长3米,横截面直径20厘米的圆柱体落水管,需要多少平方米铁皮?
- 6小明在计算除法题时,把除数210错写成21,结果得到的商是150.正确的商是多少?
- 7北师大版七上数学数学王子高斯从小就善于观察和思考.在他读小学时就能在课堂上快速的计算出1+2+3+4+5+6……+98+
- 8下列关于艾滋病的说法,错误的是( )
- 9某居民生活用电基本价格为每度0.50元,若每月的用电量超过a度,则超出部分另加收基本电价的50%.
- 10乙醛被还原成乙醇
- 11Don’t disturb me. I_______ letters all morning and have writ
- 12英语翻译On my own ;I've travelled the road of life;Mom/mum I'm a
- 13英语翻译三月十号之前翻译好,救急.请翻译以下的内容:建新国际航空速递有限公司》.《上海中通快递有限公司》.《安溪分公司》
- 14一元二次方程:3(x+1)^2=2(x+1)
- 15—I 've got to have an ice-cream.要表达”我也要“时,可以说"So do I.

