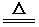
火法炼铜首先要焙烧黄铜矿,主要涉及以下反应:
 二十四桥依旧2022-10-04 11:39:541条回答
二十四桥依旧2022-10-04 11:39:541条回答①2CuFeS2+O2=Cu2S+2FeS+SO2
②Cu2S+O2=2Cu+SO2
下列说法正确的是( )
A.在反应①中:SO2既是氧化产物又是还原产物
B.在反应②中:Cu2S仅作还原剂,硫元素被氧化
C.在反应①中:每转移1.2 mol电子,有0.2 mol硫被氧化
D.在反应②中:每消耗1.0 molCu2S,有4.0 mol电子转移

已提交,审核后显示!提交回复
共1条回复
 回头是岸吗 共回答了19个问题
回头是岸吗 共回答了19个问题 |采纳率100%- 解题思路:A、标注元素化合价变化,依据氧化还原反应的概念分析判断,还原剂被氧化生成氧化产物,氧化剂被还原生成氧化产物;
B、标注化合价分析判断;
C、依据化学方程式和电子守恒、化合价变化计算判断;
D、依据化学方程式和电子守恒、化合价变化计算判断;A、2CuFeS2+O2=Cu2S+2FeS+SO2中,Cu元素由+2价降低为+1价,S元素由-2价升高到+4价,氧气中O元素由0降低为-2价,则SO2既是氧化产物又是还原产物,故A正确;
B、Cu2S+O2=2Cu+SO2,铜元素化合价从+1价降到0价,氧元素化合价从 0价降低到-2价,硫元素化合价从-2价升高到+4价,则在反应②中:Cu2S即作氧化剂又做还原剂,硫元素被氧化,故B错误;
C、2CuFeS2+O2=Cu2S+2FeS+SO2中,硫元素化合价从-2价升高到+4价,所以生成1molSO2转移电子为6mol,被氧化的硫元素为1mol,每转移1.2 mol电子,有0.2 mol硫被氧化,故C正确;
D、Cu2S+O2=2Cu+SO2,铜元素化合价从+1价降到0价,氧元素化合价从 0价降低到-2价,硫元素化合价从-2价升高到+4价,消耗1molCu2S,电子转移6mol,故D错误;
故选AC.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查了氧化还原反应的概念应用,电子守恒的判断,化合价的升降分析判断概念的应用,转移电子的计算方法. - 1年前
相关推荐
- (14分)Cu 2 S是火法炼铜一种重要的原料,下面是由Cu 2 S冶炼铜及制取CuSO 4 ·5H 2 O的流程图:
(14分)Cu 2 S是火法炼铜一种重要的原料,下面是由Cu 2 S冶炼铜及制取CuSO 4 ·5H 2 O的流程图:
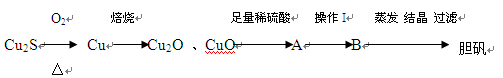
⑴Cu 2 S中铜元素的化合价为 ,火法炼铜的反应原理是 (用化学方程式表示)。
⑵Cu 2 O,CuO加入足量稀硫酸得到的体系A中看到溶液呈蓝色,且有红色物质生成,
请写出生成红色物质的离子方程式: 。
⑶若将A中单质反应,操作加入试剂最好是 。
A. 加入适量的NaNO 3 B. 适量的 HNO 3 C. 适量的H 2 O 2
⑷若B溶液的体积为0.2L,电解B溶液一段时间后溶液的pH值由2变为1(体积变化忽略不计),此时电解过程中转移电子数的物质的量是 。
⑸取5.0 g胆矾样品逐渐升高温度使其分解,分解过程的热重曲线如下图所示:通过计算确定258℃时发生反应的化学方程式 ,e点的化学式 (计算过程略去)。
 oo方草1年前1
oo方草1年前1 -
 jj不能没有ff 共回答了13个问题
jj不能没有ff 共回答了13个问题 |采纳率61.5%1年前查看全部
- 工业上以黄铜矿为原料,采用火法熔炼工艺生产粗钢。
工业上以黄铜矿为原料,采用火法熔炼工艺生产粗钢。
(1)该工艺的中间过程会发生反应:2Cu 2 O+Cu 2 S 6Cu+SO 2 ↑,反应的氧化剂是 。
6Cu+SO 2 ↑,反应的氧化剂是 。
(2)火法熔炼的粗铜含杂质较多。某化学研究性学习小组在实验室条件下用CuSO 4 溶液作电解液来实现粗铜的提纯,并对电解后溶液进行净化除杂和含量测定。
实验一 粗铜的提纯粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应),电解时粗铜应与电源的 极相连,阴极上的电极反应式为 。
实验二 电解后溶液的净化除杂在精炼铜的过程中,电解液中c(Cu 2+ )逐渐下降,c(Fe 2+ )、c(Zn 2+ )会逐渐增大,所以需定时除去其中的Fe 2+ 、Zn 2+ 。甲同学参考下表的数据,设计了如下方案:
试剂a是 (填化学式),其目的是 ;该方案能够除去的杂质离子是 (填离子符号)。
实验三 电解后溶液离子含量的测定
乙同学设计了如下方案: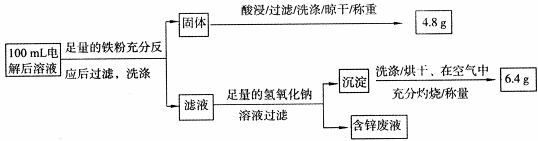
则100mL溶液中Cu 2+ 的浓度为 mol·L -1 ,Fe 2+ 的浓度为 mol·L -1 。 xyj2441年前1
xyj2441年前1 -
 宝宝蛇 共回答了15个问题
宝宝蛇 共回答了15个问题 |采纳率100%(14分)
(1)Cu 2 O 、Cu 2 S (2分);
(2)正(1分) Cu 2+ +2e - = Cu(2分) H 2 O 2 (2分)将Fe 2+ 氧化成Fe 3+ (2分) Fe 2+ (2分)
0.75(2分)0.05(2分)
1年前查看全部
- 火法炼铜Cu2S+O2=高温=2Cu+SO2氧化剂还原剂是什么
火法炼铜Cu2S+O2=高温=2Cu+SO2氧化剂还原剂是什么
Cu2S有升有降,o2降了,这怎么算氧化剂还原剂 defoeld1年前3
defoeld1年前3 -
 雨落无痕 共回答了13个问题
雨落无痕 共回答了13个问题 |采纳率84.6%火法炼铜Cu2S+O2=高温=2Cu+SO2
Cu2S中的Cu为+2价,反应到0价,↑2价,为还原剂
O2中的O为0价,反应到-2价,↓2价,为氧化剂
☆⌒_⌒☆ 希望可以帮到you~1年前查看全部
- 工业可采取火法炼铜Cu2S+O2=2Cu+SO2每生成2molcu,反应转移6mol电子还是4mol电子
 xlp5211年前1
xlp5211年前1 -
 城市年轮 共回答了12个问题
城市年轮 共回答了12个问题 |采纳率91.7%6mol电子1年前查看全部
- 5.3火法 如何丢燃烧和理解点燃求答案
 贺兰最爱T1年前1
贺兰最爱T1年前1 -
 hujielyz 共回答了23个问题
hujielyz 共回答了23个问题 |采纳率91.3%这需要看团队,火法需要考虑zs起手的颅骨战旗,还有橙色多彩,不是你想的只考虑自身buff就行了,在起手sx的情况下,巨魔法师可以让燃烧跳50跳,为了等乌苏雷叠层而放弃这橙色多彩的10sbuff和颅骨战旗的暴击伤害加成,虽然有法伤的加成,但比不上燃烧跳数和暴击伤害的损失1年前查看全部
- 黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一.工业上以黄铜矿为原料,采用火法熔炼工艺生产铜时发生如下反应:2C
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一.工业上以黄铜矿为原料,采用火法熔炼工艺生产铜时发生如下反应:2Cu2O+Cu2S
6Cu+SO2↑.高温 .
Ⅰ.反应产生的SO2是大气污染物,可用NaOH溶液吸收得到NaHSO3.常温下,0.1mol•L-1NaHSO3溶液的pH小于7,则溶液中c(H2SO3)______c(SO32-)(填“>”、“=”或“<”),原因是______.
Ⅱ.黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制.
(1)请完成下列粗铜电解得到精铜的原理:电解池中______作阴极.
(2)精炼铜产生的废液中含有Fe2+、Fe3+、Cu2+等金属阳离子.已知25℃时如下数据,请完成下列问题:
在25℃下,向浓度均为0.1mol•L-1的FeCl2和CuCl2混合溶液中逐滴加入氨水,先生成______沉淀(填化学式),生成该沉淀的离子方程式为______.物质 Fe(OH)2 Cu(OH)2 Fe(OH)3 Ksp 8.0×10-16 2.2×-20 4.0×10-38  幸福是种感觉1年前1
幸福是种感觉1年前1 -
 caodifeiqian 共回答了22个问题
caodifeiqian 共回答了22个问题 |采纳率100%解题思路:Ⅰ.常温下,0.1mol•L-1NaHSO3溶液的pH小于7,说明HSO3-电离程度大于水解程度;
Ⅱ.(1)精炼粗同时,粗铜为阳极,纯铜为阴极;
(2)溶度积越小,越先生成沉淀.Ⅰ.已知NaHSO3中的HSO3-既能电离又能水HSO3-⇌H++SO32-电离显酸性,HSO3-+H2O⇌H2SO3 +OH- 水解显碱性;常温下,0.1mol•L-1NaHSO3溶液的pH小于7,
说明电离大于水解,故:c(SO32-)>c(H2SO3),
故答案为:<;NaHSO3溶液中HSO3-电离程度大于水解程度;
Ⅱ.(1)精炼粗同时,粗铜为阳极,纯铜为阴极,故答案为:纯铜;
(2)Cu(OH)2因溶度积较小,则滴加氨水时首先生成Cu(OH)2沉淀,反应的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,
故答案为:Cu(OH)2;Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+.点评:
本题考点: 二氧化硫的污染及治理;难溶电解质的溶解平衡及沉淀转化的本质;铜金属及其重要化合物的主要性质.
考点点评: 本题考查较为综合,涉及二氧化硫的污染及治理、铜的精炼以及难溶电解质的溶解平衡问题,为高考常见题型,侧重于学生的分析能力的考查,注意相关基础知识的学习,难度不大.1年前查看全部
- 火法炼铜过程中发生下列反应:3Cu2S+3O2 高温 . 6Cu+3SO2.下
火法炼铜过程中发生下列反应:3Cu2S+3O2
6Cu+3SO2.下列说法不正确的是( )高温 .
A.Cu2S只做还原剂
B.氧化剂与还原剂的物质的量之比为2:1
C.1 mol Cu2S和O2反应生成2 molCu,转移电子的物质的量为6mol
D.反应消耗3 mol Cu2S时,被O2氧化的硫(S)的物质的量为2 mol juttiez1年前1
juttiez1年前1 -
 xiao13_3 共回答了15个问题
xiao13_3 共回答了15个问题 |采纳率93.3%解题思路:反应3Cu2S+3O2
6Cu+3SO2中,S元素化合价升高,被氧化,Cu元素化合价降低,被还原Cu2S既为氧化剂又还原剂,O元素化合价降低,被还原,O2为氧化剂,结合化合价的变化解答该题.高温 .A.S元素化合价升高,被氧化,Cu元素化合价降低,被还原,则Cu2S既为氧化剂又还原剂,故A错误;B.反应中6mol+1价铜可氧化1mol-2价硫,则3molCu2S参加反应,有1mol-2价硫自身发生氧化还原反应被氧化,则氧化剂和还原...
点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,注意从化合价的角度认识,难度不大.1年前查看全部
- 火法炼铜过程中发生下列反应:3Cu 2 S+3O 2 =6Cu +3SO 2 , 下列说法不正确的是 [
火法炼铜过程中发生下列反应:3Cu 2 S+3O 2 =6Cu +3SO 2 , 下列说法不正确的是 [ ]A.Cu 2 S只做还原剂
B.氧化剂和还原剂的物质的量之比为2:1
C.1 mol Cu 2 S和O 2 反应生成2 mol Cu转移的电子数为6mol
D.反应消耗3 mol Cu 2 S时,被O 2 氧化的硫(s)的物质的量为2 mol jizhuhanyie1年前1
jizhuhanyie1年前1 -
 Ilovett 共回答了20个问题
Ilovett 共回答了20个问题 |采纳率70%A1年前查看全部
- 火法炼铜得到的粗铜中含多种杂质(如锌、金、银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯。在电
火法炼铜得到的粗铜中含多种杂质(如锌、金、银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯。在电解精炼时 [ ]
A.粗铜接电源负极
B.杂质都将以单质形式沉积到池底
C.粗铜作阴极
D.纯铜片增重2.56 g,电路通过电子为0.08 mol RLBLOVE1年前1
RLBLOVE1年前1 -
 haier036 共回答了25个问题
haier036 共回答了25个问题 |采纳率96%D1年前查看全部
- (16分). 铜是人类最早知道的金属之一,实验室可用C、H 2 还原CuO制取少量的Cu,工业上主要用火法从黄铜矿中提炼
(16分). 铜是人类最早知道的金属之一,实验室可用C、H 2 还原CuO制取少量的Cu,工业上主要用火法从黄铜矿中提炼Cu。
Ⅰ. 实验证明,C还原CuO时既可能生成Cu,也可能生成Cu 2 O,即使在C过量时,实验中CuO也可能部分未被还原。为了测定某次实验产物的组成,取1.2 g C跟8.0 g CuO混合加热,将反应生成的气体通过足量的澄清石灰水并集气。一段时间后停止加热,共收集到560 mL气体(已经折算成标准状况),测得沉淀的质量为2.5 g。则:
(1)上述实验中C (填“完全”或“不完全”)参加反应,实验中收集到的气
体是 (填写化学式),产生这种气体的化学方程式为: 。
(2)反应后得到的固体混合物总质量为 ,其中含氧化合物的物质的量为 mol。
Ⅱ. 黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8∶7;将 m g X粉末全部溶于200 mL的浓HNO 3 ,反应后的溶液加水稀释至 2.12 L时测得其pH为0;将稀释后的溶液分为两等份,向其中一份溶液中滴加6.05mol/L的NaOH溶液,向另一份溶液中滴加0.600mol/L Ba(NO 3 ) 2 溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶液的体积变化如下图所示:
(1) 请通过计算确定 m 的值;
(2) X的摩尔质量为368 g/mol,请确定X的化学式。 lxh_丢丢1年前1
lxh_丢丢1年前1 -
 七月花吼 共回答了19个问题
七月花吼 共回答了19个问题 |采纳率78.9%Ⅰ⑴不完全(1分);CO(1分);CO 2 +C 高温 2CO 或 CuO+C 高温 Cu+CO↑ (1分);
⑵ 7.4g,(1分); 0.025 mol(1分)
Ⅱ、⑴ 依题意, m g X中: n (Cu)∶ n (Fe)=1∶1
2 n (Cu 2 + ) +3 n (Fe 3 + ) =6.05mol·L - 1 ×0.2L×2-1 mol·L - 1 ×2.12L
故: n (Cu) = n (Fe) = 0.06mol
又, n (S) = 0.6mol·L - 1 ×0.1L×2 = 0.12mol
因此, m g = m (Cu) + m (Fe) + m (S)
= 0.06mol×64g·mol - 1 +0.06mol×56g·mol - 1 +0.12mol×32g·mol - 1 = 11.04g
即 m 的值为11.04(3分)
⑵ 设X的化学式为(CuFeS 2 ) n ,则
(64+56+32×2)×n = 368 n = 2故X的化学式为Cu 2 Fe 2 S 4 (3分)
Ⅰ(1)560ml气体是CO,物质的量是0.025mol。生成CO的方程式是CO 2 +C 高温 2CO 或 CuO+C 高温 Cu+CO↑。沉淀是碳酸钙,物质的量是0.025mol,则生成的CO 2 也是0.025mol。由于碳的物质的量是0.1mol,所以实验中碳没有完全参加反应。
(2)与碳原子结合的氧原子的物质的量是0.025mol+0.025mol×2=0.075mol,质量是12.g,所以最终固体的质量是8g-1.2g+1.2g-0.6g=7.4g。原氧化铜中氧原子的物质的量是0.1mol,所以剩余氧原子的物质的量是0.1mol-0.075mol=0.025mol,因此含氧化合物的物质的量是0.025mol。
Ⅱ、考查根据方程式及有关图像进行的有关计算。1年前查看全部
- .火法炼铜得到的粗铜中含多种杂质(如锌、金、银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯.在
.火法炼铜得到的粗铜中含多种杂质(如锌、金、银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯.在电解精炼时.
A.精炼粗铜接电源负极 B.精炼时纯铜做阴极
C.杂质都将以单质形式沉淀到池底 D.纯铜片增重2.56 g,电路通过电子为0.08mol
 gjdong041年前2
gjdong041年前2 -
 侯禀鹊 共回答了13个问题
侯禀鹊 共回答了13个问题 |采纳率92.3%选B
精炼时阳极是被氧化的,阴极是还原的,所以要把粗铜接在电源正极上,纯铜接在负极上这样从溶液中Cu2+才会析出在纯铜上达到精炼的目的。
C答案不对因为粗铜中比铜活泼的金属先放电成离子,如锌会在溶液中,但是在阴极还原时铜要在锌前面。
D答案不对因为还有锌这类的活泼金属会被氧化在溶液中,所以通过的电子要大于0.08mol。
这些希望对你有些帮助。有什么问题还可补充。...1年前查看全部
- 如图所示火法炼铜首先要焙烧黄铜矿……
如图所示火法炼铜首先要焙烧黄铜矿……

第三题,. 霉酸1年前3
霉酸1年前3 -
 东方狮 共回答了19个问题
东方狮 共回答了19个问题 |采纳率78.9%1年前查看全部
- 工业可采取火法炼铜Cu2S+O2=2Cu+SO2每生成2molcu,反应转移6mol电子为何是6MOL,怎能的
 zhizi_li1年前1
zhizi_li1年前1 -
 xy_jy 共回答了16个问题
xy_jy 共回答了16个问题 |采纳率93.8%我们分析一下化合价变化
在这个反应中硫化亚铜中亚铜离子+1变为两份的0价铜单质 得2mol电子
氧气从零价变为-2价两份氧原子 得4mol电子
硫化亚铜中的硫从-2价 变为二氧化硫中的+4加 失去6mol电子
转移6mol电子1年前查看全部
- 火法炼铜技术原理及工作总结急求1000字左右 的总结,
 又見xx1年前1
又見xx1年前1 -
 mol_hcy 共回答了16个问题
mol_hcy 共回答了16个问题 |采纳率100%主要写一下主要的工作内容,取得的成绩,以及不足,最后提出合理化的建议或者新的努力方向.工作总结就是让上级知道你有什么贡献,体现你的工作价值所在.所以应该写好几点:
1、你对岗位和工作上的认识2、具体你做了什么事3、你如何用心工作,哪些事情是你动脑子去解决的.就算没什么,也要写一些有难度的问题,你如何通过努力解决了
4、以后工作中你还需提高哪些能力或充实哪些知识
5、上级喜欢主动工作的人.你分内的事情都要有所准备,即事前准备工作以下供你参考:
总结,就是把一个时间段的情况进行一次全面系统的总评价、总分析,分析成绩、不足、经验等.总结是应用写作的一种,是对已经做过的工作进行理性的思考.
总结的基本要求
1.总结必须有情况的概述和叙述,有的比较简单,有的比较详细.
2.成绩和缺点.这是总结的主要内容.总结的目的就是要肯定成绩,找出缺点.成绩有哪些,有多大,表现在哪些方面,是怎样取得的;缺点有多少,表现在哪些方面,是怎样产生的,都应写清楚.
3.经验和教训.为了便于今后工作,必须对以前的工作经验和教训进行分析、研究、概括,并形成理论知识.
总结的注意事项:
1.一定要实事求是,成绩基本不夸大,缺点基本不缩小.这是分析、得出教训的基础.
2.条理要清楚.语句通顺,容易理解.
3.要详略适宜.有重要的,有次要的,写作时要突出重点.总结中的问题要有主次、详略之分.
总结的基本格式:
1、标题
2、正文
开头:概述情况,总体评价;提纲挈领,总括全文.
主体:分析成绩缺憾,总结经验教训.
结尾:分析问题,明确方向.
3、落款
署名与日期1年前查看全部
- 当森林出现大火时,消防人员是如何用以火攻火法来控制火情
 赤扬1年前1
赤扬1年前1 -
 美眉雪儿 共回答了18个问题
美眉雪儿 共回答了18个问题 |采纳率83.3%其实以火攻火就是制造隔离带的方法来灭火
以火攻火的条件很苛刻 风向 风力 都制约着这种灭火方法
以火攻火 在风向和蔓延方向相反时 在有一定的隔离带保障.点燃森林 引导火势朝火场燃烧 在森林火灾中这样的案例不少
但更多的是砍伐出隔离带 隔离带的森林燃烧玩了也就灭了
森林有专属的消防队 入还有疑问可以吧问题补充的详细些1年前查看全部
- 黄铜矿(CuFeS 2 )是制取铜及其化合物的主要原料之一.工业上以黄铜矿为原料,采用火法熔炼工艺生产铜时发生如下反应:
黄铜矿(CuFeS 2 )是制取铜及其化合物的主要原料之一.工业上以黄铜矿为原料,采用火法熔炼工艺生产铜时发生如下反应:2Cu 2 O+Cu 2 S
6Cu+SO 2 ↑.高温 .
Ⅰ.反应产生的SO 2 是大气污染物,可用NaOH溶液吸收得到NaHSO 3 .常温下,0.1mol•L -1 NaHSO 3 溶液的pH小于7,则溶液中c(H 2 SO 3 )______c(SO 3 2- )(填“>”、“=”或“<”),原因是______.
Ⅱ.黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制.
(1)请完成下列粗铜电解得到精铜的原理:电解池中______作阴极.
(2)精炼铜产生的废液中含有Fe 2+ 、Fe 3+ 、Cu 2+ 等金属阳离子.已知25℃时如下数据,请完成下列问题:
在25℃下,向浓度均为0.1mol•L -1 的FeCl 2 和CuCl 2 混合溶液中逐滴加入氨水,先生成______沉淀(填化学式),生成该沉淀的离子方程式为______.物质 Fe(OH) 2 Cu(OH) 2 Fe(OH) 3 Ksp 8.0×10 -16 2.2× -20 4.0×10 -38  里应外合21年前1
里应外合21年前1 -
 风雨相随哦 共回答了18个问题
风雨相随哦 共回答了18个问题 |采纳率94.4%Ⅰ.已知NaHSO 3 中的HSO 3 - 既能电离又能水HSO 3 - ⇌H + +SO 3 2- 电离显酸性,HSO 3 - +H 2 O⇌H 2 SO 3 +OH - 水解显碱性;常温下,0.1mol•L -1 NaHSO 3 溶液的pH小于7,
说明电离大于水解,故:c(SO 3 2- )>c(H 2 SO 3 ),
故答案为:<;NaHSO 3 溶液中HSO 3 - 电离程度大于水解程度;
Ⅱ.(1)精炼粗同时,粗铜为阳极,纯铜为阴极,故答案为:纯铜;
(2)Cu(OH) 2 因溶度积较小,则滴加氨水时首先生成Cu(OH) 2 沉淀,反应的离子方程式为Cu 2+ +2NH 3 •H 2 O=Cu(OH) 2 ↓+2NH 4 + ,
故答案为:Cu(OH) 2 ;Cu 2+ +2NH 3 •H 2 O=Cu(OH) 2 ↓+2NH 4 + .1年前查看全部
- 国服马上要开ICC了.请问火法输出中 还有火法需要抢点燃又是什么意思
 随喜9881年前1
随喜9881年前1 -
 易篇文章 共回答了16个问题
易篇文章 共回答了16个问题 |采纳率81.3%火法输出的点燃 也就是 火法第二层的点燃天赋 点燃天赋实在你的火焰法术暴击之后(包括霜火箭) 受到火焰法术暴击的目标承受额外的 40%伤害 火法抢点燃这个问题在60年代NAXX的时候是很流行的 其原因就是 BOSS身上只能有1个点燃DEBUFF效果 如果有两个火法 打出暴击的情况下 第一个的点燃 会被第二个的暴击所吃掉 变成第二个法师的伤害 如果第一个再暴击了的话 就又成第一个人的了 这就是抢点燃 但是70年代的时候这个效果已经不存在了 也就是两个火法的暴击点燃能同时持续在怪物身上 怪物的点燃DEBUFF不是唯一的了 所以 ICC中 不需要考虑 !点燃这个问题 这个问题是不会出现的 希望对你有所帮助1年前查看全部
- 火法炼铜的原理是利用碳还原氧化铜,化学方程式为C+2CuO高温2Cu+CO2↑.对该反应的下列分析中,错误的是
火法炼铜的原理是利用碳还原氧化铜,化学方程式为C+2CuO高温2Cu+CO2↑.对该反应的下列分析中,错误的是
A反应需在高温的条件下进行
B体现C的还原性
C CuO发生了氧化反应
D反应中,元素化合价都发生改变
(多选题,可选一个或两个选项) layol1年前4
layol1年前4 -
 joceci 共回答了14个问题
joceci 共回答了14个问题 |采纳率85.7%A B 正确
C CuO生成Cu,Cu的化合价降低,发生了还原反应.
D O的化合价不变,都是-2
选CD1年前查看全部
- (2014•陕西三模)火法炼铜首先要焙烧黄铜矿,反应为:2CuFeS2+O2→Cu2S+2FeS+SO2则下列说法正确的
(2014•陕西三模)火法炼铜首先要焙烧黄铜矿,反应为:2CuFeS2+O2→Cu2S+2FeS+SO2则下列说法正确的是( )
A.CuFeS2仅作还原剂,硫元素被氧化
B.每生成1mol Cu2S,有4 mol硫被氧化
C.SO2只是氧化产物,FeS只是还原产物
D.每转移1.2 mol电子,有0.2 mol硫被氧化 mingmei351年前1
mingmei351年前1 -
 qq海角1234 共回答了18个问题
qq海角1234 共回答了18个问题 |采纳率100%解题思路:反应2CuFeS2+O2=Cu2S+2FeS+SO2中,Cu元素由+2价降低为+1价,S元素由-2价升高到+4价,氧气中O元素由0降低为-2价,以此解答该题.A.Cu元素由+2价降低为+1价,S元素由-2价升高到+4价,CuFeS2既是氧化剂又是还原剂,故A错误;
B.由方程式可知,每生成1mol Cu2S,有1mol硫被氧化生成SO2,其它物质中的S元素化合价没有发生变化,故B错误;
C.生成FeS,元素化合价没有变化,FeS不是还原产物,也不是氧化产物,故C错误;
D.元素化合价升高的只有S元素,由-2价升高到+4价,变化6价,则每转移1.2mol电子,有0.2mol硫被氧化,故D正确.
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力和计算能力的考查,注意元素化合价的判断,为解答该题的关键,从元素化合价的角度解答该类题目,难度不大.1年前查看全部
- (2013•河南模拟)火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2→Cu2S+2FeS+SO2下列说法正确的
(2013•河南模拟)火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2→Cu2S+2FeS+SO2下列说法正确的是( )
A.SO2既是氧化产物又是还原产物
B.CuFeS2仅作还原剂,硫元素被氧化
C.每生成1 molCu2S,有4mol硫被氧化
D.每转移1.2 mol电子,有0.1 mol硫被氧化 eleven-l1年前1
eleven-l1年前1 -
 雪河之子 共回答了24个问题
雪河之子 共回答了24个问题 |采纳率75%解题思路:2CuFeS2+O2→Cu2S+2FeS+SO2中,Cu元素的化合价由+2价降低为+1价,O元素的化合价由0降低为-2价,S元素的化合价由-2价升高为+4价,以此来解答.A.O元素的化合价由0降低为-2价,S元素的化合价由-2价升高为+4价,则SO2既是氧化产物又是还原产物,故A正确;
B.Cu元素的化合价降低,S元素的化合价升高,则CuFeS2既作还原剂又作还原剂,S元素被氧化,故B错误;
C.由反应可知,生成1 molCu2S,有1mol硫被氧化,故C错误;
D.由反应可知,1molS被氧化转移6mol电子,则每转移1.2 mol电子,有0.2mol硫被氧化,故D错误;
故选A.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考常见题型,注意把握元素的化合价及反应中的变化为解答的关键,侧重基本概念的考查,题目难度不大.1年前查看全部
- 火法炼铜的氧化剂是什么都分别是氧化剂和还原剂
 快乐男孩781年前2
快乐男孩781年前2 -
 neogao 共回答了22个问题
neogao 共回答了22个问题 |采纳率95.5%火法炼铜是用Cu2S和氧气,反映得到Cu和SO2
氧气是氧化剂这不用多说.铜原来是+1价,降到0价,也是氧化剂.
Cu2S既是氧化剂也是还原剂,氧气是氧化剂1年前查看全部
- 火法炼铜和湿法炼铜分别指什么
 meet20021年前1
meet20021年前1 -
 zhongchengsa 共回答了26个问题
zhongchengsa 共回答了26个问题 |采纳率84.6%火法炼铜是利用还原性物质如一氧化碳在高温下还原氧化铜,湿法炼铜是用铁放入硫酸铜溶液炼得铜1年前查看全部
- 火法炼铜过程中发生如下反应:Cu2S+O2=2Cu+SO2.若已知反应消耗3mol Cu2S,则被O2氧化的硫(S)的物
火法炼铜过程中发生如下反应:Cu2S+O2=2Cu+SO2.若已知反应消耗3mol Cu2S,则被O2氧化的硫(S)的物质的量为多少?
S不是由-2价变成了+4价么,那1mol S转移的电子数不是6mol 么..被O2氧化的怎么算啊? 闲雅居1年前6
闲雅居1年前6 -
 卡妙ACMUS 共回答了21个问题
卡妙ACMUS 共回答了21个问题 |采纳率95.2%这里Cu2S 中 cu为正一价 反应后 变成了 cu 0价
根据方程式 来看 氧化剂有 氧气和cu+1 而 还原剂就只有s2- 所以3摩尔s2- ====== s+4 共转移了18mol 电子 还有6mol cu+1得到了 6mol 电子 可以算得 那么还有18-6=12mol的电子 是被氧气得到的 那么 被氧气氧化的硫(s)就是12/6=2mol了1年前查看全部
- 火法炼铜和湿法炼铜的优缺点Cu2S+O2==2Cu+So2 这是火法的 反应条件是高温Fe+CuSO4==FeSO4+C
火法炼铜和湿法炼铜的优缺点
Cu2S+O2==2Cu+So2 这是火法的 反应条件是高温
Fe+CuSO4==FeSO4+Cu 这是湿法的 没有反应条件
它们的优缺点是什么?
你们两个...结论都相反的...... yuanliju1年前2
yuanliju1年前2 -
 西安流浪猫 共回答了16个问题
西安流浪猫 共回答了16个问题 |采纳率81.3%火法炼铜排出来的二氧化硫污染空气,并且能耗太大,并且容易使Cu和氧气反应生成氧化铜.湿法炼铜反应条件简单,但是Fe比Cu活泼,大自然中不存在单质铁,因此获得铁也是件麻烦的事,综合起来能耗比火法要大些1年前查看全部
- (2011•临川区模拟)现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题
(2011•临川区模拟)现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题.
(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选.焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来.主要反应为:
2ZnS+3O2
2ZnO+2SO2; 鼓风炉中:2C+O2高温 .
2COZnO+CO△ .
Zn+CO2△ .
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下.实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如图1;硫酸溶液的体积与固体的体积比如图2
①当酸度为196时,其物质的量浓度为______.
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:______,______.
(2)湿法炼锌的主要工艺流程为:
①从保护环境和充分利用原料角度,如何处理或利用烟气______.
②除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式______.
③酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式______. 菩菩妹妹1年前1
菩菩妹妹1年前1 -
 myonlystefanie 共回答了13个问题
myonlystefanie 共回答了13个问题 |采纳率84.6%解题思路:(1)①根据酸度的定义计算,酸度为196时,说明1L溶液中硫酸的质量为196g,即硫酸为2mol,故浓度为2mol/L;
②根据图象可以看出,当酸度为180或液固比为6:1时,浸出率变化不大;
(2)①闪锌矿主要含ZnS,在焙烧时生成二氧化硫气体,可用于生产硫酸;
②H2O2具有氧化性,在酸性条件下将具有还原性的Fe2+离子氧化成Fe3+离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
③Zn(OH)2和氢氧化铝一样也具有两性,既可与酸反应生成盐和水,又能和碱反应生成盐和水,可根据氢氧化铝的反应来书写.(1)①酸度为196时,说明1L溶液中硫酸的质量为196g,硫酸的物质的量为[196g/98g/mol]=2mol,浓度为2mol/L,故答案为:2mol•L-1;
②由图象可以看出,当酸度为180或液固比为6:1时,浸出率变化不大,从节约原料和浸出率考虑,适宜的酸度和液固比分别为:180; 6:1,故答案为:180; 6:1;
(2)①闪锌矿主要含ZnS,在焙烧时生成二氧化硫气体,如随意排放会污染环境,可用于生产硫酸,故答案为:将烟道气净化,用于生产硫酸等;
②H2O2具有氧化性,在酸性条件下将具有还原性的Fe2+离子氧化成Fe3+离子,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
③根据Zn(OH)2和氢氧化铝一样也具有两性,既可与酸反应生成盐和水,又能和碱反应生成盐和水,酸浸出液还含有Cd2+,为了防止镉污染并回收镉,可加过量的碱溶液,反应分别为:Cd2++2OH-=Cd(OH)2↓;Zn2++4OH-=ZnO22-+2H2O[或Zn2++4OH-=Zn(OH)42-].
故答案为:Cd2++2OH-=Cd(OH)2↓;Zn2++4OH-=ZnO22-+2H2O[或Zn2++4OH-=Zn(OH)42-]点评:
本题考点: 金属冶炼的一般原理;化学平衡的调控作用;常见金属元素的单质及其化合物的综合应用.
考点点评: 本题以信息题目的形式考查金属冶炼的一般原理,做题时注意题中给予的关键信息,如闪锌矿的组成,酸度等问题,本题较为综合,具有一定难度.1年前查看全部
大家在问
- 110元和5元的人民币共有405元,10元的张数是5元的张数的4倍,那么两种面值的人民币各有多少张?
- 2环境中影响生物的什么和什么的因素叫做生态因素
- 3娥还,复为曼声长歌怎么翻译
- 4如果我们一旦分离,即使天涯海角,不论晨暮 我都会一样思念你,爱着你 如何翻译
- 5境界的彼方第五集说的“我想吃苹果糖”什么意思呀
- 6初一课文走一步,再走一步的研讨练习答案请说出来
- 7文文同学收集了一些家庭装修时废弃的大理石碎片,并设计了如下图的装置来制取二氧化碳(该装置能随时控制反应的发生)。请回答问
- 8为什么提出吉布斯自由能的概念?
- 9Jill will be free this Saturday .改为一般疑问句
- 10一个“∠”型导轨垂直于磁场固定在磁感应强度为B的匀强磁场中,a是与导轨材料相同、粗细相同的导体棒,导体棒与导轨接触良好。
- 11英语翻译佛山市南海区财汇大厦物业管理有限公司地址:中国广东省佛山市南海区桂城南海大道北51号
- 12有一张长2分米、宽1.5分米的长方形彩纸,将它裁成底和高都是5厘米的三角形小旗,可以裁多少面?如果裁成底和高都是4厘米的
- 13已知△ABC的三个内角A,B,C所对的边分别为a,b,c,a=2,A=45°,B=75°则边c=33.
- 14对于鲲鹏列子等形象,作者是否认为其达到了逍遥游的境界?
- 15参考答案上写c,但我觉得b也对,作业帮的亲们,是选什么呢?