I、NaOH、FeCl 3 是中学化学实验室常用的试剂。
 阿罡2022-10-04 11:39:541条回答
阿罡2022-10-04 11:39:541条回答| I、NaOH、FeCl 3 是中学化学实验室常用的试剂。 (1)在一定条件下能与NaOH溶液反应的固体单质有________和________(举两例)。 配制一定物质的量浓度的NaOH溶液时,造成实验结果偏低的原因是________。
______________________________________________. Ⅱ丙烷在燃烧时能放如大量的热,它也是液化石油气的主要成分,作为能源应用于人们 的日常生产和生活。 已知: 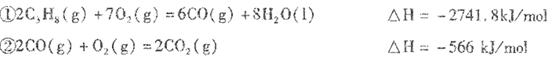 (1)反应  (2)依据(1)中的反应可以设计一种新型燃料电池,一极通人空气,另一极通入丙烷气体:燃料电池内部是熔融的掺杂着氧化钇(Y 2 O 3 )的氧化锆(ZrO 2 )晶体,在其内部可以传导O 2 - 。在电池内部O 2 - 移向_________极(填“正”或“负”);电池的负极反应为_____________________________. (3)用上述燃料电池用惰性电极电解足量Mg(NO 3 ) 2 和NaCl的混合溶液。电解开始后阴极的现象为_______________________________________________。 |

已提交,审核后显示!提交回复
共1条回复
 roger098 共回答了23个问题
roger098 共回答了23个问题 |采纳率91.3%- Ⅰ(1)铝、硅(硫) B
(2)2 Fe 3+ +Cu="=2" Fe 2+ + Cu 2+
3ClO - +2 Fe 3+ +10OH - ="2" FeO 4 2- +3Cl - +5H 2 O
Ⅱ(1)-2219.2KJ/mol
(2)负 C 3 H 8 +10O 2- —20e - =3CO 2 +4H 2 O
(3)有大量无色气泡产生,并且有白色沉淀产生。
- 1年前
相关推荐
- 三氯化铁是中学化学实验室中常用的化学试剂.同学们利用废铁屑(含少量铜杂质)来探究制备FeCl3•6H2O的方法,同学甲设
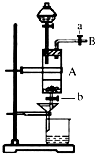 三氯化铁是中学化学实验室中常用的化学试剂.同学们利用废铁屑(含少量铜杂质)来探究制备FeCl3•6H2O的方法,同学甲设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,用分液漏斗向A中加过量的盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3•6H2O晶体.
三氯化铁是中学化学实验室中常用的化学试剂.同学们利用废铁屑(含少量铜杂质)来探究制备FeCl3•6H2O的方法,同学甲设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,用分液漏斗向A中加过量的盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3•6H2O晶体.
填写下列空白:
(1)滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是______.
(2)烧杯内放过量稀HNO3的原因是______(用离子方程式表示).
(3)整个实验过程中,弹簧夹a都必须打开,除为排出产生的气体外,另一个目的是______.
(4)乙同学对该实验进行了改进,他是用空烧杯承接滤液,加入适当的试剂,然后在HCl的气流中、一定温度下蒸发、浓缩、降温结晶而得到纯净的FeCl3•6H2O,你认为加入的最佳试剂是______.(填序号)
A.酸性高锰酸钾溶液B.适量过氧化氢和稀盐酸C.氢氧化钠溶液
在HCl的气流中、一定温度下蒸发、浓缩、降温结晶的理由是______. jjouw1年前1
jjouw1年前1 -
 gudu07 共回答了23个问题
gudu07 共回答了23个问题 |采纳率82.6%解题思路:(1)形成原电池使反应速率加快;
(2)稀HNO3有强氧化性,使Fe2+ 全部氧化成Fe3+;
(3)使分液漏斗中的酸可滴入A中;
(4)把氯化亚铁氧化为氯化铁,同时不能引入杂质;氯化铁属于强酸弱碱盐易水解.(1)废铁屑(含少量铜杂质)加盐酸后,Cu与铁形成Fe-Cu原电池使反应速率加快,
故答案为:废铁屑中的不溶性杂质与Fe在盐酸中构成原电池,加快了反应速率;
(2)过量的稀HNO3保证使Fe2+ 全部氧化成Fe3+;反应的离子方程式是3Fe2++4H++NO3-═3Fe3++NO↑+2H2O,
故答案为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O;
(3)整个实验过程中,弹簧夹a都必须打开,则装置与大气相同,使分液漏斗中的酸可滴入A中,
故答案为:使装置内部与外界大气相通,便于A中液体流下;
(4)把氯化亚铁氧化为氯化铁,同时不能引入杂质,所以选用适量过氧化氢和稀盐酸;
氯化铁属于强酸弱碱盐易水解,加热促进水解,所以要在HCl的气流中蒸发、浓缩、降温结晶,抑制氯化铁水解,防止生成氢氧化铁;
故答案为:B;抑制氯化铁水解,防止生成氢氧化铁.点评:
本题考点: 实验装置综合.
考点点评: 本题考查了FeCl3•6H2O晶体的制备实验,侧重于考查学生的实验探究能力,注意把握铁的化合物的性质,题目难度中等.1年前查看全部
- (2008•东莞一模)三氯化铁是中学化学实验室中必不可少的重要试剂.某兴趣小组利用废铁屑(含少量铜等不与盐酸反应的杂质)
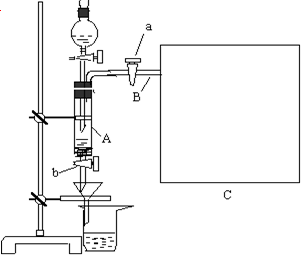 (2008•东莞一模)三氯化铁是中学化学实验室中必不可少的重要试剂.某兴趣小组利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备 FeCl3•6H2O,该同学设计的实验装置如图所示,A中放有m克废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,此时溶液呈浅绿色,再打开b 进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3•6H2O晶体.
(2008•东莞一模)三氯化铁是中学化学实验室中必不可少的重要试剂.某兴趣小组利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备 FeCl3•6H2O,该同学设计的实验装置如图所示,A中放有m克废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,此时溶液呈浅绿色,再打开b 进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3•6H2O晶体.
填写下列空白:
(1)如何检查装置A的气密性:______.
(2)滴加盐酸时,发现反应速率较之同浓度盐酸与纯铁粉反应要快,其原因是______.
(3)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3•6H2O晶体,而不用直接蒸发结晶的方法来制得晶体的理由______.
(4)用该法制得的晶体中往往混有Fe (NO3)3,为了制得较纯净的FeCl3•6H2O,可将烧杯内的稀硝酸换成______.
(5)若要测废铁屑的纯度,可测出从B中放出气体的体积V (已折算成标准状况,单位:L),则废铁屑的纯度为:[56V/22.4m×100% 双面面胶1年前0
双面面胶1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 实验是化学研究的重要手段,贯穿于化学学习的始终.试回答下列中学化学实验室中常见仪器的有关问题:
实验是化学研究的重要手段,贯穿于化学学习的始终.试回答下列中学化学实验室中常见仪器的有关问题:
(1)在仪器①分液漏斗②试剂瓶③集气瓶④滴定管⑤容量瓶⑥量筒⑦托盘天平中,标有“0“刻度的是(填序号,下同)______;标有使用温度的仪器是______.
(2)“磨砂“是增加玻璃仪器密封性的一种处理工艺.在仪器①试管②分液漏斗 ③细口试剂瓶④广口试剂瓶⑤集气瓶⑥酸式滴定管⑦碱式滴定管中,用到“磨砂“的有______.
(3)在仪器①漏斗②容量瓶③蒸馏烧瓶④分液漏斗⑤烧杯⑥蒸发皿 中,可用于粗盐提纯实验的有______;可用于分离两种沸点接近且互不相溶的液态混合物 (即分液)实验的有______. waveebye1年前1
waveebye1年前1 -
 郑砚zy 共回答了26个问题
郑砚zy 共回答了26个问题 |采纳率84.6%解题思路:(1)根据标有“0”刻度的仪器有:滴定管、托盘天平、温度计等;根据标有使用温度的仪器有:滴定管、容量瓶、量筒、烧杯等;
(2)用到“磨砂”工艺处理的玻璃仪器有:分液漏斗、细口瓶、广口瓶、滴瓶、集气瓶、酸式滴定管等;
(3)根据粗盐提纯的步骤是溶解、过滤、蒸发、结晶,由步骤可推测用的仪器有:烧杯、带铁圈的铁架台、滤纸、玻璃棒和漏斗;根据分液所需要的仪器有:带铁圈的铁架台、分液漏斗、烧杯.(1)标有“0”刻度的仪器有:滴定管、托盘天平、温度计等;标有使用温度的仪器有:滴定管、容量瓶、量筒、烧杯等;
故答案为:④⑦;④⑤⑥;
(2)凡是玻璃相互接处,不能漏水漏气的要磨砂处理,用到“磨砂”工艺处理的玻璃仪器有:分液漏斗、细口瓶、广口瓶、滴瓶、集气瓶、酸式滴定管等;
故答案为:②③④⑤⑥;
(3)粗盐提纯用的仪器有:烧杯、带铁圈的铁架台、滤纸、玻璃棒和漏斗,分液所需要的仪器有:带铁圈的铁架台、分液漏斗、烧杯;
故答案为:①⑤⑥;④⑤.点评:
本题考点: 计量仪器及使用方法;过滤、分离与注入溶液的仪器;其他仪器及其使用方法;物质的分离、提纯的基本方法选择与应用.
考点点评: 本题考查常见仪器的使用,题目难度不大,注意常见化学仪器的使用方法和注意事项.1年前查看全部
- 如图所示,中学化学实验室采用该装置用于制备乙酸乙酯.
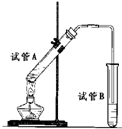 如图所示,中学化学实验室采用该装置用于制备乙酸乙酯.
如图所示,中学化学实验室采用该装置用于制备乙酸乙酯.
(1)写出制备乙酸乙酯的化学方程式______.
(2)浓硫酸在实验中的作用是______、______.
(3)加热一段时间后,在试管B饱和碳酸钠溶液的液面上方有一层油层,在油、水交界处观察到有气泡产生,气泡的主要成分是______.
(4)停止加热,取下试管B,嗅闻管内液体气味,闻到更多的是刺激性气味,这是因为物质的挥发等因素导致产品混有杂质,如______和______等,为进一步验证产物中某些杂质存在,在保持试管B相对稳定情况下,沿试管内壁滴入紫色石蕊试液,静置片刻会在试管内油层下方明显看到液体呈现三种颜色,由上而下分别为红色、紫色、蓝色,其原因可能是______,故产品需进行提纯.
(5)已知乙醇能和氯化钙结合.将所得产品依次用饱和碳酸钠溶液、饱和食盐水、饱和氯化钙溶液洗涤油层,分别分液.用饱和食盐水洗涤去除油层中可能含有的______杂质,减少乙酸乙酯的溶解,并防止对下面操作产生不利影响.
(6)在上述操作后,在所得油状液体中加入无水硫酸钠充分振荡,倾倒出油状液体,再进行______(填提纯的操作方法),收集74~78℃的馏分即可获得较纯净的乙酸乙酯. 晴天花厅1年前1
晴天花厅1年前1 -
 wlsh12 共回答了17个问题
wlsh12 共回答了17个问题 |采纳率88.2%解题思路:(1)酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,且为可逆反应;
(2)乙酸与乙醇在浓硫酸作用下加热发生酯化反应,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动;
(3)发生了化学反应,碳酸氢钠和乙酸反应生成了二氧化碳;
(4)乙酸和乙醇容易挥发出来,混在乙酸乙酯中;注入的石蕊试液密度大于油层,快速降至油层下方,油层内含有的乙酸不断扩散溶解到下层的水溶液中,上层红色是因为乙酸浓度较高,乙酸显示酸性;中间紫色层是因为乙酸与碳酸钠反应接近中性,下层蓝色是因为碳酸钠溶液呈碱性
(5)用饱和食盐水洗涤去除油层中可能含有的碳酸钠;
(6)根据液体混合物的沸点不同,可以蒸馏分离.(1)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,
故答案为:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
(2)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,浓硫酸的作用为催化剂,吸水剂,
故答案为:催化作用;吸水作用;
(3)水交界处观察到有气泡产生,气泡的主要成分是乙酸和碳酸氢钠反应生成的二氧化碳,故答案是:气体CO2;
(4)闻到的刺激性气味的物质是乙酸乙酯中混有的乙酸和乙醇;原因是:注入的石蕊试液快速降至油层下方,油层内含有的乙酸不断扩散溶解到下层的水溶液中,上层红色是因为乙酸浓度较高,中间紫色层是因为乙酸与碳酸钠反应接近中性,下层蓝色是因为碳酸钠溶液呈碱性;
故答案为:乙酸;乙醇;注入的石蕊试液快速降至油层下方,油层内含有的乙酸不断扩散溶解到下层的水溶液中,上层红色是因为乙酸浓度较高,中间紫色层是因为乙酸与碳酸钠反应接近中性,下层蓝色是因为碳酸钠溶液呈碱性;
(5)碳酸钠在饱和食盐水中易溶,乙酸乙酯溶解度减小,故选用饱和食盐水除去乙酸乙酯中的碳酸钠杂质,故答案为:碳酸钠;
(6)根据沸点不同,将混合液体分离的操作是蒸馏,通过蒸馏可以分离乙酸乙酯,故答案为:蒸馏.点评:
本题考点: 乙酸乙酯的制取.
考点点评: 本题考查了乙酸乙酯的制备,解答时须注意酯化反应的反应原理和饱和碳酸钠溶液、浓硫酸的作用,题目难度中等.1年前查看全部
- (6分)下面是中学化学实验室中几种常见的玻璃仪器:
(6分)下面是中学化学实验室中几种常见的玻璃仪器:
①滴瓶 ②容量瓶 ③滴定管 ④烧杯 ⑤圆底烧瓶 ⑦玻璃棒 ⑧移液管
(1)在仪器上具体标明使用温度的是____________(写编号,下同);可作反应容器并可加热的是____________
(2)需要用到温度计的实验是____________
①用乙醇制乙烯 ②石油分馏 ③浓硫酸的稀释 ④测定硝酸钾的溶解度 tjnuly1年前1
tjnuly1年前1 -
 十字伤痕 共回答了25个问题
十字伤痕 共回答了25个问题 |采纳率100%(1)②③⑧;④⑤(2)①②④
在仪器上具体标明使用温度的是容量瓶、滴定管、移液管。可作反应容器并可加热的是烧杯、圆底烧瓶。需要用到温度计的实验是用乙醇制乙烯、石油分馏、测定硝酸钾的溶解度1年前查看全部
- 中学化学实验室中几种常见的玻璃仪器.
中学化学实验室中几种常见的玻璃仪器.
1温度计 2容量瓶 3滴定管 4烧杯 5圆底烧瓶 6量筒 7玻璃棒
则 一般应在常温下使用的仪器是
可作反应容器并可加热的是 冰中yy1年前5
冰中yy1年前5 -
 zuoyihandsome 共回答了14个问题
zuoyihandsome 共回答了14个问题 |采纳率92.9%一般应在常温下使用的仪器是 2容量瓶 3滴定管6量筒
可作反应容器并可加热的是5圆底烧瓶4烧杯1年前查看全部
- 下面所列的是中学化学实验室中几种常见的玻璃仪器:
下面所列的是中学化学实验室中几种常见的玻璃仪器:
①温度计②容量瓶③滴定管④烧杯⑤圆底烧瓶⑥量筒⑦玻璃棒
(1)一般应在常温下使用的仪器是______(填写编号);可作反应容器并可加热的是______(填写编号)
(2)下列两个实验中都要用到玻璃棒,但其作用可能不完全相同
A.在“用无水碳酸钠配制100mL 0.12mol/L的碳酸钠溶液”的实验中,玻璃棒的作用是:(填写编号)______
B.在“用氢氧化钠溶液、碳酸钠溶液、氯化钡溶液、盐酸、水等试剂除去粗盐中的Mg2+、Ca2+、SO42-等杂质离子以获得纯净的食盐”的实验中玻璃棒的作用可能是:______(填写编号).
①搅拌②引流③蘸取溶液. 324964721年前5
324964721年前5 -
 自性之路 共回答了18个问题
自性之路 共回答了18个问题 |采纳率94.4%解题思路:(1)考虑仪器的特点和用途;
(2)根据玻璃棒的作用来考虑:溶解固体时搅拌是加速溶解的,蒸发时搅拌防止局部温度过高使液滴飞溅;转移溶液、过滤时是引流作用;测溶液酸碱性或测pH值用玻璃棒蘸取待测液.(1)有刻度的量取溶液体积的仪器标有温度,如容量瓶,滴定管和量筒;可作反应容器并可加热有烧杯、圆底烧瓶、试管等,故答案为:②③⑥;④⑤;(2)A、在溶解氯化钠时,用玻璃棒不断搅拌可以加速氯化钠溶解,在转...
点评:
本题考点: 不能加热的仪器及使用方法;间接加热的仪器及使用方法;过滤、分离与注入溶液的仪器;物质的分离、提纯和除杂.
考点点评: 本题考查了仪器的使用,特别注意玻璃棒在不同的操作中所起作用不同.1年前查看全部
- 三氯化铁是中学化学实验室中常用的化学试剂.某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3•6H2O,该
三氯化铁是中学化学实验室中常用的化学试剂.某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3•6H2O,该同学设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3•6H2O晶体.填写下列空白:
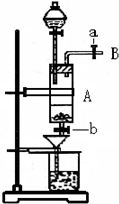
(1)收集导管B处的气体可采用的方法是______.滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是______.
(2)烧杯内放过量稀HNO3的原因是______.发生反应的离子方程式是______.
(3)整个实验过程中,弹簧夹a都必须打开,除为排出产生的气体外,另一个目的是______.
(4)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3•6H2O,而不用直接蒸干的方法来制得晶体的理由是______
(5)你认为该实验存在的缺点可能有:______. tysczy1年前1
tysczy1年前1 -
 印痕_ying 共回答了19个问题
印痕_ying 共回答了19个问题 |采纳率78.9%解题思路:(1)导管B处的气体为氢气;原电池使反应速率加快;
(2)稀HNO3有强氧化性,使Fe2+ 全部氧化成Fe3+;
(3)使分液漏斗中的酸可滴入A中;
(4)FeCl3是强酸弱碱盐水解;
(5)无尾气处理装置,用稀HNO3氧化FeCl2时会引入硝酸根离子;(1)导管B处的气体为氢气,氢气密度比空气小且不溶于水,可用排水法或向下排空气法收集;Cu与铁形成Fe-Cu原电池使反应速率加快,
故答案为:用排水法或向下排空气法;因废铁屑中含少量Cu等杂质,形成Fe-Cu原电池使反应速率加快;
(2)过量的稀HNO3保证使Fe2+ 全部氧化成Fe3+;反应的离子方程式是3Fe2++4H++NO3-═3Fe3++NO↑+2H2O,
故答案为:稀HNO3有强氧化性,为保证使Fe2+全部氧化成Fe3+;3Fe2++4H++NO3-═3Fe3++NO↑+2H2O;
(3)使分液漏斗中的酸可滴入A中,故答案为:与大气相通,使分液漏斗中的酸可滴入A中;
(4)因为FeCl3是强酸弱碱盐水解,加热蒸干时使HCl挥发造成水解平衡右移,因此得不到FeCl3•6H2O,
故答案为:因为FeCl3是强酸弱碱盐水FeCl3+3H2O⇌Fe(OH)3+3HCl,加热蒸干时使HCl挥发造成水解平衡右移,因此得不到FeCl3•6H2O;
(5)无尾气处理装置,用稀HNO3氧化FeCl2时会引入硝酸根离子使制得的FeCl3•6H2O不纯,
故答案为:反应中产生的有害气体会污染环境;用稀HNO3氧化FeCl2时会有Fe(NO3)3生成而使制得的FeCl3•6H2O不纯;点评:
本题考点: 铁及其化合物的性质实验.
考点点评: 本题考查铁及其化合物的性质实验,难度不大,注意因为FeCl3是强酸弱碱盐水解:FeCl3+3H2O⇌Fe(OH)3+3HCl,加热蒸干时使HCl挥发造成水解平衡右移,因此得不到FeCl3•6H2O.1年前查看全部
- 硫酸是中学化学实验室的常见药品,其性质有①酸性 ②吸水性 ③脱水性 ④强氧化性 ⑤催化作用,请将序号填在相应的横线上:
硫酸是中学化学实验室的常见药品,其性质有①酸性 ②吸水性 ③脱水性 ④强氧化性 ⑤催化作用,请将序号填在相应的横线上:
(4)实验室用乙醇和冰醋酸制取乙酸乙酯________;
解析… swordsman251年前3
swordsman251年前3 -
 lzm116 共回答了20个问题
lzm116 共回答了20个问题 |采纳率70%浓硫酸作催化剂,这个反应为 酯化反应,是一类有机化学反应,是醇跟羧酸或含氧无机酸生成酯和水的反应.分为羧酸跟醇反应和无机含氧酸跟醇反应何和无机强酸跟醇的反应两类.羧酸跟醇的酯化反应是可逆的,并且一般反应极缓慢,故常用浓硫酸作催化剂.1年前查看全部
- 三氯化铁是中学化学实验室中必不可少的重要试剂。某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl 3 ·6H
三氯化铁是中学化学实验室中必不可少的重要试剂。某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl 3 ·6H 2 O,该同学设计的实验装置如图所示,A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO 3 分解,再降温结晶得FeCl 3 ·6H 2 O晶体。填写下列空白 
(1)收集B处的气体可采用的方法是________________________。
(2)滴加盐酸时,发现反应速率较盐酸与纯铁粉反应的要快,其原因是________________________。
(3)烧杯内盛放过量稀HNO 3 的原因是___________________,反应的离子方程式是_________________。
(4)整个实验过程中,旋塞a都必须打开,除了为排出产生的气体外,另一个目的是___________________________________。
(5)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl 3 ·6H 2 O,而不用直接蒸干的方法来制得晶体的理由是______________________。 cyscys1年前1
cyscys1年前1 -
 射天之狼 共回答了13个问题
射天之狼 共回答了13个问题 |采纳率76.9%(1)排水集气法或向下排空气法
(2)废铁屑中有Cu杂质,形成了铜、铁原电池
(3)确保所有的Fe 2+ 转化为Fe 3+ ;3Fe 2+ +4H + +NO 3 - ==3Fe 3+ +NO↑+2H 2 O
(4)与大气相通,保证装置A中的液体顺利流下,便于过滤操作的顺利进行
(5)防止加热时FeCl 3 水解而得不到FeCl 3 ·6H 2 O1年前查看全部
- 三氯化铁是中学化学实验室中常用的化学试剂.某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl 3 •6H 2
三氯化铁是中学化学实验室中常用的化学试剂.某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl 3 •6H 2 O,该同学设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO 3 分解,再降温结晶得FeCl 3 •6H 2 O晶体.填写下列空白: 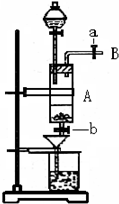
(1)收集导管B处的气体可采用的方法是______.滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是______.
(2)烧杯内放过量稀HNO 3 的原因是______.发生反应的离子方程式是______.
(3)整个实验过程中,弹簧夹a都必须打开,除为排出产生的气体外,另一个目的是______.
(4)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl 3 •6H 2 O,而不用直接蒸干的方法来制得晶体的理由是______
(5)你认为该实验存在的缺点可能有:______. zaijia11741年前1
zaijia11741年前1 -
 喵猫猫喵喵叫 共回答了17个问题
喵猫猫喵喵叫 共回答了17个问题 |采纳率100%(1)导管B处的气体为氢气,氢气密度比空气小且不溶于水,可用排水法或向下排空气法收集;Cu与铁形成Fe-Cu原电池使反应速率加快,
故答案为:用排水法或向下排空气法;因废铁屑中含少量Cu等杂质,形成Fe-Cu原电池使反应速率加快;
(2)过量的稀HNO 3 保证使Fe 2+ 全部氧化成Fe 3+ ;反应的离子方程式是3Fe 2+ +4H + +NO 3 - ═3Fe 3+ +NO↑+2H 2 O,
故答案为:稀HNO 3 有强氧化性,为保证使Fe 2+ 全部氧化成Fe 3+ ;3Fe 2+ +4H + +NO 3 - ═3Fe 3+ +NO↑+2H 2 O;
(3)使分液漏斗中的酸可滴入A中,故答案为:与大气相通,使分液漏斗中的酸可滴入A中;
(4)因为FeCl 3 是强酸弱碱盐水解,加热蒸干时使HCl挥发造成水解平衡右移,因此得不到FeCl 3 •6H 2 O,
故答案为:因为FeCl 3 是强酸弱碱盐水FeCl 3 +3H 2 O⇌Fe(OH) 3 +3HCl,加热蒸干时使HCl挥发造成水解平衡右移,因此得不到FeCl 3 •6H 2 O;
(5)无尾气处理装置,用稀HNO 3 氧化FeCl 2 时会引入硝酸根离子使制得的FeCl 3 •6H 2 O不纯,
故答案为:反应中产生的有害气体会污染环境;用稀HNO 3 氧化FeCl 2 时会有Fe(NO 3 ) 3 生成而使制得的FeCl 3 •6H 2 O不纯;1年前查看全部
- 掌握仪器名称、组装及使用方法是中学化学实验室的基础,下图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验室的基础,下图为两套实验装置.
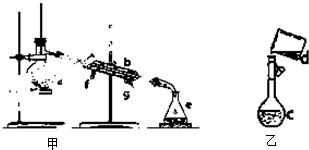
(1)写出下列仪器的名称:
a.______b.______ c.______
(2)仪器a~e中,使用前必须检查是否漏水的有______.(填序号)
(3)若利用装置甲分离四氯化碳和酒精的混合物,还缺少的仪器是______,将仪器补充完整后进行实验,温度计水银球的位置在______处.冷凝水由______(填f或g)口通入______口流出.
(4)现需配制2.0mol/LNaOH溶液480mL,装置乙是某同学转移溶液的示意图.
①图中的错误是______.
②根据计算得知,所需NaOH的质量为______g.(2分)
③下列仪器中,配制NaOH溶液时必须用到的是(填写序号)______.(2分)
①100mL量筒②烧杯③250mL容量瓶
④500mL容量瓶⑤天平⑥胶头滴管⑦玻璃棒
④出现下列操作时,将使所配制的溶液浓度偏低的是______.(2分)
A.将烧杯内的NaOH溶液向容量瓶内转移时,部分溶液溅出瓶外
B.将烧杯内的NaOH溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
C.定容时仰视观察容量瓶刻度线和凹液面的最低点. 阿钍1年前1
阿钍1年前1 -
 牛牛心事 共回答了18个问题
牛牛心事 共回答了18个问题 |采纳率100%解题思路:(1)根据仪器的结构特点进行判断;
(2)有活塞和玻璃塞的仪器使用时必须检查是否漏水;
(3)分离四氯化碳和酒精的混合物需用蒸馏,必须用酒精灯加热;温度计的水银球应该放在蒸馏烧瓶的支管口处;
(4)①根据配制一定物质的量浓度的溶液的方法和操作来寻找装置中的错误;
②配制480mL溶液,需要选用500mL的容量瓶,然后根据m=nM=cVM计算需要氢氧化钠的质量;
③根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
④根据c=[n/V]可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.(1)根据图示仪器的构造可知:a为蒸馏烧瓶,b为锥形瓶,c为容量瓶,
故答案为:蒸馏烧瓶;锥形瓶;容量瓶;
(2)容量瓶在使用前要检查是否漏水,蒸馏烧瓶、锥形瓶、冷凝管不需要检查是否漏水,
故答案为:c;
(3)分离四氯化碳和酒精的混合物用蒸馏的方法分离,必须用酒精灯;温度计用于测量馏分温度,所以温度计的水银球应该放在蒸馏烧瓶的支管口处;冷凝管的通水采用逆向通水法,及从g进水,从f出水,
故答案为:酒精灯;蒸馏烧瓶的支管口;g;f;
(4)①配制一定物质的量浓度的溶液是必须用玻璃棒引流,防止液体外溅,
故答案为:未用玻璃棒引流;
②实验室没有480mL的容量瓶,配制时需要选用500mL的容量瓶,实际上配制的是500mL 1mol/L的NaOH溶液,需要NaOH的质量为:0.5L×2mol/L×40g/mol=40.0g,
故答案为:40.0;
③配制500mL 1mol/L的NaOH溶液的步骤为:计算→称量→溶解、冷却→移液→定容→摇匀→装瓶→贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀,所以需要的仪器为:②烧杯、④500mL容量瓶、⑤天平、⑥胶头滴管、⑦玻璃棒,
故答案为:②④⑤⑥⑦;
④A.将烧杯内的NaOH溶液向容量瓶内转移时,部分溶液溅出瓶外,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故A正确;
B.将烧杯内的NaOH溶液转移至容量瓶后,未洗涤烧杯和玻璃棒,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故B正确;
C.定容时仰视观察容量瓶刻度线和凹液面的最低点,导致加入的蒸馏水低于容量瓶刻度线,配制的溶液体积偏小,溶液的浓度偏高,故C错误;
故答案为:AB.点评:
本题考点: 配制一定物质的量浓度的溶液;物质的分离、提纯的基本方法选择与应用.
考点点评: 本题考查了配制一定物质的量浓度的溶液的方法,题目难度中等,注意掌握配制一定浓度的溶液方法,试题有利于培养学生的逻辑思维能力和严谨的规范实验操作能力;该题的难点在于误差分析,注意明确误差分析的方法.1年前查看全部
- (2007•和平区二模)某中学化学实验室有如下图所示的实验装置,用于制取氧气、二氧化碳等多种体.
(2007•和平区二模)某中学化学实验室有如下图所示的实验装置,用于制取氧气、二氧化碳等多种体.
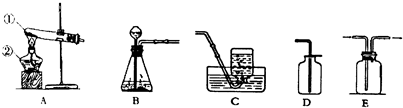
(1)请写出有标号仪器的名称:①______②______
(2)若制取二氧化碳应选用的发生装置是______(填序号,下同),反应的化学方程式是______;检验二氧化碳的方法是:______.
(3)已知二氧化硫是易溶于水、密度比空气大的有毒气体.在常温下,用亚硫酸钠固体和稀硫酸制取二氧化硫气体,应选用的发生装置是______,收集装置是______. 金jim1年前1
金jim1年前1 -
 斯渺 共回答了14个问题
斯渺 共回答了14个问题 |采纳率85.7%解题思路:(1)熟悉常见仪器,了解名称;
(2)根据制取二氧化碳是固液不加热反应选择发生装置,并能书写反应的化学反应式;根据二氧化碳能使澄清的石灰水变浑浊来检验;
(3)根据“常温下,用亚硫酸钠固体和稀硫酸反应制取二氧化硫气体”选择发生装置;根据其密度和溶水性及性质选择收集装置.(1)图中①是试管,②是酒精灯;
(2)制取二氧化碳是固体大理石与液体稀盐酸的不加热反应,可用装置B完成;该反应的化学反应式是:CaCO3+2HCl═CaCl2+H2O+CO2↑;检验二氧化碳的方法是倒入足量的澄清石灰水,振荡,若澄清石灰水变白色浑浊,证明瓶里的气体是二氧化碳;
(3)根据题目中“常温下,用亚硫酸钠固体和稀硫酸反应制取二氧化硫气体”可知此反应是固液常温下的反应,可用装置B作为发生装置;由于二氧化硫是易溶于水、密度比空气大的有毒气体,所以应用E装置收集,不用D装置收集(用D装置收集时二氧化硫逸出会污染空气);
故答案为:(1)试管;酒精灯;
(2)B;2HCl+CaCO3=CaCl2+H2O+CO2↑;倒入足量的澄清石灰水,振荡,若澄清石灰水变白色浑浊,证明瓶里的气体是二氧化碳;
(3)B;E.点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;二氧化碳的实验室制法;二氧化碳的检验和验满;书写化学方程式、文字表达式、电离方程式.
考点点评: 本道题主要考查了实验室制取气体发生装置和收集装置的选择,发生装置主要取决于反应物的状态和反应条件,收集装置主要取决于气体的密度、溶水性、是否有毒、是否与水反应、是否与空气中的物质反应等.1年前查看全部
- A:下面所列的是中学化学实验室中几种常见的玻璃仪器:
A:下面所列的是中学化学实验室中几种常见的玻璃仪器:
①温度计、 ②容量瓶、③滴定管、④烧杯、⑤蒸馏烧瓶、
⑥ 量筒、⑦玻璃棒、⑧蒸发皿
量筒、⑦玻璃棒、⑧蒸发皿
在仪器上具体标明使用温度的是(不考虑温度计) (填编号);
标有“0”刻度的有 (填编号)
对允许加热的仪器,加热时必须垫上石棉网的有 (填编号);
使用时必须检查是否漏水的有 (填序号);
B:现用物质的量的浓度为a mol / L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,
①酸式滴定管用蒸馏水洗净后,还应该进行的操作是 ;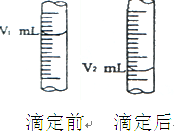
②右图是酸式滴定管中液面在滴定前后的读数:则c (NaOH)= ;
C:拟在烧杯中于加热条件下配置某溶液50mL,应选择的烧杯是(用字母回答)
D:“磨砂”是增加玻璃仪器密封性的一种处理工艺,可使仪器不漏液或不漏气。在下列仪器中:①试管②分液漏斗③细口试剂瓶④广口试剂瓶⑤集气瓶⑥滴瓶 肯定用不到“磨砂”处理的有 (填序号)。A.400mL B.250mL C.100mL D.50 ml  拽拽的小强1年前1
拽拽的小强1年前1 -
 gg之怪 共回答了19个问题
gg之怪 共回答了19个问题 |采纳率94.7%(17分)A:② ③ ⑥; ① ③; ④ ⑤; ② ③
B:①用标准 盐酸润洗滴定管2-3次 ②a(V 2 -V 1 )/Vmol / L ;
盐酸润洗滴定管2-3次 ②a(V 2 -V 1 )/Vmol / L ;
C: C;D: ①
A:②容量瓶、③滴定管、⑥ 量筒是用于配制或量取溶液的玻璃仪器,存在热胀冷缩,标明了温度,则要求在该温度下进行实验,否则有误差;①②③⑥有刻度或标线,但量筒无0刻度,容量瓶只有标线;允许加热的仪器有④⑤⑧,加热时必须垫上石棉网的有④⑤;使用时必须检查是否漏水的有②③。B:滴定管用蒸馏水洗净后,再用所装溶液润洗,否则有误差;由图知用去盐酸的体积为V 2 -V 1 ,则n(NaOH)=n(HCl)= a(V 2 -V 1 ), c (NaOH)=a(V 2 -V 1 )/V mol / L; C:在烧杯中于加热条件下配置某溶液,液体的体积不超过烧杯容积的一半;D:分液漏斗活塞处易漏液,细口试剂瓶、广口试剂瓶、集气瓶、滴瓶瓶口易漏气,因此②③④⑤⑥均要磨砂。
1年前查看全部
量筒是用于配制或量取溶液的玻璃仪器,存在热胀冷缩,标明了温度,则要求在该温度下进行实验,否则有误差;①②③⑥有刻度或标线,但量筒无0刻度,容量瓶只有标线;允许加热的仪器有④⑤⑧,加热时必须垫上石棉网的有④⑤;使用时必须检查是否漏水的有②③。B:滴定管用蒸馏水洗净后,再用所装溶液润洗,否则有误差;由图知用去盐酸的体积为V 2 -V 1 ,则n(NaOH)=n(HCl)= a(V 2 -V 1 ), c (NaOH)=a(V 2 -V 1 )/V mol / L; C:在烧杯中于加热条件下配置某溶液,液体的体积不超过烧杯容积的一半;D:分液漏斗活塞处易漏液,细口试剂瓶、广口试剂瓶、集气瓶、滴瓶瓶口易漏气,因此②③④⑤⑥均要磨砂。
1年前查看全部
- 中学化学实验室中最常用溶剂是什么
 寒塘枫雨1年前3
寒塘枫雨1年前3 -
 疼比痛苦早痊愈 共回答了17个问题
疼比痛苦早痊愈 共回答了17个问题 |采纳率88.2%常见无机溶剂:水、浓硫酸、浓硝酸等.
常见有机溶剂:四氯化碳、苯、酒精等.1年前查看全部
- 一般中学化学实验室中量筒的规格有哪些
 看海一个人1年前4
看海一个人1年前4 -
 沙漠一鱼 共回答了20个问题
沙漠一鱼 共回答了20个问题 |采纳率95%10ml.20ml.50ml.100ml.500ml1年前查看全部
- 某中学化学实验室有如下图所示的实验装置,用于制取氧气、二氧化碳等多种气体。
某中学化学实验室有如下图所示的实验装置,用于制取氧气、二氧化碳等多种气体。
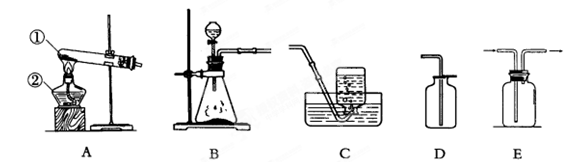
(1)请写出有标号仪器的名称:① ②
(2)若制取的一种气体是 ,应选用的收集装置是 (填序号,下同),应选用的发生装置是 , 反应的化学方程式是 ;检验所制取的气体的方法是: ;
(3)在常温下,用亚硫酸钠固体和稀硫酸制取二氧化硫气体,应选用的发生装置是: ;由于二氧化硫是易溶于水、密度比空气大的有毒气体,所以应用 装置进行收集,以便将尾气吸收处理,避免造成
(4)该中学化学课外兴趣小组同学利用发生装置B进行“石块中是否含有碳酸钙”的探究活动。在活动中小明发现,相邻小组气体产生的速率比自己小组的快。小明将这一情况报告老师,老师鼓励他们对此问题共同探究。
【提出问题】影响二氧化碳气体产生速率的因素是什么?
【作出猜想】①不同地点石块中碳酸钙含量不同;
②所用的盐酸不同;
③还可能是 。
【设计实验】(1)验证猜想①是否成立,要设计的实验:分别取大小相同、质量相同、 的石块,加入相同的稀盐酸进行实验。
【交流讨论】实验中可以通过观察 ,粗略地比较反应速率。
【拓展延伸】上述实验中,小明采用了控制单一变量的研究方法。用此方法探究“催化剂对用过氧化氢溶液制取氧气的反应速率的影响”,需要控制不变的因素有 等(答出一点即可)。 张欢1年前1
张欢1年前1 -
 牧阳女 共回答了27个问题
牧阳女 共回答了27个问题 |采纳率96.3%(1)①试管 ②酒精灯
(2)根据所选的气体完成填空
(3)B;E 空气污染
(4)石块的大小不同;不同地点;放出的气泡的激烈程度不同;过氧化氢溶液的浓度、温度等。
1年前查看全部
- 硫酸是中学化学实验室的常见药品,其性质有①酸性 ②吸水性 ③脱水性 ④强氧化性 ⑤催化作用,请将序号填在相应的横线上:
硫酸是中学化学实验室的常见药品,其性质有①酸性 ②吸水性 ③脱水性 ④强氧化性 ⑤催化作用,请将序号填在相应的横线上:
(3)浓硫酸与蔗糖的炭化实验(黑面包实验)________;
解析哦. 除螨虫1年前3
除螨虫1年前3 -
 恰是你 共回答了17个问题
恰是你 共回答了17个问题 |采纳率88.2%3和4
先在蔗糖里按2比1的比例脱去H和O,这是脱水性;然后在与生成的C发生氧化还原反应,这是氧化性.(注意浓硫酸与水反应过程有热量放出)1年前查看全部
大家在问
- 1为确定某硫酸钠和氢氧化钠固体混合物中硫酸钠含量,取10克该固体混合物与89克质量分数为百分之10的稀硫酸
- 2计算反物质湮灭的能量能用E=mc^2吗?
- 3关于位似图形对应边平行的证明因为是探究活动.所以希望有证明过程和多种解法.配合图解更好
- 4(我的爱愿意为你保留到永远)用英语怎么说
- 5环比和同比含义和区别是什么
- 6climbed请告诉我音标climb的过去式发音
- 7谁有杜甫《望岳》改成现代诗?王安石的《登飞来峰》也可以啊!
- 8come across的及物意思和不及物意思··
- 9甲乙车间人数占总人数的5/8,从甲调90人到乙;则甲乙两车间的人数是2/3,原来两车间各有多少人?
- 10印度的钢铁工业多分布在铁矿,锰矿,煤炭资源丰富的地区,为什么会这样
- 11颜回好学 中的尽子的意思
- 12Wie geht's?s ssssssssssssssss
- 13帮我翻译成英文谢谢我曾经深爱一个女孩,但我却没对她说过一句我爱她,这是我一生最大的遗憾.四年多没见了,你还好吗?希望你过
- 14英语翻译 成功在于经历失败后继续努力的能力 自行车似乎太重太难下控制. 我正要放弃,这时我父亲过
- 15厦门广播电台发射“中波”段某套节目的讯号、家用微波炉中的微波、VCD机中的激光(可见光)、人体透视用的X光,都是电磁波,

