NH 4 ClO 4 (高氯酸铵)可用作火箭推进剂,当它发生分解反应时,不能生成的物质是 A.SO 2 B.Cl 2 C
 苯苯猪Sun2022-10-04 11:39:541条回答
苯苯猪Sun2022-10-04 11:39:541条回答| NH 4 ClO 4 (高氯酸铵)可用作火箭推进剂,当它发生分解反应时,不能生成的物质是
|

已提交,审核后显示!提交回复
共1条回复
 水应ii 共回答了24个问题
水应ii 共回答了24个问题 |采纳率87.5%- A
- 1年前
相关推荐
- 航天飞机曾使用金属铝粉和高氯酸铵(NH4ClO4)混合物作为固体燃料.加热时铝粉被助燃剂氧气氧化,放出大量的热,并促使混
航天飞机曾使用金属铝粉和高氯酸铵(NH4ClO4)混合物作为固体燃料.加热时铝粉被助燃剂氧气氧化,放出大量的热,并促使混合物中高氯酸铵在受热时快速发生分解反应,生成四种气体:其中两种均是空气中的主要成分,第三种气体是氯气(Cl2),还有一种气态氧化物(常温是为液态),因而产生巨大的推动力.
其中,涉及到的化学方程式为4Al+3O2
2Al2O3△ .4Al+3O2;
2Al2O3△ .2NH4ClO4
N2↑+2O2↑+Cl2↑+4H2O↑△ .2NH4ClO4.
N2↑+2O2↑+Cl2↑+4H2O↑△ . 7nvhr1年前1
7nvhr1年前1 -
 宁静的宁 共回答了26个问题
宁静的宁 共回答了26个问题 |采纳率88.5%解题思路:根据题意,加热时铝粉被助燃剂氧气氧化,高氯酸铵在受热时快速发生分解反应,生成四种气体:其中两种均是空气中的主要成分,第三种气体是氯气(Cl2),含有一种气态氧化物(常温是为液态),写出反应的化学方程式即可.根据题意,加热铝粉使其被氧气氧化,放出大量的热,铝粉在加热条件下生成氧化铝,反应的化学方程式为:4Al+3O2
△
.
2Al2O3;
高氯酸铵受热时发生分解,同时生成四种气体;其中两种气体是空气的主要成分,一种气体是氯气(Cl2),还有一种气态氧化物(常温是为液态);空气的主要成分是氮气和氧气,一种气态氧化物(常温是为液态)是水,要注意生成的水蒸气是气体,反应的化学方程式为:2NH4ClO4
△
.
N2↑+2O2↑+Cl2↑+4H2O↑.
故答案为:4Al+3O2
△
.
2Al2O3;2NH4ClO4
△
.
N2↑+2O2↑+Cl2↑+4H2O↑.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.1年前查看全部
- 世界瞩目的“嫦娥一号”月球探测卫星于2007年10月24日在西昌卫星发射中心成功发射升空,卫星运载火箭的动力由高氯酸铵(
世界瞩目的“嫦娥一号”月球探测卫星于2007年10月24日在西昌卫星发射中心成功发射升空,卫星运载火箭的动力由高氯酸铵(NH4ClO4)分解提供,高氯酸铵分解有可能排入大气的物质是( )
A.H2O
B.SO2
C.CO2
D.CO westlife881年前1
westlife881年前1 -
 yukuai2165070 共回答了14个问题
yukuai2165070 共回答了14个问题 |采纳率92.9%解题思路:由题目中的高氯酸铵(NH4ClO4),根据质量守恒定律的元素守恒可知,高氯酸铵分解不可能排入大气的物质是SO2、CO2、CO,因为高氯酸铵(NH4ClO4)中无S、C元素.因为高氯酸铵(NH4ClO4)中无S、C元素,所以根据质量守恒定律的元素守恒可知,高氯酸铵分解不可能排入大气的物质是SO2、CO2、CO.
故选A.点评:
本题考点: 质量守恒定律及其应用;元素在化学变化过程中的特点.
考点点评: 本题是运用化学中的基本思想质量守恒思想,通过归纳不同物质或不同变化过程中相同点和不同点有效地寻找出它们之间的内在联系以及融合点和嫁接点,从而培养了学生的创新思维能力.1年前查看全部
- 高氯酸铵(NH 4 ClO 4 )是火箭的一种固体燃料,在火箭发射时发生的化学反应为:2NH 4 ClO 4 N 2 ↑
高氯酸铵(NH 4 ClO 4 )是火箭的一种固体燃料,在火箭发射时发生的化学反应为:2NH 4 ClO 4 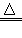 N 2 ↑+Cl 2 ↑+2O 2 ↑+4H 2 O,该反应属于[ ]
N 2 ↑+Cl 2 ↑+2O 2 ↑+4H 2 O,该反应属于[ ]A.化合反应
B.分解反应
C.置换反应
D.复分解反应 毛山药1年前1
毛山药1年前1 -
 song_xiaobo551 共回答了18个问题
song_xiaobo551 共回答了18个问题 |采纳率94.4%B1年前查看全部
- 哥伦比亚号航天飞机曾用金属铝粉和高氯酸铵(NH4ClO4)混合物做为固体燃料,加热铝粉使其被氧气氧化,放出大量的热,促使
哥伦比亚号航天飞机曾用金属铝粉和高氯酸铵(NH4ClO4)混合物做为固体燃料,加热铝粉使其被氧气氧化,放出大量的热,促使高氯酸铵(NH4ClO4)分解,生成四种气体.其中两种是空气中的主要成分,一种是氯气,还有一种是化合物(常温下是液态),因而产生巨大的推动力.试写出其中涉及的反应的化学方程式.
(1)铝粉被氧气氧化成氧化铝:4Al+3O2
2Al2O3△ .4Al+3O2;
2Al2O3△ .
(2)高氯酸铵受热分解:2NH4ClO4
N2↑+2O2↑+Cl2↑+4H2O↑△ .2NH4ClO4.
N2↑+2O2↑+Cl2↑+4H2O↑△ .
(3)“纳米材料”特指粒径为1~100nm(1nm=10-9m)的颗粒.纳米材料和纳米技术的应用几乎涉及现代工业的各个领域.用纳米级的某种氧化物作催化剂,使汽车中的CO跟NO反应转化为两种气体,其中一种可参与植物的光合作用,另一种是空气中含量最多的气体.写出上述反应的化学方程式2CO+2NO
2CO2+N2催化剂 .2CO+2NO.
2CO2+N2催化剂 . cheng32321年前1
cheng32321年前1 -
 305441330 共回答了14个问题
305441330 共回答了14个问题 |采纳率78.6%解题思路:首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可.(1)铝粉在加热条件下被氧气氧化成氧化铝,反应的化学方程式是4Al+3O2
△
.
2Al2O3.
(2)高氯酸铵受热分解,生成四种气体,其中两种是空气中的主要成分(氮气和氧气),一种是氯气,还有一种是化合物(常温下是液态,由质量守恒定律,该物质是水),
(3)CO跟NO反应转化为两种气体,其中一种可参与植物的光合作用(该气体是二氧化碳),另一种是空气中含量最多的气体(该气体是氮气),反应的化学方程式2CO+2NO
催化剂
.
2CO2+N2.
故答案为:(1)4Al+3O2
△
.
2Al2O3;(2)2NH4ClO4
△
.
N2↑+2O2↑+Cl2↑+4H2O↑;(3)2CO+2NO
催化剂
.
2CO2+N2.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.1年前查看全部
- NH 4 ClO 4 (高氯酸铵)可用作火箭推进剂,当它发生分解反应时,不能生成的物质是( ) A.CO 2 B.Cl
NH 4 ClO 4 (高氯酸铵)可用作火箭推进剂,当它发生分解反应时,不能生成的物质是( ) A.CO 2 B.Cl 2 C.O 2 D.N 2  音乐与健身1年前1
音乐与健身1年前1 -
 桃花岛之狐 共回答了14个问题
桃花岛之狐 共回答了14个问题 |采纳率85.7%化学反应前后元素的种类不变,高氯酸铵中含有氮元素、氢元素、氯元素、氧元素四种元素,没有碳元素,故分解后的产物中不可能出现碳元素.
故选A1年前查看全部
- 世界瞩目的“嫦娥一号”月球探测卫星于2007年10月24日在西昌卫星发射中心成功发射升空,卫星运载火箭的动力由高氯酸铵(
世界瞩目的“嫦娥一号”月球探测卫星于2007年10月24日在西昌卫星发射中心成功发射升空,卫星运载火箭的动力由高氯酸铵(NH 4 ClO 4 )分解提供,高氯酸铵分解有可能排入大气的物质是 [ ]A.H 2 O
B.SO 2
C.CO 2
D.CO 菲飛1年前1
菲飛1年前1 -
 嗳啭角 共回答了16个问题
嗳啭角 共回答了16个问题 |采纳率93.8%A1年前查看全部
- 我国使用“长征3号甲”运载火箭将“嫦娥Ⅰ号”送上月球.该运载火箭的动力是由高氯酸铵(NH 4 ClO 4 )分解所提供的
我国使用“长征3号甲”运载火箭将“嫦娥Ⅰ号”送上月球.该运载火箭的动力是由高氯酸铵(NH 4 ClO 4 )分解所提供的.其原理如下,2NH 4 ClO 4
N 2 ↑+Cl 2 ↑+4R↑+2O 2 ↑,试确定R的化学式( )△ . A.H 2 O B.HCl C.NH 3 D.H 2  和你去吹风1年前1
和你去吹风1年前1 -
 秋天ln 共回答了14个问题
秋天ln 共回答了14个问题 |采纳率92.9%由反应的化学方程式2NH 4 ClO 4
△
.
N 2 ↑+Cl 2 ↑+4R↑+2O 2 ↑,可知:
反应前 反应后
N原子 2 2
H原子 8 0
Cl原子 2 2
O原子 8 4
根据化学变化前后原子的种类、数目不变,可判断生成物X的4个分子中含有8个H原子和4个O原子,则每个R的分子由2个H原子和1个O原子构成,物质R的化学式为H 2 O;
故选A.1年前查看全部
- “神六”载人飞船所用固体燃料是铝粉和高氯酸铵(化学式为:NH4ClO4)的混合物.发射时,点燃铝粉产生大量的热引发高氯酸
“神六”载人飞船所用固体燃料是铝粉和高氯酸铵(化学式为:NH4ClO4)的混合物.发射时,点燃铝粉产生大量的热引发高氯酸铵发生如下反应:2NH4ClO4
N2↑+2O2↑+Cl2↑+4X高温 .
(1)NH4ClO4中氯元素的化合价为______,Cl2中氯元素的化合价为______.
(2)X的化学式为______,判断的理论依据是______.
(3)N2右下角的“2”表示的含义是______.2O2左侧的“2”表示的含义是______. desidesi1231年前1
desidesi1231年前1 -
 香水百合8301 共回答了17个问题
香水百合8301 共回答了17个问题 |采纳率100%解题思路:(1)根据化合价的原则(在化合物中正、负化合价的代数和为零),又知铵根的化合价为+1价、氧元素的化合价为-2价,可求氯元素的化合价;单质的化合价为0.
(2)根据化学方程式结合质量守恒定律,反应前后元素的种类不变,原子个数不变,可求x.
(3)根据化学式中数字的含义进行分析.(1)设氯元素的化合价为x,(+1)+x+4×(-2)=0,故解得,x=+7价;单质的化合价为0价.
(2)根据质量守恒定律可知,反应前后元素的种类不变,原子个数不变.反应物:2个氮原子、2个氯原子、8个氢原子、8个氧原子;生成物:N2、2O2、Cl2中有2个氮原子、4个氧原子、2个氯原子,故“4X”中有8个氢原子、4个氧原子,故化学式为H2O.
(3)N2右下角的“2”表示的含义是一个氮分子中含有2个氮原子;2O2左侧的“2”表示的含义是2个氧分子.
故答案为为:(1)+7;0;
(2)H2O;质量守恒定律;
(3)一个氮分子中含有2个氮原子;2个氧分子.点评:
本题考点: 有关元素化合价的计算;化学符号及其周围数字的意义;质量守恒定律及其应用.
考点点评: 掌握有关元素化合价的计算方法,掌握化合价的规律和原则、质量守恒定律的内容及其应用等,难度不大.1年前查看全部
- 航天飞机用高氯酸铵(NH4ClO4)与铝粉的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,方程式为:2NH4Cl
航天飞机用高氯酸铵(NH4ClO4)与铝粉的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,方程式为:2NH4ClO4(s)N
2(g)+4H2O(g)+Cl2(g)+2O2(g)△H=-Q kJ/mol下列不正确的是( )高温 .
A.上述反应属于分解反应
B.上述反应瞬间产生大量高温气体推动航天飞机飞行
C.反应从能量变化上看,主要是化学能转变为热能和动能
D.在反应中高氯酸铵只起氧化剂的作用 fiona啦啦1年前1
fiona啦啦1年前1 -
 爱漂亮的豆豆猫 共回答了20个问题
爱漂亮的豆豆猫 共回答了20个问题 |采纳率80%解题思路:A.一种物质分解生成2种或多种物质的反应属于分解反应;
B.反应中生成大量高温气体;
C.依据化学反应的能量变化主要是热能,同时推进航天器升空产生了动能分析;
D.NH4ClO4既是氧化剂又是还原剂.A.2NH4ClO4(s)N
高温
.
2(g)+4H2O(g)+Cl2(g)+2O2(g)反应中只有一种反应物,有多种生成物属于分解反应,故A正确;
B.该反应放出大量热,同时生成大量气体,则反应中生成大量高温气体推动航天飞机飞行,故B正确;
C.化学反应是放热反应,化学能转化为热能,推进航天器升空说明燃烧产生高速气体,则化学能转化为动能,故C正确;
D.存在化合价的变化,是氧化还原反应,反应中反应物只有一种,所以NH4ClO4既是氧化剂又是还原剂,故D错误.
故选D.点评:
本题考点: 常见的能量转化形式.
考点点评: 本题考查了氧化还原反应、反应前后的能量变化的判断和能量形式转化、化学反应类型的判断等,题目难度不大,侧重于基础知识的考查.1年前查看全部
- “神六”载人飞船所用固体燃料是铝粉和高氯酸铵(化学式为:NH4ClO4)的混合物.发射时,点燃铝粉产生大量的热引发高氯酸
“神六”载人飞船所用固体燃料是铝粉和高氯酸铵(化学式为:NH4ClO4)的混合物.发射时,点燃铝粉产生大量的热引发高氯酸铵发生如下反应:
2NH4ClO4
N2↑+2O2↑+Cl2↑+4H2O高温 .
(1)NH4ClO4中氯元素的化合价为______,Cl2中氯元素的化合价为______.
(2)N2右下角的“2”表示的含义是______;2O2左侧的“2”表示的含义是______. 科和产1年前1
科和产1年前1 -
 Davidca 共回答了19个问题
Davidca 共回答了19个问题 |采纳率100%解题思路:(1)根据单质中元素的化合价为0、在化合物中正负化合价代数和为零,结合物质的化学式进行解答本题
(2)标在化学式中元素右下角的数字表示一个分子中所含原子的数目,标在分子符号前面的数字表示分子的个数.(1)铵根显+1价,氧元素显-2价,设氯元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)×4=0,则x=+7价.
根据单质中元素的化合价为0,Cl2属于单质,故氯元素的化合价为0.
(2)标在化学式中元素右下角的数字表示一个分子中所含原子的数目,N2右下角的“2”表示1个氮分子中含有2个氮原子.
标在分子符号前面的数字表示分子的个数,2O2左侧的“2”表示氧分子的个数为2.
故答案为:(1)+7;0;
(2)1个氮分子中含有2个氮原子;氧分子的个数为2.点评:
本题考点: 有关元素化合价的计算;化学符号及其周围数字的意义.
考点点评: 本题难度不大,掌握利用化合价的原则计算指定元素的化合价的方法、标在元素符号不同位置的数字所表示的意义是正确解答此类题的关键所在.1年前查看全部
- “神舟七号”载人飞船所用的固体燃料是铝粉和高氯酸铵的混合物.发射时,点燃铝粉产生大量的热引发高氯酸铵发生如下反应:2NH
“神舟七号”载人飞船所用的固体燃料是铝粉和高氯酸铵的混合物.发射时,点燃铝粉产生大量的热引发高氯酸铵发生如下反应:2NH 4 ClO 4
N 2 ↑+2O 2 ↑+Cl 2 ↑+4X;则X的化学式为______.高温 .  要爽由双手1年前1
要爽由双手1年前1 -
 freefly_ 共回答了18个问题
freefly_ 共回答了18个问题 |采纳率94.4%根据质量守恒定律和化学方程式可得,X的化学式中应含有N的个数为:(2-2)÷4=0,应含有H的个数为:(2×4)÷4=2,应含有Cl的个数为:(2-2)÷4=0,应含有O的个数为:(2×4-2×2)÷4=1.故可判断X的化学式为:H 2 O;
故答案为:H 2 O.1年前查看全部
- 航天飞机用高氯酸铵(NH4ClO4)与铝粉的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为:2N
航天飞机用高氯酸铵(nh4clo4)与***的混合物为固体燃料,点燃时***氧化放热引发高氯酸铵反应,其方程式可表示为:2nh4clo4(s)=n2(g)+4h2o(g)+cl2(g)+2o2(g).
下列对此反应的叙述不正确的是( )
a.上述反应瞬间产生大量高温气体推动航天飞机飞行
b.反应从能量变化上说,主要是化学能转变为热能和动能
c.由***引发该反应,所以上述反应为吸热反应
d.在反应中高氯酸铵既是氧化剂又是还原剂 a2374283671年前1
a2374283671年前1 -
 全神贯注 共回答了13个问题
全神贯注 共回答了13个问题 |采纳率92.3%解题思路:反应2NH4ClO4
N2↑+4H2O+Cl2↑+2O2↑中,反应物高氯酸铵为化合物,产物中N2为单质,有元素化合价的变化,故该反应为氧化还原反应,为放热反应.△ .A.2NH4ClO4
△
.
N2↑+4H2O+Cl2↑+2O2↑+Q,+Q表示放热,故A正确.
由一种反应物发生化学反应后生成两种或两种以上的物质的反应为分解反应,反应物高氯酸铵为一种物质,产物为N2、H2O、Cl2、O2↑四种物质,符合定义,故A正确;
B.航天飞机用的铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,燃料反应为放热反应,反应从能量变化上说,主要是化学能转变为热能和动能,故B正确;
C、由铝粉引发该反应,燃料反应为放热反应,所以上述反应为放热反应,故C错误;
D.2NH4ClO4
△
.
N2↑+4H2O+Cl2↑+2O2↑+Q,2molNH4ClO4参加反应,2mol+7价Cl变成0价的1mol Cl2转移14 mol电子,NH4ClO4中氮、氧元素被氧化,氯元素被还原,高氯酸铵既是氧化剂,又是还原剂.故D正确;
故选C.点评:
本题考点: 反应热和焓变;氧化还原反应.
考点点评: 本题以信息的形式考查氧化还原反应及能量,掌握分解反应的特点,理解氧化还原反应的本质,注意放热反应、吸热反应的标志,是解答本题的关键.1年前查看全部
- (2014•长宁区一模)高氯酸铵是火箭燃料的重要氧载体.高氯酸铵在高压、450℃的条件下迅速分解,反应的化学方程式4NH
(2014•长宁区一模)高氯酸铵是火箭燃料的重要氧载体.高氯酸铵在高压、450℃的条件下迅速分解,反应的化学方程式4NH4ClO4
6H2O↑+2N2↑+4HCl↑+5O2↑其中氧化产物与还原产物的物质的量之比是______,每分解1mol高氯酸铵,转移的电子数目是______.高压 450℃  01305351年前1
01305351年前1 -
 Xenophanes 共回答了14个问题
Xenophanes 共回答了14个问题 |采纳率78.6%解题思路:4NH4ClO4
6H2O↑+2N2↑+4HCl↑+5O2↑中,N、O元素的化合价升高,Cl元素的化合价降低,则氧化产物为N2、O2,还原产物为HCl,4molNH4ClO4分解转移32mol电子,以此计算.高压 450℃ 4NH4ClO4
高压
450℃6H2O↑+2N2↑+4HCl↑+5O2↑中,N、O元素的化合价升高,Cl元素的化合价降低,则氧化产物为N2、O2,还原产物为HCl,
由反应可知,氧化产物与还原产物的物质的量之比为(2+5):4=7:4,
4molNH4ClO4分解转移32mol电子,每分解1mol高氯酸铵,转移[32/4]=8mol电子,转移的电子数目是8NA或4.816×1024个,
故答案为:7:4;8NA或4.816×1024个.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应的计算,把握反应中元素的化合价变化判断氧化产物、还原产物及转移电子为解答的关键,注意N、O元素的化合价均升高,题目难度不大.1年前查看全部
- 高氯酸铵(NH 4 ClO 4 )是复合火箭推进剂的重要成分,实验室可通过下列反应制取:NaClO 4 (aq)+NH
高氯酸铵(NH 4 ClO 4 )是复合火箭推进剂的重要成分,实验室可通过下列反应制取:NaClO 4 (aq)+NH 4 Cl(aq)  NH 4 ClO 4 (aq)+NaCl(aq)
NH 4 ClO 4 (aq)+NaCl(aq)
(1)若NH 4 Cl用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是___________。
(2)反应得到的混合溶液中NH 4 ClO 4 和NaCl的质量分数分别为0.30和0.15(相关物质的溶解度曲线如下图)。从混合溶液中获得较多NH 4 ClO 4 晶体的实验操作依次为(填操作名称)______________,干燥。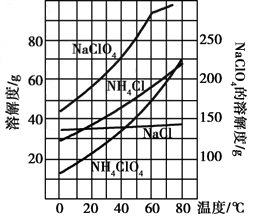
(3)样品中NH 4 ClO 4 的含量可用蒸馏法进行测定,蒸馏装置如下图所示(加热和仪器固定装置已略去),实验步骤如下: 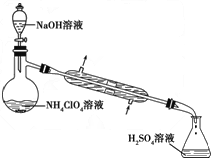
步骤1:按所示组装仪器,检查装置气密性。
步骤2:准确称取样品a g(约0.5 g)于蒸馏烧瓶中,加入约150 mL水溶解。
步骤3:准确量取40.00 mL约0.1 mol/L的H2SO4 溶解于锥形瓶中。
步骤4:向蒸馏瓶中加入20 mL 3 mol/L的NaOH 溶液。
步骤5:加热蒸馏至蒸馏烧瓶中剩余约100 mL溶液。
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤7:向锥形瓶中加入酸碱指示剂,用c mol/L的NaOH标准溶液滴定至终点,消耗NaOH标准溶液V1mL。
步骤8:将实验步骤1~7重复2次。
①步骤3中,准确量取40.00 mL H 2 SO 4 溶液的玻璃仪器是__________________。
②步骤1~7中确保生成的氨被稀硫酸完全吸收的实验是_______________(填写步骤号)。
③为获得样品中NH 4 ClO 4 的含量,还需补充的实验是____________________。 美杜杀1年前1
美杜杀1年前1 -
 mao雨mao雪 共回答了14个问题
mao雨mao雪 共回答了14个问题 |采纳率85.7%1年前查看全部
- 我国使用“长征3号甲”运载火箭的动力是高氯酸铵(NH4ClO4)分解所提供的,反应方程式为2NH4ClO4═N2↑+Cl
我国使用“长征3号甲”运载火箭的动力是高氯酸铵(NH4ClO4)分解所提供的,反应方程式为2NH4ClO4═N2↑+Cl2↑+4X+2O2↑
(1)则X的化学式为______
(2)反应生成6.4kg氧气,需要消耗多少千克的高氯酸铵? hw19801年前1
hw19801年前1 -
 peter127 共回答了21个问题
peter127 共回答了21个问题 |采纳率76.2%解题思路:(1)根据质量守恒定律,在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变.
(2)根据氧气的质量结合化学方程式计算出需要消耗的高氯酸铵的质量.(1)通过方程式可知反应物中含有:2个N原子、8个H原子、2个Cl原子、8个O原子;生成物中已经有了2个N原子、2个Cl原子、4个O原子.还缺少8个H原子、4个O原子又因为X前面个数为4,所以化学式中需要有2个H原子、1个O原子,所以化学式为H2O.
故答案为:H2O;
(2)设需要消耗高氯酸铵的质量为x.
2NH4ClO4═N2↑+Cl2↑+4H2O+2O2↑
235 64
x 6.4kg
[235/x=
64
6.4kg]
x=23.5kg
答:需要消耗高氯酸铵的质量为23.5kg.点评:
本题考点: 根据化学反应方程式的计算;质量守恒定律及其应用.
考点点评: 本题主要考查学生运用化学方程式进行计算的能力,解答本题时学生需要根据物质反应时的质量关系,正确的进行解答.1年前查看全部
- 航天飞船常用铝粉与高氯酸铵(NH 4 ClO 4 )的混合物作为固体燃料,高氯酸铵中Cl元素的化合价为 [ &
航天飞船常用铝粉与高氯酸铵(NH 4 ClO 4 )的混合物作为固体燃料,高氯酸铵中Cl元素的化合价为 [ ]A.+1
B.+3
C.+5
D.+7 xmshl021年前1
xmshl021年前1 -
 cjyx1 共回答了13个问题
cjyx1 共回答了13个问题 |采纳率92.3%D1年前查看全部
- 高氯酸铵(NH4CLO4)可做火箭推进剂,当他发生分解反应时,不可能生成
高氯酸铵(NH4CLO4)可做火箭推进剂,当他发生分解反应时,不可能生成
AN2 B.Cl2 C.O2 D.CO2 水衣瓶1年前6
水衣瓶1年前6 -
 wyz_9 共回答了4个问题
wyz_9 共回答了4个问题 |采纳率50%选C1年前查看全部
- 我国使用“长征3号甲”运载火箭的动力是由高氯酸铵(NH 4 ClO 4 )分解所提供的,反应方程式为2NH 4 ClO
我国使用“长征3号甲”运载火箭的动力是由高氯酸铵(NH 4 ClO 4 )分解所提供的,反应方程式为2NH 4 ClO 4
N 2 ↑+Cl 2 ↑+4X↑+2O 2 ↑,则X的化学式为( )△ . A.NH 3 B.H 2 C.H 2 O D.HCl  犀牛人1年前1
犀牛人1年前1 -
 每天来一次 共回答了23个问题
每天来一次 共回答了23个问题 |采纳率82.6%由反应的化学方程式2NH 4 ClO 4
△
.
N 2 ↑+Cl 2 ↑+4X↑+2O 2 ↑,可知:
反应前 反应后
N原子 2 2
H原子 8 0
Cl原子 2 2
O原子 8 4
根据化学变化前后原子的种类、数目不变,可判断生成物X的4个分子中含有8个H原子和4个O原子,则每个X的分子由2个H原子和1个O原子构成,物质X的化学式为H 2 O;
故选C.1年前查看全部
- 高氯酸铵受热分解的化学方程式 配平方法
高氯酸铵受热分解的化学方程式 配平方法
我想知道为什么这样配才可以,我知道网上搜得到答案
为什么4NH4ClO4=2N2+5O2+4HCl+6H2O 要这样配
我想要一步一步的方法,不需要跟我摘抄,大部分我都知道,
我想知道这主要是两个化学价上升,一个化学价下降的情况,就像这道题, reatea20081年前1
reatea20081年前1 -
 qixiaoying 共回答了12个问题
qixiaoying 共回答了12个问题 |采纳率83.3%这个自身氧化还原反应,N之前是负3价,0是副2价,部分上升,cl是正7价,n被氧化升高了3价,cl被还原降了8价,分子中,N跟cl是一比一,那这样就差了,5个价,就需要产生1.25个氧分子,生成水的氧就只有1.5个氧分子,水分子就是1.5
NH4ClO4=0.5N2+1.25O2+HCl+1.5H2O 配平即可1年前查看全部
- 我国使用“长征3号甲”运载火箭的动力是由高氯酸铵(NH 4 ClO 4 )分解所提供的,反应方程式为2 NH 4 ClO
我国使用“长征3号甲”运载火箭的动力是由高氯酸铵(NH 4 ClO 4 )分解所提供的,反应方程式为2 NH 4 ClO 4
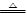 N 2 ↑+Cl 2 ↑+4X↑+2O 2 ↑,则X的化学式为()
N 2 ↑+Cl 2 ↑+4X↑+2O 2 ↑,则X的化学式为()A.NH 3 B.H 2 C.H 2 O D.HCl  阿尻1年前1
阿尻1年前1 -
 haodongxi8 共回答了20个问题
haodongxi8 共回答了20个问题 |采纳率80%C
1年前查看全部
- NH4ClO4(高氯酸铵)可用作火箭推进剂,当它发生分解反应时,不能生成的物质是( )
NH4ClO4(高氯酸铵)可用作火箭推进剂,当它发生分解反应时,不能生成的物质是( )
A. CO2
B. Cl2
C. O2
D. N2 lincy2181年前1
lincy2181年前1 -
 AiNing1126 共回答了21个问题
AiNing1126 共回答了21个问题 |采纳率85.7%解题思路:根据已有的知识进行分析,化学反应前后元素的种类不变,据此解答.NH4ClO4中含有N、H、Cl、O四种元素,则生成的物质也含有这些元素;
A、CO2中含有碳元素,而NH4ClO4中不含有碳元素,故不可能生成二氧化碳,故A错误;
B、NH4ClO4中含有Cl元素,故可能生成氯气,故B正确;
C、NH4ClO4含有O元素,故可能生成氧气,故C正确;
D、NH4ClO4含有N元素,故可能生成氮气,故D正确;
故选A.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题考查了质量守恒定律的应用,完成此题,可以依据已有的知识进行.1年前查看全部
- 著名科学家张存浩获2013年度“国家最高科学技术奖” ,他研究的火箭燃料常用的氧化剂是高氯酸铵(NH 4 ClO 4 )
著名科学家张存浩获2013年度“国家最高科学技术奖” ,他研究的火箭燃料常用的氧化剂是高氯酸铵(NH 4 ClO 4 )。其中氮元素的化合价为-3价,则氯元素的化合价是
A.-1 B.+3 C.+5 D.+7  coffeesweet1年前1
coffeesweet1年前1 -
 chenfan2031 共回答了22个问题
chenfan2031 共回答了22个问题 |采纳率72.7%D
1年前查看全部
- (2014•江西)若名科学家张存浩获2013年度“国家最高科学技术奖”,他研究的火箭燃料常用的氧化剂是高氯酸铵
(2014•江西)若名科学家张存浩获2013年度“国家最高科学技术奖”,他研究的火箭燃料常用的氧化剂是高氯酸铵 (NH4ClO4),其中氮元素的化合价为-3价,则氯元素的化合价是( )
A.-1
B.+3
C.+5
D.+7 云飞度1年前1
云飞度1年前1 -
 antoniatoni 共回答了18个问题
antoniatoni 共回答了18个问题 |采纳率94.4%解题思路:根据在化合物中正负化合价代数和为零,结合高氯酸铵的化学式进行解答本题.氮元素的化合价为-3价,氢元素显+1价,氧元素显-2价,设氯元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(-3)+(+1)×4+x+(-2)×4=0,则x=+7价.
故选:D.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度不大,掌握利用化合价的原则(化合物中正负化合价代数和为零)计算指定元素的化合价的方法即可正确解答本题.1年前查看全部
- 航天飞船常用铝粉与高氯酸铵(NH4ClO4)的混合物作为固体燃料,高氯酸铵中Cl元素的化合价为______.
 lap98181年前2
lap98181年前2 -
 steven_hua 共回答了16个问题
steven_hua 共回答了16个问题 |采纳率81.3%解题思路:根据在化合物中正负化合价代数和为零,进行解答.根据在化合物中正负化合价代数和为零,可得高氯酸铵中Cl元素的化合价为:(+1)+x+(-2)×4=0,
则 x=+7.
故答案为:+7.点评:
本题考点: 有关化学式的计算和推断;常见元素与常见原子团的化合价.
考点点评: 本题考查学生根据在化合物中正负化合价代数和为零计算指定元素化合价的解题能力.1年前查看全部
- 混合气体的相对分子质量计算题1.在高温下,高氯酸铵发生分解反应:2NH4ClO4 N2↑+Cl2↑+2O2↑+4H2O↑
混合气体的相对分子质量计算题
1.在高温下,高氯酸铵发生分解反应:2NH4ClO4 N2↑+Cl2↑+2O2↑+4H2O↑
其气态生成物组成的混合气体的平均相对分子质量是( )
A.40.75 B.29.375 C.14.69 D.无法确定
要过程,谢谢 周秘1年前2
周秘1年前2 -
 cdrzgz 共回答了17个问题
cdrzgz 共回答了17个问题 |采纳率82.4%其平均相对分子质量=气体总质量/气体总物质的量,该题中因是在高温下,故生成的水也是气态,(MN2+MCI2+2*MO2+4*MH2O)/(1+1+2+4)=(28+71+64+72)/8=29.375;
选B1年前查看全部
- 高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取
NaClO4(aq)+NH4Cl(aq)
NH4ClO4(aq)+NaCl(aq)90℃ .
(1)若NH4Cl用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是______.
(2)反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解度曲线见图1).从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)______、干燥.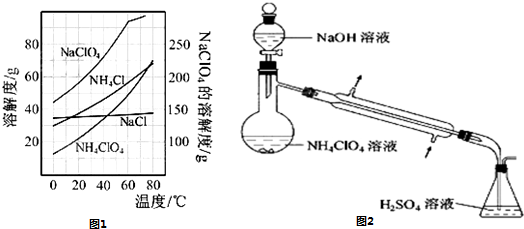
(3)样品中NH4ClO4的含量可用蒸馏法进行测定,蒸馏装置如图10所示(加热和仪器固定装置已略去),实验步骤如下:
步骤1:按图2所示组装仪器,检查装置气密性.
步骤2:准确称取样品a g(约0.5g)于蒸馏烧瓶中,加入约150mL水溶解.
步骤3:准确量取40.00mL约0.1mol/L H2SO4溶解于锥形瓶中.
步骤4:经滴液漏斗向蒸馏瓶中加入20mL3mol/L NaOH溶液.
步骤5:加热蒸馏至蒸馏烧瓶中剩余约100mL溶液.
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中.
步骤7:略
步骤8:略
①步骤4中,应先______,再______;
②步骤1~7中确保生成的氨被稀硫酸完全吸收的实验是______;
(填写步骤号)______;
③本实验需要配制一定物质的量浓度的硫酸溶液,配制过程中,将蒸馏水注入容量瓶瓶颈刻度线下1-2厘米时,下面的操作是:______. 雪浪花L1年前1
雪浪花L1年前1 -
 DDmars 共回答了22个问题
DDmars 共回答了22个问题 |采纳率90.9%解题思路:(1)反应温度较低,氨气与浓盐酸反应放出热量;
(2)由图可知,NH4ClO4的溶解度受温度影响很大,NaCl溶解度受温度影响不大,NH4Cl、NaClO4的溶解度受温度影响也很大,但相同温度下,它们溶解度远大于NH4ClO4,故采取蒸发浓缩,冷却结晶,过滤,并用冰水洗涤,减少损失;
(3)①依据分液漏斗滴加溶液的基本操作分析,需要保持内外压强相通;
②为确保生成的氨被稀硫酸完全吸收,应气密性好,尽可能反应完全,并冲洗冷凝管附着的氨水;
③依据配置溶液的操作步骤分析,最后用胶头滴管滴加定容,摇匀得到所配制的溶液.(1)氨气与浓盐酸反应放出热量,反应需要温度较低,故NH4Cl用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,
故答案为:氨气与浓盐酸反应放出热量;
(2)由图可知,NH4ClO4的溶解度受温度影响很大,NaCl溶解度受温度影响不大,NH4Cl、NaClO4的溶解度受温度影响也很大,但相同温度下,它们溶解度远大于NH4ClO4,故从混合溶液中获得较多NH4ClO4晶体的实验操作依次为:蒸发浓缩,冷却结晶,过滤,并用冰水洗涤,减少损失,
故答案为:蒸发浓缩,冷却结晶,过滤,冰水洗涤;
(3)①分液漏斗滴加溶液需要保持内外压强相通,使液体顺利留下,将分液漏斗颈上的玻璃塞打开,将分液漏斗下面的活塞拧开;
故答案为:将分液漏斗颈上的玻璃塞打开,将分液漏斗下面的活塞拧开;
②为确保生成的氨被稀硫酸完全吸收,应气密性好,尽可能反应完全,并冲洗冷凝管附着的氨水,为确保生成的氨被稀硫酸完全吸收的实验步骤为:1,5,6,
故答案为:1,5,6;
③配制一定物质的量浓度的硫酸溶液,配制过程中,将蒸馏水注入容量瓶瓶颈刻度线下1-2厘米时,用NaOH标准溶液标定H2SO4溶液的浓度,改用胶头滴管滴加蒸馏水至液面与刻度线相切,盖好瓶塞,反复上下颠倒,摇匀;
故答案为:改用胶头滴管滴加蒸馏水至液面与刻度线相切,盖好瓶塞,反复上下颠倒,摇匀;点评:
本题考点: 探究物质的组成或测量物质的含量;判断简单分子或离子的构型.
考点点评: 本题以复合火箭推进剂的重要成分制取和分析为背景的综合实验题,涉及理论分析、阅读理解、读图看图、含量测定等多方面内容,考查学生对综合实验处理能力,难度中等.1年前查看全部
- 航天飞船常用铝粉与高氯酸铵(NH4ClO4)的混合物作为固体燃料,高氯酸铵中Cl元素的化合价为______.
 chm19781年前1
chm19781年前1 -
 jennytan 共回答了27个问题
jennytan 共回答了27个问题 |采纳率81.5%解题思路:根据在化合物中正负化合价代数和为零,进行解答.根据在化合物中正负化合价代数和为零,可得高氯酸铵中Cl元素的化合价为:(+1)+x+(-2)×4=0,
则 x=+7.
故答案为:+7.点评:
本题考点: 有关化学式的计算和推断;常见元素与常见原子团的化合价.
考点点评: 本题考查学生根据在化合物中正负化合价代数和为零计算指定元素化合价的解题能力.1年前查看全部
- 哥伦比亚号航天飞机曾用金属铝和高氯酸铵(NH4ClO4)的混合物作为固体燃料.加热铝粉使其被氧气氧化,放出大量的热,促使
哥伦比亚号航天飞机曾用金属铝和高氯酸铵(NH4ClO4)的混合物作为固体燃料.加热铝粉使其被氧气氧化,放出大量的热,促使混合物中的高氯酸铵受热分解,同时生成四种气体:两种气体是空气中的主要成分,一种气体是Cl2,还有一种气体是化合物(常温下是液态),因而产生巨大的推动力.试写出其中涉及的化学方程式:
(1)铝粉被氧气氧化成三氧化二铝:4Al+3O2
2Al2O3△ .4Al+3O2;
2Al2O3△ .
(2)高氯酸铵受热分解:2NH4ClO4
2O2↑+N2↑+Cl2↑+4H2O△ .2NH4ClO4.
2O2↑+N2↑+Cl2↑+4H2O△ . 百凌沙1年前1
百凌沙1年前1 -
 sanderluohao 共回答了24个问题
sanderluohao 共回答了24个问题 |采纳率91.7%解题思路:首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可.(1)加热铝粉使其被氧气氧化,反应的化学方程式是为:.
(2)高氯酸铵受热分解,同时生成四种气体:两种气体是空气中的主要成分(氮气和氧气),一种气体是Cl2,还有一种气体是化合物(常温下是液态,是水),反应的化学方程式为:2NH4ClO4
△
.
2O2↑+N2↑+Cl2↑+4H2O.
故答案为:(1)4Al+3O2
△
.
2Al2O3;(2)2NH4ClO4
△
.
2O2↑+N2↑+Cl2↑+4H2O.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.1年前查看全部
- 航天飞船常用铝粉与高氯酸铵(NH4ClO4)的混合物作为固体燃料,高氯酸铵中Cl元素的化合价是( )
航天飞船常用铝粉与高氯酸铵(NH4ClO4)的混合物作为固体燃料,高氯酸铵中Cl元素的化合价是( )
A.+1
B.+3
C.+5
D.+7 怕起名1年前1
怕起名1年前1 -
 wld64768196 共回答了21个问题
wld64768196 共回答了21个问题 |采纳率95.2%解题思路:根据化合物中正负化合价代数和为0,进行解答.令高氯酸铵中Cl元素的化合价为x价,根据在化合物中正负化合价代数和为0,则:
(+1)+x+(-2)×4=0,解得x=+7;
故选:D.点评:
本题考点: 根据化学式判断化合价.
考点点评: 本题考查学生根据化学式计算元素化合价,难度较小,清楚物质中常见元素、原子团的化合价是关键,根据化合物中正负化合价代数和为0计算.1年前查看全部
- 已知高氯酸铵是火箭的一种燃料,加热时发生反应:NH 4 ClO 4 →N 2 ↑+H 2 O↑+Cl 2 ↑+O 2 ↑
已知高氯酸铵是火箭的一种燃料,加热时发生反应:NH 4 ClO 4 →N 2 ↑+H 2 O↑+Cl 2 ↑+O 2 ↑(方程式未配平),该反应放出大量的热.下列有关叙述不正确的是( ) A.该反应的氧化产物只有氮气 B.该反应是一个焓减和熵增的过程 C.该反应中被还原的元素位于元素周期表中第三周期第VIIA族 D.该反应属于分解反应,又属于氧化还原反应  sno148863841年前1
sno148863841年前1 -
 200652SY 共回答了16个问题
200652SY 共回答了16个问题 |采纳率100%A、化合价升高的有氮元素、氧元素,氧化产物为氮气和氧气,故A错误;
B、反应是放热反应,生成的物质能量低于反应物的能量,故是焓减小的反应,反应是气体体积增大的反应,是熵增大的反应,故B正确;
C、被还原的元素为氯元素,位于元素周期表中第三周期第VIIA族,故C正确;
D、该反应符合分解反应概念,又符合氧化还原反应概念,故D正确;
故选A.1年前查看全部
- 世界瞩目的“嫦娥一号”月球探测卫星于2007年10月24日在西昌卫星发射中心成功发射升空,卫星运载火箭的动力由高氯酸铵(
世界瞩目的“嫦娥一号”月球探测卫星于2007年10月24日在西昌卫星发射中心成功发射升空,卫星运载火箭的动力由高氯酸铵(NH 4 ClO 4 )分解提供,高氯酸铵分解有可能排入大气的物质是( ) A.H 2 O B.SO 2 C.CO 2 D.CO  大浪淘沙331年前1
大浪淘沙331年前1 -
 李芊芊 共回答了17个问题
李芊芊 共回答了17个问题 |采纳率88.2%因为高氯酸铵(NH 4 ClO 4 )中无S、C元素,所以根据质量守恒定律的元素守恒可知,高氯酸铵分解不可能排入大气的物质是SO 2 、CO 2 、CO.
故选A.1年前查看全部
- 高氯酸铵受热分解 如果生产1molcl2则转移电子数为?方程式 2NH4ClO4=加热=N2+2O2+Cl2+4H2O)
高氯酸铵受热分解 如果生产1molcl2则转移电子数为?方程式 2NH4ClO4=加热=N2+2O2+Cl2+4H2O)
电子是怎么转移的! 天才和笨蛋1年前0
天才和笨蛋1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 高氯酸铵(NH 4 ClO 4 )是复合火箭推进剂的重要成分,实验室可通过下列反应制取
高氯酸铵(NH 4 ClO 4 )是复合火箭推进剂的重要成分,实验室可通过下列反应制取 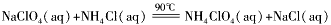
(1)若NH 4 Cl用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是________________。
(2)反应得到的混合溶液中NH 4 ClO 4 和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解度曲线见下图)。从混合溶液中获得较多NH 4 ClO 4 晶体的实验操作依次为(填操作名称)_____________干燥。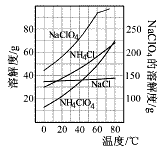
(3)样品中NH 4 ClO 4 的含量可用蒸馏法进行测定,蒸馏装置如图所示(加热和仪器固定装代已略去),实验步骤如下: 
步骤1:按上图所示组装仪器,检查装置气密性。
步骤2:准确称取样品a g(约0.5g)于蒸馏烧瓶中,加入约150mL水溶解。
步骤3:准确量取40.00mL约0.1mol/L H 2 SO 4 溶解于锥形瓶中。
步骤4:经滴液漏斗向蒸馏瓶中加入20mL 3mol/LNaOH溶液。
步骤5:加热蒸馏至蒸馏烧瓶中神域约100mL溶液。
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤7:向锥形瓶中加入酸碱指示剂,用c mol/L NaOH标准溶液滴定至终点,消耗NaOH标准溶液V1mL。
步骤8:将实验步骤1-7重复2次
①步骤3中,准确量取40.00ml H 2 SO 4 溶液的玻璃仪器是________。
②步骤1-7中确保生成的氨被稀硫酸完全吸收的实验是_____(填写步骤号)。
③为获得样品中NH 4 ClO 4 的含量,还需补充的实验是_____________。 helovexing1年前1
helovexing1年前1 -
 mobai666 共回答了14个问题
mobai666 共回答了14个问题 |采纳率92.9%(1)氨气与浓盐酸反应放出热量
(2)蒸发浓缩,冷却结晶,过滤,冰水洗涤
(3)①酸式滴定管;②1,5,6;③用NaOH标准溶液标定H 2 SO 4 溶液的浓度(或不加高氯酸铵样品,保持其他条件相同,进行蒸馏和滴定实验)1年前查看全部
- 我国使用“长征3号甲”运载火箭的动力是由高氯酸铵(NH4ClO4)分解所提供的,反应方程式为2NH4ClO4
我国使用“长征3号甲”运载火箭的动力是由高氯酸铵(NH4ClO4)分解所提供的,反应方程式为2NH4ClO4
N2↑+Cl2↑+4X↑+2O2↑,则X的化学式为______;该基本反应类型为______.△ . 唛骒砜1年前1
唛骒砜1年前1 -
 西桐 共回答了19个问题
西桐 共回答了19个问题 |采纳率84.2%解题思路:根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变.通过方程式可知反应物中含有:2个N原子、8个H原子、2个Cl原子、8个O原子;生成物中已经有了2个N原子、2个Cl原子、4个O原子.还缺少8个H原子、4个O原子又因为X前面个数为4,所以化学式中需要有2个H原子、1个O原子,所以化学式为H2O.该反应符合“一变多”,为分解反应.
故答案为:H2O;分解反应点评:
本题考点: 质量守恒定律及其应用;反应类型的判定.
考点点评: 本题主要考查学生运用质量守恒定律进行推断的能力,了解反应前后各原子个数不变.1年前查看全部
- 高氯酸铵(NH4ClO4)在高压、450摄氏度时能迅速分解,生成水蒸气、氯化氢和另外两种单质气体,求这个反应的化学方程式
高氯酸铵(NH4ClO4)在高压、450摄氏度时能迅速分解,生成水蒸气、氯化氢和另外两种单质气体,求这个反应的化学方程式?
 八章1年前4
八章1年前4 -
 diyinl 共回答了20个问题
diyinl 共回答了20个问题 |采纳率95%4NH4ClO4=高压、450℃=6H2O↑+4HCl↑+2N2↑+5O2↑1年前查看全部
- 在150度时,加热高氯酸铵发生分解反应2NH4CLO4====N2+CL2+2O2+4H2O其气态生成物组成的混合气的平
在150度时,加热高氯酸铵发生分解反应2NH4CLO4====N2+CL2+2O2+4H2O其气态生成物组成的混合气的平均相对分子质量为?
答案是2*117.5/8 snake群1年前2
snake群1年前2 -
 老乱 共回答了19个问题
老乱 共回答了19个问题 |采纳率100%不妨假设生成物的物质的量分别是a a 2a 4a 那么质量分别是28a 71a 64a 72a
平均相对分子质量在数值上等于气体的平均摩尔质量,即Ar=M=m/n=(28+71+64+72)a/(1+1+2+4)a=235/81年前查看全部
- (2008•兰州)我国使用“长征3号甲”运载火箭将“嫦娥Ⅰ号”送上月球.该运载火箭的动力是由高氯酸铵(NH4ClO4)分
(2008•兰州)我国使用“长征3号甲”运载火箭将“嫦娥Ⅰ号”送上月球.该运载火箭的动力是由高氯酸铵(NH4ClO4)分解所提供的.其原理如下,2NH4ClO4
A.H2O
B.HCl
C.NH3
D.H2 街头小报ww1年前1
街头小报ww1年前1 -
 Amanda-hoo 共回答了22个问题
Amanda-hoo 共回答了22个问题 |采纳率90.9%解题思路:根据化学变化前后原子的种类、数目不变,由反应的化学方程式2NH4ClO4 △. N2↑+Cl2↑+4R↑+2O2↑,推断反应中生成物X的分子构成,然后确定R物质的化学式.由反应的化学方程式2NH4ClO4
△
.
N2↑+Cl2↑+4R↑+2O2↑,可知:
反应前 反应后
N原子 2 2
H原子 8 0
Cl原子 2 2
O原子 8 4
根据化学变化前后原子的种类、数目不变,可判断生成物X的4个分子中含有8个H原子和4个O原子,则每个R的分子由2个H原子和1个O原子构成,物质R的化学式为H2O;
故选A.点评:
本题考点: 质量守恒定律及其应用;有关化学式的计算和推断.1年前查看全部
- 2007年10月24日,我国“嫦娥一号”探月卫星发射成功,卫星运载火箭的动力由高氯酸铵(NH4ClO4)分解提供.高氯酸
2007年10月24日,我国“嫦娥一号”探月卫星发射成功,卫星运载火箭的动力由高氯酸铵(NH4ClO4)分解提供.高氯酸铵分解可能排入大气中的物质是( )
A.CO2
B.CO
C.SO2
D.H2O 低调的烟1年前1
低调的烟1年前1 -
 luxenous 共回答了22个问题
luxenous 共回答了22个问题 |采纳率90.9%解题思路:根据质量守恒定律:化学反应前后元素不变,利用分解反应的特征,由物质的组成判断高氯酸铵(NH4ClO4)后可能排入大气的物质.由质量守恒定律:化学反应前后元素不变;高氯酸铵的化学式NH4ClO4,该物质由N、H、O、Cl四种元素组成,其组成中不含C、S元素;根据化学变化前后元素种类不变,而分解反应的反应物只有一种,则可判断高氯酸铵分解不可...
点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题难度不大,考查质量守恒定律应用,掌握质量守恒定律并能灵活运用是正确解答本题的关键.1年前查看全部
- 高氯酸铵高温分解的化学式生成水 氮气 氯化氢 和氧气
 bxxr01年前1
bxxr01年前1 -
 柳树树树 共回答了18个问题
柳树树树 共回答了18个问题 |采纳率94.4%4 6 2 4 5
怎么不给分啊?1年前查看全部
- (2010•河东区一模)“神舟七号”载人飞船所用的固体燃料是铝粉和高氯酸铵的混合物.发射时,点燃铝粉产生大量的热引发高氯
(2010•河东区一模)“神舟七号”载人飞船所用的固体燃料是***和高氯酸铵的混合物.发射时,点燃***产生大量的热引发高氯酸铵发生如下反应:2nh4clo4
n2↑+2o2↑+cl2↑+4x;则x的化学式为______.高温 . 长尾兔1年前1
长尾兔1年前1 -
 geminigod 共回答了22个问题
geminigod 共回答了22个问题 |采纳率90.9%解题思路:根据质量守恒定律的微观解释:化学反应前后原子的种类和数目不变.可知在化学反应方程式中,反应物和生成物中所含的原子的种类和数目相同.由此可推断化学反应方程式中反应物或生成物的化学式.根据质量守恒定律和化学方程式可得,X的化学式中应含有N的个数为:(2-2)÷4=0,应含有H的个数为:(2×4)÷4=2,应含有Cl的个数为:(2-2)÷4=0,应含有O的个数为:(2×4-2×2)÷4=1.故可判断X的化学式为:H2O;
故答案为:H2O.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题主要考查学生运用质量守恒定律推断化学式的能力,难度不大.1年前查看全部
- NH^4ClO^4(高氯酸铵)可用作火箭推进剂,当它发生分解反应时,不可能生成的物质是
NH^4ClO^4(高氯酸铵)可用作火箭推进剂,当它发生分解反应时,不可能生成的物质是
A.CO^2 B.Cl^2
C.O^2 D.N^2 我的未来61年前1
我的未来61年前1 -
 爱留不留 共回答了26个问题
爱留不留 共回答了26个问题 |采纳率96.2%A.哪里来的碳元素= =1年前查看全部
- 高氯酸铵受热分解的化学方程式是什么
 meryly1年前1
meryly1年前1 -
 蜜_蜜 共回答了15个问题
蜜_蜜 共回答了15个问题 |采纳率100%回答:魔法师
学长
5月2日 18:36 1、NaOH+HCl=NaCl+H2O
2、当然要化简为最简整数比7:5:3:6
3、同样要化简为最简整数比84:5:42:96
一般这种比例的题都要化简为最简整数比.1年前查看全部
- 高氯酸铵受热分解化学方程式
 tianqiming1年前1
tianqiming1年前1 -
 彼岸花118 共回答了15个问题
彼岸花118 共回答了15个问题 |采纳率93.3%2NH4ClO4=加热=N2+2O2+Cl2+4H2O1年前查看全部
- 高氯酸铵在强热条件下分解,生成氮气、氧气、氯化氢和水。反应中生成的还原产物和氧化产物的物质的量之比是
高氯酸铵在强热条件下分解,生成氮气、氧气、氯化氢和水。反应中生成的还原产物和氧化产物的物质的量之比是
A.1∶2 B.5∶4 C.4∶7 D.7∶4  tigergege1年前0
tigergege1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- NH 4 ClO 4 (高氯酸铵可用作火箭推进剂,当它发生分解反应时,不能生成的物质是( ) A.CO 2 B.Cl
NH 4 ClO 4 (高氯酸铵可用作火箭推进剂,当它发生分解反应时,不能生成的物质是( ) A.CO 2 B.Cl 2 C.O 2 D.N 2  Minnie_Zhang20071年前1
Minnie_Zhang20071年前1 -
 爱在东北 共回答了17个问题
爱在东北 共回答了17个问题 |采纳率88.2%由质量守恒定律:化学反应前后元素不变;高氯酸铵的化学式NH 4 ClO 4 ,该物质由N、H、O、Cl四种元素组成,其组成中不含C元素;根据化学变化前后元素种类不变,而分解反应的反应物只有一种,则可判断高氯酸铵分解不可能产生由C、O元素组成的CO 2 .
故选A.1年前查看全部
- 国家环境保护总局网公布了”141种高污染、高环境风险”的产品名录,包括43号氰化钠、46号氢氰酸、55号高氯酸铵、57号
国家环境保护总局网公布了”141种高污染、高环境风险”的产品名录,包括43号氰化钠、46号氢氰酸、55号高氯酸铵、57号硫化钠等.下列说法不正确的是( )
A.已知常温下0.1 mol•L-1NaCN溶液的pH=12,则已水解的CN-约占总数的10%
B.已知25℃时NH4CN溶液显碱性,则25℃时的电离常数K(NH3•H2O)>K(HCN)
C.NH4ClO4溶液中,c(Cl
)>c(NO −4
)>c(OH-)>c(H+)H +4
D.欲使0.1 mol•L-1Na2S溶液中
更接近2,可加入适量KOHc(Na)+ c(S2−)  rrbigl1年前1
rrbigl1年前1 -
 rain0828 共回答了21个问题
rain0828 共回答了21个问题 |采纳率85.7%解题思路:A、由溶液中pH计算氢离子浓度,结合溶液中离子积常数计算氢氧根离子浓度,计算分析水解的百分比;
B、NH4CN溶液显碱性说明CN-离子水解程度大于NH4+离子,依据盐类水解规律分析判断;
C、高氯酸根离子是强酸酸根离子,铵根水解显酸性;
D、硫离子水解,加入碱抑制硫离子的水解.A、已知常温下0.1 mol•L-1NaCN溶液的pH=12,溶液中c(H+)=10-12mol/L;c(OH-)=10-2mol/L;则已水解的CN-约占总数的10%;水解的CN-离子和氢氧根离子相等,已水解的CN-约占总数的10%,故A正确;
B、已知25℃时NH4CN溶液显碱性,说明CN-离子水解程度大于NH4+离子,HCN酸性弱,电离程度小,则25℃时的电离常数K(NH3•H2O)>K(HCN),故B正确;
C、NH4ClO4溶液中高氯酸根离子是强酸酸根离子,铵根水解显酸性,c(ClO4-)>c(NH4+)>c(H+)>c(OH-),故C错误;
D、硫离子水解,加入碱抑制硫离子的水解溶液中的钠离子和硫离子浓度之比接近2,故D正确;
故选C.点评:
本题考点: 盐类水解的原理.
考点点评: 本题考查了溶液酸碱性的分析判断,溶液中离子积计算应用,水解和电离程度分析判断,离子浓度大小比较的方法,题目难度中等.1年前查看全部
- NH4CLO4(高氯酸铵)燃烧后发生分解反应,不可能生成哪些物质
NH4CLO4(高氯酸铵)燃烧后发生分解反应,不可能生成哪些物质
A CO2
B CL2
C O2
D N2 IT倒爷1年前2
IT倒爷1年前2 -
 良木缘妞妞 共回答了17个问题
良木缘妞妞 共回答了17个问题 |采纳率100%选A,根据质量守恒定律,反应前后元素种类不变,高氯酸铵含有N、H、Cl、O四种元素,没有C元素,所以反应后的生成物不会有CO2.1年前查看全部
大家在问
- 11.化简:x(2-x/1)+x^2-2x/x *(x^2-4) [步骤写全】 分式的乘除那一节的题目
- 2一道小学应用题:谢谢帮助:奶奶买来一箱梨和一箱苹果,梨的质量是苹果的2倍,已知苹果的价钱是是每千克4元,重量是a千克,梨
- 3语文厉害的来回答 1.读了《孙权劝学》与《诫子书》后,你收到了怎样的启发?请就其中一个方面谈谈自己的认识.2.几千年前,
- 4修一条路,当修到这条路的[3/8]时,离中点还有30米,这条路全长有多少米?
- 5怎么求工程问题啊,.?数学
- 6若A与B互斥,且P(A)=P(B)=0.1,则P(AB)=?(AB上面有一个横杠)
- 7受自然环境的影响.我国北方地区、南方地区的人们在生产和生活方式上有很大的差异.据此完成4一6题.
- 8我的理想职业 初二英语作文初二让学期的第十单元sctionA中根据3a仿写急需!
- 9英语翻译中国拥有的人口比世界上其他任何一个国家都多
- 10英语翻译
- 113x+40%x=17怎么解
- 12毕淑敏的《提醒幸福》怎样理解文章的标题?求学霸解答。
- 13can you help me?yes.l am(c开头) 括号添什么
- 14Mary lived in Japan when she was young.So she can speak e___
- 15《乡村四月》的诗意乡村四月的词意是什么?

