常见酸的酸性与还原性比较
 倚门望断2022-10-04 11:39:542条回答
倚门望断2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 暖暖生于1982 共回答了24个问题
暖暖生于1982 共回答了24个问题 |采纳率100%- HClO4>H2SO4>HNO3
HCl - 1年前
 vincentcarter 共回答了10个问题
vincentcarter 共回答了10个问题 |采纳率- 1 2号羟基是常见的羟基 故无明显酸性 问题就在3 4号了 三和四之间隔着一个碳碳双键 而在看看右边 有一个羰基!! 羰基的氧是强吸电子的 故双键上的
- 1年前
相关推荐
- 谁有常见酸和碱的强弱性顺序?~ 急需!~~~
谁有常见酸和碱的强弱性顺序?~ 急需!~~~
高中化学啊~~~ 越全面越好~~~~
谢谢啦~~~~ kuyosa1年前1
kuyosa1年前1 -
 情感困扰 共回答了20个问题
情感困扰 共回答了20个问题 |采纳率90%中学常见弱酸强弱记诵口诀(从前到后酸性逐渐变弱,只考虑第一级电离的比较)
亚硫磷酸氢氟酸,亚硝甲酸冰醋酸,碳酸氢硫氢氰酸.
即H2SO3>H3PO4>HF>HNO2>HCOOH>CH3COOH>H2CO3>H2S>HCN
其他常见酸如HClO4,H2SO4,HNO3,HI,HBr都是强酸,强酸在水里视作酸性等同(水的拉平效应,使得强酸一级电离完全)
.
资料很全1年前查看全部
- (2007•番禺区一模)某常见酸的实验变化如下:
(2007•番禺区一模)某常见酸的实验变化如下:

请写出①②的化学方程式:
①______.
②______. 南大人1年前1
南大人1年前1 -
 爱上雷丝的小猪 共回答了16个问题
爱上雷丝的小猪 共回答了16个问题 |采纳率93.8%解题思路:根据B为蓝色溶液可以知道B是铜盐的溶液,能与氧化铜生成铜盐的物质有盐酸、硝酸、硫酸等酸,但是反应②中铜盐B与X溶液反应生成了白色沉淀和蓝色沉淀,根据所学的知识能够同时生成两种沉淀的铜盐应该是硫酸铜,所以A应该为硫酸,那么生成的白色沉淀C为硫酸钡,而蓝色沉淀D为氢氧化铜,所以X为氢氧化钡,代入验证符合题意,可以据此答题.根据B为蓝色溶液可以知道B是铜盐的溶液,能与氧化铜生成铜盐的物质有盐酸、硝酸或是硫酸,但是反应②中铜盐B与X溶液反应生成了白色沉淀和蓝色沉淀,根据所学的知识能够同时生成两种沉淀的铜盐应该是硫酸铜,所以A应该为硫酸,那么生成的白色沉淀C为硫酸钡,而蓝色沉淀D为氢氧化铜,所以X为氢氧化钡,所以反应①为氧化铜和硫酸的反应,而反应②是硫酸铜和氢氧化钡的反应,可以分别写出这两个反应的化学方程式.
故答案为:①H2SO4+CuO═CuSO4+H2O;
②CuSO4+Ba(OH)2═Cu(OH)2↓+BaSO4↓.点评:
本题考点: 物质的鉴别、推断;书写化学方程式、文字表达式、电离方程式.
考点点评: 利用物质的特性找准解题的突破口,然后利用给突破口进行顺推、逆推或两边推的方法,完成对各物质的分析,然后再进行解答,是解图框型推断题的方法.记住常见的有颜色的盐溶液:铜盐溶液呈蓝色、铁盐溶液呈棕黄色、亚铁盐呈浅绿色等.1年前查看全部
- 初中常见酸、碱、盐如题.要有名称及化学式~如 盐酸(HCl)等
 miao567828bo1年前2
miao567828bo1年前2 -
 鲁叽喳 共回答了23个问题
鲁叽喳 共回答了23个问题 |采纳率95.7%常见的酸有盐酸(HCl)、硫酸(H2SO4)、碳酸(H2CO3)、醋酸(CH3COOH)等.从名称上判断最后一个字都是“酸”,即“某酸”;从结构上看都含有氢元素
常见的碱有氢氧化钠(NaOH)、氢氧化钙(Ca(OH)2)、氢氧化铝(Al(OH)3)、一水合氨(NH3.H2O)等.除一水合氨,从名称上看都叫“氢氧化某”;从结构上看都含有氢氧根(OH)
常见的盐(NaCl、Na2CO3、CuSO4)1年前查看全部
- 谁能给一个高中化学常见酸的酸性强弱顺序
 龙吐HUI宁1年前2
龙吐HUI宁1年前2 -
 uy79g7ew 共回答了14个问题
uy79g7ew 共回答了14个问题 |采纳率100%高中阶段强酸无须排序(认为是完全电离)
弱酸排序H2SO3>H3PO4>HF>CH3COOH>H2CO3>H2S>HCN>HClO1年前查看全部
- 小红学习酸碱指示剂与常见酸、碱溶液作用后,归纳总结出如图所示的关系。图中A、B、C、D是两圆相交的部分,分别表示指示剂与
小红学习酸碱指示剂与常见酸、碱溶液作用后,归纳总结出如图所示的关系。图中A、B、C、D是两圆相交的部分,分别表示指示剂与酸、碱溶液作用时所显示出的颜色,其中颜色不正确的是 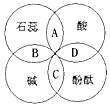 [ ]
[ ]A.紫色
B.蓝色
C.红色
D.无色 xiazxin1年前1
xiazxin1年前1 -
 sunlipingzi_010 共回答了15个问题
sunlipingzi_010 共回答了15个问题 |采纳率93.3%A1年前查看全部
- 归纳总结是学习的重要方法。小明同学在学习“应用广泛的酸、碱、盐”知识后,结合常见酸(HCl、H 2 SO 4 )的性质与
归纳总结是学习的重要方法。小明同学在学习“应用广泛的酸、碱、盐”知识后,结合常见酸(HCl、H 2 SO 4 )的性质与变化绘制出下图。图中“—”两端的物质都能够反应,其中酸碱中和反应生成盐和水,则其他连线的产物也都是盐和水的是 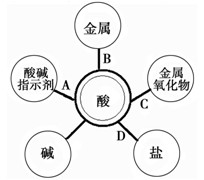
[ ]
A.A
B.B
C.C
D.D 漂rr1年前1
漂rr1年前1 -
 gaomeng521 共回答了23个问题
gaomeng521 共回答了23个问题 |采纳率100%C1年前查看全部
- (2008•花都区一模)某中学九年级A,B两班同学做常见酸和碱与指示剂反应的实验,使用的试剂如图所示.实验后废液分别集中
 (2008•花都区一模)某中学九年级A,B两班同学做常见酸和碱与指示剂反应的实验,使用的试剂如图所示.实验后废液分别集中到废液缸中.某研究小组对此废液进行了检测,结果如下:
(2008•花都区一模)某中学九年级A,B两班同学做常见酸和碱与指示剂反应的实验,使用的试剂如图所示.实验后废液分别集中到废液缸中.某研究小组对此废液进行了检测,结果如下:
A.A班废液中一定含有盐酸
B.废液中一定含有的物质氯化钠
C.B班废液的成分中肯定没有盐酸
D.B班废液中可能含有氢氧化钙 窗外小树1年前1
窗外小树1年前1 -
 爱小球 共回答了14个问题
爱小球 共回答了14个问题 |采纳率85.7%本题应该限制在给定的盐酸、氢氧化钠和氢氧化钙以及酚酞试液中来分析.
A、由于A班试液不变色,说明是向盐酸中滴加了酚酞,所以A班一定使用了盐酸.正确.
B、由于两个班都没有进行药品盐酸和氢氧化钠和氢氧化钙的反应实验,所以不存在氯化钠,错误.
C、B班由于酚酞变红因此溶液显碱性,不可能存在盐酸,正确.
D、B班由于酚酞变红因此溶液显碱性,所以溶液中可能含有氢氧化钠或氢氧化钙或两种都有,所以可能含有氢氧化钙的说法正确.
故选B.1年前查看全部
- 常见酸,碱,盐的溶解性表(20℃) 如何记忆?
 18组合1年前6
18组合1年前6 -
 今天不睡 共回答了11个问题
今天不睡 共回答了11个问题 |采纳率90.9%我们学得是,钾钠铵,硝酸溶(即所有的钾盐、钠盐、硝酸盐都溶于水,);盐酸盐中除银汞(除了氯化银和氯化汞不溶);硫酸盐中不溶有钡铅;碱类溶有钾钠钡钙铵.有这个大概意思,楼主可自行记忆,用长了就记住了.1年前查看全部
- 某化学小组同学进行探究常见酸、碱、盐的性质实验时,发现实验台上放的药品中,有一瓶溶液的试剂瓶未盖瓶盖且标签破损(如图所示
某化学小组同学进行探究常见酸、碱、盐的性质实验时,发现实验台上放的药品中,有一瓶溶液的试剂瓶未盖瓶盖且标签破损(如图所示),他们决定对此进行探究. 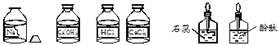
[查阅资料]
①酸、碱、盐的性质实验中用到含钠元素的物质有NaCl、NaOH、Na 2 CO 3
②CaCl 2 溶液呈中性;
③Na 2 CO 3 +CaCl 2 =2NaCl+CaCO 3 ↓
[进行实验]
①甲同学取待测液于试管中,滴加无色酚酞试液后,发现溶液呈红色,由此得出结论:该溶液不可能是______溶液,理由是______.
②乙同学取待测液于试管中,滴加稀盐酸,发现有______现象,由此得出结论:该溶液是Na 2 CO 3 溶液.
③丙同学认为乙同学的结论不严密,因为NaOH露置在空气中,不仅容易吸收______产生潮解现象,还会与CO 2 发生2NaOH+CO 2 =Na 2 CO 3 +H 2 O反应,所有这瓶溶液还可能是部分变质的NaOH溶液.
④经过同学们的讨论后,他们一致认为对这瓶溶液的实际成分,还需要进行如下实验:
试验中设计步骤I的目的是完全除去溶液中的______,避免其对______的检验造成干扰.
[实验结论]通过上述实验证明,该溶液是______. 网络朝阳1年前1
网络朝阳1年前1 -
 踏雪英子 共回答了25个问题
踏雪英子 共回答了25个问题 |采纳率84%【进行实验】①无色酚酞试液在碱性溶液中变红,而氯化钠的水溶液呈中性,不能使酚酞变红,故不会是氯化钠,故填:NaCl,NaCl溶液呈中性,不能使无色酚酞变色;②碳酸钠能与盐酸女翻译生成二氧化碳气体,有气泡产...1年前查看全部
- (2008•花都区一模)某中学九年级A,B两班同学做常见酸和碱与指示剂反应的实验,使用的试剂如图所示.实验后废液分别集中
 (2008•花都区一模)某中学九年级A,B两班同学做常见酸和碱与指示剂反应的实验,使用的试剂如图所示.实验后废液分别集中到废液缸中.某研究小组对此废液进行了检测,结果如下:
(2008•花都区一模)某中学九年级A,B两班同学做常见酸和碱与指示剂反应的实验,使用的试剂如图所示.实验后废液分别集中到废液缸中.某研究小组对此废液进行了检测,结果如下:
请你根据实验现象判断,对该废液的成分的说法错误的是( )废液来源 检测方法和结果 A班 观察废液呈无色 B班 观察废液呈红色
A.A班废液中一定含有盐酸
B.废液中一定含有的物质氯化钠
C.B班废液的成分中肯定没有盐酸
D.B班废液中可能含有氢氧化钙 luoxc8881年前1
luoxc8881年前1 -
 ywgdm 共回答了22个问题
ywgdm 共回答了22个问题 |采纳率90.9%解题思路:酚酞与酸性溶液不变色中性也不变色,遇碱性溶液会变红色,利用此知识解决问题.本题应该限制在给定的盐酸、氢氧化钠和氢氧化钙以及酚酞试液中来分析.
A、由于A班试液不变色,说明是向盐酸中滴加了酚酞,所以A班一定使用了盐酸.正确.
B、由于两个班都没有进行药品盐酸和氢氧化钠和氢氧化钙的反应实验,所以不存在氯化钠,错误.
C、B班由于酚酞变红因此溶液显碱性,不可能存在盐酸,正确.
D、B班由于酚酞变红因此溶液显碱性,所以溶液中可能含有氢氧化钠或氢氧化钙或两种都有,所以可能含有氢氧化钙的说法正确.
故选B.点评:
本题考点: 酸碱指示剂及其性质;酸、碱、盐的鉴别.
考点点评: 此题是一道废液处理的题目,解题的关键是利用实验的现象对情况进行分析,属基础性知识考查题.1年前查看全部
- 某班甲、乙两组同学分别作常见酸和碱与指示剂反应的实验,使用的试剂有稀盐酸、稀硫酸、氢氧化钠溶液和酚酞试液.实验后废液分别
某班甲、乙两组同学分别作常见酸和碱与指示剂反应的实验,使用的试剂有稀盐酸、稀硫酸、氢氧化钠溶液和酚酞试液.实验后废液分别集中到各组的一个废液缸中.研究小组对两个组的废液进行检测,结果如下表.下列说法错误的是(不考虑酚酞和水)( )
废液来源 甲组 乙组 检测方法与结果 观察废液呈无色 观察废液呈红色
A. 甲组废液中一定含有稀盐酸和稀硫酸
B. 乙组废液中一定含有氢氧化钠
C. 直接将甲组的废液排入铸铁管下水道,可能会腐蚀铸铁水管
D. 将两组的废液处理后再排放,防止污染 2qg1vn9aylin1gs1年前1
2qg1vn9aylin1gs1年前1 -
 ty_love123 共回答了18个问题
ty_love123 共回答了18个问题 |采纳率100%解题思路:根据表格内容结合酚酞的变色情况可知,甲组溶液可能为酸性或中性,乙组溶液呈碱性.A、甲组废液为无色,则甲组废液可能呈中性,不一定含有盐酸或硫酸,故A错误;
B、乙组废液呈红色,说明乙组废液为碱性,一定含有氢氧化钠,故B正确;
C、甲组废液为无色,则甲组废液可能呈酸性,直接将甲组的废液排入铸铁管下水道,可能会腐蚀铸铁水管,故C正确;
D、甲组废液为无色,则甲组废液可能呈酸性,乙组废液呈红色,说明乙组废液为碱性,将两组的废液处理后再排放,可以防止污染,故D正确,
故选A.点评:
本题考点: 酸、碱、盐的鉴别;酸碱指示剂及其性质.
考点点评: 本题考查了混合物组成的推断以及酸碱指示剂的应用,完成此题,可以依据物质间的反应以及已有的知识进行.1年前查看全部
- 写出15种常见酸的化学式
 dmmswy1年前0
dmmswy1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 某班同学做常见酸和碱与酚酞反应的实验,本次实验后废液分别集中到一个废液缸中.负责清洁实验室的小雪、小丽、小明和小华四位同
某班同学做常见酸和碱与酚酞反应的实验,本次实验后废液分别集中到一个废液缸中.负责清洁实验室的小雪、小丽、小明和小华四位同学围绕如何处理“废液”展开了讨论:
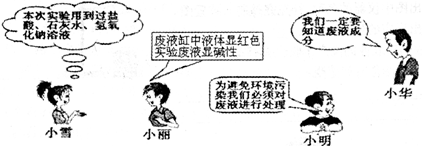
在小组讨论的基础上,三位同学决定围绕废液的成分开展科学探究.
提出问题:该废液的成分有哪些(不考虑酚酞)?
猜想与假设:小雪同学认为:废液为NaCl、NaOH、Ca(OH)2混合溶液
小丽同学认为:废液为NaCl、CaCl2、Ca(OH)2混合溶液
小华同学认为:废液为NaCl、CaCl2、NaOH混合溶液
交流与评价:请你评价小雪和小丽的猜想:
(1)对小雪猜想的评价______;
(2)对小丽猜想的评价______.
活动与探究:小丽同学取废液向其中通入二氧化碳观察到有白色沉淀产生,于是得出该废液中的是NaCl、CaCl2、Ca(OH)2的结论.
解释与结论:小华同学认为小丽同学的实验同样也能证明自己的猜想正确.大家经过分析同意了小华同学的结论,他们分析的原因是 (3)______.经过上述几位同学的共同努力,大家认为废液中溶质的成分还有可能是(4)______结论.
反思应用:小明对废液进行的处理应该是(5)______. hanyanmay1年前1
hanyanmay1年前1 -
 海明胡 共回答了14个问题
海明胡 共回答了14个问题 |采纳率85.7%解题思路:交流与评价:根据盐酸和氢氧化钙反应生成氯化钙和水,盐酸和氢氧化钠反应生成氯化钠和水,若溶液中含有大量的氢氧化钠,那么氯化钙和氢氧化钠就会产生氢氧化钙白色沉淀和氯化钙,因为氢氧化钙微溶,相当于稀盐酸先和氢氧化钙反应解答;
解释与结论:根据二氧化碳和氢氧化钠反应生成碳酸钠,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠;稀盐酸有可能剩余解答;交流与评价:盐酸和氢氧化钙反应生成氯化钙和水,盐酸和氢氧化钠反应生成氯化钠和水;若溶液中含有大量的氢氧化钠,那么氯化钙和氢氧化钠就会产生氢氧化钙白色沉淀,因为氢氧化钙微溶,氢氧化钠和氯化钙不能大量共存;相当于稀盐酸先和氢氧化钙反应,所以所得溶液中肯定有氯化钙,若稀盐酸和氢氧化钙反应完后还有剩余,余下的稀盐酸和氢氧化钠反应生成氯化钠,所以小雪的猜想不正确;小丽的猜想不正确,故答案:(1)不正确;(2)不可能;
解释与结论:碱能是酚酞变红色,氢氧化钠和氢氧化钙都是碱;稀盐酸可能有剩余,故答案:二氧化碳和氢氧化钠反应生成碳酸钠,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠;NaCl、CaCl2、HCl;
反思应用:稀盐酸和氢氧化钠反应生成氯化钠和水,稀盐酸和氢氧化钙反应生成氯化钙和水,先在废液中滴加酚酞呈红色,故答案:滴加酚酞后滴加稀盐酸到红色刚好褪去.点评:
本题考点: 酸、碱性废水的处理;二氧化碳的化学性质;酸碱指示剂及其性质.
考点点评: 本题考查酸和碱之间的反应,要求我们能分情况分析溶液的组成,并对自己的猜想设计实验进行验证.本题主要考查酸碱盐的溶解性、酸碱盐和氧化物之间的反应规律、物质的组成等方面的知识,难度较大.1年前查看全部
- (2006•崇文区二模)某中学初三年级A、B两个班同学分别做常见酸和碱与指示剂反应的实验,使用的试剂如下图所示.实验后废
 (2006•崇文区二模)某中学初三年级A、B两个班同学分别做常见酸和碱与指示剂反应的实验,使用的试剂如下图所示.实验后废液分别集中到各班的一个指定废液缸中.研究小组对两个班的废液进行检测,结果如下表.
(2006•崇文区二模)某中学初三年级A、B两个班同学分别做常见酸和碱与指示剂反应的实验,使用的试剂如下图所示.实验后废液分别集中到各班的一个指定废液缸中.研究小组对两个班的废液进行检测,结果如下表.
废液来源 检测方法与结果 推测废液成分(填物质化学式,酚酞和水不填) A班 观察废液呈红色 废液中含有______ B班 观察废液呈无色,测pH=2 废液中没有______,含有______  liweidatj1年前1
liweidatj1年前1 -
 雨后春笋168号 共回答了16个问题
雨后春笋168号 共回答了16个问题 |采纳率100%解题思路:本题主要探究了酸碱反应的废液,可根据溶液的酸碱性,可判断溶液的中溶质.由题意可知,当硫酸、盐酸与氢氧化钠混合时.硫酸、盐酸分别与氢氧氧化钠反应生成硫酸钠、氯化钠和水.
由于A班观察废液呈红色,则溶液中有剩余的氢氧化钠,则废液中含有:NaCl、Na2SO4、NaOH;
由于B班观察废液呈无色,测pH=2,说明了酸有剩余,则废液中没有NaOH,含有 NaCl、Na2SO4、HCl、H2SO4.
故答为:NaCl、Na2SO4、NaOH;NaOH;NaCl、Na2SO4、HCl、H2SO4.点评:
本题考点: 中和反应及其应用;酸碱指示剂及其性质;溶液的酸碱性与pH值的关系;离子或物质的共存问题.
考点点评: 此题是一道废液处理的题目,解题的关键是利用实验的现象对情况进行分析,属基础性知识考查题.1年前查看全部
- 实验小组的同学研讨初中常见酸、碱、盐之间的反应关系时,做了如下实验,实验中的所用物质均是初中化学常见的,且每一步均有明显
实验小组的同学研讨初中常见酸、碱、盐之间的反应关系时,做了如下实验,实验中的所用物质均是初中化学常见的,且每一步均有明显现象,实验操作及部分现象如图所示.
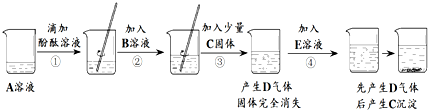
回答下列问题:
(1)A溶液一定呈______性(填“酸”或“中”或“碱”).
(2)气体D的化学式为______.
(3)步骤②的实验现象为______.
(4)E溶液中的溶质可能是______.
(5)B溶液的溶质由两种元素组成,④中产生气体的反应的化学方程式为______.
(6)实验后将盛有C固体烧杯中的上清液取出少量,继续加入E溶液,仍有C固体析出,已知A与E中的阳离子相同,则实验后所得溶液含有的溶质为酚酞和______. bainianyuren1年前1
bainianyuren1年前1 -
 landy0706 共回答了20个问题
landy0706 共回答了20个问题 |采纳率85%解题思路:(1)根据碱遇到酚酞变红进行分析;
(2)根据酸和碳酸盐反应放出二氧化碳进行分析;
(3)根据酸性溶液遇到酚酞试液不变色进行分析;
(4)根据碳酸钠和盐酸反应生成二氧化碳以及和可溶性钙盐反应生成碳酸钙沉淀进行分析;
(5)根据碳酸钠和盐酸反应生成氯化钠、水和二氧化碳进行分析;
(6)根据实验后将盛有C固体烧杯中的上清液取出少量,继续加入E溶液,仍有C固体析出,说明有氯化钙存在,同时有生成的氯化钠和酚酞进行分析.(1)碱性液体能使酚酞变红,所以A溶液一定呈碱性;
(2)酸和碳酸盐反应放出二氧化碳,所以气体D的化学式为:CO2;
(3)酸性溶液遇到酚酞试液不变色,所以步骤②的实验现象为红色液体变为无色;
(4)碳酸钠和酸反应生成二氧化碳,和可溶性钙盐反应生成碳酸钙沉淀,所以E溶液中的溶质可能是:Na2CO3;
(5)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,所以④中产生气体的反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(6)实验后将盛有C固体烧杯中的上清液取出少量,继续加入E溶液,仍有C固体析出,说明有氯化钙存在,同时有生成的氯化钠和酚酞,实验后所得溶液含有的溶质为:NaCl、CaCl2、酚酞.
故答案为:(1)碱;
(2)CO2;
(3)红色液体变为无色;
(4)Na2CO3;
(5)Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(6)NaCl、CaCl2.点评:
本题考点: 物质的鉴别、推断;酸碱指示剂及其性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查了稀盐酸和碳酸钠钠溶液发生反应及其设计实验进行相关方面证明等方面的内容,可以依据酸碱溶液的性质进行.1年前查看全部
- A、B两班同学分别做常见酸和碱反应中和的实验,使用的试剂有:盐酸、氢氧化钠溶液、酚酞试液.实验后废液倒入废液缸中,研究小
A、B两班同学分别做常见酸和碱反应中和的实验,使用的试剂有:盐酸、氢氧化钠溶液、酚酞试液.实验后废液倒入废液缸中,研究小组对两个班的废液进行检测,结果如下:
(1)A班:观察废液呈无色,则废液显______性,再向废液中加Fe若看到______说明显酸性.废液中含______.(酚酞与水除外,下同)
(2)B班:观察废液呈红色推断:废液中没有______,含有______.发生的化学反应是______. 菜刀km1年前1
菜刀km1年前1 -
 有知者有畏78 共回答了21个问题
有知者有畏78 共回答了21个问题 |采纳率90.5%解题思路:根据酚酞变色以及物质间的反应进行分析,盐酸和氢氧化钠能反应生成氯化钠和水,盐酸呈酸性,不能使酚酞变色,氢氧化钠呈碱性,能使酚酞变红,生成的氯化钠呈中性,不能使酚酞变色.(1)盐酸和氢氧化钠能反应生成氯化钠和水,废液呈无色,说明废液呈酸性或中性,若废液呈酸性,加入铁能与铁反应生成氢气,却以本题答案为:酸性或中性,有气泡产生,氯化氢和氯化钠;
(2)废液呈红色,说明废液呈碱性,废液中不含有氯化氢,含有氯化钠和氢氧化钠,所以本题答案为:氯化氢,氯化钠和氢氧化钠,NaOH+HCl═NaCl+H2O.点评:
本题考点: 酸碱指示剂及其性质;酸、碱、盐的鉴别;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了溶液的酸碱性与指示剂的颜色变化的关系,完成此题,可以依据已有的知识进行.1年前查看全部
- 归纳总结是学习的重要方法.小明同学在学习“应用广泛的酸、碱、盐”知识后,结合常见酸(HCl、H2SO4)的性质与变化绘制
归纳总结是学习的重要方法.小明同学在学习“应用广泛的酸、碱、盐”知识后,结合常见酸(HCl、H2SO4)的性质与变化绘制出图.图中“-”两端的物质都能够反应,其中酸碱中和反应生成盐和水,则其他连线的产物也都是盐和水的是( )
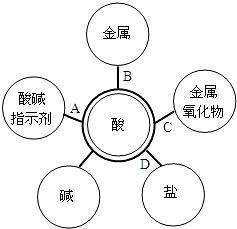 A. A
A. A
B. B
C. C
D. D 九尾狐紫日1年前1
九尾狐紫日1年前1 -
 曼曼OK 共回答了19个问题
曼曼OK 共回答了19个问题 |采纳率94.7%解题思路:根据酸的化学性质,活泼金属与酸反应生成盐和氢气;利用复分解反应发生的条件,酸与碱、金属氧化物反应均生成盐和水;酸与盐反应生成新酸和新盐.酸能与碱发生中和反应生成盐和水;金属氧化物与酸反应生成盐和水;酸与盐反应生成新酸和新盐;活泼金属与酸反应生成盐和氢气.
故选:C点评:
本题考点: 酸的化学性质.
考点点评: 熟练掌握酸的化学性质与酸碱盐之间的反应规律是解答本题的关键.1年前查看全部
- 有没有记忆常见酸、碱、盐溶解性的口诀?
有没有记忆常见酸、碱、盐溶解性的口诀?
不要溶解性表,只要口诀 ffhaaron1年前1
ffhaaron1年前1 -
 殿堂饭 共回答了17个问题
殿堂饭 共回答了17个问题 |采纳率88.2%1常见酸溶硅酸徽;
钾、钠、钡、钙四碱溶,
红铁蓝铜白镁锌,
沉淀在水中.
钾、钠、铵、硝个个溶,
盐酸盐除银亚汞、
硫酸沉淀钡和铅,
碳、磷酸盐多不溶.
(”其中‘红铁蓝铜白镁锌’是指氢氧化铁在水中呈红褐色沉淀,氢氧化铜在水中呈蓝色沉淀,氢氧化镁,氢氧化锌呈白色沉淀.)
2钾纳氨盐都易容(即X酸钾,X酸纳,X酸氨都易容)
硝酸盐入水无影踪(即硝酸盐都能容于水)
硫酸盐中钡不容
氯化盐中银也同(即氯化银不容)
碳酸盐中多不容1年前查看全部
- 高中常见酸(酸根也带上)的酸性强弱比较
高中常见酸(酸根也带上)的酸性强弱比较
高氯酸,氢碘酸,硫酸,硫酸氢根,盐酸,氢溴酸,硝酸,碘酸,亚硫酸,亚硫酸氢根,磷酸,磷酸二氢根,磷酸一氢根,亚硝酸,氢氟酸,碳酸,碳酸氢根,甲酸,乙酸,乙二酸,苯酚。
先这么多吧 我是七少爷1年前3
我是七少爷1年前3 -
 咆哮的上帝 共回答了23个问题
咆哮的上帝 共回答了23个问题 |采纳率91.3%HClO4>HI>HBr>HCl>H2SO4>HNO3>HIO3>H2C2O4>H2SO3>HSO4->H3PO4>HF>HNO2>HCOOH>CH3COOH>H2CO3>HSO3->H2PO4->C6H5OH>HCO3->HPO42-1年前查看全部
- 求常见酸及其化学式如CaCO3等和其他化学式我的意思是,某酸与其他元素化合后的化学式
 失魂鱼游天下1年前4
失魂鱼游天下1年前4 -
 abtxgt 共回答了24个问题
abtxgt 共回答了24个问题 |采纳率91.7%按元素周期表来记
第七主族
HF HCl HBr HI
氢氟酸 盐酸 氢溴酸 氢碘酸
以下用X表示卤素
HXO HXO2 HXO3 HXO4
次卤酸 亚卤酸 卤酸 高卤酸
第六主族
H2SO4 H2SO3
硫酸 亚硫酸
第五主族
HNO3 HNO2
硝酸 亚硝酸
H3PO4 H3PO2
磷酸 偏磷酸
第四主族
H2CO3 碳酸
H2SiO3 硅酸
含“-COOH”为有机酸
再加上苯酚C6H5OH1年前查看全部
- 求各种盐在各种常见酸中的溶解性.
求各种盐在各种常见酸中的溶解性.
如:硫酸,亚硫酸,盐酸,硝酸,亚硝酸,碳酸,磷酸,氯酸,次氯酸,高氯酸,氢硫酸(硫化氢)等.
主要是常见酸,多多益善.
答易溶或微溶或不溶就行.
注意是在酸溶液中的溶解性,不是在水中.
如:碳酸钙溶于盐酸.要准确! 5134601071年前0
5134601071年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2008•松北区一模)某学校两个化学兴趣小组的同学分别做常见酸和碱与指示剂反应的实验.使用的试剂如图所示.实验后废液分
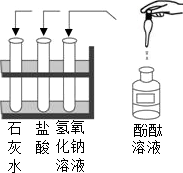 (2008•松北区一模)某学校两个化学兴趣小组的同学分别做常见酸和碱与指示剂反应的实验.使用的试剂如图所示.实验后废液分别集中到各组的一个废液缸中,并对废液进行检测.结果如下表:
(2008•松北区一模)某学校两个化学兴趣小组的同学分别做常见酸和碱与指示剂反应的实验.使用的试剂如图所示.实验后废液分别集中到各组的一个废液缸中,并对废液进行检测.结果如下表:
(1)请你帮助他们分析废液中的成分,并填写在上表中的空格中.
(2)为科学地处理实验过程中产生的废液.同学们对第二组同学的废液继续探究.请填写下列实验报告:废液来源 检测方法与结果 推断废液成分(填物质化学式,酚酞和水不填) 第一组 观察废液呈无色,pH=2. 废液中含有__________________________ 第二组 观察废液呈________色 废液中含有氢氧化钠或氢氧化钙中的_____种.
(3)据悉,许多化学实验室排救的各类废液大都未经严格处理便进入了下水道,第一组的废液若直接排入铸铁管下水道,会造成的危害是______;实验内容 实验现象 实验结论 方案一:取少量废液加入试管中,向其中________ 废液中含有氢氧化钙 方案二:取少量废液加入试管中,向其中________
请你对处理这些废液提出可行的建议______. xipewu1年前1
xipewu1年前1 -
 天堂以西 共回答了11个问题
天堂以西 共回答了11个问题 |采纳率90.9%解题思路:根据题设条件,按步分析,逻辑推理,层层推进,“对号入座”,得出结论.根据酸和碱与指示剂的反应的现象、溶液的酸碱度、碱的化学性质、金属与酸的反应、中和反应的应用,可以得出本题的答案.(1)第一组的废液中滴入无色酚酞试液后,废液呈无色,说明废液里有酸性物质;测得废液的pH=2,也说明废液中有酸性物质.根据实验中所用到的试剂,说明废液中含有盐酸.
(2)若想证明第二组的废液中含有氢氧化钙,可以进行如下实验:
向第二组的废液中加入浓的碳酸钠溶液,若有白色沉淀产生,可以确定废液中含有氢氧化钙;
向第二组的废液中加入氯化铵溶液,若产生有刺激性气味的气体,也能确定废液中含有氢氧化钙.
以上两种方法可以作为本小题的两种方案.
(3)第一组的废液若直接排入铸铁管下水道,会造成的危害是:废液中的盐酸会与铸铁管反应,造成腐蚀;
由于第一组的废液中含有盐酸,第二组的废液中含有氢氧化钠或氢氧化钙,因此可以将它们混合,让它们发生中和反应,所以处理这些废液的可行建议是:可将两种废液按照一定的比例混合,使废液中的酸性物质和碱性物质转化成中性物质.
故答案为:
(1)第一组:盐酸
第二组:红;一
(2)方案一:碳酸钠溶液;有白色沉淀产生
方案二:氯化铵溶液;产生有刺激性气味的气体
(3)废液中的盐酸会与铸铁管反应,造成腐蚀;可将两种废液按照一定的比例混合,使废液中的酸性物质和碱性物质转化成中性物质点评:
本题考点: 实验探究物质的组成成分以及含量;酸碱指示剂的使用;酸的化学性质;碱的化学性质;溶液的酸碱性与pH值的关系.
考点点评: 本题主要考查酸和碱与指示剂的反应的现象、溶液的酸碱度、碱的化学性质、金属与酸的反应、中和反应的应用,难度较大.1年前查看全部
- 谁能给一个高中化学常见酸的酸性强弱顺序
 wangzilu1年前3
wangzilu1年前3 -
 world21cn 共回答了22个问题
world21cn 共回答了22个问题 |采纳率77.3%弱酸酸性由强到弱为:草酸(乙二酸),亚硫酸,磷酸,丙酮酸,亚硝酸(以上五种为中强酸),柠檬酸,氢氟酸,苹果酸,葡萄糖酸,甲酸,乳酸,苯甲酸,丙烯酸,乙酸,丙酸,硬脂酸,碳酸,氢硫酸,次氯酸,硼酸,硅酸1年前查看全部
- (2009•龙岩)归纳总结是学习的重要方法.小明同学在学习“应用广泛的酸、碱、盐”知识后,结合常见酸(HCl、H2SO4
 (2009•龙岩)归纳总结是学习的重要方法.小明同学在学习“应用广泛的酸、碱、盐”知识后,结合常见酸(HCl、H2SO4)的性质与变化绘制出图.图中“-”两端的物质都能够反应,其中酸碱中和反应生成盐和水,则其他连线的产物也都是盐和水的是( )
(2009•龙岩)归纳总结是学习的重要方法.小明同学在学习“应用广泛的酸、碱、盐”知识后,结合常见酸(HCl、H2SO4)的性质与变化绘制出图.图中“-”两端的物质都能够反应,其中酸碱中和反应生成盐和水,则其他连线的产物也都是盐和水的是( )
A.A
B.B
C.C
D.D 收音机汕头1年前1
收音机汕头1年前1 -
 水枪王子 共回答了25个问题
水枪王子 共回答了25个问题 |采纳率100%解题思路:根据酸的化学性质,活泼金属与酸反应生成盐和氢气;利用复分解反应发生的条件,酸与碱、金属氧化物反应均生成盐和水;酸与盐反应生成新酸和新盐.酸能与碱发生中和反应生成盐和水;金属氧化物与酸反应生成盐和水;酸与盐反应生成新酸和新盐;活泼金属与酸反应生成盐和氢气.
故选:C点评:
本题考点: 酸的化学性质.
考点点评: 熟练掌握酸的化学性质与酸碱盐之间的反应规律是解答本题的关键.1年前查看全部
- 某中学初三年级A、B两个班同学分别做常见酸和碱与指示剂反应的实验,使用的试剂如下图所示.实验后废液分别集中到各班的一个指
某中学初三年级A、B两个班同学分别做常见酸和碱与指示剂反应的实验,使用的试剂如下图所示.实验后废液分别集中到各班的一个指定废液缸中.研究小组对两个班的废液进行检测,结果如下表.
废液来源 检测方法与结果 推测废液成分(填物质化学式,酚酞和水不填) A班 观察废液呈红色 废液中含有______ B班 观察废液呈无色,测pH=2 废液中没有______,含有______ 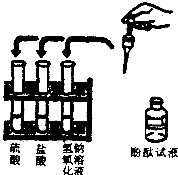
 sakgood1年前1
sakgood1年前1 -
 x250085971 共回答了17个问题
x250085971 共回答了17个问题 |采纳率88.2%由题意可知,当硫酸、盐酸与氢氧化钠混合时.硫酸、盐酸分别与氢氧氧化钠反应生成硫酸钠、氯化钠和水.
由于A班观察废液呈红色,则溶液中有剩余的氢氧化钠,则废液中含有:NaCl、Na 2 SO 4 、NaOH;
由于B班观察废液呈无色,测pH=2,说明了酸有剩余,则废液中没有NaOH,含有 NaCl、Na 2 SO 4 、HCl、H 2 SO 4 .
故答为:NaCl、Na 2 SO 4 、NaOH;NaOH;NaCl、Na 2 SO 4 、HCl、H 2 SO 4 .1年前查看全部
- 高中化学常见酸(碱)的酸(碱)性强弱,有谁知道?
高中化学常见酸(碱)的酸(碱)性强弱,有谁知道?
看过了,我要常见酸碱的酸碱性的排序. 0577491年前2
0577491年前2 -
 ann2005_999 共回答了16个问题
ann2005_999 共回答了16个问题 |采纳率100%中学常见弱酸强弱记诵口诀(从前到后酸性逐渐变弱,只考虑第一级电离的比较)
亚硫磷酸氢氟酸,亚硝甲酸冰醋酸,碳酸氢硫氢氰酸.
即H2SO3>H3PO4>HF>HNO2>HCOOH>CH3COOH>H2CO3>H2S>HCN
其他常见酸如HClO4, H2SO4,HNO3,HI,HBr都是强酸,强酸在水里视作酸性等同(水的拉平效应,使得强酸一级电离完全)
碱性:Fe(OH)2>Fe(OH)3>Cu(OH)2
规律:
0.总原则——根据碱的电离常数的大小:碱的电离常数越大,该碱的碱性越强.
推论:金属阳离子的水解常数越大,由该金属原子在该价态组成的氢氧化物的碱性越弱.
1.金属元素的电负性越小,该金属的最高价氧化物对应的水化物(即氢氧化物)的碱性越强.
推论(更具操作性):
A)一般金属活动性越大(即金属活动性顺序表中排位越靠前),该金属的最高价氧化物对应的水化物(即氢氧化物)的碱性越强.
可得出:Fe(OH)3>Cu(OH)2
B)元素周期表中,同周期的金属{主族}元素随着原子序数的递增,该金属的最高价氧化物对应的水化物(即氢氧化物)的碱性越弱;同周期的金属{副族}元素随着原子序数的递增,该金属的最高价氧化物对应的水化物(即氢氧化物)的碱性越弱;同周期的金属主族与副族元素之间不能应用此规律.
根据第二点可得出:Fe(OH)3>Cu(OH)2
C)元素周期表中,同族的金属{主族}元素随着原子序数的递增,该金属的最高价氧化物对应的水化物(即氢氧化物)的碱性越强;一般同族的金属{副族}元素随着原子序数的递增,该金属的最高价氧化物对应的水化物(即氢氧化物)的碱性越若.
2.同种金属元素不同价态的氧化物对应的水化物(即氢氧化物)的碱性的判断方法可根据盐类水解的规律——盐中有弱(酸或碱根)就水解,越弱越水解,水解产物越稳定,判断而得:同种金属元素低价态的氧化物对应的水化物(即氢氧化物)的碱性比其高价态的氧化物对应的水化物(即氢氧化物)的碱性,
如:TlOH>Tl(OH)3.
可得出:Fe(OH)2>Fe(OH)3
其实氧化物对应水化物的酸碱性可用离子键理论解释
R—O—H
A B
R离子和氢离子中,谁对氧离子的吸引力若,就在谁处电离;在A处电离,该氢氧化物显碱性,在B处电离,该氢氧化物显酸性.
随着同主族的R的原子序数的增大,R的半径也递增,对氧离子的引力自然减弱,越显碱性(如:碱性:LiOH1年前查看全部
- 生活中常见酸的用途如盐酸,硫酸,碳酸,醋酸,硼酸等.汽水中含有的酸是----等
 mary66973231年前1
mary66973231年前1 -
 yaoyaof 共回答了26个问题
yaoyaof 共回答了26个问题 |采纳率88.5%衣康酸用于其它衍生物可用作医药、化妆品试剂、润滑剂、增稠剂、除草剂以及改善丝毛织我性能.
硬脂酸主要用作助剂的原料及日用化工产品的原料.
柠檬酸用于香料或作为饮料的酸化剂,在食品和医学上用作多价螯合剂
醋酸(乙酸)可用于调味
硫酸 盐酸 硝酸 都是工业上重要的化工原料
草酸可以制得草酸钙 然后可以经过反应生成电石
盐酸(HCl)、 硫酸(H2SO4)、硝酸( HNO3 )、磷酸(H3PO4)在水溶液中电离时,产生的阴离子(酸根)虽然各不相同,但产生的阳离子(H3O+)却是相同的 ,因此它们在性质上有共同的地方,例如具有酸味;能溶解许多金属;能使蓝色石蕊试纸变红等等,这些性质实际上就是H3O+的性质.
应用 酸的用途很广,许多工业和实验室都要用酸,常用的有硫酸、盐酸、硝酸.许多化学反应在水溶液中进行,pH值很重要.如将二氧化碳通入含Ca2+的溶液,能否得到碳酸钙沉淀,取决於溶液的pH值,某些反应须在恒定的pH值下进行,为此常用弱酸(碱)及其盐的溶液作缓冲溶液.正常人的血液pH=7.4(其中含有HCO和HCO、HPO和HPO),稍微变动就会生病.1年前查看全部
- 硝酸、亚硝酸、硫酸、亚硫酸、高锰酸、磷酸等高中常见酸,由什么氧化物溶于水生成
 sinba19801年前4
sinba19801年前4 -
 tempta 共回答了16个问题
tempta 共回答了16个问题 |采纳率87.5%3NO2+H2O===2HNO3+NO
N2O3+H2O===2HNO2
SO3+H2O===H2SO4
SO2+H2O===H2SO3
Mn2O7(绿色油状物)+H2O===2HMnO4(紫色)
P2O5+3H2O===2H3PO41年前查看全部
- (2013•沈阳一模)实验小组的同学研讨初中常见酸、碱、盐之间的反应关系时,做了如下实验,实验中的每一步均有明显现象,实
(2013•沈阳一模)实验小组的同学研讨初中常见酸、碱、盐之间的反应关系时,做了如下实验,实验中的每一步均有明显现象,实验操作及部分现象如下图所示.

回答下列问题:
(1)A溶液一定呈______性(填“酸”或“中”或“碱”).
(2)气体D的化学式为______.
(3)步骤②的实验现象为______.
(4)E溶液中的溶质可能是______.
(5)B溶液的溶质由两种元素组成,④中产生气体的反应的化学方程式为______.
(6)实验后将盛有C固体烧杯中的上清液取出少量,继续加入E溶液,仍有C固体析出,已知A与E中的阳离子相同,则实验后所得溶液含有的溶质为______. kathleenww1年前1
kathleenww1年前1 -
 orangelwj66 共回答了12个问题
orangelwj66 共回答了12个问题 |采纳率83.3%解题思路:(1)根据碱遇到酚酞变红进行解答;
(2)根据酸和碳酸盐反应放出二氧化碳进行解答;
(3)酸性溶液遇到酚酞试液不变色进行解答;
(4)根据碳酸钠和盐酸反应生成二氧化碳以及和可溶性钙盐反应生成碳酸钙沉淀;
(5)根据碳酸钠和盐酸反应生成氯化钠、水和二氧化碳进行解答;
(6)根据实验后将盛有C固体烧杯中的上清液取出少量,继续加入E溶液,仍有C固体析出,说明有氯化钙存在,同时有生成的氯化钠和酚酞.(1)碱遇到酚酞变红,A溶液一定呈碱性;
(2)酸和碳酸盐反应放出二氧化碳,气体D的化学式为:CO2;
(3)酸性溶液遇到酚酞试液不变色,所以步骤②的实验现象为红色液体变为无色;
(4)碳酸钠和酸反应生成二氧化碳,和可溶性钙盐反应生成碳酸钙沉淀,E溶液中的溶质可能是Na2CO3;
(5)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳;④中产生气体的反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(6)实验后将盛有C固体烧杯中的上清液取出少量,继续加入E溶液,仍有C固体析出,说明有氯化钙存在,同时有生成的氯化钠和酚酞,实验后所得溶液含有的溶质为:NaCl、CaCl2、酚酞.
故答案为:(1)碱;(2)CO2;(3)红色液体变为无色;(4)Na2CO3;(5)Na2CO3+2HCl═2NaCl+H2O+CO2↑;(6)NaCl、CaCl2、酚酞.点评:
本题考点: 物质的鉴别、推断;酸碱指示剂及其性质;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查了稀盐酸和碳酸钠钠溶液发生反应及其设计实验进行相关方面证明等方面的内容,可以依据酸碱溶液的性质进行.1年前查看全部
- (2011•黄浦区二模)甲、乙两组同学分别在稀盐酸、稀硫酸、氢氧化钠溶液中滴加酚酞试液,做常见酸、碱与酚酞指示剂反应的实
(2011•黄浦区二模)甲、乙两组同学分别在稀盐酸、稀硫酸、氢氧化钠溶液中滴加酚酞试液,做常见酸、碱与酚酞指示剂反应的实验.
①两组同学实验后,各自将溶液倒入各组的废液缸中,研究小组对两个组的废液又进行分析,结果如下表.
甲组废液呈无色,说明溶液pH的范围是______7.废液来源 甲组 乙组 观测方法与结果 观察废液,呈无色 观察废液,呈红色
②小组成员对废液的组成判断正确的是(不考虑酚酞和水的成分)______.
A.甲组废液中一定含有盐酸和硫酸
B.乙组废液中一定含有氢氧化钠、氯化钠、硫酸钠
C.甲组的废液中只含有氯化钠
D.乙组的废液中只含有氢氧化钠. 马面猪心1年前1
马面猪心1年前1 -
 O_ctopus 共回答了22个问题
O_ctopus 共回答了22个问题 |采纳率86.4%解题思路:(1)根据酸性和中性的溶液都不会使酚酞变色进行分析,
(2)A、根据甲溶液是无色,说明不显碱性进行分析,
B、根据溶液显红色说明显碱性进行分析,
C、根据硫酸也会与氢氧化钠反应进行分析,
D、根据三种物质发生中和反应进行分析.(1)溶液显酸性或中性时,都不会使酚酞变色,只有碱性溶液会使酚酞变红,故答案为:≤
(2)A、甲溶液呈无色,说明了不存在氢氧化钠,但是三种物质发生了中和反应,硫酸和盐酸也可能存在一种,还存在硫酸钠和氯化钠,故A错误,
B、乙溶液呈红色,说明了显碱性,一定存在氢氧化钠,三种物质又发生中和反应,所以也存在硫酸钠和氯化钠,故B正确,
C、硫酸、盐酸和氢氧化钠发生中和反应,所以存在氯化钠和硫酸钠,可能存在盐酸或硫酸,故C错误,
D、乙溶液呈红色,说明了显碱性,一定存在氢氧化钠,三种物质又发生中和反应,所以也存在硫酸钠和氯化钠,故D错误.
故选B.点评:
本题考点: 酸、碱、盐的鉴别;溶液的酸碱性测定;物质的鉴别、推断.
考点点评: 在解此类题时,要掌握碱性溶液会使酚酞变红色,但是,酸性和中性的溶液都不会使酚酞变色,注意学会应用中和反应的原理判断生成物.1年前查看全部
- 常见酸的酸性大小的顺序排列(高中化学)
 565ee01年前3
565ee01年前3 -
 天蝎女孩 共回答了17个问题
天蝎女孩 共回答了17个问题 |采纳率100%由强到弱依次为:高氯酸,氢碘酸,硫酸,氢溴酸,盐酸,硝酸,碘酸(以上为强酸,了解即可,大学涉及强弱排序),草酸(乙二酸),亚硫酸,磷酸,丙酮酸,亚硝酸(以上五种为中强酸),柠檬酸,氢氟酸,苹果酸,葡萄糖酸,甲酸,乳酸,苯甲酸,丙烯酸,乙酸,丙酸,硬脂酸,碳酸,氢硫酸,次氯酸,硼酸,硅酸(其余为弱酸或极弱酸)!已经很全了,绝对够你用的了!不够的话,发留言我再给你补充!1年前查看全部
- 常见酸、碱、盐之间的互相转化关系
 哪般明媚1年前1
哪般明媚1年前1 -
 ckc998 共回答了14个问题
ckc998 共回答了14个问题 |采纳率85.7%书本后面有酸碱盐的关系1年前查看全部
- 常见酸、碱、盐的用途,不用太多像NaOH可以干什么.我说的是生活用途比如说什么发酵.做洗涤剂之类的,越多越好,酸、碱、盐
常见酸、碱、盐的用途,不用太多
像NaOH可以干什么.我说的是生活用途比如说什么发酵.做洗涤剂之类的,越多越好,酸、碱、盐至少总共5个,用途也是越多越好,不限 xingqing321年前2
xingqing321年前2 -
 美丽心灵77 共回答了10个问题
美丽心灵77 共回答了10个问题 |采纳率100%1、酸的化学性质
(1)酸 + 金属 -------- 盐 + 氢气
(2)酸 + 金属氧化物-------- 盐 + 水
56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O
57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O
58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O
59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O
(3)酸 + 碱 -------- 盐 + 水(中和反应)
60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O
61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O
62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O
63. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O
(4)酸 + 盐 -------- 另一种酸 + 另一种盐
64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑
67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl
2、碱的化学性质
(1) 碱 + 非金属氧化物 -------- 盐 + 水
68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O
69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O
70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O
71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3 ↓+ H2O
72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 ↓+ H2O
(2)碱 + 酸-------- 盐 + 水(中和反应,方程式见上)
(3)碱 + 盐 -------- 另一种碱 + 另一种盐
73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH
3、盐的化学性质
(1)盐(溶液) + 金属单质------- 另一种金属 + 另一种盐
74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu
(2)盐 + 酸-------- 另一种酸 + 另一种盐
75.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑
(3)盐 + 碱 -------- 另一种碱 + 另一种盐
76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH
(4)盐 + 盐 ----- 两种新盐
77.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓ + NaNO3
78.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl
481年前查看全部
- 常见酸的酸性比较以及常见碱的碱性比较包括盐的话更好
 徐余1年前1
徐余1年前1 -
 glacier1980 共回答了16个问题
glacier1980 共回答了16个问题 |采纳率93.8%请比较pKa,不明白在线问我
过氧化氢pka=11.62,比磷酸氢根离子酸性稍强,比水(pka=16)酸性强,比碳酸氢根离子酸性稍弱,比其他常见酸都弱得多
名称 化学式 解离常数,pka
醋酸 HAc 1.76×1O-5 4.75
碳酸 H2CO3 K1=4.3O×lO-7 6.37
K2=5.61×1O-11 1O.25
草酸 H2C2O4 K1=5.9O×lO-2 1.23
K2=6.4O×lO-5 4.19
亚硝酸 HNO2 4.6×1O-4 (285.5K) 3.37
磷酸 H3PO4 K1=7.52×lO-3 2.12
K2=6.23×1O-8 7.21
K3=2.2×lO-13 (291K) 12.67
亚硫酸 H2SO3 K1=1.54×lO-2 (291K) 1.81
K2=1.O2×lO-7 6.91
硫酸 H2SO4 K2=l.2O×lO-2 1.92
硫化氢 H2S K1=9.l×lO-8 (291K) 7.O4
K2=l.l×1O-12 11.96
氢氰酸 HCN 4.93×1O-1O 9.31
铬酸 H2CrO4 K1=1.8×lO-1 O.74
K2=3.2O×1O-7 6.49
*硼酸 H3BO3 5.8×1O-1O 9.24
氢氟酸 HF 3.53×1O-4 3.45
过氧化氢 H2O2 2.4×1O-12 11.62
次氯酸 HClO 2.95×1O-5 (291K) 4.53
次溴酸 HBrO 2.O6×1O-9 8.69
次碘酸 HIO 2.3×1O-11 1O.64
碘酸 HIO3 1.69×1O-1 O.77
砷酸 H3AsO4 K1=5.62×lO-3 (291K) 2.25
K2=l.7O×lO-7 6.77
K3=3.95×1O-12 11.4O
亚砷酸 HAsO2 6×1O-1O 9.221年前查看全部
- 【高中】常见酸及酸式根离子酸性强弱比较
【高中】常见酸及酸式根离子酸性强弱比较
醋酸、碳酸、苯酚、碳酸氢根、偏铝酸、次氯酸、硅酸.就这些,大大们给排个序吧,不要给复制一长串解说出来. 菜园小饼1231年前1
菜园小饼1231年前1 -
 inseasoft 共回答了13个问题
inseasoft 共回答了13个问题 |采纳率84.6%盐酸和硫酸的酸性都比它们强,然后依次为:醋酸、次氯酸、碳酸、苯酚、碳酸氢根、偏铝酸.硅酸是沉淀,不需要讨论.1年前查看全部
- 常见酸的强弱
 ll月明1年前1
ll月明1年前1 -
 jxiyan 共回答了14个问题
jxiyan 共回答了14个问题 |采纳率92.9%由强到弱依次为:高氯酸,氢碘酸,硫酸,氢溴酸,盐酸,硝酸,碘酸,三氯乙酸(以上为强酸,了解即可,大学涉及强弱排序),草酸(乙二酸),顺丁烯二酸,亚硫酸,磷酸,丙酮酸,丙二酸,氯乙酸,邻苯二甲酸,水杨酸,酒石酸,亚硝酸(以上十一种为中强酸),反丁烯二酸,柠檬酸,氢氟酸,苹果酸,葡萄糖酸,甲酸,乳酸,苯甲酸,丙烯酸,甲基丙烯酸,丁烯酸,乙酸,丙酸,油酸,硬脂酸,碳酸,氢硫酸,次氯酸,硼酸,硅酸,苯酚(其余为弱酸或极弱酸).1年前查看全部
- 常见酸的酸性大小的顺序排列氢氟酸与碳酸到底哪个酸性强?
 白枫秀士1年前4
白枫秀士1年前4 -
 jsxhxzj 共回答了19个问题
jsxhxzj 共回答了19个问题 |采纳率89.5%氢氟酸>碳酸1年前查看全部
- 求常见酸、碱的强弱顺序
 侬啥咛啊1年前1
侬啥咛啊1年前1 -
 许明虎 共回答了14个问题
许明虎 共回答了14个问题 |采纳率85.7%根据周期表.这个不要问吧,金属性强的碱碱性大,非金属性强的酸酸性大
金属性 与 非金属性 的比较这就查表或背表.1年前查看全部
- 帮忙把那几个弱酸的酸性大小比较一下………包括有机和无机的那几个常见酸………谢谢咯……
 huanzi83921年前1
huanzi83921年前1 -
 kiwi1122 共回答了14个问题
kiwi1122 共回答了14个问题 |采纳率92.9%磷酸>亚硫酸>乙酸(醋酸)>碳酸>苯酚(显酸性,可认为是弱酸)1年前查看全部
- 常见酸的酸性强弱顺序
 donghuchun1年前1
donghuchun1年前1 -
 dudksaif 共回答了27个问题
dudksaif 共回答了27个问题 |采纳率100%酸性由大到小:
高氯酸,氢碘酸,硫酸,氢溴酸,盐酸,硝酸,碘酸(以上为强酸,了解即可,大学涉及强弱排序)
草酸(乙二酸),亚硫酸,磷酸,丙酮酸,亚硝酸(以上五种为中强酸)
柠檬酸,氢氟酸,苹果酸,葡萄糖酸,甲酸,乳酸,苯甲酸,丙烯酸,乙酸,丙酸,硬脂酸,碳酸,氢硫酸,次氯酸,硼酸,硅酸,苯酚,硅酸,HCN(弱酸)1年前查看全部
大家在问
- 1一般来说金属元素无负价,有没有特殊的?
- 2求1+(-2)+3+(-4)+5+(-6)+...+2007+(-2008)+2009的和 要简算!
- 3一个梯形的面积是25分之3平方米,他的下底是2分之1米,高是5分之2米上低是几米?
- 4"聪明"的英语单词是什么?
- 5设计实验证明二氧化锰对过氧化氢有催化作用,且二氧化锰本身质量和化学性质没改变
- 6交通工具的英文怎么写
- 7什么是共价化合物 什么事离子化合物 有啥区别?
- 8什么是非还原性酸,能举个例子吗?
- 9分生区细胞转化成根冠细胞的过程属于?A.细胞分裂 B.细胞生长 C.细胞分化 D.细胞变异
- 10巧算‘88888乘11111加44444乘77778
- 11用浓硫酸干燥氢气后 氢气中会带上浓硫酸吗
- 12要证明二氧化锰经制氧气的实验后催化作用的性质没有改变
- 13在滑轮组中,怎样判定有几股绳子承受力呢?是不是动滑轮的二倍+1呢/
- 14英语翻译要比较长的,至少一分钟吧!越长越好...帮下忙!带翻译
- 1528乘11111加99999乘8用简便方法计算.
