将500mL0.1mol/LCuSO4溶液和 500mL4mol/LNaCl溶液相混合,然后用石墨电极进行电解.若电解过
 ii是唐唐的2022-10-04 11:39:542条回答
ii是唐唐的2022-10-04 11:39:542条回答怎么考虑

已提交,审核后显示!提交回复
共2条回复
 hujizhou2003 共回答了15个问题
hujizhou2003 共回答了15个问题 |采纳率86.7%- Cu2+ +2e-=Cu
2Cl- +2e-=Cl2↑
因为有0。2摩尔电子转移,所以转化到上面两个式子可得:生成0。1摩尔氯气,2.24升;0.1摩尔铜,因为只有0.05molCu,所以只生成0.05*64gCu换算是3.2克铜。PH值:? - 1年前
 纤纤细雨 共回答了24个问题
纤纤细雨 共回答了24个问题 |采纳率79.2%- Cu 6.4g(0.1mol)
气体 2.24L(0.1mol氯气)
PH 7(剩余酸根离子与金属阳离子电荷平衡) - 1年前
相关推荐
- 21.(14分)实验室配置500mL0.1mol/L Na2CO3溶液.回答下列问题:①应用托盘天平称取Na2CO3 &
21.(14分)实验室配置500mL0.1mol/L Na2CO3溶液.回答下列问题:①应用托盘天平称取Na2CO3 •10H2O
 kuyu_20011年前2
kuyu_20011年前2 -
 sonielong 共回答了12个问题
sonielong 共回答了12个问题 |采纳率91.7%0.5*0.1*106=5.3g 碳酸钠含水 质量分数为106/(106+10*18)=0.37 5.3/0.37=14.3g1年前查看全部
- 实验室欲配置500mL0.1mol/L的硫酸铜溶液取多少克无水硫酸铜或多少克硫酸铜晶体配置
 色贼1年前2
色贼1年前2 -
 ouyangli18 共回答了13个问题
ouyangli18 共回答了13个问题 |采纳率100%CuSO4为0.5L*0.1mol/L*160g/mol=8.0g
CuSO4 5H2O为0.5L*0.1mol/L*250g/mol=12.5g1年前查看全部
- 25℃时,用两个质量相同的铜棒作电极,电解500mL0.1mol/L H2SO4溶液,电解过程中,电解质溶液的pH变化如
25℃时,用两个质量相同的铜棒作电极,电解500mL0.1mol/L H2SO4溶液,电解过程中,电解质溶液的pH变化如
25℃时,用两个质量相同的铜棒作电极,电解500mL0.1mol/L H2SO4溶液,电解过程中,电解质溶液的pH变化如表所示(假定溶液的温度保持不变).电解2h后,取出电极,将电极干燥后称量,测得两电极的质量差为9.6g.已知25℃时,0.1mol/L CuSO4溶液的pH为4.17.
请回答下列问题:时间/h 0.5 1 1.5 2 pH 1.3 2.4 3.0 3.0
(1)实验开始阶段电解池阴极所发生反应的电极反应式为______.
(2)电解进行到1.5h后,电解质溶液的pH不再发生变化的原因是______;用离子反应方程式解释0.1mol/L CuSO4.溶液的pH为4.17的原因:______.
(3)电解进行的2h中,转移电子的总物质的量______(填“<”、“=”或“>”)0.15mol.
(4)若欲使所得的电解质溶液复原到500mL 0.1mol/L H2SO4溶液,应对溶液进行怎样处理?______.
(5)某同学用镀铜的石墨作阳极、石墨作阴极电解稀硫酸溶液,用曲线Ⅰ表示电解过程中阴极增加的质量(△m)随时间(t)的变化关系,用曲线Ⅱ表示溶液pH随时间(t)的变化关系.下列盐线图合理的是______(电解初期溶液中的H+放电).‘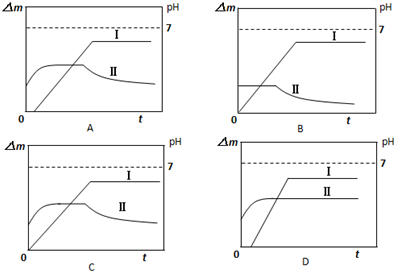
 生命为何1年前1
生命为何1年前1 -
 df1aep 共回答了11个问题
df1aep 共回答了11个问题 |采纳率81.8%(1)根据题意及表中数据可知,电解刚开始阶段,阳极反应式是Cu-2e-═Cu2+,阴极反应式为2H++2e-═H2↑,
故答案为:2H++2e-═H2↑;
(2)随着电解的继续,溶液中Cu2+的浓度增大,H+电解完后,铜离子向阴极移动,阴极反应则变成Cu2++2e-═Cu,所以电解过程中只有电镀铜的过程,阳极溶解的铜与阴极生成的铜质量相同,溶液的组成保持不变,电解持续进行,所以电解质溶液的组成、浓度不再发生变化,溶液的pH也不再发生变化;
0.1mol?L-1 CuSO4溶液的pH为4.17,溶液中铜离子水解生成氢氧化铜和氢离子,溶液呈酸性,反应的离子方程式为:Cu2++2H2O?Cu(OH)2+2H+;
故答案为:电解持续进行,H+电解完后,电解过程发生转变,阳极反应式为Cu-2e-═Cu2+,阴极反应式为Cu2++2e-═Cu,电解质溶液的组成、浓度不再发生变化,溶液的pH也不再发生变化;Cu2++2H2O?Cu(OH)2+2H+;
(3)若电解过程中只有电镀铜的过程,阳极溶解的铜与阴极生成的铜质量相同,溶液的组成保持不变,则阳极铜的减少为[9.6g/2]=4.8g,转移电子的物质的量为0.15mol,而实际上先有H2产生,后有电镀铜的过程,故实际转移电子的物质的量大于0.15mol,
故答案为:>;
(4)若欲使所得电解质溶液复原到500mL0.1mol?L-1 H2SO4溶液,根据“析出什么加入什么”原则知,应该加入氢气,但实际上氢气和溶液不反应,则加入的物质和硫酸铜溶液反应生成沉淀,且实际上溶液中增加的质量恰好等于氢气的质量,所以需要通入H2S,反应方程式为H2S+CuSO4═CuS↓+H2SO4,
故答案为:向溶液中通入H2S;
(5)整个电解过程可分为四段:
①刚开始电解时,阳极:Cu-2e-=Cu2+,阴极:2H++2e-=H2↑,这时溶液中H+减少,pH增大,阴极质量不变;
②一段时间后,Cu 2+迁移到阴极附近,阴极反应变为:Cu-2e-=Cu2+,阴极质量开始增加,由于阳极消耗铜的速率与阴极生成铜的速率相同,溶液中Cu 2+浓度不变,pH不变;
③当铜镀层溶解完全后,这时阳极反应变为:2H2O-4e-=O2↑+4H+,溶液pH开始减小,阴极上析出铜,所以阴极质量增大;
④又过一段时间,当溶液中的Cu 2+反应完全后,阴极反应又变为:2H++2e-=H2↑,阴极质量不再增加,总反应为电解水,溶剂减少,硫酸浓度增大,溶液pH还要减小;
则符合条件的为A,故选A.1年前查看全部
- 将500mL0.1mol/L的CuSO4溶液和500mL4mol/L的NaCl溶液相混合,然后用石墨电极进行电解,共有0
将500mL0.1mol/L的CuSO4溶液和500mL4mol/L的NaCl溶液相混合,然后用石墨电极进行电解,共有0.2mol电子通过,计算:
标准状况下阳极可以产生气体多少毫升 guoyiaa1年前2
guoyiaa1年前2 -
 ss19851015 共回答了15个问题
ss19851015 共回答了15个问题 |采纳率80%2240mL
NaCl的物质的量是n=cV=4*0.5=2mol
阳极:
2Cl- -2e-=Cl2↑
2 2 1
0.2 0.2 0.1
体积是V=n*Vm=0.1*22.4=2.24L=2240mL1年前查看全部
- .配制500mL0.1mol/L的H2SO4溶液,需要98%的H2SO4多少毫升(ρ=1.84g/mL)?
 约旦斯1年前1
约旦斯1年前1 -
 刺猬新新 共回答了25个问题
刺猬新新 共回答了25个问题 |采纳率88%2.72
N(H2SO4)=0.5*0.1=0.05mol
m(H2SO4)=98*0.05=4.9g
m(H2SO4+H2O)=4.9/98%=5g
V=5/1.84=2.72mL1年前查看全部
- 200mL2.5mol/LNaOH溶液与500mL0.1mol/LNaOH溶液混合,混合后溶液中NaOH的物质的量浓度是
200mL2.5mol/LNaOH溶液与500mL0.1mol/LNaOH溶液混合,混合后溶液中NaOH的物质的量浓度是多少?
 iflying1年前1
iflying1年前1 -
 hitomi_2 共回答了16个问题
hitomi_2 共回答了16个问题 |采纳率87.5%(200*2.5+500*0.1)/(200+500)=550/700=0.78mol/L1年前查看全部
- 配制500mL0.1mol/LNaOH溶液需要NaOH固体的质量是多少?
 5151734601年前1
5151734601年前1 -
 淡藍的星星 共回答了19个问题
淡藍的星星 共回答了19个问题 |采纳率84.2%解题思路:根据n=cV计算NaOH的物质的量,再根据m=nM计算需要NaOH的质量.溶液体积为500mL=0.5L,
n(NaOH)=c(NaOH)•V(aq)=0.1mol/L×0.5L=0.05mol,
m(NaOH)=n(NaOH)•M(NaOH)=0.05mol×40g/mol=2.0g,
答:需要NaOH的质量2.0g.点评:
本题考点: 物质的量的相关计算
考点点评: 本题考查物质的量浓度有关计算,比较基础,注意掌握以物质的量为中心的有关计算,有利于基础知识的巩固.1年前查看全部
- 实验室配制500mL0.1mol/LNa2CO3溶液回答下列问题
实验室配制500mL0.1mol/LNa2CO3溶液回答下列问题
(1)用托盘天平称取十水合碳酸钠晶体(Na2CO3•10H2O)______g.
(2)配制500mL0.1mol/L Na2CO3溶液时需用的主要仪器有托盘天平(带砝码、摄子)、烧杯、玻璃棒、______、______等.
(3)若实验遇下列情况,溶液的浓度是(选择填空)A(偏高)、B(偏低)、C(不变):
①忘记将洗涤液转入容量瓶______;②若该物质溶于水放热,溶解后没有冷却便转入容量瓶进行定容______;③加水定容时超过刻度线______. 陈凯歌他奶奶1年前1
陈凯歌他奶奶1年前1 -
 wblashi 共回答了16个问题
wblashi 共回答了16个问题 |采纳率87.5%解题思路:(1)根据m=nM=cvM计算;
(2)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
(3)根据c=[n/V],分析操作对溶质的物质的量或对溶液的体积的影响判断.(1)实验室配制500mL0.1mol/LNa2CO3溶液需要Na2CO3•10H2O的质量为:0.5L×0.1mol/L×286g/mol=14.3g,
故答案为:14.3;
(2)反应操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,在烧杯中溶解,冷却后转移到500ml容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以还需要的仪器为500mL容量瓶、胶头滴管,
故答案为:500mL容量瓶;胶头滴管;
(3)①忘记将洗涤液转入容量瓶,会导致溶质的物质的量偏小,溶液浓度偏低;
②若该物质溶于水放热,溶解后没有冷却便转入容量瓶进行定容,冷却后,溶液的体积减小,低于刻度线,溶液浓度偏高;
③加水定容时超过刻度线,会使溶液体积偏大,浓度偏小.
故答案为:B;A;B.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查配制一定物质的量浓度溶液额实验操作,题目难度不大,注意误差分析的方法,主用实验操作的正确方法.1年前查看全部
- 配制500mL0.1mol/L碳酸钠溶液.
配制500mL0.1mol/L碳酸钠溶液.
(1)应用托盘天平称取碳酸钠固体(Na2CO3)______g.
(2)配制碳酸钠溶液时需用到的仪器有______.
(3)下列操作使溶液物质的量浓度偏低的是:______
A.没有将洗涤液转移到容量瓶中
B.容量瓶洗净后没经干燥处理
C.转移过程中有少量溶液溅出
D.加水时,水的量超过了刻度线
E.摇匀后立即观察,发现溶液未达到刻度线,再用滴管加几滴蒸馏水至刻度线. 清幽一族1年前1
清幽一族1年前1 -
 Ronankeathing 共回答了17个问题
Ronankeathing 共回答了17个问题 |采纳率88.2%解题思路:(1)根据m=cVM计算碳酸钠的质量以及天平的精确度为0.1g来称取碳酸钠固体的质量;
(2)根据实验操作的步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等确定溶液配制所需仪器;
(3)根据c=[n/V]分析操作对溶质的物质的量或对溶液的体积的影响判断;(1)配制500mL0.1mol/L碳酸钠溶液,需要碳酸钠的质量为0.1mol/L×0.5L×106g/mol=5.3g,天平的精确度为0.1g,所以应用托盘天平称取碳酸钠固体(Na2CO3)5.3g;
故答案为:5.3;
(2)溶液配制操作步骤有:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取药品,在烧杯中溶解(可用量筒量取水),并用玻璃棒搅拌,冷却后转移到500ml容量瓶中,并用玻璃棒引流,洗涤并将该洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为托盘天平、药匙、玻璃棒、烧杯、500mL容量瓶、胶头滴管;
故答案为:托盘天平、药匙、筒量、玻璃棒、烧杯、500mL容量瓶、胶头滴管;
(3)A.没有将洗涤液转移到容量瓶中,导致溶质的物质的量偏小,根据c=[n/V]分析可知溶液浓度偏低,故A正确;
B.容量瓶洗净后没经干燥处理,对溶液的体积和溶质的物质的量均无影响,根据c=[n/V]分析可知溶液浓度不变,故B错误;
C.转移过程中有少量溶液溅出,溅出的溶液中含有溶质,导致溶质的物质的量偏小,根据c=[n/V]分析可知溶液浓度偏低,故C正确;
D.加水时,水的量超过了刻度线,导致溶液的体积偏大,根据c=[n/V]分析可知溶液浓度偏低,故D正确;
E.摇匀后立即观察,发现溶液未达到刻度线,再用滴管加几滴蒸馏水至刻度线,时间长些,粘在刻度线以上的溶液会下落,导致导致溶液的体积偏大,根据c=[n/V]分析可知溶液浓度偏低,故E正确;
故选:ACDE;点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题难度不大,明确一定物质的量浓度溶液配制的实验步骤、所需的仪器以及误差分析是正确解答本题的关键.1年前查看全部
- 在500mL0.1mol/L的FeCl2溶液中,通入一定量Cl2,待反应结束后,将溶液稀释到1L,再取出十分之一稀溶液.
在500mL0.1mol/L的FeCl2溶液中,通入一定量Cl2,待反应结束后,将溶液稀释到1L,再取出十分之一稀溶液.
在500mL0.1mol/L的FeCl2溶液中,通入一定量Cl2,待反应结束后,将溶液稀释到1L,再取出十分之一稀溶液,加入足量的AgNO3溶液,共得到2.009g沉淀.问:原溶液中的亚铁离子是否完全被氧化?若未完全氧化,试求被氧化的亚铁离子的质量分数.
 catmici1年前1
catmici1年前1 -
 爱在梧桐叶黄 共回答了18个问题
爱在梧桐叶黄 共回答了18个问题 |采纳率94.4%电脑上计算太烦了,给你思路吧.
首先沉淀的是氯化银,他的沉淀量与氧化完全有关系,如果完全氧化,那折算回去的cl-应该有0.3mol(氯化铁中氯离子含量),如果完全没氧化,那么折算回去的氯离子应该有0.2mol(氯化亚铁中氯离子量),你先求下2.009g沉淀相当于多少氯离子.另外,题目中提到了稀释什么的,不要忘记折算倍数关系.假如说最后折算的氯离子是a mol,那么按这个算式计算 设其中有亚铁x.那么氯离子总量(a)=x×0.1×2+(1-x)×0.1×3 解出x再转换为百分数即可1年前查看全部
- 配制500mL0.1mol/L碳酸钠溶液.
配制500mL0.1mol/L碳酸钠溶液.
(1)应用托盘天平称取碳酸钠固体(Na 2 CO 3 )______g.
(2)配制碳酸钠溶液时需用到的仪器有______.
(3)下列操作使溶液物质的量浓度偏低的是:______
A.没有将洗涤液转移到容量瓶中
B.容量瓶洗净后没经干燥处理
C.转移过程中有少量溶液溅出
D.加水时,水的量超过了刻度线
E.摇匀后立即观察,发现溶液未达到刻度线,再用滴管加几滴蒸馏水至刻度线. delft19951年前1
delft19951年前1 -
 o753951p 共回答了21个问题
o753951p 共回答了21个问题 |采纳率85.7%(1)配制500mL0.1mol/L碳酸钠溶液,需要碳酸钠的质量为0.1mol/L×0.5L×106g/mol=5.3g,天平的精确度为0.1g,所以应用托盘天平称取碳酸钠固体(Na 2 CO 3 )5.3g;
故答案为:5.3;
(2)溶液配制操作步骤有:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取药品,在烧杯中溶解(可用量筒量取水),并用玻璃棒搅拌,冷却后转移到500ml容量瓶中,并用玻璃棒引流,洗涤并将该洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为托盘天平、药匙、玻璃棒、烧杯、500mL容量瓶、胶头滴管;
故答案为:托盘天平、药匙、筒量、玻璃棒、烧杯、500mL容量瓶、胶头滴管;
(3)A.没有将洗涤液转移到容量瓶中,导致溶质的物质的量偏小,根据c=
n
V 分析可知溶液浓度偏低,故A正确;
B.容量瓶洗净后没经干燥处理,对溶液的体积和溶质的物质的量均无影响,根据c=
n
V 分析可知溶液浓度不变,故B错误;
C.转移过程中有少量溶液溅出,溅出的溶液中含有溶质,导致溶质的物质的量偏小,根据c=
n
V 分析可知溶液浓度偏低,故C正确;
D.加水时,水的量超过了刻度线,导致溶液的体积偏大,根据c=
n
V 分析可知溶液浓度偏低,故D正确;
E.摇匀后立即观察,发现溶液未达到刻度线,再用滴管加几滴蒸馏水至刻度线,时间长些,粘在刻度线以上的溶液会下落,导致导致溶液的体积偏大,根据c=
n
V 分析可知溶液浓度偏低,故E正确;
故选:ACDE;1年前查看全部
- 实验室配制500mL0.1mol/L Na2CO3溶液,[已知Na2CO3的式量106;Na2CO3•10H2
实验室配制500mL0.1mol/L Na2CO3溶液,[已知Na2CO3的式量106;Na2CO3•10H2O式量286]回答下列问题:
(1)应用托盘天平称取碳酸钠晶体[Na2CO3•10H2O]______g
(2)用托盘天平和小烧杯称取该质量的碳酸钠晶体,其正确操作顺序的标号为______(同一步骤可用多次).
A.调整零点
B.向天平添加砝码和调整游码到指定质量
C.将碳酸钠晶体放入小烧杯中称量
D.称量空的小烧杯
E.将砝码放回砝码盒内
F.记录称量的结果
(3)将溶液转移到容量瓶中的正确操作是______
(4)定容的正确操作是______
(5)若实验遇到下列情况,溶液的浓度如何变?用“偏高,偏低、不变”填空
A.忘记将洗涤液转移入容量瓶______B.定容时俯视标线______C.定容后摇匀液面低于刻度线______. simon55091年前1
simon55091年前1 -
 fanz32 共回答了23个问题
fanz32 共回答了23个问题 |采纳率82.6%解题思路:(1)根据m=nM求出溶质的物质的量,利用Na2CO3的物质的量和Na2CO3•10H2O的物质的量相等,根据m=nM计算;
(2)根据用天平称量物体时的正确操作顺序进行分析解答;
(3)根据把玻璃棒将玻璃棒插入容量瓶刻度线以上原因以及玻璃棒的作用分析;
(4)根据液面的形状分析;
(5)根据c=[n/V]分析操作对溶质的物质的量或对溶液的体积的影响判断.(1)实验室配制500mL0.1mol/LNa2CO3溶液需要Na2CO3的物质的量为:0.5L×0.1mol/L=0.05mol,Na2CO3•10H2O的物质的量为0.05mol,Na2CO3•10H2O的质量为:0.05mol×286g/mol=14.3g,故答案为:14.3;
(2)用天平称量物体时的正确操作步骤是:先调零点,然后先称量空的小烧杯的质量,记录称量的结果,向天平添加砝码和调整游码到指定质量,将碳酸钠晶体放入小烧杯中称量,记录称量的结果,最后调整零点,将砝码放回砝码盒内,故答案为:ADFBFCE;
(3)玻璃棒插入容量瓶刻度线以上,会使少量溶液滞留在刻度线以上而导致定容时有偏差,由于容量瓶劲较细,为避免溶液洒在外面应用玻璃棒引流,故答案为:将玻璃棒插入容量瓶刻度线以下,使溶液沿玻璃棒慢慢地倒入容量瓶中;
(4)加水至离刻度线1~2cm时,用胶头滴管滴加水,容易控制水的体积,液面是凹形的,只有液面最低端与刻度线相切时,才是溶液的真实体积,否则,会造成浓度有偏差,故答案为:加水至离刻度线1~2cm时,改用胶头滴管滴加水至液面与刻度线相切;
(5)①忘记将洗涤液转入容量瓶,会导致溶质的物质的量偏小,溶液浓度偏低,故答案为:偏低;
②定容时俯视标线,溶液的体积减小,低于刻度线,溶液浓度偏高,故答案为:偏高;
③定容后摇匀液面低于刻度线,是由于溶液滞留在刻度线以上,但溶液浓度不变,故答案为:不变.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查配制一定物质的量浓度溶液的实验操作,题目难度不大,c=[n/V]是误差分析的关键.1年前查看全部
- 配制500mL0.1mol/LNaOH溶液,需要氢氧化钠的质量为多少?
配制500mL0.1mol/LNaOH溶液,需要氢氧化钠的质量为多少?
将20mL5mol/LNaOH溶液加水稀释到400mL,稀释到400mLNaOH溶液的物质的量浓度是多少? KH兔宝宝1年前1
KH兔宝宝1年前1 -
 社_区_巡_警 共回答了14个问题
社_区_巡_警 共回答了14个问题 |采纳率92.9%解析:
1.m=nM=CVM=0.1mol/L*0.5L*40g/mol=2.0g
2.根据稀释定律:C1V1=C1V2
20ml*5mol/L=C2*400ml C2=0.25mol/L 答:略1年前查看全部
- 配制500mL0.1mol/L的硫酸溶液
配制500mL0.1mol/L的硫酸溶液
(1)从下列用品中选出实验所需用品:
,还缺少 .
a、500ml烧杯 b、玻璃棒 c、胶头滴管
d 、100ml量筒 e、1000ml容量瓶 f、广口瓶 g、10ml量筒 h、托盘天平 i、98%密度为1.84g/cm3的浓硫酸
(2)需浓硫酸 ml.
(3)若定容时俯视刻度线,会使H2SO4的浓度 天空2005蓝蓝1年前1
天空2005蓝蓝1年前1 -
 伤心城 共回答了16个问题
伤心城 共回答了16个问题 |采纳率87.5%(1)实验所需用品:a b c g i ,还缺少 500ml容量瓶 .
(2)需浓硫酸 2.7 mL.
0.5L * 0.1mol/L = 0.05mol
V * 1.84g/mL * 98% / (98g/mol) = 0.05mol
V = 2.7 mL
(3)若定容时俯视刻度线,会使H2SO4的浓度 增加 (因为实配体积减少)1年前查看全部
- 将500mL0.1mol/LCuSO4溶液和 500mL4mol/LNaCl溶液相混合,然后用石墨电极进行电解.若电解过
将500mL0.1mol/LCuSO4溶液和 500mL4mol/LNaCl溶液相混合,然后用石墨电极进行电解.若电解过程中共有0.2mol的电子通过,则阴极可析出Cu多少克?阳极产生气体多少升?
 月光寒_zy1年前2
月光寒_zy1年前2 -
 wesonchen 共回答了14个问题
wesonchen 共回答了14个问题 |采纳率78.6%Cu总共只有0.05mol,3.2g
阳极Cl2有0.1mol,2.24L1年前查看全部
- 25℃时,用两个质量相同的铜棒作电极,电解500mL0.1mol/L H2SO4溶液,电解过程中,电解质溶液的
25℃时,用两个质量相同的铜棒作电极,电解500mL0.1mol/L H2SO4溶液,电解过程中,电解质溶液的pH变化如表所示(假定溶液的温度保持不变).电解2h后,取出电极,将电极干燥后称量,测得两电极的质量差为9.6g.已知25℃时,0.1mol/L CuSO4溶液的pH为4.17.
请回答下列问题:时间/h 0.5 1 1.5 2 pH 1.3 2.4 3.0 3.0
(1)实验开始阶段电解池阴极所发生反应的电极反应式为______.
(2)电解进行到1.5h后,电解质溶液的pH不再发生变化的原因是______;用离子反应方程式解释0.1mol/L CuSO4.溶液的pH为4.17的原因:______.
(3)电解进行的2h中,转移电子的总物质的量______(填“<”、“=”或“>”)0.15mol.
(4)若欲使所得的电解质溶液复原到500mL 0.1mol/L H2SO4溶液,应对溶液进行怎样处理?______.
(5)某同学用镀铜的石墨作阳极、石墨作阴极电解稀硫酸溶液,用曲线Ⅰ表示电解过程中阴极增加的质量(△m)随时间(t)的变化关系,用曲线Ⅱ表示溶液pH随时间(t)的变化关系.下列盐线图合理的是______(电解初期溶液中的H+放电).‘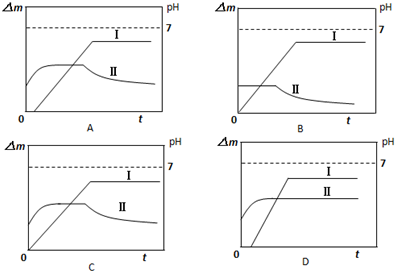
 L风逸L1年前1
L风逸L1年前1 -
 annymoon 共回答了10个问题
annymoon 共回答了10个问题 |采纳率70%解题思路:(1)电解开始时,阴极上氢离子放电生成氢气;
(2)电解进行到1.5h后,阳极上铜失电子生成铜离子,阴极上铜离子得电子析出铜,该装置为电镀池;硫酸铜为强酸弱碱盐,铜离子水解而使其溶液呈酸性;
(3)根据铜和转移电子之间的关系式计算;
(4)根据“析出什么加入什么”的原则加入物质;
(5)整个电解过程可分为四段:
①刚开始电解时,阳极上铜失电子,阴极上氢离子得电子;
②一段时间后,阴极上铜离子得电子,阳极上铜失电子;
③当阳极铜镀层溶解完全后,阴极上铜离子得电子,阳极上氢氧根离子失电子;
④又过一段时间,当溶液中的铜离子反应完全后,阴极上氢离子放电,阳极上氢氧根离子放电.(1)根据题意及表中数据可知,电解刚开始阶段,阳极反应式是Cu-2e-═Cu2+,阴极反应式为2H++2e-═H2↑,
故答案为:2H++2e-═H2↑;
(2)随着电解的继续,溶液中Cu2+的浓度增大,H+电解完后,铜离子向阴极移动,阴极反应则变成Cu2++2e-═Cu,所以电解过程中只有电镀铜的过程,阳极溶解的铜与阴极生成的铜质量相同,溶液的组成保持不变,电解持续进行,所以电解质溶液的组成、浓度不再发生变化,溶液的pH也不再发生变化;
0.1mol•L-1 CuSO4溶液的pH为4.17,溶液中铜离子水解生成氢氧化铜和氢离子,溶液呈酸性,反应的离子方程式为:Cu2++2H2O⇌Cu(OH)2+2H+;
故答案为:电解持续进行,H+电解完后,电解过程发生转变,阳极反应式为Cu-2e-═Cu2+,阴极反应式为Cu2++2e-═Cu,电解质溶液的组成、浓度不再发生变化,溶液的pH也不再发生变化;Cu2++2H2O⇌Cu(OH)2+2H+;
(3)若电解过程中只有电镀铜的过程,阳极溶解的铜与阴极生成的铜质量相同,溶液的组成保持不变,则阳极铜的减少为[9.6g/2]=4.8g,转移电子的物质的量为0.15mol,而实际上先有H2产生,后有电镀铜的过程,故实际转移电子的物质的量大于0.15mol,
故答案为:>;
(4)若欲使所得电解质溶液复原到500mL0.1mol•L-1 H2SO4溶液,根据“析出什么加入什么”原则知,应该加入氢气,但实际上氢气和溶液不反应,则加入的物质和硫酸铜溶液反应生成沉淀,且实际上溶液中增加的质量恰好等于氢气的质量,所以需要通入H2S,反应方程式为H2S+CuSO4═CuS↓+H2SO4,
故答案为:向溶液中通入H2S;
(5)整个电解过程可分为四段:
①刚开始电解时,阳极:Cu-2e-=Cu2+,阴极:2H++2e-=H2↑,这时溶液中H+减少,pH增大,阴极质量不变;
②一段时间后,Cu 2+迁移到阴极附近,阴极反应变为:Cu-2e-=Cu2+,阴极质量开始增加,由于阳极消耗铜的速率与阴极生成铜的速率相同,溶液中Cu 2+浓度不变,pH不变;
③当铜镀层溶解完全后,这时阳极反应变为:2H2O-4e-=O2↑+4H+,溶液pH开始减小,阴极上析出铜,所以阴极质量增大;
④又过一段时间,当溶液中的Cu 2+反应完全后,阴极反应又变为:2H++2e-=H2↑,阴极质量不再增加,总反应为电解水,溶剂减少,硫酸浓度增大,溶液pH还要减小;
则符合条件的为A,故选A.点评:
本题考点: 电解原理.
考点点评: 本题考查了电解池原理,明确离子的放电顺序是解本题关键,知道活泼金属作阳极时,阳极上金属失电子而不是电解质溶液中阴离子失电子,难点是(5)题,注意该电解过程分为四个阶段,明确每个阶段发生的反应,同时考查学生分析问题的缜密性,难度较大.1年前查看全部
- 配制 500mL0.1mol/LNaOH 溶液,定容时俯视刻度线,所得溶液的物质的量浓度 偏大/偏小?
配制 500mL0.1mol/LNaOH 溶液,定容时俯视刻度线,所得溶液的物质的量浓度 偏大/偏小?
这里有点晕了 狗佳1年前3
狗佳1年前3 -
 0mqr 共回答了18个问题
0mqr 共回答了18个问题 |采纳率83.3%俯视刻度线,说明液体凹液面还未达到刻度线,容量瓶中溶液体积还太少.溶度偏大1年前查看全部
- 配置500mL0.1mol/L NaOH溶液,需要NaOH的质量是
 zjtzx1年前1
zjtzx1年前1 -
 坚持到底123 共回答了21个问题
坚持到底123 共回答了21个问题 |采纳率100%需NaOH物质的量是500mL×0.1mol/L=0.05mol,
NaOH分子量为40g/mol,
故所需NaOH的质量为0.05mol×40g/mol=2g.1年前查看全部
大家在问
- 12800除于35怎么简便算?
- 2英语后缀的词性我要的不是意思,我只是想知道一些英语后缀表示的词性,比如:英语后缀是fy的是adv,是这个词性,所以我想知
- 3师徒两人加工同样的零件,徒弟先加工18个后,师傅才开始加工,徒弟平均每小时加工12个,4.5小时后师徒两人加
- 4英语作文有关元旦,80字左右!写一篇关于80字左右的元旦英语作文!真实点!紧急!
- 5炔烃如何加成成为苯环
- 6有一种美丽叫成长作文600字
- 7公里年份凡是4的倍数的这一年都是闰年,这句话是对的还是错的
- 8求一个科幻小说,100字的,女朋友要写英语科幻笑作文
- 9查古诗,王维的(山居秋瞑)
- 10已知铜与稀硫酸不反应,但如果在铜与稀硫酸的混合溶液中加入某种盐就能发生反应,且有气体生成则该盐是什
- 11在一块长8厘米,宽5厘米的长方形纸板的四个角上分别剪去一个边长是厘米的正方形。那么剩下的纸板周长是多少厘米?
- 12有哪位数学家能解答:用A,B,C,D,E五个字母取全部或部分字母任意组合成六个字母组
- 13阅读舒婷的《致橡树》 阅读舒婷的《致橡树》,完成后面的题目. 我如果爱你 绝不像攀援的凌霄花,借你的高枝炫耀自己; 我如
- 14小朋友 你要快快长大 我永远爱你噢 英文翻译
- 15点A B C D 的坐标如图,求直线AB于直线CD的交点坐标
