磷,硫,氯的氢化物的水溶液的酸性强弱怎么排列?
 舞月光的蝶2022-10-04 11:39:545条回答
舞月光的蝶2022-10-04 11:39:545条回答
已提交,审核后显示!提交回复
共5条回复
 sky01101011 共回答了22个问题
sky01101011 共回答了22个问题 |采纳率81.8%- 磷,硫,氯的氢化物的水溶液的酸性强弱排序:
HCl > H2S > PH3
其中HCl是强酸,H2S是弱酸,PH3显碱性. - 1年前
 angleboy 共回答了10个问题
angleboy 共回答了10个问题 |采纳率- 硫大于氯大于 磷 。
- 1年前
 satisifer 共回答了3个问题
satisifer 共回答了3个问题 |采纳率- 磷最强,硫次之,氯最弱,
因为磷水解过程分为三次。 - 1年前
 夕夕语 共回答了414个问题
夕夕语 共回答了414个问题 |采纳率- 由强到弱:HCl、H2S、PH3。磷化氢碱性。
- 1年前
 wsq197008 共回答了848个问题
wsq197008 共回答了848个问题 |采纳率- PH3,有碱性,可以与酸形成盐,PH4^+,称为鏻盐,类似铵盐。
H2S,弱酸
HCl,强酸 - 1年前
相关推荐
- 原子半径为0.075nm,其最高价氧化物对应的水化物与氢化物组成一种盐X.请问X是什么物质
原子半径为0.075nm,其最高价氧化物对应的水化物与氢化物组成一种盐X.请问X是什么物质
原子半径为0,075 DrognanLee1年前1
DrognanLee1年前1 -
 五成金 共回答了20个问题
五成金 共回答了20个问题 |采纳率75%原子半径为0,075可能有误
答案应为:NH4NO31年前查看全部
- 铝最高氧化物对应水化物与氯的氢化物水溶液反应的离子方程式
 jjlxr1年前1
jjlxr1年前1 -
 ynqjxyf 共回答了15个问题
ynqjxyf 共回答了15个问题 |采纳率100%Al(OH)3+3H+=Al3++3H2O1年前查看全部
- 磷的氢化物与其最高价氧化物的水化物的钾盐共热发生反应,生成一种气体单质,反应的化学方程式为
 oneriver1年前3
oneriver1年前3 -
 keven39 共回答了23个问题
keven39 共回答了23个问题 |采纳率78.3%Cl的单质与其最高价氧化物的水化物的浓溶液共热反应,生成两种物质,其中一种3Cl2+8HClO4=14ClO2(气体)+4H2O 这个主要是氯气中的0价氯和高氯酸中的+1年前查看全部
- 非金属氢化物的酸性和最高价氧化物的水化物的酸性各有何递变规律,为什么?
 笑意然1年前1
笑意然1年前1 -
 李子Lee 共回答了20个问题
李子Lee 共回答了20个问题 |采纳率80%卤族元素中非金属氢化物的酸性从F到I依次增强,需要记忆,与非金属性无关,最高价氧化物的水化物的酸性与非金属性有关1年前查看全部
- 怎么比较s的氢化物,o的氢化物,cl的氢化物的还原性
 ORZaa教1年前4
ORZaa教1年前4 -
 xx后果很严重 共回答了9个问题
xx后果很严重 共回答了9个问题 |采纳率100%..1L的那个有点不严谨
他的答案是对的
解释最好用非金属性来解释
非金属性越强 对应氢化物还原性越弱
如果用1L的方法解释
要说明是原子态的三种物质的氧化性
因为正常状态下氧气的氧化性小于氯气1年前查看全部
- 热稳定性与稳定性与溶沸点区别以前一直以为热稳定性就是溶沸点,但才晓得不一样~比如卤族元素氢化物,分别比较那三样是比分子量
热稳定性与稳定性与溶沸点区别
以前一直以为热稳定性就是溶沸点,但才晓得不一样~比如卤族元素氢化物,分别比较那三样是比分子量、键能、非金属性吗? 小笨20081年前2
小笨20081年前2 -
 cngrid 共回答了17个问题
cngrid 共回答了17个问题 |采纳率88.2%热稳定性:在加热条件下的变化,氢化物的热稳定性与非金属性一致
稳定性:物质保持原有性质的能力,即是否活泼
熔沸点:熔沸点的高低与构成该物质的晶体类型及晶体内部微粒间作用力有关,据作用力类型和大小比较1年前查看全部
- A是周期表中的短周期元素.A的最简氢化物是含氢量最高的有机物.A是什么元素.
 a44354461年前1
a44354461年前1 -
 秋水86 共回答了14个问题
秋水86 共回答了14个问题 |采纳率85.7%CH4是含H最高
A是C1年前查看全部
- 为什么说氧族元素的非金属性越强,生成氢化物时放出的热量越多
 Gillobilly1年前1
Gillobilly1年前1 -
 秋香美美 共回答了22个问题
秋香美美 共回答了22个问题 |采纳率100%氧族非金属性越强,氧化应越强,越容易氧化氢气,声称氢化物
H2X(X为氧族元素),X非金属性越强,周期表中位置越考上,原字半径约小,电负性越强,越已吸引H形成稳定的化合物,化合物越稳定,它含有的能量越少,因此防热是越多1年前查看全部
- 化学的元素周期表的族与周期中的元素氢化物性质有哪些?
 zephyros1年前2
zephyros1年前2 -
 gogoloria 共回答了19个问题
gogoloria 共回答了19个问题 |采纳率89.5%同主族,氢化物自上而下越来越不稳定,合成越来越难
同周期,氢化物从左往右越来越稳定,合成越来越容易(取决于非金属性)1年前查看全部
- 氟 氯 溴 碘 氢化物的酸性比较(一个氢) 并说明原因
 yaomazou1年前1
yaomazou1年前1 -
 股狼谷 共回答了25个问题
股狼谷 共回答了25个问题 |采纳率84%氢化物从氟到碘酸性依次增强,即酸性:HF1年前查看全部
- 钠镁铝硅氯氩原子半径最大的是?氟和氯的氢化物稳定性较强的是?
 浪子621年前3
浪子621年前3 -
 fenixy 共回答了22个问题
fenixy 共回答了22个问题 |采纳率95.5%除氩外钠的原子半径最大应为钠,因为氩与其他原子的测量标准不同,不具有可比性.r(Na)>r(Mg)>r(Al)>r(Si)>r(Cl).氟的氢化物稳定性较强,氟的非金属性较强与氢结合更牢固,就更稳定1年前查看全部
- 氮的氢化物与氧化物如何反应
 樱桃小源子1年前1
樱桃小源子1年前1 -
 lzyno12345 共回答了16个问题
lzyno12345 共回答了16个问题 |采纳率93.8%氨和氮的各种氧化物发生归中反应,产生氮气和水1年前查看全部
- 硫的氢化物的化学式是什么
 xuehelangzi1年前5
xuehelangzi1年前5 -
 高扬风 共回答了18个问题
高扬风 共回答了18个问题 |采纳率100%H2S1年前查看全部
- 下列说法正确的是( )A. 第ⅠA族元素的金属性比第ⅡA族元素的金属性强B. 第ⅥA族元素的氢化物中,稳定性最好的其沸
下列说法正确的是( )
A. 第ⅠA族元素的金属性比第ⅡA族元素的金属性强
B. 第ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C. 同周期非金属氧化物对应水化物的酸性从左到右依次增强
D. 第二周期元素随族序数的递增其最高化合价也递增 鬼龙的rr1年前1
鬼龙的rr1年前1 -
 ywc13 共回答了16个问题
ywc13 共回答了16个问题 |采纳率100%解题思路:A.同周期第ⅠA族元素的金属性比第ⅡA族元素的金属性强;
B.同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定,结合氢键判断;
C.非金属最高价氧化物对应水化物的酸性越强,中心元素的非金属性越强;
D.氧元素、氟元素没有正化合价.A.同周期第ⅠA族元素的金属性比第ⅡA族元素的金属性强,若不为同一周期,则不一定,如金属性Ca>Na,故A错误;
B.同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定,第ⅥA族元素的氢化物中,稳定性最好是H2O,氧元素电负性很大,水分子之间存在氢键,沸点故同主族其它元素氢化物,故B正确;
C.同周期自左而右,非金属性增强,非金属最高价氧化物对应水化物的酸性越强,故C错误;
D.氧元素、氟元素没有正化合价,故D错误;
故选B.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查元素周期律等,难度不大,但为易错点,学生容易审题不细致,马虎大意导致错误.1年前查看全部
- XY是A7主族元素,X的氢化物分子质量小于B的,能否证明X的氧化性大于Y的
 40211281年前1
40211281年前1 -
 perfectann 共回答了21个问题
perfectann 共回答了21个问题 |采纳率95.2%第七主族只有F Cl Br I At,又称卤素.原子量逐渐增大,其氢化物分子量也逐渐增加.
随着核外电子离原子核越来越远,亲电性也在降低,或者说电负性降低,氧化性能也就逐渐降低,因此,对该问题的答案是肯定的.但要换个说法,不是证明,而是说明.1年前查看全部
- 氮原子,氢原子的氢化物分子结合氢离子的能力较强的是(写出化学式),用一个离子方程式加以证明-----拜
 qwert2221年前1
qwert2221年前1 -
 女孩拽拽 共回答了21个问题
女孩拽拽 共回答了21个问题 |采纳率90.5%我晕~.答案是N NH3 +H3O+ ====NH4+ +H2O1年前查看全部
- 非金属元素的氢化物稳定性取决于什么?我看到了两种说法,一种是取决于共价键的
非金属元素的氢化物稳定性取决于什么?我看到了两种说法,一种是取决于共价键的
我看到了两种说法,一种是取决于共价键的强弱,与H键无关.另一种是取决于非金属元素的非金属性的强弱,与H 键有关.那么..到底是啥~求指教 typingping1年前1
typingping1年前1 -
 麦青的时候 共回答了17个问题
麦青的时候 共回答了17个问题 |采纳率94.1%非金属性越强.氢化物越稳定
与氢键无关1年前查看全部
- 为什么说氧族元素的非金属性越强,生成氢化物时放出的热量越多
 白天是hhwh1年前1
白天是hhwh1年前1 -
 33206407 共回答了20个问题
33206407 共回答了20个问题 |采纳率95%因为非金属性越强,则氢化物越稳定;而欲使稳定,则需放出的热量越多;逆向思维,欲分解非金属性强的氧族元素氢化物,需要的能量也越多!1年前查看全部
- 硼为什么可以和氢形成氢化物?硼不是+3价的吗?
 天遮眼1年前3
天遮眼1年前3 -
 佳佳麒雯 共回答了23个问题
佳佳麒雯 共回答了23个问题 |采纳率78.3%硼和氢共用电子对形成硼化氢.硼是-3价.1年前查看全部
- 非金属性强弱的辨别……谢谢了其中有一点是与对应氢化物稳定性成正比那么请问;那个稳定性是指热稳定性(物理性质)还是化学稳定
非金属性强弱的辨别……谢谢了
其中有一点是与对应氢化物稳定性成正比
那么请问;那个稳定性是指热稳定性(物理性质)还是化学稳定性呢? 窗台听风1年前2
窗台听风1年前2 -
 顶楼主的肺 共回答了20个问题
顶楼主的肺 共回答了20个问题 |采纳率100%热稳定性就是化学稳定性,不是物理稳定性.
----热稳定性是说加热时是否容易分解,是化学变化.1年前查看全部
- 什么氢化物与水在常温常压下反应生成氢气 且价格较廉?
 0o珠珠o01年前2
0o珠珠o01年前2 -
 江苏办事处 共回答了12个问题
江苏办事处 共回答了12个问题 |采纳率100%NaH+H2O=NaOH+H21年前查看全部
- 结构决定性质是化学科学中一个基本规律.主族非金属元素的氢化物在结构和性质各有特点.
结构决定性质是化学科学中一个基本规律.主族非金属元素的氢化物在结构和性质各有特点.
(1)化学键的偶极矩是矢量,方向规定为从正电中心指向负电中心,方向用→表示.甲烷和甲硅烷的偶极矩如图1所示,那么H、C、Si电负性由大到小的顺序是______.
(2)分子的极性大小与分子的空间构型及化学键的极性大小有关,物质结构上常用偶极矩表示分子极性的大小.下表是常见氢化物的偶极矩(μ)数据:
据此分析:①μ(甲烷)=0的原因是:______物质 甲烷 氨气 水 硫化氢 偶极矩(μ)/德拜尔 0 1.66 1.85 1.1
②μ(水)>μ(硫化氢)的原因是:______
(3)NH3、H2O都可以作为配体,形成配合物,CH4不能做配体,原因是______
(4)叠氮酸HN3的结构式如图2所示,其中①号N的杂化方式为______,②号N的杂化方式为______.预测其在水中的溶解度______(填写“大”或“小”)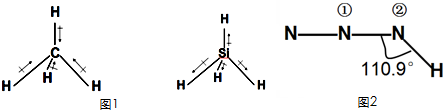
 zxcv2j3lkjfaxx1年前1
zxcv2j3lkjfaxx1年前1 -
 andyleesa 共回答了18个问题
andyleesa 共回答了18个问题 |采纳率94.4%解题思路:(1)根据共用电子对偏向电负性大的原子进行解答.
(2)①甲烷是正四面体结构,偶极矩相互抵消;
②据O的电负性大于S来分析;
(3)NH3、H2O均有孤对电子,都可以作为配体,但CH4无孤对电子;
(4)①号N含1条S轨道和1条P轨道杂化使形成的N-N键角为180°,符合SP1杂化理论;在HN3分子中,三个N原子以直线相连,H-N键与N-N-N键间的夹角为110°9',显然靠近H原子的第1个N原子是sp2杂化的.(1)共用电子对偏向电负性大的原子,CH4中共用电子对偏向C,则电负性C>H;SiH4中共用电子对偏向H,则电负性H>Si,所以C、Si、H的电负性大小关系为:C>H>Si,故答案为:C>H>Si;
(2)①甲烷是正四面体结构,偶极矩相互抵消,为非极性分子,故μ(甲烷)=0,故答案为:CH4是正四面体构型,为非极性分子;
②O的电负性大于S,所以O-H的极性大于S-H,故μ(水)>μ(硫化氢),故答案为:O的电负性大于S,所以O-H的极性大于S-H;
(3)NH3、H2O均有孤对电子,都可以作为配体,但CH4无孤对电子,不能做配体,故答案为:CH4没有孤对电子而NH3中的N,H2O中的O都有孤对电子;
(4)①号N含1条S轨道和1条P轨道杂化使形成的N-N键角为180°,符合SP1杂化理论,故①号N是SP1杂化;在HN3分子中,三个N原子以直线相连,H-N键与N-N-N键间的夹角为110°9',显然靠近H原子的第1个N原子是sp2杂化的;由于叠氮酸是极性分子,根据相似相溶原理,故在水中的溶解度较大,故答案为:sp1;sp2;大.点评:
本题考点: 物质的组成、结构和性质的关系;元素电离能、电负性的含义及应用;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查了叠氮酸的结构以及杂化方式和电负性的比较,难度不大.1年前查看全部
- 硫比氯的氢化物稳定强?我认为氯比硫更容易得电子,氯的稳定性应该更弱一些.不是么?
硫比氯的氢化物稳定强?我认为氯比硫更容易得电子,氯的稳定性应该更弱一些.不是么?
然而氧族元素,最高价氧化物对应的水化物的酸性随电荷数的增加而减弱.
这我看不太懂,感觉这些有些混乱,在我的脑子里.
还有我觉得非金属的性质,还有个别的特殊性,
只需解决 如题 xiaoyao198706251年前4
xiaoyao198706251年前4 -
 helloteddybear 共回答了20个问题
helloteddybear 共回答了20个问题 |采纳率95%同一周期从左到右,气态氢化物稳定性逐渐增强.
所以氯化氢的稳定性比硫化氢强.
同一主族从上到下,非金属性逐渐减弱,最高价氧化物对应的水化物的酸性逐渐减弱.
会出现特例的有两种,1.因为像N等元素满足半满或全满的轨道规则,故其第一电离能会反常的较大;2.某些元素的氢化物例如O S N,其氢化物会行成氢键从而使沸点较大1年前查看全部
- 阅读下列信息:Ⅰ、表中①~⑥为短周期元素及相应氢化物沸点的数据: 元素性质 元素编号 ① ② ③ ④ ⑤ ⑥ 氢化物的沸
阅读下列信息:
Ⅰ、表中①~⑥为短周期元素及相应氢化物沸点的数据:
A、B、Y均为上表中的元素.元素性质 元素编号 ① ② ③ ④ ⑤ ⑥ 氢化物的沸点(℃) -60.7 -33.4 100 -87.7 19.54 -84.9 最高化合价 +6 +5 +5 +7 最低化合价 -2 -3 -2 -3 -1 -1
Ⅱ、X是一种历史悠久,应用广泛的金属元素.
Ⅲ、X与Y可形成化合物XY、XY2,二者可用接触法制强酸甲.
IV、A与B可形成化合物AB、AB2,二者均可用于制备强酸乙.
请回答:
(1)写出一个表中所含电子数不同的氢化物之间的反应方程式______.
(2)元素①氢化物的沸点低于元素______③氢化物的沸点,原因是______.
(3)下列有关强酸甲、乙说法正确的是______.
a.二者的浓溶液在常温时均可用X的单质制成容器储运
b.二者的浓溶液在敞口容器中放置,质量都会变化
c.工业生产强酸甲、乙时,都是用水吸收相应的氧化物
d.二者的稀溶液均为强氧化剂
(4)工业上生产强酸甲时可用浓氨水处理尾气,并获得某种正盐,其化学方程式为:______.
(5)写出工业生产强酸乙的过程中获得AB的化学方程式:______,氧化剂与氧化产物的物质的量之比______,生成1molAB时转移的电子数______. 68051391年前1
68051391年前1 -
 mackay1991 共回答了19个问题
mackay1991 共回答了19个问题 |采纳率89.5%短周期元素,①有+6、-2价,处于ⅥA族,氢化物为气体,故①为S元素;②④都有+5、-3价,处于ⅤA族,②的氢化物沸点更高,故②为N元素、④为P元素;③只有-2价,氢化物沸点为100℃,则③为O元素;⑤⑥都有-1价,处于第ⅦA族,⑥有+7价,且⑤的氢化物沸点较高,故⑤为F元素、⑥为Cl元素.A、B、Y均为上述中的元素,X是一种历史悠久,应用广泛的金属元素,X与Y可形成化合物XY、XY 2 ,则X为Fe元素、Y为S元素,二者可用接触法制强酸甲,则甲为硫酸;A与B可形成化合物AB、AB 2 ,二者均可用于制备强酸乙,则A为氮元素、B为氧元素、乙为硝酸,
(1)表中所含电子数不同的氢化物之间的反应方程式为:NH 3 +HCl=NH 4 Cl等,
故答案为:NH 3 +HCl=NH 4 Cl等;
(2)水分子之间存在氢键,硫化氢分子之间存在范德华力,氢键比较范德华力更强,故硫化氢沸点比水低,
故答案为:水分子之间存在氢键;
(3)a.Fe与浓硫酸、浓硝酸发生钝化现象,常温下可以铁制容器贮存运输浓硫酸、浓硝酸,故a正确;
b.浓硫酸具有吸水性,在敞口容器中放置,溶液质量增重,浓硝酸具有挥发性,在敞口容器中放置,溶液质量减少,故b正确,
c.工业生产硫酸时用98.3%的浓硫酸吸收三氧化硫,工业生成硝酸,用硝酸镁溶液吸收二氧化氮,故c错误;
d.稀硝酸为强氧化剂,稀硫酸没有强氧化性,故d错误,
故答案为:ab;
(4)工业上生产硫酸时用浓氨水处理尾气,并获得某种正盐,其化学方程式为:SO 2 +2NH 3 •H 2 O=(NH 4 ) 2 SO 3 +H 2 O,
故答案为:SO 2 +2NH 3 •H 2 O=(NH 4 ) 2 SO 3 +H 2 O;
(5)工业生产硝酸的过程中,催化氧化氨气获得NO,化学方程式为:4NH 3 +5O 2
催化剂
.
△ 4NO+6H 2 O,氧气是氧化剂,NO是氧化产物,氧化剂与氧化产物的物质的量之比5:4,生成1molNO时转移的电子数=1mol×[2-(-3)]×N A mol -1 =5N A ,
故答案为:4NH 3 +5O 2
催化剂
.
△ 4NO+6H 2 O;5:4;5N A .1年前查看全部
- 下列有关氢化物的叙述中正确的是A稳定性:H2S>HF B HCL的电子式H(+)[CL](-)
下列有关氢化物的叙述中正确的是A稳定性:H2S>HF B HCL的电子式H(+)[CL](-)
C一个D2O分子所含的中子数为8
D在卤化氢中HF最稳定
说下为什么 某某哒xx1年前2
某某哒xx1年前2 -
 kangtazm 共回答了21个问题
kangtazm 共回答了21个问题 |采纳率90.5%非金属性越强,对应的氢化物的稳定性就越强,所以D正确,A错误
B中氯化氢是共价化合物不存在电荷
C中D中有1个中子,O中有8个中子,所以D2O有10个中子,所以错误
最后选择D1年前查看全部
- 液态卤素氢化物和卤素氢化物的水化物的酸性大小及其解释
 yang4726281年前3
yang4726281年前3 -
 zdaliang 共回答了14个问题
zdaliang 共回答了14个问题 |采纳率78.6%液态卤素氢化物属于路易斯酸(其中的H原子在同电子供体,即路易斯碱作用时表现为酸性),同时也是路易斯碱(卤素原子可对外供电子).液态中卤化氢分子间以氢键的形式相互作用形成链状结构的路易斯酸碱加合物.路易斯酸的酸性相互比较必须指明与之作用的路易斯碱才有意义,笼统谈论酸碱性没有意义.对相同的路易斯碱C,如果路易斯酸A与之加合的加合物的稳定性高于B的加合物,则称对于C,A的酸性比B强.不同的路易斯碱得出的结论就可能相反.
水溶液中,卤素氢化物酸性随周期递增.水溶液中的酸性由H+离子(H3O+)表现.相同总浓度下,电离度越高,H+离子浓度越大,酸性越强.对于卤化氢在水中的电离度的大小本质上主要决定于两个因素,一H-X键的强度(被水分子进攻容易断裂的程度),二H-X和水分子间的氢键作用强度.H-X键的强度随周期递减,更容易被水分子从两个原子间“挤进去”,引起断键而电离.H-X和水分子间的氢键作用强度,显然随周期递减,氢键越强分子越稳定,越难以电离.两方面因素都引起电离度随周期递增.H-X键的极性对电离度也有影响,不考虑其它因素,极性越强越容易电离,这一点对酸性的影响与上面两种因素造成的趋势相反,但不是主要因素.
上面讨论仅是实际情况的简化,限于篇幅难以准确描述.如有不明欢迎追问.1年前查看全部
- NH3,H2O,HF中;N,O,F皆可形成氢键且其中属氧形成的氢键的键能最弱.可为什么三种氢化物中却只有H2O是液态的?
NH3,H2O,HF中;N,O,F皆可形成氢键且其中属氧形成的氢键的键能最弱.可为什么三种氢化物中却只有H2O是液态的?
在NH3,H2O,HF中;N,O,F皆可形成氢键(对物质的熔沸点的影响相似)且其中属氧形成的氢键的键能最小.可为什么三种氢化物中却只有H2O是液态的? 周星驰我哥们1年前1
周星驰我哥们1年前1 -
 zjwlren110 共回答了22个问题
zjwlren110 共回答了22个问题 |采纳率90.9%别忘了
分子晶体的熔沸点还与分子的相对分子质量有关
相对分子质量越大,熔沸点越高
例如,I2>Cl2>Br2>F21年前查看全部
- 为什么非金属元素在氢化物中显负价请用电子对偏向知识解答,
 熟习的陌生人1年前5
熟习的陌生人1年前5 -
 指甲哥 共回答了21个问题
指甲哥 共回答了21个问题 |采纳率95.2%因为大多数非金属元素吸引电子的能力比H强,
所以共用电子对偏向非金属原子,远离H
根据化合价的定义,非金属元素为负价,H为正价.1年前查看全部
- 氢化物都是分子晶体吗?和非金属元素形成的氢化物,如N P AS等是不是都是分子晶体?
 遥远的童谣1年前2
遥远的童谣1年前2 -
 您可以使用 共回答了12个问题
您可以使用 共回答了12个问题 |采纳率100%氢化物按其结构与性质的不同可大致分为三类:离子型、金属型以及共价型氢化物
碱金属和碱土金属(铍、镁除外)在加热时能与氢直接化合,生成离子型氢化物:2M + H2 —→ 2MH (M代表碱金属)
M + H2 —→ MH2 (M代表Ca、Sr、Ba)
所以说氢化物都是分子晶体是错误的
PS:和非金属形成的氢化物都是分子晶体,没有特殊情况1年前查看全部
- 氢化物中C-H和Cl-H的化学键极性较强的是
 鱼儿飞上天1年前1
鱼儿飞上天1年前1 -
 嗳硪自嘎143 共回答了22个问题
嗳硪自嘎143 共回答了22个问题 |采纳率86.4%Cl-H键,Cl的非金属性强于C的1年前查看全部
- 第二周期非金属元素形成的最简单氢化物中沸点最高的是
 Dorise1441年前3
Dorise1441年前3 -
 宾馆八号 共回答了20个问题
宾馆八号 共回答了20个问题 |采纳率85%是水,水分子中的氧有孤对电子,与其他水分子中的氢形成氢键,使其结合更稳定,沸点高1年前查看全部
- 下列说法中不正确的是( )A. ⅥA族元素的氢化物中,稳定性最强的其沸点也最高B. 由极性键形成的分子不一定是极性分子
下列说法中不正确的是( )
A. ⅥA族元素的氢化物中,稳定性最强的其沸点也最高
B. 由极性键形成的分子不一定是极性分子
C. 原子晶体的硬度大,不导电
D. 碘晶体升华时,化学键被破坏 softandsoft1年前1
softandsoft1年前1 -
 边效力 共回答了15个问题
边效力 共回答了15个问题 |采纳率100%解题思路:A.分子间存在氢键的物质,其沸点较高;
B.CH4、CO2中均是非极性分子,却都有极性键;
C.相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体叫做原子晶体;
D.物质的熔沸点与分子间作用力有关.A.第ⅥA族元素的氢化物中稳定性最好的是H2O,因分子间存在氢键,其沸点也最高,故A正确;
B.非极性分子中不一定含有非极性键,如CH4、CO2中均是非极性分子,却都有极性键,故B正确;
C.熔点很高、硬度大、不导电等性质是原子晶体的特点,故C正确;
D.物质的熔沸点与分子间作用力有关,碘升华破坏分子间作用力,不破坏化学键,故D错误.
故选D.点评:
本题考点: 不同晶体的结构微粒及微粒间作用力的区别;极性分子和非极性分子.
考点点评: 本题考查微粒间的作用力,明确物质的晶体类型和微粒间的作用力是解题的关键,题目难度不大.1年前查看全部
- 您好!我想请教一下在有机物中有哪几类物质能和卤族元素的氢化物反应.尤其是酚可以吗?谢谢啊!
 ipsu3591年前2
ipsu3591年前2 -
 zcc123123 共回答了18个问题
zcc123123 共回答了18个问题 |采纳率83.3%连在链烃上的醇羟基可以卤化氢中的卤原子取代生成卤代烃,酚羟基上的氧原子与苯环共轭,不易被取代.1年前查看全部
- 老师,是不是所有的元素都是氧化性越强,则与氢气反应就越容易,生成氢化物稳定性越强,是不是元素得是最高价氢化物才能比较稳定
老师,是不是所有的元素都是氧化性越强,则与氢气反应就越容易,生成氢化物稳定性越强,是不是元素得是最高价氢化物才能比较稳定性
 wufeiyong1年前1
wufeiyong1年前1 -
 宋佳佳 共回答了23个问题
宋佳佳 共回答了23个问题 |采纳率91.3%氢气是还原性气体,可以与金属氧化物、硫化物或非金属单质反应.
氢气与金属氧化物或硫化物反应得到的是H2O和H2S.
氢气与非金属反应得到氢化物,比较常见的是第五主族(N、P)、第六主族(O、S、Se)、第七主族(F、Cl、Br、I),对于这些物质的单质而言,氧化性强的与氢气反应较为容易,生成的氢化物较为稳定,如H2O>H2S,当然也有例外NH31年前查看全部
- 碳,氮 ,氧的氢化物稳定性顺序由大到小为(用分子式表示)::氮的氢化物和氮的最高价氧化物的水化物反应生成什么?生成物的化
碳,氮 ,氧的氢化物稳定性顺序由大到小为(用分子式表示)::氮的氢化物和氮的最高价氧化物的水化物反应生成什么?生成物的化学键类型为?生成物的晶体类型为?
 小猪springsun1年前1
小猪springsun1年前1 -
 cewgp 共回答了16个问题
cewgp 共回答了16个问题 |采纳率93.8%H2O》NH3》CH4 非金属性越强,越稳定
N的氢化物是NH3,最高价氧化物的水化物是HNO3
生成硝酸铵NH4NO3
共价键,离子键
离子化合物1年前查看全部
- 由烷基镁热分解制得镁的氢化物,实验测得该氢化物中氢的质量分数为7.7%.求该氢化物的化学式?
 wulongchacha1年前1
wulongchacha1年前1 -
 我是萧洋 共回答了24个问题
我是萧洋 共回答了24个问题 |采纳率91.7%Mr(待测物)=n(1.008/0.077)=13.09g/mol
∵Ar(Mg)=24
∴当n=2时 Mr(待测物)=26.18,且Mr(MgH2)=26.33
∴待测物化学式为MgH21年前查看全部
- 氮的最高价氧化物对应的水化物与其氢化物反应生成一种盐X,X水溶液显酸性.那么X是什么啊?
氮的最高价氧化物对应的水化物与其氢化物反应生成一种盐X,X水溶液显酸性.那么X是什么啊?
X水溶液显酸性的原因?(化学反应方程式说明) asavdhx1年前1
asavdhx1年前1 -
 brf_2003 共回答了11个问题
brf_2003 共回答了11个问题 |采纳率90.9%NH4NO3
这个要用到水解的原理,我讲讲,你随意看看
NH3*H2O是一种水合物,可部分电离,即电离为NH4+和OH-,而部分即意味着这是可逆的,那么NH4NO3溶于水后就有NH4+,NH4+与水结合就有了NH3*H2O和H+,正是这氢离子使溶液显酸性1年前查看全部
- 下列说法正确的是( )A.碱金属单质的熔点随原子序数的增大而降低B.砹位于第七周期第VIIA族,其氢化物的稳定性大于氯
下列说法正确的是( )
A.碱金属单质的熔点随原子序数的增大而降低
B.砹位于第七周期第VIIA族,其氢化物的稳定性大于氯化氢
C.硒的最高价氧化物对应水化物的酸性比硫酸强
D.第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 kitty_08121年前1
kitty_08121年前1 -
 wuhujun010 共回答了25个问题
wuhujun010 共回答了25个问题 |采纳率84%A.因碱金属属于金属晶体,半径越大,金属键越弱,熔沸点越低,则碱金属单质的熔点随原子序数的增大而降低,故A正确;
B.同主族从上到下非金属性在减弱,非金属性Cl>At,则砹的氢化物的稳定性小于氯化氢,故B错误;
C.同主族从上到下非金属性在减弱,非金属性S>Se,则硒的最高价氧化物对应水化物的酸性比硫酸弱,故C错误;
D.N元素位于第二周期,氢化物为氨气,溶于水后溶液显碱性,C的氢化物不溶于水,其余第二周期非金属元素(不包括
Ne)的氢化物溶于水显酸性,故D错误;
故选A.1年前查看全部
- 如图中每条折线表示元素周期表中第ⅣA~ⅦA族中的某一族元素氢化物的沸点变化.每个小黑点代表一种氢化物,其中a点代表的是(
如图中每条折线表示元素周期表中第ⅣA~ⅦA族中的某一族元素氢化物的沸点变化.每个小黑点代表一种氢化物,其中a点代表的是( )
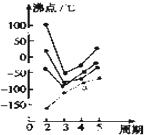 A. H2Se
A. H2Se
B. GeH4
C. AsH3
D. HBr 悬崖采红杏1年前1
悬崖采红杏1年前1 -
 boboli 共回答了16个问题
boboli 共回答了16个问题 |采纳率93.8%解题思路:根据相对分子质量与物质熔沸点的关系以及氢键的存在对物质性质的影响判断.在ⅣA~ⅦA中的氢化物里,NH3、H2O、HF因存在氢键,故沸点高于同主族相邻元素氢化物的沸点,只有ⅣA族元素氢化物不存在反常现象,故a点代表的应是第IVA族的第三种元素Ge的氢化物,即GeH4.
故选B.点评:
本题考点: 同一周期内元素性质的递变规律与原子结构的关系;不同晶体的结构微粒及微粒间作用力的区别.
考点点评: 本题考查了氢键的存在对物质性质的影响,侧重考查学生对一般规律中异常现象的辨别能力,题目难度不大.1年前查看全部
- cl Br I的氢化物的沸点,哪个高,为什么
 emj11年前1
emj11年前1 -
 bluelight 共回答了15个问题
bluelight 共回答了15个问题 |采纳率100%一般情况下,分子质量数越大,沸点越高,Cl,Br,I氢化物相对分子质量依此增大,所以HI的沸点是最高的1年前查看全部
- 若HnXOm为强酸 则X的氢化物溶于水一定显酸性
若HnXOm为强酸 则X的氢化物溶于水一定显酸性
其中n m 为正整数 这句话 对么 士兵黑豆1年前3
士兵黑豆1年前3 -
 595rc 共回答了19个问题
595rc 共回答了19个问题 |采纳率100%不对
HNO31年前查看全部
- 为什么卤素族的氢化物的酸性,不是随着氧化性越强酸性越强?
 傻天下1年前1
傻天下1年前1 -
 1j621akg 共回答了16个问题
1j621akg 共回答了16个问题 |采纳率93.8%卤素的氧化性越强,则卤素原子对氢原子的吸引能力越强,二者结合就更紧密,更难分离(= =)
因此,氢化物在水中就更难电离,于是酸性就变弱了.
比如HF,F对H的吸引极强,水分子难以将HF分子拆散(= =),所以HF就是弱酸.1年前查看全部
- 某氢化物的分子式为R2H2氢元素的质量占7.7%R元素的原子量为( )
某氢化物的分子式为R2H2氢元素的质量占7.7%R元素的原子量为( )
A 4 B 8 C 16 D 12 星光无限00发1年前2
星光无限00发1年前2 -
 1桔梗 共回答了19个问题
1桔梗 共回答了19个问题 |采纳率84.2%设R元素的原子量为X,则:
2/(2X+1×2)= 7.7%
7.7%(2X+2)= 2
0.154X = 1.846
X ≈ 12
所以,答案是:D 121年前查看全部
- 请教化学题关于求元素化合价元素R的最高价含氧酸的化学式为HnRO2n-2,则在氢化物中R的化合价为()A 12-3n B
请教化学题关于求元素化合价
元素R的最高价含氧酸的化学式为HnRO2n-2,则在氢化物中R的化合价为()
A 12-3n B 3n-12 C 3n-10 D 6-3n luoligang69541年前2
luoligang69541年前2 -
 oo爱木薯 共回答了24个问题
oo爱木薯 共回答了24个问题 |采纳率91.7%根据:最高正价+负价的绝对值=8,则有负价=最高正价-8
根据最高价含氧酸的化学式为HnRO2n-2可求得最高正价为=3n-4,负价=3n-12=-(12-n)
氢化物中R为负价,故选择B1年前查看全部
- 非金属氢化物的沸点如何判断
 w-jc1年前1
w-jc1年前1 -
 荔枝迷 共回答了19个问题
荔枝迷 共回答了19个问题 |采纳率84.2%1.同一主族中,表现为从上倒下气态氢化物的稳定性递减x0d2.同一周期中,表现为从左至右气态氢化物的稳定性递增x0d注意这里是没有例外的!x0d是通用性质,x0d所谓HF中含有特殊的氢键,x0d这种只作用于分子间,不作用于原子之间的键能x0d而原子之间的键能越大,气态氢化物的稳定性也就越强.这种分子间作用的氢键,只能影响物质的溶沸点1年前查看全部
- 卤素的最高价水化物的酸性为什么逐渐降低,它的氢化物为什么却相反?请说清楚一下
 甲壳虫5201年前3
甲壳虫5201年前3 -
 wangeepeng 共回答了12个问题
wangeepeng 共回答了12个问题 |采纳率83.3%氢化物是因为非金属性减弱,原子半径变大,对电子的束缚力变小,所以非金属性减弱,H+易电离,酸性就越强.
含氧酸恰好相反,其连接可以表示为X-O-H,X的电荷相同,但是半径依次增大,对氧上电子的吸附能力依次减弱,使得氧上的电子云密度依次升高,使得氢离子不易离开,酸性减弱.1年前查看全部
- 下列氢化物按稳定性由大到小顺序排列正确的是()?
下列氢化物按稳定性由大到小顺序排列正确的是()?
A.HI>HBr>HCl>HF
B.HF>HCl>HBr>HI
C.H2S>HCl>PH3>SiH4
D.H2O>H2S>HCl>HBr
答案是:B
为什么不是C?稳定性的大小是根据什么排列的?
请详细说明每个选项。
 ivancook1年前3
ivancook1年前3 -
 goldgamer 共回答了19个问题
goldgamer 共回答了19个问题 |采纳率84.2%同一主族元素从上到下的相应元素的气态氢化物稳定性降低,如HF>HCl>HBr>HI,因为越往下的元素其还原性增强,氧化性降低,并且向固态元素过渡,所以与还原性的氢气反应愈发困难。同一横排从左到右,相应元素的气态氢化物稳定性一般是增强,如NH31年前查看全部
- 如何比较物质的熔点?相对分子质量大的熔点就大是吗?N O F的氢化物在该周期熔点最大是吗?如果和别的周期的比,还是遵循相
如何比较物质的熔点?
相对分子质量大的熔点就大是吗?
N O F的氢化物在该周期熔点最大是吗?
如果和别的周期的比,还是遵循相对分子质量的比较是吗? yjbsky1年前2
yjbsky1年前2 -
 柠檬很酸 共回答了18个问题
柠檬很酸 共回答了18个问题 |采纳率100%不能说“相对分子质量大的熔点就大”.熔点除了与相对分子质量有关外,还与分子的极性、氢键等有关.
只有当分子相似,为同一种类型,才能说“相对分子质量大的熔点就大”.
熔点:H2O>HF>NH3,本来应该是HF>H2O>NH3,但因为三者都有氢键,其中水氢键最多,所以熔点最大.
如果和别的周期的比,除了这三个有氢键的外,还是遵循相对分子质量的比较是1年前查看全部
- 化学物质推断题.A元素氢化物的核外电子总数为10个.A的最高价氧化物B与烧碱反应生成盐C.C受热分解出新盐D和气体E.问
化学物质推断题.
A元素氢化物的核外电子总数为10个.A的最高价氧化物B与烧碱反应生成盐C.C受热分解出新盐D和气体E.问A.B.C.D.E各是什么.并给出所有反应的化学方程式和离子方程式.
我推断出A是碳..但是E跟B物质就是一样的了?是不是有问题..请高手给出推断依据.. yl761年前3
yl761年前3 -
 40009024110 共回答了29个问题
40009024110 共回答了29个问题 |采纳率86.2%A不一定是碳,氮、氧、氟均有可能(NH3、H2O、HF的核外电子总数都是10个,不信你数数),通过第二、三句话,把氧和氟排除掉.当A是氮时,B是N2O5(五氧化二氮,硝酸的酸酐),C是NaNO3,硝酸盐不稳定,受热会分
2NaNO3==2NaNO2(亚硝酸钠)+O2
则D是NaNO2,E是氧气1年前查看全部
大家在问
- 1关于时态的选择题1.many old houses ______ to make room for the office
- 2depth propagation什么意思
- 3宗璞的《紫藤萝瀑布》中句子的理解
- 4关于宗璞的紫藤萝瀑布,高分,求速度和正确率
- 5地面半径是六厘米的圆柱体的体积等于底面半径是两厘米的等高圆柱体的体积对的还是错的
- 6一个底面半径10厘米,高4.5厘米的圆锥体浸没在一个半径等于15厘米的圆柱体容器中,求水面比原来高了多少厘
- 7"in order that","in order to"的区别
- 8左弟右鸟是什么字
- 9设函数f(x)=tan(x/2-π/3),求定义域、周期和单调区间
- 10汽车在牵引力作用下在水平路面上做匀速运动已知汽车在十秒内从五米每秒增加到十五米每秒.试求汽车的加速度,和十米内的位移
- 11四个字的成语,带日字的成语是什么成语?
- 12请问(成语);绝( ),日( ).再用这两成语最后的字再写下两个成语(这两成语最后的字做头).
- 13设等比数列An 的前N项和为Sn若S6比上S3等于1比2,那么S9比S3为多少
- 14如果cosx=(m+4)/(4倍根号下m)有意义,m取值范围
- 15求解释”凤;凰”两字!
