降冰片烷烃立体结构以及所有常见烷烃的立体结构
 一半兽一半人2022-10-04 11:39:541条回答
一半兽一半人2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 周伟吉 共回答了15个问题
周伟吉 共回答了15个问题 |采纳率86.7%- 降冰片烷是一个椅式折叠的环己烷上面连了一个亚甲基,分别连在了中间的两个碳上
常见的几个,甲烷正四面体,新戊烷正四面体,其他大多具有链状结构 - 1年前
相关推荐
- 怎样把冰片溶解到白凡士林中?
 juzi-liu1年前1
juzi-liu1年前1 -
 正常人的LG 共回答了19个问题
正常人的LG 共回答了19个问题 |采纳率94.7%试一试先将冰片溶解在乙醇中,再慢慢加入凡士林中,边搅拌边溶解.1年前查看全部
- (2012?青浦区一模)已知 可简写为利用某些有机物之间的转化可贮存太阳能,如原降冰片二烯(NBD)经太阳
(2012?青浦区一模)已知 可简写为利用某些有机物之间的转化可贮存太阳能,如原降冰片二烯(NBD)经太阳
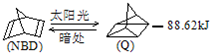 (2012?青浦区一模)已知
(2012?青浦区一模)已知  可简写为
可简写为 利用某些有机物之间的转化可贮存太阳能,如原降冰片二烯(NBD)经太阳光照转化成四环烷(Q)的反应为如图所示下列有关说法不正确的是( )
利用某些有机物之间的转化可贮存太阳能,如原降冰片二烯(NBD)经太阳光照转化成四环烷(Q)的反应为如图所示下列有关说法不正确的是( )
A.物质Q比NBD更稳定
B.物质Q的一氯取代物只有3种
C.一定条件下,1 mol NBD最多可与2 mol Br2发生加成反应
D.NBD和Q二者互为同分异构体
 圣荷ST1年前1
圣荷ST1年前1 -
 hyh50 共回答了21个问题
hyh50 共回答了21个问题 |采纳率100%1年前查看全部
- (2012•青浦区一模)已知 可简写为利用某些有机物之间的转化可贮存太阳能,如原降冰片二烯(NBD
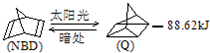 (2012•青浦区一模)已知
(2012•青浦区一模)已知  可简写为
可简写为 利用某些有机物之间的转化可贮存太阳能,如原降冰片二烯(NBD)经太阳光照转化成四环烷(Q)的反应为如图所示下列有关说法不正确的是( )
利用某些有机物之间的转化可贮存太阳能,如原降冰片二烯(NBD)经太阳光照转化成四环烷(Q)的反应为如图所示下列有关说法不正确的是( )
A.物质Q比NBD更稳定
B.物质Q的一氯取代物只有3种
C.一定条件下,1 mol NBD最多可与2 mol Br2发生加成反应
D.NBD和Q二者互为同分异构体 dengeeg1年前1
dengeeg1年前1 -
 MercuryCrabber 共回答了20个问题
MercuryCrabber 共回答了20个问题 |采纳率95%解题思路:A.原降冰片二烯(NBD)经太阳光照转化成四环烷(Q),吸收能量,则NBD的能量低;
B.Q的结构对称,有3种位置的H;
C.NBD中含2个双键;
D.NBD和Q的分子式相同,但结构不同.A.原降冰片二烯(NBD)经太阳光照转化成四环烷(Q),吸收能量,NBD的能量低,则NBD稳定,故A错误;
B.Q的结构对称,有3种位置的H,如图为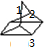 ,则Q的一氯取代物只有3种,故B正确;
,则Q的一氯取代物只有3种,故B正确;
C.NBD中含2个双键,1 mol NBD最多可与2 mol Br2发生加成反应,故C正确;
D.NBD和Q的分子式相同,但结构不同,二者互为同分异构体,故D正确;
故选A.点评:
本题考点: 有机物的结构和性质.
考点点评: 本题考查有机物的结构与性质,为高频考点,把握能量与稳定性的关系、有机物中的官能团、结构对称性为解答的关键,侧重分析与应用能力的考查,题目难度不大.1年前查看全部
- 请问冰片怎样溶解在外用洗剂中?不可以加酒精的哦!
 evoone_zheng1年前1
evoone_zheng1年前1 -
 1978小辣椒 共回答了16个问题
1978小辣椒 共回答了16个问题 |采纳率93.8%加明矾1年前查看全部
- 乙酸酐和冰片反应方程式,
 maxivv1年前1
maxivv1年前1 -
 xiaohuicao 共回答了15个问题
xiaohuicao 共回答了15个问题 |采纳率86.7%冰片主要含龙脑(Borneol) 59.78%~58.93%、异龙脑(Isoborneol)38.98%~37.52%、樟脑(Camphor)2.70%~2.09%. 从龙脑香的树脂和挥发油中取得的结晶,是几乎纯粹的右旋龙脑(d-Borneol).龙脑香的树脂和挥发油中含有多种萜类成分.除龙脑外,尚含有葎草烯(Humulene)、β-榄香烯(β-Elemene)、石竹烯(Caryophyllene)等倍半萜类成分和齐墩果酸(Oleanolic acid)、麦珠子酸(Alphitolic acid)、积雪草酸(Asiatic acid)、龙脑香醇酮(Dipterocarpol,Hydroxydammarenone Ⅱ)、龙脑香二醇酮(Dryobalanone)、古柯二醇(Erythrodiol)等三萜类成分.
【你说的冰片分子式是什么?】
【除非你指的冰片不是我说的冰片.这个反应式怎么写?写出来是一章书啊,同学.甭等了,等俩礼拜也没用.百度知道回答的空间都不够.前两天我就传了几个反应式图,都传不上来,还这个.】1年前查看全部
- 草酸(H2C2O4)主要用于生产抗菌素和冰片等药物以及提炼稀有金属的溶剂、染料还原剂、鞣革剂等.已知25℃时,草酸Ka1
草酸(H2C2O4)主要用于生产抗菌素和冰片等药物以及提炼稀有金属的溶剂、染料还原剂、鞣革剂等.已知25℃时,草酸Ka1=5.9×10-2,Ka2=6.4×10-5;碳酸(H2CO3)的电离平衡常数为Ka1=4.2×10-7,Ka2=5.6×10-11.
NH3•H2O:Kb=1.8×10−5.
(1)在盛有3ml 0.1mol•L-1Na2CO3溶液的试管中,逐滴加入0.1mol•L-1H2C2O4溶液,并不断振荡,请写出初始阶段发生反应的离子方程式:______;0.1mol•L-1的H2C2O4溶液加水稀释过程中,下列表达式的值变大的是______.
A.
B.c(H+) c(OH−)
C.c(H+) c(H2C2O4)
D.c(C2
)O 2−4c(HC2
)O −4c2(H+)•c(C2
)O 2−4c(H2C2O4)
(2)25℃时,在10mL0.2mol•L-1H2C2O4溶液中加入10mL 0.2mol•L-1NaOH溶液时,所得溶液pH<7,其原因是:______.下列说法正确的是______
A.10mL0.1mol•l-1H2C2O4溶液中加入VmL0.1mol•L-1NH3•H2O溶液,所得溶液pH=7,则V>20mL
B.等物质的量浓度的NaHC2O4、Na2C2O4、Na2CO3溶液的pH大小顺序为:Na2CO3>Na2C2O4>NaHC2O4
C.NaHC2O4溶液中各离子浓度大小顺序:c(Na+)>c(HC2O4)>c(H+)>c(OH−)>c(C2O42−)
D.等物质的量浓度的Na2C2O4和NaHCO3混合液中,c(CO32−)+c(HCO3−)=c(C2O42−)+c(HC2O4−)
(3)当在浓度均为0.1mol•L-1的Na2CO3和NaHCO3混合溶液中加入少量的酸或碱,结果发现该溶液的pH变化不大,其原因是______.据此可判断浓度均为0.1mol•L-1的下列混合溶液中,不能抵抗外加少量酸或碱对溶液pH影响的是______.
A.H2C2O4、NaHC2O4 B.NH4Cl、NaCl C.NaHSO3、Na2SO3 D.Na2S2O3、KNO3
(4)已知CaCO3、CaC2O4的溶度积常数(25℃)分别为5.0×10-9、2.5×10-9,向0.3mol•L-1Na2C2O4溶液中加入过量CaCO3固体后,溶液中的c(CO32−)=______.
(5)设计实验方案证明在水中存在着电离平衡______. iabird1年前1
iabird1年前1 -
 wxsp002 共回答了15个问题
wxsp002 共回答了15个问题 |采纳率100%解题思路:(1)草酸和碳酸钠反应生成草酸钠和碳酸氢钠;加水稀释草酸促进草酸电离,但溶液中氢离子浓度减小,氢氧根离子浓度增大;
(2)草酸和碳酸钠的物质的量相等,二者反应生成草酸一氢钠,溶液呈酸性,说明草酸氢根离子电离程度大于水解程度,结合物料守恒和电荷守恒解答;
(3)该溶液为缓冲溶液;
(4)C2O42-沉淀完全时,令CO32- 的浓度为a mol/L,由碳酸钙溶度积计算溶液中c(Ca 2+ ),进而表示出溶液中C2O42-的浓度的变化量,平衡时C2O42-的浓度,由草酸钙溶度积列方程计算;
(5)用pH计测量溶液的pH判断.(1)根据电离平衡常数知,酸性强弱顺序是:草酸>草酸氢根离子>碳酸>碳酸氢根离子,所以草酸和碳酸钠反应生成草酸钠和碳酸氢钠,离子方程式为:H2C2O4+2CO32-=C2O42-+2HCO3-;加水稀释草酸促进草酸电离,但溶液中氢离子浓度减小,氢氧根离子浓度增大,
A.氢氧根离子浓度增大,氢原子浓度减小,则氢离子浓度与氢氧根离子浓度之比减小,故错误;
B.加水稀释促进草酸电离,则氢离子个数增大,草酸分子个数减小,所以氢离子浓度与草酸分子浓度之比增大,故正确;
C.加水稀释促进草酸根离子电离,草酸根离子个数增大,草酸氢根离子个数减小,所以草酸根离子浓度与草酸氢根离子浓度之比增大,故正确;
D.温度不变,草酸的电离平衡常数不变,故错误;
故答案为:H2C2O4+2CO32-=C2O42-+2HCO3-;BC;
(2)草酸和碳酸钠的物质的量相等,二者反应生成草酸一氢钠,溶液呈酸性,说明草酸氢根离子电离程度大于水解程度,
A.10mL0.1mol•l-1H2C2O4溶液中加入VmL0.1mol•L-1NH3•H2O溶液,所得溶液pH=7,草酸铵溶液呈酸性,要使溶液呈中性,一水合氨的物质的量应该稍微过量,所以V>20mL,故正确;
B.等物质的量浓度的NaHC2O4、Na2C2O4、Na2CO3溶液中,酸根离子水解程度:碳酸根离子>碳酸氢根离子>草酸氢根离子,酸根离子水解程度越大溶液的PH越大,所以这三种溶液的pH大小顺序为:Na2CO3>Na2C2O4>NaHC2O4,故正确;
C.草酸氢钠溶液中草酸氢根离子电离程度大于水解程度,溶液呈酸性,水还电离出氢离子,导致氢离子浓度大于草酸根离子浓度,溶液中氢氧根离子浓度最小,故错误;
D.等物质的量浓度的Na2C2O4和NaHCO3混合液中,根据物料守恒得c(H2CO3)+c(CO32- )+c(HCO3-)=c(C2O42- )+c(HC2O4-)+c(H2C2O4),故错误;
故答案为:草酸氢根离子电离程度大于水解程度;AB;
(3)当在浓度均为0.1mol•L-1的Na2CO3和NaHCO3混合溶液中加入少量的酸或碱时,酸抑制碳酸氢根离子电离,氢氧根离子抑制碳酸根离子水解,溶液溶液pH变化不大;
A.H2C2O4、NaHC2O4中草酸能和碱反应、草酸氢钠能和碱反应,所以能抵抗外加少量酸或碱对溶液pH影响,故错误;
B.NH4Cl、NaCl中氯化铵能和酸但不能和碱反应,所以不能抵抗外加少量酸或碱对溶液pH影响,故正确;
C.NaHSO3、Na2SO3中能和酸或碱反应,所以能抵抗外加少量酸或碱对溶液pH影响,故错误;
D.Na2S2O3、KNO3和酸反应但不和碱反应,所以不能抵抗外加少量酸或碱对溶液pH影响,故正确;
故答案为:当加入少量酸时,氢离子和碳酸根离子反应生成碳酸氢根离子,使得增加的氢离子减少,当加入少量碱时,氢氧根离子和碳酸氢根离子作用生成碳酸根离子,使得增加的氢氧根离子减少,因而加入少量的酸或碱对溶液的pH影响不大;BD;
(4)C2O42-沉淀完全时,令CO32- 的浓度为a mol/L,由碳酸钙溶度积可知,溶液中c(Ca 2+ )=
5×10−9
amol/L,故C2O42-的浓度的变化量=(a-
5×10−9
a)mol/L,平衡时C2O42-的浓度=0.3mol/L-(a-
5×10−9
a)mol/L,由草酸钙溶度积可知:[0.3-(a-
5×10−9
a)]×
5×10−9
a=2.5×10-9,溶液中碳酸根浓度远大于钙离子浓度,可以近似为(0.3-a)×
5×10−9
a=2.5×10-9,解得a=0.2,
故答案为:0.2mol/L;
(5)如果草酸氢根离子完全电离,则溶液的pH=1,用pH计测量0.10mol/L草酸氢钠溶液的pH大于1小于7,则证明HC2O4-在水中存在着电离平衡,故答案为:用pH计测量0.10mol/L草酸氢钠溶液的pH大于1小于7.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算;影响盐类水解程度的主要因素;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了弱电解质的电离、难溶物的溶解平衡等知识点,根据电离平衡常数确定酸的酸性强弱,酸性越强的酸其酸根离子水解程度越小,再结合溶度积常数进行计算,难度中等.1年前查看全部
大家在问
- 1课间休息的英语则么拼
- 2\'\'课间休息\'\'用英语怎么说
- 3英语翻译高三学习紧张,压力大.在课间的十分钟休息很有必要,在下课时要注意适当的休息方式.翻译成一篇英语作文
- 4你做的寿司也很好吃用英文怎么说
- 5在2.5.8.16.10五个书中,选4个书组成的比例是
- 6甲乙两地相距140千米,一艘货轮在其间航行,已知顺流用了7小时,逆流用了10小时,求这艘货轮在静水中的速
- 7英语翻译“我认为那些事是恶心的.”又怎么翻译?
- 8"上英语课"用英语怎么说 ____ ______ ______ in English
- 9怎样分析物体的受力情况需要详细的步骤.谢谢
- 10人是由古猿进化而来,那么古猿由什么进化来的?
- 11英语翻译讲一下这样翻译的由来
- 12作文 搬走那座"山"这作文应该怎么写呢?
- 13故园无此声中的此声的意思
- 1412g金刚石近体中含有碳碳单键的数目是多少NA?
- 15在某月的日历上,若一个竖列上相邻3个数之和为55,能求出这三个数吗?为什么?
