七水硫酸镁的标准摩尔生成焓是多少?计算方法是什么?
 lozhliangqq2022-10-04 11:39:541条回答
lozhliangqq2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 娃哈哈qai 共回答了22个问题
娃哈哈qai 共回答了22个问题 |采纳率90.9%- 七水硫酸镁的标准摩尔生成焓是-3388.71 kj/mol.
以下方程的标准摩尔焓变均省略,查表可知:
Mg+H2SO4====MgSO4+H2 ①
H2+1/2O2====H2O ②
S+3/2O2+H2O====H2SO4 ③
MgSO4(s)+7H2O(l)====MgSO4•7H2O(s) ;ΔH=XXX kj/mol ④
(规定:单质的标准摩尔生成焓为零)
①+②+ ③得
Mg(s)+S(s)+2O2(g)====MgSO4(s)
故硫酸镁的标准摩尔生成焓可求.
水的标准摩尔焓都会算吧
最后:
MgSO4(s)+7H2O(l)====MgSO4•7H2O(s)
ΔH=MgSO4•7H2O的标准摩尔生成焓-(MgSO4(s)的标准摩尔生成焓+H2O(l)的标准摩尔焓)
即可知:七水硫酸镁的标准摩尔生成焓是-3388.71 kj/mol. - 1年前
相关推荐
- (2013•凉州区二模)七水硫酸镁(MgSO4•7H2O)在印染、造纸和医药等工业上都有广泛的应用.可利用化工厂生产硼砂
(2013•凉州区二模)七水硫酸镁(MgSO4•7H2O)在印染、造纸和医药等工业上都有广泛的应用.可利用化工厂生产硼砂的废渣M(主要成分是MgCO3,还含有MgO、SiO2、Fe2O3、FeO、CaO、Al2O3等杂质)来制取七水硫酸镁.已知:
表1部分阳离子以氢氧化物形式完全沉淀时的pH
表2盐的溶解度(单位为 g/100g水)沉淀 Al(OH)3 Fe(OH)3 Fe(OH)2 Mg(OH)2 pH 5.2 3.2 9.7 11.2
由废渣M制取七水硫酸镁的工艺流程如下:温度 10℃ 30℃ 40℃ 50℃ 60℃ CaSO4 0.19 0.21 0.21 0.20 0.19 MgSO4•7H2O 30.9 35.5 40.8 45.6 -- 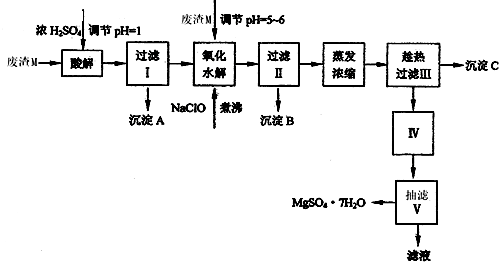
回答下列问题:
(1)过滤I的滤液中加入NaClO溶液的目的是______,写出反应的离子方程式______,需要加热煮沸的目的是______.
(2)操作Ⅱ所用的玻璃仪器是______.
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+,其实验方法是______.(用离子方程式表示).
(4)沉淀C的化学式是______,过滤Ⅲ需趁热过滤的理由是______. 看客在线1年前1
看客在线1年前1 -
 cccc的虫 共回答了13个问题
cccc的虫 共回答了13个问题 |采纳率84.6%解题思路:向废渣M中加硫酸时SiO2不溶解,NaClO具有氧化性,能将Fe2+氧化为Fe3+,PH=5~6时Fe(OH)3、Al(OH)3生成沉淀,加热煮沸的主要目的是促进Al3+、Fe3+水解,由于MgSO4的溶解度不大,温度低时结晶析出,所以过滤II需趁热过滤.(1)根据表中数据可知Fe3+易水解生成Fe(OH)3沉淀,NaClO具有氧化性,能将Fe2+氧化为Fe3+,易于除杂,
反应的方程式为6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-或2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,
盐的水解为吸热过程,加热有利于促进Al3+、Fe3+的水解生成Fe(OH)3、Al(OH)3等沉淀,
故答案为:将Fe2+氧化为Fe3+;6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-或2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;促进Al3+、Fe3+的水解;
(2)过滤用到的仪器或用品有铁架台(带铁圈)、烧杯、玻璃棒、漏斗以及滤纸,其中玻璃仪器有烧杯、漏斗、玻璃棒,故答案为:烧杯、漏斗、玻璃棒;
(3)实验室检验Fe3+离子的方法是在溶液中加入KSCN,溶液变红色,反应的离子方程式为Fe3++3SCN-=Fe(SCN)3,
故答案为:Fe3++3SCN-=Fe(SCN)3;
(4)趁热过滤时,硫酸钙的溶解度较小,而硫酸镁的溶解度较大,易于分离混合物,
此时过滤得到的沉淀为CaSO4•2H2O或CaSO4,如不趁热过滤,冷却后硫酸镁的溶解度减小,会生成硫酸镁晶体,
故答案为:CaSO4•2H2O或CaSO4;防止MgSO4在温度降低时结晶析出.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质;制备实验方案的设计.
考点点评: 本题考查制备实验方案的设计,题目难度中等,注意分析物质的制备的流程,理解反应原理,注重基础知识的积累.1年前查看全部
- 七水硫酸镁含硫多少?含镁多少?
 容妮1年前2
容妮1年前2 -
 晚上喝农夫山泉 共回答了21个问题
晚上喝农夫山泉 共回答了21个问题 |采纳率81%MgSO4,7H2O
含硫32/246*100%=13%
含镁 24/246*100%=9.8%1年前查看全部
- 硫酸镁可溶于水吗?七水硫酸镁是如何来的?
 mlhk3dbpg7___fcb1年前4
mlhk3dbpg7___fcb1年前4 -
 gxq_357 共回答了19个问题
gxq_357 共回答了19个问题 |采纳率89.5%硫酸镁,或七水硫酸镁,是一种含镁的化合物,分子式为MgSO4(或MgSO4·7H2O).无水的硫酸镁是一种常用的化学试剂及干燥试剂.但是硫酸镁常指七水硫酸镁,因为它不容易潮解,比无水硫酸镁更容易称量,便于在工业中进行的定量控制.
硫酸镁属斜方晶系,为四角粒状或菱形晶体,无色、透明,集合体为白色、玫瑰色或绿色玻璃光泽.形状有纤维状、针状、粒状或粉末.无臭,清凉,有苦咸味,相对密度1.67~1.71.易溶于水,慢溶于甘油,微溶于乙醇,水溶液呈中性,在48.1℃以下的潮湿空气中稳定,在温热干燥空气中易风化,高于48.1℃时,失去1个结晶水,成为六水硫酸镁,在67.5℃时,溶于自身结晶水,同时析出一水硫酸镁,在70~80℃时,失去4个结晶水,100℃时失去5个结晶水,在150℃时失去6个结晶水,在200℃时失去全部结晶水,成为粉状无水硫酸镁,脱水物放置于潮湿的空气中以能重新吸收水分.在硫酸镁饱和溶液中,可以结晶出分别带有1、2、3、4、5、6、12个水的水合结晶物,在-3.1.8℃饱和水溶液中,析出十二水硫酸镁,在-1.48.18℃饱和水溶液中,析出七水硫酸镁,在48.67.5℃饱和水溶液中,析出六水硫酸镁,高于67.5℃时析出一水硫酸镁,六水硫酸镁在87~92℃间发生异元熔化,并生成五水或四水硫酸镁,四水硫酸镁在106℃下转化成三水硫酸镁,三水硫酸镁在122~124℃下转化二水硫酸镁,二水硫酸镁在161~169℃下转化成稳定的一水硫酸镁.1年前查看全部
- (2014•吉林模拟)七水硫酸镁(MgSO4•7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废
(2014•吉林模拟)七水硫酸镁(MgSO4•7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁.硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等).
表1部分阳离子以氢氧化物形式完全沉淀时溶液的pH
表2两种盐的溶解度(单位为g/100g水)沉淀物 Al(OH)3 Fe(OH)3 Fe(OH)2 Mn(OH)2 Mg(OH)2 pH值 5.2 3.2 9.7 10.4 11.2
硼镁泥制取七水硫酸镁的工艺流程如下:温度/℃ 10 30 40 50 60 CaSO4 0.19 0.21 0.21 0.20 0.19 MgSO4•7H2O 30.9 35.5 40.8 45.6 / 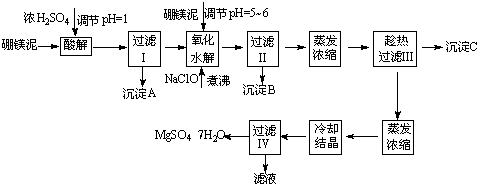
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-Mn2++ClO-+H2O=MnO2↓+2H++Cl-.加热煮沸的主要目的是促进Al3+、Fe3+水解及Mn2+氧化成MnO2促进Al3+、Fe3+水解及Mn2+氧化成MnO2.
(2)沉淀B中除MnO2、SiO2外还含有Fe(OH)3、Al(OH)3Fe(OH)3、Al(OH)3(填化学式)等物质.
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是取过滤II后的滤液1~2ml于试管中,加入少量KSCN溶液,如果溶液不显红色,证明滤液中无Fe3+取过滤II后的滤液1~2ml于试管中,加入少量KSCN溶液,如果溶液不显红色,证明滤液中无Fe3+;
(4)沉淀C的化学式是CaSO4•2H2O或CaSO4CaSO4•2H2O或CaSO4.过滤Ⅲ需趁热过滤的理由是以防MgSO4在温度低时结晶析出以防MgSO4在温度低时结晶析出. aileen9991年前1
aileen9991年前1 -
 锋之风 共回答了17个问题
锋之风 共回答了17个问题 |采纳率94.1%(1)NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,反应的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-,盐类的水解为吸热反应,加热有利于Al3+、Fe3+水解
以及Mn2+氧化成MnO2,故答案为:Mn2++ClO-+H2O=MnO2↓+2H++Cl-;促进Al3+、Fe3+水解及Mn2+氧化成MnO2;
(2)根据表中数据可知,在调节溶液的PH在5~6时,Fe3+、Al3+水解生成Fe(OH)3、Al(OH)3沉淀,故答案为:Fe(OH)3、Al(OH)3;
(3)Fe3+离子与KSCN溶液生成血红色的Fe(SCN)3,可利用该反应进行检验,故答案为:取过滤II后的滤液1~2 ml于试管中,加入少量KSCN溶液,如果溶液不显红色,
证明滤液中无Fe3+;
(4)CaSO4的溶解度随温度的变化不大,而MgSO4在温度较高时易溶于水,趁热过滤利于分离硫酸钙和硫酸镁,并防止MgSO4在温度低时结晶析出,
故答案为:CaSO4•2H2O或CaSO4;以防MgSO4在温度低时结晶析出.1年前查看全部
- (2014•吉林模拟)七水硫酸镁(MgSO4•7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废
(2014•吉林模拟)七水硫酸镁(MgSO4•7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁.硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等).
表1部分阳离子以氢氧化物形式完全沉淀时溶液的pH
表2两种盐的溶解度(单位为g/100g水)沉淀物 Al(OH)3 Fe(OH)3 Fe(OH)2 Mn(OH)2 Mg(OH)2 pH值 5.2 3.2 9.7 10.4 11.2
硼镁泥制取七水硫酸镁的工艺流程如下:温度/℃ 10 30 40 50 60 CaSO4 0.19 0.21 0.21 0.20 0.19 MgSO4•7H2O 30.9 35.5 40.8 45.6 / 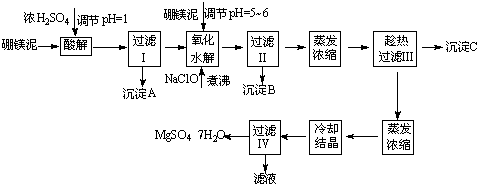
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为______.加热煮沸的主要目的是______.
(2)沉淀B中除MnO2、SiO2外还含有______(填化学式)等物质.
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是______;
(4)沉淀C的化学式是______.过滤Ⅲ需趁热过滤的理由是______. 点击20061年前1
点击20061年前1 -
 tupu 共回答了13个问题
tupu 共回答了13个问题 |采纳率92.3%解题思路:(1)根据氧化还原反应得失电子相等,利用离子方程式的配平方法书写反应的离子方程式;盐类的水解为吸热反应,加热有利于Al3+、Fe3+水解;
(2)根据表中各物质溶解时的PH可知沉淀还应有Fe(OH)3、Al(OH)3;
(3)利用Fe3+离子与KSCN溶液生成血红色的物质检验;
(4)根据CaSO4和MgSO4•7H2O在不同温度下的溶解度判断沉淀的组成和趁热过滤的理由.(1)NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,反应的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-,盐类的水解为吸热反应,加热有利于Al3+、Fe3+水解
以及Mn2+氧化成MnO2,故答案为:Mn2++ClO-+H2O=MnO2↓+2H++Cl-;促进Al3+、Fe3+水解及Mn2+氧化成MnO2;
(2)根据表中数据可知,在调节溶液的PH在5~6时,Fe3+、Al3+水解生成Fe(OH)3、Al(OH)3沉淀,故答案为:Fe(OH)3、Al(OH)3;
(3)Fe3+离子与KSCN溶液生成血红色的Fe(SCN)3,可利用该反应进行检验,故答案为:取过滤II后的滤液1~2 ml于试管中,加入少量KSCN溶液,如果溶液不显红色,
证明滤液中无Fe3+;
(4)CaSO4的溶解度随温度的变化不大,而MgSO4在温度较高时易溶于水,趁热过滤利于分离硫酸钙和硫酸镁,并防止MgSO4在温度低时结晶析出,
故答案为:CaSO4•2H2O或CaSO4;以防MgSO4在温度低时结晶析出.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质;离子方程式的书写;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查物质的制备、除杂,涉及物质的检验以及沉淀的转化等知识,题目较为综合,有一定难度,本题注意要认真分析题中数据,考查学生的分析能力.1年前查看全部
- 一水和七水硫酸镁在肥料上哪个用的多
 草原之星1年前1
草原之星1年前1 -
 明天是 共回答了17个问题
明天是 共回答了17个问题 |采纳率94.1%肥料硫酸镁的有效成分是硫酸镁,一水和七水之别是硫酸镁中所含水分子的个数.按有效成分计算的话,需要等量的硫酸镁,当然是七水的硫酸镁用量大.1年前查看全部
- 一个培养基中有葡萄糖,氯化钠,硫酸钾,琼脂,三水磷酸氢钾,七水硫酸镁,碳酸钙,蒸馏水.pH7.7.4
一个培养基中有葡萄糖,氯化钠,硫酸钾,琼脂,三水磷酸氢钾,七水硫酸镁,碳酸钙,蒸馏水.pH7.7.4
分析各营养成分作用
根据培养基成分来源和物理状态,此培养基属何种类型培养基?
此培养基的作用是什么?并说明其理由.
 wuyeyueer1年前1
wuyeyueer1年前1 -
 sjzd 共回答了29个问题
sjzd 共回答了29个问题 |采纳率86.2%培养基一般需要碳源、氮源、生长因子、无机盐等
这个培养基葡萄糖就是碳源,氯化钠这类就是无机盐拉,是细菌生长的营养物质.生长因子就是像硫酸镁那种.根据培养基有琼脂这个特点,此培养基是固体培养基.由于培养基需要有氮源,但是这里的配方没有氮源,所以此培养基是选择培养基,筛选可以自身固氮的细菌1年前查看全部
- 七水硫酸镁(MgSO4•7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-一硼镁泥可制取七水
七水硫酸镁(MgSO4•7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-一硼镁泥可制取七水硫酸镁.硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等).
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
表2 两种盐的溶解度(单位为g/100g水)沉淀物 Al(OH)3 Fe(OH)3 Fe(OH)2 Mn(OH)2 Mg(OH)2 pH值 5.2 3.2 9.7 10.4 11.2
硼镁泥制取七水硫酸镁的工艺流程如下:温度/℃ 10 30 40 50 60 CaSO4 0.19 0.21 0.21 0.20 0.19 MgSO4•7H2O 30.9 35.5 40.8 45.6 / 
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)沉淀C的化学式是______
(2)过滤Ⅲ需趁热过滤的理由是______
(3)操作Ⅰ和操作Ⅱ的名称分别为______、______
(4)滤液I中加入硼镁泥,调节溶液的pH=5~6,可除去滤液Ⅰ中______(填离子符号);加入NaClO溶液加热煮沸,可将Fe2+氧化成Fe3+的同时,还会将溶液中的Mn2+氧化成MnO2,写出Mn2+被氧化成MnO2的离子反应方程式为______
(5)硼镁泥是硼镁矿生产硼砂(Na2B4O7•10H2O)时的废渣.将硼镁矿(Mg2B2O5•H2O)煅烧、粉碎后加水和纯碱,在加热加压下通入CO2可得硼砂.此反应为熵减小反应,试写出反应方程式______. whitewz1年前1
whitewz1年前1 -
 咚咚356 共回答了23个问题
咚咚356 共回答了23个问题 |采纳率91.3%解题思路:由制备流程可知,向废渣M中加硫酸时SiO2不溶解,NaClO具有氧化性,能将Fe2+氧化为Fe3+,PH=5~6时Fe(OH)3、Al(OH)3生成沉淀,则沉淀B中除MnO2、SiO2外还含有Fe(OH)3、Al(OH)3,加热煮沸的主要目的是促进Al3+、Fe3+水解,由于CaSO4的溶解度随温度的变化不大,而MgSO4在温度较高时易溶于水,趁热过滤利于分离硫酸钙和硫酸镁,并防止MgSO4在温度低时结晶析出,所以过滤Ⅲ需趁热过滤,过滤得到的沉淀C为CaSO4•2H2O或CaSO4,滤液中主要含硫酸镁,然后蒸发浓度、冷却结晶、过滤得到MgSO4•7H2O,以此来解答.向废渣M中加硫酸时SiO2不溶解,NaClO具有氧化性,能将Fe2+氧化为Fe3+,PH=5~6时Fe(OH)3、Al(OH)3生成沉淀,则沉淀B中除MnO2、SiO2外还含有Fe(OH)3、Al(OH)3,加热煮沸的主要目的是促进Al3+、Fe3+水解,由于CaSO4的溶解度随温度的变化不大,而MgSO4在温度较高时易溶于水,趁热过滤利于分离硫酸钙和硫酸镁,并防止MgSO4在温度低时结晶析出,所以过滤Ⅲ需趁热过滤,过滤得到的沉淀C为CaSO4•2H2O或CaSO4,滤液中主要含硫酸镁,然后蒸发浓度、冷却结晶、过滤得到MgSO4•7H2O,
(1)由上述分析可知,沉淀C为CaSO4•2H2O或CaSO4,故答案为:CaSO4•2H2O或CaSO4;
(2)过滤Ⅲ需趁热过滤的理由是以防MgSO4在温度低时结晶析出,故答案为:以防MgSO4在温度低时结晶析出;
(3)由上述分析可知,操作I、操作Ⅱ的名称分别为蒸发浓缩、冷却结晶,故答案为:蒸发浓缩;冷却结晶;
(4)NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,反应的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-,盐类的水解为吸热反应,加热有利于Al3+、Fe3+水解
以及Mn2+氧化成MnO2,而调节溶液的pH=5~6,可除去滤液Ⅰ中Al3+、Fe3+,故答案为:Al3+、Fe3+;Mn2++ClO-+H2O=MnO2↓+2H++Cl-;
(5)Mg2B2O5•H2O煅烧、粉碎后加水和纯碱,在加热加压下通入CO2可得硼砂,此反应为熵减小反应,则反应后不生成气体,由原子守恒可知,生成硼砂和碳酸镁,该反应为2Mg2B2O5+Na2CO3+3CO2+10H2O=Na2B4O7•10H2O+4MgCO3,故答案为:2Mg2B2O5+Na2CO3+3CO2+10H2O=Na2B4O7•10H2O+4MgCO3.点评:
本题考点: 制备实验方案的设计;难溶电解质的溶解平衡及沉淀转化的本质;物质的分离、提纯和除杂.
考点点评: 本题考查制备实验方案的设计,为高频考点,把握物质的制备的流程、理解反应原理为解答的关键,涉及物质的制备、除杂,涉及物质的检验以及沉淀的转化等知识,题目较为综合,有一定难度,本题注意要认真分析题中数据,考查学生的分析能力,题目难度中等.1年前查看全部
- ms培养基大量元素母液中,七水硫酸镁和二水氯化钙分别用无水硫酸镁和无水氯化钙代替,会不会使配制时更易
 红塔山19651年前2
红塔山19651年前2 -
 矜持妖妇 共回答了17个问题
矜持妖妇 共回答了17个问题 |采纳率94.1%如果硫酸镁和氯化钙都是无水的话,溶解的时候比较困难,这样反而会使得配置更困难.1年前查看全部
- (2009•静安区二模)利用化工厂生产硼砂的废渣--硼镁泥可制取七水硫酸镁(MgSO4•7H2O),硼镁泥的主要成分是M
(2009•静安区二模)利用化工厂生产硼砂的废渣--硼镁泥可制取七水硫酸镁(MgSO4•7H2O),硼镁泥的主要成分是MgCO3,还含有其它杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等).
表1部分阳离子以氢氧化物形式完全沉淀时溶液的pH
表2两种盐的溶解度(g/100g水)沉淀物 Al(OH)3 Fe(OH)3 Fe(OH)2 Mn(OH)2 Mg(OH)2 pH值 5.2 3.2 9.7 10.4 11.2
硼镁泥制取七水硫酸镁的工艺流程如下:温度/℃ 10 30 40 50 60 CaSO4 0.19 0.21 0.21 0.20 0.19 MgSO4•7H2O 30.9 35.5 40.8 45.6 / 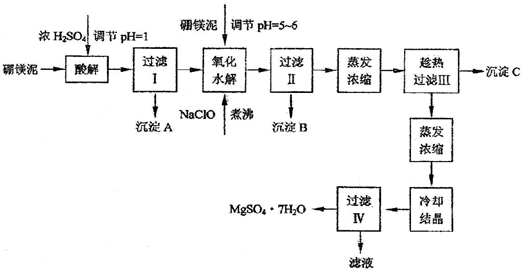
根据以上流程图并参考pH数据和溶解度数据,试回答下列问题:
(1)硼镁泥加入浓硫酸时,FeO发生的变化是______(选填序号).
a.被钝化b.被氧化c.被溶解
(2)往过滤Ⅰ得到的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液可将溶液中的Mn2+氧化成MnO2,该反应的离子反应方程式为______.加热煮沸的目的是______.
(3)沉淀B中除MnO2外还含有______(填化学式)等物质.
(4)沉淀C的化学式是______;产生沉淀C的操作需趁热进行的原因是______;洗涤沉淀需要的玻璃仪器有:烧杯、______;若用乙醇代替水作洗涤剂洗涤沉淀C,原因是______.
(5)过滤出MgSO4•7H2O晶体的滤液中含有的金属阳离子有______,生产中对该滤液的处理方法是______;检验滤液是否含有SO42-操作是______. 转身看影视31年前1
转身看影视31年前1 -
 afsdfewrq23 共回答了10个问题
afsdfewrq23 共回答了10个问题 |采纳率90%解题思路:(1)氧化亚铁是金属氧化物,亚铁离子有还原性,根据金属氧化物和还原性离子的性质确定氧化亚铁发生的变化;
(2)次氯酸钠有强氧化性,二价锰离子被氧化生成二氧化锰,同时自身被还原,弱根离子水解是吸热反应,温度越高,水解程度越大;
(3)根据表1确定沉淀B的成分;
(4)根据表2确定沉淀C的成分,根据硫酸镁和温度的关系分析,根据仪器的作用选取仪器,根据相似相溶原理知,硫酸钙在水中的溶解度大于在乙醇中的溶解度;
(5)溶液中存在可溶性的阳离子,为节约资源,应循环利用,用盐酸酸化的氯化钡检验硫酸根离子.(1)浓硫酸有强氧化性,氧化亚铁是金属氧化物,能和硫酸反应生成盐,所以氧化亚铁能溶解,亚铁离子检验还原性,浓硫酸有强氧化性,所以亚铁离子能被浓硫酸氧化,即氧化亚铁被氧化,
故选:b c;
(2)根据题意知,二价锰离子反应后生成二氧化锰,次氯酸根离子生成硫离子,结合原子守恒得,该离子反应方程式为:Mn2++ClO-+H2O═MnO2↓+2H++Cl-,铝离子和铁离子水解是吸热反应,加热能促进铝离子和铁离子水解,从而生成氢氧化铝和氢氧化铁,
故答案为:Mn2++ClO-+H2O═MnO2↓+2H++Cl-,促进Al3+、Fe3+水解;
(3)根据表1知,pH=5-6时,氢氧化铝和氢氧化铁完全生成沉淀,所以B沉淀的成分还有Fe(OH)3、Al(OH)3
,
故答案为:Fe(OH)3、Al(OH)3;
(4)根据表2知,硫酸钙随着温度的升高其溶解度降低,所以沉淀C是硫酸钙;
温度越低硫酸镁的溶解度越小,为减少硫酸镁的析出和硫酸钙的溶解,产生沉淀C的操作需趁热进行;
洗涤沉淀需要的玻璃仪器有:起过滤作用的漏斗、起搅拌和引流作用的玻璃棒;
硫酸钙在无机溶剂中的溶解度大于在有机溶剂中的溶解度,所以为降低硫酸钙的溶解度,用乙醇代替水作洗涤剂洗涤沉淀C,
故答案为:CaSO4•2H2O或CaSO4;以防MgSO4在温度低时结晶析出;漏斗、玻璃棒;降低CaSO4•2H2O的溶解度(或减少CaSO4•2H2O的溶解);
(5)加入的次氯酸钠中含有钠离子,硫酸钠和硫酸镁是可溶性盐,所以过滤出MgSO4•7H2O晶体的滤液中含有的金属阳离子有Mg2+、Na+;
滤液中含有镁离子,生产的原料中需要镁离子,所以为减少资源的浪费,镁离子可以循环利用;
硫酸根离子的检验方法是:取滤液1~2 mL于试管中,加入BaCl2溶液,若有白色沉淀生成,说明有SO42-,否则没有;
故答案为:Mg2+、Na+;循环利用;取滤液1~2 mL于试管中,加入BaCl2溶液,若有白色沉淀生成,说明有SO42-.点评:
本题考点: 镁、铝的重要化合物;物质分离和提纯的方法和基本操作综合应用;制备实验方案的设计.
考点点评: 本题考查化学与技术,涉及离子的检验方法、仪器的选取、物质的分离等知识点,注意阅读题给信息并充分利用信息进行解答,难度较大.1年前查看全部
- 1摩尔七水硫酸镁含有结晶水的质量怎么算
 机话天下1年前2
机话天下1年前2 -
 tony74719 共回答了21个问题
tony74719 共回答了21个问题 |采纳率95.2%1mol 7H2O.MgSO4
也就是7mol水
18*7=126g
18为水的摩尔质量1年前查看全部
- 用硫酸镁溶液 怎么能制备出来七水硫酸镁(要详细,
 fanmeina1年前1
fanmeina1年前1 -
 zb001024 共回答了16个问题
zb001024 共回答了16个问题 |采纳率87.5%硫酸镁常指七水硫酸镁,因为它不容易潮解,比无水硫酸镁更容易称量,便于在工业中进行的定量控制.在硫酸镁饱和溶液中,可以结晶出分别带有1、2、3、4、5、6、12个水的水合结晶物,精确控制温度在-1.48.18℃饱和水溶液中,析出七水硫酸镁.在-3.1.8℃饱和水溶液中,析出十二水硫酸镁,在-1.48.18℃饱和水溶液中,析出七水硫酸镁,在48.67.5℃饱和水溶液中,析出六水硫酸镁,高于67.5℃时析出一水硫酸镁,六水硫酸镁在87~92℃间发生异元熔化,并生成五水或四水硫酸镁,四水硫酸镁在106℃下转化成三水硫酸镁,三水硫酸镁在122~124℃下转化二水硫酸镁,二水硫酸镁在161~169℃下转化成稳定的一水硫酸镁1年前查看全部
- 七水硫酸镁的标准摩尔生成焓是多少?计算方法是什么?
 art1111年前1
art1111年前1 -
 tcz26 共回答了21个问题
tcz26 共回答了21个问题 |采纳率95.2%七水硫酸镁应该是晶体吧,—3285.6 用盖斯定理,反应中的能量变化与反应过程没有关系,配合物中的水应该是按照L状态来计算,硫酸镁的标准摩尔生成焓是—1285 水是—285.8 计算得—3285.61年前查看全部
- 七水硫酸镁在多少温度下失水生成一水硫酸镁
 xiaoluotie1年前1
xiaoluotie1年前1 -
 孤独_鹰 共回答了16个问题
孤独_鹰 共回答了16个问题 |采纳率100%七水硫酸镁在150℃失去六分子结晶水生成一水硫酸镁
,在200℃失去全部结晶水.1年前查看全部
- (2014•南通)七水硫酸镁(MgSO4•7H2O)是一种重要的化工原料,在48.1℃以下的潮湿空气中稳定,在湿热干燥空
(2014•南通)七水硫酸镁(MgSO4•7H2O)是一种重要的化工原料,在48.1℃以下的潮湿空气中稳定,在湿热干燥空气中易失去结晶水,工业上将白云石(主要成分为MgCO3,CaCO3)碳烧成粉,用于制取MgSO4•7H2O,工艺流程如图所示.

(1)煅烧过程中,MgCO3转化为MgO的基本反应类型是______;
(2)写出MgO与H2SO4反应的化学方程式:______;
(3)操作a的名称为______;
(4)将分离后的母液循环利用的目的是______;
(5)干燥得成品时,需要控制的条件是______. syhk571年前1
syhk571年前1 -
 andy_liuyong 共回答了18个问题
andy_liuyong 共回答了18个问题 |采纳率100%解题思路:根据碳酸镁煅烧反应生成氧化镁和二氧化碳进行解答;
根据碳酸镁和硫酸反应生成硫酸镁、水和二氧化碳进行解答;
根据操作a是过滤操作进行解答;(1)碳酸镁煅烧反应生成氧化镁和二氧化碳,属于分解反应;
(2)碳酸镁和硫酸反应生成硫酸镁、水和二氧化碳,化学方程式为:MgO+H2SO4=MgSO4+H2O;
(3)操作a是过滤操作;
(4)结晶后的母液是MgSO4的饱和溶液,循环利用母液可使原料中的镁元素最大可能地转化到产物中,因此将分离后的母液循环利用的目的是提高原料的利用率;
(5)由于七水硫酸镁在湿热干燥空气中易失去结晶水,因此干燥得成品时,需要控制的条件是温度,以防止七水硫酸镁水解;
故答案为:(1)分解反应;(2)MgO+H2SO4=MgSO4+H2O;(3)过滤;(4)提高原料的利用率;(5)温度.点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;酸的化学性质;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了物质分离的实验设计和方法应用,主要是利用硫酸除去杂质,得到较纯净的MgSO4溶液来制备MgSO4•7H2O晶体,同时考查了物质分离方法,题目难度中等.1年前查看全部
大家在问
- 1111111的二进制等于多少
- 2已知函数f(x)=根号下1-ax,求函数f(x)的定义域
- 3H2SO4~MgSO4~Mg的波浪线是什么意思
- 4世界上年降水量最多的地方是哪?谁知道?
- 5因为地球上的陆地少,大海比较多,所以天就比较蓝
- 6光合作用中光反应和暗反应所用酶都分布在哪里
- 7对勾函数的两个顶点怎么求
- 8半径相同带等量同种的电荷的两个金属小球A、B,相隔一定距离,两球之间的相互作用力的大小是F,今让第三个半径相同的不带电的
- 9世界上降水量最多的是 ,是缺乏的地区是 .
- 10在竖直平面上做匀速圆周运动的物体,机械能守恒吗?
- 11两条直线不平行则相交.______.(判断对错)
- 12在同一平面内,两条直线不是相交就是平行.这句话对吗?
- 13硫酸镁、铝两物质组成的混合溶液100ml中、硫酸根离子勿质量浓度为0.1 摩尔每升、加氢氧化钠
- 14有关报国之志的诗词句子
- 15二,五,六,七,八,九,十 (根据数字特点写成语)
