稀有气体化合物三氧化氙、四氧化氙溶于水生成氙酸、高氙酸+6、+8价的氙氧化性那么强,为什么可溶于水,不会把水氧化为氧气呢
 lanlan2152022-10-04 11:39:542条回答
lanlan2152022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 宝宝要努力99 共回答了24个问题
宝宝要努力99 共回答了24个问题 |采纳率95.8%- 这是所谓的动力学稳定
其实理论上高锰酸钾就可以氧化水了,但是实际上反应很慢,可以忽略 - 1年前
 gurenren 共回答了88个问题
gurenren 共回答了88个问题 |采纳率- 水中氢原子交代不了,况且这两中稀有气体化合物中,氧原子是以配位键与氙原子相连,所以氧化性氧原子体现,氧能氧化氧么?
- 1年前
相关推荐
- 常见的稀有气体化合物有哪些?它们的化合价该如何判断呢?
 萧萧糖1年前2
萧萧糖1年前2 -
 hxhzhr 共回答了22个问题
hxhzhr 共回答了22个问题 |采纳率95.5%氟化氙分三种:二氟化氙,四氟化氙和六氟化氙.他们均为无色晶体,其中二氟化氙熔点为129℃,四氟化氙为113℃,六氟化氙为89℃.XeF2在碱溶液中易被还原成Xe.XeF4则在水中岐化为XeO3+Xe.XeF6则水解成XeO3.氟化氙能被氢气还原为Xe.XeF2能将Cl-变为Cl2,BrO3-变为BrO4-.都可以用氙和氟直接化合生成,也可做氟化剂.
易升华,前二者气态无色,后者黄色.化学活泼性、氧化性和氟化性依次递增.如XeF2 和XeF4 不和SiO2 反应,而XeF6 最终反应生成XeO3 .XeF2 可用作有机物的氟化剂,选择性较好,产率较高.XeF4 及XeF6 和某些有机物接触会引起燃烧或爆炸.改性的XeF6 为有前途的氟化剂.XeF2 可用作氧化铀的氟化剂,以分离235 U.用生成氟化氙除去核反应堆裂变产物放射性氙的小型试验已获成功.用135 XeF4 作核反应堆的减速剂正在试验.控制不同的温度,压力等条件,可由氙和氟直接反应制得上述三种氟化氙.还可通过放电、辐射、光化学反应等制备.
稀有气体化合物中 氟为负一价 氧为负二价 稀有气体的化合价按电
中性原则判断1年前查看全部
- 1962年,英国化学家将PtF 6 和Xe(氙)适量混合后,首次制得稀有气体化合物六氟酸合铂氙:Xe+PtF 6 ==X
1962年,英国化学家将PtF 6 和Xe(氙)适量混合后,首次制得稀有气体化合物六氟酸合铂氙:Xe+PtF 6 ==XePtF 6 。有关该反应的叙述中,正确的是( )
A.Xe是氧化剂 B.PtF 6 是氧化剂 C.PtF 6 既是氧化剂,又是还原剂 D.该反应是非氧化还原反应  深圳的耳机1年前1
深圳的耳机1年前1 -
 zvz2006 共回答了21个问题
zvz2006 共回答了21个问题 |采纳率85.7%B
关键确定XePtF 6 中各元素的化合价,须破除Xe在化合物中为0价的思维定势,由于F元素为-1价,不会表现出氧化性,在化合物PtF 6 中Pt显+6价,而在XePtF 6 中,Xe和Ft的化合价总和为+6价。故Xe化合价升高,Pt的化合价降低,所以在该反应中,Xe做还原剂,PtF 6 做氧化剂。1年前查看全部
- [化学-选修物质结构与性质]第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对惰性”的观念.(1)Pt与Ni
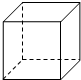 [化学-选修物质结构与性质]
[化学-选修物质结构与性质]
第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对惰性”的观念.
(1)Pt与Ni在周期表中位于同一族,写出基态Ni原子核外电子排布式______.
(2)金属Pt内部原子的堆积方式与铜及干冰中CO2相同,图正方体是Pt晶胞示意图,叙述Pt原子在晶胞中位置:______.
(3)已知XeO3分子中氙原子上有1对孤对电子,则XeO3为______分子(填“极性”或“非极性”);XeO3分子中中心原子的杂化类型为______;XeO3分子实际空间构型为______
(4)一定压强,将HF和HCl混合气体降温时,首先液化的物质是______. redaiyu661年前1
redaiyu661年前1 -
 女巫除非 共回答了18个问题
女巫除非 共回答了18个问题 |采纳率100%解题思路:(1)Ni的原子序数为28,根据能量最低原理和洪特规则书写电子排布式;
(2)铜的堆积模型为最紧密堆积,配位数为12,铜原子位于顶点和面心,与二氧化碳分子晶胞结构相似;
(3)XeO3分子中含有3个δ键和一个孤电子对,为三角锥形分子,杂化方式为sp3杂化;
(4)根据HF含有氢键判断.(1)Ni的原子序数为28,根据能量最低原理和洪特规则可写出基态Ni原子核外电子排布式为1s22s22p63s23p63d84s2,
故答案为:1s22s22p63s23p63d84s2;
(2)铜的堆积模型为最紧密堆积,配位数为12,铜原子位于顶点和面心,与二氧化碳分子晶胞结构相似,
故答案为:正方体的八个顶点和六个面心;
(3)XeO3分子中含有3个δ键和一个孤电子对,为三角锥形分子,结构不对称,为极性分子,杂化方式为sp3杂化
故答案为:极性;sp3;三角锥形;
(4)HF含有氢键,沸点较高,易液化,故答案为:HF.点评:
本题考点: 晶胞的计算;原子核外电子排布;判断简单分子或离子的构型;极性分子和非极性分子;原子轨道杂化方式及杂化类型判断;氢键的存在对物质性质的影响.
考点点评: 本题考查较为综合,涉及电子排布式的书写、晶胞结构、分子的极性以及氢键等知识,题目难度中等,本题注意常见金属的堆积模型,为易错点,也是易忽视的地方.1年前查看全部
- 1962年,英国化学家将PtF6和稀有气体单质氙(Xe)适量混合后,首次制得稀有气体化合物六氟合铂酸 氙,发生反应的化学
1962年,英国化学家将PtF6和稀有气体单质氙(Xe)适量混合后,首次制得稀有气体化合物六氟合铂酸 氙,发生反应的化学方程式可表示为:Xe+PtF 6 →XePtF 6 。下列对有关此反应的叙述中正确的是 [ ]A.Xe是氧化剂
B.PtF 6 是氧化剂
C.PtF 6 既是氧化剂,又是还原剂
D.该反应属于非氧化还原反应 lxlxi1年前1
lxlxi1年前1 -
 疯颜疯雨 共回答了18个问题
疯颜疯雨 共回答了18个问题 |采纳率88.9%B1年前查看全部
- 自从稀有气体被发现,人类一直在进行寻找其化合物的尝试.1962年英国化学家巴特利特合成了第一种稀有气体化合物——六氟铂酸
自从稀有气体被发现,人类一直在进行寻找其化合物的尝试.1962年英国化学家巴特利特合成了第一种稀有气体化合物——六氟铂酸氙(XePtF6),在化学界引起了很大震动.同年8月美国化学家也成功地合成了氟和氙的另一种化合物.已知这种化合物中氙元素的质量分数为63.3%,氟元素的质量分数为36.7%,求该化合物的化学式.
 忘不川1年前1
忘不川1年前1 -
 猴子孙 共回答了19个问题
猴子孙 共回答了19个问题 |采纳率94.7%设化合物为XenFm(n.m为氟和氙的脚码)
Xe%===63.3%,F%131n:19m
n:m==1:4
化合物为XenFm为XeF41年前查看全部
- 首先用来与F2反应制备稀有气体化合物的元素是__
首先用来与F2反应制备稀有气体化合物的元素是__
为什么是0族元素中最下面的那个 gpress1年前1
gpress1年前1 -
 cheroer 共回答了21个问题
cheroer 共回答了21个问题 |采纳率95.2%是Xe
因为它的第一电离能和O2相似
而当时已经制出O2+(2是下标,+是上标)的化合物:O2[PtF6]
因此就想到Xe是否也能制成相似的物质,于是用Xe制出了Xe[PtF6]1年前查看全部
- 稀有气体化合物怎样制得其化学键类型及怎样形成化学键
稀有气体化合物怎样制得其化学键类型及怎样形成化学键
应是氧化还原反应吧,且是像氟气这样的强氧化剂吧 yi_bi1年前1
yi_bi1年前1 -
 索多玛盐柱 共回答了15个问题
索多玛盐柱 共回答了15个问题 |采纳率93.3%是第18族的元素,共包括氦、氖、氩、氪、氙和氡六个.所有的稀有气体元素外层s和p轨道都填充满了电子,氦有两个外层电子,其它的都为8个.它们的电离能很高,电子亲合能几乎为零,生成化合物的倾向很小.因此直到20世纪,化学家都认为稀有气体化合物不存在,并将这些元素称为“惰性气体”.
然而,莱纳斯·鲍林在1933年时预测,原子序数较大的稀有气体元素有可能与氟和氧生成化合物.他预言了六氟化氪和六氟化氙(XeF6)的存在,提出八氟化氙可能是个不稳定的化合物,以及氙酸会以高氙酸盐的形式成盐.
现在看来,这些预测相当准确,只是八氟化氙这个化合物不仅在热力学不稳定,而且在动力学上也不稳定.2006年时仍未制得.
相比而言,原子序数较大的稀有气体元素具有更多的电子层,因此内层电子对最外层电子的屏蔽效应致使其电离能减小,可能小到能与电负性强的元素(氟和氧)形成稳定化合物的地步.编辑本段1962年之前 在1962年以前,唯一可以分离出来的稀有气体化合物都是包合物,包括水合包合物.其它则是只有在光谱中才可观测到的配位化合物.
包合物
稀有气体包合物在近几十年曾被广泛研究过,它们由于有可能用于储存稀有气体而引起了人们的兴趣.在这些包合物中,稀有气体原子基本上都是被包容在笼状的主体分子中,即主体分子构成笼状晶格,将稀有气体包藏在笼中.能否形成包合物主要决定于主体分子和客体分子间的几何因素是否合适.例如,氩、氪和氙可以与β-氢醌形成包合物,氦和氖却因为体积太小而无法包合在内.
稀有气体包合物中,研究较多的主体分子是水、氢醌、苯酚和氟代苯酚.
包合物可以用来从稀有气体中分离出He和Ne,及运输Ar、Kr和Xe.此类化合物亦可用作放射源,Kr的包合物是β粒子的安全来源,Xe的包合物则是γ射线的来源.
配位化合物
曾经一度认为诸如Ar·BF3之类的配位化合物可在低温下存在,但始终未经实验验证.并且,有报道称化合物WHe2和HgHe2可由电子轰击制得.然而最近的研究表明,它们并不是真正的化合物,He很有可能只是被金属表面吸附.
水合物
水合物可由将稀有气体压入水中制得.有理论认为,强极性的水分子使稀有气体原子产生诱导偶极,产生偶极-偶极作用力.因此原子序数较大的稀有气体所形成的水合物,如Xe·6H2O,比原子序数小的稀有气体元素形成的要更加稳定.但近年来对于这些化合物是否存在产生了疑问.编辑本段真正的稀有气体化合物 1962年,巴特利特在研究无机氟化物时,发现强氧化性的六氟化铂可将O2氧化为O2.由于O2到O2的电离能(1165 kJ mol)与Xe到Xe的电离能相差不大(1170 kJ mol),因此他尝试用PtF6氧化Xe.结果反应得到了橙黄色的固体.巴特利特认为它是六氟合铂酸氙(Xe[PtF6]). 这是第一个制得的稀有气体化合物.后期的实验证明该化合物化学式并非如此简单,包括XeFPtF6和XeFPt2F11.
在成功合成六氟合铂酸氙,化学家又尝试用类似的六氟化钌来氧化氙.结果发现除了生成Xe(RuF6)x外,还存在有氙和氟气直接生成二元氙氟化物的副反应.因此克拉森(Howard Claassen)通过让氙和氟在高温下反应,成功合成了四氟化氙.
目前合成的稀有气体化合物绝大多数都是氙的化合物,其中比较重要的包括:
氙氟化物——XeF2、XeF4、XeF6 氙的氟氧化物——XeOF2、XeOF4、XeO2F2、XeO3F2、XeO2F4 氙氧化物——XeO3、XeO4 二氟化氙可由Xe和F2混合气暴露在阳光下制得.但有趣的是,1960年代之前的半个世纪中,却没有人发现仅仅混合这两种气体就有可能发生反应.
氡可与氟反应生成二氟化氡,在固态时会发出黄色光.氪与氟反应得到二氟化氪.激发二聚体Xe2及稀有气体卤化物,如XeCl2都被用在准分子激光器中.目前唯一知道的氩化合物是HArF,于2000年制得.虽然2003年时有媒体报道ArF2的存在,但尚未证实.目前还没有制得He和Ne的化合物.
最近制得了一大种类形式为XeOxY2的稀有气体化合物,其中x = 1、2、3,Y是任何电负性强的基团,比如CF3、N(SO2F)2或OTeF5.这类化合物范围相当广,可以有上千个之多,并且涉及氙和氧、氮、碳甚至金之间的化学键.一同报道的还有高氙酸、一些稀有气体卤化物和配离子.化合物Xe2Sb2F11中含有目前已知最长的化学键,其中的Xe–Xe键长308.71 pm.
稀有气体原子可以被包覆在富勒烯分子中形成内嵌富勒烯.广义上看,它们也属于稀有气体化合物的范畴. ]编辑本段富勒烯化合物 稀有气体原子可以被包覆在富勒烯分子中,形成多种多样的内嵌富勒烯型化合物.它们首先在1993年合成.用C60与He或Ne在3bar压力下反应,得到的大约650000个富勒烯分子中,只有一个可以与稀有气体原子形成包合物He@C60或Ne@C60;压力增大至3000bar时,产率增至0.1%.编辑本段应用 稀有气体化合物主要被用作氧化剂.这一类型的试剂包括:氙酸、高氙酸盐、三氧化氙.它们被称为所谓“绿色氧化剂”,所参与的反应中,最终还原产物是气态的稀有气体,不会干扰反应,而且比较容易分离.受氧化性影响,氙氟化物容易放出氟,是有机化学中比较新颖高效的氟化试剂,以二氟化氙的用途最广.
由于氪和氙的放射性核素不易储存,因此常将它们以相应化合物的形式来存放及使用.不好意思我是听说过,但是不是研究这方面的人,只能帮你找点材料,很惭愧,希望能够对你理解有帮助!1年前查看全部
- 稀有气体化合物XeF2为什么是SP3d杂化
 浪子3531年前1
浪子3531年前1 -
 o45qamc 共回答了25个问题
o45qamc 共回答了25个问题 |采纳率92%价电子对互斥理论:Xe价电子组态是5s2 5p6,8个电子,其中两个电子与F形成sigma键,还剩下三对孤对电子.价电子对数=2对成键+3对孤对=5,电子构型为三角双锥.
根据杂化方式与电子构型之间的关系,对应sp3d1年前查看全部
大家在问
- 1英语翻译我是SPA成员,我们将于4月1日晚6点于教学楼四楼的团委报告厅进行关于比赛的宣讲会,特请来去年辽宁省第一名的团队
- 2小明是一个品学兼优的好学生,妈妈一直以他为骄傲.可是有一次他做错了事,妈妈并没迁就他,立刻批评了他,后来.
- 3古诗文填空。(6题限选4题)(1)渔樵于江渚之上,_____________,驾一叶之扁舟,_____________。
- 4暑假作业上面的做不来.高手帮忙.能有详细做法最好我数痴
- 5在ΔABC中,∠C=90°,P为三角形内一点,且S(PAB)=S(PBC)=S(PCA).
- 6________ number of people who own luxury cars is on ________
- 7已知函数f(x)在x=0的某个领域内连续,并f(0)=0,lim[x到0](f(x)/1-cosx)=2 问f(x)在x
- 8(2014•郯城县一模)水、食盐、醋、熟石灰均为生活中常见的物质,利用这些物质难以完成的实验是( )
- 9已知sin阿法减cos阿法=负4分之5,则,则cos阿法*sin阿法=
- 10以My plan 为题写一篇70词左右短文,要求,使用if条件状语从句,中心内容为将来成为一名医生
- 11对话填空(共10题,每小题1分,满分10分)
- 12平角有没有对顶角.我想问一下.1.比如说三条直线相交于一点时.一共有几对对顶角?如果是4条直线呢?2.这个时候有没有把两
- 13排列/组合 4个同学分到3个班级,每班至少1人,则分配分法有几种?求步骤………
- 14有下列命题:A∩B=U,A=B=U
- 1512( )即是3的倍数,又是5的倍数,()里填()?
