将硫化亚铁和稀盐酸在常温下反应生成硫化氢,是什么化学性质?是不是还原性?
 菲菲蝴蝶2022-10-04 11:39:541条回答
菲菲蝴蝶2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 天l涯王子 共回答了20个问题
天l涯王子 共回答了20个问题 |采纳率85%- 还原性是指元素失去电子的性质
一种元素非常容易失去电子,也就是容易 [被] 氧化,就说这种元素的还原性较强.
至于硫化亚铁和稀盐酸生成硫化氢的反应,不是还原性.因为此反应是复分解反应,体现的应该是硫化氢的挥发性.因为硫化氢是气体且为弱电解质,从溶液中逸出,从而使反应顺利进行 - 1年前
相关推荐
- 硫化亚铁和水还有二氧化硫反应生成什么
 free_sc1年前1
free_sc1年前1 -
 gdmi4ex 共回答了19个问题
gdmi4ex 共回答了19个问题 |采纳率84.2%Fes+H2o+so2--Fe2(so4)3+H2s 没有配平,属于氧化还原反应.1年前查看全部
- 请问氯化亚铁如何转化为硫化亚铁?
 xx草1年前1
xx草1年前1 -
 lipeng198319 共回答了24个问题
lipeng198319 共回答了24个问题 |采纳率91.7%加入硫化钠溶液中吧,硫化亚铁难溶
如果是固体的话,可以混合硫和氯化亚铁隔绝空气加热试下1年前查看全部
- 硫化亚铁和硝酸反应生成硝酸铁硫酸一氧化氮和水的化学方程式配平
 聪哥哥仔1年前1
聪哥哥仔1年前1 -
 一条狗0125 共回答了21个问题
一条狗0125 共回答了21个问题 |采纳率95.2%FeS+6HNO3=Fe(NO3)3+H2SO4+3NO+2H2O1年前查看全部
- 请给我写三个离子方程式:1.用稀硝酸溶解硫化亚铁(FeS)固体;2.少量二氧化硫通入次氯酸钙溶液中;3.氢...
请给我写三个离子方程式:1.用稀硝酸溶解硫化亚铁(FeS)固体;2.少量二氧化硫通入次氯酸钙溶液中;3.氢...
请给我写三个离子方程式:1.用稀硝酸溶解硫化亚铁(FeS)固体;2.少量二氧化硫通入次氯酸钙溶液中;3.氢氧化钙溶液与等物质的量的稀硫酸混合 njfwm1年前4
njfwm1年前4 -
 303881710 共回答了19个问题
303881710 共回答了19个问题 |采纳率89.5%1.FeS + 6H+ + 3NO3- CaSO4(沉淀)+2H2O1年前查看全部
- 硫化亚铁是否与硫化氢反应?为什么硫酸铜能与硫化氢反应?请详细说明原因.
 lldmy1年前1
lldmy1年前1 -
 baobeigg 共回答了14个问题
baobeigg 共回答了14个问题 |采纳率85.7%FES+H2S=FE(HS)2
CUSO4+H2S=CUS↓+H2SO41年前查看全部
- 硫化亚铁与硝酸的生成硫酸的反应方程式
 渔夫509156591年前1
渔夫509156591年前1 -
 心漏一拍 共回答了17个问题
心漏一拍 共回答了17个问题 |采纳率94.1%FeS + 6HNO3(稀) = Fe(NO3)3 + H2SO4 + 2H2O + 3NO↑1年前查看全部
- 硫化亚铁与硫酸反应生成什么?要方程式,
 sept121年前2
sept121年前2 -
 飞翔鸟-老歪 共回答了8个问题
飞翔鸟-老歪 共回答了8个问题 |采纳率100%生成SO2,绝对不会是有-2价的硫存在的.1年前查看全部
- 鉴别铁、氧化亚铁、氧化铜、碳、二氧化锰、硫化亚铁
鉴别铁、氧化亚铁、氧化铜、碳、二氧化锰、硫化亚铁
用一种试剂进行鉴别 justicet1年前2
justicet1年前2 -
 tanpin001 共回答了18个问题
tanpin001 共回答了18个问题 |采纳率77.8%类似问题
鉴别铁,氧化亚铁,氧化铜,硫化亚铁四种,应该加什么鉴别
能同时鉴别铁,氧化亚铁,氧化铜,硫化亚铁的试剂
木炭,铁粉,二氧化锰,氧化铜,氧化亚铁的鉴别1年前查看全部
- 为什么硫化铜能存在于盐酸中 硫化亚铁不能存在于盐酸中
 异珍1年前2
异珍1年前2 -
 面朝大海_ 共回答了21个问题
面朝大海_ 共回答了21个问题 |采纳率85.7%你学了化学选修4了吗?这是因为硫化铜(不溶)的溶解度小于氯化铜(可溶),而硫化亚铁能与盐酸反应生氯化亚铁(溶液)与硫化氢(气体,散走).1年前查看全部
- 去除硫化亚铁中少量铁粉
 大火柴小女孩1年前2
大火柴小女孩1年前2 -
 有缘无份 共回答了19个问题
有缘无份 共回答了19个问题 |采纳率78.9%可以用磁铁
由于硫化亚铁和铁都不溶于水,都能溶于酸,所以不能过滤也不能用酸
也可以用氯化铁溶液
2FeCl3+Fe==3FeCl21年前查看全部
- 少量稀硝酸滴入硫化亚铁中先发生氧化还原反应还是复分解反应?
 hua651年前3
hua651年前3 -
 jzlius 共回答了21个问题
jzlius 共回答了21个问题 |采纳率85.7%这里就不发生复分解反应
只有Fe2+和S2-被氧化的两个反应
3Fe2+ +NO3- +4H+ 3S + 2NO+ 4H2O
先发生第二个反应,因为S2- 还原性更强1年前查看全部
- 铁粉与硫粉混合加热生成硫化亚铁,反应方程式怎么写?
铁粉与硫粉混合加热生成硫化亚铁,反应方程式怎么写?
我今天就要用`~ croce1年前1
croce1年前1 -
 蹇驴嘶 共回答了27个问题
蹇驴嘶 共回答了27个问题 |采纳率81.5%Fe+S(加热)=FeS1年前查看全部
- 已知硫化亚铁可溶于稀硫酸生成硫化氢.若取一定量铁粉和硫粉的混合物,隔绝空气加热充分反应,冷却后再加入足量稀硫酸,产生2.
已知硫化亚铁可溶于稀硫酸生成硫化氢.若取一定量铁粉和硫粉的混合物,隔绝空气加热充分反应,冷却后再加入足量稀硫酸,产生2.24升气体(标准状况下),则下列说法正确的是( )
A.2.24升气体的质量肯定是3.4克 B.原混合物的质量不可能大于8.8克
C.原混合物加热后肯定生成0.1mol硫化亚铁 D.原混合物中一定含有5.6克铁 dqgw1年前1
dqgw1年前1 -
 苗启杰 共回答了15个问题
苗启杰 共回答了15个问题 |采纳率86.7%答案为D.由于气体物质的量为0.1mol,并且是稀硫酸,有可能生成的是氢气,并且硫化亚铁与硫酸反应,1mol对应1mol硫化氢气体,1mol铁对应1mol氢气,故硫化亚铁和铁与稀硫酸反应的总量是0.1mol,一定有5.6g铁.1年前查看全部
- 只用一种试剂鉴别铁,氧化亚铁,氧化铜,硫化亚铁,二氧化锰
 jiajia3151年前3
jiajia3151年前3 -
 南燕七 共回答了16个问题
南燕七 共回答了16个问题 |采纳率93.8%用稀硫酸.
Fe:溶解,生成无色气体,溶液变浅绿色;
FeO:溶解,无气体生成,溶液变浅绿色;
CuO:溶解,无气体生成,溶液变蓝色;
FeS:溶解,生成臭鸡蛋味气体(H2S),溶液变浅绿色;
MnO2:溶解,生成无色气体(O2),溶液无色.1年前查看全部
- 用一种试剂鉴别硫化亚铁,木炭,二氧化锰,氧化铜是什么
 tangyuansf1年前2
tangyuansf1年前2 -
 abandon6408 共回答了20个问题
abandon6408 共回答了20个问题 |采纳率80%浓盐酸
---
和硫化亚铁可以反应生成难闻(臭鸡蛋味),无色的气体(H2S)
和木炭没有反应
和二氧化锰混合加热可以的到黄绿色气体(Cl2)
和氧化铜反应,可以生成蓝色或绿色溶液(看CuCl2浓度)1年前查看全部
- 用块状固体硫化亚铁常温下与盐酸制取硫化氢,收集方法是什么
 ft23sina1年前1
ft23sina1年前1 -
 只会洗碗 共回答了15个问题
只会洗碗 共回答了15个问题 |采纳率93.3%排硫化钠溶液1年前查看全部
- 氯化亚铁生成硫化亚铁的化学方程式和氢氧化亚铁生成硫酸亚铁的方程式
 lovexj20041年前3
lovexj20041年前3 -
 懒小聪 共回答了14个问题
懒小聪 共回答了14个问题 |采纳率85.7%FeCl2+Na2S==FeS(向下箭头符号)+2NaCl
Fe(OH)2+H2SO4=FeSO4+2H2O1年前查看全部
- 为什么不能用稀盐酸和硫化亚铁制硫化氢?
为什么不能用稀盐酸和硫化亚铁制硫化氢?
答案是HCl会挥发会有HCl杂质
同理 为什么要用稀盐酸和碳酸钙制CO2呢? dingding20031年前2
dingding20031年前2 -
 天堂人鱼 共回答了25个问题
天堂人鱼 共回答了25个问题 |采纳率92%第一个不用稀盐酸但是可以用稀硫酸,就是因为HCl混在H2S不好用试剂除去,而制二氧化碳时虽然混有HCl但是通过饱和食盐水就可以除去HCl气体.1年前查看全部
- 硫酸铁和硫化氢反应生成什么,原理是什么,为什么不生成硫化亚铁沉淀和二氧化硫
 senu981年前1
senu981年前1 -
 q_papaya 共回答了14个问题
q_papaya 共回答了14个问题 |采纳率78.6%主反应是Fe3+把S2-氧化成S单质.副反应会生成硫化铁和硫化亚铁.Fe3+不能和S反应生成SO21年前查看全部
- 硫酸亚铁怎样生成硫化亚铁化学方程式还有离子方程式
 不吃草的小灰兔1年前3
不吃草的小灰兔1年前3 -
 fhwhecj 共回答了17个问题
fhwhecj 共回答了17个问题 |采纳率100%FeS+H2SO4=H2S↑+FeSO4
FeS+2H+ =Fe2+ +H2S ↑1年前查看全部
- 硫化亚铁除去废水中的重金属比硫化氢好?学到 沉淀溶解平衡
 丝丝妖气1年前1
丝丝妖气1年前1 -
 紫色尘埃 共回答了29个问题
紫色尘埃 共回答了29个问题 |采纳率86.2%重金属离子比如铜离子 锌离子 汞离子等 都可以和硫离子或硫化氢或硫化亚铁等生成极难溶于水的金属硫化物而达到除去重金属离子的目的 因为硫化氢溶于水后形成的氢硫酸是弱电解质 而弱电解质的电离微弱 而硫化亚铁是盐 可以直接和重金属离子反应生成比硫化亚铁溶度积更小的金属硫化物 所以等量的硫化亚铁比硫化氢能与更多的重金属离子反应 即硫化亚铁比硫化氢效果好1年前查看全部
- 硫化亚铁和硫化氢可以相互转化吗?化学方程式是什么?硫的化合物的所有化学方程式!
 hao36261年前1
hao36261年前1 -
 goost 共回答了12个问题
goost 共回答了12个问题 |采纳率91.7%FeS+2HCl=FeCl2+H2S1年前查看全部
- 为什么硫化钠溶液不能使亚铁氰化钾溶液产生硫化亚铁沉淀,而饱和硫化氢溶液能使铜氨配合物的溶液产生硫化
 做个小记号1年前1
做个小记号1年前1 -
 lnyylzl 共回答了19个问题
lnyylzl 共回答了19个问题 |采纳率84.2%这是配位平衡与沉淀平衡的趋势大小的比较问题.
由于 [Fe(CN)6](4-) = Fe(2+) + 6CN(-)
中配合物极稳定,所以溶液中产生的Fe(2+)浓度极低,而FeS的溶解度(溶度积)相对又较大,所以溶液中[S(2-)] * [Fe(2+)] < KspFeS,因此沉淀无法生成.
而 [Cu(NH3)4](2+) = Cu(2+) + 4NH3
中配合物的稳定性远不如亚铁氰化钾,而CuS的溶度积又远小于FeS,所以溶液中[S(2-)] * [Cu(2+)] > KspCuS,因此有沉淀生成.1年前查看全部
- 硫化亚铁,硫化铁化学式都是FeS?
硫化亚铁,硫化铁化学式都是FeS?
百科里这么写,怎么可能?铁是+2+3可变价啊!硫是-2,+4,+6可变价啊?
什么什么啊?帮帮忙啊! ying荧1年前3
ying荧1年前3 -
 zpz5884 共回答了19个问题
zpz5884 共回答了19个问题 |采纳率89.5%不.
铁的硫化物很多,常见的有硫化铁Fe2S3,硫化亚铁FeS,二硫化亚铁FeS2.
百科里之所以那样写,是因为在有时候铁的变价会被人们忽略,即不管是三价铁还是二价铁,都统称为某某化铁,这是一个模糊的概念,没有一个标准化的称谓1年前查看全部
- 已知硫的活泼性比碘单质要弱,那么硫化亚铁能不能与碘单质反应?
 jcc_max1年前1
jcc_max1年前1 -
 舞舞潇潇 共回答了18个问题
舞舞潇潇 共回答了18个问题 |采纳率94.4%不行 FeS是难溶物.没有硫离子的存在.1年前查看全部
- 写出下列离子方程式1硫酸铝与过量氨水2次氯酸钙与二氧化硫3钠和冷水4硫化亚铁和稀硫酸
 zhq902851年前1
zhq902851年前1 -
 梦里醒着睡 共回答了16个问题
梦里醒着睡 共回答了16个问题 |采纳率93.8%1、 2Al3+ + 6NH3.H2O == 2Al(OH)3↓ + 6NH4+2、 Ca2+ + 2ClO- + 2SO2 + 2H2O == CaSO4↓ + 4H+ + 2Cl- + SO4^2-3、 2Na + 2H2O == 2Na + 2OH- + H2↑4、 FeS + 2H+ == Fe2+ + H2S↑1年前查看全部
- 硫化亚铁和硫化铁在水中的沉淀溶解平衡方程式?
 erstd1年前1
erstd1年前1 -
 修道的魊 共回答了12个问题
修道的魊 共回答了12个问题 |采纳率91.7%FeS=====Fe2+ + S2-1年前查看全部
- 几种物质的颜色硫化亚铁 硫化铜硫化亚铜硫化镁硫化铝它们在溶液中是沉淀吗是的话颜色是什么 不是的话溶液颜色是什么
 uy55uy1年前2
uy55uy1年前2 -
 xinyi7983 共回答了19个问题
xinyi7983 共回答了19个问题 |采纳率84.2%硫化亚铁黑色,硫化铜黑色,硫化亚铜黑色或铅灰色光泽粉末,硫化镁白色或红棕色晶体或者粉末,硫化铝白色固体.在冷水中硫化镁会生成Mg(OH)2和Mg(HS)2,热水中分解成氢氧化镁和硫化氢.硫化铝入水分解,生成氢氧化铝和硫化氢!1年前查看全部
- 在通常情况下,硫化氢(H2S)是一种没有颜色、具有臭鸡蛋气味的有毒气体,比空气重,能溶于水.实验室用块状固体硫化亚铁(F
在通常情况下,硫化氢(H2S)是一种没有颜色、具有臭鸡蛋气味的有毒气体,比空气重,能溶于水.实验室用块状固体硫化亚铁(FeS)跟稀硫酸通过复分解反应来制取H2S气体,请回答:
(1)实验室制H2S气体的发生装置可选用______(填“制H2”或“制O2”)的气体发生装置;
(2)收集H2S气体应选用______法;
(3)硫化亚铁与稀硫酸反应的化学方程式为______;
(4)已知H2S水溶液的pH值小于7,向其中加入紫色石蕊试液,溶液呈______色;
(5)实验室制取H2S气体时,为防止污染和避免中毒,多余的硫化氢应该用______吸收. zzlwj1年前1
zzlwj1年前1 -
 95585 共回答了20个问题
95585 共回答了20个问题 |采纳率95%解题思路:制取装置包括加热和不需加热两种,实验室用块状固体硫化亚铁(FeS)跟稀硫酸反应制取的,因此不需要加热;实验室是用锌粒和稀硫酸在常温下反应制氢气的,因此也不需要加热;如果用双氧水和二氧化锰制氧气就不需要加热;收集H2S气体应选用向上排空气法收集,因为硫化氢气体比空气重,能溶于水;硫化亚铁与稀硫酸反应生成硫酸亚铁和硫化氢气体;H2S水溶液的pH值小于7,因此呈酸性,向其中加入紫色石蕊试液,溶液呈红色;硫化氢(H2S)是一种没有颜色、具有臭鸡蛋气味的有毒气体,为防止污染和避免中毒,多余的硫化氢应该用氢氧化钠溶液吸收.(1)实验室用块状固体硫化亚铁(FeS)跟稀硫酸反应制取的,因此不需要加热;实验室是用锌粒和稀硫酸在常温下反应制氢气的,因此也不需要加热;如果用双氧水和二氧化锰制氧气就不需要加热;故答案为:制H2或制O2
(2)收集H2S气体应选用向上排空气法收集,因为硫化氢气体比空气重,能溶于水,故答案为:向上排空气
(3)硫化亚铁与稀硫酸反应生成硫酸亚铁和硫化氢气体,故答案为:FeS+H2SO4=FeSO4+H2S↑
(4)H2S水溶液的pH值小于7,因此呈酸性,向其中加入紫色石蕊试液,溶液呈红色,故答案为:红
(5)硫化氢(H2S)是一种没有颜色、具有臭鸡蛋气味的有毒气体,为防止污染和避免中毒,多余的硫化氢应该用氢氧化钠溶液吸收,故答案为:NaOH溶液点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;酸碱指示剂及其性质;溶液的酸碱性与pH值的关系;书写化学方程式、文字表达式、电离方程式.
考点点评: 本考点主要考查了气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和溶液的酸碱性等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.1年前查看全部
- 一步制的硫化亚铁的方法类型不同,要5种
 koeiztxc1年前1
koeiztxc1年前1 -
 粉猫猫P 共回答了17个问题
粉猫猫P 共回答了17个问题 |采纳率88.2%Fe+S=加热=FeS、FeSO4+Na2S==FeS+Na2SO4(水溶液中)、FeSO4+2C=加热=FeS+2CO2、H2S+FeO=加热=FeS+H2O、Fe+Na2S2O3=加热=FeS+Na2SO3、2Fe+SCl2==FeCl2+FeS1年前查看全部
- 硫化亚铁和硫化亚铜分别与浓硝酸反应的方程式
 柔打礼服1年前1
柔打礼服1年前1 -
 紫藤秀 共回答了22个问题
紫藤秀 共回答了22个问题 |采纳率77.3%FeS +12HNO3 ===9NO2 + Fe(NO3)3 + H2SO4 +5H2O
Cu2S +14HNO3 ==10NO2 +2Cu(NO3)2 +H2sO4 +6H2O1年前查看全部
- 为什么实验室用稀硫酸洗涤硫化亚铁沉淀?而不用稀盐酸等其他强酸?
 纸妄1年前2
纸妄1年前2 -
 qlilip 共回答了15个问题
qlilip 共回答了15个问题 |采纳率80%稀盐酸或其它酸与硫化亚铁反应,产生硫化氢;
氧化性酸产生二氧化硫.1年前查看全部
- 将a克氧化铁和硫化亚铁组成的混合物溶解在足量的稀盐酸中,结果得到b克沉淀,则原混合物中硫化亚铁的质量
将a克氧化铁和硫化亚铁组成的混合物溶解在足量的稀盐酸中,结果得到b克沉淀,则原混合物中硫化亚铁的质量
可能为0
A 5b克 B (a-5b)g C (a-11b/4)g D 11b/4g 白文超1年前1
白文超1年前1 -
 zzlove 共回答了17个问题
zzlove 共回答了17个问题 |采纳率88.2%得到的沉淀为S单质,发生的反应为
H2S + 2Fe3+===S +2Fe2+ +2H+ 我们根据沉淀质量求H2S或者Fe3+的质量
34 112 32
X Y b 如果H2S不足量,那么硫元素全部形成沉淀,所以
S-----FeS
32 88
b =88b/32=11b/4 也就是原来混合物中有11b/4g FeS
我们再来分析 如果是H2S过量,那么Fe3+完全反应完
y=112b/32 g 而2Fe3+-------------Fe2O3
112 160
112b/32 =5bg 也就是原来混合物中有5bgFe2O3,所以FeS质量为a-5b 克,答案为B C1年前查看全部
- 高锰酸钾与硫化亚铁有如下反应6KMnO4 +10FeS +24H2SO4 === 3K2SO4+ 6MnSO4+ 24H
高锰酸钾与硫化亚铁有如下反应6KMnO4 +10FeS +24H2SO4 === 3K2SO4+ 6MnSO4+ 24H2O+ 5Fe2(SO4)3 +10S
若上诉反应前后质量减少了2.8克,则硫元素与高锰酸钾之间发生电子转移数目是( )个 hwq21751年前1
hwq21751年前1 -
 miaomiao7721 共回答了19个问题
miaomiao7721 共回答了19个问题 |采纳率94.7%由反应式可见反应前的1份FeS固体,反应后变成1份硫单质,式量之差为56,而反应前后固体质量减少了2.8g,可知有2.8/56=0.05mol的FeS发生了反应,在该反应中,铁失去一个电子变成三价铁离子,硫失去两个电子变成单质硫,因此1molFeS失去3mol电子,0.05molFeS失去0.15mol电子,转移的电子数目为0.15NA个,或9.03*10^22个.1年前查看全部
- 稀硝酸与硫化亚铁反应,为什么只能把负2价的硫氧化却不能把正2价的铁氧化
稀硝酸与硫化亚铁反应,为什么只能把负2价的硫氧化却不能把正2价的铁氧化
真的练习册上就这么说 mswangcm1年前4
mswangcm1年前4 -
 jiajiasl 共回答了29个问题
jiajiasl 共回答了29个问题 |采纳率82.8%是吗?硝酸过量的话二者都氧化1年前查看全部
- 离子反应方程式和一道化学题1.过量SO2通入少量氨气中2.SO2通入淀粉的碘溶液中,蓝色褪去3.用硫化亚铁和稀硫酸反应制
离子反应方程式和一道化学题
1.过量SO2通入少量氨气中
2.SO2通入淀粉的碘溶液中,蓝色褪去
3.用硫化亚铁和稀硫酸反应制取H2S气体
4.H2S气体通入FeCl3溶液中出现浑浊
5.蔗糖中滴加浓硫酸变成黑面包
可以的话顺便打一下化学方程式(有加分的哦)
某白色固体混合物,可能含有NaHSO4、BaCl2、MaCl2、NaHCO3 和NaAlO2中的一种或几种.对式样进行检验有如下实验现象:1.取少量该固体物质,加水溶解,最终得到澄清溶液,没有沉淀和气体生成;2.向所得澄清溶液中滴加氢氧化钠溶液,有白色沉淀生成,加至过量时沉淀消失 .
1.原混合物中一定含有的物质是:
2.原混合物中不一定含有的物质是:
3.写出实验中产生沉淀和沉淀消失的化学反应方程式 阅人多矣1年前4
阅人多矣1年前4 -
 没有杂乱的ll 共回答了15个问题
没有杂乱的ll 共回答了15个问题 |采纳率93.3%SO2+NH3+H2O=NH4++HSO3-
I2+SO2+2H2O=2I-+SO42-+4H+
FeS+2H+=H2S+Fe2+
H2S+2Fe3+=S+2Fe2++2H+
C12H22O11=(浓硫酸)=12C+11H2O C+2H2SO4(浓)=CO2+2SO2+2H2O
1.NaHSO4 NaAlO2
2.NaHCO3 BaCl2
3.Al3+ +3OH-=Al(OH)3 Al(OH)3+OH-=AlO2-+2H20(4H+ + AlO2-=Al3++2H2O)1年前查看全部
- 硫化亚铁溶于稀硝酸中方程式FeS + 6HNO3 = Fe(NO3)3 + H2SO4 + 3NO + 2H2O,
 hufenglou1年前3
hufenglou1年前3 -
 傻姑娘83 共回答了22个问题
傻姑娘83 共回答了22个问题 |采纳率81.8%对.
1).得失电子相等.这里Fe由+2价升到+3价,S由-2价升到+6价,Fe和S总共上升了9;而N由+5价降到+2价(一共有3个N),故一共下降9.
2).反应生成的4种东西中铁离子,硝酸根离子,氢离子,硫酸根离子能大量共存.
故正确.1年前查看全部
- 硫化亚铁与氧化铁投入到硝酸溶液中反应的化学反应方程式为
硫化亚铁与氧化铁投入到硝酸溶液中反应的化学反应方程式为
是氧化亚铁 大难不vv必有后福1年前3
大难不vv必有后福1年前3 -
 81759938 共回答了19个问题
81759938 共回答了19个问题 |采纳率89.5%氧化铁:
化学方程式:1 FeS +4 Fe2O3 +8 HNO3 =1 FeSO4 +4 Fe(NO3)2 +4 H2O
离子方程式:1 FeS +4 Fe2O3 +8 H+ =5 (Fe)2+ + (SO4)2- +4 H2O
这只是一种可能而已,还有其他可能,比如生成(SO3)2-,或者硝酸够浓的话还会继续氧化Fe2+成为Fe3+.
氧化亚铁:
化学方程式:3 FeS ╃3 FeO ╃ 10 (NO3)- ╃22 H+ = 6 Fe3+ ╃ 3 (SO4)2- ╃ 10 NO +11 H2O
离子方程式:3 FeS ╃3 FeO ╃ 22HNO3 = 4 Fe(NO3)3 ╃ Fe2(SO4)3 ╃ 10 NO +11 H2O
PS:昨晚突然断网了,不好意思啊.
好久没接触化学了,一时反应不过来,有什么疑问再补充吧,尽量满足你.1年前查看全部
- 硫化铝和硫化亚铁是不溶于水能容于强酸吗?
 ytgw00001年前1
ytgw00001年前1 -
 巴蒂M 共回答了17个问题
巴蒂M 共回答了17个问题 |采纳率88.2%硫化铝在水中立即发生双水解反应,生成氢氧化铝沉淀和硫化氢气体(带有臭鸡蛋气味的有毒气体).它与强酸也能发生发应,生成硫化氢气体和响应的铝盐.
硫化亚铁难溶于水,但可以和强酸反应,也生成硫化氢气体和对应的亚铁盐.1年前查看全部
- 用硫化亚铁制取硫化氢最适合的酸 为什么是稀硫酸而不是盐酸
 lexeing1年前1
lexeing1年前1 -
 小安秀吉 共回答了23个问题
小安秀吉 共回答了23个问题 |采纳率95.7%因为盐酸本身就是一种挥发性酸,他自己就会释放出HCl气体.这样制取的硫化氢气体就不纯了.1年前查看全部
- 几个化学的反应方程式亚硫酸钠与浓硫酸反应,二氧化锰与浓硫酸反应,硫化亚铁与稀盐酸反应
 lengdong19901年前5
lengdong19901年前5 -
 sunlang 共回答了18个问题
sunlang 共回答了18个问题 |采纳率100%Na2SO3+H2SO4(浓)=Na2SO4+H2SO3
4KCl+4H2SO4(浓)+MnO2=MnCl2+4KHSO4+Cl2↑+2H2O
2HCl+FeS=H2S+FeCl21年前查看全部
- 什么铁跟硫起反应生成的是硫化亚铁,而跟氯气起反应生成的 却是氯化铁而不是氯化亚
什么铁跟硫起反应生成的是硫化亚铁,而跟氯气起反应生成的 却是氯化铁而不是氯化亚
为什么铁跟硫起反应生成的是硫化亚铁,而跟氯气起反应生成的 却是氯化铁而不是氯化亚铁 aqua121年前3
aqua121年前3 -
 szjdd2zd 共回答了23个问题
szjdd2zd 共回答了23个问题 |采纳率87%因为氯气的氧化性比硫的强
得电子能力更强一些1年前查看全部
- 硫化亚铁和过量浓硫酸
 noirxyz1年前1
noirxyz1年前1 -
 45168008 共回答了17个问题
45168008 共回答了17个问题 |采纳率94.1%稀:FeS 2H = Fe2 H2S↑
浓:2FeS 6H2SO4(浓) =(Δ) Fe2(SO4)3 3SO2↑ 2S 6H2O
若浓H2SO4过量则可发生后续反应:S 2H2SO4(浓) =(Δ) 3SO2↑ 2H2O1年前查看全部
- 1.这个离子方程式为什么不对?硫化亚铁放入盐酸中:S(2-)+2H(+)=H2S2.为什么下列离子在酸性条件中不能共存?
1.这个离子方程式为什么不对?
硫化亚铁放入盐酸中:S(2-)+2H(+)=H2S
2.为什么下列离子在酸性条件中不能共存?
A.氯离子,铝离子,钠离子,硝酸根离子
B.钾离子,氨根离子,硫酸根离子,硝酸根离子
3.这个说法对吗:形成物质中的化学键时,要吸收能量
4."核素"的概念是什么? zexsky1年前3
zexsky1年前3 -
 crystaltxs 共回答了18个问题
crystaltxs 共回答了18个问题 |采纳率83.3%固体是要写全部化学式的
硝酸根在酸性条件下有强氧化性,会把氯离子氧化成更高价氯
和上面一样,硝酸根会把氨根氧化为高价N
上面的筒子说了成键放热赫赫
核素是指具有一定数目质子和一定数目中子的一种原子.例如,原子核里有6个质子和6个中子的碳原子,质量数是12,称为碳-12核素,或写成12C核素.原子核里有6个质子和7个中子的碳原子,质量数为13,称13C核素.氧元素有16O,17O,18O三种核素.具有多种核素的元素称多核素元素.自然界仅有一种核素存在的元素称为单核素元素,如氦、氟、铝、钠等20种元素.质子数为偶数的元素,可有较多的稳定核素,一般不少于3个,而质子数为奇数的元素,通常只有一个稳定核素,从不会多于两个,这是由核子的结合能所决定的.多核素元素中各核素互称同位素,因为它们处于周期表中同一位置上,化学性质基本相同,但核性质不同;单核素元素没有同位素.核素的质量即原子质量,总小于孤立质子、中子和电子的质量总和,在概念上也不等于质量数,在数值上除12C外均与质量数稍有不同.核素的质量是用质谱仪测定的,这种测定很先进,可测得7位或更多位有效数字.1年前查看全部
- 下列离子方程式书写错误的是( ) A.硫化亚铁与稀H 2 SO 4 反应:2H + + FeS = H 2 S↑+
下列离子方程式书写错误的是()
A.硫化亚铁与稀H 2 SO 4 反应:2H + + FeS = H 2 S↑+ Fe 2 + B.碳酸氢钠溶液中加入稀盐酸:HCO 3 - + H + = CO 2 ↑+ H 2 O C.NaHSO 3 溶液与NaHSO 4 溶液混合:HSO 3 - + H + = H 2 O + SO 2 ↑ D.次氯酸钙溶液中通入少量二氧化硫反应:Ca 2 + + 2ClO - + H 2 O + SO 2 =CaSO 3 ↓+ 2HClO  135621298791年前1
135621298791年前1 -
 想想甜甜 共回答了23个问题
想想甜甜 共回答了23个问题 |采纳率91.3%D
次氯酸盐具有氧化性,能把SO 2 氧化生成硫酸,所以选项D中的生成物应该是氯化钙和硫酸,因此答案选D。1年前查看全部
- 硫化亚铁和氧气反应怎么用双线桥
 kingcai198309101年前1
kingcai198309101年前1 -
 我要起床 共回答了15个问题
我要起床 共回答了15个问题 |采纳率100%...|...|---------------------|.|
4FeS + 7O2 -----> 2Fe2O3 + 4SO2
.|------------------|.|1年前查看全部
- 硫化氢(H2S)是一种有毒气体,密度比空气大,且能溶于水形成氢硫酸.实验室常用块状固体硫化亚铁(FeS)与稀H2SO4混
硫化氢(H2S)是一种有毒气体,密度比空气大,且能溶于水形成氢硫酸.实验室常用块状固体硫化亚铁(FeS)与稀H2SO4混合,在常温下反应制得硫化氢气体,同时生成硫酸亚铁.试回答:
(1)实验室制取硫化氢气体的化学方程式为:______;
(2)根据装置图回答下列问题: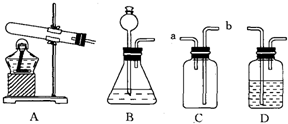
①制取硫化氢气体的发生装置可选用(填序号)______;
②若用C装置收集硫化氢气体,H2S气体应从(填“a”或“b”)______进入,原因是______;
③为验证硫化氢气体的水溶液呈酸性,可将该气体通入装置D中.D中所盛试剂应该是______,现象是______;
④制取H2S气体实验中,多余的气体能否直接排放到空气中?为什么?应怎样处理?______. zings1231年前1
zings1231年前1 -
 sl3397837 共回答了14个问题
sl3397837 共回答了14个问题 |采纳率92.9%(1)实验室制取硫化氢气体的化学方程式为:FeS+H2SO4═FeSO4+H2S↑.
故填:FeS+H2SO4═FeSO4+H2S↑.
(2)①硫化亚铁和稀硫酸反应不需要加热,应该用B装置作为发生装置.
故填:B.
②因为硫化氢气体的密度比空气大,所以H2S气体应从b导管进入.
故填:b;硫化氢气体的密度比空气大.
③为验证硫化氢气体的水溶液呈酸性,可将该气体通入装置D中,D中所盛试剂应该是紫色石蕊试液,现象是溶液由紫色变成红色.
故填:紫色石蕊试液;溶液由紫色变成红色.
④因为硫化氢气体有毒,排放到空气中会污染环境,所以不能把硫化氢排放到空气中;
处理方法:将尾气用氢氧化钠等碱溶液吸收,这是因为氢氧化钠溶液能和硫化氢反应生成硫化钠和水.
故填:不能;因为H2S气体有毒,会污染空气;处理方法:将尾气用氢氧化钠等碱溶液吸收.1年前查看全部
- 求硫化亚铁与盐酸,硝酸钡与硫酸钠 醋酸与氢阳化钠 石灰石与盐酸 氯化铝与氨水的离子方程式?
 耒木451年前1
耒木451年前1 -
 rqshen 共回答了18个问题
rqshen 共回答了18个问题 |采纳率83.3%FeS+2H+=H2S+Fe2+
Ba2++SO42-=BaSO4
CH3COOH+OH-=CH3COO-+H2O
CaCO3+2H+=Ca2++H2O+CO2
Al3++3NH3.H2O=Al(OH)3+3NH4+1年前查看全部
- 写出下列离子方程式1小苏打溶液加醋酸2溴化亚铁溶液加过量氯气3硫化亚铁加入用硫酸酸化过的氧化氢4电解饱
写出下列离子方程式1小苏打溶液加醋酸2溴化亚铁溶液加过量氯气3硫化亚铁加入用硫酸酸化过的氧化氢4电解饱
和食盐水 elaineqian1年前1
elaineqian1年前1 -
 e403 共回答了16个问题
e403 共回答了16个问题 |采纳率81.3%1、 HCO3- + CH3COOH == CH3COO- + H2O + CO2↑
2、 2Fe2+ + 4Br- + 3Cl2 == 2Fe3+ + 6Cl- + 2Br2
3、 2FeS + 3H2O2 + 6H+ == 2S↓ + 2Fe3+ + 6H2O
4、 2Cl- + 2H2O ==通电== 2OH- + H2↑ + Cl2↑1年前查看全部
大家在问
- 1一种袋装咖啡粉净重500克,每冲一杯咖啡需要6克咖啡粉和四克方糖.冲完这袋咖啡粉,大约需要多少千克方糖
- 2ΔABC中,∠B=45°,AB=2,AC=3,AD⊥BC于D,求BC
- 3已知1+X+X1+X2+X3+X4=0 1+x1+x2+x3+x4+...x1998+x1999=
- 4I just want to be the one who loves myself most.这一句有语法错误吗?
- 5长度为36个字符的英文句子要唯美一点的句子哦
- 6左边是豸,右边是区的是什么字?在史记里面的五帝本纪第一里面滴。
- 7左边一个豸右边一个亘念什么字有这个字嘛.
- 8什么是pair-end 测序?只测一个片段的两端吗,那中间的序列怎么得知?有什么优点?
- 9水平面上的重150牛的物体受到一个斜向上的拉力F=100牛处于匀速直线运动状态,拉力与水平方向的夹角为30度求<1>地面
- 10ride、eat、open、chase、throw的单三形式.
- 115( )0000大于530000?6( )8万小于680万?1345000大于134( )000 2( )5万小于289
- 12一桶油用去10分之7后加入15千克后正好是这桶油的一半.问这桶油多少千克
- 13芳芳今年11岁,妈妈今年43岁,几年后妈妈年龄是女儿的3倍
- 14寒假作业是不是光写语文数学就行是五年级的
- 15不定式翻译昨天没有人在家,因为所有人都去度假了(两个不定代词) 不定式翻译你想给你的爸爸买点什么嘛
