甲烷燃料电池电解质是碱性 电化学方程式
 caoliang19842022-10-04 11:39:543条回答
caoliang19842022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 fun10000 共回答了18个问题
fun10000 共回答了18个问题 |采纳率88.9%- 首先写出总的离子反应方程式:CH4+2O2+2OH-==CO32-+3H20 ①就是CH4在O2中燃烧,生成的CO2和OH-反应生成CO32-的离子反应方程式接着写正极,记住:正极在碱性条件下的反应一定是:O2+4e-+2H2O==4OH- ②接着将总反应式减去正极反应式就是负极反应式,这里有一点非常重要,就是一定要将O2消去,因为原电池负极发生氧化反应,而O2发生还原反应 故一定要将O2消去将②X2 得到 2O2+8e-+4H2O===8OH- ③①-③ 得到CH4-8e--4H2o+2OH-==CO32-+3H2O-8OH-移项的到负极反应式:CH4+10OH--8e-==CO32-+7H20总反应:CH4+2O2+2OH-==CO32-+3H20负极:CH4+10OH--8e-==CO32-+7H20正极:O2+4e-+2H2O==4OH-希望我的方法对你有帮助
- 1年前
 clfly 共回答了1个问题
clfly 共回答了1个问题 |采纳率- 负极:CH4+10OH - - 8e- = CO32- +7H2O
正极:2O2+8e-+4H2O = 8OH-
CH4+2O2+2OH-===CO32-+3H2O - 1年前
 半文钱 共回答了22个问题
半文钱 共回答了22个问题 |采纳率86.4%- CH4+OH-→H2O+CO2 自己配平
- 1年前
相关推荐
- 求甲烷燃料电池的正负极方程式(电解质溶液为Na2CO3)各位学霸帮帮忙
 爱路蜗牛1年前2
爱路蜗牛1年前2 -
 qq67 共回答了8个问题
qq67 共回答了8个问题 |采纳率12.5%1年前查看全部
- 甲烷燃料电池以硫酸为电解质正负极反应和总反映方程式
 shelee0410271年前1
shelee0410271年前1 -
 爱情已离开nn区 共回答了17个问题
爱情已离开nn区 共回答了17个问题 |采纳率100%甲烷燃料电池总反应:CH4+2O2---->CO2+2H2O (酸性介质)
正极:2O2+8H+ +8e- = 4H2O 负极:CH4+ 2H2O - 8e- = CO2 + 8H+1年前查看全部
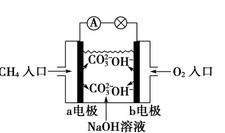
- (1)如图是甲烷燃料电池原理示意图,回答下列问题:
(1)如图是甲烷燃料电池原理示意图,回答下列问题:
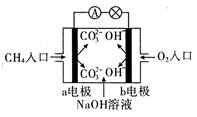
①电池的负极是 (填“a”或“b” )极,该极的电极反应式是 。
② 电池工作一段时间后电解质溶液的pH (填“增大”、“减小”或“不变”)。
(2)利用甲烷燃料电池及下图所示的装置完成电解饱和食盐水的实验,要求测定产生的氢气的体积,并检验氯气的氧化性。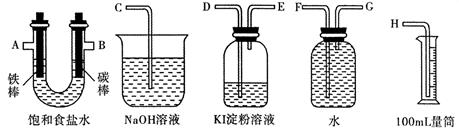
①设计上述实验装置时,各接口的正确连接顺序为: 接 、 接 A 、 B 接 、 接 。
②实验中,在盛有 KI 淀粉溶液的容器中发生反应的离子方程式为 。
③已知饱和食盐水50mL,某时刻测得 H 2 体积为56mL (标准状况),此时溶液 pH 约为 婚缘1年前1
婚缘1年前1 -
 厅功 共回答了14个问题
厅功 共回答了14个问题 |采纳率85.7%(1)①a CH 4 +10OH - -8e - ==CO 3 2- +7H 2 O ②减小
(2)①H F G D E ②Cl 2 +2I - ==2Cl - +I 2 ③ 13
1年前查看全部
- 甲烷燃料电池质子交换膜、甲醇燃料电池(固体、质子交换膜、熔融碳酸钠)的电极方程式
 a64157361年前1
a64157361年前1 -
 3ab3 共回答了17个问题
3ab3 共回答了17个问题 |采纳率94.1%碱性介质下的甲烷燃料电池
负极:CH4+10OH - - 8e-===CO32- +7H2O
正极:2O2+8e-+4H2O===8OH-
离子方程式为:CH4+2O2+2OH-===CO32-+3H2O
总反应方程式为:CH4+2O2+2KOH===K2CO3+3H2O1年前查看全部
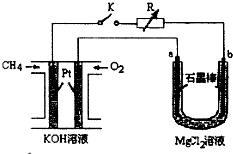
- (1)甲烷是一种重要的清洁能源,请写出以KOH溶液为电解质溶液,甲烷燃料电池的正极反应式:____。 (2)电解原理在化
(1)甲烷是一种重要的清洁能源,请写出以KOH溶液为电解质溶液,甲烷燃料电池的正极反应式:____。 (2)电解原理在化学工业中有广泛的应用。图中a为电解液,X和Y是两块电极板,则:
①若X和Y分别为铁和石墨,a为饱和食盐水,则电解时X电极反应式为______________。
②若X、Y分别为石墨和铁,a为饱和食盐水,则电解过程中生成的白色固体露置 在空气中,可观察到的现象是___________。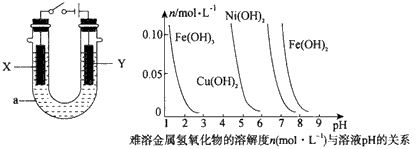
(3)高纯铜(纯度可达99. 99%)广泛应用于电器工业。某粗铜样品中含Fe、Ni、 Ag、Au等四种金属杂质,可用电解法进行精炼制得高纯铜。电解完毕后,某兴趣小组欲对电解溶液中的离子进行分离,他们通过查阅资料,得知相关氢氧化物在不同pH下的溶解度曲线如上图。
①结合图分析,相同温度下Ksp[Cu(OH) 2 ]、Ksp[Ni(OH) 2 ]、Ksp[Fe(OH) 2 ]由大到小的顺序为_________。
②分离过程中,使上述溶液的pH逐渐增加,则溶液中的Cu 2+ 、Fe 3+ 和Ni 2+ 沉淀的先后顺序依次为____________(填写离子符号)。 3162710271年前1
3162710271年前1 -
 lin5890 共回答了21个问题
lin5890 共回答了21个问题 |采纳率95.2%(1)O 2 +2H 2 O+4e - =4OH -
(2)①2H + +2e - =H 2 ↑ ;②白色固体迅速变灰绿色,最终变成红褐色
(3)①Kap[Fe(OH) 2 ]>Kap[Ni(OH) 2 ]> Kap [Cu(OH) 2 ] ;②Fe 3+ .Cu 2+ .Fe 2+1年前查看全部
- 甲烷燃料电池是一种新型化学电源,该电池是以铂丝为电极,NaOH为电解质溶液,然后从两极分别通入甲烷和氧气,该电池的电极反
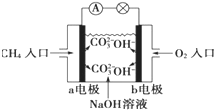 甲烷燃料电池是一种新型化学电源,该电池是以铂丝为电极,NaOH为电解质溶液,然后从两极分别通入甲烷和氧气,该电池的电极反应为:
甲烷燃料电池是一种新型化学电源,该电池是以铂丝为电极,NaOH为电解质溶液,然后从两极分别通入甲烷和氧气,该电池的电极反应为:
a极CH4-8e-+10OH-=CO32-+7H2Ob极2O2+8e-+4H2O=8OH-
关于此燃料电池的下列说法不正确的是( )
A.通入CH4的a极为电池的负极
B.电子由a极流入b极
C.电流由b极流入a极
D.该装置能将电能转化为化学能 层xx钗1年前1
层xx钗1年前1 -
 中了1000万 共回答了20个问题
中了1000万 共回答了20个问题 |采纳率95%解题思路:A.失电子发生氧化反应的电极为负极;
B.电子从负极沿导线流向正极;
C.电流从正极沿导线流向负极;
D.将化学能转化为电能的装置是原电池.A.根据电极反应式知,甲烷失电子发生氧化反应,所以通入甲烷的电极为负极,故A正确;
B.通入甲烷的电极a为负极,通入氧气的电极b为正极,电子从负极a流向正极b,故B正确;
C.电流的流向与电子流向相反,从b流向a,故C正确;
D.该装置属于原电池,是将化学能转化为电能的装置,故D错误;
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了氢氧燃料电池,根据电极上得失电子、电子流向、原电池的概念来分析解答即可,注意燃料电池中,通入燃料的电极为负极,通入氧化剂的电极为正极,题目难度不大.1年前查看全部
- 科学家预言,燃料电池是21 世纪获得电能的重要途径。一种甲烷燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和
科学家预言,燃料电池是21 世纪获得电能的重要途径。一种甲烷燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下 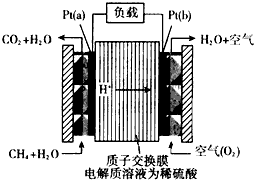
请回答下列问题:
(1)Pt(a)电极是电池的_____极,其电极反应式为_________________。Pt(b)电极发生____(填“氧化”或“还原”)反应,其电极反应式为_______________。
(2)如果该电池工作时电路中通过2mol电子,则消耗CH 4 的物质的量为_______mol。
(3)25℃、101 kPa时,若CH 4 在氧气中直接燃烧生成1 mol 水蒸气放热401kJ,写出该反应的热化学方程式:________________;若1 g水蒸气转化成液态水放热2. 445 kJ,则CH 4 的燃烧热为_________kJ/mol。 多多P1年前1
多多P1年前1 -
 bj_5201314 共回答了20个问题
bj_5201314 共回答了20个问题 |采纳率85%(1)负;CH 4 -8e - +2H 2 O=CO 2 +8H + ;还原;2O 2 +8e - +8H + =4H 2 O
(2)0.25
(3)CH 4 (g)+2O 2 (g)=CO 2 (g)+2H 2 O(g) △H=-802 kJ/mol;8901年前查看全部
- 酸性和碱性甲醇燃料电池,酸性和碱性甲烷燃料电池的电极反应式,分别写出正极,负极和总反应式.并解释
 清风细浪寄深情1年前2
清风细浪寄深情1年前2 -
 0风声水起 共回答了21个问题
0风声水起 共回答了21个问题 |采纳率90.5%酸性:正极 8H(+)+2O2+8e(-)===4H2O负极 CH4+2H2O===C02+8H(+)+8e(-)总 CH4+2O2===CO2+2H2O碱性:正极 4H2O+2O2+8e(-)===8OH(-)负极 CH4+8OH(-)===C02+6H2O+8e(-)总 CH4+2O2===CO2+2H2O以前有人问过.见参考....1年前查看全部
- 如图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图:
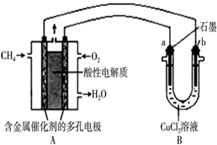 如图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图:
如图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图:
请回答:
①甲烷燃料电池的负极反应式为______.
②当线路中有0.6mol电子通过时,B中阳极产物的质量为______g. 雨中碎1年前1
雨中碎1年前1 -
 lwh553552 共回答了20个问题
lwh553552 共回答了20个问题 |采纳率95%解题思路:①甲烷燃料酸性电池中,负极上甲烷失电子和水生成氢离子和二氧化碳;
②b电极为阴极,阴极上铜离子放电生成Cu,根据Cu和转移电子之间的关系式计算.①甲烷燃料酸性电池中,负极上甲烷失电子和水生成氢离子和二氧化碳,电极反应为CH4-8e─+2H2O=CO2+8H+,故答案为:CH4-8e─+2H2O=CO2+8H+;
②a电极为阳极,阳极上氯离子放电生成氯气,50mL2mol/L的氯化铜溶液含有氯离子是0.2mol,只能转移电子0.2mol,根据氯气和转移电子之间的关系式得析出氯气的质量=0.1mol×71g/mol=7.1g,剩余的电子是在氢氧根失电子生成的氧气过程转移的,转移0.4mol电子会生成氧气0.1mol,质量是3.2g,所以阳极上产物的质量是7.1g+3.2g=10.3g,故答案为:10.3.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题涉及燃料电池的工作原理以及原电池的工作原理以及计算等知识,注意电子守恒的计算是重点,难度不大.1年前查看全部
- 如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,
如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题: 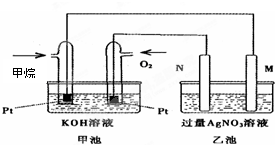
①N电极的材料是______,乙池N极的电极反应式是______.M极的电极反应式是______.
②在此过程中,乙池中某一电极析出金属银10.8g时,甲池中理论上消耗氧气为______L(标况下). 4589349391年前1
4589349391年前1 -
 Funghonchu 共回答了17个问题
Funghonchu 共回答了17个问题 |采纳率94.1%①酸性甲烷燃料电池中通入甲烷的一极为原电池的负极,通入氧气的一极为原电池的正极,乙池为电解池,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,N连接原电池的正极,应为电解池的阳极,则应为石墨材料,N为阳极,电极反应式是4OH - -4e - =O 2 ↑+2H 2 O,M为阴极,电极反应式为Ag + +e - =Ag,
故答案为:石墨;4OH - -4e - =O 2 ↑+2H 2 O;Ag + +e - =Ag;
②n(Ag)=
10.8g
108g/mol =0.1mol,根据Ag + +e - =Ag可知转移电子为0.1mol,
甲池中通入氧气的一极为正极,反应式为2O 2 +8H + +8e - =4H 2 O,则消耗n(O 2 )=
1
4 ×0.1mol=0.025mol,
V(O 2 )=0.025mol×22.4L/mol=0.56L,
故答案为:5.6.1年前查看全部
- 如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,
如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
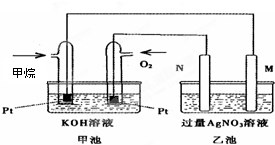
①N电极的材料是______,乙池N极的电极反应式是______.M极的电极反应式是______.
②在此过程中,乙池中某一电极析出金属银10.8g时,甲池中理论上消耗氧气为______L(标况下). 青竺1年前1
青竺1年前1 -
 海_追程 共回答了13个问题
海_追程 共回答了13个问题 |采纳率100%解题思路:酸性甲烷燃料电池中通入甲烷的一极为原电池的负极,通入氧气的一极为原电池的正极,乙池为电解池,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,N连接原电池的正极,应为电解池的阳极,则应为石墨材料,M为电解池的阴极,为铁电极,电解硝酸银溶液时,阴极反应式为Ag++e-=Ag,阳极反应式为4OH--4e-=O2↑+2H2O,结合电子的转移的物质的量的判断进行计算.①酸性甲烷燃料电池中通入甲烷的一极为原电池的负极,通入氧气的一极为原电池的正极,乙池为电解池,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,N连接原电池的正极,应为电解池的阳极,则应为石墨材料,N为阳极,电极反应式是4OH--4e-=O2↑+2H2O,M为阴极,电极反应式为Ag++e-=Ag,
故答案为:石墨;4OH--4e-=O2↑+2H2O;Ag++e-=Ag;
②n(Ag)=[10.8g/108g/mol]=0.1mol,根据Ag++e-=Ag可知转移电子为0.1mol,
甲池中通入氧气的一极为正极,反应式为2O2+8H++8e-=4H2O,则消耗n(O2)=[1/4]×0.1mol=0.025mol,
V(O2)=0.025mol×22.4L/mol=0.56L,
故答案为:5.6.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了原电池原理和电解池原理,明确原电池和电解池电极上发生反应的类型即可分析解答本题,难度不大,注意电极反应式的书写与电解质溶液的酸碱性有关.1年前查看全部
- 甲烷燃料电池(中性)的化学式要正极,负极,和总反应式
 hhyyyy1年前2
hhyyyy1年前2 -
 nei4afy 共回答了18个问题
nei4afy 共回答了18个问题 |采纳率88.9%正极:2O2+8e- +4H2O=8OH-
负极:CH4-8e- +10(OH)-=CO3(2-)+7H2O
总:CH4+2O2+2OH-=CO3(2-)+2H2O
总算打完了,累死了1年前查看全部
- 高考题引申出来的小疑惑2012年高考海南卷原题:16.(9分) 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入
高考题引申出来的小疑惑
2012年高考海南卷原题:
16.(9分) 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 ,电解质为KOH溶液.某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示.
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为 、 .
(2)闭合K开关后,a、b电极上均有气体产生.其中b电极上得到的是 ,电解氯化钠溶液的总反应方程式为 ;
(3)若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量为 (法拉第常数F=9.65×l04C · mol-1列式计算),最多能产生的氯气体积为 L(标准状况).
第3小题第一空
参考答案为:1L/22.4L·mol-1×8×9.65×l04C · mol-1=3.45×l04C
经过多方论证,以下是几点共识:
通过一个原电池的电荷量是固定的(即1L甲烷完全反应),而整个是串联电路,故通过电解池的电荷量与通过一个原电池的电荷量相等,即电荷量按照1L的甲烷完全反应来计算,设为Q.又因为两个原电池串联,故电压为2U,电阻R不变,故电流变为2I.完全反应所需时间t=Q/(2I)=t/2,即所需时间为正常情况下只接入一个原电池时完全反应所需时间的一半.
由此,我觉得是不是意味着多个相同原电池的串联提高了某个原电池的反应速率?
而且是以正比上升?
还有一个问题就是如果串联在电路中的不是两个相同的原电池怎么办?比如一个产生的电压是U,另一个是5U,一个反映所需时间为t,另一个为8t,这是如何考虑?
呵呵,不好意思,叙述得有些烦了,在下只是一名高中生,希望化学帝能解释的明白些,来吧,小弟洗耳恭听! 弯弓羽毛1年前1
弯弓羽毛1年前1 -
 凤凰onlien 共回答了15个问题
凤凰onlien 共回答了15个问题 |采纳率86.7%着多个相同原电池的串联提高了某个原电池的反应速率,应该是没有问题的,相当于反应物的浓度均增大一倍.
如果串联在电路中的不是两个相同的原电池,比如一个产生的电压是U,另一个是5U,这样会导致电压高的原电池反应受到抑制,电压低的原电池反应加快,可以把高电压的电池想象成原电池,而电压低的原电池内电阻高,阻碍强电流.
.个人看法.1年前查看全部
- 科学家预言,燃料电池是21世纪获得电能的重要途径.一种甲烷燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水
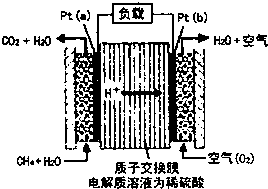 科学家预言,燃料电池是21世纪获得电能的重要途径.一种甲烷燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如下:
科学家预言,燃料电池是21世纪获得电能的重要途径.一种甲烷燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如下:
请回答下列问题:
(1)Pt(a)电极是电池的______极,其电极反应式为______.
Pt(b)电极发生______反应(填“氧化”或“还原”),其电极反应式为______.
(2)如果该电池工作时电路中通过2mol电子,则消耗CH4的物质的量为______mol.
(3)25℃、101kPa时,若CH4在氧气中直接燃烧生成1mol水蒸气放热401kJ,写出该反应的热化学方程式______;若lg水蒸气转化成液态水放热2.445kJ,则CH4的燃烧热为______kJ/mol. tdhsr1年前1
tdhsr1年前1 -
 天边一棵菜 共回答了21个问题
天边一棵菜 共回答了21个问题 |采纳率85.7%解题思路:(1)该原电池中质子交换膜只允许质子和水分子通过,说明电解质溶液为酸性溶液,燃料电池中,通入燃料的电极为负极,负极上失电子发生氧化反应,通入氧化剂的电极为正极,正极上得电子发生还原反应;
(2)根据甲烷和转移电子之间的关系式计算;
(3)CH4在氧气中直接燃烧生成1mol水蒸气放热401kJ,生成2mol水蒸气放出802kJ热量,据此写出其热化学反应方程式;lg水蒸气转化成液态水放热2.445kJ,2mol水蒸气转化为液态水放出的热量为
×2=9.78kJ,根据盖斯定律计算其燃烧热.2.445kJ 1g 2g/mol (1)该原电池中质子交换膜只允许质子和水分子通过,说明电解质溶液为酸性溶液,燃料电池中,通入燃料的电极为负极,负极上甲烷失电子和水反应生成二氧化碳和氢离子,电极反应式为:CH4-8e-+2H2O=8H++CO2,通入氧化剂的电极为正极,正极上氧气得电子和氢离子反应生成水而发生还原反应,
电极反应式为2O2+8e-+8H+=4H2O,
故答案为:负;CH4-8e-+2H2O=8H++CO2;还原;2O2+8e-+8H+=4H2O;
(2)负极上电极反应式为CH4-8e-+2H2O=8H++CO2,根据甲烷和转移电子之间的关系式知,该电池工作时电路中通过2mol电子则消耗CH4的物质的量=
2mol
8×1=0.25mol,
故答案为:0.25;
(3)CH4在氧气中直接燃烧生成1mol水蒸气放热401kJ,生成2mol水蒸气放出802kJ热量,
所以其热化学反应方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 ①;
lg水蒸气转化成液态水放热2.445kJ,2mol水蒸气转化为液态水放出的热量为
2.445kJ
1g
2g/mol×2=9.78kJ,
2H2O(g)═2H2O(l)△H=-9.78kJ/mol②,
将方程式①+②得CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.08kJ/mol,
所以甲烷的燃烧热为890.08kJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1;890.08.点评:
本题考点: 常见化学电源的种类及其工作原理.
考点点评: 本题考查了燃料电池及盖斯定律,根据离子交换膜通过的微粒确定电解质溶液的酸碱性,再结合正负极上发生的反应来分析解答,题目难度不大.1年前查看全部
- 甲烷燃料电池的化学反应为CH4+2O2=CO2+2H2O,其中1个电极反应式为2O2+8H++8e-=4H2O下列叙述不
甲烷燃料电池的化学反应为CH4+2O2=CO2+2H2O,其中1个电极反应式为2O2+8H++8e-=4H2O下列叙述不正确的是( )
A.CH4通入负极
B.O2通入正极
C.正极发生氧化反应
D.负极的电极反应式为:CH4+2H2O-8e-=CO2+8H+ darkdj1年前1
darkdj1年前1 -
 boqq000 共回答了23个问题
boqq000 共回答了23个问题 |采纳率95.7%解题思路:酸性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,入氧气的一极为原电池的正极,发生还原反应,电极反应式为2O2+8H++8e-=4H2O原电池工作时,电子从负极经外电路流向正极,电解质溶液中,阳离子向正极移动,阴离子向负极移动.A、甲烷燃料电池,具有还原性的甲烷为原电池的负极,故A正确;
B、甲烷燃料电池,具有氧化性的氧气为原电池的正极,故B正确;
C、甲烷燃料电池中,正极是氧气发生得电子得还原反应,故C错误;
D、酸性甲烷燃料电池,具有还原性的甲烷为原电池的负极,CH4+4H2O-8e-=+8H+,故D错误.
故选CD.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查酸性甲烷电池的工作原理,题目难度不大,本题中注意把握电极反应式的书写,正确判断两极的化学反应,在学习中注意积累电子、电流、离子的流向.1年前查看全部
- (正常进度)(1)写出以30% KOH溶液为电解质溶液,甲烷燃料电池的负极电极反应式______.(2)在标准状况下,甲
(正常进度)
(1)写出以30% KOH溶液为电解质溶液,甲烷燃料电池的负极电极反应式______.
(2)在标准状况下,甲烷和氧气的混合气体224mL,充分燃烧后,将生成的气体通入100mL 0.02mol/L的石灰水,得到0.1g白色沉淀.求混合气体中甲烷和氧气的体积比. dujj11年前1
dujj11年前1 -
 hobg 共回答了13个问题
hobg 共回答了13个问题 |采纳率76.9%解题思路:(1)燃料电池中,负极上燃料失电子发生氧化反应;
(2)甲烷燃烧生成二氧化碳和水,二氧化碳和氢氧化钙反应生成碳酸钙白色沉淀,碳酸钙和二氧化碳、水反应生成碳酸氢钙,分情况讨论,当二氧化碳不足量时,结合碳原子守恒根据碳酸钙的量计算甲烷的量,从而得出甲烷和氧气的体积比;当二氧化碳过量时,根据钙元素守恒计算二氧化碳的量,再结合碳原子守恒计算甲烷的量,从而得出甲烷和氧气的体积比.(1)甲烷燃料电池中,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH4-8e-+10OH-=CO32-+7H2O,
故答案为:CH4-8e-+10OH-=CO32-+7H2O;
(2)混合气体的物质的量=[0.224L/22.4L/mol]=0.01mol,
涉及的化学方程式:CH4+2O2=CO2+2H2O、CO2+Ca(OH)2=CaCO3↓+H2O、CaCO3+CO2+H2O═Ca(HCO3)2 ,
根据方程式知,白色沉淀是碳酸钙,碳酸钙的物质的量=
0.1g
100g=0.001mol,
氢氧化钙的物质的量=0.02mol/L×0.1L=0.002mol,
当生成的CO2刚好为0.001mol时,根据碳原子守恒知,n(CaCO3)=n(CH4)=0.001mol,则氧气的物质的量是0.009mol,则甲烷与氧气的体积比为1:9;
当生成的CO2过量时,n(CaCO3)=0.001mol,根据钙原子守恒知,n(Ca(HCO3)2 )=0.001mol,
根据碳原子守恒得,n(CH4)=n(CO2)=0.001mol+0.002mol=0.003mol,则氧气的物质的量=0.007mol,所以甲烷与氧气的体积比为3:7,
故答案为:1:9或3:7.点评:
本题考点: 化学电源新型电池;化学方程式的有关计算.
考点点评: 本题考查燃料电池及物质的量的有关计算,注意计算时要分情况讨论,易漏掉二氧化碳过量的情况,为易错点.1年前查看全部
- 甲烷燃料电池的电极反应式怎么写的?
 SSDD191年前1
SSDD191年前1 -
 一支枯笔 共回答了8个问题
一支枯笔 共回答了8个问题 |采纳率87.5%[技巧1]燃料电池的负极反应,一般较难写出,而正极反应和电池总反应却较易写出.用电池总反应减去正极反应可得负极反应,这是写负极反应式的一种巧妙方法.
甲烷燃料电池总离子反应式为:CH4+ 2OH-+ 2O2= CO+ 3H2O ①正极反应式为:O2+ 2H2O + 4e- = 4OH-②故负极反应式应为:①-②*2 即得CH4+ 10OH-- 8e- = CO+ 7H2O[技巧2]根据得失电子守恒,原子守恒,电荷守恒直接书写较复杂的负极电极反应式.
负极中,甲烷被氧化为二氧化碳,二氧化碳在碱性条件不能存在,结合氢氧根生成碳酸根.甲烷中碳元素化合价由-4价升高到碳酸根中的+4价,故1 mol甲烷失去8 mol电子,结合OH-生成1 mol CO
,再根据电荷守恒,电极反应式右侧CO
带两个单位负电荷,故左侧应该有10 mol OH-,再根据原子守恒,电极反应式右侧加上7 mol H21年前查看全部
- (化学)甲烷燃料电池和乙醇燃料电池在碱性条件下的电极方程和电池方程怎么写?
 石头马1年前2
石头马1年前2 -
 abbreviation 共回答了14个问题
abbreviation 共回答了14个问题 |采纳率92.9%在实用中没有以甲烷或乙醇为燃料的碱性燃料电池.原因很简单,甲醇燃料电池正常运行时的排出产物是水和二氧化碳,而二氧化碳是弱酸性气体,会和碱液性电解质反应生成碳酸盐和水.这样,电解质就被燃料电池自己的排出产物所消耗,使得工作性能严重衰减了.因此,以甲烷或乙醇为燃料的燃料电池都是在酸性环境下运行的.1年前查看全部
- 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电
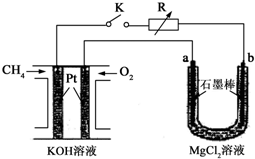 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源进行氯化镁溶液电解实验,电解装置如图所示.
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源进行氯化镁溶液电解实验,电解装置如图所示.
请回答下列问题:
(1)甲烷燃料电池负极的电极反应式为:______.
(2)闭合开关K后,a、b电极上均有气体产生,其中a电极上的电极反应式为______,b电极上得到的气体是______,电解氯化镁溶液的离子方程式为Mg2++2Cl-+2H2O
Mg(OH)2↓+H2↑+Cl2↑通电 .Mg2++2Cl-+2H2O.
Mg(OH)2↓+H2↑+Cl2↑通电 .
(3)若甲烷通入量为1.12L(标准状况),且反应完全,则理论上通过电解池的电子的物质的量为______,产生的氯气体积为______L(标准状况). hdxsjl1年前1
hdxsjl1年前1 -
 ivyforever 共回答了12个问题
ivyforever 共回答了12个问题 |采纳率91.7%解题思路:(1)甲烷燃料电池中,负极上甲烷失电子发生氧化反应;
(2)闭合K开关后,a是阳极,b是阴极,阳极上氯离子放电,用湿润的淀粉碘化钾试纸检验氯气,阴极上氢离子放电,同时溶液中生成氢氧化镁;
(3)根据转移电子守恒计算.(1)甲烷燃料电池中,负极上甲烷失电子发生氧化反应,电极反应式为:CH4+10OH--8e-═CO32-+7H2O,故答案为:CH4+10OH--8e-=CO32-+7H2O;
(2)闭合K开关后,a是阳极,b是阴极,a极上氯离子放电生成氯气,电极方程式为2Cl--2e-=Cl2,阴极上氢离子放电,同时溶液中生成氢氧化镁沉淀,所以电池反应的离子方程式为Mg2++2Cl-+2H2O
通电
.
Mg(OH)2↓+H2↑+Cl2↑,故答案为:2Cl--2e-=Cl2;H2;Mg2++2Cl-+2H2O
通电
.
Mg(OH)2↓+H2↑+Cl2↑;
(3)若甲烷通入量为 1.12L(标准状况),则甲烷的物质的量为[1.12L/22.4L/mol]=0.05mol,由CH4+10OH--8e-═CO32-+7H2O,得转移电子为0.4mol;
根据转移电子守恒得氯气的体积=0.4mol×[1/2]×22.4L/mol=4.48L,
故答案为:0.4mol;4.48L.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题综合考查原电池和电解池知识,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握电极方程式的书写,为解答该类题目的关键,难度中等.1年前查看全部
- 甲烷燃料电池正极方程式 负极方程式
 booksircn1年前3
booksircn1年前3 -
 awtges36 共回答了23个问题
awtges36 共回答了23个问题 |采纳率95.7%正极
2O2+4H20+8e-=8OH-
负极
CH4-8e-+10OH-=CO32-+3H2O1年前查看全部
- 高中化学原电池的判断反应物有些燃料电池不好判断正负极的反应物,哪些又应该有水参加.有何技巧?比如说:甲烷燃料电池里,我怎
高中化学原电池的判断反应物
有些燃料电池不好判断正负极的反应物,哪些又应该有水参加.
有何技巧?
比如说:甲烷燃料电池里,我怎么就知道甲烷是否参加了反应呢? 5040031年前1
5040031年前1 -
 binghezhu 共回答了20个问题
binghezhu 共回答了20个问题 |采纳率85%这是我给我的学生讲原电池电极反应书写的常用方法,希望对你有用
1、电极反应式的书写
x09⑴根据原电池装置的书写
x09负极:
x09①若负极材料本身被氧化,其电极反应式有两种情况:
x09一种是负极金属失电子后生成金属阳离子不与电解质溶液的成分反应,此时是电极反应可表示为M-ne-=Mn+.
x09另一种是负极金属失电子后生成的金属阳离子与电解质溶液成分反应,此时的电极反应要将金属失电子的反应、金属阳离子与电解质溶液的反应叠加在一起,如铅蓄电池的负极反应为:Pb+2OH--2e-=2H2O.
x09②若负极材料本身不反应,如燃料电池,在书写负极反应式时,要将燃料电池失电子的反应及其产物与电解质溶液反应叠加在一起书写,如H2-O2(KOH溶液)电池的负极反应为
H2+2OH--2e-=2H2O.
x09正极:
x09首先判断在正极发生反应的物质.①当负极材料与电解质溶液发生自发的化学反应时,在正极上发生电极反应的物质是电解质溶液中的某种微粒;②当负极材料与电解质溶液不发生自发化学反应时,在正极上发生反应的物质是溶解在电解质溶液中的O2.
x09然后再根据具体情况写出正极反应式,在书写时也要考虑正极反应产物是否与电解质溶液反应的问题,若反应也要书写叠加式.
x09⑵根据原电池反应书写
x09①找出发生氧化反应和还原反应的物质,确定正负极产物.
x09②利用电荷守恒分别写出电极反应式.
x09③验证:两电极反应式相加所得式子和原化学方程式相同,则书写正确.1年前查看全部
- Ⅰ、写出甲烷燃料电池在酸性溶液中的电极反应和总电池反应:
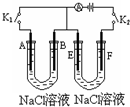 Ⅰ、写出甲烷燃料电池在酸性溶液中的电极反应和总电池反应:
Ⅰ、写出甲烷燃料电池在酸性溶液中的电极反应和总电池反应:
正极:______
负极:______
总反应:______
Ⅱ、如图所示,A、F为石墨电极,B、E为铁片电极.
按要求回答下列问题.
(1)打开K2,合并K1.
①B为______极,A极的电极反应为:______
②最终可观察到的现象是:______
③涉及的两个主要的化学反应的化学方程式为:______
(2)打开K1,合并K2.
①E为______极,F极的电极反应为:______
②检验F极产生气体的方法是:______
(3)若往U型管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是______,原因是:(在下表中填写,可不填满)
周围变红的电极代号(填字母) 原因 ______ ______ ______ ______ ______ ______ ______ ______  冷雨夜里1年前1
冷雨夜里1年前1 -
 condy_98 共回答了17个问题
condy_98 共回答了17个问题 |采纳率88.2%解题思路:Ⅰ、燃料电池中负极上燃料失电子和水反应生成二氧化碳和氢离子,正极上氧气得电子和氢离子反应生成水,据此写出正负极上电极反应式和电池反应式.
Ⅱ、(1)打开K2,合并K1,该装置是原电池,较活泼的金属铁作负极,石墨作正极,正极上氧气得电子和水反应生成氢氧根离子,铁发生吸氧腐蚀;负极上铁失电子生成亚铁离子,正极上生成氢氧根离子,亚铁离子和氢氧根离子 反应生成氢氧化亚铁沉淀,氢氧化亚铁易被氧化生成氢氧化铁,据此判断实验现象并写出反应方程式.
(2)该装置是电解池,F是阳极,E是阴极,阳极上氯离子放电,阴极上氯离子放电,写出相应的电极反应式;检验氯气用湿润的淀粉碘化钾试纸,能使湿润的淀粉碘化钾试纸变蓝就是氯气,否则不是.
(3)若往U型管中滴加酚酞,进行(1)(2)操作时,电极周围能变红说明产生氢氧根离子,据此分析.Ⅰ、该燃料电池中,正极上投放的是氧化剂,原电池放电时正极上氧气得电子和氢离子反应生成水,电极反应式为2O2+8H++8e-=4H2O;
负极上投放的是燃料,甲烷失电子和水反应生成二氧化碳和氢离子,电极反应式为CH4+2H4O-8e-=CO2+8H+;
所以电池反应式为:CH4+2O4=CO2+2H2O.
故答案为:正极:2O2+8H++8e-=4H2O;负极:CH4+2H4O-8e-=CO2+8H+;总反应:CH4+2O4=CO2+2H2O.
Ⅱ、(1)①该装置是原电池,较活泼的金属铁作负极,石墨作正极,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-;
故答案为:负;O2+2H2O+4e-=4OH-.
②该原电池放电时,负极上铁失电子生成亚铁离子,正极上氧气得电子和水反应生成氢氧根离子,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁易被氧化生成氢氧化铁,所以溶液中有红褐色沉淀生成.
故答案为:溶液中有红褐色沉淀生成.
③发生的反应方程式为:2Fe+O2+2H2O=2Fe(OH)2;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
故答案为:2Fe+O2+2H2O=2Fe(OH)2;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(2)①该装置是电解池,E是阴极,F是阳极,阳极上氯离子放电生成氯气,电极反应式为:2Cl--2e-=Cl2↑.
故答案为:阴; 2Cl--2e-=Cl2↑.
②阳极上生成氯气,检验氯气用湿润的淀粉碘化钾试纸,如果用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,证明是氯气.
故答案为:用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,证明是氯气.
(3)若往U型管中滴加酚酞,进行(1)操作时,该装置是原电池,正极上氧气得电子和水反应生成氢氧根离子,导致A附近溶液呈碱性,所以酚酞试液变红.
若往U型管中滴加酚酞,进行(2)操作时,阴极上氢离子放电导致溶液中氢氧根浓度大于氢离子浓度而使溶液呈碱性,加入酚酞试液会变红.
故答案为:A、E
周围变红的电极代号(填字母) 原因
A O2+2H2O+4e-=4OH-,产生OH-
E 2H++2e-=H2↑
H+反应,促进了水的电离,溶液中c(OH-)>c(H+)点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理和电解池原理,明确原电池和电解池电极上发生反应的类型即可分析解答本题,难度不大,注意电极反应式的书写与电解质溶液的酸碱性有关.1年前查看全部
- 下列关于甲烷燃料电池的说法不正确的是(电解质溶液是KOH溶液)( )
下列关于甲烷燃料电池的说法不正确的是(电解质溶液是KOH溶液)( )
A.负极反应式为:CH4+10OH--8e-=CO32-+7H2O
B.正极反应式为:2O2+4H2O+8e-=8OH-
C.电池放电过程中,电解质溶液的pH值不变
D.甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大 qeapb1年前1
qeapb1年前1 -
 爱上朱丽叶 共回答了24个问题
爱上朱丽叶 共回答了24个问题 |采纳率87.5%解题思路:燃料电池是燃料跟O2(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱(如KOH)溶液,燃料气体通入的是原电池的负极失电子发生氧化反应,氧气通入的是正极发生还原反应;
A、通入甲烷的一极为负极发生氧化反应;
B、通氧气的电极为正极,正极反应为O2+2H2O+4e-=4OH-;总化学方程式为:CH4+2O2+2OH-=CO32-+3H2O;总反应减去正极反应得到负极的电极反应式为:CH4+10OH--8e-═CO32-+7H2O;
C、随着不断放电,原电池反应中反应生成水,氢氧根离子浓度减小,电解质溶液的pH减小;
D、甲烷燃料电池的能量实现化学能转化为电能,能量利用率比甲烷燃烧的大,甲烷燃烧损失能量.A、通入甲烷的一极为负极发生氧化反应,电极反应为CH4+10OH--8e-=CO32-+7H2O,故A正确;
B、通氧气的电极为正极,正极反应为O2+2H2O+4e-=4OH-;总化学方程式为:CH4+2O2+2OH-=CO32-+3H2O;总反应减去正极反应得到负极的电极反应式为CH4+10OH--8e-═CO32-+7H2O,故B正确;
C、随着不断放电,原电池反应中反应生成水,氢氧根离子浓度减小,电解质溶液的pH减小,故C错误;
D、甲烷燃料电池的能量实现化学能转化为电能,能量利用率比甲烷燃烧的大,甲烷燃烧损失能量,甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大,故D正确;
故选C.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了化学新型电源电池的应用,主要是电极名称,电极反应,电极反应的判断和应用,题目难度中等.1年前查看全部
- 甲烷燃料电池是一种新型化学电源,该电池是以铂丝为电极,KOH为电解质溶液,然后从两极分别通入甲烷和氧气,该电池的电极反应
甲烷燃料电池是一种新型化学电源,该电池是以铂丝为电极,KOH为电解质溶液,然后从两极分别通入甲烷和氧气,该电池的电极反应为:
X极CH4-8e-+10OH-=CO32-+7H2O
Y极2O2+8e-+4H2O=8OH-
关于此燃料电池的下列说法不正确的是( )
A.通入CH4的X极为电池的负极,通入O2的Y极为电池的正极
B.电池工作过程中溶液pH将下降
C.放电时每转移4mol电子,正极有1mol O2被氧化
D.该燃料电池的总化学方程式可表示为:CH4+2O2+2KOH=K2CO3+3H2O gbtfsdat1年前1
gbtfsdat1年前1 -
 我是活着还是gg了 共回答了17个问题
我是活着还是gg了 共回答了17个问题 |采纳率88.2%解题思路:碱性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,通入氧气的一极为原电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,根据电极反应确定液的pH变化情况以及电子转移和物质量之间的关系.A、碱性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,所以X极是负极,通入氧气的一极为原电池的正极,发生还原反应,Y极为正极,故A正确;
B、根据总反应:CH4+2O2+2OH-=CO32-+3H2O,则氢氧化钾被消耗,电池工作过程中溶液pH将下降,故B正确;
C、根据电极反应式:O2+2H2O+4e-=4OH-,每转移4mol电子,正极有1mol O2被还原,故C错误;
D、该电池工作时的总反应CH4+2O2+2KOH=K2CO3+3H2O,故D正确.
故选C.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查碱性甲烷电池的工作原理,题目难度不大,本题中注意把握电极反应式的书写,正确判断两极的化学反应.1年前查看全部
- Ⅰ、写出甲烷燃料电池在酸性溶液中的电极反应和总电池反应:正极:______负极:______总反应:______Ⅱ、
Ⅰ、写出甲烷燃料电池在酸性溶液中的电极反应和总电池反应:正极:______负极:______总反应:______Ⅱ、
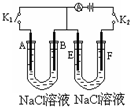 Ⅰ、写出甲烷燃料电池在酸性溶液中的电极反应和总电池反应:
Ⅰ、写出甲烷燃料电池在酸性溶液中的电极反应和总电池反应:
正极:______
负极:______
总反应:______
Ⅱ、如图所示,A、F为石墨电极,B、E为铁片电极.
按要求回答下列问题.
(1)打开K2,合并K1.
①B为______极,A极的电极反应为:______
②最终可观察到的现象是:______
③涉及的两个主要的化学反应的化学方程式为:______
(2)打开K1,合并K2.
①E为______极,F极的电极反应为:______
②检验F极产生气体的方法是:______
(3)若往U型管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是______,原因是:(在下表中填写,可不填满)
周围变红的电极代号(填字母) 原因 ______ ______ ______ ______ ______ ______ ______ ______
 linyong8115201年前1
linyong8115201年前1 -
 denser513 共回答了25个问题
denser513 共回答了25个问题 |采纳率96%Ⅰ、该燃料电池中,正极上投放的是氧化剂,原电池放电时正极上氧气得电子和氢离子反应生成水,电极反应式为2O2+8H++8e-=4H2O;
负极上投放的是燃料,甲烷失电子和水反应生成二氧化碳和氢离子,电极反应式为CH4+2H4O-8e-=CO2+8H+;
所以电池反应式为:CH4+2O4=CO2+2H2O.
故答案为:正极:2O2+8H++8e-=4H2O;负极:CH4+2H4O-8e-=CO2+8H+;总反应:CH4+2O4=CO2+2H2O.
Ⅱ、(1)①该装置是原电池,较活泼的金属铁作负极,石墨作正极,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-;
故答案为:负;O2+2H2O+4e-=4OH-.
②该原电池放电时,负极上铁失电子生成亚铁离子,正极上氧气得电子和水反应生成氢氧根离子,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁易被氧化生成氢氧化铁,所以溶液中有红褐色沉淀生成.
故答案为:溶液中有红褐色沉淀生成.
③发生的反应方程式为:2Fe+O2+2H2O=2Fe(OH)2;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
故答案为:2Fe+O2+2H2O=2Fe(OH)2;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(2)①该装置是电解池,E是阴极,F是阳极,阳极上氯离子放电生成氯气,电极反应式为:2Cl--2e-=Cl2↑.
故答案为:阴; 2Cl--2e-=Cl2↑.
②阳极上生成氯气,检验氯气用湿润的淀粉碘化钾试纸,如果用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,证明是氯气.
故答案为:用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,证明是氯气.
(3)若往U型管中滴加酚酞,进行(1)操作时,该装置是原电池,正极上氧气得电子和水反应生成氢氧根离子,导致A附近溶液呈碱性,所以酚酞试液变红.
若往U型管中滴加酚酞,进行(2)操作时,阴极上氢离子放电导致溶液中氢氧根浓度大于氢离子浓度而使溶液呈碱性,加入酚酞试液会变红.
故答案为:A、E
周围变红的电极代号(填字母) 原因
A O2+2H2O+4e-=4OH-,产生OH-
E 2H++2e-=H2↑
H+反应,促进了水的电离,溶液中c(OH-)>c(H+)1年前查看全部
- 甲烷燃料电池电极反应式酸性条件下
甲烷燃料电池电极反应式酸性条件下
包括总式 pandame1年前3
pandame1年前3 -
 Dipper_bupt 共回答了15个问题
Dipper_bupt 共回答了15个问题 |采纳率80%负极 CH4-8e-+2H2O=CO2+8H+
正极 O2+4H+4e-=2H2O1年前查看全部
- (2009•肇庆二模).将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2构成甲烷燃料电池.下列有关叙述正确的是(
(2009•肇庆二模).将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2构成甲烷燃料电池.下列有关叙述正确的是( )
A.负极的电极反应为:CH4+10OH--8e-=CO32-+7H2O
B.正极发生氧化反应,电极反应为:O2+2H2O+4e-=4OH-
C.该电池使用一段时间后应补充KOH
D.燃料电池工作时,溶液中的OH-向正极移动 而受的伤1年前1
而受的伤1年前1 -
 郭靖888 共回答了16个问题
郭靖888 共回答了16个问题 |采纳率75%解题思路:碱性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,通入氧气的一极为原电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,原电池工作时,电子从负极经外电路流向正极,电解质溶液中,阳离子向正极移动,阴离子向负极移动.A、通入CH4的电极为负极,电极反应为:CH4+10OH--8e-=CO32-+7H2O,故A正确;
B、通入氧气的一极为原电池的正极,发生还原反应:O2+2H2O+4e-=4OH-,故B错误;
C、电池反应式为:CH4+2OH-+2O2=CO32-+3H2O,随着反应的进行,溶液中氢氧根离子不断减少,所以该电池使用一段时间后应补充KOH,故C正确;
D、燃料电池工作时,溶液中的阴离子OH-向负极移动,故D错误.
故选AC.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查碱性甲烷电池的工作原理,题目难度不大,本题中注意把握电极反应式的书写,正确判断两极的化学反应,在学习中注意积累电子、电流、离子的流向.1年前查看全部
- 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入 CH4和 O2,电解质为 KOH
 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入 CH4和 O2,电解质为 KOH 溶液.某研究小组将甲烷燃料电 池作为电源进行氯化镁溶液龟解实验,电解装置如图所示.
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入 CH4和 O2,电解质为 KOH 溶液.某研究小组将甲烷燃料电 池作为电源进行氯化镁溶液龟解实验,电解装置如图所示.
请回答下列问题:
(1)甲烷燃料电池负极的电极反应式为:______.
(2)闭合开关 K 后,a、b 电极上均有气体产生,
其中 a 电极上的气体可用______ 检验,b 电极上得到的气体是______,电解氯化镁溶液的离子方程式为Mg2++2Cl-+2H2O
Mg(OH)2↓+H2↑+Cl2↑电解 .Mg2++2Cl-+2H2O
Mg(OH)2↓+H2↑+Cl2↑电解 .
(3)若甲烷通入量为 1.12L(标准状况),且反应完全,则理论上通过电解池的电子的物质的量为______,产生的氯气体积为______L(标准状况).
(4)已知常温常压下,0.25molCH4完全燃烧生成 CO2和 H2O 时,放出 222.5kJ 热量,请写出 CH4燃烧热的热化学方程式______.
(5)已知:①C(石墨)+O2(g)=CO2(g)△H1=-393.5kJ/mol
②2H2(g)+O2(g)=2H2O(I)△H2=-571.6kJ/mol
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2599kJ/mol
计算:C(石墨)与H2(g)反应生成1molC2H2(g)的△H=______. jky_jeca1年前1
jky_jeca1年前1 -
 孤寂边缘 共回答了18个问题
孤寂边缘 共回答了18个问题 |采纳率94.4%(1)甲烷燃料电池中,负极上甲烷失电子发生氧化反应,电极反应式为:CH4+10OH--8e-═CO32-+7H2O,故答案为:CH4+10OH--8e-═CO32-+7H2O;
(2)闭合K开关后,a是阳极,b是阴极,a极上氯离子放电生成氯气,氯气具有氧化性能使湿润的淀粉碘化钾试纸变蓝色,阴极上氢离子放电,同时溶液中生成氢氧化镁沉淀,所以电池反应的离子方程式为:Mg2++2Cl-+2H2O
电解
.
Mg(OH)2↓+H2↑+Cl2↑,
故答案为:湿润的淀粉碘化钾试纸;氢气;Mg2++2Cl-+2H2O
电解
.
Mg(OH)2↓+H2↑+Cl2↑;
(3)若甲烷通入量为 1.12L(标准状况),则甲烷的物质的量为[1.12L/22.4L/mol]=0.05mol,由CH4+10OH--8e-═CO32-+7H2O,得转移电子为0.4mol;
根据转移电子守恒得氯气的体积=0.4mol×[1/2]×22.4L/mol=4.48L,
故答案为:0.4mol;4.48L;
(4)0.25mol CH4完全燃烧生成CO2和液态H2O时,放出222.5kJ热量,1mol甲烷燃烧生成二氧化碳和液态水放热890kJ,反应的热化学方程式为:
CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890kJ/mol;
故答案为:CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890kJ/mol;
(5)已知:①C(石墨)+O2(g)=CO2(g)△H1=-393.5kJ/mol
②2H2(g)+O2(g)=2H2O(I)△H2=-571.6kJ/mol
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2599kJ/mol
2C (s,石墨)+H2(g)=C2H2(g)的反应可以根据①×2+②×[1/2]-③×[1/2]得到,
则△H=2×(-393.5kJ•mol-1)+(-571.6kJ•mol-1)×[1/2]-(-2599kJ•mol-1)×[1/2]=+226.7kJ•mol-1,
故答案为:+226.7kJ•mol-1.1年前查看全部
- 甲烷燃料电池负极分布反应 碱性环境
 1227725741年前1
1227725741年前1 -
 跟不上 共回答了14个问题
跟不上 共回答了14个问题 |采纳率78.6%甲烷燃料电池负极分布反应 碱性环境
正极:
负极:CH4+10OH— -8e—=CO32—+7H2O
分解步骤:
CH4+2H2O -8e—= CO2 + 8H+
CO2 + 2OH—=CO32—+H2O
8H++8OH—=8H2O1年前查看全部
- 甲烷燃料电池和甲醇燃料电池分别在碳酸根和氧二负离子存在下的电极反应方程式
 彷徨的苹果虫儿1年前1
彷徨的苹果虫儿1年前1 -
 神雕大瞎 共回答了13个问题
神雕大瞎 共回答了13个问题 |采纳率92.3%碱性介质下的甲烷燃料电池 负极:CH4+10OH-—8e-===CO32- + 7H2O 正极:O2+4e-+2H2O===4OH-离子方程式为:CH4+2O2+2OH-===C O32-+3H2O 总反应方程式为:CH4+2O2+2KOH== =K2CO3+3H2O 酸性介质下的甲烷燃料电池:负极:CH 4-8e-+2H2O=CO2+8H+ 正极:O2+4e-+ 4H+=2H2O CO32-是碳酸根,反应过程就是把原来的 直接燃烧变成间接的,通过酸性或碱性的 溶液介质,让溶液中的氢氧根或水分子等 和反应物质先反应,电子通过外部的导线 传递,溶液内的离子通过浓度差从阳极迁 移到阴极或从阴极到阳极,保持溶液内离 子浓度的平衡.如第一个碱性条件下,CH4和OH-反应,给出8个电子,通过外部导线传到正极,这样外部就产生电流,正极的氧就结合负 极给出的电子,和水结合在生成OH-,正 常电池反应中溶液浓度是不会变化的,单 此处溶液PH会逐渐降低,因为甲烷燃烧 产生的是CO2,CO2和水结合产生H2CO3 ,这里就会产生H+,所以PH会降低,同 时因为OH-浓度的改变也会影响电池的效 率,所过过一段时间就要通过其他的方法 改变一下溶液的PH,保证电池的效率.酸性条件按碱性类推一下就出来了.1年前查看全部
- 甲烷燃料电池原理一种说法是:(我们老师讲的)总反应:CH4+2O2+2OHˉ=CO32ˉ+3H2O 正极:O2+4eˉ+
甲烷燃料电池原理
一种说法是:(我们老师讲的)
总反应:CH4+2O2+2OHˉ=CO32ˉ+3H2O
正极:O2+4eˉ+2H2O=4OHˉ
负极:CH4-8e+10OHˉ=CO32ˉ(碳酸根)+7H2O
一种说法是:(在知道里经常看到)
CH4 - 8e- +8OH-=CO2+6H2O
2O2 + 8e- +4H2O=8OH-
哪个对? 说说为啥对
 cc83276981年前2
cc83276981年前2 -
 qqwzh 共回答了15个问题
qqwzh 共回答了15个问题 |采纳率100%甲烷燃料电池、 KOH溶液为电解质溶液
电极反应:负极: CH4+10OH--8e-=CO32-+7H2O
正极: 2O2+4H2O+8e-=8OH-
电池总反应式: CH4+2O2+2KOH=K2CO3+4H2O1年前查看全部
- 如图是甲烷燃料电池原理示意图,回答下列问题:①电池的负极是________(填“a”或“b”)电极,该极的电极反应是:_
如图是甲烷燃料电池原理示意图,回答下列问题:①电池的负极是________(填“a”或“b”)电极,该极的电极反应是:___________.
②电池工作一段时间后电解质溶液的pH________(填“增大”、“减小”或“不变”).
10.金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐
我想问负极反应怎么来的 xing71年前1
xing71年前1 -
 hmucheng 共回答了21个问题
hmucheng 共回答了21个问题 |采纳率85.7%① a CH4 - 8e + 10 氢氧根离子= 碳酸根离子+7H2O
② 减少
负极甲烷电解后后生成,二氧化碳,与NaOH溶液反应,生成碳酸根离子1年前查看全部
- 将两个薄电池插入氢氧化钾溶液中,向两级分别同入氢气和甲烷,构成甲烷燃料电池
将两个薄电池插入氢氧化钾溶液中,向两级分别同入氢气和甲烷,构成甲烷燃料电池
已知通入甲烷一极,其电极的反应为CH4+10OH(-)-8e(-)=CO3(2-)+7H2O
通入氢气的一极为2O2+8e(-)+4H2O=8OH(-) 或O2+4e(-)+2H2O=4OH(-)
下列叙述中正确的是()
A.通入甲烷的电极为负极
B.正极发生氧化反应
C.该电池使用一段时间后应补充氢氧化钾
D.燃料电池工作后,溶液中的阴离子向正极移动 最后悔爱谁5551年前4
最后悔爱谁5551年前4 -
 蜚橱 共回答了16个问题
蜚橱 共回答了16个问题 |采纳率100%先问下,O2这个事氢气么?我怎么没有见过.
哈……
失去电子的为负极,发生氧化反应;得到电子的为正极,发生还原反应.
由于反应生成CO2,需要消耗KOH,所以C正确.而且A也正确.
答案为 ,AC1年前查看全部
- 甲烷燃料电池碱性环境的负极反应:
甲烷燃料电池碱性环境的负极反应:
负极:CH4+8OH- -8e-==CO2+6H2O或
CH4+10OH- -8e-==CO32-+7H2O是对还是错 zengqc1年前1
zengqc1年前1 -
 lxz19881227 共回答了19个问题
lxz19881227 共回答了19个问题 |采纳率94.7%在碱性环境下,CO2与OH-反应生成CO32-
负极:CH4+10OH— -8e—=CO32—+7H2O
分解步骤:
CH4+2H2O -8e—= CO2 + 8H+
CO2 + 2OH—=CO32—+H2O1年前查看全部
- 科学家预言,燃料电池是21世纪获得电能的重要途径.一种甲烷燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水
科学家预言,燃料电池是21世纪获得电能的重要途径.一种甲烷燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如下:
请回答下列问题:

(1)Pt(a)电极是电池的______极,其电极反应式为______.
Pt(b)电极发生______反应(填“氧化”或“还原”),其电极反应式为______.
(2)如果该电池工作时电路中通过2mol电子,则消耗CH4的物质的量为______mol.
(3)25℃、101kPa时,若CH4在氧气中直接燃烧生成1mol水蒸气放热401kJ,写出该反应的热化学方程式______;若lg水蒸气转化成液态水放热2.445kJ,则CH4的燃烧热为______kJ/mol. kenthsz1年前1
kenthsz1年前1 -
 隐于山林 共回答了15个问题
隐于山林 共回答了15个问题 |采纳率86.7%解题思路:(1)该原电池中质子交换膜只允许质子和水分子通过,说明电解质溶液为酸性溶液,燃料电池中,通入燃料的电极为负极,负极上失电子发生氧化反应,通入氧化剂的电极为正极,正极上得电子发生还原反应;
(2)根据甲烷和转移电子之间的关系式计算;
(3)CH4在氧气中直接燃烧生成1mol水蒸气放热401kJ,生成2mol水蒸气放出802kJ热量,据此写出其热化学反应方程式;lg水蒸气转化成液态水放热2.445kJ,2mol水蒸气转化为液态水放出的热量为
×2=9.78kJ,根据盖斯定律计算其燃烧热.2.445kJ 1g 2g/mol (1)该原电池中质子交换膜只允许质子和水分子通过,说明电解质溶液为酸性溶液,燃料电池中,通入燃料的电极为负极,负极上甲烷失电子和水反应生成二氧化碳和氢离子,电极反应式为:CH4-8e-+2H2O=8H++CO2,通入氧化剂的电极为正极,正极上氧气得电子和氢离子反应生成水而发生还原反应,
电极反应式为2O2+8e-+8H+=4H2O,
故答案为:负;CH4-8e-+2H2O=8H++CO2;还原;2O2+8e-+8H+=4H2O;
(2)负极上电极反应式为CH4-8e-+2H2O=8H++CO2,根据甲烷和转移电子之间的关系式知,该电池工作时电路中通过2mol电子则消耗CH4的物质的量=
2mol
8×1=0.25mol,
故答案为:0.25;
(3)CH4在氧气中直接燃烧生成1mol水蒸气放热401kJ,生成2mol水蒸气放出802kJ热量,
所以其热化学反应方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 ①;
lg水蒸气转化成液态水放热2.445kJ,2mol水蒸气转化为液态水放出的热量为
2.445kJ
1g
2g/mol×2=9.78kJ,
2H2O(g)═2H2O(l)△H=-9.78kJ/mol②,
将方程式①+②得CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.08kJ/mol,
所以甲烷的燃烧热为890.08kJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1;890.08.点评:
本题考点: 常见化学电源的种类及其工作原理.
考点点评: 本题考查了燃料电池及盖斯定律,根据离子交换膜通过的微粒确定电解质溶液的酸碱性,再结合正负极上发生的反应来分析解答,题目难度不大.1年前查看全部
- 通常情况下,甲烷燃料电池的能量利用率 甲烷直接燃烧的能量利用率
 欧欧2121年前1
欧欧2121年前1 -
 清越好 共回答了24个问题
清越好 共回答了24个问题 |采纳率87.5%通常情况下,甲烷燃料电池的能量利用率 大于 甲烷直接燃烧的能量利用率
因为甲醇燃烧时,很多能量转化成了光能1年前查看全部
- 在酸性条件下,甲烷燃料电池的正负极反应是什么,碱性呢
 ymj6ghu1年前1
ymj6ghu1年前1 -
 重工痞子 共回答了14个问题
重工痞子 共回答了14个问题 |采纳率100%不管怎样 甲烷进的是负极 只有甲烷可以失电子1年前查看全部
- 甲烷燃料电池负机产物为啥是碳酸根而不是二氧化碳?
甲烷燃料电池负机产物为啥是碳酸根而不是二氧化碳?
而甲醇燃料电池产物是二氧化碳?
 fanyumm1年前1
fanyumm1年前1 -
 完美产品经销商 共回答了18个问题
完美产品经销商 共回答了18个问题 |采纳率77.8%二氧化碳和水 2CH3OH 3O2=4H2O 2CO2 总方程就是甲烷燃烧的方程,产生二氧化碳和水 CO2和H2O1年前查看全部
- 碱性介质下的甲烷燃料电池 负极:CH4+10OH-+8e-===CO32- +7H2O 正极:2O2+8e-+4H
碱性介质下的甲烷燃料电池 负极:CH4+10OH-+8e-===CO32- +7H2O 正极:2O2+8e-+4H2O===8OH-
请问氢氧根是哪里来的,后边的水又是怎么一回事, sure00701年前2
sure00701年前2 -
 八戒在此 共回答了19个问题
八戒在此 共回答了19个问题 |采纳率100%解析:因为是碱性介质下,也就是碱性电解质提供OH-.
甲烷CH4被氧化,生成CO2,而CO2与OH-生成CO32-;甲烷CH4中的氢只能和OH-作用生成H2O.1年前查看全部
- 甲烷燃料电池方程式负极:CH4+10OH--8e-=CO3²﹣+7H2O 正极:2O2+4H2O- +8e-=8OH-
甲烷燃料电池方程式
负极:CH4+10OH--8e-=CO3²﹣+7H2O
正极:2O2+4H2O- +8e-=8OH-
总方程式:CH4+2O2=CO2+2H2O CO2+2OH-=CO3²﹣+H2O
和为 CH4+2O2+2OH﹣=CO3²﹣+3H2O
为何最后与甲烷燃烧方程式不同而酸性环境却相同呢 花语争鸣1年前4
花语争鸣1年前4 -
 希腊_潘多拉 共回答了15个问题
希腊_潘多拉 共回答了15个问题 |采纳率93.3%因为在酸性条件下生成CO2,这个和燃烧方程式一样,但在碱性条件下CO2变成了CO32-,所以不一样.
你可以先写燃烧方程式,再加上生成CO2和碱的反应方程式.1年前查看全部
- 甲烷燃料电池方程式为何那么写?原理?
 774271561年前1
774271561年前1 -
 chris和cris 共回答了28个问题
chris和cris 共回答了28个问题 |采纳率92.9%原电池的正极发生还原反应,负极发生氧化反应.这里的燃料电池电极反应为:负极CH4+10OH--8e-==CO32-+7H2O,正极O2+2H2O+4e-==4OH-.1年前查看全部
- 甲烷燃料电池的化学方程式
 huiryti1年前3
huiryti1年前3 -
 就只此一名 共回答了14个问题
就只此一名 共回答了14个问题 |采纳率64.3%碱性介质下的甲烷燃料电池 负极:CH4+10OH - - 8e-===CO32- +7H2O
正极:2O2+8e-+4H2O===8OH-
离子方程式为:CH4+2O2+2OH-===CO32-+3H2O
总反应方程式为:CH4+2O2+2KOH===K2CO3+3H2O
酸性介质下的甲烷燃料电池:
负极:CH4-8e-+2H2O===CO2+8H+
正极:2O2+8e-+8H+===4H2O
总反应方程式为:2O2+CH4===2H2O+CO21年前查看全部
- 碱性甲烷燃料电池中甲烷过量的方程式
 忍不住披nn啦1年前1
忍不住披nn啦1年前1 -
 梦伊卡 共回答了14个问题
梦伊卡 共回答了14个问题 |采纳率100%甲烷过量,意味着产生的CO2与碱性电解质,生成对应的碳酸氢盐.
正极:O2 + 4e(-) + H2O→ 4OH(-)
负极:CH4 + 9OH(-) → HCO3(-)+ 4H2O + 8e(-)
总反应:CH4 + 2O2 + OH(-) == HCO3(-) + 2H2O1年前查看全部
- 甲烷燃料电池碱性有产物二氧化碳么
 jolin101年前2
jolin101年前2 -
 秋天的小囡 共回答了24个问题
秋天的小囡 共回答了24个问题 |采纳率95.8%碱性介质下的甲烷燃料电池
负极:CH4+10OH - - 8e-===CO32- +7H2O 正极:2O2+8e-+4H2O===8OH- 离子方程式为:CH4+2O2+2OH-===CO32-+3H2O 总反应方程式为:CH4+2O2+2KOH===K2CO3+3H2O
没有1年前查看全部
- 甲烷燃料电池,碳酸钾溶液作电解质
甲烷燃料电池,碳酸钾溶液作电解质
你给的电极反应式,H原子个数未守恒.应该是错了. 001011年前2
001011年前2 -
 lovesnoopy 共回答了18个问题
lovesnoopy 共回答了18个问题 |采纳率83.3%负极:10OH-+CO32-+CH4-8e-=2HCO3-+7H2O
正极:2O2+8e-+4H2O=8OH-1年前查看全部
- 下图所示装置中,直流电源用的是甲烷燃料电池,甲乙丙三个烧杯分别是盛放200g10%的NaOH溶液、足量的CuSO4
下图所示装置中,直流电源用的是甲烷燃料电池,甲乙丙三个烧杯分别是盛放200g10%的NaOH溶液、足量的CuSO4
溶液、足量的K2SO4溶液,电极均为石墨电极.
接通电源后.经过一段时间后,测的乙中c电极增加16g.
1、点解过程中消耗甲烷的体积
2、甲中NaOH百分含量变为 (保留四位有效数字)
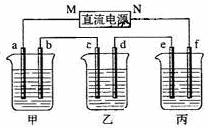
 kk的覅1年前1
kk的覅1年前1 -
 cyc200079 共回答了16个问题
cyc200079 共回答了16个问题 |采纳率87.5%C电极增重16g,说明生成16g(即1/4mol)Cu,所以转移电子数0.5mol 又1molCH4完全氧化转移4mole,所以消耗了1/8摩尔CH4,即标况下2,8L
甲的本质是电解水,且电解掉的水为0.25mol,即4.5g.
所以NaOH质量分数变为20/(200-4.5)=10.2%1年前查看全部
- 如何判断电解质有没参与反应有一道题是甲烷燃料电池的,电解质溶液是NaOH 我当时想总反应式是CH4+2O2=CO2+2H
如何判断电解质有没参与反应
有一道题是甲烷燃料电池的,电解质溶液是NaOH 我当时想总反应式是CH4+2O2=CO2+2H2O 但是答案是CH4+2O2+2NaOH=Na2CO3+3H2O 我不懂为什么电解质参与了反应.
上网问了下怎么判断电解质何时参与反应.但网友们说看总方程式.问题是多数情况下总方程式我都要自己凑自己想.结果就错了.
我想请各位先帮我分析一下上面这道题.再结合我的情况教下我怎么判断? 我首席牛人被封了1年前3
我首席牛人被封了1年前3 -
 luhuiluhui 共回答了17个问题
luhuiluhui 共回答了17个问题 |采纳率100%最主要的方法就是看反应产物能不能和电解质反应,比如本题中显然CO2是溶解于碱的
欢迎追问1年前查看全部
- 为什么甲烷燃料电池在碱性条件下正极反应是氧气和水的反应,而在酸性条件下是氧气的氢离子的反应?
 逝水随风1年前1
逝水随风1年前1 -
 tiantianwodeai 共回答了23个问题
tiantianwodeai 共回答了23个问题 |采纳率95.7%碱性条件下,氢氧根离子比较多,不会把氢氧根离子消耗完,所以就是氧气和水,而酸性条件下就是相反的!1年前查看全部
- 如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),电池总反应为:CH4+2O2+2KOH=K2CO3+3H2O,
 如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),电池总反应为:CH4+2O2+2KOH=K2CO3+3H2O,通过装置Ⅱ实现铁棒上镀铜.下列说法正确的是( )
如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),电池总反应为:CH4+2O2+2KOH=K2CO3+3H2O,通过装置Ⅱ实现铁棒上镀铜.下列说法正确的是( )
A.装置Ⅰ中b电极为负极,电极上发生的是氧化反应
B.装置Ⅰ中,电解质溶液中的阳离子移向a电极
C.电镀时,装置Ⅱ中阳极发生的电极反应式为4OH--4e-=H2O+O2↑
D.若完全反应后,装置Ⅱ中阴极质量增加12.8g,则装置Ⅰ中理论上消耗甲烷1.12L (标准状况下) 海斌8881年前1
海斌8881年前1 -
 忽儿 共回答了17个问题
忽儿 共回答了17个问题 |采纳率88.2%解题思路:通过装置Ⅱ实现铁棒上镀铜,则铁做阴极,铜作阳极,a是负极,b是正极,
A.通入燃料的电极是负极,通入氧化剂的电极是正极;
B.原电池放电时,阳离子向正极移动;
C.电镀时,阳极上金属电极失电子发生氧化反应;
D.根据转移电子相等计算.通过装置Ⅱ实现铁棒上镀铜,则铁做阴极,铜作阳极,a是负极,b是正极,
A.b是正极,正极上通入氧化剂,正极上氧化剂得电子发生还原反应,故A错误;
B.原电池I放电时,阳离子向正极b移动,故B错误;
C.电镀时,阳极上金属电极失电子发生氧化反应,电极反应式为:Cu-2e-=Cu 2+,故C错误;
D.串联电路中转移电子相等,II中阴极上铜离子放电生成铜,生成12.8g铜时转移电子的物质的量=
12.8g
64g/mol×2=0.4mol,根据甲烷和转移电子的关系知,消耗甲烷的体积=
0.4mol
[4−(−4)]×22.4L/mol=1.12L,故D正确;
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池和电解池原理,明确原电池和电解质电极的判断、各个电极上发生的反应是解本题关键,易错选项是C,注意如果活泼金属作电解池阳极材料,则电解时阳极上金属材料失电子而不是电解质溶液中阴离子失电子,为易错点.1年前查看全部
大家在问
- 1已知a-b=4+根号5,b-c=4-根号5,求,a的平方+b的平方+c的平方-ab-bc-ac
- 2铁镍蓄电池电解质为什么是碱性的呢?电解质不能是中性的吗?,水也能电离出OH-
- 3已知数列An满足:a1=1,a2=a(a>0),数列Bn=AnAn+1 (1)若AN是等差数列,且B3=12,求...
- 4等差数列an中a1=28,d=-4,设bn=|an|求数列bn的前n项和Tn
- 5一个不规则的实心物体,质量55kg,放入装满纯水的烧杯中沉入底部,排开0.5N的水.然后向烧杯中加盐并搅拌,直到物体悬浮
- 6一个不规则的实心物体,质量为55g,放入装满纯水的烧杯中,沉入底部,排开0.5N的水,然后向烧杯加盐并且
- 7一个不规则的实心物体,质量55g,放入装满纯水的烧杯中,沉入底部,排开0.5N的水.然后向烧杯中加盐并搅拌,直到物体悬浮
- 8燃料电池写方程式时,酸性电解质和碱性电解质的区别是什么?
- 9甲、乙两地相距500km,两辆汽车同时从甲、乙两地相向开出,客车每小时行85km,货车每小时行49km,3小时能相
- 10请问:“锄头杆”中的“杆”字是读第一声还是第三声啊?
- 11方程组{3x+2y=2 2x+3y=27 的解集 用描述法或列举法表示
- 1215.下列特点在动物进化上具有“划时代”意义的是
- 13我爸爸明天很忙 英文作文 6句话
- 14我认为他获奖是会想起你的 I think he will_,_,you when he wins the prize.那
- 15在16点16分这个时刻,钟表盘面上时针和分针的夹角是______度.

