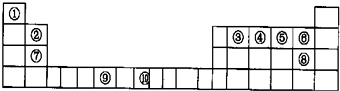
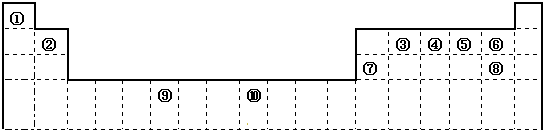
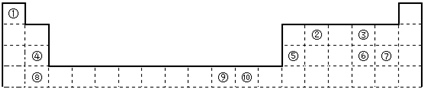
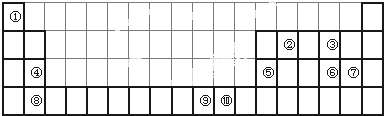
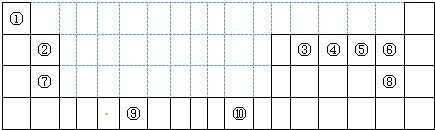
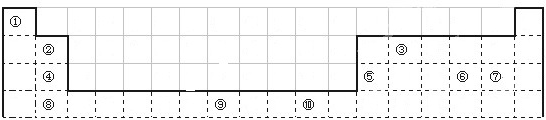
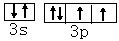下表为长式周期表的一部分,其中的编号代表对应的元素.
 tigerhz2022-10-04 11:39:541条回答
tigerhz2022-10-04 11:39:541条回答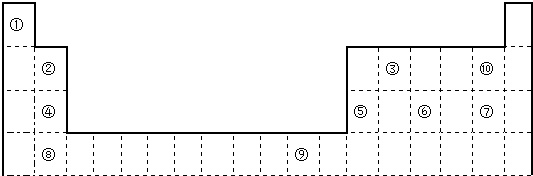
请回答下列问题:
(1)③和⑦形成的一种常见溶剂的电子式为______,其立体构型为______.
(2)某元素原子的外围电子排布式为nsnnpn+1,该元素原子的最外电子层上未成对电子数为______;该元素与元素①形成的最简单分子X属于______分子(填“极性”或“非极性”).
(3)用氢键表示式写出元素 ⑩的氢化物的水溶液中存在的所有氢键类型______.
(4)相同条件下,③与 ⑩的氢化物在水中的溶解度较大的是______(化学式),理由是______.
(5)⑦与⑩的氢化物沸点:⑩的更高,热稳定性⑩的也更强.理由是______.
(6)用电子式表示元素④和⑦形成化合物的过程为______.
(7)元素⑨的基态原子外围电子排布式是______.
(8)元素④的第一电离能______元素⑤(选填“>”、“=”、“<”)的第一电离能;元素⑥的电负性______元素⑦(选填“>”、“=”、“<”)的电负性.

已提交,审核后显示!提交回复
共1条回复
 靖莉jing 共回答了18个问题
靖莉jing 共回答了18个问题 |采纳率100%- 解题思路:由元素在周期表中位置,可知①为H、②为Be、③为C、④为Mg、⑤为Al、⑥为P、⑦为Cl、⑧为Ca、⑨为Cu、⑩为F.
(1)③和⑦形成的一种常见溶剂为CCl4;
(2)某元素原子的外围电子排布式为nsnnpn+1,s能级只能容纳2个电子,故n=2,该元素原子的最外电子层电子排布为2s22p3,为N元素,与元素①形成的最简单分子X为NH3;
(3)⑩的氢化物是HF,HF的水溶液中,HF和HF之间能形成氢键,水分子之间能形成氢键,水中氢原子和氟化氢中氟原子能形成氢键,氟化氢中氢原子和水中氧原子能形成氢键;
(4)③的氢化物为CH4,⑩的氢化物为HF,根据分子极性与氢气分析在水中的溶解度;
(5)⑦的氢化物为HCl,⑩的氢化物为HF,HF分子之间存在氢键,沸点高于HCl;根据H-X键的键能判断氢化物稳定性;
(6)元素④和⑦形成化合物为MgCl2,由镁离子与氯离子构成,用Mg原子、Cl原子电子式表示其形成;
(7)元素⑨为Cu,根据能量最低原理书写其基态原子外围电子排布式;
(8)元素原子各轨道处于半满、全满、全空时,能量较低,第一电离能高于同周期相邻元素;同周期自左而右电负性增大.由元素在周期表中位置,可知①为H、②为Be、③为C、④为Mg、⑤为Al、⑥为P、⑦为Cl、⑧为Ca、⑨为Cu、⑩为F.
(1)③和⑦形成的一种常见溶剂为CCl4,电子式为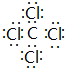 ,为正四面体结构,
,为正四面体结构,
故答案为: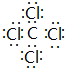 ;正四面体;
;正四面体;
(2)某元素原子的外围电子排布式为nsnnpn+1,s能级只能容纳2个电子,故n=2,该元素原子的最外电子层电子排布为2s22p3,最外电子层上未成对电子数为3,为N元素,与元素①形成的最简单分子X为NH3,为三角锥形,分子中正负电荷不重合,属于极性分子,
故答案为:3;极性;
(3)⑩的氢化物是HF,HF的水溶液中,HF和HF之间能形成氢键,水分子之间能形成氢键,水中氢原子和氟化氢中氟原子能形成氢键,氟化氢中氢原子和水中氧原子能形成氢键,所以其氢键有:F-H…F、F-H…O、O-H…F、O-H…O,
故答案为:F-H…F、F-H…O、O-H…F、O-H…O;
(4)③的氢化物为CH4,⑩的氢化物为HF,CH4是非极性分子,HF与水都是极性分子,且HF与水之间形成氢键,故HF在水中溶解度更大,
故答案为:HF;CH4是非极性分子,HF与水都是极性分子,且HF与水之间形成氢键;
(5)⑦的氢化物为HCl,⑩的氢化物为HF,HF分子之间存在氢键,沸点高于HCl;H-F的键能比较H-Cl键能大,故HF更稳定,
故答案为:HF分子之间存在氢键,沸点高于HCl;H-F的键能比较H-Cl键能大,HF更稳定;
(6)元素④和⑦形成化合物为MgCl2,由镁离子与氯离子构成,用Mg原子、Cl原子电子式表示其形成为: ,
,
故答案为: ;
;
(7)元素⑨为Cu,根据能量最低原理,其基态原子外围电子排布式为3d104s1,
故答案为:3d104s1;
(8)Mg原子3s轨道容纳2个电子,处于全满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能Mg>Al;同周期自左而右电负性增大,故电负性P<Cl,
故答案为:>;<.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题是对物质结构的考查,涉及元素周期表、电子数、分子结构与性质、氢键、电离能、电负性、核外电子排布等,比较全面考查物质结构主干知识,需要学生具备知识的基础,难度中等. - 1年前
相关推荐
- (2014•潍坊模拟)如图为长式周期表的一部分,其中的编号代表对应的元素.
(2014•潍坊模拟)如图为长式周期表的一部分,其中的编号代表对应的元素.
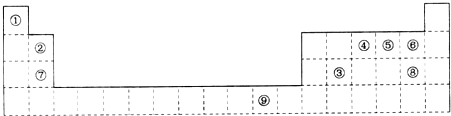
(1)元素⑨原子的价电子排布式为______.
(2)试用VSEPR理论分析②与⑧形成的化合物的空间构型为______.
(3)元素④的第一电离能______(填“>”=”或“<”)元素⑤的第一电离能;元素④与元素①通过共价键形成X分子,其中心原子在成键时,其原子轨道采用的是______杂化方式.请写出与④的单质互为等电子体(电子总数相等)的分子、离子的化学式:______、______.(各写一种)
(4)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是______. u333322221年前1
u333322221年前1 -
 tzyboy 共回答了16个问题
tzyboy 共回答了16个问题 |采纳率93.8%解题思路:由元素在周期表中位置知:①为H、②为Be、③为Si、④为N、⑤为O、⑥为、⑦为Mg、⑧为Cl、⑨为Cu.
(1)元素⑨为Cu,核外电子数为29,根据能量最低原理与洪特规则书写外围电子排布式;
(2)②与⑧形成的化合物为BeCl2,计算Be原子的孤电子对数、价层电子对数,确定BeCl2的空间结构;
(3)N元素原子2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
元素④与元素①通过共价键形成X分子为HF,根据F原子孤电子对数、σ键数确定杂化轨道数目,进而确定杂化方式;
原子数目相同,价电子总数或电子总数相同的微粒,互为等电子体;
(4)①与⑥形成化合物为HF,HF分子之间存在氢键,存在缔合(HF)n分子.由元素在周期表中位置知:①为H、②为Be、③为Si、④为N、⑤为O、⑥为、⑦为Mg、⑧为Cl、⑨为Cu,
(1)元素⑨为Cu,核外电子数为29,根据能量最低原理与洪特规则,其外围电子排布式为3d104s1,故答案为:3d104s1;
(2)②与⑧形成的化合物为BeCl2,Be原子的孤电子对数=[2−1×2/2]=0、价层电子对数=2+0=2,故为直线型结构,故答案为:直线型;
(3)同周期随原子序数增大,元素第一电离能呈增大趋势,但N元素2p能级容纳3个电子,处于半满稳定状态,能量较低,失去第一个电子需要的能量较高,故第一电离能N>O,
元素④与元素①通过共价键形成X分子为HF,F原子孤电子对数为3、成1个σ键数,杂化轨道数目为4,故F原子采取sp3杂化;
原子数目相同,价电子总数或电子总数相同的微粒,互为等电子体,与F2互为等电子体(电子总数相等)的微粒有:CO、CN-等,
故答案为:>;sp3;CO;CN-;
(4)①与⑥形成化合物为HF,HF分子之间存在氢键,存在缔合(HF)n分子,故实验测得的相对分子质量一般高于理论值,故答案为:HF分子之间存在氢键,形成缔合(HF)n分子.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题是对物质结构的考查,涉及元素周期表、核外电子排布、电离能、分子结构与性质、杂化轨道、氢键等,难度中等,注意氢键对物质性质的影响.1年前查看全部
- 如图为长式周期表的一部分,其中的编号代表对应的元素.
如图为长式周期表的一部分,其中的编号代表对应的元素.
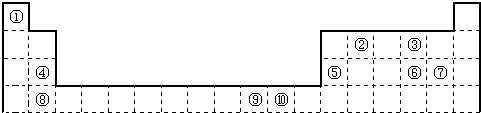
(1)表中属于ds区的元素是______(填编号).
(2)元素②与③形成的一种化合物是重要的化工原料,该化合物可用于人工降雨.有关该化合物分子的说法不正确的是______.
A.分子中含极性共价键 B.含有2个σ键和2个π键
C.属于非极性分子 D.该化合物分子中,②原子采用sp2杂化
(3)根据上述表格中的十种元素填空:
Ⅰ、金属性最强的主族元素的电子排布式为______;
Ⅱ、⑤、⑥、⑦的离子半径由小到大的顺序是______(填化学式)
Ⅲ、⑥、⑦两种元素的最高价氧化物对应的水化物的酸性由大到小的顺序是______(填化学式)
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为______;该元素与元素①形成的分子X的空间构型为______. eastwardly1年前1
eastwardly1年前1 -
 xy1115 共回答了18个问题
xy1115 共回答了18个问题 |采纳率88.9%解题思路:由元素在周期表中的位置可知,①为H,②为C,③为O,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ca,⑨为Ni,⑩为Cu,
(1)以上元素只有Cu为ds区元素;
(2)②与③形成的一种化合物是重要的化工原料,该化合物可用于人工降雨,该化合物为CO2,为含极性键的非极性分子,C原子为sp杂化,双键中含1个σ键和1个π键;
(3)I、以上元素,金属性最强的为Ca,原子序数为20;
II、离子的电子层越多,半径越大,具有相同电子层结构的离子,原子序数大的离子半径小;
Ⅲ、⑥、⑦的非金属性为Cl>S,非金属性越强,元素的最高价氧化物对应的水化物的酸性越强;
(4)元素的特征电子排布式为nsnnpn+1,s最多有2个电子,所以n=2,即电子排布式为1s22s22p3,该元素为N元素,核外最外层电子的孤对电子数为1,单电子为3,与元素①形成的分子X为NH3,为三角锥型.由元素在周期表中的位置可知,①为H,②为C,③为O,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ca,⑨为Ni,⑩为Cu,(1)元素周期表中位于ds区的元素为第ⅠB、ⅡB族,以上元素只有Cu为ds区元素,故答案为:⑩;(2)②与...
点评:
本题考点: 位置结构性质的相互关系应用;元素周期律和元素周期表的综合应用.
考点点评: 本题考查位置、结构、性质的应用,涉及元素周期表中元素的分区、元素周期表中元素的位置、电子排布式、分子构型、非金属性比较等,综合性较强,题目难度中等.1年前查看全部
- 下表为长式周期表的一部分,其中的编号代表对应的元素。
下表为长式周期表的一部分,其中的编号代表对应的元素。


请回答下列问题:
(1)表中属于d区的元素是 (填编号);
(2)表中编号原子中,半径最小的是 (填元素符号,下同),第一电离能最小的是: ,电负性最大的是 ;
电负性大小:⑤元素 ④元素(填大于、等于或小于),第一电离能大小:⑤元素 ④元素( 填大于、等于或小于)。
(3)某元素的价电子排布式为ns n-1 np n+1 ,该元素原子的最外电子层的孤对电子数为 ;该元素还可与元素①形成18电子的气体分子Y,将过量的Y气体通入盛有硫酸铜水溶液的试管里,反应的离子方程式为: ;
(4)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据:

表中的金属元素是 (填字母);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是
。 dtlove19821年前1
dtlove19821年前1 -
 魔法柜的巫婆 共回答了20个问题
魔法柜的巫婆 共回答了20个问题 |采纳率95%(1)⑨;(2)H;K;O;>;<
(3)2;Cu 2 + +H 2 S = CuS↓+2H +
(4)DEF;B中np轨道为半充满状态,能量较低,较稳定,所以第一电离能大。
1年前查看全部
- 下表为长式周期表的一部分,其中的编号代表对应的元素.
下表为长式周期表的一部分,其中的编号代表对应的元素.
试填空.
(1)与元素⑨同周期且最外层电子数相同的元素还有______.
(2)元素④、⑤的第一电离能由大到小顺序是:______(用元素符号表示);元素④与元素①形成的简单的X分子的空间构型为:______.请写出与元素④最高价氧化物对应水化物互为等电子体的离子的化学式______(写一种).
(3)X分子极易溶于的元素⑤与元素①形成的简单的Y分子主要原因是______.
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质,写出元素②的氢氧化物与NaOH溶液反应后盐的化学式______.
(5)元素⑩在一定条件下形成的晶体的基本结构单元如下图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为:______.
 不再猶豫1年前1
不再猶豫1年前1 -
 甜恬_vv 共回答了16个问题
甜恬_vv 共回答了16个问题 |采纳率87.5%解题思路:根据元素周期表可知①为H元素,②为Be元素③C元素④N元素⑤O元素⑥F元素⑦为Al元素⑧为Cl元素⑨为Cr元素⑩为Co元素.依次解答.根据元素周期表可知①为H元素,②为Be元素③C元素④N元素⑤O元素⑥F元素⑦为Al元素⑧为Cl元素⑨为Cr元素⑩为Co元素.
(1)Cr为24号元素,其最外层电子数为1,同周期其最外层电子数为1的元素还有K、Ni;
故答案为:K、Ni;
(2)非金属性越强,第一电离能越大.但由于氮元素的2p轨道电子处于半充满状态,稳定性强,所以第一电离能大于氧元素的;
氨气分子中中心原子氮原子含有1对孤对电子,所以NH3分子的空间构型是三角锥型;
N元素最高价氧化物对应水化物为硝酸,和硝酸互为等电子体的离子有NO3-;
故答案为:N>O;三角锥型;NO3-;
(3)氨气极易溶于水,是由于氨气分子和水分间形成了氢键;
故答案为:氨气分子和水分间形成了氢键;
(4)Al与Be位于对角线位置,性质相似,则Be与NaOH溶液反应生成Na2BeO2;
故答案为:Na2BeO2;
(5)由图1可知,与体心原子距离最近的原子位于顶点,则有8个;由图2可知,与顶点原子距离最近的原子位于面心,1个晶胞中有3个,空间有8个晶胞无隙并置,且1个面被2个晶胞共用,则晶体中有3×8×
1
2=12个,所以在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为8:12=2:3;
故答案为:2:3.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题为综合题,涉及知识点较多,注重元素周期表和原子结构的知识相结合来考查学生,熟悉元素在周期表的位置、第一电离能、氢键、晶胞结构等知识即可解答.1年前查看全部
- 下表为长式周期表的一部分,其中的字母代表相应的元素 试回答下列问题:
下表为长式周期表的一部分,其中的字母代表相应的元素 
试回答下列问题:
(1)元素h的二价阳离子的基态电子排布式为____________。
(2)在1185 K时,元素h可形成如图所示基本结构单元的晶体,则其中h原子的配位数是____。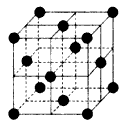
(3)e、d、e、f元素的第一电离能(I 1 )由小到大的顺序为________________。(用相应元素符号表示)
(4)表中所列的元素之间可以形成多种化合物,其中邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点,理由是__________________。邻甲基苯甲醛分子中碳原 子轨道的杂化类型为________。1 mol苯甲醛分子中σ键的数目为______。
(5)一种表中元素形成的离子与单质d 3 互为等电子体,其化学式为_____________。 执谜不悔1年前1
执谜不悔1年前1 -
 东北人什么东西 共回答了8个问题
东北人什么东西 共回答了8个问题 |采纳率87.5%(1)1s 2 2s 2 2p 6 3s 2 3p 6 3d 10
(2)12
(3)Al(4)邻羟基苯甲醛分子之间不存在氢键,对羟基苯甲醛能在分子间形成氢键;sp 2 、sp 3 ;14
(5)NO 2 -1年前查看全部
- (2012•南昌二模)图一:长式周期表的一部分(编号代表对应元素)
(2012•南昌二模)图一:长式周期表的一部分(编号代表对应元素)
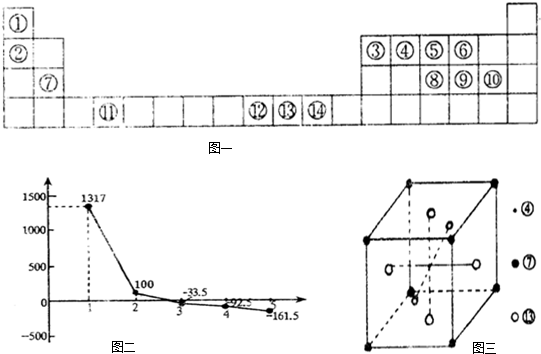
图二:②③④⑤⑥对应氢化物沸点
请回答下列问题:
(1)图一中属于P区的元素共有______种;原子核外有5种运动状态不同的电子,该元素名称是______;14种元素中电负性最大的元素是______;(填元素符号)
(2)科学家发现④⑦⒀三种元素形成的晶体有超导作用,其晶胞结构如图三所示,则该化合物化学式为______;晶体中每个⑦原子周围距离最近且等距离的⑩原子有______个.
(3)①④⑥三种元素组成的一种化合物X是新装修居室中的一种有害气体;①④二种元素形成原子个数比为1:1的化合物Y是一种常见的有机溶剂,下列有关叙述正确的是______:(填字母)
A.X与水分子能形成氢键,Y是非极性分子
B.Y分子中每个碳含有2个σ键,1个π键
C.④⑥元素形成常见的化合物晶体熔点沸点都比SiO2晶体低,因为前者是分子晶体,后者是原子晶体.
D.X与CO2分子中的中心原子均采用SP3杂化
(4)图二中,系列3对应的氢化物中心原子杂化方式是______;
系列1对应的氢化物沸点比其他氢化物高的原因是______;
系列2对应的氢化物比系列3、4、5对应的氢化物沸点高的原因是______. rockvic1年前1
rockvic1年前1 -
 丁丁66 共回答了20个问题
丁丁66 共回答了20个问题 |采纳率90%解题思路:由元素在周期表中的位置可知,①为H,②为Li,③为B,④为C,⑤为N,⑥为O,⑦为Mg,⑧为P,⑨为S,⑩为Cl,⑾为Ti,⑿为Co,⒀为Ni,⒁为Cu,
(1)P区包括ⅢA~ⅦA及零族元素;原子核外有5种运动状态不同的电子,则该元素原子核外有5个电子,为硼元素;金属性越强电负性越小,同周期自左而右电负性增大,⑥⑩元素电负性最大,再结合⑥⑩元素化合物中元素化合价判断;
(2)根据均摊法计算晶胞中各原子数目,据此书写化学式;⑦原子处于晶胞顶点,与之最近的,⒀原子处于面心位置,每个⑦原子为12面共用;
(3)①④⑥三种元素组成的一种化合物X是新装修居室中的一种有害气体,X为HCHO;①④二种元素形成原子个数比为1:1的化合物Y是一种常见的有机溶剂,Y为苯;
(4)②的氢化物为离子化合物,沸点最高,为系列1;⑥的氢化物为水,沸点为100℃,为系列2;B2H6、CH4、NH3,都属于分子晶体,B2H6的相对分子质量最大,三者沸点相对最高,为系列3,根据B2H6的结构判断B原子杂化方式.由元素在周期表中的位置可知,①为H,②为Li,③为B,④为C,⑤为N,⑥为O,⑦为Mg,⑧为P,⑨为S,⑩为Cl,⑾为Ti,⑿为Co,⒀为Ni,⒁为Cu,
(1)P区包括ⅢA~ⅦA及零族元素,③④⑤⑥⑧⑨⑩属于P区元素,共7种;原子核外有5种运动状态不同的电子,则该元素原子核外有5个电子,为硼元素;金属性越强电负性越小,同周期自左而右电负性增大,故O、Cl元素电负性最大,Cl、O两元素化合物中O元素表现负化合价,氧原子对键合电子吸引力更大,则O元素的电负性比Cl元素大,故上述元素中氧元素的电负性增大,
故答案为:7;硼;O;
(2)晶胞中C原子处于体心,有1个C原子,Mg原子处于晶胞顶点、Mg各原子数目为8×[1/8]=1,Ni原子处于面心、Ni原子数目为6×[1/2]=3,故该化合物化学式为 MgCNi3;Mg原子处于晶胞顶点,与之最近的Ni原子处于面心位置,每个Mg原子为12面共用,故与Mg原子最近的Ni原子有12个,
故答案为:MgCNi3;12;
(3)①④⑥三种元素组成的一种化合物X是新装修居室中的一种有害气体,X为HCHO;①④二种元素形成原子个数比为1:1的化合物Y是一种常见的有机溶剂,Y为苯,
A.HCHO中氧原子与水分子中氢原子之间形成氢键,苯是平面对称结构,是非极性分子,故A正确;
B.苯分子中每个碳3个σ键,苯分子中存在1个大π键,故B错误;
C.④⑥元素形成常见的化合物为CO2,属于分子晶体,SiO2属于原子晶体,故CO2晶体熔点沸点都比SiO2晶体低,故C正确;
D.HCHO中C原子成3个σ键,不含孤对电子,采取sp2杂化,CO2分子中的C原子成2个σ键,不含孤对电子,原子采取sp杂化,故D错误,
故答案为:AC;
(4)系列3为B2H6,结构为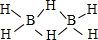 ,B2H6中B原子成成4个σ键,不含孤对电子,采取sp3杂化;
,B2H6中B原子成成4个σ键,不含孤对电子,采取sp3杂化;
系列1为LiH,属于离子化合物,沸点比其他氢化物高;
系列2为水,水分子之间容易形成氢键,使分之间作用力增大,比系列3、4、5对应的氢化物沸点高,
故答案为:sp3;系列1为LiH,属于离子化合物,沸点比其他氢化物高;水分子之间容易形成氢键,使分之间作用力增大.点评:
本题考点: 元素周期律和元素周期表的综合应用;共价键的形成及共价键的主要类型;晶胞的计算;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查物质结构与性质,涉及元素周期表、元素周期表、晶胞计算、杂化理论、分子结构与性质、晶体类型与性质等,难度较大,(4)为易错点、难点,中学一般不涉及B的氢化物.1年前查看全部
- 无机化学命名委员会在1989年作出决定,把长式元素周期表原先的主、副族及族号取消,由左到右改为18列.按此规定,下列说法
无机化学命名委员会在1989年作出决定,把长式元素周期表原先的主、副族及族号取消,由左到右改为18列.按此规定,下列说法中错误的是( )
A.第15列元素的最高价氧化物的化学式是R2O3
B.第17列元素单质熔、沸点逐渐升高
C.第11列中肯定没有非金属元素
D.在18列元素中,第3列的元素种类最多 红枫叶_kk1年前1
红枫叶_kk1年前1 -
 letheer 共回答了22个问题
letheer 共回答了22个问题 |采纳率86.4%解题思路:从左到右改为第1~18列,如第ⅠA族为第1列,零族为第18列,则第2列为碱土金属,第15列为氮族元素,第17列为卤族元素,第14列为碳族元素,结合同族元素的性质及特性来解答.A.第15列为氮族元素,最高化合价为+5价,最高价氧化物的化学式是R2O5,故A错误;
B.第17列元素对应的单质为非金属单质,相对分子质量越大,单质熔、沸点越高,故B正确;
C.第11列为第ⅠB族元素,为过渡金属元素,没有非金属,故C正确;
D.第3列为ⅢB族,有镧系和锕系元素,元素种类最多,故D正确.
故选A.点评:
本题考点: 元素周期表的结构及其应用.
考点点评: 本题考查元素周期表和元素周期律,为高频考点,侧重于学生的基础知识的综合理解和运用的考查,明确列对应的主族元素是解答本题的关键,注意把握特例和元素性质的相似性,题目难度不大.1年前查看全部
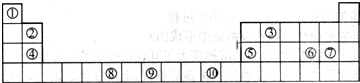
- 如表为长式周期表的一部分,其中的序号代表对应的元素.
如表为长式周期表的一部分,其中的序号代表对应的元素.
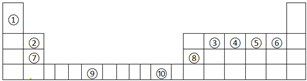
(1)写出上表中元素⑤的轨道表示式______,元素⑨原子的核外电子排布式______.
(2)元素第一电离能的大小比较:④______⑤(填写“>”“=”或“<”,下同);元素电负性的大小比较:④______⑤(填写“>”“=”或“<”);请写出与元素④的单质互为等电子体的一种微粒的化学式______.
(3)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是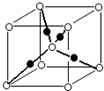 ______.
______.
(4)上述③与④元素组成的(CN)2化合物中σ键与π键之比______.
(5)⑦的氧化物是优良的耐高温材料,它的熔点比CaO高,其原因是______.
(6)元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则该氧化物的化学式______. tuifeidaishu1年前1
tuifeidaishu1年前1 -
 wmpol 共回答了15个问题
wmpol 共回答了15个问题 |采纳率93.3%解题思路:由元素在周期表中位置,可知①为H、②为Be、③为C、④为N、⑤为O、⑥为F、⑦为Mg、⑧为Al、⑨为Cr、⑩为Cu.
(1)根据核外电子排布规律进行解答;
(2)同周期自左而右第一电离能呈增大趋势,但N元素2p轨道容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;同周期自左而右电负性增大;
原子总数、价电子总都相等的微粒互为等电子体;
(3)HF分子之间存在氢键,形成缔合(HF)n分子;
(4)化合物(CN)2的结构式为N≡C-C≡N;
(5)氧化镁与氧化钙都属于离子晶体,离子所带电荷相同,离子半径越小,离子键越强,晶格能越大,熔沸点越高;
(6)根据均摊法计算晶胞中各原子数目,确定化学式.由元素在周期表中位置,可知①为H、②为Be、③为C、④为N、⑤为O、⑥为F、⑦为Mg、⑧为Al、⑨为Cr、⑩为Cu.
(1)⑤为O,原子核外电子排布为1s22s22p4,核外电子轨道排布式为: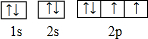 ,
,
⑨为Cr,原子核外电子数为14,根据能量最低原理解洪特规则特例,可知其基态原子核外电子排布为:1s22s22p63s23p63d54s1,
故答案为: ;1s22s22p63s23p63d54s1;
;1s22s22p63s23p63d54s1;
(2)同周期自左而右第一电离能呈增大趋势,但N元素2p轨道容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:N>O;同周期自左而右电负性增大,故电负性N<O;
元素④的单质为N2,与N2互为等电子体的一种微粒为CO等,
故答案为:>;<;CO;
(3)HF分子之间存在氢键,形成缔合(HF)n分子,故实验测得HF的相对分子质量的值一般高于理论值,
故答案为:HF分子之间存在氢键,形成缔合(HF)n分子;
(4)化合物(CN)2的结构式为N≡C-C≡N,单键为σ键,三键含有1个σ键、2个π键,故(CN)2化合物中σ键与π键之比为3:4,
故答案为:3:4;
(5)氧化镁与氧化钙都属于离子晶体,离子所带电荷相同,Mg2+离子比Ca2+离子半径小,MgO中离子键强,MgO比CaO的晶格能大,故MgO熔沸点高,
故答案为:离子所带电荷相同,Mg2+离子比Ca2+离子半径小,MgO中离子键强,MgO比CaO的晶格能大;
(6)C原子位于晶胞内部,晶胞中含有4个Cu原子,晶胞中O原子数目=1+8×[1/8]=2,晶胞中Cu、O原子数目之比=4:2=2:1,故该氧化物化学式为Cu2O,
故答案为:Cu2O.点评:
本题考点: 元素周期律和元素周期表的综合应用;晶胞的计算.
考点点评: 本题是对物质结构的考查,涉及元素周期表、元素周期律、核外电子排布、化学键、晶体类型与性质、晶胞计算等,难度中等,注意理解同周期元素第一电离能突跃原因,掌握物质熔沸点比较.1年前查看全部
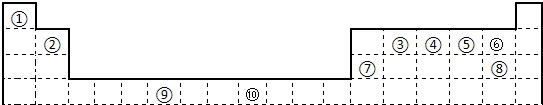
- 下表为长式周期表的一部分,其中的编号代表对应的元素.
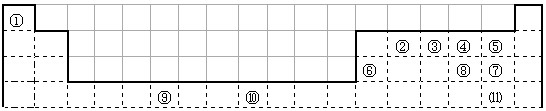
下表为长式周期表的一部分,其中的编号代表对应的元素.
请回答下列问题:
(1)表中属于d区的元素是______(填编号).元素⑧的原子外围电子排布式______;
(2)③和⑦形成的常见化合物的晶体类型是______;②、③、④的电负性______>______>______(用元素符号表示).判断依据______;
(3)某元素的特征电子排布式(价电子排布式)为nsnnpn+1,该元素为周期表中______(填编号);该元素与元素①形成的化合物x极易溶于水的原因是______;
(4)在⑧元素的硫酸盐溶液中加入过量的x的水溶液,可生成的配合物的化学式______,简要描述该配合物中化学键的成键情况______;
(5)②、③形成一种超硬、耐磨、耐高温的新型无机非金属材料,则其化学式为______,其硬度比金刚石______(填“大”或“小”). 又是一夜春风来1年前1
又是一夜春风来1年前1 -
 塔塔倍 共回答了20个问题
塔塔倍 共回答了20个问题 |采纳率95%解题思路:由元素在周期表中的位置可知,①为H,②为N,③为C,④为O,⑤为Al,⑥为S、⑦为Cl,⑧为Cu,⑨为Fe,
(1)由图可知⑨处于d区;根据核外电子排布规律书写Cu的外围电子排布;
(2))③和⑦形成的常见化合物为CCl4,属于分子晶体;
同周期元素从左到右的非金属性逐渐增强,电负性增强;
(3)元素的特征电子排布式(价电子排布式)为nsnnpn+1,则n=2,故为2s22p3,为N元素;
根据形似相溶与氢键分析氨气极易溶于水;
(4)铜离子与氨分子形成配位键,故形成的配合物为[Cu(NH3)4]SO4;
(5)②、③形成一种超硬、耐磨、耐高温的新型无机非金属材料为C3N4,根据键长分析判断与金刚石的硬度大小.由元素在周期表中的位置可知,①为H,②为N,③为C,④为O,⑤为Al,⑥为S、⑦为Cl,⑧为Cu,⑨为Fe,
(1)由图可知⑨处于d区;Cu原子核外电子数为29,故Cu原子的外围电子排布3d104s1,故答案为:⑨;3d104s1;
(2))③和⑦形成的常见化合物为CCl4,属于分子晶体;同周期元素从左到右的非金属性逐渐增强,电负性增强,故电负性O>N>C,
故答案为:分子晶体;O;N;C;同周期元素从左到右的非金属性逐渐增强;
(3)元素的特征电子排布式(价电子排布式)为nsnnpn+1,则n=2,故为2s22p3,为N元素,为表中②;
氨气和水都是极性分子,氨气和水分子之间可以形成分子间氢键,故氨气极易溶于水;
故答案为:②;氨气和水都是极性分子,氨气和水分子之间可以形成分子间氢键;
(4)NH3和Cu2+之间以配位键结合,SO42-和配离子之间以离子键结合,故形成的配合物为[Cu(NH3)4]SO4,
故答案为:[Cu(NH3)4]SO4;NH3和Cu2+之间以配位键结合,SO42-和配离子之间以离子键结合;
(5)②、③形成一种超硬、耐磨、耐高温的新型无机非金属材料为C3N4,属于原子晶体,C-N键长小于金刚石中C-C键长,故C-N更稳定,C3N4的硬度比金刚石大,
故答案为:C3N4;大.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查元素周期表与周期律的综合应用、核外电子排布规律、化学键、晶体类型与性质等,难度中等,注意掌握周期表的结构.1年前查看全部
- 下表为长式周期表的一部分,其中的编号代表对应的元素.
下表为长式周期表的一部分,其中的编号代表对应的元素.
(1)表中属丁d区的元素是______(填编号);
(2)③、④两种元素的电负性人小为③______④(填“>”、“<”、“=”,下同),它们的第一电离能大小为③______④.
(3)②、⑤、⑧元素的单质熔点高低的顺序是______(用编号表示).
(4)③元素的氢化物住水中的溶解度比同族元素的其它氢化物大得多的原因是______
(5)⑥与⑧形成的分子最外层都满足8电子稳定结构,则在分子中⑥原子的杂化轨道的形式是______.分子空间构型是______.
(6)1183K以下,⑨元素形成品体的基本结构单元如图1所示1183K以上基本结构单元转变为如图2所示,在两种晶体中最邻近的原子间距离相等.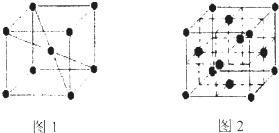
在图2中,与一个⑨原子等距离且最近的⑨原子的个数是______;图1与图2中含有的⑨原子个数之比为______. 恶想时代1年前1
恶想时代1年前1 -
 chaoye98 共回答了20个问题
chaoye98 共回答了20个问题 |采纳率85%解题思路:由元素在周期表中位置,可知①为Be、②为C、③为N、④为O、⑤为Mg、⑥为Si、⑦为S、⑧为Cl、⑨为Fe、⑩为Cu.
(1)d区元素包含3~10列元素(镧系元素、锕系元素除外);
(2)同周期随原子序数增大电负性增大,N元素2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
(3)根据晶体类型及物质的状态判断;
(4)氨气能与水反应,且能与水分子之间形成氢键;
(5)⑥与⑧形成的分子最外层都满足8电子稳定结构,该分子为SiCl4,根据Si原子所成σ键数目确定其杂化方式,进而确定空间结构;
(6)图2中,以定点原子为研究对象,与之最近的原子处于面心上,每个顶点为12面共用;根据均摊法计算晶胞中原子数目,进而计算两种晶胞中含有原子数目之比.由元素在周期表中位置,可知①为Be、②为C、③为N、④为O、⑤为Mg、⑥为Si、⑦为S、⑧为Cl、⑨为Fe、⑩为Cu.
(1)d区元素包含3~10列元素(镧系元素、锕系元素除外),故⑨号元素处于d区,故答案为:⑨;
(2)同周期随原子序数增大电负性增大,故电负性N<O;N元素2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O,故答案为:<;>;
(3)②的单质金刚石为原子晶体,故碳单质熔点最高,常温下Mg为固体,氯气为气体,故Mg的熔点高于氯气,故单质熔点高低的顺序是:②>⑤>⑧,故答案为:②>⑤>⑧;
(4)氨气能与水反应,且能与水分子之间形成氢键,故氨气在水的溶解度比同主族其它氢化物大的多,
故答案为:氨气分子与分子形成氢键且发生化学反应;
(5)⑥与⑧形成的分子最外层都满足8电子稳定结构,该分子为SiCl4,分子中Si原子成4个σ键,没有孤电子对,杂化轨道数目为4,采取sp3杂化方式,杂化轨道全部参与成键,故其空间结构为正四面体,
故答案为:sp3;正四面体;
(6)图2中,以定点原子为研究对象,与之最近的原子处于面心上,每个顶点为12面共用,故与一个⑨原子等距离且最近的⑨原子的个数是12;
图1晶胞中原子数目=1+8×[1/8]=2,图2晶胞中原子数目=6×[1/2]+8×[1/8]=4,故图1与图2中含有的⑨原子个数之比为2:4=1:2,
故答案为:12;1:2.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题是对物质结构的考查,涉及元素周期表、电负性、电离能、晶体类型与性质、杂化轨道、分子结构与性质、晶胞计算等,比较全面考查物质结构主干知识,需要学生具备扎实的基础,难度中等.1年前查看全部
- 下列关于教材附录长式元素周期表的结构的说法中正确的是( ) A.元素周期表有七个横行,也就是七个周期 B.元素周期表有
下列关于教材附录长式元素周期表的结构的说法中正确的是( ) A.元素周期表有七个横行,也就是七个周期 B.元素周期表有18个纵行,也就是18个族 C.元素周期表中含有元素最多的周期是第六周期,共有32种元素 D.元素周期表中含有元素最多的族是第IA族,共有元素7种  totter06121年前1
totter06121年前1 -
 鬼靈貓 共回答了15个问题
鬼靈貓 共回答了15个问题 |采纳率80%A、元素周期表有七个横行,为七个周期,故A正确.
B、元素周期表有18个纵行,其中包括七个主族、七个副族、一个0族和VIII族共16个族,故B不正确.
C、元素周期表中含有元素最多的周期是第六周期,共有32种元素,故C正确.
D、元素周期表中含有元素最多的族为第ⅢB族,含有镧系和锕系,共32种元素,故D不正确.
故选AC.1年前查看全部
- F表为长式周期表的一部分,其中的编号代表对应的元素 请回答下列问题:
F表为长式周期表的一部分,其中的编号代表对应的元素 
请回答下列问题:
(1)表中属于d区的元素是____(填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种常见环状分子名称为____;③和⑦形成的常见化合物类型是_______(填“离子”或“共价”)化合物。
(3)某元素的特征电子排布式为ns n np n+1 ,该元素原子的核外最外层电子的成对电子数为____个。
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:__________________。 您说的真好1年前1
您说的真好1年前1 -
 洋洋517 共回答了21个问题
洋洋517 共回答了21个问题 |采纳率81%(1)⑨
(2)苯;共价
(3)2
(4) Be(OH) 2 +2NaOH=Na 2 BeO 2 +2H 2 O1年前查看全部
- 下表为长式周期表的一部分,其中的编号代表对应的元素。 试填空(答题时如需表示具体元素,请用相应的元素符号):。
下表为长式周期表的一部分,其中的编号代表对应的元素。 
试填空(答题时如需表示具体元素,请用相应的元素符号):。
(1)元素②和④形成的化合物中(元素②显最高价),每一个分子中含__________个π键。元素①的某种晶体熔点约2300°C,沸点3658°C,硬度仅次于金刚石。则元素①的该种晶体为__________晶体。
(2)在一定压强下,将元素⑤与⑧的氢化物的混合气体降温时,首先液化的是__________(填化学式),将元素⑥与⑧,⑨与⑧组成的化合物分别升温,首先熔化的是__________(填化学式)。
(3)写出⑩基态原子的外围电子排布式:__________,其晶体堆积方式名称为__________。
(4)③、④、⑤三种元素的第一电离能大小顺序是:__________。⑦原子价电子的轨道表示式
__________。 lanslot7881年前1
lanslot7881年前1 -
 KINGLYP 共回答了14个问题
KINGLYP 共回答了14个问题 |采纳率92.9%1年前查看全部
- 下图为长式周期表的一部分,其中的编号代表对应的元素.
下图为长式周期表的一部分,其中的编号代表对应的元素. 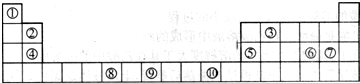
请回答下列问题:
(1)表中属于ds区的元素是______(填编号).
(2)表中元素①的2个原子与元素③的2个原子形成的分子中元素③的杂化类型是______;③和⑦形成的常见化合物的化学键类型是______.
(3)元素⑧的外围电子排布式为______,该元素原子中未成对电子数为______.
(4)在周期表中位于对角线的元素的性质也有一定的相似性.试写出元素②的氢氧化物与NaOH溶液反应的化学方程式:______.
(5)在1183K以下,元素⑨形成如图1所示基本结构单元的晶体;1183K以上,转变为图2所示基本结构单元的晶体.
在1183K以下的晶体中,与元素⑨的原子等距离且最近的原子数为______;
在1183K以上的晶体中,与元素⑨的原子等距离且最近的原子数为______. yujidongxue1年前1
yujidongxue1年前1 -
 yilansmall1981 共回答了23个问题
yilansmall1981 共回答了23个问题 |采纳率91.3%(1)处于ds区的元素为第ⅠB和ⅡB,其中⑩位于第ⅠB,故属于ds区的元素为⑩,故答案为:⑩;
(2)元素①为氢元素,元素③为碳元素,2个氢原子与的2个碳原子形成的分子中为乙烯,元素碳的杂化类型是sp杂化;
元素③为碳元素和元素⑦氯元素形成的常见化合物为四氯化碳,四氯化碳的化学键类型是极性共价键,故答案为:sp;极性共价键;
(3)元素⑧为铬元素,位于第四周期第ⅥB族,价电子为六个,排布在s和d上,d上排五个电子形成半充满结构,比较稳定,故其外围电子排布式为3d 5 4s 1 ,六个电子均为单电子,故单电子数为 6个,故答案为:3d 5 4s 1 ;6;
(4)在周期表中位于对角线的元素的性质有一定的相似性,根据对角线法则,铍元素与铝元素具有一定的相似性,氢氧化铝为两性氢氧化物,故氢氧化铍也为两性氢氧化物,生成相应的偏铍酸盐,化学方程式为2NaOH+Be(OH) 2 ═Na 2 BeO 2 +2H 2 O,故答案为:2NaOH+Be(OH) 2 ═Na 2 BeO 2 +2H 2 O;
(5)在1183K以下,为左图所示,可知体心中有一个原子周围有八个原子,故每个晶胞中有8个原子与中心原子等距离且最近,在晶体中依然为8个,在1183K以上时为右图所示,以最上面中间原子为为例,同一个平面上有4个原子距离相等且距离最小,在竖直方向的四个面上,中间原子与所选定原子等距离且距离最小,在晶体中晶胞重复出现,故对面会有对称的四个竖直面上的点,一共12个,故答案为:8;12.1年前查看全部
- 元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对照中学化学常见长式元素周期表,回答下列问题:
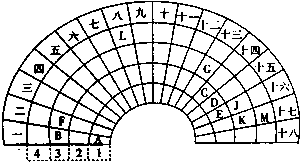 元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对照中学化学常见长式元素周期表,回答下列问题:
元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对照中学化学常见长式元素周期表,回答下列问题:
(1)元素C的最高价氧化物的电子式为______;元素G的离子结构示意图为______.
(2)元素L位于周期表的第______族,1mol/L LM2溶液500ml与0.4mol K单质恰好完全反应的离子方程式为______.
(3)化合物X是由B、E、G三种元素组成,其水溶液呈______性,原因是______(用离子方程式表示).
(4)D和G组成的化合物GD,被大量用于制造电子元件.工业上用G的氧化物、C单质和D单质在高温下制备GD,其中G的氧化物和C单质的物质的量之比为1:3,则该反应的化学方程式为Al2O3+3C+N2
2AlN+3CO高温 .Al2O3+3C+N2.
2AlN+3CO高温 .
(5)制取粗硅的过程中,SiO是反应中间产物,隔绝空气时SiO和NaOH溶液反应(产物之一是硅酸钠)的化学方程式______. bailuobo171年前1
bailuobo171年前1 -
 werther914 共回答了11个问题
werther914 共回答了11个问题 |采纳率90.9%解题思路:根据图片知,阿拉伯数字表示周期数,大写数字表示周期表的列,根据元素在周期表中的位置知,A、B、C、D、E、F、G、J、K、L、M分别是H、Na、C、N、O、Mg、Al、S、Cl、Fe、Br元素,
(1)元素C是C元素,碳元素的最高价氧化物是二氧化碳,二氧化碳分子中碳原子和每个氧原子之间存在共价双键;G是Al元素,铝离子核外有2个电子层,最外层有8个电子;
(2)元素L为Fe元素,位于周期表的第VIII族,溴离子还原性小于亚铁离子,所以氯气先氧化亚铁后氧化溴离子,n(FeBr2)=1mol/L×0.5L=0.5mol,Fe 2+完全被氧化需要n(Cl2)为0.25mol,Br-完全被氧化需要n(Cl2)为0.5mol,所以FeBr2完全被氧化需要n(Cl2)为0.75mol>0.4mol,所以该反应中只有部分溴离子被氧化;
(3)化合物X是由Na、O、Al三种元素组成,则X是NaAlO2,偏铝酸钠是强碱弱酸盐,其溶液呈碱性;
(4)N和Al组成的化合物AlN,G的氧化物是Al2O3,C单质是C,D的单质在N2,高温条件下,碳、氮气和氧化铝反应生成AlN,且Al2O3和C单质的物质的量之比为1:3,据此书写方程式;
(5)隔绝空气时SiO和NaOH溶液反应硅酸钠,根据元素守恒及转移电子守恒知,另一种生成物是氢气.根据图片知,阿拉伯数字表示周期数,大写数字表示周期表的列,根据元素在周期表中的位置知,A、B、C、D、E、F、G、J、K、L、M分别是H、Na、C、N、O、Mg、Al、S、Cl、Fe、Br元素,
(1)素C是C元素,碳元素的最高价氧化物是二氧化碳,二氧化碳的电子式为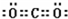 ,G是Al元素,铝离子核外有2个电子层,最外层有8个电子,其离子结构示意图为
,G是Al元素,铝离子核外有2个电子层,最外层有8个电子,其离子结构示意图为 ,故答案为:
,故答案为: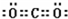 ;
; ;
;
(2)元素L为Fe元素,位于周期表的第VIII族,溴离子还原性小于亚铁离子,所以氯气先氧化亚铁后氧化溴离子,n(FeBr2)=1mol/L×0.5L=0.5mol,Fe 2+完全被氧化需要n(Cl2)为0.25mol,Br-完全被氧化需要n(Cl2)为0.5mol,所以FeBr2完全被氧化需要n(Cl2)为0.75mol>0.4mol,所以只有部分溴离子被氧化,被氧化的n(Br-)=[0.4mol×2−0.5mol×1/1]=0.3mol,所以被氧化的Fe 2+、Br-与参加反应的Cl2物质的量之比为0.5mol:0.3mol:0.4mol=5:3:4,所以其离子方程式为:10Fe2++6Br-+8Cl2=10Fe3++3Br2+16Cl-,
故答案为:VIII;10Fe2++6Br-+8Cl2=10Fe3++3Br2+16Cl-;
(3)化合物X是由Na、O、Al三种元素组成,则X是NaAlO2,偏铝酸钠是强碱弱酸盐,偏铝酸根离子水解而使其溶液呈碱性,水解离子方程式为AlO2-+2H2O⇌Al(OH)3+OH-,
故答案为:碱性;AlO2-+2H2O⇌Al(OH)3+OH-;
(4)N和Al组成的化合物AlN,G的氧化物是Al2O3,C单质是C,D的单质在N2,高温条件下,碳、氮气和氧化铝反应生成AlN,且Al2O3和C单质的物质的量之比为1:3,根据元素守恒知,另一种生成物是一氧化碳,结合原子守恒得反应方程式为Al2O3+3C+N2
高温
.
2AlN+3CO,故答案为:Al2O3+3C+N2
高温
.
2AlN+3CO;
(5)隔绝空气时SiO和NaOH溶液反应硅酸钠,根据元素守恒及转移电子守恒知,另一种生成物是氢气,反应方程式为SiO+2NaOH=Na2SiO3+H2↑,故答案为:SiO+2NaOH=Na2SiO3+H2↑.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查了元素周期表和元素周期律应用,正确连接扇形图所表达的含义是解本题关键,再结合元素化合物知识来分析解答,同时考查学生对基础知识的掌握、知识框架的构成、综合知识的应用能力,难点是(2)离子方程式的书写,要根据离子还原性强弱顺序及转移电子守恒判断生成物,从而正确书写方程式,难度中等.1年前查看全部
- 下表为长式周期表的一部分,其中的编号代表对应的元素.
下表为长式周期表的一部分,其中的编号代表对应的元素.
请回答下列问题:
(1)表中属于d区的元素是______(填编号).
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为______(用对应的元素符号表示).
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是______.
A.分子中含有氢键 B.属于非极性分子
C.含有4个σ键和1个π键D.该氢化物分子中,②原子采用sp2杂化
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为______;该元素与元素①形成的分子X构形为______;X在①与③形成的分子Y中的溶解度很大,其主要原因是______.
(5)A、B均为短周期金属元素.依据下表数据,写出B原子的电子排布式:______.
(6)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般而言,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O6]2+显粉红色.据此判断,[Mn(H2O6]2+______颜色(填“无”或“有”).电离能/kJ•mol-1 I1 I2 I3 I4 A 932 1821 15390 21771 B 738 1451 7733 10540  了一个和1年前1
了一个和1年前1 -
 重庆爷们 共回答了12个问题
重庆爷们 共回答了12个问题 |采纳率83.3%解题思路:(1)d区的元素第ⅢB~ⅦB、Ⅷ族(镧系元素、锕系元素除外),为第3列到10列元素;
(2)由元素指周期表中的位置可知,②为C元素、④为Mg元素、⑨为Ni元素,根据晶胞结构,利用均摊法计算晶胞中各原子数目,据此书写化学式;
(3)②为C元素,碳元素一种氢化物是的产量作为衡量石油化工发展水平的标志,该氢化物为C2H4,C元素电负性不大,分子中不存在氢键,为对称结构,属于非极性分子,分子中含有1个C=C双键、4个C-H键,单键为σ键,双键中1个σ键、1个π键,根据杂化轨道数目确定杂化方式,据此结合选项解答;
(4)某元素的特征电子排布式为nsnnpn+1,则n=2,故该元素的特征电子排布式为2s22p3,为N原子,元素①为H元素,与X形成的物质为NH3,为三角锥型,①与③形成的分子为H2O,NH3与H2O都是极性分子,且分子之间能形成氢键;
(5)由表中数据可知,A、B元素的第三电离能都剧增,故表现+2价,为第ⅡA族元素,B的第一电离能比A的小,故B为Mg元素,根据原子核外电子排布规律书写;
(6)根据核外电子排布规律,书写Mn2+的核外电子排布式,据此结合题目信息判断.(1)d区的元素第ⅢB~ⅦB、Ⅷ族(镧系元素、锕系元素除外),为第3列到10列元素,由元素在周期表中的位置可知,⑨处于第10列,为第Ⅷ族,属于d区元素,故答案为:⑨;
(2)由元素指周期表中的位置可知,②为C元素、④为Mg元素、⑨为Ni元素,根据晶胞结构可知,晶胞中C原子数目为1,Mg原子数目为8×[1/8]=1,Ni原子数目为6×[1/2]=3,该物质化学式为:MgCNi3,故答案为:MgCNi3;
各原子数目,据此书写化学式;
(3)②为C元素,碳元素一种氢化物是的产量作为衡量石油化工发展水平的标志,该氢化物为C2H4,
A.C元素电负性不大,分子中不存在氢键,故A错误
B.乙烯为对称结构,属于非极性分子,故B正确;
C.分子中含有1个C=C双键、4个C-H键,单键为σ键,双键中1个σ键、1个π键,含有5个σ键和1个π键,故C错误;
D.C原子呈1个C=C双键、2个C-H键,杂化轨道数为3,原子采用sp2杂化,故D正确;
故答案为:BD;
(4)某元素的特征电子排布式为nsnnpn+1,则n=2,故该元素的特征电子排布式为2s22p3,该原子外层电子的孤对电子数
为1,为N元素,元素①为H元素,与X形成的物质为NH3,为三角锥型,①与③形成的分子为H2O,NH3与H2O都是极性分子,且分子之间能形成氢键,故NH3在H2O中的溶解度很大,
故答案为:1,三角锥型,NH3与H2O都是极性分子,根据相似相溶原理,极性分子易溶于极性溶剂中,且分子之间能形成氢键;
(5)由表中数据可知,A、B元素的第三电离能都剧增,故表现+2价,为第ⅡA族元素,B的第一电离能比A的小,故B为Mg元素,原子的电子排布式为1s22s22p63s2,
故答案为:1s22s22p63s2;
(6)Mn2+的核外电子排布式为1s22s22p63s23p63d8,d能级为排满电子,故,[Mn(H2O6)]2+ 有颜色,故答案为:有.点评:
本题考点: 元素周期律和元素周期表的综合应用;原子核外电子排布;共价键的形成及共价键的主要类型;配合物的成键情况;晶胞的计算.
考点点评: 本题考查元素周期表的结构、晶胞计算、分子结构与性质、电离能等,难度中等,注意(5)中电离能与化合价的关系.1年前查看全部
- (2012•延边州模拟)如图1为长式周期表的一部分,其中的编号代表对应元素.
(2012•延边州模拟)如图1为长式周期表的一部分,其中的编号代表对应元素.
请回答下列问题:
(1)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是______.
A.分子中含有氢键
B.属于含有极性键的非极性分子
C.只含有4个σ键和1个π键
D.该氢化物分子中元素②原子采用sp2杂化
(2)科学发现,②、⑤、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构如图2所示(图中②、⑤、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为______(用对应的元素符号表示).
(3)a:比较②、③、④三种元素第一电离能大小,由小到大排列的顺序为______(用元素符号表示).
b:比较④、⑥、⑦、⑧四种元素的电负性大小,由大到小排列的顺序为______(用元素符号表示).
(4)某元素的价电子排布式为nsnnpn+1,该元素与元素①形成的18电子的X分子的结构式为______;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有含⑩元素的硫酸盐溶液中,反应过程中的实验现象为:______;反应过程中的离子方程式为______.
(5)⑩元素单质晶体是面心立方体,立方体的每个面5个⑩原子紧密堆砌,⑩原子半径为d cm,该金属的密度为
a2 8d3 g•cm-3.(该金属原子的质量为a g)
a2 8d3  chandou19791年前1
chandou19791年前1 -
 天空中的云 共回答了29个问题
天空中的云 共回答了29个问题 |采纳率96.6%解题思路:由元素所在周期表中的位置可知①为H,②为C,③为N,④为O,⑤为Mg,⑥为Al,⑦为S,⑧为Cl,⑨为Ni,⑩为Cu,
(1)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志,为乙烯;
(2)利用均摊法计算;
(3)a.同周期从左到右,元素的第一电离能逐渐增大,注意N原子最外层为半充满的特征;
b.根据同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小判断;
(4)某元素的价电子排布式为nsnnpn+1,应为2s22p3,应为N元素,与元素①形成的18电子的X分子为N2H4,与元素①形成10电子的气体分子Y为NH3,氨气通入铜盐溶液中,先生成蓝色沉淀,继续反应生成配合物;
(5)利用均摊法计算晶胞中含有的Cu原子个数,质量质量,结合ρ=[m/V]计算.由元素所在周期表中的位置可知①为H,②为C,③为N,④为O,⑤为Mg,⑥为Al,⑦为S,⑧为Cl,⑨为Ni,⑩为Cu,
(1)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志,为乙烯,结构式为 ,可知分子中含有C=C非极性键和C-H极性键,为平面形分子,含有5个σ键和1个π键,每个C形成3个σ键,为sp2杂化,
,可知分子中含有C=C非极性键和C-H极性键,为平面形分子,含有5个σ键和1个π键,每个C形成3个σ键,为sp2杂化,
故答案为:BD;
(2)晶胞中,含有Mg个数为8×[1/8]=1,Ni个数为6×[1/2]=3,N原子个数为1,则化学式为MgNi3C,
故答案为:MgNi3C;
(3)a:同周期从左到右,元素的第一电离能逐渐增大,N原子最外层为半充满结构,第一电离能大于相邻原子的第一电离能,则顺序为C<O<N,
故答案为:C<O<N;
b:同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小,电负性顺序为O>Cl>S>Al,故答案为:O>Cl>S>Al;
(4)某元素的价电子排布式为nsnnpn+1,应为2s22p3,应为N元素,与元素①形成的18电子的X分子为N2H4,结构式为 ,与元素①形成10电子的气体分子Y为NH3,氨气通入铜盐溶液中,先生成蓝色沉淀,继续反应生成配合物,反应的离子方程式为Cu2++2 NH3•H2O=Cu(OH)2↓+2 NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,
,与元素①形成10电子的气体分子Y为NH3,氨气通入铜盐溶液中,先生成蓝色沉淀,继续反应生成配合物,反应的离子方程式为Cu2++2 NH3•H2O=Cu(OH)2↓+2 NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,
故答案为: ;先生成蓝色沉淀,后沉淀溶解,溶液呈深蓝色;Cu2++2 NH3•H2O=Cu(OH)2↓+2 NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
;先生成蓝色沉淀,后沉淀溶解,溶液呈深蓝色;Cu2++2 NH3•H2O=Cu(OH)2↓+2 NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
(5)铜晶胞是面心立方,所以每个金晶胞中含有的原子个数=8×[1/8]+6×[1/2]=4,
每个铜晶胞中含有4个原子,原子半径为d cm,则晶胞的体积为(2
2d)3cm3,晶胞的质量为4a,
则ρ=
4a
(2
2d)3=
2a
8d3(g•cm-3),
故答案为:
2a点评:
本题考点: 位置结构性质的相互关系应用;元素电离能、电负性的含义及应用;化学键;晶胞的计算;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查位置、结构性质的相互关系以及应用,侧重于学生的分析能力和计算能力的考查,为高考常见题型,注意把握晶胞的计算,为该题的难点,也是易错点,难度中等.1年前查看全部
- (2009•大连一模)[化学选修物质结构与性质]图1中几种“俄罗斯方块”均裁剪于长式元素周期表.特同答下列问题:
(2009•大连一模)[化学选修物质结构与性质]图1中几种“俄罗斯方块”均裁剪于长式元素周期表.特同答下列问题:
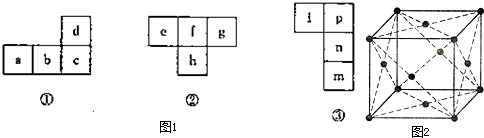
(1)a、d都是日常生活中的常见金属,常温下d在浓硝酸中发生钝化,则:元素c在周期表中的位置为第______周期______族; a的单质晶胞结构如图2.构成晶体的微粒之间的作用为______.每个晶胞中含有的原 子数为______个,晶体巾距离每个a原子最近且等距离的a原子有______个.
(2)短周期元素h的最外层电子数是其核外电子总数的[1/3],则e、f、g的简单氢化物的沸点由高到低的次序为:______>______>______(用化学式表达),根据杂化轨道理论和价层电子对互斥理论,h的三氯化物中h原子的杂化类型为______,分子的空间形状为:______.
(3)n的双原子分子常温下为液态.则图23一③中的四种元素均属于周期表的______区元素,m、n、p元素的电负性依次______(填“增强”或“减弱”). 再别情缘1年前1
再别情缘1年前1 -
 yuanyuan333 共回答了14个问题
yuanyuan333 共回答了14个问题 |采纳率92.9%解题思路:(1)a、d都是日常生活中的常见金属,有Fe、Al、Cu,常温下d在浓硝酸中发生钝化,有Al、Fe,由元素位置关系可知,d为Al,则a为Cu、b为Zn、c为Ga.Cu晶体为金属晶体,利用均摊法计算晶胞中Cu原子数目,以顶点Cu为研究对象,与之最近的Cu处于面心上,补全晶胞结构可知,每个顶点Cu原子为12个面共用;
(2)短周期元素h的最外层电子数是其核外电子总数的[1/3],则h为P元素,由元素位置关系可知,e为C元素、f为N元素、g为O元素,根据常温下状态及氢键判断氢化物沸点高低;
h的三氯化物为PCl3,计算P原子的价层电子对数、孤对电子确定杂化方式与分子空间构型;
(3)n的双原子分子常温下为液态,则n为Br,由元素位置关系可知,l为S、p为Cl、m为I,四元素核外电子排布最后都填充p能级,均属于周期表的p区元素,同主族元素自上而下电负性减弱.(1)a、d都是日常生活中的常见金属,有Fe、Al、Cu,常温下d在浓硝酸中发生钝化,有Al、Fe,由元素位置关系可知,d为Al,则a为Cu、b为Zn、c为Ga,则:
Ga与Al同主族,处于Al的下一周期,则Ga处于第四周期ⅢA族,Cu晶体为金属晶体,构成晶体的微粒之间的作用为金属键,由Cu晶胞结构可知为面心立方,晶胞中Cu数目为8×[1/8]+6×[1/2]=4,以顶点Cu为研究对象,与之最近的Cu处于面心上,补全晶胞结构可知,每个顶点Cu原子为12个面共用,故距离每个Cu原子最近且等距离的Cu原子有12个,
故答案为:四、ⅢA;金属键;4;12;
(2)短周期元素h的最外层电子数是其核外电子总数的[1/3],则h为P元素,由元素位置关系可知,e为C元素、f为N元素、g为O元素,则:
e、f、g的简单氢化物分别为 CH4、NH3、H2O,常温下水为液体,沸点最高,氨气分子之间存在氢键,沸点比较甲烷高,故沸点H2O>NH3>CH4,
h的三氯化物为PCl3,P原子的价层电子对数=3+[5−1×3/2]=4,杂化轨道数为4,P原子产生sp3杂化,P原子有1对孤对电子,PCl3分子的空间形状为三角锥型,
故答案为:H2O、NH3、CH4;sp3;三角锥型;
(3)n的双原子分子常温下为液态,则n为Br,由元素位置关系可知,l为S、p为Cl、m为I,则:
四元素核外电子排布最后都填充p能级,均属于周期表的p区元素,同主族元素自上而下电负性减弱,故m、n、p元素的电负性依次减弱,
故答案为:p;减弱.点评:
本题考点: 位置结构性质的相互关系应用;晶胞的计算.
考点点评: 本题是物质结构与性质综合题目,涉及元素推断、元素周期表结构、晶胞结构及计算、杂化理论与价层电子对互斥理论、元素周期律等,需要学生具备扎实的基础、较好空间想象力,注意整体把握元素周期表的结构.1年前查看全部
- 下表为长式周期表的一部分,其中的编号代表对应的元素.
下表为长式周期表的一部分,其中的编号代表对应的元素.
请回答下列问题:
(1)表中属于S区的元素是______(填编号).
(2)写由上述元素组成的分子中电子总数为10,其VSEPR模型与分子立体构型不一致的分子的分子式:______.
(3)元素①与②组成的化合物中,有一种含6原子分子是重要的化工原料,常把该物质作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是______.
A.属于含有极性键的极性分子
B.含有4个sp-s的σ键和1个p-p的π键
C.该分子中②原子采用sp2杂化
(4)某元素的价电子排布式为nsnnpn+1,该元素与元素①形成的18电子的分子的电子式为______;
(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据.
请回答:表中的非金属元素是______(填字母);若E、F为原子序数依次增大的同周期相邻元素,表中显示E比F的第一电离能略大,其原因是______.电子能I(Ev) A B C D E F I1 11.3 14.5 13.6 5.2 7.6 6.0 I2 24.4 29.6 35.1 49.3 15.0 18.8 I3 47.9 47.4 54.9 71.6 80.1 28.4 I4 64.5 77.5 77.4 98.9 109.2 112.0 I5 392.1 97.9 113.9 138.3 141.3 153.7  hellekitty1年前1
hellekitty1年前1 -
 Lotus_nut 共回答了22个问题
Lotus_nut 共回答了22个问题 |采纳率90.9%解题思路:由元素在周期表中的位置可知,①为H、②为C、③为O、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ca、⑨为Ni、⑩为Cu,
(1)s区包含ⅠA、ⅡA族;
(2)由上述元素组成电子总数为10的分子有甲烷、氨气、水、HF,根据价层电子对数判断;
(3)素①与②组成的化合物中,有一种含6原子分子是重要的化工原料,该化合物为乙烯;
(4)元素的价电子排布式为nsnnpn+1,则n=2,该元素为N元素,与元素①形成的18电子的分子为N2H4;
(5)非金属元素第一个电子不易失去,非金属元素的第一电离能比较大;
D、E、F的等于电离能减小为金属元素,故分别为Na、Mg、Al,Mg的3s轨道上的电子全充满,能量比Al低,自身更稳定,所以第一电离能比Al大.(1)由元素在周期表中的位置可知,①为H、②为C、③为O、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ca、⑨为Ni、⑩为Cu,
(1)s区包含ⅠA、ⅡA族,故①④⑧处于s区,故答案为:①④⑧;
(2)由上述元素组成电子总数为10的分子有甲烷、氨气、水、HF,
甲烷分子中碳原子价层电子数为4,不含孤对电子对,VSEPR模型与分子立体构型都是正四面体;
氨气分子中N原子价层电子数为4,含1对孤对电子对,VSEPR模型为正四面体,分子立体构型为三角锥型;
水分子中O原子价层电子数为4,含2对孤对电子对,VSEPR模型为正四面体,分子立体构型为V型;
HF分子VSEPR模型与分子立体构型都是直线型;
故答案为:NH3、H2O;
(3)素①与②组成的化合物中,有一种含6原子分子是重要的化工原料,该化合物为乙烯,
A.乙烯为平面对称结构,正负电荷的重心重合,为非极性分子,故A错误;
B.乙烯分子中C原子价层电子数为3,产生sp2杂化,含有4个sp-s的σ键、1个sp-sp的σ键和1个p-p的π键,故B错误;
C.乙烯分子中C原子价层电子数为3,故C正确;
故选:C;
(4)元素的价电子排布式为nsnnpn+1,则n=2,该元素为N元素,与元素①形成的18电子的分子为N2H4,电子式为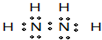 ,
,
故答案为: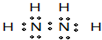 ;
;
(5)非金属元素第一个电子不易失去,非金属元素的第一电离能比较大,通过表格可以看出ABC的第一电离能比较大,为非金属元素;
D、E、F的第一电离能较小为金属元素,故分别为Na、Mg、Al,Mg的3s轨道上的电子全充满,能量比Al低,自身更稳定,所以第一电离能比Al大,
故答案为:ABC;Mg的3s轨道上的电子全充满,能量比Al低,自身更稳定,所以第一电离能比Al大.点评:
本题考点: 元素周期律和元素周期表的综合应用;原子核外电子的能级分布;元素电离能、电负性的含义及应用.
考点点评: 本题考查了元素周期表、元素周期律的综合运用,是物质结构的综合性题目,难度中等,注意掌握元素周期律.1年前查看全部
- 如图为长式周期表的一部分,其中的编号代表对应的元素.
如图为长式周期表的一部分,其中的编号代表对应的元素.
根据上述表格中的十种元素填空:
(1)表中属于ds区的元素是______(填编号).
(2)元素②与③形成的一种化合物是重要的化工原料,该化合物可用于人工降雨.有关该化合物分子的说法正确的是______.
A.分子中含极性共价键B.含有1个σ键和2个π键
C.属于非极性分子D.该化合物分子中,②原子采用sp2杂化
(3)金属性最强的主族元素是______ (填元素名称).
(4)⑤、⑥、⑦的离子半径由小到大的顺序是______(填化学式).
(5)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的未成对电子数为______个; 该元素与元素①形成的分子X的空间构型为______. 苏幕遮pingzi1年前1
苏幕遮pingzi1年前1 -
 640211 共回答了15个问题
640211 共回答了15个问题 |采纳率93.3%解题思路:由元素在周期表中的位置可知,①为H,②为C,③为O,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ca,⑨为Ni,⑩为Cu,
(1)以上元素只有Cu为ds区元素;
(2)②与③形成的一种化合物是重要的化工原料,该化合物可用于人工降雨,该化合物为CO2,为含极性键的非极性分子,C原子为sp杂化,双键中含1个σ键和1个π键;
(3)以上元素中,金属性最强的为Ca;
(4)离子的电子层越多,半径越大,具有相同电子层结构的离子,原子序数大的离子半径小;
(5)元素的特征电子排布式为nsnnpn+1,s最多有2个电子,所以n=2,即电子排布式为1s22s22p3,该元素为N元素,核外最外层电子的孤对电子数为1,单电子为3,与元素①形成的分子X为NH3,为三角锥型.由元素在周期表中的位置可知,①为H,②为C,③为O,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ca,⑨为Ni,⑩为Cu,
(1)元素周期表中位于ds区的元素为第ⅠB、ⅡB族,以上元素只有Cu为ds区元素,故答案为:⑩;
(2)②与③形成的一种化合物是重要的化工原料,该化合物可用于人工降雨,该化合物为CO2,
A.分子中含C、O之间的极性共价键,故A正确;
B.结构式为O=C=O,含有2个σ键和2个π键,故B错误;
C.结构对称,正负电荷中心重合,为含极性键的非极性分子,故C正确;
D.该化合物分子为直线型,②原子采用sp杂化,故D错误;
故答案为:AC;
(3)以上元素中,金属性最强的为Ca,名称为钙,故答案为:钙;
(4)离子的电子层越多,半径越大,具有相同电子层结构的离子,原子序数大的离子半径小,所以离子半径由小到大的顺序为Al3+<Cl-<S2-,
故答案为:Al3+<Cl-<S2-;
(5)元素的特征电子排布式为nsnnpn+1,s最多有2个电子,所以n=2,即电子排布式为1s22s22p3,该元素为N元素,最外层为第2层,2s电子为孤对电子,孤对电子数为1,2p电子均为单电子,则单电子为3,与元素①形成的分子X为NH3,N原子为sp3杂化,空间构型为三角锥型,故答案为:3;三角锥型.点评:
本题考点: 位置结构性质的相互关系应用;元素周期律和元素周期表的综合应用.
考点点评: 本题考查位置、结构、性质的应用,为高频考点,涉及元素周期表中元素的分区、元素周期表中元素的位置、杂化类型、键的极性与分子极性、分子构型、非金属性比较等,综合性较强,题目难度中等.1年前查看全部
- 下表为长式周期表的一部分,其中的序号代表对应的元素.
下表为长式周期表的一部分,其中的序号代表对应的元素.
(1)写出⑨原子的外围电子排布式:______.
(2)①与③形成的气态化合物是一种水果催熟剂,该化合物中③的杂化方式为:______杂化;⑦与⑧形成化合物的晶体类型是______.
(3)④的第一电离能______(填“>”、“=”或“<”)⑤的第一电离能;①与④形成X,其分子空间构型为______.
(4)实验测定①与⑥形成化合物的相对分子质量时,实验测得值一般高于理论值,试从物质结构角度解释原因:______.
(5)将X通入含有⑩的蓝色硫酸盐溶液中,首先形成难溶物,继续通入X,难溶物溶解得到深蓝色的透明溶液.试写出该过程的有关离子方程式:______、______. ii旋涡1年前1
ii旋涡1年前1 -
 樱木伊雪 共回答了10个问题
樱木伊雪 共回答了10个问题 |采纳率100%解题思路:由元素在周期表中的位置可知,①为H、②为Be、③为C、④为N、⑤为O、⑥为F、⑦为Mg、⑧为Cl、⑨为Cr、⑩为Cu,
(1)为Cr元素,原子核外电子数为24,结合洪特规则特例书写;
(2))①与③形成的气态化合物是一种水果催熟剂,该化合物为C2H4,分子中C原子成3个σ键,不含孤对电子,杂化轨道数为3,据此确定C原子的杂化方式;
⑦与⑧形成化合物氯化镁,为活泼金属与活泼非金属元素形成的化合物,属于离子化合物;
(3)N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于氧元素;①与④形成X为NH3,分子空间构型为三角锥形;
(4)HF分子之间形成氢键,缔合形成(HF)n;
(5)铜离子与氨水反应生成氢氧化铜蓝色沉淀,氨水过量,与氢氧化铜反应生成[Cu(NH3)4]2+,得到深蓝色的透明溶液.由元素在周期表中的位置可知,①为H、②为Be、③为C、④为N、⑤为O、⑥为F、⑦为Mg、⑧为Cl、⑨为Cr、⑩为Cu,
(1)为Cr元素,原子核外电子数为24,由洪特规则特例可知,其外围电子排布式为:3d54s1,
故答案为:3d54s1;
(2))①与③形成的气态化合物是一种水果催熟剂,该化合物为C2H4,分子中C原子成3个σ键,不含孤对电子,杂化轨道数为3,故C原子的杂化方式为sp2,⑦与⑧形成化合物氯化镁,为活泼金属与活泼非金属元素形成的化合物,属于离子化合物,
故答案为:sp2;离子化合物;
(3)N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于氧元素;①与④形成X为NH3,分子空间构型为三角锥形
故答案为:>;三角锥形;
(4)HF分子之间形成氢键,缔合形成(HF)n,故测定HF的相对分子质量偏大,
故答案为:HF分子之间形成氢键,缔合形成(HF)n;
(5)铜离子与氨水反应生成氢氧化铜蓝色沉淀,氨水过量,与氢氧化铜反应生成[Cu(NH3)4]2+,得到深蓝色的透明溶液,涉及的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3 =[Cu(NH3)4]2++2OH-,
故答案为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3 =[Cu(NH3)4]2++2OH-.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查结构性质位置关系的综合应用,涉及核外电子排布、电离能、杂化轨道、分子结构、氢键、配合物等,(1)为易错点,学生容易忽略洪特规则特例,注意氢键对物质性质的影响.1年前查看全部
- 下列关于教材附录长式元素周期表的结构的说法中正确的是( )
下列关于教材附录长式元素周期表的结构的说法中正确的是( )
A.元素周期表有七个横行,也就是七个周期
B.元素周期表有18个纵行,也就是18个族
C.元素周期表中含有元素最多的周期是第六周期,共有32种元素
D.元素周期表中含有元素最多的族是第IA族,共有元素7种 chenjuan0081年前1
chenjuan0081年前1 -
 baixue93 共回答了20个问题
baixue93 共回答了20个问题 |采纳率95%解题思路:元素周期表有七个横行,分属七个周期,18个纵行,其中包括七个主族、七个副族、一个0族和VIII族共16个族,目前元素种类最多的周期为第六周期,含有32种元素,第七周期没有排满,元素周期表中含有元素最多的族为第ⅢB族,含有镧系和锕系,共32种元素.A、元素周期表有七个横行,为七个周期,故A正确.
B、元素周期表有18个纵行,其中包括七个主族、七个副族、一个0族和VIII族共16个族,故B不正确.
C、元素周期表中含有元素最多的周期是第六周期,共有32种元素,故C正确.
D、元素周期表中含有元素最多的族为第ⅢB族,含有镧系和锕系,共32种元素,故D不正确.
故选AC.点评:
本题考点: 元素周期表的结构及其应用.
考点点评: 本题考查长式元素周期表的结构,要求学生对元素周期表的组成特点要熟悉,周期表中周期与周期之间,族与族之间含有较多规律,在学习中要善于抓住这些规律会起到事半功倍的效果.1年前查看全部
- 下图为长式周期表的一部分,其中的编号代表对应的元素.
下图为长式周期表的一部分,其中的编号代表对应的元素.
请回答下列问题:
(1)表中属于ds区的元素是______(填编号).
(2)表中元素①的2个原子与元素③的2个原子形成的分子中元素③的杂化类型是______;③和⑦形成的常见化合物的化学键类型是______.
(3)元素⑧的外围电子排布式为______,该元素原子中未成对电子数为______.
(4)在周期表中位于对角线的元素的性质也有一定的相似性.试写出元素②的氢氧化物与NaOH溶液反应的化学方程式:______.
(5)在1183K以下,元素⑨形成如图1所示基本结构单元的晶体;1183K以上,转变为图2所示基本结构单元的晶体.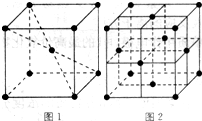
在1183K以下的晶体中,与元素⑨的原子等距离且最近的原子数为______;
在1183K以上的晶体中,与元素⑨的原子等距离且最近的原子数为______. 心情感1年前1
心情感1年前1 -
 卷发丫丫 共回答了20个问题
卷发丫丫 共回答了20个问题 |采纳率85%解题思路:(1)元素周期表中位于ds区的元素为第ⅠB、ⅡB族,故符合的为⑩元素铜;
(2)元素①为氢元素,元素③为碳元素,元素⑦氯元素,根据题意可知,2个氢原子与的2个碳原子形成的分子中为乙烯,杂化类型是sp杂化,碳元素和氯元素形成化合物为四氯化碳,化学键类型是极性共价键;
(3)⑧为铬元素,价电子排布为3d54s1,六个电子均为单电子,故单电子数为 6个;
(4)根据对角线法则,铍元素与铝元素性质相似,氢氧化铍也为两性氢氧化物,可以与氢氧化钠反应生成相应的偏铍酸盐,化学方程式为2NaOH+Be(OH)2═Na2BeO2+2H2O;
(5)计算晶胞中原子个数,晶体中晶胞重复出现,推算到晶体中的原子个数.(1)处于ds区的元素为第ⅠB和ⅡB,其中⑩位于第ⅠB,故属于ds区的元素为⑩,故答案为:⑩;
(2)元素①为氢元素,元素③为碳元素,2个氢原子与的2个碳原子形成的分子中为乙烯,元素碳的杂化类型是sp杂化;
元素③为碳元素和元素⑦氯元素形成的常见化合物为四氯化碳,四氯化碳的化学键类型是极性共价键,故答案为:sp;极性共价键;
(3)元素⑧为铬元素,位于第四周期第ⅥB族,价电子为六个,排布在s和d上,d上排五个电子形成半充满结构,比较稳定,故其外围电子排布式为3d54s1,六个电子均为单电子,故单电子数为 6个,故答案为:3d54s1;6;
(4)在周期表中位于对角线的元素的性质有一定的相似性,根据对角线法则,铍元素与铝元素具有一定的相似性,氢氧化铝为两性氢氧化物,故氢氧化铍也为两性氢氧化物,生成相应的偏铍酸盐,化学方程式为2NaOH+Be(OH)2═Na2BeO2+2H2O,故答案为:2NaOH+Be(OH)2═Na2BeO2+2H2O;
(5)在1183K以下,为左图所示,可知体心中有一个原子周围有八个原子,故每个晶胞中有8个原子与中心原子等距离且最近,在晶体中依然为8个,在1183K以上时为右图所示,以最上面中间原子为为例,同一个平面上有4个原子距离相等且距离最小,在竖直方向的四个面上,中间原子与所选定原子等距离且距离最小,在晶体中晶胞重复出现,故对面会有对称的四个竖直面上的点,一共12个,故答案为:8;12.点评:
本题考点: 元素周期律和元素周期表的综合应用;化学键;晶胞的计算;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查了元素周期表中元素的分区;元素周期表中元素的位置;根据价电子数判断单电子个数;元素周期表中的对角线法则;晶胞及晶体中原子个数的计算.1年前查看全部
- 下表为长式周期表的一部分,其中的编号代表对应的元素.
下表为长式周期表的一部分,其中的编号代表对应的元素.
试填空.① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩
(1)写出上表中元素⑩原子的外围电子排布式______.
(2)元素③与⑥形成的化合物中元素③的杂化方式为:______杂化,其形成的化合物的晶体类型是:______.
(3)元素④、⑤、⑥的第一电离能大小顺序是:______(用元素符号表示);请写出与N3-互为等电子体的分子、离子的化学式______,______(各写一种).
(4)元素④、⑤、⑥与①形成的最简单化合物中沸点最高的为:______(填化学式),理由为:______.
(5)某些不同族元素的性质也有一定的相似性,如上表中元素⑨与元素②的氢氧化物有相似的性质,写出元素②的氢氧化物与NaOH溶液反应生成盐的化学式______.
(6)⑦、⑧两种元素分别与⑥在一定条件下形成的晶体中熔点较高的为:______(填化学式),其理由为:______.
实验化学. black20501年前1
black20501年前1 -
 谁占了我的灵感熙 共回答了15个问题
谁占了我的灵感熙 共回答了15个问题 |采纳率93.3%解题思路:由元素在周期表中的位置可知,①为H,②为Be,③为C,④为N,⑤为O,⑥为F,⑦为Na,⑧为Mg,⑨为Al,⑩为Cr,
(1)根据电子排布规律及半充满为稳定状态来分析;
(2)根据成键判断杂化类型,根据构成微粒来分析晶体类型;
(3)非金属性越强,第一电离能越大,根据原子的质子数、原子个数来分析等电子体;
(4)根据氢键来分析氢化物的沸点;
(5)根据性质的相似性可知,氢氧化铝与氢氧化钠反应,则氢氧化铍能与氢氧化钠反应;
(6)根据离子的电荷、半径来分析离子晶体的晶格能和沸点.由元素在周期表中的位置可知,①为H,②为Be,③为C,④为N,⑤为O,⑥为F,⑦为Na,⑧为Mg,⑨为Al,⑩为Cr,
(1)Cr的原子序数为24,3d电子半满时为稳定状态,则外围电子排布式为3d54s1,故答案为:3d54s1;
(2)在CF4中,C原子上没有孤对电子,成键数为4,则C原子为sp3杂化,其构成微粒为分子,则属于分子晶体,故答案为:sp3;分子晶体;
(3)非金属性F的最强,第一电离能最大,但N原子为2p3的半满状态,则第一电离能N>O,第一电离能为F>N>O;N3-的原子数为3,电子数为7×3+1=22,CO2、CS2、N2O、BeCl2、CNO-、SCN-的原子数为3,电子数都是22,则N3-与互为等电子体,故答案为:F>N>O;CO2(或CS2、N2O、BeCl2);CNO-(或SCN-);
(4)氨气、水、氟化氢中均存在氢键,但水中的氢键数最多,则沸点最高,故答案为:H2O;因为水分子之间形成的氢键数多;
(5)因Al与Be的性质相似,则Be(OH)2+2NaOH═Na2BeO2+2H2O,故答案为:Na2BeO2;
(6)因镁离子带的电荷大于钠离子带的电荷,且镁离子的半径小,则MgF2晶体的晶格能大于NaF晶体的晶格能,MgF2的熔点较高,
故答案为:MgF2;因为MgF2 晶体的晶格能大于NaF晶体的晶格能.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查元素周期表和元素周期律,难度较大,熟悉物质的结构和性质是解答本题的关键.1年前查看全部
- 下列有关现在的长式元素周期表的判断中正确的是( ) A.从左向右数第七纵行是ⅦA族 B.从左向右数第十一纵行是ⅠB族
下列有关现在的长式元素周期表的判断中正确的是( ) A.从左向右数第七纵行是ⅦA族 B.从左向右数第十一纵行是ⅠB族 C.ⅠA族全部是金属元素 D.ⅦA族的全部元素只能表现非金属的性质  lvvvv121年前1
lvvvv121年前1 -
 最熟悉的陌生人9 共回答了20个问题
最熟悉的陌生人9 共回答了20个问题 |采纳率80%A.从左向右数第七纵行是ⅦB族,故A错误;
B.从左向右数第十一纵行是ⅠB族,故B正确;
C.ⅠA族为碱金属元素和H元素,故C错误;
D.ⅦA族从上到下非金属性在减弱,金属性在增强,则原子序数较大的表现出一定的金属性,故D错误;
故选B.1年前查看全部
- 下列说法中正确的是______.A.长式元素周期表中现有7个横行,7个周期,18个纵行,18个族
下列说法中正确的是______.A.长式元素周期表中现有7个横行,7个周期,18个纵行,18个族
下列说法中正确的是______.
A.长式元素周期表中现有7个横行,7个周期,18个纵行,18个族
B.同周期的第ⅡA族和第ⅢA族元素的原子序数一定相差1
C.除短周期外,其他周期均有18种元素
D.最外层电子数相同的元素不一定在同一主族
E.元素所在的周期数一定等于其原子的电子层数
F.每个周期都是从碱金属开始到稀有气体结束
请说明一下. 喜欢美丽cc1年前1
喜欢美丽cc1年前1 -
 南海人语 共回答了20个问题
南海人语 共回答了20个问题 |采纳率90%A错,注意第八族有三列
B错,第四周期就不对了(过渡元素,钪-->锌)
C错,镧系和锕系笑而不语
D对,He和IIA
E对,周期就是这么划分的
F错,第八周期还没构建结束1年前查看全部
- 下表为长式周期表的一部分,其中的编号代表对应的元素.
下表为长式周期表的一部分,其中的编号代表对应的元素.
试填空.
(1)写出上表中元素⑨原子的外围电子排布式______.
(2)元素③与⑧形成的化合物中元素③的杂化方式为:______杂化,其形成的化合物的晶体类型是:______.
(3)元素④、⑤的第一电离能大小顺序是:______>______(用元素符号表示);元素④与元素①形成的X分子的空间构型为:______.请写出与N3-互为等电子体的分子、离子的化学式______,______(各写一种).
(4)在测定①与⑥形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是:______.
(5)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质,写出元素②的氢氧化物与NaOH溶液反应后盐的化学式______.
(6)元素⑩在一定条件下形成的晶体的基本结构单元如下图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为______.
 未知的游鱼1年前1
未知的游鱼1年前1 -
 若风 共回答了17个问题
若风 共回答了17个问题 |采纳率88.2%解题思路:由元素在周期表中的位置可知,①为H,②为Be,③为C,④为N,⑤为O,⑥为F,⑦为Al,⑧为Cl,⑨为Cr,⑩为Co,
(1)Cr的原子序数为24,注意外围电子的半满为稳定状态;
(2)元素③与⑧形成的化合物为CCl4,存在4个共价单键,没有孤对电子,构成微粒为分子;
(3)④为N,⑤为O,N原子的2p电子半满为稳定结构,则第一电离能大;X分子为NH3,与N3-互为等电子体的分子、离子,应具有3个原子和16个价电子;
(4)HF分子之间含有氢键;
(5)Al与Be位于对角线位置,性质相似;
(6)由图1可知,与体心原子距离最近的原子位于顶点,则有8个;由图2可知,与顶点原子距离最近的原子位于面心,1个晶胞中有3个,则晶体中有[3×8/2]=12个.由元素在周期表中的位置可知,①为H,②为Be,③为C,④为N,⑤为O,⑥为F,⑦为Al,⑧为Cl,⑨为Cr,⑩为Co,
(1)Cr的原子序数为24,注意外围电子的半满为稳定状态,则外围电子排布为3d54s1,故答案为:3d54s1;
(2)元素③与⑧形成的化合物为CCl4,存在4个共价单键,没有孤对电子,则C原子为sp3杂化,构成微粒为分子,属于分子晶体,故答案为:sp3;分子晶体;
(3)④为N,⑤为O,N原子的2p电子半满为稳定结构,则第一电离能大,即N>O;X分子为NH3,空间构型为三角锥形;与N3-互为等电子体的分子、离子,应具有3个原子和16个价电子,则有CO2(或CS2、N2O、BeCl2)、CNO-等微粒,故答案为:N;O;三角锥形;CO2;CNO-;
(4)因HF分子之间含有氢键,能形成缔合分子(HF)n,则测定的相对分子质量较大,故答案为:HF分子之间有氢键,能形成缔合分子(HF)n;
(5)Al与Be位于对角线位置,性质相似,则Be与NaOH溶液反应生成Na2BeO2,故答案为:Na2BeO2;
(6)由图1可知,与体心原子距离最近的原子位于顶点,则有8个;由图2可知,与顶点原子距离最近的原子位于面心,1个晶胞中有3个,空间有8个晶胞无隙并置,且1个面被2个晶胞共用,则晶体中有[3×8/2]=12个,所以在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为8:12=2:3,故答案为:2:3.点评:
本题考点: 晶胞的计算;元素周期律和元素周期表的综合应用;原子核外电子排布;元素电离能、电负性的含义及应用;判断简单分子或离子的构型;“等电子原理”的应用;原子轨道杂化方式及杂化类型判断.
考点点评: 本题为综合题,涉及知识点较多,注重元素周期表和原子结构的知识相结合来考查学生,熟悉元素在周期表的位置、杂化、第一电离能、氢键、晶胞结构等知识即可解答,题目难度中等,(4)、(6)为学生解答的难点.1年前查看全部
- 下表为长式周期表的一部分,其中的编号代表对应的元素.
下表为长式周期表的一部分,其中的编号代表对应的元素.
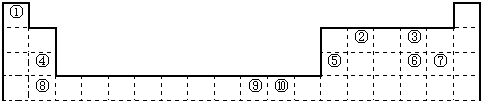
(1)表中属于ds区的元素是______(填编号).
(2)元素②与③形成的一种化合物是重要的化工原料,该化合物可用于人工降雨.有关该化合物分子的说法正确的是______.
A.分子中含极性共价键
B.含有2个σ键和2个π键
C.属于非极性分子
D.该化合物分子中,②原子采用sp2杂化
(3)根据上述表格中的十种元素填空:
Ⅰ、⑤、⑥、⑦的离子半径由小到大的顺序是______(填化学式)
Ⅱ、⑥、⑦两种元素的最高价氧化物对应的水化物的酸性由大到小的顺序是______(填化学式) 鸵鸟月1年前1
鸵鸟月1年前1 -
 a5485943 共回答了27个问题
a5485943 共回答了27个问题 |采纳率88.9%解题思路:由元素在周期表中的位置可知,①为H,②为C,③为O,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ca,⑨为Ni,⑩为Cu,
(1)以上元素只有Cu为ds区元素;
(2)②与③形成的一种化合物是重要的化工原料,该化合物可用于人工降雨,该化合物为CO2,为含极性键的非极性分子,C原子为sp杂化,双键中含1个σ键和1个π键;
(3)I、离子的电子层越多,半径越大,具有相同电子层结构的离子,原子序数大的离子半径小;
II、⑥、⑦的非金属性为Cl>S,非金属性越强,元素的最高价氧化物对应的水化物的酸性越强.由元素在周期表中的位置可知,①为H,②为C,③为O,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ca,⑨为Ni,⑩为Cu,
(1)元素周期表中位于ds区的元素为第ⅠB、ⅡB族,以上元素只有Cu为ds区元素,故答案为:⑩;
(2)②与③形成的一种化合物是重要的化工原料,该化合物可用于人工降雨,该化合物为CO2,
A.分子中含C、O之间的极性共价键,故A正确;
B.结构式为O=C=O,含有2个σ键和2个π键,故B正确;
C.结构对称,正负电荷中心重合,为含极性键的非极性分子,故C正确;
D.该化合物分子为直线型,②原子采用sp杂化,故D错误;
故答案为:ABC;
(3)I、离子的电子层越多,半径越大,具有相同电子层结构的离子,原子序数大的离子半径小,所以离子半径由小到大的顺序为Al3+<Cl-<S2-,
故答案为:Al3+<Cl-<S2-;
Ⅱ、⑥、⑦的非金属性为Cl>S,非金属性越强,元素的最高价氧化物对应的水化物的酸性越强,所以酸性为HClO4>H2SO4,故答案为:HClO4>H2SO4.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查位置、结构、性质的应用,涉及元素周期表中元素的分区、元素周期表中元素的位置、电子排布式、分子构型、非金属性比较等,综合性较强,题目难度中等.1年前查看全部
- 关于长式元素周期表的说法正确的是( )
关于长式元素周期表的说法正确的是( )
A.元素周期表有18纵行18个族
B.ⅠA族的元素全部是金属元素
C.元素周期表有7个周期
D.短周期是指第一、二周期 陈陈爱zz1年前1
陈陈爱zz1年前1 -
 孔燕子 共回答了17个问题
孔燕子 共回答了17个问题 |采纳率76.5%解题思路:元素周期表有七个横行,分属七个周期,18个纵行,其中包括七个主族、七个副族、一个0族和VIII族共16个族,短周期包含一、二、三周期,ⅠA族包含氢元素与碱金属元素.A.元素周期表有18个纵行,其中包括七个主族、七个副族、一个0族和VIII族共16个族,故A错误;
B.ⅠA族的元素除H元素外都是金属元素,故B错误;
C.元素周期表有7个周期,故C正确;
D.短周期是指第一、二、三周期,故D错误;
故选C.点评:
本题考点: 元素周期表的结构及其应用.
考点点评: 本题考查长式元素周期表的结构,要求学生对元素周期表的组成特点要熟悉,周期表中周期与周期之间,族与族之间含有较多规律,在学习中要善于抓住这些规律会起到事半功倍的效果.1年前查看全部
- 下表为长式周期表的一部分,其中的编号代表对应的元素.
下表为长式周期表的一部分,其中的编号代表对应的元素.
(1)写出上表中元素⑩基态原子的外围电子排布图______.① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为:______.
(3)按要求完成下列各题:
a.与元素④所形成的单质互为等电子体的分子、离子的化学式______、______(各一种).
b.元素④的气态氢化物X的水溶液在微电子工业中,可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为______.
(4)由元素③和⑧形成的液态化合物Z,是非极性的直线形分子.0.2mol的Z在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ.该反应的热化学方程式为______.
(5)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是:______.
(6)元素⑨和铁元素均可形成+2价氧化物,晶体结构类型均与氯化铯的相同,
a、比较离子半径大小:Cl-______K+(填“大于”、“小于”或“等于”).
b、元素⑨和铁的+2价离子半径分别为69pm和78pm,则比较两种氧化物的熔点较高的为______(填化学式),请解释原因______.
(7)元素⑩所形成的单质晶体中原子的堆积方式为fcc(面心立方),晶胞边长为361pm.又知⑩单质的密度为9.00g•cm-3,原子量为63.6,请回答下列问题:
a、晶体中该原子的配位数为______,一个晶胞中包含的原子数目为______.
b、⑩单质的晶胞的体积是______cm3,阿伏加德罗常数为NA=[4×63.69.00×4.70×10-23  lbq5981年前1
lbq5981年前1 -
 jackalibi 共回答了16个问题
jackalibi 共回答了16个问题 |采纳率93.8%解题思路:由元素在周期表中的位置可知①为H,②为Li,③为C,④为N,⑤为O,⑥为F,⑦为Mg,⑧为S,⑨为Ni,⑩为Cu,
(1)⑩为Cu,原子序数为29,结合构造原理书写电子排布式;
(2)元素③与①形成的水果催熟剂为C2H4,根据形成的δ键判断;
(3)元素④所形成的单质为N2,含有14个电子;元素④的气态氢化物X为NH3,与H2O2反应生成N2和水;
(4)元素③和⑧形成的液态化合物CS2;
(5)HF分子之间因形成氢键而形成(HF)n缔合分子;
(6)a、核外电子排布相同的离子,核电荷数越大,离子半径越小;
b、离子半径越小、晶体熔点越高;
(7)利用均摊法计算.由元素在周期表中的位置可知①为H,②为Li,③为C,④为N,⑤为O,⑥为F,⑦为Mg,⑧为S,⑨为Ni,⑩为Cu,
(1)⑩为Cu,原子序数为29,电子排布式为1s22s22p63s23p63d104s1,故答案为:1s22s22p63s23p63d104s1;
(2)元素③与①形成的水果催熟剂为C2H4,结构简式为CH2=CH2,C形成3个δ键,为sp2杂化,故答案为:sp2;
(3)a、元素④所形成的单质为N2,含有14个电子,与元素④所形成的单质互为等电子体的分子、离子有CO、C22-或CN-或NO+或O22+,
故答案为:CO;C22-或CN-或NO+或O22+;
b、元素④的气态氢化物X为NH3,与H2O2反应生成N2和水,方程式为2NH3+3H2O2=N2+6H2O,故答案为:2NH3+3H2O2=N2+6H2O;
(4)元素③和⑧形成的液态化合物CS2,0.2mol的Z在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ.
则1mol燃烧放出1075kJ,热化学方程式为CS2(l)+3O2(g)═CO2(g)+2SO2(g)△H=-1075kJ/mol,
故答案为:CS2(l)+3O2(g)═CO2(g)+2SO2(g)△H=-1075kJ/mol;
(5)F的非金属性很强,对应氢化物中含有氢键,HF分子之间因形成氢键而形成(HF)n缔合分子,实际测得的为HF和(HF)n的相对分子质量的平均值,比HF的分子量大,
故答案为:HF分子之间因形成氢键而形成(HF)n缔合分子,实际测得的为HF和(HF)n的相对分子质量的平均值,比HF的分子量大;
(6)a、Cl-、K+核外电子排布相同,核电荷数越大,离子半径越小,Cl的原子序数小于K,则Cl-离子半径较大,故答案为:大于;
b、两种氧化物中的阴阳离子的电荷(绝对值)均相等,离子半径越小、晶格能越大,则晶体熔点越高,
故答案为:NiO;两种氧化物中的阴阳离子的电荷(绝对值)均相等,Ni2+的半径小则NiO的阴阳离子核间距小于FeO的阴阳离子核间距,可知NiO的晶格能较大,熔点高;
(7)a、Cu单质的晶体为面心立方最密堆积,以顶点Cu原子研究,与之最近的Cu原子处于面心上,每个顶点为12个面共用,故Cu的配位数为12,
一个晶胞中包含的原子数目为6×
1/2]+8×[1/8]=4,
故答案为:12;4;
b、晶胞边长为361pm.则晶胞的体积为(361×10-10cm)3=4.70×10-23cm3,
设阿伏加德罗常数为NA,
则ρ=[m/V]=
4×
63.6
NA
4.70×10-23=9.00g•cm-3,则NA=
4×63.6
9.00×4.70×10-23/mol,
故答案为:4.70×10-23;NA=
4×63.6
9.00×4.70×10-23/mol=6.01×1023mol-1.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题以元素推断为载体,综合考查物质结构与性质,涉及核外电子排布规律、杂化理论与分子结构、氢键、晶胞计算等,难度中等,(7)注意利用均摊法进行晶胞计算.1年前查看全部
- 下表为长式周期表的一部分,其中的编号代表对应的元素。
下表为长式周期表的一部分,其中的编号代表对应的元素。
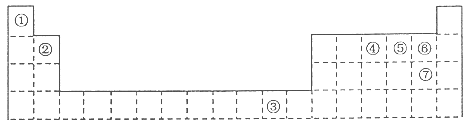
(1)元素③基态原子的电子排布式为 。
(2)②与⑦形成的化合物的空间构型为 。
(3)元素②④⑤⑥的第一电离能由大到小的顺序是 (填元素符号)
(4)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因 。
(5)胆矾CuSO 4 ·5H 2 O可写成[Cu(H 2 O) 4 ]SO 4 ·H 2 O,其结构如图所示。下列说法正确的是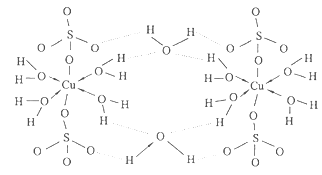
a.在上述结构示意图中,所有氧原子都采用sp 3 杂化
b.在上述结构示意图中,存在配位键、共价键和离子键
c.胆矾是分子晶体,分子间存在氢键
d.胆矾中的水在不同温度下会分步失去
(6)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH 3 ) 4 ] 2+ 配离子。已知NF 3 与NH 3 的空间构型都是三角锥形,但NF 3 不易与Cu 2+ 形成配离子,其原因是 。 不是oo又咋样1年前1
不是oo又咋样1年前1 -
 想起你会微笑 共回答了25个问题
想起你会微笑 共回答了25个问题 |采纳率84%(1)1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 ;
(2)直线型;
(3)F>N>O>Be;
(4)因为HF分子在气相时会通过氢键二聚或多聚,导致实测相对分子质量偏大;
(5)bd;
(6)N、F、H三种元素的电负性:F>N>H,在NF 3 中,共用电子对偏向F,偏离N原子使得氮原子上的孤对电子难于与Cu 2+ 形成配位键。
1年前查看全部
- (2013•河南二模)如表为长式周期表的一部分,其中的序号代表对应的元素.
 曾经111年前0
曾经111年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 下表为长式周期表的一部分,其中的编号代表对应的元素。 请回答下列问题
下表为长式周期表的一部分,其中的编号代表对应的元素。 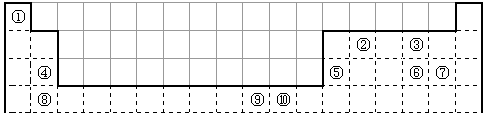
请回答下列问题
(1)表中属于d区的元素是________________(填编号)。
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为_________________(用对应的元素符号表示)。
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是__________________。
A.分子中含有氢键
B.属于非极性分子
C.含有4个σ键和1个π键
D.该氢化物分子中,②原子采用sp 2 杂化
(4)某元素的特征电子排布式为ns n np n+1 ,该元素原子的核外最外层电子的孤对电子数为_________;该元素与元素①形成的分子X构形为______________;X在①与③形成的分子Y中的溶解度很大,其主要原因是__________________________。
(5)A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式:__________________
(6)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d 0 或
d 10 排布时,无颜色;为d 1 ~d 9 排布时,有颜色,如[Co(H 2 O) 6 ] 2+ 显粉红色。据此判断,[Mn(H 2 O) 6 ] 2+
_____________颜色(填“无”或“有”)。 超级破裤子1年前1
超级破裤子1年前1 -
 嘎嘎e代 共回答了18个问题
嘎嘎e代 共回答了18个问题 |采纳率77.8%(1)⑨
(2)MgCNi 3 或CMgNi 3
(3)BD
(4)1;三角锥形;X和Y都是极性分子(且能形成氢键),根据相似相溶原理,极性分子易溶于极性溶剂中
(5)1s 2 2s 2 2p 6 3s 2
(6)有1年前查看全部
- 下列说法中正确的是 A.同周期元素的原子电子层数相同 B.(长式)元素周期表是按相对原子质量逐渐增大的顺序从左到右排列的
下列说法中正确的是
A.同周期元素的原子电子层数相同 B.(长式)元素周期表是按相对原子质量逐渐增大的顺序从左到右排列的 C.最外层电子数相同的元素都是同一族的元素 D.同一主族元素的原子最外层电子数一定相同  流逝的音符1年前1
流逝的音符1年前1 -
 真如网线 共回答了21个问题
真如网线 共回答了21个问题 |采纳率95.2%AD
1年前查看全部
- (12分)下表为长式周期表的一部分,其中的编号代表对应的元素。
(12分)下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。写出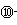 号元素的核外电子排布式_______________________________________;
号元素的核外电子排布式_______________________________________; 第一电离能的大小关系为________________(用元素符号表示)
第一电离能的大小关系为________________(用元素符号表示)
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为 (用对应的元素符号表示)。
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 。
(4)某元素的特征电子排布式为ns n np n+1 ,该元素原子的价电子数为 ; 该元素与元素①形成的分子X在①与③形成的分子Y中的溶解度很大,其主要原因是 。A.分子中含有氢键 B.易发生加成反应 C.含有4个σ键和1个π键 D.分子中所有原子处于同一个平面  我还是生愁1年前1
我还是生愁1年前1 -
 ri0ic 共回答了13个问题
ri0ic 共回答了13个问题 |采纳率76.9%(12分) (1)⑨ (1分) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 (2分) Mg>Al (2分) (2)MgCNi 3 或CMgNi 3 (2分) (3)B D (2分) (4)5(1分); X和Y都是极性...1年前查看全部
- 下表为长式周期表的一部分,其中的编号代表对应的元素。 (1)写出上表中元素⑨原子基态时的电子排布式________,该元
下表为长式周期表的一部分,其中的编号代表对应的元素。 
(1)写出上表中元素⑨原子基态时的电子排布式________,该元素的符号是_________。
(2)在元素②与①形成的气态化合物(水果催熟剂)中,元素②的杂化方式为________杂化,分子中σ键与π键之比为____。
(3)①~⑨元素的p亚层有两个单电子且第一电离能最大的元素名称是__________。 ②与④两种元素形成的化合物中,属于非极性分子的是__________(填化学式)。元素④与元素⑦形成的氢化物中,沸点由高到低的顺序为_____________(填化学式)。
(4)解释工业上制取⑥的单质是电解⑥的氧化物而不是氯化物的原因____________。
(5)⑤和⑧形成的离子化合物其晶胞结构如下图。该离子化合物晶胞的边长为 a cm,则晶体的密度是_________g·cm -3 (只要求列出算式)。
 tthome1年前1
tthome1年前1 -
 水逐流 共回答了22个问题
水逐流 共回答了22个问题 |采纳率90.9%(1)[Ar]3d 5 4s 1 ;Cr
(2)sp 2 ;5:1
(3)氧 ;CO 2 ;H 2 O>H 2 S
(4))氧化铝是离子晶体,熔融状态导电。氯化铝是分子晶体,熔融状态不导电
(5)4×78/(a3×N A )1年前查看全部
- 下表为长式周期表的一部分,其中的编号代表对应的元素.
下表为长式周期表的一部分,其中的编号代表对应的元素.
请回答下列问题:
(1)表中属于d区的元素是______(填编号).
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为______;③和⑦形成的常见化合物的晶体类型是______.
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为______;该元素与元素①形成的分子X的空间构形为______
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质.请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:______. 诸葛亮的亮1年前1
诸葛亮的亮1年前1 -
 天崖首席 共回答了16个问题
天崖首席 共回答了16个问题 |采纳率87.5%解题思路:由元素在周期表中的位置可知,①为H,②为Be,③为C,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ca,⑨为Fe,⑩为Cu,
(1)d区元素在副族元素和过渡元素区;
(2)元素①的6个原子与元素③的6个原子形成的某种环状分子为苯,③和⑦形成的常见化合物为CCl4;
(3)元素的特征电子排布式为nsnnpn+1,n只能为2,则该元素为N,形成的分子X为NH3;
(4)元素②的氢氧化物与NaOH溶液反应反应生成Na2BeO2.由元素在周期表中的位置可知,①为H,②为Be,③为C,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ca,⑨为Fe,⑩为Cu,
(1)d区元素在副族元素和过渡元素区,Cu位于ds区,只有Fe位于d区,故答案为:⑨;
(2)元素①的6个原子与元素③的6个原子形成的某种环状分子为苯,③和⑦形成的常见化合物为CCl4;,由分子构成,属于分子晶体,故答案为:苯;分子晶体;
(3)元素的特征电子排布式为nsnnpn+1,n只能为2,则该元素为N,最外层有5个电子,孤对电子数为1,形成的分子X为NH3,空间构成为三角锥形,故答案为:1;三角锥形;
(4)元素②的氢氧化物与NaOH溶液反应反应生成Na2BeO2,该反应为Be(OH)2+2NaOH═Na2BeO2+2H2O,故答案为:Be(OH)2+2NaOH═Na2BeO2+2H2O.点评:
本题考点: 位置结构性质的相互关系应用;元素周期律和元素周期表的综合应用.
考点点评: 本题考查位置、结构、性质的应用,涉及元素周期表中元素的分区、元素周期表中元素的位置、晶体类型、分子构型、化学反应等,综合性较强,题目难度较大.1年前查看全部
- 下表为长式周期表的一部分,其中的编号代表对应的元素。
下表为长式周期表的一部分,其中的编号代表对应的元素。

根据上述表格中的十种元素填空:
1)表中属于ds区的元素是 (填编号)。
2)元素②与③形成的一种化合物是重要的化工原料,该化合物可用于人工降雨。有关该化合物分子的说法正确的是 。
3)金属性最强的主族元素是 (填元素名称)。A.分子中含极性共价键 B.含有1个σ键和2个π键 C.属于非极性分子 D.该化合物分子中,②原子采用sp 2 杂化
4)⑤、⑥、⑦的离子半径由小到大的顺序是 (填化学式)。
5)某元素的特征电子排布式为ns n np n+1 ,该元素原子的核外最外层电子的未成对电子数为 个; 该元素与元素①形成的分子X的空间构型为 。 月影心歌1年前1
月影心歌1年前1 -
 谷城 共回答了22个问题
谷城 共回答了22个问题 |采纳率90.9%1年前查看全部
- (16分)下表为长式周期表的一部分,其中的编号代表对应的元素
(16分)下表为长式周期表的一部分,其中的编号代表对应的元素

试填空
(1)写出①、④两元素按原子个数比为1:1形成的化合物的电子式 ;写出上表中元素⑨原子的外围电子排布式 ;
(2)元素②与⑦形成的化合物的晶体类型是:_ _ _;
(3)元素⑤、⑥的第一电离能大小顺序是: > (用元素符号表示);元素③与元素①形成的X分子的空间构型为: 。请写出一种与N 3 — 互为等电子体的分子的化学式
(4)⑦、⑧两种元素能形成一种AB 2 型的共价分子,该分子属于 分子(填“极性”或“非极性”)⑤、⑦、⑾三种元素之间能以原子个数比1∶1两两形成互化物,这些互化物的性质类似于这些元素的单质。请写出⑦、⑾两种元素形成的互化物的化学式 (正价元素写在前面)。
(5)元素⑩在元素周期表分区中属于 区元素,元素⑩在一定条件下形成的晶体的两种晶胞如下图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为: 。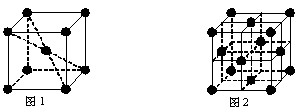
 罗高智1年前1
罗高智1年前1 -
 whx603 共回答了11个问题
whx603 共回答了11个问题 |采纳率100%(1)H 2 O 2 的电子式(2分)3d 5 4s 1 (2分) (2)分子晶体(2分)
(3)Al>F;(1分)三角锥形,(1分) CO 2 (或CS 2 、N 2 O、BeCl 2 )(2分)
(4)非极性(1分) BrCl (2分) (5)d(1分) 2∶3(或8∶12)(2分)
略1年前查看全部
- (2014•凉山州三模)如图1为长式周期表的一部分,其中的编号代表对应的元素.
(2014•凉山州三模)如图1为长式周期表的一部分,其中的编号代表对应的元素.

(1)写出上表中元素⑧原子基态时的电子排布简式______;该元素符号为______.
(2)在元素①与②形成的气态化合物中(水果催熟剂),原子②的杂化方式为______
(3)以上9种元素中,p能级有两个未成对电子且第一电离能最大的元素名称是______;②与③两种元素形成的化合物中,属于非极性分子的空间构型是______;元素③与元素⑤的简单氢化物中,沸点低的分子的电子式______.
(4)④和⑦形成的离子化和物的晶胞结构如图2所示,该离子化和物晶胞的边长为acm3,则晶体的密度为[312a3NA  jigou131年前0
jigou131年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 下表为长式周期表的一部分,其中的序号代表对应的元素。 (1)写出上表中元素⑨原子的外围电子排布式__________。
下表为长式周期表的一部分,其中的序号代表对应的元素。 
(1)写出上表中元素⑨原子的外围电子排布式__________。
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为__________杂化;元素⑦与⑧形成的化合物的晶体类型是__________。
(3)元素④的第一电离能__________元素⑤(填写“>”“=”或“<”)的第一电离能;元素④与元素①形成的X分子的空间构型为__________。请写出与元素④的单质互为等电子体分子、离子的化学式__________(各写一种)。
(4)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是__________。
(5)元素④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为 __________。
(6)将过量的X通入含有元素⑩的蓝色硫酸盐溶液中,反应的离子方程式为__________;元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则一个晶胞中所包含的氧原子数目为__________。
 weiweiweiting1年前1
weiweiweiting1年前1 -
 点点14 共回答了18个问题
点点14 共回答了18个问题 |采纳率94.4%(1)3d 5 4s 1
(2)sp 2 ;离子晶体
(3)> ; 三角锥形;CO, C 2 2-
(4)HF气态时会形成(HF)n分子(或HF分子间会形成氢键)
(5)4Mg+10HNO 3 =4Mg(NO 3 ) 2 +NH 4 NO 3 +3H 2 O
(6)Cu 2+ +4NH 3 =[Cu(NH 3 ) 4 ] 2+ 或 Cu 2+ +2OH - =Cu(OH) 2 ↓ ,Cu(OH) 2 +4NH 3 =[Cu(NH 3 ) 4 ] 2+ +OH - ;21年前查看全部
大家在问
- 1一杯糖水,糖占总数的3分之1,又加入15克水,这时糖占总数的9分之2,糖有几千克?
- 26x的三次方-7x+1 因式分解
- 3食醋和鸡蛋壳反应的化学方程式?
- 4日本的气候类型是什么?练习册和参考书是两个答案.海洋性季风气候或温带海洋性气候.
- 5NaN3中氮元素化合价是多少?
- 6以我.你眼中的我为话题写一篇作文
- 7( )is this your rubber no ,it isn t.a.hi b.sorry c.Excuse me
- 8用英文写出下列短语。 1. 一张新床
- 9一项工程,若由甲乙二个工程队合做要24天,甲乙二工程队的工作效率是3:4,甲乙做这项工程各要用多少天`要有过程`最好要讲
- 10我们要不断改进学习方法,增加学习效率。(改病句)
- 11There used to be a big tree in front of the house.(改为一般疑问)
- 12300箱饮料 卡车运多少前
- 13什么情况下是平方根,什么情况下是算数平方根?搞不懂··急!
- 14子罕之所宝者至矣翻译这句
- 15当汽车B在汽车A前方7m时,A正以vA=4m/s的速度向右做匀速直线运动,而汽车B此时速度vB=10m/s,向右做匀减速