含锌65%的锌粒100g与足量的稀硫酸反应,可制取氢气多少升?(标准大气压下氢气的密度是0.09g*L的负一次方)
 夏季的星星2022-10-04 11:39:542条回答
夏季的星星2022-10-04 11:39:542条回答回答清楚点,我会给分的.

已提交,审核后显示!提交回复
共2条回复
 小非菲 共回答了16个问题
小非菲 共回答了16个问题 |采纳率93.8%- 设生成氢气X克.
Zn+H2SO4==ZnSO4+H2
65---------------2
100*65%-----------X
X=2克
体积=质量/密度=2/0.09=22.2升 - 1年前
 mjgdrerh 共回答了65个问题
mjgdrerh 共回答了65个问题 |采纳率- 锌65g,生成氢气2g
v=m/密度=2g÷0.09g/L - 1年前
相关推荐
- 稀硫酸和锌粒反应制取氢气的离子方程式
 loev89815471年前0
loev89815471年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 为什么锌粒和稀盐酸反应一段时间后速率会加快?
 辰冬尔1年前1
辰冬尔1年前1 -
 维维0427 共回答了18个问题
维维0427 共回答了18个问题 |采纳率88.9%因为刚开始 表面有一部分是氧化物 会影响反应速率 当这部分氧化物被反应掉以后 速率加快 但是随着反应进行 盐酸的浓度降低 所以之后反应速率又会降低1年前查看全部
- (8分)某学生设计如下图Ⅰ装置,测定2 mol/L的硫酸与锌粒和锌粉反应的速率。请回答:
(8分)某学生设计如下图Ⅰ装置,测定2 mol/L的硫酸与锌粒和锌粉反应的速率。请回答:

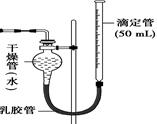
图Ⅰ 图Ⅱ
(1)装置图Ⅰ中放有硫酸的仪器名称是 。
(2)按照图Ⅰ装置实验时,他限定了两次实验时间均为10 min,他还需要测定的另一个数据是 。
(3)实验结束后,得到的结论是。
(4)该生又将图Ⅰ装置中的气体收集装置改为图Ⅱ,实验完毕待冷却后,该生准备读取滴定管上液面所在处的刻度数,发现滴定管中液面高于干燥管中液面,应首先采取的操作是 。 OP组合1年前1
OP组合1年前1 -
 wyzxcvb 共回答了25个问题
wyzxcvb 共回答了25个问题 |采纳率96%(8分) (1)分液漏斗 (2)收集到气体的体积
(3)其他条件相同时,锌粉比锌粒反应的速率快 (4)调节滴定管的高度使得两侧液面相平
1年前查看全部
- 本实验所用的氢气来自于锌粒与稀盐酸的反应.如果要还原得到6.4克铜,那么理论上需要消耗多少克锌粒?
本实验所用的氢气来自于锌粒与稀盐酸的反应.如果要还原得到6.4克铜,那么理论上需要消耗多少克锌粒?
(请列式计算) 风ff1年前2
风ff1年前2 -
 13HHH10 共回答了24个问题
13HHH10 共回答了24个问题 |采纳率91.7%H2 +CuO=加热=Cu+H2O
2 64
x 6.4g
x=0.2g
Zn +2HCL=ZnCl2 +H2
65 2
y 0.2g
y=6.5g1年前查看全部
- 含杂质3%的锌粒(杂质不与酸反应)与稀盐酸反应,制取氢气11.2升(标准状况下),则需该种锌粒______克,质量分数为
含杂质3%的锌粒(杂质不与酸反应)与稀盐酸反应,制取氢气11.2升(标准状况下),则需该种锌粒______克,质量分数为15%稀盐酸______克.(标准状况下,1L氢气的质量是0.09克).  my51gps1年前1
my51gps1年前1 -
 易中天品ll 共回答了18个问题
易中天品ll 共回答了18个问题 |采纳率88.9%设消耗锌的质量为x、HCl的质量为y
Zn+2HCl═ZnCl 2 +H 2 ↑
65 73 2
xy 11.2L×0.09g/L
65
x =
73
y =
2
11.2L×0.09g/L
x=32.76g,y=36.79g
则需该种锌粒的质量=32.76g÷(1-3%)=33.8g
需质量分数为15%稀盐酸的质量=36.79g÷15%=245.3g
故答案为:33.8;245.3.1年前查看全部
- 含锌65%的锌粒200g,与足量H2SO4反应,克制的H2多少升
 天使任务61年前2
天使任务61年前2 -
 恍然如梦 共回答了11个问题
恍然如梦 共回答了11个问题 |采纳率100%含锌65%的锌粒200g含有Zn的质量是200*65%=130g
设生成H2的质量为x.
Zn+H2SO4=ZnSO4+H2↑
65 2
130g x
65/130=2/x
x=4g
H2的体积V=m/ρ=4/0.0899=44.5L
答:可制得H2 44.5L.
如果是高中,用物质的量做.
Zn的物质的量是n=m/M=130/65=2mol
Zn+H2SO4=ZnSO4+H2↑
1 1
2mol n(H2)
n(H2)=2mol
H2的体积V=n*Vm=2*22.4=44.8L1年前查看全部
- 将10g不纯的锌粒(杂质不溶于水也不溶于酸)投入100g稀硫酸中,恰好完全反应,得到0.2g氢气
将10g不纯的锌粒(杂质不溶于水也不溶于酸)投入100g稀硫酸中,恰好完全反应,得到0.2g氢气
用98%的浓硫酸来配置500g反应使用的稀硫酸,需要浓硫酸多少毫升?水多少毫升?(浓硫酸的密度为1.84g/ml)
(详细过程) 亲爱的小爱1年前2
亲爱的小爱1年前2 -
 Inchon 共回答了19个问题
Inchon 共回答了19个问题 |采纳率94.7%Zn+H2SO4=ZnSO4+H2
98 2
x 0.2g
x=9.8g 所以该稀硫酸的溶质质量分数=9.8g/100g*100%=9.8%
设:用98%的浓硫酸来配置500g反应使用的稀硫酸,需要浓硫酸v毫升
v*1.84*98%=500*9.8% 需要浓硫酸多少毫升(v)=27.1739ml;
需要水多少毫升:500g-27.1739*1.84g=450g=450ml1年前查看全部
- 100克h硫酸溶液与一定量的锌粒恰好完全反应,反应后总质量比反应前少0.5克
100克h硫酸溶液与一定量的锌粒恰好完全反应,反应后总质量比反应前少0.5克
100克h⑵so⑷溶液与一定量的锌粒恰好完全反应,反应后总质量比反应前少0.5克,求锌的质量.硫酸质量分数.反应后溶液中溶质的分数. 一颗虎牙8211181年前1
一颗虎牙8211181年前1 -
 unkerxuxi 共回答了16个问题
unkerxuxi 共回答了16个问题 |采纳率100%这个质量差其实就是氢气的质量,根据质量差为0.5g,得出氢气的物质的量是0.25mol,所以根据方程式,H2SO4+Zn =H2+ZnSO4,可得得到硫酸跟锌的物质的量都是0.25mol,在根据它俩的相对分子质量可以算出硫酸是24.5g,锌是16.25g,最后根据硫酸的质量24.5g和溶液质量为100g,可以算出硫酸溶液中溶质的质量分数为24.5%1年前查看全部
- 长时间放置的锌粒会有什么变化长时间放置的锌粒和足量的稀硫酸反应,写出方程式和现象( ),( ),( )
 qeeeeq1年前3
qeeeeq1年前3 -
 sherey831219 共回答了19个问题
sherey831219 共回答了19个问题 |采纳率73.7%Zn+H2SO4==ZnSO4+H2
长期放置的Zn难道会变成ZnO~
那就ZnO+H2SO4==ZnSO4+H2O
现象:溶解,伴随气泡1年前查看全部
- 某同学为测定10g某赤铁矿石中氧化铁的质量分数,利用稀硫酸和锌粒制取氢气,设计了下图所示的装置,进行有关的实验探究(提示
某同学为测定10g某赤铁矿石中氧化铁的质量分数,利用稀硫酸和锌粒制取氢气,设计了下图所示的装置,进行有关的实验探究(提示:3H 2 +Fe 2 O 3
 2Fe+3H 2 O;杂质不参加反应,假定每步均完全反应或吸收)。请回答有关问题:
2Fe+3H 2 O;杂质不参加反应,假定每步均完全反应或吸收)。请回答有关问题: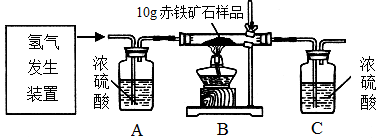
得到如下数据:装置 B C 反应前质量 84.3g 294.1g 反应后质量 81.9g 296.8g
(1)请计算该赤铁矿石样品中氧化铁的质量分数。(写出计算过程)
(2)该实验还可测定组成水中各元素之间的质量关系,请用表中实验数据列式表示出水中氢、氧元素的质量比为_______________________________________________(只列式,不计算);若玻璃管中的氧化铁没有完全反应,则求得水中氢、氧元素的质量比会__________(选填“偏大”、“偏小” 或“不变”)。 67270051年前1
67270051年前1 -
 飞的更高我 共回答了23个问题
飞的更高我 共回答了23个问题 |采纳率87%(1)80%;(2)H:O=[(296.8g-294.1g)-(84.3g-81.9g)]:(84.3g-81.9g) 不变
1年前查看全部
- 为探究某稀硫酸中溶质的质量分数,甲和乙两学生分别取溶质质量分数相等的稀硫酸100g.甲向其中加入6.5g锌粒,反应结束时
为探究某稀硫酸中溶质的质量分数,甲和乙两学生分别取溶质质量分数相等的稀硫酸100g.甲向其中加入6.5g锌粒,反应结束时观察到锌粒完全消失;乙向所取稀硫酸中加入13g锌粒,反应结束时观察到锌粒有很少量剩余.有关实验的推理一定正确的是 [ ]A、原稀硫酸中溶质质量分数大于9.8%而小于19.6%
B、反应后甲所得溶液中溶质一定只有硫酸锌
C、乙实验中所得氢气的质量是甲的2倍
D、反应后乙所得溶液中还含有硫酸 娃哈哈xz5561年前1
娃哈哈xz5561年前1 -
 nataliatutu 共回答了15个问题
nataliatutu 共回答了15个问题 |采纳率86.7%A1年前查看全部
- 对于100 mL 1 mol/L盐酸与锌粉的反应,采取下列措施能使反应速率加快的是 A.用等量锌粒代替锌粉 B.改用10
对于100 mL 1 mol/L盐酸与锌粉的反应,采取下列措施能使反应速率加快的是
A.用等量锌粒代替锌粉 B.改用100 mL 0.5 mol/L盐酸 C.改用300 mL 1 mol/L盐酸 D.适当升高温度  TO雨林1年前1
TO雨林1年前1 -
 我和狗狗去流浪 共回答了21个问题
我和狗狗去流浪 共回答了21个问题 |采纳率81%D
1年前查看全部
- 利用氯酸钾、稀硫酸、少量高锰酸钾、石灰石、锌粒,在实验室中能制取的气体有( )
 steelfa161年前1
steelfa161年前1 -
 只爱梅子 共回答了12个问题
只爱梅子 共回答了12个问题 |采纳率100%氯酸钾和高锰酸钾可加热制氧气
稀硫酸与石灰石制二氧化碳
与锌制氢气1年前查看全部
- 向200ml2mol/l的盐酸中加入6.5g锌粒,充分反应
向200ml2mol/l的盐酸中加入6.5g锌粒,充分反应
求1:反应前溶液盐酸的物质的量是( )
2:反应后的氯化锌的物质的量的浓度是( )[假定反应前后溶液体积不变]
3:反应前后氢气的体积是( )L【标准状况下】
麻烦有过程,不然我看不懂~ 0217cui1年前1
0217cui1年前1 -
 夏天的雪QZ 共回答了20个问题
夏天的雪QZ 共回答了20个问题 |采纳率95%1.n=cxv=2x0.2=0.4mol
2.n(zn)=0.1mol=n(zncl2)
c(zncl2)=n/v=0.1/0.2=0.5mol/L
3.n(H2)=n(Zn)=0.1mol
V(H2)=nxVm=2.24L1年前查看全部
- 将锌粒放入锥形瓶的具体操作
 xiaolaoshu1年前1
xiaolaoshu1年前1 -
 ca453dd0080d3f76 共回答了18个问题
ca453dd0080d3f76 共回答了18个问题 |采纳率100%用镊子(纸槽或药匙)取锌粒,将锥形瓶横置,镊子(纸槽或药匙)伸入锥形瓶底部,然后竖起锥形瓶,操作完成.1年前查看全部
- 在水,硝酸银溶液、氧气、氢氧化钠溶液、锌粒、细铁丝、稀硫酸、碳酸钙、氧化钙、胆矾中选择恰当的物质,写出一个属于氧化还原反
在水,硝酸银溶液、氧气、氢氧化钠溶液、锌粒、细铁丝、稀硫酸、碳酸钙、氧化钙、胆矾中选择恰当的物质,写出一个属于氧化还原反应的化合反应,并写出在该反应中,氧化剂是.,被氧化的物质是.
 Timecool1年前1
Timecool1年前1 -
 破天2000 共回答了17个问题
破天2000 共回答了17个问题 |采纳率88.2%3Fe+2O2=点燃=Fe3O4
在该反应中,氧化剂是氧气,被氧化的物质是铁1年前查看全部
- 盐酸与锌粒的反应如题,快
 5176995361年前2
5176995361年前2 -
 zqzqwertyu 共回答了19个问题
zqzqwertyu 共回答了19个问题 |采纳率84.2%锥形瓶,试管里都能进行.化学方程式:Zn+2HCl=ZnCl2+H2↑ 生成氯化锌和氢气.1年前查看全部
- 7克含杂质7.1%的锌粒与足量的稀盐酸反应可生成多少升的氢气
 纠错1年前1
纠错1年前1 -
 ginew 共回答了12个问题
ginew 共回答了12个问题 |采纳率83.3%Zn + 2HCl= ZnCl2 + H2
65 22.4L
7*(1-7.1%) X
有65X=22.4*7*(1-7.1%)
X =2.24L1年前查看全部
- 20克锌(含杂质)与200克稀硫酸充分反应后残余物质量为219.4克 求反应生成多少氢气 求锌粒中锌的质量分
 卡迷1年前3
卡迷1年前3 -
 蓝晰滢 共回答了16个问题
蓝晰滢 共回答了16个问题 |采纳率87.5%固体质量差即是氢气质量20+200-219.4=0.6g
设Zn有x克
Zn+H2SO4=ZnSO4+H2
65……………………2
x……………………0.6
65/x=2/0.6
x=19.5
所以锌粒中锌的质量分数为19.5/20×100%=97.5%1年前查看全部
- 用盐酸和锌粒制H2要除的杂质:水蒸气(H2O)、氯化氢气体(HCl,盐酸酸雾)(用稀硫酸没此杂质),先除__,
用盐酸和锌粒制H2要除的杂质:水蒸气(H2O)、氯化氢气体(HCl,盐酸酸雾)(用稀硫酸没此杂质),先除__,
常用———等,后除——,也可以用——试剂 一次性除去. 不要在雨天1年前2
不要在雨天1年前2 -
 心十二妹 共回答了13个问题
心十二妹 共回答了13个问题 |采纳率92.3%先除HCl,常用NaOH等,后除H2O,也可以用碱石灰试剂 一次性除去.
如还有疑问~欢迎追问1年前查看全部
- 在通常情况下,氢气是一种无色无味气体,难溶于水,密度比空气小,实验室常用锌粒和稀硫反应制取氢气:Zn+H2SO4====
在通常情况下,氢气是一种无色无味气体,难溶于水,密度比空气小,实验室常用锌粒和稀硫反应制取氢气:Zn+H2SO4====ZnSO4+H2↑,某同学用质量为8g含有杂质的锌粒与100g过量的稀硫酸反应,有关数据如下表(假定杂质不溶于水,也不参加反应)请回答:
(1)产生氢气的质量是多少?
(2)从表中有关数据,计算参加反应的稀硫酸质量分数是多少?
我看网上问过这个问题,都说0.2剩下的是杂质,那生成出来的 ZnSO4去哪了 它难道不是固体吗? 冬刀1年前1
冬刀1年前1 -
 假面星期五 共回答了22个问题
假面星期五 共回答了22个问题 |采纳率95.5%ZnSO4在水中的溶解度是比较大的,在稀硫酸里会充分溶解,不会出现固体ZnSO41年前查看全部
- 酸性溶液具有酸的通性么?本人理解有问题:题上说检验溶液的酸碱性,可以用锌粒观察是否产生气泡,可以么?不是酸才可与活泼金属
酸性溶液具有酸的通性么?
本人理解有问题:
题上说检验溶液的酸碱性,可以用锌粒观察是否产生气泡,可以么?不是酸才可与活泼金属反应么?显酸性溶液一定具有酸的通性么?CUSO4溶液呢?显酸性可以与ZN反应么? syhaozi1年前2
syhaozi1年前2 -
 acc72 共回答了19个问题
acc72 共回答了19个问题 |采纳率94.7%太弱的就不好了,还是酸碱指示剂稳妥,硫酸铜的确酸性溶液,强酸弱碱盐么,但是明显但是和锌发生的是置换反应1年前查看全部
- 硫酸溶液与过量锌粒反应,为减缓速率,为什么不能加入硫酸铵固体?
 木木de嗳1年前1
木木de嗳1年前1 -
 emily_ma11 共回答了19个问题
emily_ma11 共回答了19个问题 |采纳率84.2%减缓速率只有几种方法
对于在溶液中的反应
1.改变温度
由于加入硫酸铵之后温度几乎不变,所以不能减缓速率
2.改变反应物质的浓度
由于H+和Zn反应
而Zn是固体浓度不变,H+的浓度也不会因为加入硫酸铵的加入而改变
所以反应物的浓度不变
也不能减缓速率1年前查看全部
- 以1,2溴乙烷,氢氧化钠醇溶液,二氧化锰,锌粒,浓盐酸为原料合成聚氯乙烯各步反
 yufeng9981年前1
yufeng9981年前1 -
 hvnc5pf 共回答了12个问题
hvnc5pf 共回答了12个问题 |采纳率91.7%1,2-二溴乙烷与锌粒反应的到乙烯
BrCH2CH2Br + Zn = C2H4 + ZnBr2
浓盐酸和二氧化锰反应制备氯气
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
氯气对乙烯加成,得到1,2-二氯乙烯
C2H4 + Cl2 = ClCH2CH2Cl
用氢氧化钠醇溶液消除一分子氯化氢,得到氯乙烯
ClCH2CH2Cl + NaOH = CH2=CHCl + NaCl + H2O
氯乙烯催化加聚得到聚氯乙烯
nCH2=CHCl = (CH2CHCl)n1年前查看全部
- 在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的
在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气.下列说法正确的是( )
A. 甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大
B. 甲烧杯中的酸过量
C. 乙烧杯中的锌有剩余
D. 反应开始后乙烧杯中的C(H+)始终比甲烧杯中的c(H+)小 n_tt_n1年前3
n_tt_n1年前3 -
 潜水一万米 共回答了23个问题
潜水一万米 共回答了23个问题 |采纳率100%解题思路:A.醋酸浓度大,消耗的Zn多,但产生等量的氢气时,醋酸消耗的Zn少;
B.两种溶液的体积和pH都相等,HCl的浓度小;
C.盐酸的浓度小,生成等量的氢气,盐酸完全反应;
D.反应开始后,醋酸持续电离.A.在体积和pH都相等的盐酸和醋酸中,已提供的H+的浓度和其物质的量相等,但由于醋酸是弱酸,只有部分电离;盐酸是强酸,已经完全电离,所以可提供的H+的物质的量显然是醋酸大于盐酸,与足量的锌反应时,消耗锌的质量是醋酸大于盐酸将大于盐酸,所以在醋酸中加入的锌粒质量应较小,盐酸中加入的锌粒质量较大,故A正确;
B.当加入的锌粒质量不等而产生等量的氢气时,说明参加反应的锌粒相等,乙烧杯中醋酸一定有剩余度,故B错误;
C.盐酸一定无剩余(盐酸中锌粒当有剩余),否则不可能产生等质量的氢气,故C错误;
D.由于醋酸还能继续电离而盐酸不能,所以反应开始后,醋酸中的H+浓度大于盐酸中的氢离子浓度,则反应开始后乙烧杯中的C(H+)始终比甲烧杯中的c(H+)大,故D错误;
故选A.点评:
本题考点: 弱电解质在水溶液中的电离平衡.
考点点评: 本题考查弱电解质的电离与酸与金属的反应,明确浓度与氢离子的关系,氢气与金属的质量关系是解答本题的关键,题目难度不大,但属于易错题.1年前查看全部
- 过量锌粒投入到FeCl3溶液中的现象是?
过量锌粒投入到FeCl3溶液中的现象是?
如题 akxwz1年前1
akxwz1年前1 -
 忘情太平洋 共回答了14个问题
忘情太平洋 共回答了14个问题 |采纳率78.6%锌的还原性比较强,既能还原+3价铁,也能还原+2价铁1年前查看全部
- 供选择的仪器装置如下图所示(图中A-G为装置代号,①-⑧为仪器的接口符号).供选择的药品有:金属钠、铜片、锌粒、炭粉、硝
供选择的仪器装置如下图所示(图中A-G为装置代号,①-⑧为仪器的接口符号).供选择的药品有:金属钠、铜片、锌粒、炭粉、硝酸、稀硫酸.
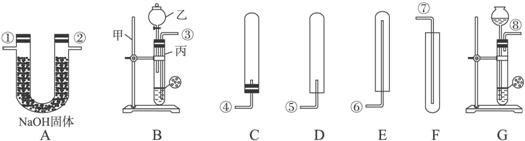
完成下列问题:
(1)写出B装置中的仪器名称:甲______,乙______,丙______.
(2)实验室制取氢气时,常选用的药品是______和______;发生反应的化学方程式为______.
(3)若一个学生选用盐酸为原料之一,则制得的氢气中会含有少量盐酸的酸,如让氢气通过装置(写装置代号)______,酸雾即可除去,化学反应方程式为______;制取和收集的装置是(写装置代号)______和______.
(4)请正确连接氢气的制取、除酸雾和收集氢气的装置(写接口符号)______接______,______接______. hotdog_w1年前1
hotdog_w1年前1 -
 x18h6c 共回答了14个问题
x18h6c 共回答了14个问题 |采纳率92.9%解题思路:(1)根据仪器图示和其作用,辨识常见仪器,写出仪器名称;
(2)实验室制取氢气选用药品的反应化学方程式的考查;
(3)选用稀盐酸制取氢气时,产生的氢气混有稀盐酸挥发出的HCl气体,混合气体通过氢氧化钠可净化氢气;
根据发生装置的装置图示,分析装置图中的正确装置,选取正确装置制取氢气;
(4)氢气的制取、除酸雾和收集氢气的装置的连接顺序:发生装置→净化→干燥→收集装置.净化后进行干燥以保证所收集的气体为干燥的气体,若净化与干燥顺序颠倒,则净化后的氢气因没通过再次干燥而不能得到干燥的气体.(1)仪器甲为固体装置的铁架台,乙为添加反应溶液带活塞的分液漏斗,丙为少量药品反应的容器试管.
故答:铁架台,分液漏斗,试管;
(2)实验室常用与不挥发的稀硫酸反应速度适中的锌粒制取氢气,锌与硫酸发生置换反应放出氢气.
故答:锌粒,稀硫酸,Zn+H2SO4═ZnSO4+H2↑;
(3)装置A中装有氢氧化钠,可与混在氢气中的HCl气体发生中和反应而除去,所以把混合气体通过装置A除去酸雾;
故选A,NaOH+HCl═NaCl+H2O;
使用固体锌粒和液体稀硫酸反应制取氢气,选择“固液不加热”型发生装置,由于装置B的导管伸入过长是错误装置,所以发生装置选G;
密度小于空气,应选择向下排空气收集气体的方法,图中装置C试管口被密封不能用来收集气体,装置D内导管没伸入试管底,收集气体不纯,所以收集氢气应选装置E.
故答:G,E;
(4)根据正确的连接顺序:发生装置→净化→干燥→收集装置,装置连接的接口顺序为:⑧→①→②→⑥,接口①②不分先后,所以连接顺序也可以为:⑧→②→①→⑥.
故答:⑧,①(或②),②(或①),⑥.点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;实验室制取气体的思路;常用气体的收集方法;常见气体的检验与除杂方法;书写化学方程式、文字表达式、电离方程式.
考点点评: 要掌握H2的实验室制法的原理装置、收集方法等,对装置的连接要了解一般的原则,发生装置→净化→干燥→收集装置.1年前查看全部
- 锌遇氢离子和铜离子先和谁反应有个实验室制取氢气的简易装置,若加入稀硫酸时发现锌粒和稀硫酸没有接触而稀硫酸又不够了,为使反
锌遇氢离子和铜离子先和谁反应
有个实验室制取氢气的简易装置,若加入稀硫酸时发现锌粒和稀硫酸没有接触而稀硫酸又不够了,为使反应顺利进行,而又不影响氢气的生成,则可以从长颈漏斗中加入的试剂是?
加适量的硫酸铜溶液可以吗?为什么?
但是部分Zn用来生成了Cu,会影响氢气的生成量吧? 石头s1年前3
石头s1年前3 -
 afdjdsiafjids 共回答了17个问题
afdjdsiafjids 共回答了17个问题 |采纳率100%因为稀硫酸不够,加入硫酸铜可以使其液面升高,淹没到锌,继续反应.
虽然锌会与硫酸铜反映,但是如果锌量足,那也不影响.并且还可以构成原电池,加快反映速率.1年前查看全部
- 在一定条件下,反应物的溶液中溶质质量分数越大,化学反应速率越快。现有100g溶质质量分数为27%的硫酸溶液与足量的锌粒反
在一定条件下,反应物的溶液中溶质质量分数越大,化学反应速率越快。现有100g溶质质量分数为27%的硫酸溶液与足量的锌粒反应,为了减缓化学反应的速率,而又不影响生成氢气的总质量,可向该溶液中加入适量的 [ ]A.水
B.盐酸溶液
C.碳酸钠溶液
D.氢氧化钠溶液 左心房的窗1年前1
左心房的窗1年前1 -
 桑塔菲 共回答了24个问题
桑塔菲 共回答了24个问题 |采纳率95.8%A1年前查看全部
- 下列哪些反应要放热:1.生石灰与水 2.石灰石与稀盐酸 3.氯化钠与水 4.锌粒与稀盐酸A.1 2 3 B.1 2 4
下列哪些反应要放热:
1.生石灰与水 2.石灰石与稀盐酸 3.氯化钠与水 4.锌粒与稀盐酸
A.1 2 3 B.1 2 4
C.2 3 4 D.1 3 4 maoxion1年前1
maoxion1年前1 -
 chocalate888 共回答了25个问题
chocalate888 共回答了25个问题 |采纳率92%124选B化学反应基本都放热,第三个是物理溶解不放热1年前查看全部
- 如图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石
如图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰。现欲利用这些药品分别制取NH 3 、Cl 2 、H 2 、CO 2 四种气体,试回答下列问题:
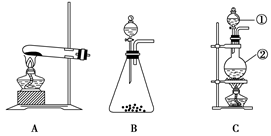
(1) ①写出利用上述有关药品制取氨气的化学方程式:_____________;用 干燥剂干燥(填名称);
②制取CO 2 的化学方程式 ;
(2)①制取Cl 2 选用装置为__________(填序号);
②写出制取该气体反应的化学方程式 ;
③生成的气体先通过盛 的洗气瓶,除去 气体。
④用湿润的 试纸验满。
⑤写出尾气吸收反应的化学方式 。 sxd19851年前1
sxd19851年前1 -
 easter- 共回答了14个问题
easter- 共回答了14个问题 |采纳率85.7%1年前查看全部
- 一种固体两种液体能不能构成原电池?比如锌粒和稀硫酸中加入NaCl
 jy000590181年前3
jy000590181年前3 -
 313978374 共回答了25个问题
313978374 共回答了25个问题 |采纳率84%电极必须要2个.1年前查看全部
- (2005•武汉)在通常状况下,氢气是一种无色、无味的气体,难溶于水,密度比空气小.实验室常用锌粒和稀硫酸反应制取氢气:
 (2005•武汉)在通常状况下,氢气是一种无色、无味的气体,难溶于水,密度比空气小.实验室常用锌粒和稀硫酸反应制取氢气:Zn+H2SO4═ZnSO4+H2↑.为了得到0.20s氢气,某请回答下列问题:
(2005•武汉)在通常状况下,氢气是一种无色、无味的气体,难溶于水,密度比空气小.实验室常用锌粒和稀硫酸反应制取氢气:Zn+H2SO4═ZnSO4+H2↑.为了得到0.20s氢气,某请回答下列问题:
(1)该同学可以用排水(或向下排空气)排水(或向下排空气)法收集氢气(填一种);
(2)实际产生氢气的质量是多少?(精确到0.01g) 大大笨女人1年前1
大大笨女人1年前1 -
 书夫 共回答了11个问题
书夫 共回答了11个问题 |采纳率100%解题思路:(1)根据氢气的性质结合收集气体的方法考虑;
(2)由图示可知,完全反应后,剩余杂质的质量为0.20g,据此计算出锌的质量;然后利用锌与稀硫酸反应的化学方程式和参与反应的锌的质量,就可计算出实际产生氢气的质量.(1)由题意可知,氢气难溶于水,故可用排水法收集;氢气密度比空气小,故可用向下排空气法收集;故答案为:排水(或向下排空气)
(2)设实际生成氢气的质量为x,
依题意可知,锌粒中杂质的质量为0.20g,那么锌的质量为8.00g-0.20g═7.80g.
Zn+H2SO4=ZnSO4+H2↑
652
7.8g x
∴
65
2=
7.8g
x,
解之得:x=0.24g.
答:实际产生氢气的质量是0.24g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查学生利用化学方程进行计算的能力.学生要正确识图和分析数量关系,从图中找出有效数据进行计算,不要被其它数据干扰思维.1年前查看全部
- 稀硫酸和锌粒,反应制取的氢气中,是都夹带有水蒸气?
 xhomme1年前1
xhomme1年前1 -
 砸人ff总裁 共回答了17个问题
砸人ff总裁 共回答了17个问题 |采纳率94.1%是的,只要是溶液状态下的反应,产生的气体中都会混有水蒸气.同时当气体通过含溶液的吸气瓶时也会带出少量水蒸气的!1年前查看全部
- 将锌粒投入稀硫酸溶液中,完全反应后溶液的质量是( )
将锌粒投入稀硫酸溶液中,完全反应后溶液的质量是( )
A不变 B减轻 C增加 D不能确定 阿牛ANIU1年前1
阿牛ANIU1年前1 -
 子非鱼之薇 共回答了18个问题
子非鱼之薇 共回答了18个问题 |采纳率100%是C.吧
题目中问的应该是跟硫酸比较的
理由是因为硫酸锌的质量大于硫酸的质量1年前查看全部
- 对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是( )
对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是( )
①升高温度;②改用100mL 3mol/L盐酸;③改用300mL 1mol/L醋酸;④用等量锌粉代替锌粒;⑤增大压强.
A. ①③④⑤
B. ①②④
C. ①②③④
D. ①②④⑤ yanfen04191年前1
yanfen04191年前1 -
 eaisz 共回答了19个问题
eaisz 共回答了19个问题 |采纳率84.2%解题思路:增大反应速率,可增大固体表面积、升高温度,增大浓度,加入催化剂或形成原电池反应等,以此解答该题.①升高温度,活化分子百分数增大,反应速率增大,故正确;
②改用100mL 3mol/L盐酸,浓度增大,反应速率增大,故正确;
③醋酸为弱酸,改用300mL 1mol/L醋酸,氢离子浓度减小,则反应速率减小,故错误;
④用等量锌粉代替锌粒,固体表面积增大,反应速率增大,故正确;
⑤反应在溶液中进行,增大压强,溶液浓度基本不变,则反应速率基本不变,故错误.
故选B.点评:
本题考点: 化学反应速率的影响因素.
考点点评: 本题考查化学反应速率的影响,侧重于基本理论知识的理解和运用的考查,为高频考点,难度不大,注意相关基础知识的积累.1年前查看全部
- 25℃时,0.1mol/L的醋酸溶液和pH=1的醋酸溶液各100ml,分别与足量的锌粒反应,产生的气体体积前者比后者(填
25℃时,0.1mol/L的醋酸溶液和pH=1的醋酸溶液各100ml,分别与足量的锌粒反应,产生的气体体积前者比后者(填多,相等,少).为什么?
 烂瓜崽1年前2
烂瓜崽1年前2 -
 雪婉婷 共回答了15个问题
雪婉婷 共回答了15个问题 |采纳率93.3%少.因为醋酸是弱电解质,只有少量才会电离.前者的氢离子总量是0.1,而后者由于只有部分电离,它表现出了0.1,但其实它的仓库里还储存着很多很多,所以前者比后者和足量的锌粒反应,产生的气体要少得多.1年前查看全部
- 将16g含有杂质的锌粒投入到盛有足量稀硫酸的烧杯中(杂质跟稀硫酸不反应).测得加入锌粒前烧杯和稀硫酸的总质量为200g,
将16g含有杂质的锌粒投入到盛有足量稀硫酸的烧杯中(杂质跟稀硫酸不反应).测得加入锌粒前烧杯和稀硫酸的总质量为200g,反应停止后,烧杯和烧杯内剩余物的总质量为215.6g.求:
(1)反应中生成氢气的质量;______
(2)这16g含杂质的锌粒中金属锌的质量分数.______. 潇然991年前1
潇然991年前1 -
 honzp 共回答了20个问题
honzp 共回答了20个问题 |采纳率90%解题思路:根据题意,由于锌与硫酸反应放出氢气而使锌完全反应前后物质的总质量有所减小,减小的质量即放出氢气的质量,运用质量守恒定律,求出氢气质量;然后由氢气质量,根据反应的化学方程式,计算出含杂质的锌粒中金属锌的质量即可求得含杂质的锌粒中金属锌的质量分数.(1)根据质量守恒定律,反应中生成氢气的质量=16g+200g-215.6g=0.4g;(2)设含杂质的锌粒中金属锌的质量为xZn+H2SO4═ZnSO4+H2↑65&nbs...
点评:
本题考点: 含杂质物质的化学反应的有关计算;根据化学反应方程式的计算.
考点点评: 利用质量守恒定律求出反应放出氢气的质量,是进行后面计算的基础,体现出运用知识分析问题的能力.1年前查看全部
- 为什么把锌粒放入盛有盐酸的试管中,加入几滴CuCl2溶液,气泡放出速率加快 急……
 明明知道薇的心1年前2
明明知道薇的心1年前2 -
 xy125548537 共回答了20个问题
xy125548537 共回答了20个问题 |采纳率80%置换出铜,附在锌表面,形成了原电池.1年前查看全部
- 利用化学方程式计算题1.制取标准状况下的氢气(密度为0.0899g/L)11.2L,需要多少克锌粒跟盐酸反应?(Zn+H
利用化学方程式计算题
1.制取标准状况下的氢气(密度为0.0899g/L)11.2L,需要多少克锌粒跟盐酸反应?(Zn+H2SO4=ZnSO4+H2)
2.若充分燃烧8g氢气,在标准状况下,最少需要氧气多少升(标准状况下氧气的密度约为1.43g/L)? fenglin12151年前1
fenglin12151年前1 -
 romanticgc4 共回答了28个问题
romanticgc4 共回答了28个问题 |采纳率89.3%1第一个32.5g
算出氢气质量1g
2 8g氢气需要64g氧气转化以下1年前查看全部
- 用水吸收标准状况下的5.6L的氯化氢气体,制成200ML溶液,在所得的溶液中加入6.5g锌粒,充分反应后,计算溶液中Zn
用水吸收标准状况下的5.6L的氯化氢气体,制成200ML溶液,在所得的溶液中加入6.5g锌粒,充分反应后,计算溶液中Zn2+ H+ Cl-的物质的量浓度分别为多少?(溶液的体积变化忽略不计)
 懒懒梦1年前6
懒懒梦1年前6 -
 请叫我王丽娟 共回答了14个问题
请叫我王丽娟 共回答了14个问题 |采纳率100%5.6LHCl的物质的量是5.6÷22.4=0.25mol,6.5gZn是0.1mol,所以盐酸过量
Zn+ 2HCl= ZnCl2+H2↑
1mol 2mol 1mol
0.1mol n m n=0.2mol m=0.1mol
所以c(Zn2+)=0.1÷0.2=0.5mol/L
(cH+)=(0.25-0.2)÷0.2=0.25mol/L
c(Cl-)=0.25÷0.2=1.25mol/L1年前查看全部
- 实验室可用锌粒和稀硫酸(H2SO4)反应制取得到硫酸锌(ZnSO4)和最轻的气体氢气.若用去6.5克锌,则得到多
 tonton20501年前4
tonton20501年前4 -
 可爱kk兔子 共回答了21个问题
可爱kk兔子 共回答了21个问题 |采纳率85.7%问题也没啊?》
是不是H2so4+Zn=So4zn+H2
设H2为x克.
104.5+6.5=161+2x
x=2.51年前查看全部
- 铝与盐酸反应、铝与氢氧化钠溶液反应、锌粒与氯化铜溶液反应的化学方程式和离子方程式各是什么?
 啾啾鳞1年前1
啾啾鳞1年前1 -
 神秘dē猫 共回答了10个问题
神秘dē猫 共回答了10个问题 |采纳率80%2Al+6HCl===2AlCl3+3H2↑
2Al+6H+===2Al3++3H2↑
2Al+ 2NaOH + 2H2O=== 2NaAlO2+ 3H2↑
2Al+ 2OH-+2H2O===2AlO2-+3H2↑
Zn+CuCl2===Cu+ZnCl2
Zn+Cu2+===Cu+Zn2+1年前查看全部
- 6.5g锌粒与足量的稀硫酸完全反应后,可生成多少克硫酸锌和多少克氢气?氢气合多少升?
6.5g锌粒与足量的稀硫酸完全反应后,可生成多少克硫酸锌和多少克氢气?氢气合多少升?
(标准状况下,氢气的密度约为0.09克/升) 福音谷G1年前1
福音谷G1年前1 -
 高虹 共回答了17个问题
高虹 共回答了17个问题 |采纳率88.2%解题思路:根据锌与硫酸反应的方程式,由锌的质量可以求出生成的氢气和硫酸锌的质量,根据公式m=ρv即可解的氢气质量;设制得氢气的质量为x,硫酸锌的质量为y
Zn+H2SO4═ZnSO4+H2↑
65 161 2
6.5g y x
[65/6.5g=
2
x],[65/6.5g=
161
y]
解得 x=0.2g y=16.1g
m=ρv故v=[m/ρ]=[0.2g/0.09g/L]=2.22L,
答:生成硫酸锌16.1g,生成氢气0.2g,合2.22L.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查学生对化学方程式的计算能力.学生需正确书写出化学方程式,并能正确运用公式m=ρv进行计算,才能正确答题1年前查看全部
- 把12.1克铁屑与锌粒的混合物投入足量的稀硫酸中,充分反应后,金属全部溶解,在标准状况下
把12.1克铁屑与锌粒的混合物投入足量的稀硫酸中,充分反应后,金属全部溶解,在标准状况下
共收集到气体4.48升,求混合物中铁的质量分数 wwm4311年前1
wwm4311年前1 -
 1986120212 共回答了19个问题
1986120212 共回答了19个问题 |采纳率78.9%设混合物中含锌的物质的量为x、含铁的物质的量为y
则有:65g/mol × x + 56g/mol × y =12.1g ----(1)
Zn + H2SO4=ZnSO4 + H2 ↑
1 1
x x
Fe+ H2SO4=FeSO4 + H2 ↑
1 1
y y
x + y = 4.48L ÷ 22.4L/mol=0.2mol --------(2)
联立(1)(2)解得
X=0.1mol Y=0.1mol
则混合物中铁的质量=0.1mol × 56g/mol=5.6g
混合物中铁的质量分数=5.6g ÷ 12.1g × 100%=46.3%
答:混合物中铁的质量分数为46.3%1年前查看全部
- 在天平的两个托盘上各放一个烧杯,杯中盛有相同的稀硫酸,此时天平平衡.如果一边放少许锌粒,另一边放入相同质量的铁,两者完全
在天平的两个托盘上各放一个烧杯,杯中盛有相同的稀硫酸,此时天平平衡.如果一边放少许锌粒,另一边放入相同质量的铁,两者完全溶解后,天平指针( )
A.偏向有锌的一边
B.偏向有铁的一边
C.不偏转
D.无法判断 断翼之虎1年前1
断翼之虎1年前1 -
 嘿嘿_呵呵 共回答了26个问题
嘿嘿_呵呵 共回答了26个问题 |采纳率92.3%解题思路:根据信息:足量稀盐酸,投入等质量的锌和铁可分析出关键在于产生氢气的多少,来判断天平偏转情况.由于投入等质量的锌和铁,所以关键看谁产生氢气多,哪一边就轻,由于铁产生的氢气比锌多,所以最后偏向于锌.
故选:A.点评:
本题考点: 金属的化学性质.
考点点评: 在学习中我们应记住一些常用的数字,如要得到两份质量的氢气,需要铁56份,锌65份,铝18份,镁24份,以便在做题时能方便使用.1年前查看全部
- (2013•嘉兴)往一定量的稀硫酸中加入过量的锌粒,如图是反应过程中某种量Y随加入锌粒的质量变化的关系,则Y不可能表示(
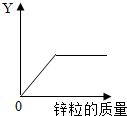 (2013•嘉兴)往一定量的稀硫酸中加入过量的锌粒,如图是反应过程中某种量Y随加入锌粒的质量变化的关系,则Y不可能表示( )
(2013•嘉兴)往一定量的稀硫酸中加入过量的锌粒,如图是反应过程中某种量Y随加入锌粒的质量变化的关系,则Y不可能表示( )
A.溶液中水的质量
B.生成硫酸锌的质量
C.参加反应的硫酸质量
D.生成氢气的质量 这路没有尽1年前1
这路没有尽1年前1 -
 可怜的狮城MM 共回答了20个问题
可怜的狮城MM 共回答了20个问题 |采纳率90%解题思路:根据锌和稀硫酸反应生成硫酸锌和氢气,溶液中的水不参加反应,并结合具体选项分析解答.A、往一定量的稀硫酸中加入过量的锌粒,无水生成,且溶液中的水也不参加反应,所以水的质量不随着反应的进行而有所变化,和图象不相符,故符合题意;
B、锌和稀硫酸反应生成硫酸锌和氢气,所以随着反应的进行硫酸锌的质量逐渐增加,当硫酸反应完毕,硫酸锌的质量不再增加,其变化与图象相符,不符合题意;
C、锌和稀硫酸反应,所以随着锌质量的增加,参加反应的硫酸质量逐渐增加,当硫酸反应完毕,不再变化,其变化与图象相符,不符合题意;
D、锌和稀硫酸反应生成硫酸锌和氢气,所以随着反应的进行氢气的质量逐渐增加,当硫酸反应完毕,氢气的质量不再增加,其变化与图象相符,不符合题意;
故选A.点评:
本题考点: 金属的化学性质.
考点点评: 了解锌和稀硫酸反应的原理,并能结合图象正确分析各个量在反应中的变化情况,考查了学生分析和解决问题的能力.1年前查看全部
- 甲、乙两烧杯中分别盛放500mL等物质的量浓度的稀硫酸,向甲烧杯中加入mg铁粉,向乙烧杯加mg锌粒,完全反应后发现有一烧
甲、乙两烧杯中分别盛放500mL等物质的量浓度的稀硫酸,向甲烧杯中加入mg铁粉,向乙烧杯加mg锌粒,完全反应后发现有一烧杯中仍有金属剩余,若H2SO4的物质的量浓度为xmol·L-1,则x的范围是
 桃花梦梦1年前1
桃花梦梦1年前1 -
 ho6ho630 共回答了22个问题
ho6ho630 共回答了22个问题 |采纳率95.5%因为锌的相对原子质量为64,铁为56,故剩余的为铁,因为H2SO4的物质的量浓度为xmol·L-1,所以H2SO4为0.5xmol,反应的铁为28xg,锌为32xg,所以28x<m,32x≥m,联立解得m/28>x≥m/321年前查看全部
- 稀盐酸与锌粒混合的现象是什么?还有稀盐酸和碳酸钠粉末混合的现象是什么?
稀盐酸与锌粒混合的现象是什么?还有稀盐酸和碳酸钠粉末混合的现象是什么?
具体点,还有稀盐酸和碳酸钠粉末混合后生成了什么,用什么检验? gongfu8081年前2
gongfu8081年前2 -
 这个不太冷 共回答了13个问题
这个不太冷 共回答了13个问题 |采纳率84.6%都是冒泡.一个是氢气,另一个是二氧化碳,可以通入氢氧化钙溶液,会有浑浊出现.1年前查看全部
大家在问
- 1有一串数4,9,13,22,35,57,92,...,问这串数中,第2003个数除以3后所得的余数是几?
- 28.5mb+1.87gb等于多少
- 34.5MB等于几本书
- 4(吉+祥)*32-吉=2000 (吉+祥)*31+祥=2000 算式中的“吉”“祥”各表示一个两位数,问它们各是多少?
- 5当集合Df包含于集合Y时.映射f:X→Y是不是与映射f:X→Df一样?
- 6一根空心管长两米,内直径是10厘米,外直径是20厘米,如果每立方米港才重7.8克,这个钢材重多少千克?
- 7初三化学,总结酒精的性质
- 81molCACL2中含有A.6.02*10^23个CACL2分子B.6.02*10^23个氯离子C.2mol氯离子D.3
- 91.不能说明分之间有间隔的事实是
- 10这个向量题怎么做,问的是a+b的模吗?求详细解答谢谢
- 11一般过去式的一个极小问题they missed the bus and walk home.这句话walk为什么不用过去
- 12与传统能源相对的新能源有哪些
- 13My brother ____to school tomorrow because he_____ill A isn't
- 14(2+5/18×9/10)÷18
- 15求向量的模向量(2,1,2)的模是多少?

