化学电池在通信、交通和日常生活中有着广泛的应用,但是,废弃电池所带来的环境污染问题也日益突出.已知镍镉(Ni﹣Cd)电池
 boshideqizi2022-10-04 11:39:541条回答
boshideqizi2022-10-04 11:39:541条回答 化学电池在通信、交通和日常生活中有着广泛的应用,但是,废弃电池所带来的环境污染问题也日益突出.已知镍镉(Ni﹣Cd)电池中发生的化学反应为:Cd+2NiO(OH)+2H 2 O 2Ni(OH) 2 +Cd(OH) 2 其中Ni(OH) 2 和Cd(OH) 2 均难溶于水,但能溶于酸. 2Ni(OH) 2 +Cd(OH) 2 其中Ni(OH) 2 和Cd(OH) 2 均难溶于水,但能溶于酸. |
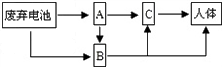 |
| 请回答: (1)镍镉电池充电时,其能量的转化是由 _________ 能转化为 _________ 能; (2)一节废镍镉电池会使1m 2 的耕地失去使用价值,要酸性土壤中,这种污染尤为严重.这是因为 _____ ____ . (3)废弃的镍镉电池所产生的Cd 2+ 污染,可导致人体患骨痛病及肝、肾、肺病变,其中Cd 2+ 进入人体的途径如上图所示:A、B、C代表Cd 2+ 污染传递的载体,如果A代表土壤;则B代表 ____ _____ ;C代表 ___ ______ . (4)你认为减少甚至消除废弃电池污染,应采取的措施是: __ _______ . |

已提交,审核后显示!提交回复
共1条回复
 WAL998 共回答了18个问题
WAL998 共回答了18个问题 |采纳率94.4%- (1)电能;化学;
(2)Ni(OH) 2 和Cd(OH) 2 能溶于酸溶液,导致这些重金属离子污染的扩散;
(3)水体; 生物体(或食物);
(4)集中回收,处理废旧电池; 研制高效无污染的电池. - 1年前
相关推荐
- 给定一个化学电池总反应式 如何判断向哪边是充电反应
给定一个化学电池总反应式 如何判断向哪边是充电反应
举几个常见的例子也好 爱上yu的猫1年前1
爱上yu的猫1年前1 -
 ourschool 共回答了20个问题
ourschool 共回答了20个问题 |采纳率95%能自发地氧化还原反应的方向是放电反应,或者说能放出能量的方向.
充电反应则相反
如氢氧燃料电池H2+O2=H2O很常见1年前查看全部
- 化学电池在通讯、交通及日常生活中有着广泛的应用。
化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍镉(Ni Cd)电池,其电池总反应可以表示为:
Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H 2 O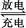 2Ni(OH) 2 +Cd(OH) 2
2Ni(OH) 2 +Cd(OH) 2
已知Ni(OH) 2 和Cd(OH) 2 均难溶于水但能溶于酸,以下说法中正确的是( )
①以上反应是可逆反应
②以上反应不是可逆反应
③充电时化学能转变为电能
④放电时化学能转变为电能
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重。这是因为 。A.①③ B.②④ C.①④ D.②③  jzhou071年前1
jzhou071年前1 -
 zjtwb1 共回答了15个问题
zjtwb1 共回答了15个问题 |采纳率86.7%1年前查看全部
- 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中
 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.
(1)a极是______极,b极是______极,电极反应式分别为______,______.
(2)氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制.常用的燃料,往往是某些碳氢化合物,如甲烷(天然气)、汽油等.请写出将图中H2换成CH4时所构成的甲烷燃料电池中a极的电极反应式:______.此时电池内总的反应方程式为______. pengmian19861年前1
pengmian19861年前1 -
 崔烟绕 共回答了18个问题
崔烟绕 共回答了18个问题 |采纳率83.3%解题思路:(1)氢氧燃料电池中,原电池工作时,氢氧燃料电池的总反应为2H2+O2=2H2O;通入氢气的一极a为电源的负极,发生氧化反应,电极反应式为:H2-2e-+2OH-=2H2O,通入氧气的一极b为原电池的正极,
电极反应式为:O2+4e-+2H2O=4OH-;
(2)氢气换成甲烷是甲烷和氧气反应生成二氧化碳和水的氧化还原反应,图中电解质溶液是碱性溶液,依据原电池的原理,结合元素化合价变化分析失电子的物质甲烷在负极a发生氧化反应,氧气再正极b发生还原反应;(1)氢氧燃料电池中,通入氢气的一极为电源的负极,通入氧气的一极为原电池的正极,由于电解质溶液呈碱性,则负极电极反应式为:2H2-4e-+4OH-=4H2O(或H2-2e-+2OH-=2H2O),正极电极反应式为:O2+4e-+2H2O=4OH-,
故答案为:负;正;2H2-4e-+4OH-=4H2O(或H2-2e-+2OH-=2H2O);O2+4e-+2H2O=4OH-;
(2)图中H2换成CH4时所构成的甲烷燃料电池中,甲烷燃烧生成二氧化碳和水,二氧化碳和氢氧化钾反应生成碳酸钾和水,所以电池的反应的离子方程式为:CH4+2O2+2OH-=CO32-+3H2O
其中正极上是氧气得到电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-;电池总反应的离子方程式减去正极电极反应×2,得到负极电极反应:CH4+10OH--8e-=CO32-+7H2O;
故答案为:CH4+10OH--8e-=CO32-+7H2O、CH4+2O2+2OH-=CO32-+3H2O;点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了原电池的工作原理的应用,电极名称,电极判断,电极反应,电池反应,熟练掌握原电池的基本知识,分清化合价变化判断氧化反应、还原反应、电子守恒是解题关键.1年前查看全部
- 原电池中都是电解质得电子,而化学电池都是正极材料得电子吗?为什么?
 dionysoszh1年前2
dionysoszh1年前2 -
 尘风88 共回答了20个问题
尘风88 共回答了20个问题 |采纳率85%1.原电池中不都是电解质得电子
例如金属的吸氧腐蚀,正极得电子为O2
2.电解池中不都是材料得电子
例如惰性电极电解饱和食盐水,阴极是H2O得电子1年前查看全部
- 燃料电池是一种连续的将燃料和氧化剂的化学能直接转化为电能的化学电池.氢气、烃、肼、甲醇等液体或气体,均可以作燃料电池的燃
 燃料电池是一种连续的将燃料和氧化剂的化学能直接转化为电能的化学电池.氢气、烃、肼、甲醇等液体或气体,均可以作燃料电池的燃料.请回答下列问题:
燃料电池是一种连续的将燃料和氧化剂的化学能直接转化为电能的化学电池.氢气、烃、肼、甲醇等液体或气体,均可以作燃料电池的燃料.请回答下列问题:
(Ⅰ)以甲烷和氧气为原料,氢氧化钠溶液为电解质溶液构成电池.写出其正极电极反应式______;
(Ⅱ)以上述电池为电源,石墨为电极电解1L 0.1mol/L的氯化钾溶液.回答下列问题:
(1)写出电解总反应的离子方程式2Cl-+2H2O
2OH-+H2↑+Cl2↑电解 .2Cl-+2H2O;
2OH-+H2↑+Cl2↑电解 .
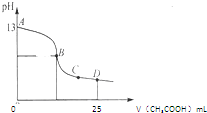
(2)室温时,电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L醋酸,加入醋酸的体积与溶液的pH的关系如图所示(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).
①计算消耗标准状况下甲烷______mL;
②若图中的B点pH=7,则酸碱恰好完全反应的点在______区间(填“AB”、“BC”或“CD”);
③AB区间溶液中各离子浓度大小关系中可能正确的是______;
A.c(K+)>c(OH-)>c (CH3COO-)>c(H+)
B.c(K+)>c(CH3COO-)>c(OH-)>c(H+)
C.c(K+)>c(CH3COO-)=c(OH-)>c(H+) langping1年前1
langping1年前1 -
 娃娃520 共回答了14个问题
娃娃520 共回答了14个问题 |采纳率92.9%解题思路:(Ⅰ)甲烷碱性燃料电池中,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,正极上氧气得电子和水才氢氧根离子;
(Ⅱ)(1)电解时,阳极上氯离子放电、阴极上氢离子放电;
(2)①溶液的pH=13,则溶液中c(OH-)=0.1mol/L,根据氢氧根离子和转移电子之间的关系式计算;
②醋酸钾为强碱弱酸盐,其溶液呈碱性,要使混合溶液呈中性,则醋酸应该稍微过量;
③AB区间溶液呈碱性,则c(OH-)>c(H+),再根据溶液中的溶质及电荷守恒判断.(I)甲烷燃料碱性电池中,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(II)(1)电解时,阳极上氯离子放电、阴极上氢离子放电,则电池反应式为2Cl-+2H2O
电解
.
2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O
电解
.
2OH-+H2↑+Cl2↑;
故答案为:;
(2)①根据图示,开始溶液的PH为13,所以氢氧化钾的浓度是0.1mol/L,物质的量是0.1mol,根据电解方程式:2Cl-+2H2O
电解
.
Cl2↑+H2↑+2OH-,转移电子的物质的量是0.1mol,根据电子守恒,转移0.1mol电子消耗标准状况下甲烷的物质的量为0.0125mol,体积为280mL,故答案为:280;
②25mL0.1mol/L的氢氧化钠和0.2mol/L醋酸恰好完全反应时,消耗醋酸的体积是12.5mL,即B点的体积值是12.5mL,此时生成的醋酸钠溶液显碱性,当溶液显中性时,则醋酸的量应该大于12.5mL,所以酸碱恰好完全反应的点处于AB之间,故答案为:AB;
③AB区间的溶液可以是加入醋酸的量很少时的点,也可以是醋酸和氢氧化钠恰好完全反应的点,还可以是醋酸稍过量,溶液仍是碱性时的点,即c(K+)>c(OH-)>c(CH3COO-)>c(H+)(醋酸量很少)或c(K+)>c(CH3COO-)>c(OH-)>c(H+)(恰好反应)或 c(K+)>c(CH3COO-)=c(OH-)>c(H+)(溶液显中性的),故选ABC.点评:
本题考点: 化学电源新型电池;盐类水解的原理;电解原理.
考点点评: 本题考查了原电池和电解池原理,根据得失电子书写甲烷燃料电极反应式,再结合转移电子相等、盐的性质及溶液酸碱性分析解答,题目难度中等.1年前查看全部
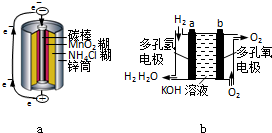
- 锌锰干电池是最早使用的化学电池,其基本构造如图所示.
锌锰干电池是最早使用的化学电池,其基本构造如图所示.
(1)锌锰干电池的负极是______,电路中每通过0.2mole - ,负极质量减少______g;工作时NH 4 + 离子在正极放电产生两种气体,其中一种气体分子是含10e - 的微粒,正极的电极反应式是______.
(2)某研究小组对电池内黑色糊状物进行了下列实验.
电池内黑色糊状物粉末
无色溶液
溶解过滤
黑色残渣
已知:Zn(OH) 2 是两性氢氧化物.完成下列实验报告.
(3)利用残渣中分离出的MnO 2 ,研究其在H 2 O 2 制O 2 过程中的作用.实验装置如右图所示.将等物质的量浓度、等体积H 2 O 2 溶液加入烧瓶中,分别进行2个实验(气体的体积在相同条件下测定).实验步骤 实验现象 实验结论和解释 取少量上述无色溶液于试 管中,逐滴加入NaOH溶液,直至过量,再加热 生成白色沉淀,
______
______无色溶液中存在Zn 2+ 、NH 4 + 离子
检验NH 4 + 离子存在的离子方程式是
______
实验一、二中参加反应的H 2 O 2 的物质的量之比为______,实验二中反应的离子方程式为______.序号 烧瓶中的物质 实验记录 实验结论与解释 实验一 足量MnO 2 收集到56mL气体 MnO 2 做催化剂 实验二 足量MnO 2 和稀硫酸 黑色粉末部分溶解,
收集到112mL气体MnO 2 做氧化剂,生成Mn 2+ 离子 
 X_档案1年前1
X_档案1年前1 -
 秋江带雨 共回答了23个问题
秋江带雨 共回答了23个问题 |采纳率95.7%(1)锌锰干电池的负极是锌,正极为石墨棒,电解质溶液为二氧化锰和氯化铵,负极发生氧化反应,
电极反应式为Zn-2e - =Zn 2+ ,根据电极反应式可知,电路中每通过0.2mole - ,消耗0.1molZn,质量为0.1mol×65g/mol=6.5g,正极发生还原反应,工作时NH 4 + 离子在正极放电产生两种气体,其中一种气体分子是含10e - 的微粒,应为NH 3 ,电极反应式为2NH 4 + +2e - =2NH 3 ↑+H 2 ↑,
故答案为:Zn;6.5;2NH 4 + +2e - =2NH 3 ↑+H 2 ↑;
(2)无色溶液中存在Zn 2+ 、NH 4 + 离子,加入NaOH发生反应Zn 2+ +2OH - =Zn(OH) 2 ↓,有白色沉淀产生,Zn(OH) 2 是两性氢氧化物,继续反应,沉淀溶解,反应为Zn(OH) 2 +2OH - =ZnO 2 2- +H 2 O,然后发生NH 4 + +OH -
△
.
NH 3 ↑+H 2 O,产生有刺激性气味的气体,故答案为:白色沉淀消失,产生有刺激性气味的气体;NH 4 + +OH -
△
.
NH 3 ↑+H 2 O;
(3)实验一反应的方程式为2H 2 O 2
Mn O 2
.
2H 2 O+O 2 ↑,生成56ml氧气,即
0.056L
22.4L/mol =0.0025mol,则消耗的H 2 O 2 物质的量为0.005mol,
实验二反应的方程式为H 2 O 2 +2H + +MnO 2 =Mn 2+ +2H 2 O+O 2 ↑,生成112ml氧气,即
0.112L
22.4L/mol =0.005mol,则消耗的H 2 O 2 物质的量为0.005mol,故答案为:1:1;H 2 O 2 +2H + +MnO 2 =Mn 2+ +2H 2 O+O 2 ↑.1年前查看全部
- 常见的化学电池有哪两种?
 兔毛光子1年前2
兔毛光子1年前2 -
 linda_cai66 共回答了25个问题
linda_cai66 共回答了25个问题 |采纳率96%补充1楼.
铜锌电池工作原理:锌片和铜片在上端用导线连接,下端平行插入稀硫酸.让氧化反应在锌片上进行,锌失电子,(Zn-2e~==Zn2+)电子通过导线向铜片移动,那么在导线中就有电流通过了.在铜片上发生还原反应,(2H++2e~==H2!)
是负号,!是向上箭头.
氢氧电池工作原理和铜锌电池差不多,也是让氧化反应和还原反应在不同区域进行,让电子得失的过程形成电流.这就是化学电池的工作原理.1年前查看全部
- 以下关于能源和环境的叙述中,错误的是 [ ] A.化学电池是化学能转化成
以下关于能源和环境的叙述中,错误的是 [ ]A.化学电池是化学能转化成电能的装置
B.废旧电池的随意丢弃,会带来严重的环境污染问题
C.氢气燃烧的过程,是热能转化成化学能的过程
D.氢能是理想的新型能源,它有放热多、资源丰富、不污染环境等优点 zz烧白猪1年前1
zz烧白猪1年前1 -
 fuxintj 共回答了11个问题
fuxintj 共回答了11个问题 |采纳率100%C1年前查看全部
- (8分)化学电池在通讯、交通及日常生活中有着广泛的应用。 (1)右图是锌锰干电池的基本构造图,关于该
(8分)化学电池在通讯、交通及日常生活中有着广泛的应用。 (1)右图是锌锰干电池的基本构造图,关于该(8分)化学电池在通讯、交通及日常生活中有着广泛的应用。

(1)右图是锌锰干电池的基本构造图,关于该电池的使用和性能,说法 正确的是
正确的是
A.该 电池可充电后反复使用
电池可充电后反复使用
B.该电池可用于闹钟、收音机、照相机等
C.该电池使用后能投入火中,也可投入池塘中
(2)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为: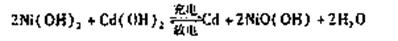
已知Ni(OH) 2 和Cd(OH) 2 均难于溶于但酸,以下说法正确的是 A.以上反应是可逆反应 B.反应环境为碱性
A.以上反应是可逆反应 B.反应环境为碱性
C.电池放电时Cd做负极 D.是一种二次电池
(3)美国阿波罗的氢氧燃料电池是一种新型电源,其构造如图所示,a、b两个电极均由多孔的碳块组成,通入氢气和氧气由孔隙中逸出,并在电极表面发生电极反应而放电。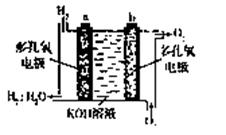
①其电极为a是 极(填正或负)
②若为飞行员提供了360kg的水,则电路中通过了 mol电子。
 hai929131年前1
hai929131年前1 -
 dongsmqs 共回答了21个问题
dongsmqs 共回答了21个问题 |采纳率81%(每空2分)
(1)B(2)B、C、D(3)负 40000
略1年前查看全部
- 短时间里一定采纳)一个化学电池的总反应方程式为:Zn + Cu(2+) ==== Zn(2+) + Cu
短时间里一定采纳)一个化学电池的总反应方程式为:Zn + Cu(2+) ==== Zn(2+) + Cu
一个化学电池的总反应方程式为:Zn + Cu(2+) ==== Zn(2+) + Cu ,该化学电池的组成可能为 ()
A.正极 Cu ,负极 Zn 电解质溶液 H2SO4
B.正极 Mg ,负极 Zn 电解质溶液 CuSO4
C.正极 Zn ,负极 Cu 电解质溶液 ZnCl2
D.正极 Fe ,负极 Zn 电解质溶液 CuCl2
请问答案的理由...
其他几个为什么不对,错在哪..
如何判断这类题目...
希望有人愿意帮忙,分不多但希望愿意帮忙...
短时间里一定采纳.. 蓝晴蜓1年前4
蓝晴蜓1年前4 -
 纪梦释 共回答了17个问题
纪梦释 共回答了17个问题 |采纳率100%答案是D,因为Zn比铁活泼,所以在反应中应该Zn失去电子,电子转移到Fe上,然后由Cu2+得到,变为Cu,答案A也是Zn失去电子,但是溶液是H2SO4,所以反应为Zn + 2H+ ==== Zn2+ + H2,答案B由于Mg比Zn活泼,所以失去电子的是Mg,且Mg应该是负极,所以B是错的,答案C中Zn比Cu活泼,所以Zn应该是负极,在化学电池中总是活泼的失去电子,然后活泼的是负极1年前查看全部
- 化学电池是_________的装置,其反应的基础是_________ 。写出铜锌原电池(稀硫酸为介质)的电极反应:正极_
化学电池是_________的装置,其反应的基础是_________ 。写出铜锌原电池(稀硫酸为介质)的电极反应:正极__________________,负极__________________。  qqlonghui1年前1
qqlonghui1年前1 -
 流浪在英伦 共回答了18个问题
流浪在英伦 共回答了18个问题 |采纳率83.3%化学能转化成电能;氧化还原反应;Zn-2e - =Zn 2+ ;2H + +2e - =H 2 ↑1年前查看全部
- 以下关于能源和环境的叙述中,错误的是( ) A.化学电池是化学能转化成电能的装置 B.氢气燃烧的过程,是热能转化成化学
以下关于能源和环境的叙述中,错误的是( ) A.化学电池是化学能转化成电能的装置 B.氢气燃烧的过程,是热能转化成化学能的过程 C.氢能是理想的新型能源,它有放热多、资源丰富、不污染环境等优点 D.大量废旧电池的随意丢弃,会带来严重的环境污染问题  a1m10071年前1
a1m10071年前1 -
 平静的坏心情 共回答了15个问题
平静的坏心情 共回答了15个问题 |采纳率100%A、化学电池是把化学能转化成电能的装置,故正确;
B、氢气燃烧的过程,是化学能转化成热能的过程,故错误;
C、氢的燃烧值高,且产物是水,不污染环境,故正确;
D、废旧电池中含有金属汞,它是重金属,有毒,所以不能随意丢弃,要回收,故正确.
故选B1年前查看全部
- 化学电池在通迅、交通及日常生活中有着广泛的应用.
 化学电池在通迅、交通及日常生活中有着广泛的应用.
化学电池在通迅、交通及日常生活中有着广泛的应用.
(1)如图a是普通锌锰干电池的基本构造图.
①该电池的负极材料是______.其电极反应方程式为:______.
②关于该电池的使用和性能,说法正确的是______.
A.该电池可充电后反复使用
B.该电池可用于闹钟、收音机、照相机等
C.该电池使用后可烧毁,也可埋入土壤中
(2)氢氧燃料电池是一种新型电源,其构造如图b所示:a、b两个电极均由多孔的碳块组成,通入的氢气和氧气由孔隙中逸出,并在电极表面发生电极反应而放电.
①电极b是______极.(填“正”或“负”)
②若为飞行员提供了360kg的水,则电路中通过了______mol电子.
(3)化学能在一定的条件下可以转化为电能.现有如下两个反应:
A.2FeCl3+Cu═2FeCl2+CuCl2;
B.Na2CO3+2HCl═2NaCl+H2O+CO2↑.
根据两个反应的本质判断,您认为可以设计成原电池的是______(填反应序号),理由是______. ysh10171年前1
ysh10171年前1 -
 sunming1124 共回答了24个问题
sunming1124 共回答了24个问题 |采纳率95.8%解题思路:(1)①锌锰干电池中负极材料是锌,电极反应式为Zn-2e-=Zn2+;
②A.干电池属于一次电池;
B.该电池可用于闹钟、收音机、照相机等;
C.该电池会污染环境;
(2)①燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极;
②根据水和转移电子之间的关系式计算;
(3)原电池反应必须是自发进行的放热的氧化还原反应.(1)①锌锰干电池中,锌易失电子发生氧化反应而作负极,所以负极材料是Zn,负极上电极反应式为Zn-2e-=Zn2+,故答案为:Zn;Zn-2e-=Zn2+;
②A.该电池属于一次电池,不能反复使用,故A错误;
B.该电池中产生的电能较少,所以可用于闹钟、收音机、照相机等,故B正确;
C.该电池中含有酸性物质、锰等金属,会污染地下水和土壤,所以不能焚烧、埋入土壤,故C错误;
故选B;
(2)①该装置是碱性燃料电池,负极上电极反应式为H2+2OH--2e-=2H2O,正极上电极反应式为O2+2H2O+4e-=4OH-,通入氧气的电极为正极,所以b是正极,
故答案为:正;
②该反应的电池反应式为:2H2+O2=2H2O,水的物质的量=[360000g/18g/mol]=20000mol,
设转移电子的物质的量为x,
2H2+O2=2H2O 转移电子
2mol 4mol
20000mol x
2mol:4mol=20000mol:x,
x=[20000mol×4mol/2mol]=40000mol,
故答案为:40000;
(3)原电池反应必须是自发进行的放热的氧化还原反应,
A.2FeCl3+Cu═2FeCl2+CuCl2属于自发进行是放热的氧化还原反应,所以能设计成原电池;
B.Na2CO3+2HCl═2NaCl+H2O+CO2↑不是氧化还原反应,所以不能设计成原电池,
所以A能设计成原电池,
故答案为:A;反应A是氧化还原反应,有电子转移.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理,知道燃料电池中正负极的判断方法,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,知道原电池反应特点,题目难度不大.1年前查看全部
- 化学电池在通讯、交通及日常生活中有着广泛的应用。
化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)下列相关说法正确的是________。
A.通过某种电池单位质量或单位体积所能输出能量的多少,可以判断该电池的优劣
B.二次电池又称充电电池或蓄电池,这类电池可无限次重复使用
C.除氢气外,甲醇、汽油、氧气等都可用作燃料电池的燃料
D.近年来,废电池必须进行集中处理的问题被提到议事日程,其首要原因是电池外壳的金属材料需要回收
(2)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为:
2Ni(OH) 2 +Cd(OH) 2 Cd+2NiO(OH)+2H 2 O
Cd+2NiO(OH)+2H 2 O
已知Ni(OH) 2 和Cd(OH) 2 均难溶于水,但能溶于酸,以下说法正确的是___。
A.以上反应是可逆反应
B.反应环境为碱性
C.电池放电时Cd作负极
D.该电池是一种二次电池
(3)在宇宙飞船和其他航天器上经常使用的氢氧燃料电池是一种新型电源,其构造如图所示:a、b两个电极均由多孔的碳块组成,通入的氢气和氧气由孔隙中逸入,并在电极表面发生反应而放电。
①a电极是电源的________极;
②若该电池为飞行员提供了360kg的水,则电路中通过了________mol电子。 Wtpda1年前1
Wtpda1年前1 -
 8490793 共回答了20个问题
8490793 共回答了20个问题 |采纳率95%(1)A (2)B、C、D (3)负40000
(1)B:二次电池可以多次但不可能无限次重复使用。C:氧气可用作燃料电池的氧化剂,而不是燃料。D:废旧电池进行集中处理的主要原因是电池中含有汞、镉和铅等金属离子,它们会对土壤、水源造成污染。
(2)两个方向的条件不同,不能称为可逆反应。
(3)电路中通过的电子的物质的量为:360000 g÷18 g/mol×2=40000 mol。1年前查看全部
- (2009•宿迁)化学电池是一类重要的能源,按工作性质可分为:一次电池(例如干电池)和二次电池(可充电电池,例如铅酸蓄电
(2009•宿迁)化学电池是一类重要的能源,按工作性质可分为:一次电池(例如干电池)和二次电池(可充电电池,例如铅酸蓄电池).请简要回答下列各空
(1)铅酸蓄电池放电时能量转变是______能转变成______能.
(2)宿迁经济开发区某铅酸电池厂生产电池用的是28%的稀硫酸,将浓硫酸稀释配制成该稀硫酸时,一定将______沿器壁缓慢注入______中,并不断搅拌以防液体飞溅.
(3)使用铅酸蓄电池的电动车与使用汽油燃料的轻便摩托车相比,电动车不会产生
______等有害气体,但电池对土壤和水体的污染是不容忽视的.
(4)废旧干电池中许多物质是可以回收利用的.某种型号干电池的剖面如图所示.现对干电池内的填充物(MnO2、C、可溶性糊状物和水)进行探究,请填空: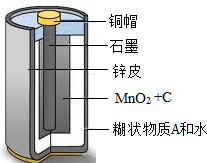
1取填充物溶于水,过滤、洗涤、干燥,得到黑色不溶物.再经过______处理,即可得到纯净的MnO2;
2取①中过滤得到的滤液,分为两份,一份加入烧碱溶液,加热产生一种刺激性气味的气体,该气体的水溶液pH>7,且常用作化
肥,则该气体的化学式为______;另一份加入AgNO3溶液,产生白色沉淀,滴加稀HNO3沉淀不溶解,则可推知糊状物的化学式为______. 飞来之脚1年前1
飞来之脚1年前1 -
 浪迹ffqaw 共回答了25个问题
浪迹ffqaw 共回答了25个问题 |采纳率92%解题思路:(1)根据能量转化方式,铅酸蓄电池放电时化学能转化成电能
(2)稀释浓硫酸时要 根据浓硫酸的密度和溶于水放热考虑稀释的顺序
(3)从汽油燃烧时能生成一氧化碳、一氧化氮等物质方面考虑
(4)填充物主要是二氧化锰和碳,要除去碳就要用高温加热,使碳氧化而除去;
铵盐能和显碱性的物质反应生成有刺激性气味的气体氨气,氨气的水溶液显碱性,氯化银是不溶于稀硝酸的白色沉淀.(1)铅酸蓄电池放电时是将化学能转化成电能.故填:化学;电.
(2)将浓硫酸稀释配制成该稀硫酸时,一定将浓硫酸沿器壁缓慢注入水中,并不断搅拌以防液体飞溅.故填:浓硫酸;水.
(3)电动车与使用汽油燃料的轻便摩托车相比,电动车不会产生一氧化碳、一氧化氮等有害气体.故填:一氧化碳、一氧化氮.
(4)①灼烧可以除去二氧化锰中的碳.故填:灼烧.
②铵盐能和显碱性的物质反应生成有刺激性气味的气体氨气,氨气的水溶液显碱性,氯化银是不溶于稀硝酸的白色沉淀.
故填:NH3;NH4Cl.点评:
本题考点: 浓硫酸的性质及浓硫酸的稀释;混合物的分离方法;常见气体的检验与除杂方法;证明盐酸和可溶性盐酸盐;有关化学式的计算和推断;物质发生化学变化时的能量变化.
考点点评: 解答本题要掌握能量的转化关系,稀释浓硫酸的方法,充分理解铵盐的检验方法等,本题综合性较强,有一定的难度.1年前查看全部
- 如图所示是一种环保型手电筒,这种手电筒不用化学电池作为电源。使用时,只要将它来回摇晃,它的灯泡就能发光;并且来回摇晃得越
如图所示是一种环保型手电筒,这种手电筒不用化学电池作为电源。使用时,只要将它来回摇晃,它的灯泡就能发光;并且来回摇晃得越快,灯泡就越亮。这种手电筒是利用______________现象制成的,其能量转化是___________能转化成电能。 
 xlbkl1年前1
xlbkl1年前1 -
 香榭舍亭 共回答了18个问题
香榭舍亭 共回答了18个问题 |采纳率88.9%电磁感应;机械1年前查看全部
- (2009•青浦区一模)如图所示,是一种内电阻可调的化学电池,可用来验证闭合电路欧姆定律.A、B为电池的正、负极,C、D
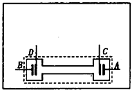 (2009•青浦区一模)如图所示,是一种内电阻可调的化学电池,可用来验证闭合电路欧姆定律.A、B为电池的正、负极,C、D为靠近正、负极板的两个探极,目的是为了测量电池的内部电压.向电池内打气,可以改变电解质溶液液面的高低,从而改变电池的内电阻.
(2009•青浦区一模)如图所示,是一种内电阻可调的化学电池,可用来验证闭合电路欧姆定律.A、B为电池的正、负极,C、D为靠近正、负极板的两个探极,目的是为了测量电池的内部电压.向电池内打气,可以改变电解质溶液液面的高低,从而改变电池的内电阻.
现在要验证闭合电路中内电压和外电压之和等于电源电动势,除该电池以外,还备有理想电流表A和理想电压表V各一个、一个定值电阻R=5Ω、电键S和导线若干.正确连接电路以后,得到表中实验数据.
(1)右图是该化学电池的俯视示意图,请用上述器材符号在方框内画出实验电路原理图;次数 1 2 3 4 5 电流表(A) 0.20 0.16 0.12 0.10 0.08 电压表(V) 1.01 1.20 1.40 1.50 1.59
(2)该电池的电动势E=______V;
(3)上述实验中第2次操作时该化学电池的内阻r=______Ω tt福tt福1年前1
tt福tt福1年前1 -
 jiejie20021983 共回答了18个问题
jiejie20021983 共回答了18个问题 |采纳率100%解题思路:(1)由题意可知实验原理,则由原理可得出实验选用的仪器及接法;
(2)由实验中每次的测量数据,由闭合电路欧姆定律可求得电源的电动势,求出几次实验中的平均值可得出电动势;
(3)由闭合电路欧姆定律可求得该化学电池的内阻. (1)由题意可知,电压表用来测内电阻上的电压;而路端电压由欧姆定律求出,故电流表与定值电阻串连接在电源两端,电压表测内电压,故原理图如图所示:
(1)由题意可知,电压表用来测内电阻上的电压;而路端电压由欧姆定律求出,故电流表与定值电阻串连接在电源两端,电压表测内电压,故原理图如图所示:
(2)由E=U内+IR可得:
电动势分别为:2.1V、2.1V、2.0V、2.0V、1.99V;
则平均值为:E=[2.1+2.1+2+2+1.99/5]V=2.0V;
(3)第二次操作时的内阻r=[U/I]=[1.2/0.16]Ω=7.5Ω
故答案为:(2)2.0;(3)7.5点评:
本题考点: 测定电源的电动势和内阻.
考点点评: 本题改编自测电动势和内阻的实验,要注意电压表测量的是内电阻,而不是路端电压,则由E=U内+U外可得出结果.1年前查看全部
- 利用下列反应:Fe+2Fe3+═3Fe2+制一个化学电池(给出若干导线,电极材料和电解液自选),画出实验装置图,注明电解
利用下列反应:Fe+2Fe3+═3Fe2+制一个化学电池(给出若干导线,电极材料和电解液自选),画出实验装置图,注明电解质溶液名称和正负极材料,标出电子流动方向,写出电极反应式.
(1)______是正极,正极的电极反应式:______;
(2)______是负极,负极的电极反应式:______.
(3)若导线上转移电子0.2mol,则负极质量变化是______. Kristin851年前0
Kristin851年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 锌锰干电池是最早使用的化学电池,其基本构造如图1所示.(1)锌锰干电池的负极电极反应式是______,电路
锌锰干电池是最早使用的化学电池,其基本构造如图1所示.(1)锌锰干电池的负极电极反应式是______,电路
锌锰干电池是最早使用的化学电池,其基本构造如图1所示.
(1)锌锰干电池的负极电极反应式是______,电路中每通过0.4mole - ,负极质量减少______g;工作时NH 4 + 离子在正极放电产生2种气体,其中一种气体分子是含10e - 的微粒,正极的电极反应式是______.
(2)某研究小组对电池内黑色糊状物进行了如图2所示实验
已知:Zn(OH) 2 是两性氢氧化物.完成下列实验报告:
(3)利用残渣中分离出的MnO 2 ,研究其在H 2 O 2 制O 2 过程中的作用.实验装置如图3所示.将等物质的量浓度、等体积H 2 O 2 溶液加入分液漏斗中,分别进行2个实验(气体的体积在相同条件下测定).实验步骤 实验现象 实验结论 ①取少量上述无色溶液于试管中,逐滴加入NaOH溶液,直至过量. 生成白色沉淀,______ 无色溶液中
存在Zn 2+ 离子②______ ______ 无色溶液中
存在NH 4 + 离子
①实验一、二中参加反应的H 2 O 2 的物质的量之比为______;序号 烧瓶中的物质 实验记录 实验结论与解释 实验一 足量MnO 2 收集到56mL气体 MnO 2 做催化剂 实验二 足量MnO 2
和稀硫酸黑色粉末部分溶解,
收集到112mL气体______
______
②实验二中反应的离子方程式为______;
③在测量气体体积时,除要注意待气体温度恢复至室温、平视读数外,还需要注意______.
 solojean0071年前1
solojean0071年前1 -
 uuren2007 共回答了20个问题
uuren2007 共回答了20个问题 |采纳率95%(1)锌锰干电池的负极上Zn失去电子,负极反应为Zn-2e - ═Zn 2+ ,负极消耗1mol时转移2mol电子,每通过0.4mole - ,负极质量减少0.2mol×65g/mol=13.0g,由NH 4 + 离子在正极放电产生2种气体,其中一种气体分子是含10e - 的微粒为氨气,另一种为氢气,正极反应为2NH 4 + +2e - ═2NH 3 ↑+H 2 ↑,
故答案为:Zn-2e - ═Zn 2+ ;13.0;2NH 4 + +2e - ═2NH 3 ↑+H 2 ↑;
(2)①无色溶液中含Zn 2+ 、NH 4 + ,加碱均发生反应,先生成的白色沉淀能溶解在强碱溶液中,铵根离子与碱反应生成有刺激性气味的气体为氨气,
故答案为:白色沉淀逐渐溶解,产生刺激性气味的气体;
②检验生成的氨气,则将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口,观察到红色石蕊试纸变蓝,证明含铵根离子,
故答案为:将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口;红色石蕊试纸变蓝;
(3)黑色粉末部分溶解,则二氧化锰反应生成锰离子,Mn元素的化合价降低,则MnO 2 做氧化剂,生成Mn 2+ 离子,故答案为:MnO 2 做氧化剂;生成Mn 2+ 离子;
①等物质的量浓度、等体积H 2 O 2 溶液加入分液漏斗中,实验一中过氧化氢既是氧化剂又是还原剂,实验二中H 2 O 2 是还原剂,由氧气的体积1:2可知,等物质的量的过氧化氢均完全反应,则参加反应的H 2 O 2 的物质的量之比为1:1,故答案为:1:1;
②实验二中反应生成锰离子、水、氧气,离子反应为H 2 O 2 +2H + +MnO 2 ═Mn 2+ +2H 2 O+O 2 ↑,故答案为:H 2 O 2 +2H + +MnO 2 ═Mn 2+ +2H 2 O+O 2 ↑;
③测量气体体积时,除要注意待气体温度恢复至室温、平视读数外,要注意上下移动B管,使A、B两管中液面相平,故答案为:上下移动B管,使A、B两管中液面相平.1年前查看全部
- (2012•铜陵县二模)如图所示是一种环保型手电筒,这种电筒不用化学电池作为电源,使用时只要将它来回摇晃就能发光,并且来
 (2012•铜陵县二模)如图所示是一种环保型手电筒,这种电筒不用化学电池作为电源,使用时只要将它来回摇晃就能发光,并且来回摇晃得越快,手电筒发光越强,这种手电筒所产生的电能是根据______现象获得的.
(2012•铜陵县二模)如图所示是一种环保型手电筒,这种电筒不用化学电池作为电源,使用时只要将它来回摇晃就能发光,并且来回摇晃得越快,手电筒发光越强,这种手电筒所产生的电能是根据______现象获得的.  缘分与感觉1年前1
缘分与感觉1年前1 -
 kpylpy 共回答了23个问题
kpylpy 共回答了23个问题 |采纳率82.6%解题思路:当闭合电路中的部分导体做切割磁感线运动时,电路中可以产生感应电流,这就是电磁感应现象.晃动手电筒时,手电筒中的永磁体在线圈中运动,运动是相对而言的,相对于永磁体而言,线圈在做切割磁感线运动,线圈中就会产生感应电流,小灯泡就会发光,所以上述现象是利用电磁感应现象的原理制成的.
故答案为:电磁感应.点评:
本题考点: 电磁感应.
考点点评: 此题通过生活中的一些现象考查电磁感应的应用,利用电磁感应可以将机械能转化为电能.1年前查看全部
- 化学电池在日常生活中有着广泛的应用.
化学电池在日常生活中有着广泛的应用.
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O
2Ni(OH)2+Cd(OH)2放电 充电
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是______.
①以上电池反应是在非水溶液中进行的②以上电池反应是在强碱溶液中进行的
③以上电池反应不需要电解质就能进行④电池工作时是化学能转变为电能
A.①③B.②④C.①④D.②③
(2)另一种常用的电池是锂电池由于它的容量特别大而广泛应用于心脏起搏器,一般使用时间可长达十年.电池总反应可表示为:Li+MnO2=LiMnO2,它的负极材料是______,电极反应式为______;锂电池中的电解质溶液需用非水溶剂配制,其原因用化学方程式表示为______.
(3)铅蓄电池是典型的可充型电池,电池总反应式为:
Pb+PbO2+4H++2SO2−4
2PbSO4+2H2O放电 充电
放电时电解液中H2SO4的浓度将变______;当外电路通过1mol电子时,理论上负极板的质量增加______g.
(4)随着人们生活质量的不断提高,废弃的电池必须进行集中处理的问题被提到议事日程,其首要原因是______. huayuxuelu1年前1
huayuxuelu1年前1 -
 yinlinsun 共回答了21个问题
yinlinsun 共回答了21个问题 |采纳率90.5%解题思路:(1)该电池放电时为原电池,充电时为电解池,根据电池反应式确定在何种电解质溶液中进行;
(2)原电池中,负极上失电子发生氧化反应;锂是活泼金属,易和水反应生成氢氧化锂和氢气;
(3)根据电池反应式知,该反应中硫酸增加反应且该反应中生成水;根据转移电子和负极电极反应式之间的关系式计算;
(4)重金属对土壤和水资源产生污染.(1)①因为电池反应中有水参加反应,所以该电池反应是在水溶液里进行的,故错误;
②根据电池反应式知,Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,所以该电池反应应该是在强碱性水溶液里进行的,故正确;
③该反应需要强碱性电解质,故错误;
④该电池放电时,是将化学能转化为电能,故正确;
故选B;
(2)该电池反应中,负极上锂失电子发生氧化反应,电极反应式为Li-e-=Li+,锂是活泼金属,易和水反应生成氢氧化锂和氢气,2Li+2H2O=2LiOH+H2↑,
故答案为:锂;Li-e-=Li+;2Li+2H2O=2LiOH+H2↑;
(3)放电时,硫酸参加反应生成硫酸铅和水,所以硫酸的浓度逐渐减小,负极上铅失电子和硫酸根离子反应生成难溶性的硫酸铅,所以负极质量增加的量是硫酸根离子的量,根据Pb-2e-+SO42-=PbSO4知,当转移1mol电子时负极增加的质量=
1mol
2×96g/mol=48g,
故答案为:小;48;
(4)电池中含有汞、铬、铅等重金属,这些重金属对土壤和水资源都造成污染,所以废弃电池要集中处理,不能随便丢弃,
故答案为:防止电池中的汞、镉和铅等重金属离子对土壤和水源的污染.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了原电池原理,根据电池反应式中得失电子的物质确定正负极上发生的电极反应,书写电极反应式是学习难点,注意结合电解质溶液的酸碱性,难度不大.1年前查看全部
- 下列关于能源和环境的叙述中,错误的是( ) A.化学电池是化学能转化成电能的装置 B.氢气燃烧的过程是热能转化成化学能
下列关于能源和环境的叙述中,错误的是( ) A.化学电池是化学能转化成电能的装置 B.氢气燃烧的过程是热能转化成化学能的过程 C.大量废旧电池的随意丢弃,会带来严重的环境污染 D.氢能是理想的新型能源,它有放热多、资源丰富、不污染环境等优点  tigerA771年前1
tigerA771年前1 -
 甘贫乐道 共回答了19个问题
甘贫乐道 共回答了19个问题 |采纳率94.7%A、化学电池是化学能转化成电能的装置.正确;
B、氢气燃烧的过程是化学能转化成热能的过程.错误;
C、大量废旧电池的随意丢弃,会带来严重的环境污染,因为电池中含有重金属离子,会污染环境.正确;
D、氢能是理想的新型能源,它有放热多、资源丰富、不污染环境等优点.错误.
故选B.1年前查看全部
- 关于化学电池 阴阳正负极看铅蓄电池,二氧化铅上发生还原反应,应该算阴极吧?又被叫做正极.这是怎么分的正负极?
 江江0071年前1
江江0071年前1 -
 小浸泡 共回答了21个问题
小浸泡 共回答了21个问题 |采纳率81%这个应该是高中书本里的概念,其实在大学里的教程里面没有这么搞,好久不碰高中书了,以下答案楼主斟酌采纳.
蓄电池的原理是这个样子的,放电,发生的是原电池反应,是将化学能转化为电能的反应,在这里有正负极的概念,负极往往是较为活泼的,发生氧化反应,化合价升高,电子和阴离子向负极移动,正极恰好相反,能发生还原反应,化合价降低,阳离子和质子向正极移动.
充电,发生的是电解池反应是电能转化为化学能储存在电池中的反应,有阴阳极的概念,在同一蓄电池中,原来放电的负极在电解池中成为阳极,正极变为阴极.电子移动方向依旧不变,那么在电解池中阴离子和电子就是流向阳极的,质子和阳离子是流向阴极的.阳极发生氧化反应,阴极发生还原反应.
你说的这个情况,二氧化铅在充电时应该属于阴极,放电时应该叫阳极#1年前查看全部
- 理论上讲,任何自发的氧化还原反应都可以设计成原电池.请利用反应“2Fe3++Cu=2Fe2++Cu2+”设计一个化学电池
理论上讲,任何自发的氧化还原反应都可以设计成原电池.请利用反应“2Fe3++Cu=2Fe2++Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的负极材料是______,发生______反应(填“氧化”或“还原”),电解质溶液是______;
(2)正极的电极反应式______;
(3)外电路中,电子是从______极流出. blzgb1年前1
blzgb1年前1 -
 ul66416 共回答了18个问题
ul66416 共回答了18个问题 |采纳率100%解题思路:(1)根据方程式,失电子的物质作负极;根据得失电子判断反应类型;电解质是反应物中可溶性的、得电子的物质;(2)得电子的物质在正极上反应,结合方程式判断得电子的离子,从而写出电极反应式;(3)根据原电池的工作原理判断;(1)原电池中失电子的物质作负极,根据方程式知,铜作负极,比锌活泼性小的金属或导电的非金属作正极;铜失电子,发生氧化反应;电解质是反应物中可溶性的、得电子的物质,所以电解质是可溶性的铁盐,可用氯化铁作电解质;
故答案为:铜;氧化;氯化铁;
(2)正极上得电子,发生还原反应,根据方程式知,Fe3+得电子,生成Fe2+,
故答案为:2Fe3++2e-=2Fe2+
(3)负极上失电子,正极上得电子,所以电子的流向是;从负极沿导线经正极流出.
故答案为:负极沿导线经正.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 原电池的设计方法:设计原电池时要紧扣原电池的构成条件,具体方法是:1、先将已知的氧化还原反应拆分为两个半反应;2、根据原电池的电极反应特点,结合两个半反应找出正负极材料及电解质溶液;3、按要求画出原电池装置图;1年前查看全部
- 为什么化学电池工作时,发生氧化反应的是负极而不是阳极
 saokangkang1年前1
saokangkang1年前1 -
 莫小邪1 共回答了21个问题
莫小邪1 共回答了21个问题 |采纳率85.7%正负极是按照电势高低划分,高的为正极,低的为负极;阴阳极是根据反应类型划分,氧化反应为阳极,还原反应为阴极.所以...原电池放电,负极(如铜锌原电池中的锌)失电子,化合价升高,发生氧化反应,他就是阳极!可以做出一下总结
原电池 正极即阴极 负极即阳极
电解池 正极即阳极 负极即阴极1年前查看全部
- 一个化学电池的总反应方程式为:Zn+Cu 2+ = Zn 2+ +Cu,该化学电池的组成可能为 [
一个化学电池的总反应方程式为:Zn+Cu 2+ = Zn 2+ +Cu,该化学电池的组成可能为 [ ]正极 负极 电解质溶液
A. CuZn H 2 SO 4
B. Cu Zn CuSO 4
C. Zn Cu ZnCl 2
D. FeZn CuCl 2 nuidans141年前1
nuidans141年前1 -
 费戈 共回答了21个问题
费戈 共回答了21个问题 |采纳率90.5%BD1年前查看全部
- (2012•黄石)化学电池内部的电解液有一定的电阻,这个电阻构成了电池内阻.与新电池相比,旧电池的电压其实并没有发生太大
(2012•黄石)化学电池内部的电解液有一定的电阻,这个电阻构成了电池内阻.与新电池相比,旧电池的电压其实并没有发生太大的变化,但它的内阻却变得很大.这就是为什么小灯泡接新电池时很亮,而接旧电池时灯泡几乎不亮的原因.对于旧电池,我们可以将它等效为一个电压恒定不变的新电池与一个定值电阻r串联,如图2所示.
为了研究某一电池的电压和内阻,小明设计了如下实验: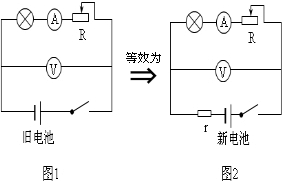
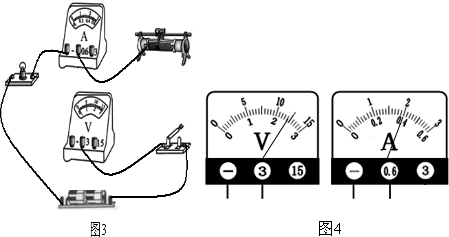
(1)请根据电路图1,将图3中的实物连接成电路图.
(2)如果电路中电流表和电压表的度数如图4所示,则电流表的度数为______A,电压表的读数为______V,滑动变阻器接入电路部分的电阻与灯泡电阻之和为______Ω.
(3)通过调节滑动变阻器改变电路的电阻,小明获得了多组U和I的数据,下列描述U和I的关系的图线正确的是______.
A.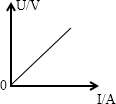 B.
B. C.
C.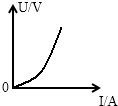 D.
D.
 jbgg66881年前1
jbgg66881年前1 -
 long2033 共回答了17个问题
long2033 共回答了17个问题 |采纳率94.1%解题思路:(1)电压表应接在电源两端,滑动变阻器按照电路图接在开关的左边接线柱上;
(2)首先要弄清楚电流表和电压表的量程和分度值,再去读数;根据公式R=[U/I]求出其电阻值.
(3)根据图2可以看出,滑动变阻器和灯泡串联后再与电池内阻串联组成串联电路,起分压作用.根据公式U=Ir可知,当电流越大时,电池内阻分担的电压越大,那么灯泡和滑动变阻器分担的电压就会越小.(1)按照电路图连接的实物图如下:

(2)电流表接的量程是0.6A,分度值为0.02A,此时电流表的示数为0.4A;
电压表用的是0~3V量程,其分度值为0.1V,故其读数为2V+0.4V=2.4V;
滑动变阻器接入电路部分的电阻与灯泡电阻之和为R=[U/I=
2.4V
0.4A]=6Ω
故答案为:0.4;2.4;6
(3)根据公式U=IR可知,电池的内阻r一定,当电流I增大时,电池内阻分担的电压会增大,总电压一定,所以灯泡和滑动变阻器分担的电压就会随着电流的增大而减小.只有图象D符合题意.
故选D点评:
本题考点: 实物的电路连接;电流表的读数方法;电压表的读数方法;欧姆定律的应用.
考点点评: 此题考查的知识点比较多,有电路图的连接、电流表和电压表的读数以及串联电路的分压作用等知识点.属于中考的常见题型,难度不是很大.1年前查看全部
- 以下过程中,可以看成为电流化学效应的是( ) A.工业上用电来提炼铝、铜金属 B.化学电池供电使电灯发光 C.暴露在空
以下过程中,可以看成为电流化学效应的是( ) A.工业上用电来提炼铝、铜金属 B.化学电池供电使电灯发光 C.暴露在空气中的电热丝长期使用会发生氧化 D.电炉把饭烧焦  棒槌的可爱1年前1
棒槌的可爱1年前1 -
 西隅 共回答了12个问题
西隅 共回答了12个问题 |采纳率100%A、工业上用电来提炼铝、铜金属,是电流流过导体时,导体发生了化学变化,是电流的化学效应,故A正确;
B、化学电池供电使电灯发光,电流流过灯泡时灯丝产生热量,发光,是电流的热效应,不是化学效应,故B错误;
C、暴露在空气中的电热丝长期使用会发生氧化,是高温的电热丝与空气中的氧气发生化学反应的结果,与电流流过电热丝无关,不是电流的化学效应,故C错误;
D、电流流过电炉使电炉丝丝发热,是电流的热效应,但电炉把饭烧焦,是电炉温度太高造成的,与电流无关,因此电炉把饭烧焦不是电流的化学效应,故D错误.
故选A.1年前查看全部
- 下列有关化学电池的说法中正确的是( )
下列有关化学电池的说法中正确的是( )
A.化学电池只能将化学能转化为电能
B.燃料电池能将全部化学能转化为电能
C.锌银电池比能量大,电压稳定,储存时间长
D.一次电池包括干电池和蓄电池 jiajiafengle1年前1
jiajiafengle1年前1 -
 shenhua123 共回答了16个问题
shenhua123 共回答了16个问题 |采纳率100%解题思路:A.化学电池包含原电池和电解池,只有原电池是将化学能转化为电能;
B.燃料电池部分转化为热能;
C.电池反应式为Zn+Ag2O=2Ag+ZnO;
D.蓄电池属于二次电池.A.化学电池包含原电池和电解池,只有原电池是将化学能转化为电能,电解池能将电能转化为化学能,故A错误;
B.燃料电池部分转化为热能、部分转化为电能,故B错误;
C.电池反应式为Zn+Ag2O=2Ag+ZnO,锌银电池比能量大,电压稳定,储存时间长,适用于小电流连续放电,常制成纽扣式微型电池,故C正确;
D.蓄电池能连续放电、充电,所以属于二次电池,故D错误;
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理,从能量转化、电池分类、电池特点等方面考查,题目难度不大.1年前查看全部
- 化学电池是 ___
化学电池是 ___ 的装置,其反应的基础是 _ 。写出铜锌原电池(稀硫酸为电解质)的电极反应:正极 ,负极 。
 远游人bill1年前1
远游人bill1年前1 -
 禁猎メ天使 共回答了18个问题
禁猎メ天使 共回答了18个问题 |采纳率88.9%化学能转化为电能,自发进行的氧化还原反应、2H+ +2e — =H 2 ↑、Zn -2e — =Zn 2+
略1年前查看全部
- 一个化学电池的总反应方程式为:Zn+Cu 2+ ==Zn 2+ +Cu,该化学电池的组成可能为 [
一个化学电池的总反应方程式为:Zn+Cu 2+ ==Zn 2+ +Cu,该化学电池的组成可能为 [ ]正极 负极 电解质溶液
A.Cu Zn H 2 SO 4
B.Cu Zn CuSO 4
C.Zn Cu ZnCl 2
D.Fe Zn CuCl 2 静寂山林1年前1
静寂山林1年前1 -
 zsd_neo 共回答了32个问题
zsd_neo 共回答了32个问题 |采纳率84.4%BD1年前查看全部
- 电瓶充电前后重量是否发生改变?当电动车的电瓶里的电用完之后和充满电的重量是否会发生改变?我认为不会改变,因为是化学电池,
电瓶充电前后重量是否发生改变?
当电动车的电瓶里的电用完之后和充满电的重量是否会发生改变?我认为不会改变,因为是化学电池,虽然充放电前后发生了化学反应,但总质量是不变的对吗?
还有一个是一根导线,有无电流通过,单位长度的导线的重量会发生改变吗?我认为不会,因为是电子的定向移动,电子的质量又可忽略不计,我突然想到法拉第的电磁感应,磁针和导线会互相靠近,这种磁力应该会影响到重量的改变吧?应该怎么解释呢? cxlhy1年前5
cxlhy1年前5 -
 妖精m宝贝 共回答了21个问题
妖精m宝贝 共回答了21个问题 |采纳率81%你自己解释的很正确.电瓶的充放电都是普通的化学反应,不可能存在质量的改变了,否则就成了核反应了.
你说的法拉第的电磁感应,那是由于引力改变的是力.但我们生活中常说的重量实际是物理学中的质量.质量不变受到的重力也不会变1年前查看全部
- 化学电池在通信、交通和日常生活中有着广泛的应用.但是,废弃电池中含有铅、镍、镉、汞等所带来的环境污染问题也日益突出.为了
化学电池在通信、交通和日常生活中有着广泛的应用.但是,废弃电池中含有铅、镍、镉、汞等所带来的环境污染问题也日益突出.为了解决这一问题,江苏移动“绿箱子计划”全新升级,以此呼唤人们在享受手机带来便利的同时,共同关注环保问题.下图是我市新浦海连中路营业厅里放置的回收废手机及电池等配件的“绿箱子”.关于回收废电池的说法,不正确的是( ) A.回收废电池主要是为了利用废电池外壳的金属材料 B.废电池中含有铅、镍、镉、汞等,一旦渗漏出来就会对土壤造成严重污染 C.回收废电池不仅可以节约金属资源,而且可以减少环境污染,有利于人类健康 D.右侧“绿箱子”上的“ 
”是回收标志
 阳光果冻HYHY1年前1
阳光果冻HYHY1年前1 -
 明月奴113 共回答了23个问题
明月奴113 共回答了23个问题 |采纳率100%废电池中含有铅、镍、镉、汞等,一旦渗漏出来就会对水体、土壤造成严重污染,不随意丢弃废电池有利于环境保护,合理回收利用废旧电池及废旧金属还节约了金属资源;
故选A1年前查看全部
- 化学电池可以直接将化学能转化为电能,化学电池的本质是 A.化合价的升降 B.中和反应 C.氧化还原反应 D.电能的储存
 今后几个溶糖锅1年前1
今后几个溶糖锅1年前1 -
 cwzlove1 共回答了23个问题
cwzlove1 共回答了23个问题 |采纳率95.7%C
电池里必然有电子的定向移动。1年前查看全部
- 如图所示是一种环保型手电筒,这种手电筒不用化学电池作为电源.使用时,只要将它来回摇晃,它的灯泡就能发光.这种手电筒是利用
 如图所示是一种环保型手电筒,这种手电筒不用化学电池作为电源.使用时,只要将它来回摇晃,它的灯泡就能发光.这种手电筒是利用______现象制成的,要使灯泡亮度增大,可采用的方法是______(写出一种即可).
如图所示是一种环保型手电筒,这种手电筒不用化学电池作为电源.使用时,只要将它来回摇晃,它的灯泡就能发光.这种手电筒是利用______现象制成的,要使灯泡亮度增大,可采用的方法是______(写出一种即可).  夜茴1年前1
夜茴1年前1 -
 owennon 共回答了15个问题
owennon 共回答了15个问题 |采纳率86.7%解题思路:解答本题需掌握:发电机都是由电磁感应原理制造的,及决定电流大小的因素.当永磁体在线圈中运动时,线圈切割磁感线产生感应电流,故依据电磁感应原理制造的.要使灯泡亮度增大,即电流变大,可以加速切割、增加线圈匝数或更换磁性更强的永磁体.
故答案为:电磁感应;加快摇晃,增加线圈匝数或更换磁性更强的永磁体(任选一个即可).点评:
本题考点: 电磁感应.
考点点评: 本题考查电磁感应的条件,及感应电流大小的决定因素.1年前查看全部
- 你知道哪些是物理电池?哪些属于化学电池?
你知道哪些是物理电池?哪些属于化学电池?
随便写一点常规的,我刚学物理,想了解一下,只要大致写一点就行了,不要写得太深奥 qiyiqun1年前2
qiyiqun1年前2 -
 小宇呀 共回答了20个问题
小宇呀 共回答了20个问题 |采纳率90%化学电池:手机锂电池 电动车蓄电池 手电筒干电池
物理电池:计算器上的太阳能电池1年前查看全部
- 化学电池酸碱中性条件下反应原理
 zjd8881年前1
zjd8881年前1 -
 王的麻子 共回答了23个问题
王的麻子 共回答了23个问题 |采纳率95.7%是利用两个电极之间金属性的不同,产生电势差,从而使电子的流动,产生电流.又称非蓄电池,是电化电池的一种,其电化反应不能逆转,即是只能将化学能转换为电能,简单说就即是不能重新储存电力,与蓄电池相对.
原电池的形成条件
原电池的工作原理原电池反应属于放热的氧化还原反应,但区别于一般的氧化还原反应的是,电子转移不是通过氧化剂和还原剂之间的有效碰撞完成的,而是还原剂在负极上失电子发生氧化反应,电子通过外电路输送到正极上,氧化剂在正极上得电子发生还原反应,从而完成还原剂和氧化剂之间电子的转移.两极之间溶液中离子的定向移动和外部导线中电子的定向移动构成了闭合回路,使两个电极反应不断进行,发生有序的电子转移过程,产生电流,实现化学能向电能的转化. 从能量转化角度看,原电池是将化学能转化为电能的装置;从化学反应角度看,原电池的原理是氧化还原反应中的还原剂失去的电子经导线传递给氧化剂,使氧化还原反应分别在两个电极上进行. 原电池的构成条件有三个: 1.电极材料由两种金属活泼性不同的金属或由金属与其他导电的材料(非金属或某些氧化物等)组成. 2.两电极必须浸泡在电解质溶液中,自发的氧化还原反应. 3.两电极之间有导线连接,形成闭合回路. 只要具备以上三个条件就可构成原电池.而化学电源因为要求可以提供持续而稳定的电流,所以除了必须具备原电池的三个构成条件之外,还要求有自发进行的氧化还原反应.也就是说,化学电源必须是原电池,但原电池不一定都能做化学电池. 形成前提:总反应为自发的氧化还原反应 电极的构成: a.活泼性不同的金属—锌铜原电池,锌作负极,铜作正极;b.金属和非金属(非金属必须能导电)—锌锰干电池,锌作负极,石墨作正极;c.金属与化合物—铅蓄电池,铅板作负极,二氧化铅作正极;d.惰性电极—氢氧燃料电池,电极均为铂. 电解液的选择:电解液一般要能与负极材料发生自发的氧化还原反应. 原电池正负极判断: 负极发生氧化反应,失去电子;正极发生还原反应,得到电子. 电子由负极流向正极,电流由正极流向负极.溶液中,阳离子移向正极,阴离子移向负极1年前查看全部
- 化学电池中发生的主要反应是否必须是氧化还原反应,氧化还原反应发生在何处,为什么
 god_32121年前2
god_32121年前2 -
 一张老树皮 共回答了23个问题
一张老树皮 共回答了23个问题 |采纳率95.7%化学电池中发生的主要反应必须是氧化还原反应 .
因为化学电池主要是化学能和电能之间的转化,而这个过程就得通过氧化还原反应的得失电子来完成,
所以化学电池中发生的主要反应必须是氧化还原反应 .
关于发生的地点,楼上说的不对,所谓阳极阴极只在电解池中才有的概念,原电池是正极和负极.
地点是都有可能,因为氧化还原反应在那里都可以发生,可以是电解溶液中的溶质和正负极或阴阳极,也可以是空气与正负极或阴阳极,甚至是空气中的分子参与氧化还原,要根据实际来讨论.
反正你记住一点,只要可以发生氧化还原的就不要放过,仔细看看就可以了.1年前查看全部
- 给你总方程式写化学电池正负极反应怎么写
 失心狼1年前4
失心狼1年前4 -
 老赌 共回答了17个问题
老赌 共回答了17个问题 |采纳率94.1%拆成两个:
正极:氧化反应
负极:还原反应
还要注意电解质是酸还是碱如:
燃料电池:
原理为:氢气和氧气燃烧
在酸,碱不同条件下是不一样的.1年前查看全部
- 化学电池的电能的来源?比如在锌铜硫酸原电池中,原来是锌的电子与氢离子结合放热,做成电池后,还是锌的电子与氢离子结合,放出
化学电池的电能的来源?
比如
在锌铜硫酸原电池中,原来是锌的电子与氢离子结合放热,做成电池后,还是锌的电子与氢离子结合,放出的热量应该相等啊,但却多出了电能可以用,为什么?电能是从哪里来的?
为什么不放热?有电子和氢离子的结合啊? 我是小31年前1
我是小31年前1 -
 p6lfojd 共回答了22个问题
p6lfojd 共回答了22个问题 |采纳率77.3%电池之所以为电池,是不放热的
将化学能直接转化为电能
根据氧化还原反应中电子的移动来产生电能,所以你理解错了
希望能被采纳为答案,1年前查看全部
- 电容器为何能用化学电池充电从原子,电子的角度来说化学反应不能进行,电子不转移,电容器两端的电荷哪来的?
 贝宁伏特感应1年前2
贝宁伏特感应1年前2 -
 zhuzinsser 共回答了24个问题
zhuzinsser 共回答了24个问题 |采纳率95.8%电流的产生是因为有电势差,化学电池的阳极电极电势与阴极电极电势不同,之间存在着电势差,所以电子会移动,能给电容充电.1年前查看全部
- 为什么在化学电池中,电子流向与电流相反?
 咬猪1年前5
咬猪1年前5 -
 liuling8161 共回答了13个问题
liuling8161 共回答了13个问题 |采纳率100%因为电子中带负电,所以电子流出的一段是负极,流进得一端是正极,电流的方向是从正极流向负极,所以电子合电流方向相反1年前查看全部
- 一个化学电池的总反应方程式为:Zn+Cu 2+ ==Zn 2+ +Cu,该化学电池的组成可能为(
一个化学电池的总反应方程式为:Zn+Cu 2+ ==Zn 2+ +Cu,该化学电池的组成可能为()
A B C D 正极 Cu Mg Zn Fe 负极 Zn Zn Cu Zn 电解质溶液 H 2 SO 4 CuSO 4 ZnCl 2 CuCl 2  georgehenry1年前1
georgehenry1年前1 -
 ll品牌 共回答了16个问题
ll品牌 共回答了16个问题 |采纳率87.5%D
考查原电池的构成,构成原电池的条件是活泼性不同的金属或金属和非金属,导线相连并插入到电解质溶液中。根据方程式可知,锌失去电子,所以作负极。铜离子得到电子,因此电解质溶液中必须含有铜离子,答案选D。1年前查看全部
- 原电池是化学电池的一种吗?
 12veil1年前1
12veil1年前1 -
 黑茶壶 共回答了19个问题
黑茶壶 共回答了19个问题 |采纳率94.7%是的.化学电池按工作性质可分为:一次电池(原电池);二次电池(可充电电池);铅酸蓄电池;燃料电池.其中:一次电池可分为:糊式锌锰电池、纸板锌锰电池、碱性锌猛电池、扣式锌银电池、扣式锂锰电池、扣式锌锰电池、锌空气电池、一次锂锰电池等.二次电池可分为:镉镍电池、氢镍电池、锂离子电池、二次碱性锌锰电池等.铅酸蓄电池可分为:开口式铅酸蓄电池、全密闭铅酸蓄电池.1年前查看全部
- 化学电池是一种将___________ 直接转化为___________ 的装置。一节1 号电池烂在地里,能使1 m 2
化学电池是一种将___________ 直接转化为___________ 的装置。一节1 号电池烂在地里,能使1 m 2 的土壤永久失去利用价值;一粒纽扣电池能使600 t 水受污染,相当于一个人一生的水饮用量。废旧电池的乱扔乱放,会导致_________________________________ 。应该采取的措施有______________________ 、______________________ 。  丽丽安12301年前1
丽丽安12301年前1 -
 本质生长 共回答了16个问题
本质生长 共回答了16个问题 |采纳率87.5%化学能;电能;水源、土壤等严重污染;回收利用废旧电池;集中处理废旧电池1年前查看全部
- 化学电池是一类重要的能源,按工作性质可分为:一次电池(例如:干电池)和二次电池(例如:铅酸蓄电池).请简要回答下列各空:
化学电池是一类重要的能源,按工作性质可分为:一次电池(例如:干电池)和二次电池(例如:铅酸蓄电池).请简要回答下列各空:
(1)铅酸蓄电池放电时能量转变是______能转变成______能.
(2)某铅酸电池厂生产电池用的是28%的稀硫酸,将浓硫酸稀释配制成该稀硫酸时,一定将______沿器壁缓慢注入______中,并不断搅拌以防液体飞溅.
(3)某种型号干电池的剖面如图所示.现对干电池内的可溶性糊状物进行探究,请填空:
①取少量溶于水,过滤;
②取①中过滤得到的滤液,分为两份,一份加入烧碱溶液,加热产生一种刺激性气味的气体,该气体的水溶液pH>7,且常用作化肥,则该气体的化学式为______;另一份加入AgNO 3 溶液,产生白色沉淀,滴加稀HNO 3 沉淀不溶解,则可推知糊状物含有物质______(填化学式).
③另取白色糊状物,滴加少量碘溶液,溶液变蓝,则糊状物中含有______.
 maniks1年前1
maniks1年前1 -
 多多反转2 共回答了10个问题
多多反转2 共回答了10个问题 |采纳率90%(1)铅酸蓄电池放电时是将化学能转化成电能.故答案为:化学;电.
(2)将浓硫酸稀释配制成该稀硫酸时,一定将浓硫酸沿器壁缓慢注入水中,并不断搅拌以防液体飞溅.故填答案为:浓硫酸;水.
(3)铵盐能和显碱性的物质反应生成有刺激性气味的气体氨气,氨气的水溶液显碱性,氯化银是不溶于稀硝酸的白色沉淀.
故答案为:NH 3 ;NH 4 Cl.1年前查看全部
- 常用的化学电池的种类、名称、形状、电极、电解质、可否再充电、价格、存放期、特点、用途、回收途径有哪
常用的化学电池的种类、名称、形状、电极、电解质、可否再充电、价格、存放期、特点、用途、回收途径有哪
希望可以快点,
我星期一急需.. 涂雅小盐1年前1
涂雅小盐1年前1 -
 来上网吧003 共回答了17个问题
来上网吧003 共回答了17个问题 |采纳率94.1%碳性氯化锌电池,包括D、C、AA、AAA、N及9伏型号
氯化锌电池的化学成份 - 正极:二氧化锰 负极:锌壳 电解液:氯化锌水.
氧化银钮扣型电池
化学成份 - 正极:氧化银 负极:锌 电解液:氢氧化钾
碱性钮扣型电池
化学成份 - 正极:二氧化锰 负极:锌 电解液:氢氧化钾
专用电池
化学成份:锂离子或镍金属氢化物(NiMH)
充电电池
化学成份:镍金属氢化物(NIMH)
一次性锂电池
化学成份:锂,碱 这个是在朋友问题里摘的 请看1年前查看全部
- 化学电池在通讯、交通及日常生活中有着广泛的应用.目前常用的镍(Ni)镉(Cd)
化学电池在通讯、交通及日常生活中有着广泛的应用.目前常用的镍(Ni)镉(Cd)
电池,其电池的总反应为:Cd+2NiO(OH)+2X⇌2Ni(OH)2+Cd(OH)2以下说法正确的是( )
①充电时化学能转变为电能②放电时化学能转变为电能
③充电过程为物理变化④放电过程为化学变化⑤X物质的化学式为H2O.
A.②④⑤
B.①③⑤
C.②③⑤
D.①③④ tianhan_041年前1
tianhan_041年前1 -
 金库 共回答了14个问题
金库 共回答了14个问题 |采纳率85.7%解题思路:根据化学方程式可以判断物质的化学式;
电池在充电时电能转变为化学能,放电时化学能转变为电能;
电池在充电过程和放电过程中发生的都是化学变化.根据Cd+2NiO(OH)+2X⇌2Ni(OH)2+Cd(OH)2可知,每个X中含有1个氧原子和2个氢原子,是水;
电池在充电时电能转变为化学能,放电时化学能转变为电能;
电池在充电过程和放电过程中发生的都是化学变化.
故选A.点评:
本题考点: 质量守恒定律及其应用;化学变化和物理变化的判别;物质发生化学变化时的能量变化.
考点点评: 在化学反应中遵循质量守恒定律,即反应前后元素的种类不变,原子的种类、个数不变.1年前查看全部
- 常有的化学电池有那几种?要求:电池种类、名称、形状、电极、电解质、电压、可否能充电、价格、存放期、特点、用途.回收途径等
常有的化学电池有那几种?
要求:电池种类、名称、形状、电极、电解质、电压、可否能充电、价格、存放期、特点、用途.回收途径等. 玉笔幽灵1年前1
玉笔幽灵1年前1 -
 angel7wing 共回答了14个问题
angel7wing 共回答了14个问题 |采纳率85.7%化学电池按工作性质可分为:一次电池(原电池);二次电池(可充电电池);铅酸蓄电池.其中:一次电池可分为:糊式锌锰电池、纸板锌锰电池、碱性锌锰电池、扣式锌银电池、扣式锂锰电池、扣式锌锰电池、锌空气电池、一次锂锰电池等.二次电池可分为:镉镍电池、氢镍电池、锂离子电池、二次碱性锌锰电池等.铅酸蓄电池可分为:开口式铅酸蓄电池、全密闭铅酸蓄电池.1年前查看全部
大家在问
- 1引起动生电动势的非静电力是什么?
- 2下列哪一种动物属于我国特产的哺乳动物( )
- 3用changes are that 来翻译:我们很可能轻松会取胜 用adopt翻译:我们采用了新的酿酒方法
- 4读如图(1)“四城市气温曲线和降水量柱状图”,回答下列问题.
- 5(2010•雅安三模)袋中装有3个红球和2个白球,每个球除颜色外都相同,则任意摸出两个球均为红球的概率是( )
- 6三角函数tan60°-tan45°/tan45°+tan60°+2sin60°
- 7有碳原子数相同的烯烃、炔烃混合气aL,完全燃烧后生成bL 和cL水蒸气(温度、压强与原混合气相同),若a∶b∶c=3∶6
- 8I'm sorry to have kept you waiting?
- 9电功的公式W=UIt 分别表示什么
- 10高中英语句子分析用到的词组 be devoted to_devoted__to his research work,th
- 11怎么求这个抛物线P的值和焦点坐标
- 12什么是母线的支持绝缘子,它的功能是什么?
- 13八年级下的书面表达一篇 求英语高手写下 别写八年级没学过的句型和单词谢谢了!
- 14英语词组 (体力劳动)和(健康护理)
- 15小明在学校运动会上获得一枚奖牌,他想知道这块奖牌是否是纯铜制成的,于是他用天平和量杯分别测出奖牌的质量和体积分别为14g

