电解法制取金属的前提是什么含金属的原料必须是离子化合物吗
 lhklf2022-10-04 11:39:543条回答
lhklf2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 go5go 共回答了19个问题
go5go 共回答了19个问题 |采纳率94.7%- 恩,必须是离子化合物,比如NaCl可以在熔融条件下电解钠
但AlCl3却不能用来电解铝,因为他不是离子化合物所以电解铝用
Al2O3 .(离子化合物会在熔融条件电离)这是个必要的条件 - 1年前
 渔民的粉丝 共回答了1个问题
渔民的粉丝 共回答了1个问题 |采纳率- 不一定,比如氧化铝的电解
- 1年前
 温_馨 共回答了547个问题
温_馨 共回答了547个问题 |采纳率- 金属的原料只要是含金属就可以,不用是离子化合物,如电解AL2O3。
前提是:无水参与。 - 1年前
相关推荐
- 用电解法、还原法、加热法冶炼金属,能不能分别举些例子?要方程式.
 w3b01年前1
w3b01年前1 -
 橘子笑笑 共回答了18个问题
橘子笑笑 共回答了18个问题 |采纳率77.8%1.热分解法(用于不活泼金属Hg,Ag)
2HgO=△=2Hg=O2↑
2.热还原法(多数金属)
CO+Fe2O3=高温=2Fe+3CO2
3.电解法用于还原性强的金属K,Ca,Na,Al)
2Al2O3==通电==4Al+3O2↑1年前查看全部
- Mg Al Cu 可以分别用置换法、直接加热法和电解法冶炼得到
Mg Al Cu 可以分别用置换法、直接加热法和电解法冶炼得到
金属顺序表的这些个金属分别是哪种方法得到 详细说下
 phoenix_wq1年前1
phoenix_wq1年前1 -
 李院长的单车 共回答了20个问题
李院长的单车 共回答了20个问题 |采纳率95%首先是较活泼的金属,一般用电解法,例如Al是由电解Al2O3制的的,而Mg是由海水提炼的,而Gu是置换得来的,置换法适用于不活泼金属,用H2还原GuO,直接加热法则是适用于极不活泼金属,如Hg是用加热HgO制的,1年前查看全部
- 对于冶炼像钠、钙、镁、铝这样活泼的金属,电解法几乎是唯一可行的工业方法.下列有关说法中正确的是( )
对于冶炼像钠、钙、镁、铝这样活泼的金属,电解法几乎是唯一可行的工业方法.下列有关说法中正确的是( )
A. 电解NaOH溶液可生成金属钠、O2以及H2
B. 电解熔融CaCl2时,金属钙在阳极生成
C. 可用电解饱和MgCl2溶液的方法获得金属镁
D. 电解熔融Al2O3制备金属铝时,要加入冰晶石,使Al2O3在较低温度下熔解 别吵架啥1年前1
别吵架啥1年前1 -
 sh66128467do 共回答了20个问题
sh66128467do 共回答了20个问题 |采纳率95%解题思路:A.根据离子放电顺序可知,电解NaOH溶液实质是电解水;B.电解中阳极发生氧化反应,氯离子在阳极放电生成氯气;C.根据离子放电顺序可知,电解饱和MgCl2溶液生成氢氧化镁、氢气与氯气;D.电解熔融Al2O3制备金属铝时,要加入冰晶石,降低氧化铝的熔点,使Al2O3在较低温度下熔解.A.根据离子放电顺序可知,电解NaOH溶液实质是电解水,生成氢气与氧气,故A错误;
B.电解中阳极发生氧化反应,氯离子在阳极放电生成氯气,钙离子在阴极发生还原反应,阴极析出金属钙,故B错误;
C.根据离子放电顺序可知,电解饱和MgCl2溶液生成氢氧化镁、氢气与氯气,应电解熔融的氯化镁制备金属Mg,故C错误;
D.电解熔融Al2O3制备金属铝时,要加入冰晶石,降低氧化铝的熔点,使Al2O3在较低温度下熔解,故D正确,
故选D.点评:
本题考点: 电解原理;金属冶炼的一般原理.
考点点评: 本题以金属的原理为载体,考查电解原理,比较基础,掌握离子放电顺序与电极反应是关键.1年前查看全部
- 冶炼金属的三种常用方法是:①热分解法 ②热还原剂法 ③电解法.人类用量处在前三位的金属是铁、铝、铜.
冶炼金属的三种常用方法是:①热分解法 ②热还原剂法 ③电解法.人类用量处在前三位的金属是铁、铝、铜.(填编号)
(1)冶炼铝用到的方法是______;
(2)冶炼铁和铜的常用方法是______. 不断幺九1年前1
不断幺九1年前1 -
 张富强 共回答了23个问题
张富强 共回答了23个问题 |采纳率100%解题思路:(1)铝是活泼金属,通常采用电解氧化铝制取铝;
(2)铁和铜属于较活泼金属,通常采用热还原法;一般来说,活泼金属用电解法,较活泼金属用热还原法,不活泼金属如Hg、Ag等用热分解法.
(1)铝是活泼金属,电解氧化铝生成铝和氧气,反应的化学方程式为:2Al2O3
电解
.
4Al+3O2↑,常采用此法冶炼铝,
故答案为:③;
(2)由Fe、Zn、Cu等中等活泼金属用热还原法,即以C、CO或H2做还原剂还原冶炼,
故答案为:②;点评:
本题考点: 金属冶炼的一般原理.
考点点评: 本题考查学生金属的冶炼方法,掌握解金属的活动性与金属冶炼的原理是解答的关键,题目难度不大.1年前查看全部
- 不同的金属应选用不同的冶炼方法,如:热还原法、热分解法、电解法等.你认为选择的原则主要是依据( )
不同的金属应选用不同的冶炼方法,如:热还原法、热分解法、电解法等.你认为选择的原则主要是依据( )
A.金属在自然界的存在形式
B.金属熔点的高低
C.金属离子得电子的能力
D.金属元素在地壳中的含量 gzqlf01年前1
gzqlf01年前1 -
 狗小狗 共回答了14个问题
狗小狗 共回答了14个问题 |采纳率78.6%解题思路:根据金属的活动性强弱选择合适的冶炼方法,一般来说,活泼金属用电解法,较活泼金属用热还原法,不活泼金属如Hg、Ag等用热分解法冶炼.不同的金属应选用不同的冶炼方法,金属的冶炼方法是根据金属的活动性强弱确定,即金属离子得电子的能力.
故选C.点评:
本题考点: 金属冶炼的一般原理.
考点点评: 本题考查了确定金属冶炼方法的依据,难度不大,注意根据金属的活动性强弱确定金属的冶炼方法.1年前查看全部
- 电解法中,为什么标准电极电位大的离子先在阴极析出?
电解法中,为什么标准电极电位大的离子先在阴极析出?
电解浓度分别胃0.01N和1N的Ag+和Cu2+的硫酸盐溶液.
已知φ(Ag+/Ag)=0.800V φ(Cu2+/Cu)=0.345V
问何者能在阴极上先析出,分解电压为多大?
二者能否分离? fangda1年前1
fangda1年前1 -
 piaodongdeyun 共回答了12个问题
piaodongdeyun 共回答了12个问题 |采纳率83.3%银离子会先析出.标准电极电位越大的离子氧化性越强,得电子的能力越强,所以阴极上的电子首先提供给这些离子,如果还有多余的电子则提供给其他离子,条件是电压允许.
可以通过控制电压在0.345v到0.8v之间将两者分离.1年前查看全部
- 金属镍有广泛的用途.粗镍中含有少量杂质Fe、Zn、Cu、Pt,可用电解法制备高纯度的镍(已知:氧化性Fe2+<Ni2+<
金属镍有广泛的用途.粗镍中含有少量杂质Fe、Zn、Cu、Pt,可用电解法制备高纯度的镍(已知:氧化性Fe2+<Ni2+<Cu2+),下列叙述正确的是( )
A. 阳极发生还原反应,其电极反应式:Ni2++2e-=Ni
B. 电解后,电解槽底部的阳极泥中只有Cu和Pt
C. 电解后,溶液中存在的阳离子只有Fe2+和Zn2+
D. 电解过程中,阳极质量的减少与阴极质量的增加相等 tanghaonan1年前1
tanghaonan1年前1 -
 hs1313 共回答了22个问题
hs1313 共回答了22个问题 |采纳率90.9%解题思路:A、阳极失去电子发生氧化反应;
B、粗镍中含有少量Fe、Zn、Cu、Pt等杂质做阳极,铜和鉑不失电子沉降电解池底部形成阳极泥;
C、精炼过程中,电解质溶液中一定含有Ni2+;
D、阳极失电子的有Fe、Zn、Cu;阴极析出的是铜;依据电子守恒计算分析.A、阳极发生氧化反应,其电极反应式:Ni-2e-=Ni2+,Fe-2e-=Fe2+;Zn-2e-=Zn2+,故A错误;
B、粗镍中含有少量Fe、Zn、Cu、Pt等杂质做阳极,铜和鉑不失电子沉降电解池底部形成阳极泥,电解后,电解槽底部的阳极泥中只有Cu和Pt,故B正确;
C、电解后,溶液中存在的金属阳离子有Fe2+、Zn2+、Ni2+,故C错误;
D、电解过程中阳极失电子的有Fe、Zn、Cu;阴极析出的是铜;依据电子守恒,阳极质量的减少与阴极质量的增加不相等,故D错误;
故选B.点评:
本题考点: 电解原理.
考点点评: 本题考查了电极原理的应用,主要考查电解精炼镍的原理分析判断,题目难度中等.1年前查看全部
- 1806年,英国化学家戴维用电解法从苏打(碳酸钠)中得到一种金属.他对这种新金属作了如下实验:取一块金属,用小刀切下一小
1806年,英国化学家戴维用电解法从苏打(碳酸钠)中得到一种金属.他对这种新金属作了如下实验:取一块金属,用小刀切下一小块,投入水中;小金属块浮水面上,并与水发生剧烈反应;此金属在水面上急速转动,发出嘶嘶声,并立刻融化成一个闪亮的银白色小球,过一会小球逐渐变小,最后完全消失.根据上述实验过程和现象,请列出这种金属的物理性质和化学性质.
 yxlrxj1年前1
yxlrxj1年前1 -
 zxlhyf 共回答了18个问题
zxlhyf 共回答了18个问题 |采纳率94.4%这是钠
用小刀切下一小块:这种金属质软
小金属块浮水面上:密度比水小
并立刻融化成一个闪亮的银白色小球:熔点低
与水发生剧烈反应:化学性质活泼
此金属在水面上急速转动,发出嘶嘶声:与水反应有气体生成
过一会小球逐渐变小,最后完全消失:与水反应的产物溶于水1年前查看全部
- 用电解法制取金属镁时需要无水氯化镁.在干燥的_________气流中加热MgCl2 6H2O时,能得到无水氯化镁,其原因
用电解法制取金属镁时
需要无水氯化镁.在干燥的_________气流中加热MgCl2 6H2O时,能得到无水氯化镁,其原因是_____________________.
能讲讲吗?谢谢啊
 贺兰飘飘1年前1
贺兰飘飘1年前1 -
 Gone_with_wind 共回答了12个问题
Gone_with_wind 共回答了12个问题 |采纳率100%氯化氢
镁离子是弱碱阳离子
在溶液中会发生水解生成氢氧化镁
加入氯化氢会抑制水解1年前查看全部
- 冶炼金属常用以下几种方法:①热分解法;②热还原法;③电解法请将适宜冶炼以下金属的方法的标号填写在该金属后面的横线上.(1
冶炼金属常用以下几种方法:①热分解法;②热还原法;③电解法请将适宜冶炼以下金属的方法的标号填写在该金属后面的横线上.(1)铝______(2)铁______(3)汞______.
 shengjiang511年前1
shengjiang511年前1 -
 Lò∧Ё呦 共回答了16个问题
Lò∧Ё呦 共回答了16个问题 |采纳率93.8%解题思路:Fe、Zn、Cu等中等活泼金属通常用热还原法;
Na、Mg、Al等活泼或较活泼金属通常采用电解法冶炼制备;
Hg、Ag等不活泼金属通常采用热分解法冶炼;
据此分析判断.(1)Na、Mg、Al等活泼或较活泼金属的化合物与C、CO或H2等不反应,故Al采用电解法冶炼制备,
故答案为:③;
(2)由Fe、Zn、Cu等中等活泼金属用热还原法,即以C、CO或H2做还原剂还原冶炼,铁用热还原法,
故答案为:①;
(3)Hg、Ag等不活泼金属的氧化物不稳定,受热易分解,故汞采用热分解法冶炼,
故答案为:①.点评:
本题考点: 金属冶炼的一般原理.
考点点评: 本题考查了金属的冶炼方法、掌握常见金属的冶炼方法是解题关键,题目较简单.1年前查看全部
- (08陕西四校联考,8)下列叙述不正确的是( ) A.电解法精炼铜时,纯铜作阴极,Cu 2 + 发生还原反应
(08陕西四校联考,8)下列叙述不正确的是( )
A.电解法精炼铜时,纯铜作阴极,Cu 2 + 发生还原反应 B.电解饱和食盐水时,用铁作阳极,C1 - 发生氧化反应 C.电镀锌时,金属锌作阳极,电镀液可用硫酸锌溶液 D.铜锌原电池中,锌作负极,电子沿导线从锌极流向铜极  雪地里的星星81年前1
雪地里的星星81年前1 -
 haoee 共回答了11个问题
haoee 共回答了11个问题 |采纳率90.9%B
本题考查原电池和电解池,中等题。电解法精炼铜时,纯铜作阴极,粗铜作阳极,A对;电解饱和食盐水时,应用惰性电极(如Pt、石墨等)做阳极,B错;电镀锌时,镀层金属(Zn)作为阳极,含有镀层金属离子的溶液作电镀液,C对;铜锌原电池中,锌作负极,铜作正极,电子从负极经导线流向正极,D对。1年前查看全部
- 下列反应的离子方程式正确的是( ) A.工业上用电解法制备烧碱:2Cl - +H 2 O 通电 . . 2OH - +
下列反应的离子方程式正确的是( ) A.工业上用电解法制备烧碱:2Cl - +H 2 O
2OH - +H 2 ↑+Cl 2 ↑通电 . . B.用食醋除去水垢中的CaCO 3 :CaCO 3 +2H + =Ca 2+ +H 2 O+CO 2 ↑ C.NH 4 HCO 3 溶液中加过量NaOH溶液并加热NH 4 + +OH
NH 3 ↑+H 2 O△ . D.铜溶于硫酸酸化的过氧化氢溶液:Cu+2H + +H 2 O 2 =Cu 2+ +2H 2 O  phq07991年前1
phq07991年前1 -
 瞬_Wink 共回答了17个问题
瞬_Wink 共回答了17个问题 |采纳率88.2%A.工业上用电解法制备烧碱的离子反应为2Cl - +2H 2 O
通电
.
2OH - +H 2 ↑+Cl 2 ↑,故A错误;
B.用食醋除去水垢中的CaCO 3 的离子反应为CaCO 3 +2HAc=Ca 2+ +H 2 O+CO 2 ↑+2Ac - ,故B错误;
C.NH 4 HCO 3 溶液中加过量NaOH溶液并加热的离子反应为HCO 3 - +NH 4 + +2OH
△
.
NH 3 ↑+2H 2 O+CO 3 2- ,故C错误;
D.铜溶于硫酸酸化的过氧化氢溶液的离子反应为Cu+2H + +H 2 O 2 =Cu 2+ +2H 2 O,故D正确;
故选D.1年前查看全部
- 65%含量的铜能用电解精炼么 还含有一些其他金属 不知道能不能用电解法分解呢
 xiaohu18181年前1
xiaohu18181年前1 -
 feiyan258 共回答了15个问题
feiyan258 共回答了15个问题 |采纳率80%一般不能,电解精炼多的铜都在99%左右,吹炼以后的铜都有98%.你这杂质金属含量太高了,像镍,铅含量过高的话会引起阴极铜再溶解,而且电解液成分会很复杂,净化起来困难.当然,其中的金,银等铂族金属还是要想办法回收的.建议你先火法精炼,除去铅,镍等.1年前查看全部
- 1806年,英国化学家戴维用电解法从苏打(Na2CO3)中得到一种金属.他对这种新金属作了如下实验:取一块金属,用小刀切
1806年,英国化学家戴维用电解法从苏打(Na2CO3)中得到一种金属.他对这种新金属作了如下实验:取一块金属,用小刀切下一小块,投入水中它浮在水面上,与水发生剧烈反应;且在水面上急速转动,发出嘶嘶声,并立刻融化成一个银白色的小球,过一会小球逐渐缩小,最后完全消失,得到氢氧化钠溶液.
(1)电解法制取该金属的过程中______能转化为______能.
(2)该金属的物质性质:
①______;②______;
③______;④______;
(3)化学性质______,该反应属于______(填“吸热”或“放热”)反应. hwandhw1年前1
hwandhw1年前1 -
 冲冠一怒为红颜 共回答了25个问题
冲冠一怒为红颜 共回答了25个问题 |采纳率96%解题思路:(1)根据电解法制取该金属是将电能转化为化学能;
(2)物质的物理性质是指不需要通过化学变化表现出来的性质.物理性质主要有:颜色、状态、气味、密度、硬度、熔点、沸点等解答;
(3)根据物质的化学性质是指在化学变化中表现出来的性质.化学性质主要有:可燃性、毒性、氧化性、还原性、稳定性等.(1)电解法制取该金属是将电能转化为化学能;
(2)金属的物理性质有:物质的硬度、密度、颜色、状态不需要通过化学变化就能表现出来,属于物质的物理性质.能用小刀切下一块说明金属较软;能浮在水面上说明金属的密度比水小;熔成一闪亮的银白色小球说明金属是银白色的;立即熔成一闪亮的银白色小球说明金属的熔点低.
(3)化学性质有:该金属能和水反应需要通过化学变化表现出来,属于物质的化学性质,该反应属于放热反应;
答案:
(1)电 化学
(2)①质软;②密度小于水;③熔点低;④银白色固体;
(3)能和水反应 放热.点评:
本题考点: 物质发生化学变化时的能量变化;化学性质与物理性质的差别及应用.
考点点评: 本题主要考查了如何根据具体的描述正确的判断物质的性质方面的知识,可以依据题干提供的信息进行.1年前查看全部
- 1806年英国化学家戴维用电解法从苏打中得到一种新金属.他对该金属做了以下实验:“取一块该金属,用小刀切下一块,把一小块
1806年英国化学家戴维用电解法从苏打中得到一种新金属.他对该金属做了以下实验:“取一块该金属,用小刀切下一块,把一小块金属投入水中,发生剧烈变化.它在水面上急速转动,发生嘶嘶声,并立即熔成一闪亮的银白色小球,并逐渐缩小,最后完全消失.”阅读后,归纳这种金属的物理性质
(1)______;(2)______;
(3)______;(4)______. whitehawl1年前1
whitehawl1年前1 -
 林善文 共回答了17个问题
林善文 共回答了17个问题 |采纳率88.2%解题思路:物质的物理性质是指不需要通过化学变化表现出来的性质.物理性质主要有:颜色、状态、气味、密度、硬度、熔点、沸点等.(1)能用小刀切下一块说明金属较软.故填:质软.
(2)能浮在水面上说明金属的密度比水小.故填:密度小于水.
(3)熔成一闪亮的银白色小球说明金属是银白色的.故填:银白色.
(4)立即熔成一闪亮的银白色小球说明金属的熔点低.故填:熔点低.点评:
本题考点: 化学性质与物理性质的差别及应用.
考点点评: 本题主要考查了如何根据具体的描述正确的判断物质的性质方面的知识,可以依据题干提供的信息进行.1年前查看全部
- (1)为什么从氯化镁中提取镁必须用电解法?
(1)为什么从氯化镁中提取镁必须用电解法?
(2)在海边的海水提取镁工厂常建有风力或潮汐发电站,这样做的意义是什么?
 青青果果1年前2
青青果果1年前2 -
 hiwng 共回答了17个问题
hiwng 共回答了17个问题 |采纳率82.4%1 也可以用碱金属还原 不过价格贵啊 而镁很活泼 不能用碳 一氧化碳还原 所以只能电解
2 解决电的问题啊 要不然用什么电解呢 海边原料丰富 风力和潮汐都是可再生清洁能源 海边风力和潮汐能源丰富 正好利用啊1年前查看全部
- 请问用五氧化二磷电解法测量气体中的微量水(PPm)含量的仪表可以测量乙炔、丙烯中的微量水含量吗?
 粉xx1年前1
粉xx1年前1 -
 rita-xu 共回答了20个问题
rita-xu 共回答了20个问题 |采纳率80%可以,生成很少量的磷酸或偏磷酸,因为生成量太少,并且大量的五氧化二磷存在,不会和乙炔或者烯烃反应.1年前查看全部
- 近年来,加“碘”食盐较多使用了碘酸钾,KIO3在工业上可用电解法制取,以石墨和铁为电极,以KI溶液为电解液在一定条件下电
近年来,加“碘”食盐较多使用了碘酸钾,KIO3在工业上可用电解法制取,以石墨和铁为电极,以KI溶液为电解液在一定条件下电解,反应式为:KI+H2O→KIO3+H2↑.下列有关说法中,正确的是( )
A. 电解时,石墨做阳极,铁作阴极
B. 电解时,在阳极上产生氢气
C. 电解后得到KIO3产品的步骤有:过滤→浓缩→结晶→灼烧
D. 电解中,每转移0.6mol电子,理论上可得到0.1mol无水KIO3晶体 dzjrx1年前1
dzjrx1年前1 -
 ILOVEOLD 共回答了15个问题
ILOVEOLD 共回答了15个问题 |采纳率80%解题思路:A、依据反应分析判断,溶液中氢离子在阴极得到电子生成氢气,碘离子失电子生成碘酸根离子;
B、电解时阴极产生氢气;
C、碘酸钾溶液浓缩蒸干结晶灼烧会发生分解;
D、依据配平的化学方程式,KI+3H2O→KIO3+3H2↑,转移电子数6mol,生成1mol碘酸钾;A、反应式为:KI+H2O→KIO3+H2↑,阳极是惰性电极,所以电解时,石墨做阳极,铁作阴极,故A正确;
B、依据反应原理,电解时阴极产生氢气,故B错误;
C、碘酸钾溶液浓缩蒸干结晶,得到的晶体灼烧碘酸钾会分解,故C错误;
D、化学方程式,KI+3H2O→KIO3+3H2↑,转移电子数6mol,生成1mol碘酸钾;每转移0.6mol电子,理论上可得到0.1mol无水KIO3晶体,故D正确;
故选AD.点评:
本题考点: 电解原理.
考点点评: 本题考查电解池原理的分析判断,电极分析,电极反应是解题关键,题目难度中等.1年前查看全部
- 【化学--化学与技术】工业上以碳素铬铁为原料制取铬铵矾,利用电解法制取金属铬.其工艺流程如图所示.已知:H2SO4+Cr
【化学--化学与技术】
工业上以碳素铬铁为原料制取铬铵矾,利用电解法制取金属铬.其工艺流程如图所示.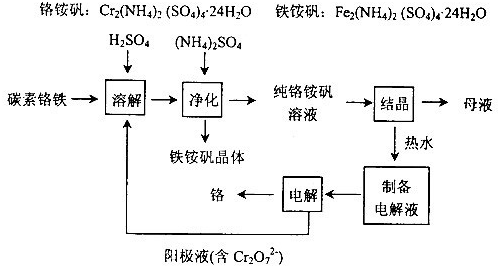
已知:H2SO4+Cr═CrSO4+H2↑
(1)碳素铬铁是铁铬合金,粉碎后溶于硫酸和电解阳极液的混合溶液中.该过程中电解阳极液的主要作用是______.
(2)加入(NH4)2SO4的目的是______.
(3)结晶后的母液从绿色化学的角度可采用的处理方法是______.
(4)产品铬中含氧呈脆性,为了降低其含氧量,可通过______提高其纯度. cherishrong1年前1
cherishrong1年前1 -
 棉花糖即溶巧克力 共回答了19个问题
棉花糖即溶巧克力 共回答了19个问题 |采纳率94.7%解题思路:(1)根据流程及重铬酸钾溶液具有氧化性进行分析;(2)根据工艺流程进行分析;(3)从绿色化学的角度进行分析处理结晶后的母液方法;(4)根据隔离空气降低其含氧量角度进行分析.(1)重铬酸钾溶液具有氧化性,将铬铁元素转化为Fe3+和Cr3+,
故答案为:作氧化剂,将铬铁元素转化为Fe3+和Cr3+,
(2)根据流程,加入(NH4)2SO4后,铁离子生成铁铵矾晶体析出,与铬铵矾溶液分离,
故答案为:生成铁铵矾和铬铵矾进行分离;
(3)母液中含有铬铵矾溶液,可以转入净化后的纯铬铵矾溶液进行结晶,得到铬铵矾晶体,
故答案为:转入净化后的纯铬铵矾溶液进行结晶;
(4)可以通过真空处理或氢还原的方法,降低产品铬中含氧量,
故答案为:真空处理或氢还原.点评:
本题考点: 制备实验方案的设计;金属冶炼的一般原理.
考点点评: 本题考查了工业上以碳素铬铁为原料制取铬铵矾的方法,解题关键是合理分析制取流程,本题充分考查了学生的分析、理解能力,难度中等.1年前查看全部
- 能人请进请写明原因金属有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的
能人请进
请写明原因
金属有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是 ( )
(已知:氧化性Fe2+ 作琵琶行1年前1
作琵琶行1年前1 -
 huang303 共回答了22个问题
huang303 共回答了22个问题 |采纳率95.5%选b
放电时的电池反应为:Li+LiMn2O4==Li2Mn2O4 是氧化反应
充电时就是还原反应了1年前查看全部
- 炼金属Fe Ze Cu等中等活泼金属用什么方法 常用方法有电解法,热分解法,吕热反应还
 创造者归来1年前1
创造者归来1年前1 -
 3933976 共回答了17个问题
3933976 共回答了17个问题 |采纳率88.2%常用方法:电解法、热还原法(铝热反应)、热分解法
对于铁、铜用热还原法,加入碳或一氧化碳可以还原金属单质1年前查看全部
- 1806年,英国化学家戴维用电解法从苏打中得到一种新金属.他对新金属作了以下的实验:“取一块该金属,用小刀切下一小块,把
1806年,英国化学家戴维用电解法从苏打中得到一种新金属.他对新金属作了以下的实验:“取一块该金属,用小刀切下一小块,把他投入水中发生剧烈的反应.它在水面上急速转动,发出嘶嘶声,并立即熔化成一个闪亮的银白色的小球,逐渐缩小,最后完全消失.”阅读后,请归纳出该金属的物理性质:①_________②__________③_________④_________;化学性质:___________.
 123yang20061年前1
123yang20061年前1 -
 文明的沉积 共回答了15个问题
文明的沉积 共回答了15个问题 |采纳率93.3%物理性质:
1.密度小(浮在水上)
2.熔点低(熔成小球)
3.硬度低(用到可以切割)
4.是银白色固体(颜色和状态)
化学性质:能与水反应(也可以说和水反应产生气体,因为在水上急速运动,说明有气体推动)1年前查看全部
- 工业上用电解法制备铝单质,写出反应方程式.当产生标准状况下氧气22.4L时,反应转移了多少摩尔电子?
工业上用电解法制备铝单质,写出反应方程式.当产生标准状况下氧气22.4L时,反应转移了多少摩尔电子?
消耗氧化铝多少克? palm19861年前1
palm19861年前1 -
 铭音 共回答了21个问题
铭音 共回答了21个问题 |采纳率95.2%方程式为2Al2O3=电解=4Al+3O2↑
标况下氧气22.4L,那么生成氧气1mol,方程式中氧气系数为3,那么三氧化二铝(氧化铝)消耗了2/3mol,氧化铝相对分子质量为102,那么消耗氧化铝质量为102X2/3=68g.
方程式中可看出,2mol氧化铝反应转移电子数为12,那么2/3mol氧化铝转移电子数为4mol.
所以反应转移电子数为4mol.1年前查看全部
- 用电解法怎么冶炼金属铝?
 badan1年前2
badan1年前2 -
 叶莉的uu 共回答了18个问题
叶莉的uu 共回答了18个问题 |采纳率83.3%原料:三氧化二铝
催化剂:冰晶石[六氟合铝酸钠],可以降低三氧化二铝的熔点
加热熔融后电解就可以了.1年前查看全部
- 电解法精练铜的过程 ZN等离子怎么变化的
电解法精练铜的过程 ZN等离子怎么变化的
如果电极是FE 和含杂质的CU 离子会怎样变 mitac12211年前3
mitac12211年前3 -
 gigiyan 共回答了17个问题
gigiyan 共回答了17个问题 |采纳率94.1%在电解精炼铜的时候,在阳极上铜和比铜活泼的金属失去电子变成离子进入溶液,没有铜活泼的金属不失去电子溶解,而是沉在阳极附近形成阳极泥.在溶液中,金属阳离子向阴极方向移动,由于溶液中铜离子的氧化性最强,于是铜离子变成金属铜附着在阴极上.
如果阴极是铁和含杂质的铜,由于阴极上铁有外加电流提供电子,因此不会被腐蚀,发生的反应不变.而如果阳极是铁和含杂质的铜,那么亚铁离子将进入溶液中,铜离子和铁离子均向阴极方向移动,最终铜离子得电子变成金属铜,溶液变为硫酸亚铁溶液.1年前查看全部
- 能用电解法冶炼的金属有哪些,能用热分解法冶炼的金属有哪些,能用铝热反应冶炼的金属有哪些
 离人倾1年前1
离人倾1年前1 -
 kd8g1nlwimc2sk 共回答了15个问题
kd8g1nlwimc2sk 共回答了15个问题 |采纳率86.7%常见单质活泼性:钾钙钠镁铝,锌铁锡铅氢,铜汞银铂金 铝以前的都用电解,以后的锌到铜可以用铝热法,汞以后的用热分解法,金还可以用物理方法(淘金)1年前查看全部
- 电解法精练铜的问题电解法精练铜时,纯铜做负极,Cu2+离子发生还原反应这句话错在哪?
 abandon64081年前1
abandon64081年前1 -
 TWOTWO333 共回答了20个问题
TWOTWO333 共回答了20个问题 |采纳率90%电解池不叫正、负极,发生还原反应的电极叫“阴极”,精铜做的就是阴极,发生氧化反应的电极叫“阳极”,粗铜做的是阳极.1年前查看全部
- 在铝表面着色,先应用电解法使铝表面附上一层氧化铝,其方法是将铝件作阳极,铁作阴极,用碳酸氢钠作电解液进行电解.其原理是通
在铝表面着色,先应用电解法使铝表面附上一层氧化铝,其方法是将铝件作阳极,铁作阴极,用碳酸氢钠作电解液进行电解.其原理是通电后在铝件与电解液的接触面上逐渐形成一层Al(OH)3薄膜,薄膜的某些部位存在着小孔,电流从小孔通过,并产生热量使
Al(OH)3分解,从而在铝表面形成一层较厚的氧化膜.试回答:
(1)铝表面形成Al(OH)3薄膜的电极反应式为______________
(2)电解过程中,必须使电解槽pH保持相对稳定(不能太大,也不能太小)的原因是__________________
(3)使用NaHCO3溶液为电解液,会减缓阴极区pH的增大,能说明这一原理的离子反应方程式为___________________ rencongyu1年前1
rencongyu1年前1 -
 大木头11 共回答了18个问题
大木头11 共回答了18个问题 |采纳率100%1、Al - 3e- + 3OH- = Al(OH)3
2、pH太大或者太小,Al(OH)3是两性物质,都会反应而溶解
3、HCO3^- + OH- = CO3-2- + H2O1年前查看全部
- 1806年,英国化学家戴维用电解法从苏打(碳酸钠)中得到一种金属.他对这种新金属作了如下实验:取一块金属
 yanfv5131年前1
yanfv5131年前1 -
 kingkyoking 共回答了21个问题
kingkyoking 共回答了21个问题 |采纳率85.7%物理性质:
1.密度小(浮在水上)
2.熔点低(熔成小球)
3.硬度低(用到可以切割)
4.是银白色固体(颜色和状态)
化学性质:能与水反应(也可以说和水反应产生气体,因为在水上急速运动,说明有气体推动)1年前查看全部
- 电解法中加入氯化钠的作用是
 阳光81年前1
阳光81年前1 -
 gdw001x 共回答了15个问题
gdw001x 共回答了15个问题 |采纳率93.3%增强溶液导电性或盐析.1年前查看全部
- 利用电解法制取Cu2O ,用什么电解液
 1220693351年前1
1220693351年前1 -
 猫猫1985 共回答了23个问题
猫猫1985 共回答了23个问题 |采纳率87%H2O2溶液1年前查看全部
- 19、近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取.以石墨和不锈钢为电极,以KI溶液
19、近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取.以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:
x05KI + 3H2O KIO3 + 3H2↑.下列有关说法正确的是 ( )
A.电解时,石墨作阴极,不锈钢作阳极
B.电解时,阳极反应是:I – – 6e – + 3H2O = IO3 – + 6H+
C.溶液调节至强酸性,对生产有利
x05D.电解前后溶液的pH几乎不变 Emma_lp1年前1
Emma_lp1年前1 -
 锈琴 共回答了20个问题
锈琴 共回答了20个问题 |采纳率100%A不正确,因为根据总反应KI + 3H2O =电解=KIO3 + 3H2↑可知,电极没有参加反应,所以阳极不能用不锈钢,如果用不锈钢,铁要参加反应,与总反应不符;B正确,C不正确,因为在强酸溶液中,I-与生成IO3 –发生氧化还原反应,对生的...1年前查看全部
- 工业上冶炼金属的方法正确的是 A 加热分解法冶炼铜 B 铝热法冶炼镁 C 氢气或CO还原冶炼钾 D 电解法冶炼铝
 希米洛1年前1
希米洛1年前1 -
 青水格天 共回答了30个问题
青水格天 共回答了30个问题 |采纳率93.3%D
铜用热还原法制取
铝热法不能用来制取镁1年前查看全部
- 如何使用电解法除氯离子?手头有分产品,氯离子浓度过高,想用电解法出去氯离子.包括条件和步骤,
 e冷眼旁观1年前6
e冷眼旁观1年前6 -
 lengyuesh 共回答了16个问题
lengyuesh 共回答了16个问题 |采纳率93.8%插一跟钋黑电极 一跟C黑电极,基本上就ok了
关键还是电压啊!不知道多少的电压合适
难道只能用电解法来吗?1年前查看全部
- 热分解法,热还原法,电解法和钠,铁,汞怎么配
 zfk7891年前2
zfk7891年前2 -
 shi0897 共回答了18个问题
shi0897 共回答了18个问题 |采纳率88.9%附:四种方法适用范围:热还原法:中等活泼金属,如铁铜等电解法:活泼金属,如钠镁铝等铝热反应法:冶炼高熔点金属,如钨等热分解法:不活泼金属,如汞1年前查看全部
- 冶炼金属的三种常用方法是:①热分解法 ②热还原法 ③电解法。(填序号)
冶炼金属的三种常用方法是:①热分解法②热还原法③电解法。(填序号)
(1)冶炼铝用到的方法是 ;
(2)冶炼铁的常用方法是 。 燕双1年前1
燕双1年前1 -
 建设创新型xx 共回答了17个问题
建设创新型xx 共回答了17个问题 |采纳率88.2%(1)③(1分); (2)②(1分)
1年前查看全部
- 如图是某研究小组采用电解法处理石油炼制过程中产生的大量H2S废气的工艺流程.该方法对H2S的吸收率达99%以上,并可制取
如图是某研究小组采用电解法处理石油炼制过程中产生的大量H2S废气的工艺流程.该方法对H2S的吸收率达99%以上,并可制取H2和S.下列说法正确的是( )
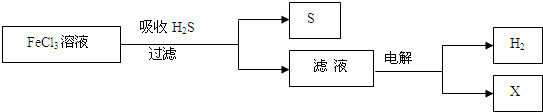
A.吸收H2S的离子方程式为:2Fe3++H2S═2Fe2++S↓+2H+
B.电解过程中的阳极反应主要为:2Cl--2e-═Cl2↑
C.电解产物X在该工艺流程中可循环利用
D.实验室可用点燃充分燃烧的方法消除H2S污染 gexin537701年前1
gexin537701年前1 -
 想不到好名咋办 共回答了19个问题
想不到好名咋办 共回答了19个问题 |采纳率89.5%解题思路:A.根据Fe3+的氧化性和H2S的还原性,再根据离子方程式正误的判断;
B.根据溶液中离子的还原性强弱判断;
C.根据阳极反应Fe2+-e-═Fe3+进行判断;
D.根据H2S充分燃烧的产物的性质进行判断;A.由图中的流程图可知,FeCl3与H2S反应,FeCl3中+3价的铁具有氧化性,H2S中-2价的硫具有还原性,所以两者反应生成S和Fe2+,书写离子方程式时,硫化氢是气体,水是弱电解质写化学式,得失电子数守恒,所以离子方程式正确,故A正确;
B.电解的是氯化亚铁和盐酸溶液,阳极发生的应该是氧化反应,所得滤液中含有Fe2+、H+和Cl-,由于还原性Fe2+>Cl-,电解时阳极反应式为Fe2+-e-═Fe3+,故B错误;
C.该流程图中过程中电解的是氯化亚铁和盐酸溶液,电解时阳极反应式为Fe2+-e-═Fe3+,所以X为FeCl3,可回收与H2S反应,所以电解产物X在该工艺流程中可循环利用,故C正确;
D.由于H2S充分燃烧的化学方程式为2H2S+3O2
点燃
.
2SO2+2H2O,生成的SO2也是一种有毒气体,故D错误;
故选:A、C.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;电解原理.
考点点评: 本题主要考查离子方程式正误判断,电极反应式的书写,H2S的化学性质等知识点,读懂流程图熟练运用氧化还原反应是解答的关键,题目难度不大.1年前查看全部
- 三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠
三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解.电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍.以下说法不正确的是( )
A. 可用铁作阳极材料
B. 电解过程中阳极附近溶液的pH降低
C. 阳极反应方程式为:2Cl--2e-═Cl2
D. 1 mol二价镍全部转化为三价镍时,外电路中通过了1 mol电子 girron1年前1
girron1年前1 -
 lianfa 共回答了20个问题
lianfa 共回答了20个问题 |采纳率90%解题思路:阳极发生氧化反应生成氯气,应用惰性电极,发生2Cl--2e-=Cl2↑,Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍,据此分析解答.A.阳极上氯离子放电,所以不能用铁作阳极材料,故A错误;B.阳极反应方程式为:2Cl--2e-=Cl2↑,Cl2在弱碱性条件下生成ClO-,故电解过程中阳极附近溶液的pH降低,故B正确;C.电解时阳极产生Cl2,电极反应式为2Cl--...
点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了电解池原理,正确获取并理解题干信息是解本题关键,同时考查学生对知识的理解、运用能力,题目难度不大.1年前查看全部
- 电解法精致铜为什么要用硫酸铜作电解质,直接用水不行吗?
 爱人小爱1年前4
爱人小爱1年前4 -
 大毛毛雨 共回答了16个问题
大毛毛雨 共回答了16个问题 |采纳率75%第一,水的导电性太差,
第二,用水的话,铜从阳极下来也是氢氧化物的形态,根本无法到阴极还原
第三,假如用别的无干扰不含铜离子导电溶液,那么在电解开始相当长的一段时间内电极的阴极不会有精铜产生,造成能量浪费
所以实际上是用硫酸铜溶液的1年前查看全部
- 电解法粗炼精铜 作阴阳极的材料?
 verca1年前1
verca1年前1 -
 gracelily 共回答了19个问题
gracelily 共回答了19个问题 |采纳率100%用粗铜做阳极,用纯铜做阴极.1年前查看全部
- 制备制备KMnO4的最佳方法是电解法,工业上以K2MnO4的水溶液为电解液,镍板(不参与反
制备制备KMnO4的最佳方法是电解法,工业上以K2MnO4的水溶液为电解液,镍板(不参与反
制备制备KMnO4的最佳方法是电解法,工业上以K2MnO4的水溶液为电解液,镍板(不参与反应)为阳极,铁板为阴极进行电解.分别写出阴、阳的电极反应式:_________________,电解总反应式_:_______ zhangyuecuicui1年前1
zhangyuecuicui1年前1 -
 xiyuxingyue 共回答了19个问题
xiyuxingyue 共回答了19个问题 |采纳率94.7%阴极:2H^++2e^-=H2↑
阳极:2MnO4^2--2e^-=2MnO4^-
电解总反应式:2K2MnO4+2H2O=2KMnO4+2KOH+H2↑1年前查看全部
- 高铁酸钠(Na2FeO4)是铁的一种重要化合物,可用电解法制备,阳极材料为铁,其电解质溶液应选用_______ (填H2
高铁酸钠(Na2FeO4)是铁的一种重要化合物,可用电解法制备,阳极材料为铁,其电解质溶液应选用_______ (填H2SO4、HNO3、KOH、NaOH、Na2SO4)溶液,原因是_____________,阳极反应式为_________________.
我想知道的是 仅凭题目给的条件 我怎么知道要选NAOH? 电子翅膀1年前1
电子翅膀1年前1 -
 浓仪 共回答了12个问题
浓仪 共回答了12个问题 |采纳率91.7%肯定要选含Na的,不选硫酸钠是因为这样得不到纯净的高铁酸钠,选氢氧化钠,当OH-放电完毕之后,溶液中就没有其他杂质了.1年前查看全部
- 金属镍有广泛的用途.粗镍中含有少量杂质Fe、Zn、Cu、Pt,可用电解法制备高纯度的镍(已知:氧化性Fe2+<Ni2+<
金属镍有广泛的用途.粗镍中含有少量杂质Fe、Zn、Cu、Pt,可用电解法制备高纯度的镍(已知:氧化性Fe2+<Ni2+<Cu2+),下列叙述正确的是( )
A. 阳极发生还原反应,其电极反应式:Ni2++2e-=Ni
B. 电解后,电解槽底部的阳极泥中只有Cu和Pt
C. 电解后,溶液中存在的阳离子只有Fe2+和Zn2+
D. 电解过程中,阳极质量的减少与阴极质量的增加相等 adas3311年前2
adas3311年前2 -
 身大力不亏 共回答了18个问题
身大力不亏 共回答了18个问题 |采纳率83.3%解题思路:A、阳极失去电子发生氧化反应;
B、粗镍中含有少量Fe、Zn、Cu、Pt等杂质做阳极,铜和鉑不失电子沉降电解池底部形成阳极泥;
C、精炼过程中,电解质溶液中一定含有Ni2+;
D、阳极失电子的有Fe、Zn、Cu;阴极析出的是铜;依据电子守恒计算分析.A、阳极发生氧化反应,其电极反应式:Ni-2e-=Ni2+,Fe-2e-=Fe2+;Zn-2e-=Zn2+,故A错误;
B、粗镍中含有少量Fe、Zn、Cu、Pt等杂质做阳极,铜和鉑不失电子沉降电解池底部形成阳极泥,电解后,电解槽底部的阳极泥中只有Cu和Pt,故B正确;
C、电解后,溶液中存在的金属阳离子有Fe2+、Zn2+、Ni2+,故C错误;
D、电解过程中阳极失电子的有Fe、Zn、Cu;阴极析出的是铜;依据电子守恒,阳极质量的减少与阴极质量的增加不相等,故D错误;
故选B.点评:
本题考点: 电解原理.
考点点评: 本题考查了电极原理的应用,主要考查电解精炼镍的原理分析判断,题目难度中等.1年前查看全部
- 不同的金属应选用不同的冶炼方法,如:热还原法、热分解法、电解法等.你认为选择的原则主要是依据( )
不同的金属应选用不同的冶炼方法,如:热还原法、热分解法、电解法等.你认为选择的原则主要是依据( )
A. 金属在自然界的存在形式
B. 金属熔点的高低
C. 金属离子得电子的能力
D. 金属元素在地壳中的含量 小新七代1年前1
小新七代1年前1 -
 我想揣他 共回答了9个问题
我想揣他 共回答了9个问题 |采纳率100%解题思路:根据金属的活动性强弱选择合适的冶炼方法,一般来说,活泼金属用电解法,较活泼金属用热还原法,不活泼金属如Hg、Ag等用热分解法冶炼.不同的金属应选用不同的冶炼方法,金属的冶炼方法是根据金属的活动性强弱确定,即金属离子得电子的能力.
故选C.点评:
本题考点: 金属冶炼的一般原理.
考点点评: 本题考查了确定金属冶炼方法的依据,难度不大,注意根据金属的活动性强弱确定金属的冶炼方法.1年前查看全部
- 下列关于电解法精炼粗铜的叙述中不正确的是( )
下列关于电解法精炼粗铜的叙述中不正确的是( )
A.粗铜板与电源的正极相连
B.电解时,阳极发生氧化反应,而阴极发生的反应为:Cu2++2e-=Cu
C.粗铜中所含Ni、Fe、Au、Ag等金属杂质,电解后以单质形式沉积槽底,形成阳极泥
D.电解铜的纯度可达99.95%~99.98% lg_xa_cn1年前1
lg_xa_cn1年前1 -
 iasrmyga 共回答了17个问题
iasrmyga 共回答了17个问题 |采纳率88.2%解题思路:电镀法精炼铜时,粗铜为阳极,精铜为阴极,阳极材料是粗铜,阳极上金属失电子变成离子进入溶液,Cu-2e-=Cu2+,比金属铜活泼的金属锌、铁、镍会先于金属铜失电子,比金属铜活泼性差的Pt、Ag等固体会沉积下来形成阳极泥,这样最终电解铜的纯度可达99.95%~99.98%,根据电解原理来回答.A、电镀法精炼铜时,粗铜为阳极,即粗铜板与电源的正极相连,故A正确;
B、电解时,阳极上只要是金属Cu失电子变成离子进入溶液,Cu-2e-=Cu2+,阳极发生氧化反应,而阴极发生的反应为:Cu2++2e-=Cu,故B正确;
C、粗铜中所含Pt、Au、Ag等金属杂质,电解后以单质形式沉积槽底,形成阳极泥,金属镍、铁都比铜活泼,先于金属铜失电子,故C错误;
D、根据电解精炼铜的工作原理,这样最终电解铜的纯度可达99.95%~99.98%,故D正确.
故选C.点评:
本题考点: 铜的电解精炼.
考点点评: 本题考查学生电解精炼铜的工作原理,可以根据教材知识来回答,注意教材知识的梳理和记忆,难度不大.1年前查看全部
- 如图是某研究小组采用电解法处理石油炼制过程中产生的大量H 2 S废气的工艺流程.该方法对H 2 S的吸收率达99%以上,
如图是某研究小组采用电解法处理石油炼制过程中产生的大量H 2 S废气的工艺流程.该方法对H 2 S的吸收率达99%以上,并可制取H 2 和S.下列说法正确的是( ) 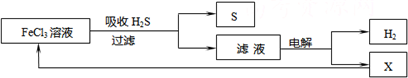
A.吸收H 2 S的离子方程式为:2Fe 3+ +H 2 S=2Fe 2+ +S↓+2H + B.电解过程中的阳极反应主要为:2Cl - -2e - =Cl 2 ↑ C.该工艺流程体现绿色化学思想 D.实验室可用点燃充分燃烧的方法消除H 2 S污染  vncldd01年前1
vncldd01年前1 -
 sunkiss83 共回答了30个问题
sunkiss83 共回答了30个问题 |采纳率100%A、由图中的流程图可知,FeCl 3 与H 2 S反应生成S和Fe 2+ ,离子方程式正确,得失电子数是守恒的,故A正确; B、电解的是氯化亚铁和盐酸溶液,阳极发生的应该是氧化反应,所得滤液中含有Fe 2+...1年前查看全部
- 当用电解法除去溶液中的Cr2O72-时,因其具有强氧化性易得电子,故可在阴极 放电生成Cr3+,最后生成Cr(OH)3沉
当用电解法除去溶液中的Cr2O72-时,因其具有强氧化性易得电子,故可在阴极 放电生成Cr3+,最后生成Cr(OH)3沉淀除去.
为什么错! 063007001491年前1
063007001491年前1 -
 半夜加水 共回答了14个问题
半夜加水 共回答了14个问题 |采纳率100%请注意Cr2O72-是带负电的,所以只要通电就会向正极移动,没有机会接触到阴极.不能在阴极得电子1年前查看全部
- 不用电解法怎样从氯化钙CaCl2制氯气
 thehi2u1年前2
thehi2u1年前2 -
 一人花开 共回答了23个问题
一人花开 共回答了23个问题 |采纳率95.7%氯化钙与次氯酸钙在酸性条件下可反应生成氯气
或者直接向漂白粉中加稀硫酸加热即可值得氯气1年前查看全部
- 下列有关电化学知识的叙述正确的是( ) A.原电池中,溶液中的阴离子向正极移动 B.电解法提纯铜时,一定用纯铜作阴极
下列有关电化学知识的叙述正确的是( )
A.原电池中,溶液中的阴离子向正极移动 B.电解法提纯铜时,一定用纯铜作阴极 C.电解池中,阳极本身一定不参加反应 D.电解池工作时,阳极上不一定析出物质  幸福村的不幸福哦1年前1
幸福村的不幸福哦1年前1 -
 wang_god 共回答了22个问题
wang_god 共回答了22个问题 |采纳率72.7%BD
原电池中,阴离子移向负极,阳离子移向正极;电解池中,如果阳极是活泼金属,那么阳极就参加反应;电解池工作时,阳极上可能有物质析出,如Cl - 放电生成Cl 2 ,也可能没有物质析出。1年前查看全部
大家在问
- 1从一块长12厘米,宽8厘米的长方形纸上剪下一个最大的圆,这个圆的直径是多少厘米 ...
- 2关于多边形的数学题用三种不同的正多边形拼成平面镶嵌图案,边数分别为m,n,p.在同一顶点处,正多边形内角之和为360°,
- 3Up to now,I'm trying...but I'm still not sure I'll make the
- 4已知有理数a,b,c在数轴上对应点的位置,且lal=2,lbl=3,lcl=1,求a+b+c的值
- 5甲乙俩队修一条长48千米的公路甲队修了全长的三分之一已队是甲队的八分之五乙队修
- 6怎样翻译摩斯密码 ...- ..- -.-.-- -..- -..- -..- -.-...-...-..- --..-
- 7如何证明相似四边形的周长比
- 8坐公交车到那里大约需要10分钟请翻译
- 9英文脑筋急转弯:Why does a pet shop owner look up at the sky on a ra
- 10“上学期间你们得穿校服吗?”用英语怎么说?
- 11尊严使人不再丑陋,尊严让美丽成为永恒.把你和伙伴们的发言整理成一段话,写下来.
- 12"I haven't seen her once in a blue moon.
- 13把下列各数填在相应的集合里:+5,−12,-20,0,0.174,-1,334,-8.09,600%,-|-12|.整数
- 14收获的作文,600字,必采纳
- 15图甲表示以一条模板链合成一条子链的过程,图乙表示生物体遗传信息的传递过程.下列相关叙述正确的是( )
