IA族元素的金属性比IIA族元素的金属性强,这句话是否正确
 小猪猪猪猪2022-10-04 11:39:543条回答
小猪猪猪猪2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 zww123 共回答了18个问题
zww123 共回答了18个问题 |采纳率88.9%- 比较的时候还得看是否在同一个周期
我们熟知的金属活动性顺序表中,K Ca Na Mg
其中Ca是IIA,Na是IA,但是Ca在Na前面,这个就是这句话的反例 - 1年前
 物理看花 共回答了5个问题
物理看花 共回答了5个问题 |采纳率- 不正确 ,由元素周期表进行判断,同周期金属性依次减弱,同主族金属性依次增强。
- 1年前
 hgtr 共回答了776个问题
hgtr 共回答了776个问题 |采纳率- 错误 必须是同周期的
- 1年前
相关推荐
- 第8周期Ia族元素的原子序数为——,第八周期含有——种元素,原因是———————————————— 原子核外出现第一个g
第8周期Ia族元素的原子序数为——,第八周期含有——种元素,原因是———————————————— 原子核外出现第一个g原子轨道的元素的原子序数是——,其原因是————————————————--
 zxp91111年前2
zxp91111年前2 -
 渴望平凡的幸福 共回答了13个问题
渴望平凡的幸福 共回答了13个问题 |采纳率92.3%第8周期 IA 族元素的原子序数为(119),第八周期含有(50)种元素,
原因是:
第8周期新出现的能级有8s、7d、6f、5g、8p,
它们共能容纳 2+10+14+18+6=50个电子,故第8周期含有50种元素.
原子核外出现第一个g原子轨道的元素的原子序数是(121),
其原因是:
出现第一个g原子轨道的为5g原子轨道,
从核外电子排布的构造原理可知出现第一个5g电子的元素的核外电子排布式为
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f14 5g1 6s2 6p6 6d10 7s2 7p6 8s2,原子序数1211年前查看全部
- IA族元素有哪些共同之处,或者告诉我有哪些不同之处
 Youkk_1年前3
Youkk_1年前3 -
 sjskk 共回答了16个问题
sjskk 共回答了16个问题 |采纳率81.3%IA族元素除了H都是金属,又叫碱金属,因此IA族也叫碱金属族.
单质都很活泼,除了H都可以与H2O常温反应,生成对应的氢氧化物.
IA族最外层电子数都是1
都易失去最外层的1个电子变成阳离子.
而其阳离子基本都很稳定.
同族元素原子序数越大,金属性越强,越活泼.
所有单质都是还原性为主,易燃.1年前查看全部
- 已知ABC三种短周期元素可以形成化合物AB2 CA2,则A又没有可能是IA族元素?
 朱成文1年前3
朱成文1年前3 -
 heyjude0 共回答了18个问题
heyjude0 共回答了18个问题 |采纳率94.4%没有可能.在AB2中A显正价,且为偶数;在CA2中A为负价,也是偶数.(当然这样说要排除像超氧化钾KO2这类特殊情况)常见化合价为偶数的元素通常主族序数也为偶数,所以不可能是H,到很可能是S,比如SO2和CS2.1年前查看全部
- IA族元素与IB族元素最外层都有一个s电子,但前者的单质活泼性明显强于后者,试试从原子结构特征加以说明?问了好多人,
 你猪才怪1年前0
你猪才怪1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 下列说法不正确的是 [ ] A.IA族元素的电负性从上到下逐渐减小,而Ⅶ
下列说法不正确的是 [ ]A.IA族元素的电负性从上到下逐渐减小,而ⅦA族元素的电负性从上到下逐渐增大
B.电负性的大小可以作为衡量元素的金属性和非金属性强弱的量度
C.氢原子中只有一个电子,故氢原子只有一个原子轨道
D.NaH的存在能支持可将氢元素放在ⅦA的观点 lili4051年前1
lili4051年前1 -
 秋水有伊人 共回答了22个问题
秋水有伊人 共回答了22个问题 |采纳率81.8%AC1年前查看全部
- 第六周期的IA族元素铯的原子序数是55,第八周期的IA族元素的核电荷数是多少?它最不可能具有的性质是?
 曲靖人1年前1
曲靖人1年前1 -
 iloveyou1 共回答了8个问题
iloveyou1 共回答了8个问题 |采纳率75%119
氧化性1年前查看全部
- (1)IA族元素单质熔点是除氢之外,随核电核数的增加而降低,那么可以一直降到0么?
(1)IA族元素单质熔点是除氢之外,随核电核数的增加而降低,那么可以一直降到0么?
是否可以用下面这个图像(第一个图像)表示 ? 请说明理由! (2)第三周期元素的最高正化合价是从左到右一直升高吗,是否可以用下面这个图(第二个图)来表示? (3)短周期元素的原子半径的图像(第三个图)又是否可以用下列的图表示,说明理由!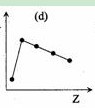 虽然悬赏没多少,但是我认为能够教好别人,授人智慧也是一件很 好的事,希望各位帮我详细分析, 请根据题号一 一解答,
虽然悬赏没多少,但是我认为能够教好别人,授人智慧也是一件很 好的事,希望各位帮我详细分析, 请根据题号一 一解答,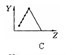
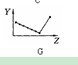
 爱心的叶子1年前1
爱心的叶子1年前1 -
 whajg0 共回答了26个问题
whajg0 共回答了26个问题 |采纳率88.5%(1)IA族最后一个元素钫,熔点27摄氏度,没有到零度.但是(d)图可以表示.主族金属同族熔点随周期增加降低 (2)应该是不能,从钠到氯可以飙升到+7,但是氩是惰性气体,不能飙升到+8.所以图c是对的,到氩,就是0.(3)图三可...1年前查看全部
- 下列有关碱金属的说法中,不正确的是 [ ] A.IA族元素都是碱金属元素
下列有关碱金属的说法中,不正确的是 [ ]A.IA族元素都是碱金属元素
B.K的还原性强于Na
C.Na和Na + 灼烧时都能使火焰呈黄色
D.Na在空气中燃烧时生成Na 2 O 2 历史的天空_小何1年前1
历史的天空_小何1年前1 -
 crystal汪汪 共回答了20个问题
crystal汪汪 共回答了20个问题 |采纳率95%A1年前查看全部
- IA族元素单质的熔点随和电荷数增大 怎样变化?为什么
IA族元素单质的熔点随和电荷数增大 怎样变化?为什么
H2S和HCl的沸点哪个高呢? 同意8同意1年前1
同意8同意1年前1 -
 风中这舞 共回答了16个问题
风中这舞 共回答了16个问题 |采纳率93.8%IA元素除氢外,金属单质的熔点随核电荷数的增加而降低,因为单质属于金属晶体,熔沸点与金属键能有关,原子半径越来越大,金属键越来越弱,所以熔沸点逐渐降低.
VIIA元素,非金属单质的熔沸点随核电荷数的增加而升高,因为单质属于分子晶体,熔沸点与分子间作用力有关,分子构型相同,相对分子量越大,分子间作用力越大,则熔沸点越高.
H2S和HCl都是分子晶体,但是分子构型不同,不能根据相对分子量判断分子间作用力,也就不能判断熔沸点高低,得查阅相关资料.1年前查看全部
大家在问
- 1多边形的内角和可能是 A.300度 B.600度 C.1200度 D.900度
- 2已知如图,AB=AD,BC=CD求证:∠ABC=∠ADC
- 3为什么说测量显微镜测量的是牛顿环的直经,而不是显微镜内被放大了的直经?若改变显
- 4关于铷的结构、性质和保存的判断,错误的是( )
- 5六年级一班参加兴趣小组的人数占全班总人数的五分之三,兴趣小组中男生的人数占八分之五,
- 6Unit1 is (中间该填什么)unit of our English book.A、the first B、the
- 7若A为空白时,B=0,若A不为空白时,B=C*D,用EXCEl怎么设公式
- 8一个富有凝聚力的班集体的形成,靠的是 [ ] A.班主任的管理
- 9描写梦想成真 成语
- 10两个大小不等的等腰直角三角板如图1所示位置放置,图2是由它抽象出的几何图形,B、C、E在同一条直线,连接DC.
- 11已知数列(an)满足:a1-1,a2-a(a>0),数列(bn)满足bn=ana(n+1)(n∈N)
- 12负三分之一的2003次幂乘以负三的2007次幂等于( )
- 13镇江实验七年级下册数学《周末练习(1)》的答案.
- 14i like eat(),so i keep many() A chicken,chickens B chickens,
- 15She can fly kites very well now是什么时态
