(2013•川汇区一模)甲、乙两个港口相距36千米,一艘轮船从甲港出发,顺流航行3小时到达乙港.休息1小时后立即返回;一
 xl862022-10-04 11:39:541条回答
xl862022-10-04 11:39:541条回答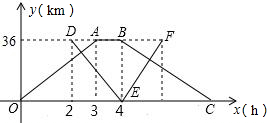 (2013•川汇区一模)甲、乙两个港口相距36千米,一艘轮船从甲港出发,顺流航行3小时到达乙港.休息1小时后立即返回;一艘快艇在轮船出发2小时后从乙港出发,逆流航行2小时到达甲港,并立即返回(掉头时间忽略不计).已知水流的速度是1千米/米.如图表示轮船和快艇距甲港的距离y(千米)与轮船出发时间x(小时)之间的函数关系图象.
(2013•川汇区一模)甲、乙两个港口相距36千米,一艘轮船从甲港出发,顺流航行3小时到达乙港.休息1小时后立即返回;一艘快艇在轮船出发2小时后从乙港出发,逆流航行2小时到达甲港,并立即返回(掉头时间忽略不计).已知水流的速度是1千米/米.如图表示轮船和快艇距甲港的距离y(千米)与轮船出发时间x(小时)之间的函数关系图象.(1)求轮船和快艇返回时的解析式,并写出自变量的取值范围;
(2)快艇出发多长时间,轮船和快艇在返回途中相距6千米?

已提交,审核后显示!提交回复
共1条回复
 薇薇雪 共回答了18个问题
薇薇雪 共回答了18个问题 |采纳率94.4%- 解题思路:(1)先根据图象求出甲船的顺流速度,就可以由条件求出逆流航行速度,从求出轮船从乙港返回甲港的时间,就可以求出C的坐标,根据待定系数法就可以求出BC的解析式,同理先求出快艇的逆流速度,再根据条件可以求出顺流速度,从而可以快艇返回的时间,求出F的坐标.由待定系数法求出其解析式;
(2)根据(1)的解析式建立方程就可以得出结论.(1)由题意,得
轮船顺水航行的速度为:36÷3=12km/时,
∴轮船逆流航行的速度为:12-1=11km/时.
∴轮船逆流航行的时间为:36÷11=[36/11],
∴C([80/11],0)
快艇逆水航行的速度为:36÷2=18km/时,
∴快艇顺水航行的速度为:18+1=19km/时,
∴快艇顺水航行的时间为:[36/19],
∴F([112/19],36).
设BC的解析式为y=k1x+b1,设EF的解析式为y=k2x+b2,由题意,得
36=4k1+b1
0=
80
11k1+b1,
0=4k2+b2
36=
112
19k2+b2,
解得:
k1=−11点评:
本题考点: 一次函数的应用.
考点点评: 本题是一道一次函数的综合试题,考查了航行问题在实际问题中的运用,待定系数法求一次函数的解析式的运用,解答时求出一次函数的解析式时解答本题的关键. - 1年前
相关推荐
- (2013•川汇区模拟)下列有关二氧化碳的性质、检验、制备的叙述正确的是( )
(2013•川汇区模拟)下列有关二氧化碳的性质、检验、制备的叙述正确的是( )
A.二氧化碳气体通入紫色石蕊试液中,溶液变为蓝色
B.将燃着的木条伸入集气瓶,火焰立即熄灭,证明瓶内原有气体就是二氧化碳
C.用块状石灰石和稀硫酸迅速制备大量二氧化碳
D.常用澄清石灰水检验某种气体是不是二氧化碳 llr8301年前1
llr8301年前1 -
 crsctlz 共回答了20个问题
crsctlz 共回答了20个问题 |采纳率85%解题思路:A、根据二氧化碳的化学性质进行分析判断.
B、将燃着的木条伸入集气瓶,火焰立即熄灭,说明该气体不能支持燃烧.
C、根据实验室二氧化碳的制取方法进行分析判断.
D、根据二氧化碳的检验方法进行分析判断.A、二氧化碳气体通入紫色石蕊试液中,二氧化碳与水反应生成碳酸,碳酸能使紫色石蕊试液变红色,故选项说法错误.
B、将燃着的木条伸入集气瓶,火焰立即熄灭,说明该气体不能支持燃烧,不能支持燃烧的气体不一定是二氧化碳,故选项说法错误.
C、石灰石与H2SO4反应生成微溶的CaSO4覆盖在块状石灰石的表面,阻止了反应继续进行,不能用于迅速制备大量二氧化碳,故选项说法错误.
D、二氧化碳能与石灰水中的溶质氢氧化钙反应生成碳酸钙沉淀和水,常用澄清石灰水检验某种气体是不是二氧化碳,故选项说法正确.
故选D.点评:
本题考点: 二氧化碳的化学性质;二氧化碳的实验室制法.
考点点评: 本题难度不大,掌握二氧化碳的化学性质、实验室制取二氧化碳的方法是正确解答本题的关键.1年前查看全部
- (2013•川汇区模拟)某实验室的废液中含有大量的FeSO4、CuSO4,小刚同学欲从上述废液中回收Cu,并得到副产品F
(2013•川汇区模拟)某实验室的废液中含有大量的FeSO4、CuSO4,小刚同学欲从上述废液中回收Cu,并得到副产品FeSO4.设计实验流程如下图所示,回答问题:
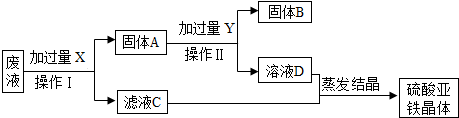
(1)物质X、Y的名称是______.
(2)操作I用到的玻璃仪器有______(三种)
(3)写出上述流程中所涉及的一个化学反应的化学方程式______. kingtu1年前1
kingtu1年前1 -
 江小鱼2008 共回答了24个问题
江小鱼2008 共回答了24个问题 |采纳率87.5%解题思路:向废液中加入过量的铁粉,铁比铜活泼,能和硫酸铜反应生成铜和硫酸亚铁,过滤,得到的滤液是硫酸亚铁溶液,固体中含有生成的铜和剩余的铁粉;
向铜和铁粉的混合物中加入过量的稀硫酸,其中的铁粉能和稀硫酸反应生成硫酸亚铁和氢气,过滤得到的滤液中含有硫酸亚铁和硫酸,固体是铜;
蒸发滤液,能够得到硫酸亚铁晶体.(1)X、Y分别是铁、稀硫酸.
故填:铁、稀硫酸.
(2)操作I是过滤,过滤用到的玻璃仪器有玻璃棒、烧杯、漏斗.
故填:玻璃棒、烧杯、漏斗.
(3)上述流程中所涉及到的化学反应有:铁和硫酸铜反应,铁和稀硫酸反应,化学方程式分别为:Fe+CuSO4=Cu+FeSO4,Fe+H2SO4═FeSO4+H2↑.
故填:Fe+CuSO4=Cu+FeSO4.点评:
本题考点: 金属的化学性质;过滤的原理、方法及其应用;常用仪器的名称和选用;书写化学方程式、文字表达式、电离方程式.
考点点评: 化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,有助于提高观察实验、进行实验的能力.所以,对化学实验不仅要认真观察,还应掌握设计实验、观察实验现象的方法.1年前查看全部
- (2013•川汇区三模)请用所学化学知识回答下列问题.
(2013•川汇区三模)请用所学化学知识回答下列问题.
(1)“酒香不怕巷子深”,说明______
(2)用化学方程式表示用稀盐酸除铁锈(主要成分是Fe2O3)的原理______.
(3)在Cu(NO3)2,Fe(NO3)2,Mg(NO3)2的混合溶液中加入一定量锌粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,没有气泡产生.则滤出的固体中含有的成分是______,写出反应过程中发生的化学反应方程式______. pc265011年前1
pc265011年前1 -
 黑夜穿梭 共回答了12个问题
黑夜穿梭 共回答了12个问题 |采纳率91.7%解题思路:(1)分子是在不断的运动的,据此结合事实进行分析解答.
(2)铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,写出反应的化学方程式即可.
(3)在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,向滤出的固体中滴加稀硫酸,没有气泡产生,说明固体中不含有能与酸反应的金属;据此进行分析解答.(1)“酒香不怕巷子深”,是因为酒香中含有的分子是在不断运动的,向四周扩散,使人们闻到酒香.(2)铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,反应的化学方程式是:Fe2O3+6HCl═2FeCl3+3H2O.(3)Cu(...
点评:
本题考点: 利用分子与原子的性质分析和解决问题;金属活动性顺序及其应用;酸的化学性质.
考点点评: 本题难度不大,掌握利用分子的基本性质分析和解决问题的方法、盐酸的化学性质、金属活动性应用(反应则活泼、不反应则不活泼)是正确解答本题的关键.1年前查看全部
- (2013•川汇区三模)生活中下列做法不正确的是( )
(2013•川汇区三模)生活中下列做法不正确的是( )
A.服用适量的氢氧化钠治疗胃酸过多
B.做馒头时向发酵后的面团中加入纯碱
C.食用适量富含维生素A的动物肝脏可预防夜盲症
D.洗过衣服的水用来冲厕所 pxd9578781年前1
pxd9578781年前1 -
 防蛋喷雾 共回答了24个问题
防蛋喷雾 共回答了24个问题 |采纳率83.3%解题思路:A、氢氧化钠具有强烈的腐蚀性;
B、纯碱--碳酸钠可与酸反应生成二氧化碳;
C、预防夜盲症可多吃含维生素A的动物肝脏等;
D、从节约水资源,一水多用分析解答.A、氢氧化钠具有强烈的腐蚀性,所以不能用来治疗胃酸过多,错误;
B、纯碱--碳酸钠可与酸反应生成二氧化碳,所以在做馒头时向发酵后的面团中加入纯碱,将反应的酸反应掉,从而生成二氧化碳,让馒头疏松多孔,正确;
C、预防夜盲症可多吃含维生素A的动物肝脏等,正确;
D、由于地球上的淡水资源有限,所以要合理利用水资源,如洗过衣服的水用来冲厕所,可节约水资源,正确;
故选A.点评:
本题考点: 常见碱的特性和用途;常用盐的用途;保护水资源和节约用水;生命活动与六大营养素.
考点点评: 了解物质的性质,并且在依据其性质分析用途时还要考虑物质的实用性,如氢氧化钠虽然可与盐酸反应,但由于其腐蚀性太强,不宜用于治疗胃酸过多.1年前查看全部
- (2013•川汇区三模)锌不但能与稀硫酸反应,还能与浓硫酸反应,现有一定质量的锌与浓硫酸在密闭器内发生反应,测得反应前后
(2013•川汇区三模)锌不但能与稀硫酸反应,还能与浓硫酸反应,现有一定质量的锌与浓硫酸在密闭器内发生反应,测得反应前后各物质的质量如下表所示,则下列有关X的说法中,正确的是( )
物质 Zn H2SO4 H2O ZnSO4 X 反应前质量(g) 10.0 48.0 2.0 0 0 反应后质量(g) 3.5 28.4 5.6 16.1 x
A.X一定是催化剂
B.X可能是催化剂
C.X中含有锌和硫元素
D.X中硫元素质量分数为50.0% dlboy1年前1
dlboy1年前1 -
 新北海 共回答了22个问题
新北海 共回答了22个问题 |采纳率95.5%解题思路:根据质量守恒定律:参加化学反应的各物质质量总和等于反应后生成的各物质质量总和,利用在发生化学反应时反应物质量会减小,生成物质量会增多,判断反应物与生成物,然后结合表中的信息逐一分析即可.根据质量守恒定律,反应后X的质量x=10g+48g+2g-3.5g-28.4g-5.6g-16.1g=6.4g;
A、X的质量增加,是生成物,故A错误;
B、X的质量增加,是生成物,故B错误;
C、锌、硫酸质量减少,是反应物;水、硫酸锌、X质量增加,是生成物;反应前共有锌、氢、硫、氧四种元素,其中参加反应的锌元素的质量为10g-3.5g=6.5g;参加反应的硫酸中氢元素的质量为(48-28.4)g×[2/98]=0.4g,硫元素的质量为(48-28.4)g×[32/98]=6.4g,氧元素的质量为48g-28.4g-0.4g-6.4g=12.8g;生成的水中氢元素的质量为(5.6-2)g×[2/18]=0.4g,氧元素的质量为5.6g-2g-0.4g=3.2g;生成的硫酸锌中锌元素的质量为16.1g×[65/161]=6.5g,硫元素的质量为16.1g×[32/161]=3.2g,氧元素的质量为16.1g-6.5g-3.2g=6.4g;根据质量守恒定律可知,X中含有硫元素的质量为6.4g-3.2g=3.2g,含有氧元素的质量为12.8g-3.2g-6.4g=3.2g,因此X中含有氧元素和硫元素,故C错误;
D、由C分析可知,X中含有硫元素的质量为6.4g-3.2g=3.2g,含有氧元素的质量为12.8g-3.2g-6.4g=3.2g,因此X中硫元素质量分数为[3.2g/3.2g+3.2g]×100%=50.0%,故D正确.
故选D.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 做这类题目的关键是反应后质量和反应前进行比较,质量增加了说明是生成物,质量减少了是反应物,质量不变可能是催化剂.1年前查看全部
- (2013•川汇区一模)不同类别的物质间存在着一定的关系,碳酸钠溶液、氢氧化钠溶液和稀盐酸之间的变化关系如图所示.(“-
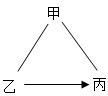 (2013•川汇区一模)不同类别的物质间存在着一定的关系,碳酸钠溶液、氢氧化钠溶液和稀盐酸之间的变化关系如图所示.(“-”表示相连的两种物质能发生反应,“→”表示某种物质可转化为另一种物质.)试判断:
(2013•川汇区一模)不同类别的物质间存在着一定的关系,碳酸钠溶液、氢氧化钠溶液和稀盐酸之间的变化关系如图所示.(“-”表示相连的两种物质能发生反应,“→”表示某种物质可转化为另一种物质.)试判断:
①乙物质是______,在生产和生活中的一种用途______.
②写出“乙→丙”的化学方程式______. 照面1年前1
照面1年前1 -
 故乡韵 共回答了19个问题
故乡韵 共回答了19个问题 |采纳率89.5%解题思路:题给的物质为酸、碱和盐,所以解答时可以依据复分解反应的发生条件对相关物之间的反应进行判断,要求符合甲与乙、甲与丙能反应,乙可在一定条件下生成丙,据此分析解答即可;①根据甲乙丙三种物质分别是碳酸钠溶液、氢氧化钠溶液和稀盐酸中的一种,结合甲与乙、甲与丙能反应,乙可在一定条件下生成丙,可知乙可以是碳酸钠或氢氧化钠,当乙碳酸钠时丙即为氢氧化钠,乙是氢氧化钠丙即为碳酸钠,而甲应为盐酸,乙是Na2CO3或NaOH是都可用来制作洗涤剂(合理即可);
②由①的分析知“乙→丙”的方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH或2NaOH+CO2═Na2CO3+H2O;
故答案为:①Na2CO3或NaOH;制洗涤剂(合理答案均可);
②Na2CO3+Ca(OH)2═CaCO3↓+2NaOH或2NaOH+CO2═Na2CO3+H2O(合理答案均可).点评:
本题考点: 物质的鉴别、推断.
考点点评: 推断题是中考化学题中的一种常见题型,它涉及的知识面广,题型多样,变化复杂,条件隐蔽,容易出错,是一种既考查知识,又考查能力的题型.解题的关键是在审题的基础上找准解题的突破口.经过分析,归纳,推理,得出正确的答案.1年前查看全部
- (2013•川汇区模拟)2013年1月份郑州出现持续雾霾天气,影响到市民健康和交通出行.专家分析电厂、工业燃煤、机动车尾
(2013•川汇区模拟)2013年1月份郑州出现持续雾霾天气,影响到市民健康和交通出行.专家分析电厂、工业燃煤、机动车尾气、工地扬尘在郑州的空气污染贡献中各占三成.请你结合生活实际谈谈如何更好的治理空气污染,还大家一片蓝天.(写三条简单可行、行之有效的措施)
 jinhui7710291年前1
jinhui7710291年前1 -
 ChisenZ 共回答了16个问题
ChisenZ 共回答了16个问题 |采纳率100%空气污染的主要途径是电厂、工业燃煤、机动车尾气、工地扬尘等因素,所以为了更好的治理空气污染,我们应该使用清洁能源、尽量使用公共交通工具、工地要定时洒水,渣土车要覆盖等.
故答案为:①使用清洁能源;②尽量使用公共交通工具;③工地要定时洒水,渣土车要覆盖.1年前查看全部
- (2013•川汇区模拟)下列括号中的物质是除去杂质所需的药品,其中错误是( )
(2013•川汇区模拟)下列括号中的物质是除去杂质所需的药品,其中错误是( )
A.NaCl中有杂质Na2SO4(氯化钡)
B.CuO中有杂质Cu(稀硫酸)
C.CO2中有少量CO(灼热的氧化铜)
D.SO2中有少量HCl气体(氢氧化钠溶液) tccye1年前1
tccye1年前1 -
 最爱青岛的秋天 共回答了19个问题
最爱青岛的秋天 共回答了19个问题 |采纳率94.7%解题思路:A、根据硫酸钠和氯化钡会生成硫酸钡沉淀进行分析;
B、根据金属氧化物会溶于酸进行分析;
C、根据一氧化碳具有还原性进行分析;
D、根据酸性气体会与碱反应进行分析.A、硫酸钠和氯化钡反应生成硫酸钡沉淀和氯化钠,过滤后,就只剩氯化钠了,故A正确;
B、氧化铜会与硫酸反应而溶解,但是氧化铜是主要物质,故B错误;
C、混合气通过灼热的氧化铜后,一氧化碳会生成二氧化碳,故C正确;
D、二氧化硫和氯化氢气体都会与氢氧化钠反应,但是二氧化硫是主要物质,故D错误,
故选BD.点评:
本题考点: 物质除杂或净化的探究.
考点点评: 在解此类题时,首先分析杂质和物质的性质,然后选择合适的试剂只与杂质反应,又不会引入新的杂质就可选取.1年前查看全部
- (2013•川汇区三模)下列图示的实验操作正确的是( )
(2013•川汇区三模)下列图示的实验操作正确的是( )
A.
取用碳酸钠固体
B.
熄灭酒精灯
C.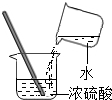 稀释浓硫酸
稀释浓硫酸
D.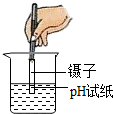
测溶液酸碱度 llv2700340821年前1
llv2700340821年前1 -
 nnnnxx 共回答了15个问题
nnnnxx 共回答了15个问题 |采纳率100%解题思路:A、根据向试管中粉末状固体药品的方法进行分析判断.
B、使用酒精灯时要注意“两查、两禁、一不可”.
C、根据浓硫酸的稀释方法进行分析判断.
D、根据用pH试纸测定溶液的pH的方法进行分析判断.A、取用粉末状药品,试管横放,用药匙或纸槽把碳酸钠固体送到试管底部,图中所示操作正确.
B、使用酒精灯时要注意“两查、两禁、一不可”,不可用嘴吹灭酒精灯,应用灯帽盖灭,图中所示操作错误.
C、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;一定不能把水注入浓硫酸中;图中所示操作错误.
D、用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH.不能将pH试纸伸入待测液中,以免污染待测液,图中所示操作错误.
故选A.点评:
本题考点: 固体药品的取用;加热器皿-酒精灯;浓硫酸的性质及浓硫酸的稀释;溶液的酸碱度测定.
考点点评: 本题难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操作的注意事项是解答此类试题的关键.1年前查看全部
- (2013•川汇区三模)氨气是一种具有强烈刺激性气味的气体,密度比空气小,极易溶于水,其水溶液显碱性,实验室可用浓氨水与
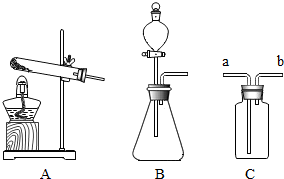 (2013•川汇区三模)氨气是一种具有强烈刺激性气味的气体,密度比空气小,极易溶于水,其水溶液显碱性,实验室可用浓氨水与生石灰反应来制取氨气.
(2013•川汇区三模)氨气是一种具有强烈刺激性气味的气体,密度比空气小,极易溶于水,其水溶液显碱性,实验室可用浓氨水与生石灰反应来制取氨气.
(1)请你从图中选择实验室用此方法制取氨气的发生装置.
(2)若用C装置收集氨气,则气体要从______(填“a”或“b”)进入集气瓶.
(3)将石蕊溶液滴加到盛有氨气的集气瓶中,可观察到的现象是什么?
(4)氨气具有强烈刺激性,怎么才能正确闻氨气的气味? seyou9991年前1
seyou9991年前1 -
 ashelyyin 共回答了19个问题
ashelyyin 共回答了19个问题 |采纳率94.7%解题思路:(1)根据反应物的状态和反应条件选择发生装置:固体加热型和固液常温型;
(2)根据氨气的密度选择合适的进气口;
(3)根据氨气水溶液显碱性的信息分析对石蕊试液的作用;
(4)闻氨气时,在操作上应注意:不要把鼻孔凑到容器口去闻氨气的气味;应该用手在容器口轻轻扇动,让极少量气体飘进鼻孔.(1)实验室可用浓氨水与生石灰反应来制取氨气,故发生装置的特点是固液常温型的B装置;
(2)因为密度比空气小,故进气口是短管b,把空气从长管压出;
(3)氨气水溶液显碱性,能够使石蕊试液变成蓝色;
(4)氨气具有强烈刺激性,正确闻氨气的气味的方法是:用手在容器口轻轻扇动,让极少量气体飘进鼻孔.
故答案为:(1)B;(2)B;(3)石蕊试液变成蓝色;(4)用手在容器口轻轻扇动,让极少量气体飘进鼻孔.点评:
本题考点: 常用气体的发生装置和收集装置与选取方法.
考点点评: 本题考查了实验室制气体的发生装置和收集装置的选择以及气体性质的检验,综合性比较强.关键是明确发生装置、收集方法选择的依据,并充分利用题目给出的信息结合已有的相关知识完成.1年前查看全部
- (2013•川汇区模拟)在实验室中可用下图装置来制取气体,请回答下列问题:
(2013•川汇区模拟)在实验室中可用下图装置来制取气体,请回答下列问题:
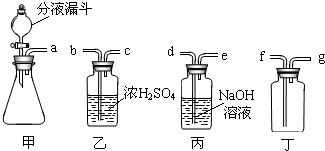
(1)实验室确定气体发生装置时应考虑的因素是______.
(2)制取氧气时,液体反应物不是一次性加入到锥形瓶中,而是通过分液漏斗逐滴加入,这样做的优点是______,
(3)制取干燥的氧气时,装置的正确连接顺序是(填导管口的字母)______.
(4)装置甲也可用来制取二氧化碳,通常要检验所制得的气体是否为二氧化碳?写出检验时所发生反应的化学方程式.______. 这里的用户名真短1年前1
这里的用户名真短1年前1 -
 hongyunzhizi 共回答了18个问题
hongyunzhizi 共回答了18个问题 |采纳率100%解题思路:(1)根据选择气体发生装置要考虑反应物的状态和反应条件分析;
(2)根据分液漏斗的特点写出优点;
(3)依据常用的气体干燥(除水)装置及实验装置的连接来解答;
(4)澄清石灰水可用来检验二氧化碳,据反应原理书写方程式.(1)确定气体发生装置时要考虑反应物的状态和反应条件;
(2)分液漏斗可逐滴加入可以控制反应的速率,需要时滴加,不需要时可停止,所以还可以节约药品;
(3)依据常用的气体干燥(除水)装置及实验装置的连接方法,应先让气体从长导管通入浓硫酸,水分被吸收,干燥后的气体从短导管导出;氧气密度比空气大,选用向上排空气法收集,应先让氧气从长导管进入集气瓶底部,空气从短导管排出;因此制取干燥的氧气时,装置的正确连接顺序是:a→b→c→f→g;
(4)检验二氧化碳气体用澄清石灰水,即通入所得气体,若石灰水变浑浊,说明通入的气体是二氧化碳,反应方程式是:Ca(OH)2+CO2=CaCO3↓+H2O;
故答案为:(1)反应物的状态和反应条件;
(2)便于控制反应的速率;
(3)a→b→c→f→g;
(4)Ca(OH)2+CO2=CaCO3↓+H2O.点评:
本题考点: 实验室制取气体的思路;气体的干燥(除水);二氧化碳的检验和验满;书写化学方程式、文字表达式、电离方程式.
考点点评: 发生装置的选择要考虑反应物的状态和反应条件,分液漏斗可以控制反应的速率,洗气装置中导管长进短出,检验二氧化碳用澄清的石灰水等,这些知识是化学实验中的常考问题,同学们一定要记清,才能进行相关问题的解答.1年前查看全部
- (2013•川汇区三模)请你从:氮气、氢气、氦气、甲烷、一氧化碳等物质中选择适当的物质,用化学式填空.
(2013•川汇区三模)请你从:氮气、氢气、氦气、甲烷、一氧化碳等物质中选择适当的物质,用化学式填空.
(1)可充填探空气球,也可做焊接金属时的保护气的是______;
(2)属于可再生能源的是______;
(3)能与血红蛋白结合使人中毒的是______. uu大军81年前1
uu大军81年前1 -
 箭步如肥 共回答了24个问题
箭步如肥 共回答了24个问题 |采纳率95.8%解题思路:首先根据题意确定物质的化学名称,然后根据书写化学式的方法和步骤写出物质的化学式即可.(1)氦气的密度小、化学性质很不活泼,可充填探空气球,也可做焊接金属时的保护气,其化学式为:He.
(2)甲烷属于可再生能源,其化学式为:CH4.
(3)一氧化碳能与血红蛋白结合使人中毒,其化学式为:CO.
故答案为:(1)He;(2)CH4;(3)CO.点评:
本题考点: 化学式的书写及意义.
考点点评: 本题难度不大,熟练掌握常见物质的性质、用途、组成及化学式的书写是正确解答此类题的关键所在.1年前查看全部
- (2013•川汇区三模)下列物质能在指定环境下能共同存在的是( )
(2013•川汇区三模)下列物质能在指定环境下能共同存在的是( )
A.在有CO32−存在的溶液中:食醋、食盐、小苏打
B.在澄清,无色溶液中:氯化钠、氢氧化钡、硝酸钾
C.在pH=0的溶液中:碳酸钠、硫酸铜、氯化钾
D.在能使酚酞变红色的溶液中:碳酸钠、氯化镁、硝酸锌 晶生晶誓1年前1
晶生晶誓1年前1 -
 赵妙妙 共回答了20个问题
赵妙妙 共回答了20个问题 |采纳率95%解题思路:根据复分解反应发生的条件可知,若物质之间相互交换成分不能生成水、气体、沉淀,则能够在溶液中大量共存;
A、醋酸中的氢离子和碳酸根离子、碳酸氢根离子会生成水和二氧化碳;
B、三种物质之间不会反应;
C、pH=0的溶液,显酸性,氢离子和碳酸根离子反应会生成水和二氧化碳;碳酸根离子和铜离子反应会生成碳酸铜沉淀;
D、使酚酞显红色的溶液,显碱性,氢氧根离子和镁离子、锌离子等产生沉淀.A、醋酸中的氢离子和碳酸根离子-能结合生成水和二氧化碳气体,也和小苏打中的碳酸氢根离子能结合生成水和二氧化碳气体,则不能大量共存,故A错误;
B、三种物质之间不会反应,则能大量共存,且不存在带颜色的物质,故B正确;
C、pH=0的溶液,显酸性,氢离子和碳酸根离离子反应会生成水和二氧化碳;碳酸根离子和铜离子反应会生成碳酸铜沉淀,则不能大量共存,故C错误;
D、滴加酚酞显红色的溶液,显碱性,OH-能分别与镁离子、锌离子结合产生沉淀,则离子不能共存,故D错误;
故选项为:B.点评:
本题考点: 离子或物质的共存问题.
考点点评: 本题考查离子的共存问题,学生能利用复分解反应发生的条件来解答即可,还应注意隐含信息的挖掘,如本题PH=0、有CO32−存在等的分析和应用.1年前查看全部
- (2013•川汇区一模)先化简,再求值:(a+2)(a−1)a2+2a÷(a+1a−2),其中a 2+2a=0
(2013•川汇区一模)先化简,再求值:
÷(a+(a+2)(a−1) a2+2a
−2),其中a 2+1 a
a=0.2  telwap1年前1
telwap1年前1 -
 AA805 共回答了20个问题
AA805 共回答了20个问题 |采纳率85%解题思路:首先对括号内的分式进行通分相减,然后把除法转化成乘法计算乘法则可以化简,然后解方程求得a的值,代入数值计算即可.原式=
(a+2)(a−1)
a(a+2)•[a
(a−1)2
=
1/a−1].
∵a2+
2a=0,
∴a=0或a=-
2,由条件知a≠0,
∴取a=-
2,代入上式,原式=
1
−
2−1=1-
2.点评:
本题考点: 分式的化简求值.
考点点评: 考查了分式的化简求值,分式混合运算要注意先去括号;分子、分母能因式分解的先因式分解;除法要统一为乘法运算.1年前查看全部
- (2013•川汇区三模)“水是生命之源”,请回答以下有关水的问题;
(2013•川汇区三模)“水是生命之源”,请回答以下有关水的问题;
(1)缓解旱情可利用______进行人工降雨.
(2)井水、河水、山泉水几乎都是硬水,长期饮用硬水对健康不利,生活中可以通过______的方法解决这个问题.
(3)高铁酸钾(化学式;K2FeO4)是一种新型的自来水消毒剂,它在水中发生反应的化学方程式为:4K2FeO4+4H2O=2Fe2O3+8KOH+3X↑,则X的化学式为______,K2FeO4中Fe的化合价为______价. King_01年前1
King_01年前1 -
 红红的月亮 共回答了22个问题
红红的月亮 共回答了22个问题 |采纳率86.4%解题思路:(1)根据干冰的性质和用途进行分析;
(2)从硬水的成分和如何简单有效的消除硬水成分进行考虑;
(3)根据化学变化前后原子的种类、数目不变,由反应的化学方程式4K2FeO4+4H2O=2Fe2O3+8KOH+3X↑,推断反应中生成物X的分子构成,根据分子的构成确定X物质的化学式;根据在化合物中正负化合价代数和为零进行分析.(1)干冰升华吸热,可用于人工降雨,故答案为:干冰;
(2)硬水是指含有较多钙、镁离子的水,煮沸能使钙、镁离子形成沉淀、析出,煮沸是生活中最常用的最简单的降低水硬度的方法,故答案为:煮沸;
(3)由反应的化学方程式4K2FeO4+4H2O=2Fe2O3+8KOH+3X↑可知,反应中各原子在反应前后的个数为
反应前 反应后
K原子 8 8
Fe原子 4 4
O原子 20 14
H原子88
根据化学变化前后原子的种类、数目不变,可判断生成物X的3个分子中含6个O原子,则每个X分子由2个O原子构成,物质X的化学式为O2;
钾元素显+1价,氧元素显-2价,设铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(-2)×4=0,则x=+6;
故答案为:O2;+6.点评:
本题考点: 二氧化碳的用途;硬水与软水;有关元素化合价的计算;质量守恒定律及其应用.
考点点评: 根据化学变化前后原子的种类、数目不变,由反应的化学方程式,可以推断反应中某物质的分子构成及物质化学式的确定,掌握利用化合价的原则计算指定元素的化合价的方法.1年前查看全部
- (2013•川汇区模拟)如图是元素周期表中碘元素的信息,下列说法正确的是( )
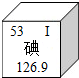 (2013•川汇区模拟)如图是元素周期表中碘元素的信息,下列说法正确的是( )
(2013•川汇区模拟)如图是元素周期表中碘元素的信息,下列说法正确的是( )
A.该元素的质子数为53
B.该元素的原子序数为126.9
C.该元素在地壳中的含量为53%
D.该元素属于金属元素 寸夜1年前1
寸夜1年前1 -
 liu63hm 共回答了12个问题
liu63hm 共回答了12个问题 |采纳率91.7%解题思路:根据原子序数=核内质子数=核外电子数,可知其质子数;金属元素:带金字旁(除汞),则可知碘元素为非金属元素;熟练掌握元素周期表中各元素符号周围内容的含义.A、根据原子序数=核内质子数=核外电子数,故碘原子核内质子数为53,故A正确;
B、126.9表示碘元素的相对原子质量,而不是原子序数,故B错误;
C、53标在此位置表示其原子序数,而不是在地壳中的含量,故C错误;
D、金属元素:带金字旁(除汞),碘为非金属元素,故D错误.
故选A.点评:
本题考点: 元素周期表的特点及其应用;地壳中元素的分布与含量;元素的简单分类.
考点点评: 掌握元素周期表的特点及其应用,会识别和应用原子结构示意图,熟练掌握元素周期表中各元素符号周围内容的含义.1年前查看全部
- (2013•川汇区一模)如图,抛物线经过A(-2,0)、B(8,0)两点,与y轴正半轴交与点C,且AB=BC,点P为第一
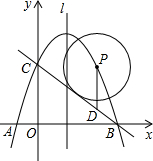 (2013•川汇区一模)如图,抛物线经过A(-2,0)、B(8,0)两点,与y轴正半轴交与点C,且AB=BC,点P为第一象限内抛物线上一动点(不与B、C重合),设点P的坐标为(m,n).
(2013•川汇区一模)如图,抛物线经过A(-2,0)、B(8,0)两点,与y轴正半轴交与点C,且AB=BC,点P为第一象限内抛物线上一动点(不与B、C重合),设点P的坐标为(m,n).
(1)求抛物线的解析式;
(2)点D在BC上,且PD∥y轴,探索[BD•DC/PD]的值;
(3)设抛物线的对称轴为l,若以点P为圆心的⊙P与直线BC相切,请写出⊙P的半径R关于m函数关系式,并判断⊙P与直线l的位置关系. 小啊Q1年前0
小啊Q1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2013•川汇区模拟)镁元素的原子结构示意图为,则m=______,该原子在化学反应中易______(选填“得到”或“
(2013•川汇区模拟)镁元素的原子结构示意图为
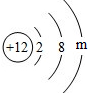 ,则m=______,该原子在化学反应中易______(选填“得到”或“失去”)电子.说明该元素的化学性质与原子的______关系密切.
,则m=______,该原子在化学反应中易______(选填“得到”或“失去”)电子.说明该元素的化学性质与原子的______关系密切.  紫色天门1年前1
紫色天门1年前1 -
 雨夜心星 共回答了20个问题
雨夜心星 共回答了20个问题 |采纳率95%解题思路:由原子中质子数等于核外电子数利用镁元素的原子结构示意图可知m的值,依据其最外层电子数,推测其得失电子情况并进而发现元素的性质和最外层电子数的关系.利用原子序数为12的镁元素的原子结构示意图,根据质子数等于核外电子数可得m=2,其最外层电子数是2,小于4在化学反应中易失去电子,说明元素的化学性质与原子的最外层电子数关系密切.
故答案为:2;失去;最外层电子数;点评:
本题考点: 原子结构示意图与离子结构示意图;核外电子在化学反应中的作用.
考点点评: 此题是对原子结构相关知识的考查;掌握核外电子在化学反应中的作用;了解原子结构示意图的意义是解题的关键;1年前查看全部
- (2013•川汇区三模)某化学兴趣小组探究可燃物燃烧的条件时,做了如图所示实验.他们所做实验的目的是通过控制可燃物___
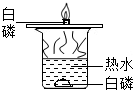 (2013•川汇区三模)某化学兴趣小组探究可燃物燃烧的条件时,做了如图所示实验.他们所做实验的目的是通过控制可燃物______来探究燃烧的条件,白磷燃烧的化学方程式为4P+5O2
(2013•川汇区三模)某化学兴趣小组探究可燃物燃烧的条件时,做了如图所示实验.他们所做实验的目的是通过控制可燃物______来探究燃烧的条件,白磷燃烧的化学方程式为4P+5O2
2P2O5点燃 .4P+5O2.
2P2O5点燃 . 丑angel1年前1
丑angel1年前1 -
 kk110 共回答了10个问题
kk110 共回答了10个问题 |采纳率90%解题思路:燃烧的条件是:物质具有可燃性;可燃物与氧气接触;温度达到可燃物的着火点;
根据反应物、生成物、质量守恒定律可以书写化学方程式.如图所示实验中,铜片上的白磷与氧气接触,温度达到了其着火点,燃烧起来;热水中的白磷没有与氧气接触,虽然温度达到了它的着火点,但是没有燃烧.
他们所做实验的目的是通过控制可燃物是否与氧气接触来探究燃烧的条件.
故填:是否与氧气接触.
白磷燃烧生成五氧化二磷,反应的化学方程式为:4P+5O2
点燃
.
2P2O5.
故填:4P+5O2
点燃
.
2P2O5.点评:
本题考点: 燃烧与燃烧的条件.
考点点评: 书写化学方程式时要注意四步,一是反应物和生成物的化学式要正确,二是遵循质量守恒定律,三是写上必要的条件,四是看是否有“↑”或“↓”.1年前查看全部
- (2013•川汇区模拟)兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验.请你与他们一起完成以下探究
(2013•川汇区模拟)兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验.请你与他们一起完成以下探究活动:
【对固体猜想】
猜想Ⅰ:全部是NaOH;猜想Ⅱ:全部是Na2CO3;猜想Ⅲ:是NaOH和Na2CO3混合物.
【实验和推断】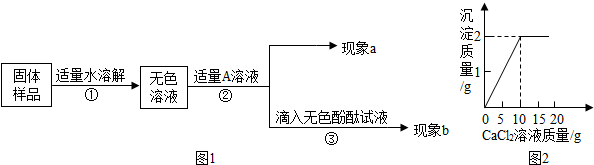
(1)若现象a为有气泡产生,则加入的A溶液是______,说明氢氧化钠已经变质,有气泡产生的反应化学方程式是______.
(2)若A是Ca(OH)2溶液,现象a有白色沉淀,现象b为无色酚酞试液变红色,则白色沉淀为______(填化学式),该实验______(选填“能”或“不能”)说明样品中有NaOH.
(3)若A是CaCl2溶液,当实验现象a为______,现象b为______,则猜想Ⅱ成立.
(4)若同学取该固体样品10g于烧杯中,加水溶解,然后逐滴滴加一定浓度的CaCl2溶液.测得生成沉淀的质量与滴入CaCl2溶液的质量,其关系如图2所示.
请根据题意计算:该样品中Na2CO3的质量分数是多少? kissmytit1年前1
kissmytit1年前1 -
 夏天的** 共回答了19个问题
夏天的** 共回答了19个问题 |采纳率78.9%解题思路:根据氢氧化钠的性质进行分析,氢氧化钠露置在空气中易与二氧化碳反应生成碳酸钠而变质,反应的程度不同,则变质的程度不同;检验碳酸盐使用的是加酸化气的方法或加入含有可溶性钙离子、钡离子的方法,要证明含有氢氧化钠,则需要除去碳酸钠再进行检验,且加入的试剂与碳酸钠反应后不能生成显碱性的物质;
变质的氢氧化钠含有碳酸钠,与氯化钙反应会生成碳酸钙沉淀,由图象知加入10g氯化钙溶液碳酸钠正好完全反应,生成碳酸钙质量是2g,从而可求碳酸钠的质量和质量分数.(1)氢氧化钠变质生成的是碳酸钠,如果加入A后产生气泡,则加入的物质是酸,可以是稀盐酸,盐酸能与碳酸钠反应生成氯化钠、水和二氧化碳,该反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(2)氢氧化钙能与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,故白色沉淀是碳酸钙,其化学式为:CaCO3;生成的氢氧化钠能使酚酞试液变红,故不能确定原固体中是否含有氢氧化钠;
(3)若全部是碳酸钠,则加入的氯化钙能与碳酸钠反应生成碳酸钙白色沉淀和氯化钠,生成的氯化钠的水溶液呈中性,不能使酚酞试液变红,所以现象a为产生白色沉淀,现象b为酚酞不变色;
(4)解;由图可知反应生成碳酸钙质量是2g,
设样品中碳酸钠的质量为x,
Na2C03+CaCl2=CaC03↓+2NaCl
106 100
x 2g
[106/x]=[100/2g] x=2.12g
该样品中碳酸钠的质量分数=[2.12g/10g]×100%=21.2%
答:该样品中碳酸钠的质量分数是21.2%.
故答案为:
(1)稀盐酸; Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(2)CaCO3;不能;
(3)有白色沉淀生成;无色酚酞试液不变色;
(4)解;由图可知反应生成碳酸钙质量是2g,
设样品中碳酸钠的质量为x,
Na2C03+CaCl2=CaC03↓+2NaCl
106 100
x 2g
[106/x]=[100/2g] x=2.12g
该样品中碳酸钠的质量分数=[2.12g/10g]×100%=21.2%
答:该样品中碳酸钠的质量分数是21.2%.点评:
本题考点: 药品是否变质的探究;酸的化学性质;碱的化学性质;盐的化学性质;根据化学反应方程式的计算.
考点点评: 本考点考查了氢氧化钠在空气中的变质情况的探究,还考查了利用图象的分析求出碳酸钠的质量分数,题目不是太难,但是综合性比较强,完成此题,可以依据氢氧化钠和碳酸钠的性质及检验方法进行.1年前查看全部
- (2013•川汇区模拟)在锌和氧化铜混合粉末中,加入一定量的稀硫酸充分反应后过滤,发现滤纸上有锌和铜.滤液所含的溶质是_
(2013•川汇区模拟)在锌和氧化铜混合粉末中,加入一定量的稀硫酸充分反应后过滤,发现滤纸上有锌和铜.滤液所含的溶质是______(填化学式),该反应事实说明:锌的金属活动性比铜______(填“强”或“弱”)
 小弯5261年前1
小弯5261年前1 -
 ll的ll 共回答了23个问题
ll的ll 共回答了23个问题 |采纳率87%解题思路:锌可以和稀硫酸反应生成硫酸锌和氢气,氧化铜可以和稀硫酸反应生成硫酸铜和水,锌可以与硫酸铜反应生成硫酸锌和铜.根据给出的物质,可以知道,锌可以和稀硫酸反应生成硫酸锌和氢气,氧化铜可以和稀硫酸反应生成硫酸铜和水,锌可以与硫酸铜反应生成硫酸锌和铜,现在反应完后发现滤纸上有锌和铜,说明滤液中一定有硫酸锌,锌可以把硫酸铜中的铜置换出来,说明在金属活动性顺序中,锌在铜的前面,活动性比铜强,所以本题答案为:ZnSO4,强.
点评:
本题考点: 金属活动性顺序及其应用;酸的化学性质.
考点点评: 本题通过物质间的反应考查了金属活动性顺序的判断,完成此题,可以依据已有的知识进行,所以要求同学们在平时的学习中加强基础知识的储备,以便能够灵活应用1年前查看全部
- (2013•川汇区三模)下列各化学反应方程式所表示的反应能够进行.且属于置换反应的是( )
(2013•川汇区三模)下列各化学反应方程式所表示的反应能够进行.且属于置换反应的是( )
A.CO+CuO
Cu+CO2加热 .
B.3C+2Fe2O3
4Fe+3CO2↑高温 .
C.Fe+ZnSO4=Zn+FeS04
D.Ba(OH)2+CuSO4=BaSO4↓+Cu(OH)2 catangle1年前1
catangle1年前1 -
 A_08630 共回答了11个问题
A_08630 共回答了11个问题 |采纳率100%解题思路:置换反应是指由一种单质和一种化合物反应,生成另外一种单质和一种化合物的反应;两种物质混合时能否反应,取决于物质的性质.A、一氧化碳和氧化铜在加热条件下能够反应,生成铜和二氧化碳,但是,反应物是两种化合物,没有单质,不属于置换反应.
B、碳和氧化铁在高温条件下反应,能够生成铁和二氧化碳,反应物和生成物都是一种单质和一种化合物,属于置换反应.
C、铁在金属活动性顺序中,排在锌的后面,不能置换硫酸锌中的锌,即该反应不能进行.
D、氢氧化钡和硫酸铜反应能够生成硫酸钡沉淀和氢氧化铜沉淀,但是,反应物和生成物都是两种化合物,不属于置换反应.
故选:B.点评:
本题考点: 置换反应及其应用.
考点点评: 本题属于基础知识题,只要掌握了物质的性质就可顺利解答.1年前查看全部
- (2013•川汇区模拟)下列说法错误的是( )
(2013•川汇区模拟)下列说法错误的是( )
A.NaHCO3俗称小苏打,可用于制发酵粉
B.稀释浓硫酸应将酸慢慢加入水中,并搅拌
C.生石灰吸水属于物理变化
D.氢氧化钠固体不能用于干燥二氧化碳气体 iambillie1年前1
iambillie1年前1 -
 安蓉2004 共回答了22个问题
安蓉2004 共回答了22个问题 |采纳率95.5%解题思路:A、NaHCO3俗称小苏打,碳酸氢钠能与胃酸中的盐酸反应.
B、根据浓硫酸的稀释方法进行分析判断.
C、生石灰吸水时与水反应生成氢氧化钙,有新物质生成.
D、氢氧化钠固体不能干燥二氧化碳、二氧化硫、氯化氢等溶于水显酸性的气体.A、NaHCO3俗称小苏打,碳酸氢钠能与胃酸中的盐酸反应,可用于制发酵粉,故选项说法正确.
B、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散,故选项说法正确.
C、生石灰吸水时与水反应生成氢氧化钙,有新物质生成,属于化学变化,故选项说法错误.
D、CO2能与氢氧化钠反应生成碳酸钠和水,不能用NaOH固体干燥,故选项说法错误.
故选C.点评:
本题考点: 常用盐的用途;浓硫酸的性质及浓硫酸的稀释;生石灰的性质与用途;根据浓硫酸或烧碱的性质确定所能干燥的气体;化学变化和物理变化的判别.
考点点评: 本题难度不大,物质的性质决定物质的用途,掌握常见化学物质的性质和用途、干燥剂不能与被干燥的气体发生化学反应是正确解答本题的关键.1年前查看全部
- (8414•川汇区一模)人感染HwN9禽流感是由HwN9亚型禽流感病毒引起的急性呼吸道传染病.该病毒平均球形直径为4.4
(8414•川汇区一模)人感染HwN9禽流感是由HwN9亚型禽流感病毒引起的急性呼吸道传染病.该病毒平均球形直径为4.44444418米,将这个数用科学记数法表示为( )
A.1.2×10-5
B.1.2×10-6
C.1.2×10-7
D.1.2×10-8 忘忧小芬1年前1
忘忧小芬1年前1 -
 belinda119 共回答了25个问题
belinda119 共回答了25个问题 |采纳率92%解题思路:绝对值小于1的正数也可以利用科学记数法表示,一般形式为a×10-n,与较大数的科学记数法不同的是其所使用的是负指数幂,指数由原数左边起第一个不为零的数字前面的0的个数所决定.他.他他他他他他12=1.2×1他-他,
故选:C.点评:
本题考点: 科学记数法—表示较小的数.
考点点评: 本题考查用科学记数法表示较小的数,一般形式为a×10-n,其中1≤|a|<10,n为由原数左边起第一个不为零的数字前面的0的个数所决定.1年前查看全部
- (2013•川汇区三模)如图所示是氢氧化钠的溶解度曲线,请回答下列问题:
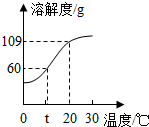 (2013•川汇区三模)如图所示是氢氧化钠的溶解度曲线,请回答下列问题:
(2013•川汇区三模)如图所示是氢氧化钠的溶解度曲线,请回答下列问题:
(1)t℃时氢氧化钠饱和溶液的溶质质量分数是______.
(2)室温为20℃时,某同学向100g20℃的水中加入150g氢氧化钠,发现氢氧化钠全部溶解,过一段时间后又有部分氢氧化钠晶体析出,请你解释出现这种现象的原因是______. 林思遥1年前1
林思遥1年前1 -
 黎玉 共回答了17个问题
黎玉 共回答了17个问题 |采纳率100%解题思路:(1)据t℃时氢氧化钠的溶解度分析解答;
(2)根据氢氧化钠溶于水放热,及氢氧化钠的溶解度随温度的升高而增大分析解答.(1)t℃时氢氧化钠的溶解度是60g,所以氢氧化钠溶液的溶质质量分数是[60g/160g]×100%=37.5%;
(2)室温为20℃时,某同学向100g20℃的水中加入150g氢氧化钠,发现氢氧化钠全部溶解,过一段时间后又有部分氢氧化钠晶体析出,出现这种现象的原因是氢氧化钠溶于水放热,使水温升高,溶解度增大,使氢氧化钠全部溶解,一段时间后,水温恢复到室温,溶解度降低,多余的氢氧化钠又形成晶体析出;
故答案为:(1)37.5%;
(2)氢氧化钠溶于水放热,使水温升高,溶解度增大,使氢氧化钠全部溶解,一段时间后,水温恢复到室温,溶解度降低,多余的氢氧化钠又形成晶体析出.点评:
本题考点: 固体溶解度曲线及其作用;常见碱的特性和用途.
考点点评: 饱和溶液中溶质质量分数的计算式[溶解度/溶解度+100g]×100%,氢氧化钠溶于水放热,氢氧化钠的溶解度随温度的升高而增大.1年前查看全部
大家在问
- 1如图所示,质量为m1和m2的两个物体用细线相连,在水平恒力F作用下,沿光滑水平面,做匀加速直线运动,细线上拉力的大小是(
- 2当你打电话,询问对方是谁时,你应该说:
- 3小刚有五角硬币和一元硬币各若干枚共六元五角钱设五角硬币有x枚一元硬币y枚列出方程为
- 4(2014•抚州二模)2012年12月31日,山西某公司发生一起苯胺泄漏事故,造成水体严重污染.苯胺的化学式C6H5NH
- 5一个个什么?一个个( )填词,不是填一个字,
- 6one is a chinese book. _is an english book.
- 7用the head teacher来回答
- 8初中一年级数学100闯关39至40的答案
- 9saturday and sunday are ( 选什么是weekend还是weekends?
- 10一个分数的分子比分母大12,把它约分后得10分之7,这个分数是多少
- 11The most of和Most of 有什么区别
- 12人教版英语书八年级下第六单元43页3a翻译
- 13五段动词、一段动词、サ变动词和カ变动词的过去式分别是怎样的?
- 14根据中文提示完成下列句子(人称代词,物主代词和反身代词)
- 15坚持自我,不管别人怎么说用成语怎么说?
