在恒容的密闭容器中,可逆反应X(s)+Y(g)=2Z(g)▷H>0
 bx092022-10-04 11:39:541条回答
bx092022-10-04 11:39:541条回答达到平衡时,下列说法正确的是
A:充入少量He使容器内压强增大,平衡正移
B:升高温度,平衡向正反应方向移动,容器内压强减小
C:继续加入少量X,再次平衡时,Y的转化率增大
D:继续加入少量Y,再次平衡时,Y的体积分数比上次平衡小

已提交,审核后显示!提交回复
共1条回复
 lihuimin7711 共回答了14个问题
lihuimin7711 共回答了14个问题 |采纳率92.9%- 选D
解析:
A 恒温恒容时,充入稀有气体,总压增大,分压不变,浓度不变,所以平衡不移动.
B 温度升高,平衡向正反应方向移动,生成气体的物质的量增大,所以容器内压强增大.
C加入X,X是固体,不影响化学平衡,所以Y的转化率不变.
D 加入Y,平衡向正向移动,但加入的量多,转化的少,所以再次平衡时,Y的体积分数比上次平衡小. - 1年前
相关推荐
- 关于转化率的问题.aA+bB=cC+dD 恒温恒容中 (全是气体,可逆反
关于转化率的问题.aA+bB=cC+dD 恒温恒容中 (全是气体,可逆反
aA+bB=cC+dD 恒温恒容中 (全是气体,可逆反应)
加入A,那么由于是恒容,C(A) 变大.反应向正反应移动,即B 的 转化率增大.那么A的转化率呢?
aA=bB+cC 中 若 a>b+c 那么加入A,由于压强增大,本应增大的体积没增大,跟减少体积一个道理.所以,促进正反应所以 转化率会提高.—————这是正确的.
所以,按理来 A的转化率 若 a+b>c+d 应该增加.
然后是我要问的部分
但是 A的转化率却减少,这是为什么? 网络改变了我1年前2
网络改变了我1年前2 -
 maigei1131 共回答了15个问题
maigei1131 共回答了15个问题 |采纳率86.7%大家都这一点不明白,关键是物质B,物质B,已经反应了一大部分,你加入A,哪来的物质B与之反应呢1年前查看全部
- 现有甲乙两个容积相等的恒容密闭容器,向甲中通入6molA和2molB,向乙中通入1.5molA,0.5molB和3mol
现有甲乙两个容积相等的恒容密闭容器,向甲中通入6molA和2molB,向乙中通入1.5molA,0.5molB和3molC,将两容器的温度恒定为770K,使反应3A(g)+B(g)==xC(g)+D(s)达到平衡,此时测得甲乙两容器中C的体积分数都为0.2.
若平衡时,甲、乙两容器中A的物质的量相等,改为按不同配比作为乙的起始物质,达到平衡后,C的体积分数都仍为0.2.
①反应从逆反应方向开始,则D的起始物质的量应满足的条件是________________
②若加入0.6molA和0.2molB,则C和D起始物质的量分别应满足__________、__________
③若平衡时两容器中的压强不相等,则两容器中压强之比为____________.
①n(D)>4/3mol ②n(C)=3.6mol n(D)>1.13mol ③8:5
求详详详详解. 卡卡奴1年前1
卡卡奴1年前1 -
 长城置业0 共回答了15个问题
长城置业0 共回答了15个问题 |采纳率100%要使甲乙平衡相等,必 甲中加入物质=乙加入物质
3A(g)+ B(g)==xC(g)+D(s)
起:1.5 0.2 3mol
变:9/x 3/x 3mol
平:1.5+9/x 0.2+3/x 0
1.5+9/x=6
0.2+3/x=2没地方写了1年前查看全部
- 恒容下,一定的理想气体,当温度升高时热力学能怎么变化?
 美猴王NO_1小猴子1年前3
美猴王NO_1小猴子1年前3 -
 我怕来不及 共回答了18个问题
我怕来不及 共回答了18个问题 |采纳率94.4%既然是一定质量的理想气体,当温度升高时,它的内能是增大的.1年前查看全部
- 有关化学平衡与转化率的求助反应物用量的影响(恒温恒容条件下)若反应物不只一种,如:aA(g)+bB(g)可逆号c(C)+
有关化学平衡与转化率的求助
反应物用量的影响(恒温恒容条件下)
若反应物不只一种,如:aA(g)+bB(g)可逆号c(C)+dD(g)
“若只增加A的量,平衡向正反应方向移动,则A的转化率减小,B的转化率增大”为什么?还有 “若只减小A的量,平衡向逆反应方向移动,则B的转化率减小.”那A呢?如何变化? yueqihui1年前1
yueqihui1年前1 -
 宝ル 共回答了17个问题
宝ル 共回答了17个问题 |采纳率94.1%1.A的转化率 = 反应的A的质量 /A的总质量
若只增加A的量,平衡向正反应方向移动,
A虽然也反应了一些,但A的总质量是增大了,
而且A后反应的量没有增加的量多,也就是分母增大的要多.
而B的总质量不变,加入A后B又反应了一些,所以B的转化率增大.
2.只减小A的量,A的转化率变大,
上式分子变小的幅度小于分母变小的幅度.1年前查看全部
- (一)恒温恒容下,将2mol A气体和2mol B气体通入体积为2L的密闭容器中发生如下反应:2A(g)+B(g)⇌x&
(一)恒温恒容下,将2mol A气体和2mol B气体通入体积为2L的密闭容器中发生如下反应:2A(g)+B(g)⇌x C(g)+2D(s),2min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol•L-1.
(1)从开始反应至达到平衡状态,生成C的平均反应速率为______.
(2)x=______.
(3)A的转化率与B的转化率之比为______.
(4)下列各项可作为该反应达到平衡状态的标志的是______.
A.压强不再变化B.气体密度不再变化
C.A的消耗速率与B的消耗速率之比为2:1
(二)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上合成甲醇的反应原理为:CO(g)+2H2(g)⇌CH3OH(g)△H,
下表所列数据是该反应在不同温度下的化学平衡常数(K).
①根据表中数据可判断△H______0 (填“>”、“=”或“<”).温度 250℃ 300℃ 350℃ K 2.041 0.270 0.012
②在300℃时,将2mol CO、3mol H2和2mol CH3OH充入容积为1L的密闭容器中,此时反应将______.
A.向正方向移动B.向逆方向移动C.处于平衡状态D.无法判断
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1451.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
写出该条件下甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______.
(3)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4KOH═2K2CO3+6H2O,则正极的电极反应式为______,随着反应的不断进行溶液的pH______(填“增大”“减小”或“不变”).
(4)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为______. myluckbaby20001年前0
myluckbaby20001年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 一定温度下,向1升的恒容容器中加入2moL碳和2moLCO2,反应为:
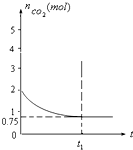 一定温度下,向1升的恒容容器中加入2moL碳和2moLCO2,反应为:
一定温度下,向1升的恒容容器中加入2moL碳和2moLCO2,反应为:
C(s)+CO2(g)⇌2CO(g)△H>0
容器中CO2的物质的量随时间t的变化关系如图.
(1)该温度下,若t1=10min时达到平衡,此时CO2的反应速率为______(写单位),该反应的平衡常数K=______(保留一位小数).
(2)若温度不变,向上述平衡体系中再通入2moLCO2,CO2的转化率将______(填增大、减小、不变、无法确定,下同);若使用适宜的催化剂,CO2的转化率将______;若升高温度,该平衡状态将______移动(填“向正反应方向”、“向逆反应方向”或“不”,下同);若向该容器再通入2moL氦气,该平衡状态将______移动.
(3)该温度下,向该容器加入4moL碳和4moLCO2,达到平衡时CO2物质的量为2moL,请在图中画出容器中CO2的物质的量随时间t的变化示意图. axl19861年前1
axl19861年前1 -
 南泥湾790119 共回答了18个问题
南泥湾790119 共回答了18个问题 |采纳率77.8%解题思路:(1)根据二氧化碳的变化量求出浓度变化,再求速率;根据平衡的浓度求出K;
(2)该反应中方向为体积增大的方向,再通入2moLCO2,体系压强增大,平衡逆移,依此分析转化率;催化剂对平衡无影响;根据温度对平衡的影响分析;体积不变充入稀有气体平衡不移动;
(3)向该容器加入4moL碳和4moLCO2,达到平衡时CO2物质的量为2moL,由于反应物浓度增大,平衡所用时间缩短,据此作图.(1)由图象可知平衡时2moLCO2为0.75mol;
C(s)+CO2(g)⇌2CO(g)
初始量(mol):2 2
转化量(mol):1.25 1.25 2.5
平衡量(mol):0.750.75 2.5
则CO2的反应速率为:
1.25mol
1L
10min=0.125•mol-1•L-1•min-1;平衡时各气体物质的浓度为:c(CO2)[0.75mol/1L]=0.75mol/L,c(CO)=[2.5mol/1L ]=2.5mol/L;
所以K=
c2(CO)
c(CO2)=
2.52
0.75=8.3;
故答案为:0.125•mol-1•L-1•min-1;8.3;
(2)该反应中方向为体积增大的方向,再通入2moLCO2,体系压强增大,与原平衡比较,相当于平衡逆移,所以二氧化碳的转化率减小;催化剂对平衡无影响,所以CO2的转化率不变;已知该反应正方向为吸热反应,所以升高温度平衡正移;体积不变的容器中充入稀有气体,各反应气体的浓度不大,所以平衡不移动;
故答案为:减小;不变; 向正反应方向;不;
(3)向该容器加入4moL碳和4moLCO2,达到平衡时CO2物质的量为2moL,由于反应物浓度增大,平衡所用时间缩短,图象为: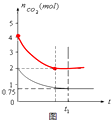 ;
;
故答案为: .
.点评:
本题考点: 物质的量或浓度随时间的变化曲线;化学平衡的计算.
考点点评: 本题考查了化学反应速率、平衡常数、化学平衡影响因素与化学平衡图象等,注意根据反应的特征分析外界条件对平衡的影响,难度中等.1年前查看全部
- 恒温恒容,A+B=C(可逆反应),增加C的物质的量,平衡向哪边移动?
恒温恒容,A+B=C(可逆反应),增加C的物质的量,平衡向哪边移动?
ABC均为气体 没风的日子又如何1年前1
没风的日子又如何1年前1 -
 滑稽兄 共回答了12个问题
滑稽兄 共回答了12个问题 |采纳率75%可用勒沙特列原理定性地说明浓度对化学平衡的影响——增加反应物浓度或减小生成物浓度,平衡向生成物方向移动,增加生成物浓度或减小反应物浓度,平衡向反应物方向移动.1年前查看全部
- 相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/m
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/mol.
实验测得起始、平衡时的有关数据如下表:
下列叙述正确的是( )容器编号 起始时各物质物质的量/mol 平衡时反应中的能量变化 N2 H2 NH3 ① 1 3 0 放出热量a kJ ② 2 3 0 放出热量b kJ ③ 2 6 0 放出热量c kJ
A.放出热量关系:c>2a
B.三个容器内反应的平衡常数:③>①>②
C.平衡时氨气的体积分数:①>③
D.N2的转化率:②>①>③ huan63834561年前1
huan63834561年前1 -
 franksun258 共回答了23个问题
franksun258 共回答了23个问题 |采纳率91.3%解题思路:A、体积不变,加入反应物物质的量增加,压强增大,转化率增大,反应放出的热量增大;
B、平衡常数随温度变化,不随浓度改变;
C、恒温恒容容器内的反应平衡,依据起始量增大一倍,相当于增大体系压强,根据平衡移动方向判断;
D、恒温恒容容器内的反应平衡,依据起始量增大一倍,相当于增大体系压强,根据平衡移动方向判断.A、③起始量相当于在①中又加入了1mol氮气、3mol氢气,由于压强增大,平衡向着正向移动,氮气的转化率增大,即反应消耗的氮气物质的量大于①的2倍,所以反应放出的热量c>2a,故A正确; B、平衡常数随温度变化,不随...
点评:
本题考点: 化学平衡建立的过程.
考点点评: 本题考查化学平衡知识应用(判断平衡状态、图象分析、平衡移动原理、平衡计算);考题主要有两类形式:第一类考查平衡的一般问题,如化学反应速率的表示(计算)、化学平衡图象的分析、平衡常数的大小比较及相关计算.回答化学反应速率时重点留意是否为浓度的改变量.平衡常数的大小比较,关键两者的温度高低.第二类为等效平衡的相关判断.1年前查看全部
- 2SO2+O2=2SO3 恒温恒容 达到平衡 再次加入SO3 SO2的转化率增加
2SO2+O2=2SO3 恒温恒容 达到平衡 再次加入SO3 SO2的转化率增加
平衡正向还是逆向移动?S02的转化率是怎么表示的?起始量按多少算? windies_801年前5
windies_801年前5 -
 浪中浪仙 共回答了17个问题
浪中浪仙 共回答了17个问题 |采纳率76.5%这时平衡一定是逆向移动的,这样的话SO2的转化率当然要减小了,是不需要计算的.1年前查看全部
- N2H4+2O2=2NO+2H2O 1000℃时。恒容条件下,充入N2H4为什么会使C(NO)/C
N2H4+2O2=2NO+2H2O 1000℃时。恒容条件下,充入N2H4为什么会使C(NO)/C
N2H4+2O2=2NO+2H2O
1000℃时。恒容条件下,充入N2H4为什么会使C(NO)/C(O2)增大?
以下是我的想法,不理解为什么这样想就不对。
N2H4增多,因为恒容,所以相当于增大压强,反应逆向移动, C(NO)/C(O2)就相当于 n(NO)/n(O2)那么NO就减少,氧气增多了啊,比值不就减少了么,,,,
 佳音_zz1年前1
佳音_zz1年前1 -
 怕结婚的小猫猫_ff 共回答了14个问题
怕结婚的小猫猫_ff 共回答了14个问题 |采纳率92.9%本题:N2H4增多,是反应物浓度增大。所以反应正向移动,生成更多的NO,还消耗了O2。
楼主误区:单纯压强不改变反应速率,增大压强的情况有两种,一是减少体积,实际上是因为减少体积的同时,各物质浓度都增大了,所以反应速率才增大。二是,恒容加入不参加反应的气体,这种情况不会改变反应进度。1年前查看全部
- 蔗糖恒容燃烧热是多少(文献值)
 laomengzi1年前2
laomengzi1年前2 -
 sars927 共回答了19个问题
sars927 共回答了19个问题 |采纳率100%恒压燃烧热890.31kJ/mol
恒容热的话按照完全燃烧方程式
恒压热减去体积功就行了1年前查看全部
- 有加分! 恒温恒容,可逆反应N2O4=2NO2.充入1molN2O4,反应达平衡状态.若再充入1molN2O4,平衡正移
有加分! 恒温恒容,可逆反应N2O4=2NO2.充入1molN2O4,反应达平衡状态.若再充入1molN2O4,平衡正移还是逆移
1.根据勒夏特列原理,充入N2O4增加反应物浓度平衡正向移动.
2.充入N2O4相当于加压,平衡逆向移动.
这两种理解到底哪种是正确的?
我很纠结. yj9n1年前1
yj9n1年前1 -
 wing_517 共回答了15个问题
wing_517 共回答了15个问题 |采纳率100%1.加入N2O4平衡肯定向正反应方向移动.
2.充入N2O4相当于加压,是相对平衡移动的结果来说的.
以上两个问题应是对于不同问题应用不同方法,过程即移动方向只能用增大反应物的浓度平衡正移来解决.
而对于结果即问最终NO2、N2O4的含量、转化率等时应用等效平衡来处理.1年前查看全部
- PCl 5 (气) PCl 3 (气) +Cl 2 (气) △H>0 当反应达到平衡时,下列措施:①降温②恒容通入惰性气
PCl 5 (气)
 PCl 3 (气) +Cl 2 (气) △H>0 当反应达到平衡时,下列措施:①降温②恒容通入惰性气体③增加Cl 2 的浓度④加压⑤加催化剂⑥恒压通入惰性气体,能提高PCl 5 质量分数的是
PCl 3 (气) +Cl 2 (气) △H>0 当反应达到平衡时,下列措施:①降温②恒容通入惰性气体③增加Cl 2 的浓度④加压⑤加催化剂⑥恒压通入惰性气体,能提高PCl 5 质量分数的是A.①②④ B.①③④ C.②③⑥ D.③⑤⑥  胖乐仙1年前1
胖乐仙1年前1 -
 绿茶kk 共回答了15个问题
绿茶kk 共回答了15个问题 |采纳率100%1年前查看全部
- 在一恒容密闭容器中发生某化学反应2A(g)⇌B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ
在一恒容密闭容器中发生某化学反应2A(g)⇌B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始浓度都为0,反应物A的浓度(mol•L -1 )随时间(min)的变化如图所示:
试回答下列问题:
(1)在实验Ⅰ中,反应在20min至40min内A的平均反应速率为______.
(2)实验Ⅱ和实验I相比,可能隐含的反应条件是______.
(3)根据实验Ⅲ和实验Ⅰ的比较,可推测该反应降低温度,平衡向______(填“正”或“逆”)反应方向移动,该正反应是______(填“放热”或“吸热”)反应.
(4)与实验Ⅰ相比,若实验Ⅰ中的A的起始浓度改为0.8mol•L -1 ,其它条件不变,则达到平衡时所需用的时间______实验Ⅰ(填写“大于”、“等于”或“小于”).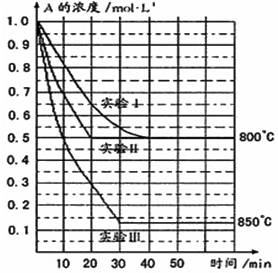
 12345想你1年前1
12345想你1年前1 -
 我爱12 共回答了14个问题
我爱12 共回答了14个问题 |采纳率85.7%(1)实验Ⅰ中,反应在20min至40min内A的浓度变化为0.65mol/L-0.5mol/L=0.15mol/L,所以v(A)=
0.15mol/L
40min-20min =0.0075mol•L -1 •min -1 .
故答案为:0.0075mol•L -1 •min -1 .
(2)实验Ⅱ和实验I相比,平衡状态完全相同,平衡时A的浓度相同,但实验Ⅱ的反应速率快,改变压强平衡不移动,但物质的浓度发生变化,故实验Ⅱ应该使用了催化剂.
故答案为:实验Ⅱ使用了催化剂.
(3)实验Ⅲ和实验Ⅰ的比较,降低温度,平衡时A的浓度增大,平衡向逆反应移动,降低温度平衡向放热反应移动,故正反应为吸热反应.
故答案为:逆;吸热.
(4)A的起始浓度改为0.8mol•L -1 ,等效为降低压强,反应速率降低,到达平衡时间增长,即达到平衡时所需用的时间 大于实验Ⅰ.
故答案为:大于.1年前查看全部
- 相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
2NH 3 (g) N 2 (g)+3H 2 (g)△H=+92.4kJ/mol
N 2 (g)+3H 2 (g)△H=+92.4kJ/mol
实验测的起始、平衡时的有关数据如下表:容器编号 起始时各物质物质的量/mol 平衡时反应中的能量变化 NH 3 N 2 H 2 ① 2 0 0 吸收热量akJ ② 0 1 3 放出热量bkJ ③ 4 0 0 吸收热量ckJ
下列叙述正确的是
A.热量关系:a=b
B.反应的平衡常数:③>①>②
C.达平衡时H 2 的体积分数:①>③
D.①中的密度不再改变时说明反应已达到平衡状态 好友zj1231年前1
好友zj1231年前1 -
 寻找失去的灯火 共回答了25个问题
寻找失去的灯火 共回答了25个问题 |采纳率88%C
1年前查看全部
- 在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知 N2+3
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知 N2+3H2=2NH3) △H=-92.4KJ/mol
图:http://hi.baidu.com/g%D2%BB%BF%C3%B2%DDg/album/item/3e9a4adf4feadc888d1029d4.html#
若压缩至相同体积时,平衡不移动,则有a1+a3=1,现在丙中平衡向正反应方向移动,则a1+a3<1 .
问:我现在以平衡不移动作为条件,那么 转化率=已转化的量/初始的量.但是题目并没给出转化的量,那a1+a3=1是怎样得到的? jxndguodan1年前3
jxndguodan1年前3 -
 亲密爱仁 共回答了17个问题
亲密爱仁 共回答了17个问题 |采纳率88.2%其实不用给出转化的量也可以,
你可以自己设一个转化的量在甲中求得a1表达式
又因为平衡不移动,那么平衡时丙中各物质的量是甲中的两倍
那么可以推得a3的表达式
a1 ,a3相加即可得1
(试一下,不清楚可以再问我)1年前查看全部
- 在一条件下,反应N 2 +3H 2 ⇌2NH 3 在10L恒容密闭容器中进行,测得2min内,N 2 的物质的量由20m
在一条件下,反应N 2 +3H 2 ⇌2NH 3 在10L恒容密闭容器中进行,测得2min内,N 2 的物质的量由20mol减少到8mol,则2min内N 2 的化学反应速率为( ) A.1.2mol•L -1 •min -1 B.1.0 mol•L -1 •min -1 C.0.6 mol•L -1 •min -1 D.0.4 mol•L -1 •min -1  子陌1年前1
子陌1年前1 -
 竹里梅花 共回答了19个问题
竹里梅花 共回答了19个问题 |采纳率89.5%2min内,N 2 的物质的量由20mol减少到8mol,则
v=
△c
△t =
20mol-8mol
10L
2min =0.6 mol•L -1 •min -1 ,
故选C.1年前查看全部
- (2013•江苏三模)在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)⇌zC(g),图I表示200℃时容器中A
(2013•江苏三模)在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)⇌zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )
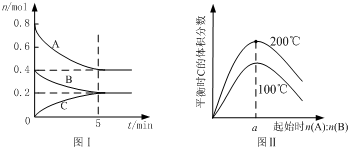
A.200℃时,反应从开始到平衡的平均速率v(B)=0.02 mol•L-1•min-1
B.图Ⅱ所知反应xA(g)+yB(g)⇌zC(g)的△H<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5 喜酸1年前1
喜酸1年前1 -
 whydo33 共回答了15个问题
whydo33 共回答了15个问题 |采纳率93.3%解题思路:A.由图Ⅰ可知,200℃时平衡时,B的物质的量变化量为0.4mol-0.2mol,根据v=
计算v(B);△n V △t
B.由图Ⅱ可知,n(A):n(B)一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应移动,据此判断反应热效应;在一定的温度下只要A、B起始物质的量之比刚好等于平衡化学方程式化学计量数之比,平衡时生成物C的体积分数就最大,由图Ⅰ判断200℃时A、B的起始物质的量,据此计算a的值;
C.恒温恒容条件下,通入氦气反应混合物的浓度不变,平衡不移;
D.200℃时,向容器中充入2 mol A 和1 mol B达到平衡等效为原平衡增大压强,根据图Ⅰ中A、B、C的物质的量变化量之比等于化学计量数之比确定x、y、z,据此判断增大压强平衡移动方向.A.由图Ⅰ可知,200℃时5min达到平衡,平衡时B的物质的量变化量为0.4mol-0.2mol=0.2mol,故v(B)
0.2mol
2L
5min=0.02 mol•L-1•min-1,故A正确;
B.由图Ⅱ可知,n(A):n(B)一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,即△H>0,图Ⅰ可知,200℃时平衡时,A的物质的量变化量为0.8mol-0.4mol=0.4mol,B的物质的量变化量为0.2mol,在一定的温度下只要A、B起始物质的量之比刚好等于平衡化学方程式化学计量数之比,平衡时生成物C的体积分数就最大,A、B的起始物质的量之比=0.4mol:0.2mol=2,故B错误;
C.恒温恒容条件下,通入氦气反应混合物的浓度不变,平衡不移动,故v(正)=v(逆),故C错误;
D.由图Ⅰ可知,200℃时平衡时,A、B、C的物质的量变化量分别为0.4mol、0.2mol、0.2mol,物质的量之比等于化学计量数之比,故x:y;z=0.4mol:0.2mol:0.2mol=2:1:1,平衡时A 的体积分数为[0.4mol/0.4mol+0.2mol+0.2m0l]=0.5,200℃时,向容器中充入2 mol A 和1 mol B达到平衡等效为原平衡增大压强,平衡向正反应移动,A的增大,故达到平衡时,A 的体积分数小于0.5,故D正确;
故选AD.点评:
本题考点: 物质的量或浓度随时间的变化曲线;化学平衡的影响因素.
考点点评: 本题考查化学平衡图象、反应速率计算、影响化学平衡的因素、化学平衡有关计算等,难度中等,注意B选项中理解稀有气体对化学平衡移动的影响.1年前查看全部
- 有关化学平衡中百分含量的问题在一恒容密闭容器中,反应A(g)+B(g)←→C(g)达到平衡,若增大A的浓度,使平衡右移,
有关化学平衡中百分含量的问题
在一恒容密闭容器中,反应A(g)+B(g)←→C(g)达到平衡,若增大A的浓度,使平衡右移,并达到新的平衡,为什么说C的百分含量不一定大于原平衡C的百分含量? 花开现佛1年前4
花开现佛1年前4 -
 尘土飞飞 共回答了18个问题
尘土飞飞 共回答了18个问题 |采纳率100%由于百分比和产量以及总量有关,所以总量的大小(分母)是起到决定作用的,有些时候,虽然平衡正向移动了,产物增加了,但是其百分含量却减少.可以列举很多实例,如加入大量反应物,在A+B=C中,计算C的百分含量,而A、B系数较小,C系数很大时等等一些情况,都会造成百分含量减小.如二氧化硫的氧化,二氧化硫和氧气分别是2摩尔,1摩尔,达平衡后,通入过量氧气至无穷大.平衡正向移动生成物的量增加,但是其百分含量却趋近于零.1年前查看全部
- 在恒温恒容条件下,对于反应A(s)+B(g)=可逆C(g)+D(g),可以使正逆反应速率都增大的措施
在恒温恒容条件下,对于反应A(s)+B(g)=可逆C(g)+D(g),可以使正逆反应速率都增大的措施
A 增大A的物质的量 B 减少D的物质的量
C 减少C的物质的量 D 增大B的物质的量 bbvbbvbbv1年前2
bbvbbvbbv1年前2 -
 fengfan0092 共回答了18个问题
fengfan0092 共回答了18个问题 |采纳率72.2%选D,增大B的量
促进正反应不必多说,一旦平衡移动,C和D的浓度增加,逆反应速率同样会加快(化学反应速率和浓度正相关的),特别注意A是固体,所以加入A起不到效果1年前查看全部
- 化学平衡与速率1、两容器A和B,A恒压,B恒容,容积相等,起始时分别向AB通入体积比2:1的等量的SO2和O2,并达到平
化学平衡与速率
1、两容器A和B,A恒压,B恒容,容积相等,起始时分别向AB通入体积比2:1的等量的SO2和O2,并达到平衡.问起始时两容器中的反应速率___较大;反应过程中的反应速率___较大.(说明原因)
2、某温度下,在容积固定的密闭容器中发生可逆反应:A(g)+2B(g)===2Q(g).平衡时,各物质的浓度比为A:B:C=1:1:2,保持温度不变,以1:1:2的体积比再充入A、B、Q,则下列说法正确的是:
A、刚充入的反应速率V正减少,V逆增大
B、达到新的平衡时,反应混合物中AB的物质的量分数增加
C、达到新的平衡时,ABQ浓度之比仍为1:1:2
D、达到新的平衡过程中,体系压强先增大,后逐渐减小
3、将镁带投入盛放在敞口容器的盐酸里,产生H2的速率与时间的关系如图(可惜不能显示出来),在下列因素中:
1.盐酸的浓度 2.镁带的表面积 3.溶液的浓度 4.氢气的压强 5.氯离子浓度
影响反应速率的因素有_________
解释图中速率增大段AB形成的原因_________
解释图中速率到达最大值后速率逐渐减小段的原因_________
 Nancylu83161年前1
Nancylu83161年前1 -
 chenyigirl 共回答了20个问题
chenyigirl 共回答了20个问题 |采纳率95%1.起始时速率相等.因所有条件都一样,速率也一样.反应过程中恒压容器中速率快.因这是一个等体积气体反应,恒压时体积会减小,浓度相对恒容的要大,所以速率快.
2.D.
A.速率都增大
B.此操作相当于加压,平衡向正反应移动.Q体积分数增大.
C.因平衡发生移动,比值变化.若是恒压,平衡不移动,则不变.
D.刚充入时,压强增大,因平衡向右移动,分子数减少,压强减小.
3.影响因素:123
AB增大是因为该反应放热,温度上升,速率增大.
过B后是因为盐酸浓度减小太多,浓度的影响超过了温度的影响,所以速率减小.1年前查看全部
- 恒容容器中通入与反应无关的气体,反应速率改变吗?
 初始磁导率1年前2
初始磁导率1年前2 -
 andy12345 共回答了21个问题
andy12345 共回答了21个问题 |采纳率85.7%在温度不变的情况下,反应速率只与浓度或分压有关(对气体来说浓度和分压是一回事).
按以上原理,你可以方便地判断,由于体积没有改变,因此原反应组份的浓度或分压没有发生任何改变.无关的气体只是增加了容器的总压,却没有改变反应组份的分压,因此反应速率不变.1年前查看全部
- 等效平衡恒温恒压为什么只需成比例,有恒温恒容时却要相等,还有,平衡常数与等效平衡有何关系
 辽AJE4311年前1
辽AJE4311年前1 -
 6207832 共回答了20个问题
6207832 共回答了20个问题 |采纳率80%恒压的时候体积是会改变的.所以只要成比例.反应进行的程度就是相同的.就是有点像浓度是一样的.恒容的时候体积不变.物质的量什么的必须一样.浓度才一样.
平衡常数越大反应进行的越容易.
我是这样理解的.我也是上高二滴.有错误的话你通知我哈.1年前查看全部
- 2HI=H2+I2,恒温恒容下冲入HI平衡向哪边移动?
2HI=H2+I2,恒温恒容下冲入HI平衡向哪边移动?
所对于平衡移动,现在网上有两种说法,一种是正逆速率相等为平衡不移动即答案为向右移动,另一种为分解率不变为不移动,即平衡不移动.哪一种是正确的 634443171年前1
634443171年前1 -
 dongyanx 共回答了19个问题
dongyanx 共回答了19个问题 |采纳率89.5%平衡一定是向正反应方向移动的.
那些回答不移动的,根本就不知道.乱说的.他们是把等效平衡的内容用在这里.根本就不知道等效平衡与平衡的关系.1年前查看全部
- 将6mol A和5mol B混合于2L恒容密闭容器中,发生如下反应:3A(g)+B(g)⇌nC(g)
将6mol A和5mol B混合于2L恒容密闭容器中,发生如下反应:3A(g)+B(g)⇌nC(g)+2D(g),5s后反应达到平衡状态,生成2mol D,经测定以C表示的平均反应速率为0.4mol•L-1•s-1.则下列结论中正确的是( )
A.5 s内以A表示的平均反应速率为0.15 mol•L-1•s-1
B.n值等于4
C.平衡时B的转化率为20%
D.平衡时,B的浓度为4mol•L-1 郁儿1年前1
郁儿1年前1 -
 哈将 共回答了12个问题
哈将 共回答了12个问题 |采纳率100%解题思路:A、结合D的物质的量,根据方程式计算参加反应的A的物质的量,再根据v=
计算v(A);△n V △T
B、利用速率之比等于化学计量数之比计算n的值;
C、B的转化率=[参加反应B的物质的量/B开始投入的总的物质的量]×100%,据此计算;
D、结合D的物质的量,根据方程式计算参加反应的B的物质的量,计算平衡时B的物质的量,根据c=[n/V]计算平衡时B的浓度.A、平衡时生成2mol的D,所以参加反应的A为3mol,故v(A)=
3mol
2L
5s=0.3mol•(L•min)-1,故A错误;
B、速率之比等于化学计量数之比,故3:n=0.3mol•(L•min)-1:0.4mol•(L•min)-1,解得n=4,故B正确;
C、平衡时B的转化率为[1mol/5mol]×100%=20%,故C正确;
D、平衡时生成2mol的D,所以参加反应的B为1mol,故平衡时B的物质的量为5mol-1mol=4mol,平衡时B的浓度为[4mol/2L]=2mol/L,故D错误;
故选BC.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡、反应速率的有关计算,难度不大,旨在考查学生对基础知识的理解掌握.1年前查看全部
- (2012•河西区一模)相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g)⇌2XY
(2012•河西区一模)相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g)⇌2XY3(g)△H=-92.6kJ•mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
下列叙述不正确的是( )容器
编号起始时各物质物质的量/mol 达平衡时体系能量的变化 X2 Y2 XY3 ① 1 3 0 放热 23.15kJ ② 0.6 1.8 0.8 Q(Q>0)
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量为Q
C.达平衡时,两个容器中XY3的物质的量浓度均为2 mol•L-1
D.若容器①体积为0.20 L,则达平衡时放出的热量大于23.15 kJ admw1年前1
admw1年前1 -
 joe6000 共回答了20个问题
joe6000 共回答了20个问题 |采纳率85%解题思路:A.平衡常数只与温度有关;
B.由达平衡时①放出的热为23.15 kJ,计算平衡时X2、Y2和XY3的物质的量,分析②是否处于平衡状态或是向哪个方向进行,判断②是吸热还是放热,再根据转化率计算具体的值;
C.由达平衡时①放出的热为23.15 kJ,计算平衡时XY3的物质的量浓度,再根据两平衡是完全等效平衡解答;
D.从平衡移动的角度比较反应放出的热量与23.15kJ的关系.A.衡常数只与温度有关,温度不变,对同一反应平衡常数不变,故A正确;
B.①容器中放出23.15kJ热量,则生成氨气的物质的量为:[23.15kJ/92.6kJ/mol×2=0.5mol,
X2(g)+3Y2(g)⇌2XY3(g)
起始(mol):13 0
转化(mol):0.25 0.75 0.5
平衡(mol):0.75 2.25 0.5
可知平衡时①容器中X2、Y2和XY3的物质的量分别为0.75mol、2.25mol和0.5mol,②与①为完全等效平衡,所以,平衡时②容器中X2、Y2和XY3的物质的量也分别为0.75mol、2.25mol和0.5mol,可知②的反应向逆反应方向进行,反应过程需要吸收热,故B错误;
C.由B计算可知此时XY3的物质的量浓度均为
0.5mol
0.25L]=2mol/L,将②按化学计量数比换算成左边与①对应的物质的物质的量相等,恒温恒容下,两平衡是完全等效平衡,平衡时各物质的浓度相等,故C正确;
D.若容器①体积为0.20L,增大压强平衡向正反应方向移动,放出热量多,故D正确.
故选B.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡移动问题、等效平衡、反应热等问题,题目难度不大,注意B项根据计算分析,从等效平衡的角度判断反应进行的方向是解答该题的关键.1年前查看全部
- 恒温恒容两边气体系数和相等与不等的等效平衡,到底各自等的是什么?恒温恒压两边气体系数和相等与不等的等效平衡,各自等的又是
恒温恒容两边气体系数和相等与不等的等效平衡,到底各自等的是什么?恒温恒压两边气体系数和相等与不等的等效平衡,各自等的又是什么?
 k87541年前1
k87541年前1 -
 梦的儿子 共回答了23个问题
梦的儿子 共回答了23个问题 |采纳率100%等效平衡的等指的都是各物质的体积分数,也就是各物质在体系中所占比例相等,不是绝对量.当然绝对量相等也是等效平衡,那个叫全等平衡.懂啦!1年前查看全部
- 可逆反应A(g)+3B(g)=2C(g),在恒温恒容容器中加入2molC,达到平衡后再加入1/3molA,1molB,4
可逆反应A(g)+3B(g)=2C(g),在恒温恒容容器中加入2molC,达到平衡后再加入1/3molA,1molB,4/3molC,平衡怎么移动?
 harkyo1年前1
harkyo1年前1 -
 雨打背 共回答了21个问题
雨打背 共回答了21个问题 |采纳率90.5%平衡向右移动吧,加入1/3摩尔A和1摩尔的B相当于加入2/3摩尔的C,即一共再加入了2摩尔的C,因为是恒容假设当它达到原来的平衡时,容器内的压强大于原来压强,而A、B前面的系数比C前面的系数大,所以压强增大使平衡向减少压强的方向进行,即向右移1年前查看全部
- 高中化学平衡问题。为什么2NO2N2O4当恒容时,充入N2O4平衡正向移动。从压强的角度考虑,压强增大了,平衡向气体分子
高中化学平衡问题。为什么2NO2N2O4当恒容时,充入N2O4平衡正向移动。从压强的角度考虑,压强增大了,平衡向气体分子数少的一方移动,所以平衡向正反应移动。但是从浓度角度考虑,反应物浓度增加了,平衡应向逆反应方向进行。难道在压强与浓度共同影响下,压强是主要影响因素。但如果压强是主要影响因素那么N2+3H22NH3 在恒容条件下,未达到平衡时,容器内的气体分子数在减小,压强在下降,平衡应该向气体分子数多的一方移动,也就是逆反应方向移动。但这显然是错的。
 gsme1年前2
gsme1年前2 -
 为啥而来 共回答了19个问题
为啥而来 共回答了19个问题 |采纳率78.9%从你的问题中暴露出以下几个问题:1.条件是什么意思不知道 2.公式的含义不清楚1年前查看全部
- 在体积为VL的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)⇌2HBr(g);△H<0
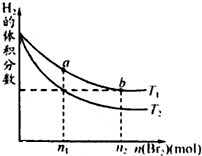 在体积为VL的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)⇌2HBr(g);△H<0.当温度分别为T1、T2达平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法不正确的是( )
在体积为VL的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)⇌2HBr(g);△H<0.当温度分别为T1、T2达平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法不正确的是( )
A.由图可知:T1>T2
B.a、b两点的反应速率:b>a
C.为了提高Br2(g)的转化率,可采取将HBr液化并及时移走的方法
D.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加 feifei6543211年前1
feifei6543211年前1 -
 gfstar 共回答了18个问题
gfstar 共回答了18个问题 |采纳率100%解题思路:A.该反应是正反应为放热的化学反应,升高温度,平衡向逆反应方向移动导致氢气的含量增大,据此判断;
B.对比两个平衡状态,可以看作向a的平衡状态加入(n2-n1)molBr2建立了化学平衡b,利用速率与平衡移动关系分析;
C.根据浓度对化学平衡移动的影响来分析;
D.加入溴平衡向正反应方向移动,HBr的体积分数与加入溴的量及转化率有关.A.根据图象可知,当加入的n(Br2)均为n1建立化学平衡后,H2的体积分数温度T1的大于温度T2,该反应是正反应为放热反应,升高温度,平衡逆反应方向移动导致氢气的体积分数降低,所以T1>T2,故A正确;
B.对a和b来说,温度相同,H2的初始量相同,Br2的初始量是b>a,a、b两个平衡状态,可以认为是向a的平衡状态加入(n2-n1)molBr2建立了化学平衡b,而加入Br2,平衡向正反应方向移动,建立平衡b后,其反应速率要增加,即两点的反应速率a<b,故B正确;
C.将HBr液化并及时移走,HBr的浓度降低,平衡向正反应方向移动,溴的转化率增大,故C正确;
D.当温度均为T1时,加入Br2,平衡会向正反应方向移动,导致HBr的物质的量不断增大,但体积分数不一定逐渐增大,这与加入的溴的量及转化率有关,故D错误,
故选D.点评:
本题考点: 体积百分含量随温度、压强变化曲线.
考点点评: 本题考查了外界条件对化学平衡的影响,易错选项是D,注意反应物的转化率增大,生成物的体积分数不一定增大,这与反应物的量有关.1年前查看全部
- 在温度溶剂相同的三个密闭容器中,按不同方式投入产物,保持恒温恒容,测得反应达
在温度溶剂相同的三个密闭容器中,按不同方式投入产物,保持恒温恒容,测得反应达
家 tomhjhcat1年前2
tomhjhcat1年前2 -
 21910030 共回答了17个问题
21910030 共回答了17个问题 |采纳率94.1%14.在温度、容积相同的3个密闭容器中,按不同方式 投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)========= 2NH3(g) ⊿H=-92.4kJ·mol-1)
容器 甲 乙 丙
反应物投入量 1molN2 、3molH2 2mol NH3 4mol NH3
NH3的浓度(mol/L) c1 c2 c3
反应的能量变化 放出a kJ 吸收b kJ 吸收c kJ
体系压强(Pa) p1 p2 p3
反应物转化率 α 1 α 2 α 3
下列说法正确的是
A.2c1 > c3 B.a + b = 92.4 C.2p2 < p3 D.α1 + α3 < 1
【分析】若甲容器反应物投入量1molN2 、3molH2与乙容器反应物投入量2mol NH3在保持恒温、恒容情况下是二个简单等效平衡,平衡时NH3的浓度c1=c2 、 p1=p2、α1 +α 2=1 、a + b能量总变化相当于1molN2 、3molH2完全转化成2mol NH3的能量,即不言吸放热a + b数值上就等于92.4 kJ.
甲容器反应物投入量1molN2 、3molH2与丙容器反应物投入量4mol NH3若恒温丙容器容积是甲容器2倍,则甲容器与丙容器也是等效平衡,然而现在是温度、容积相同的3个密闭容器,我们可以把丙容器容积是甲容器2倍压缩成容积相同,则丙容器平衡向正向移动,因此2c1 < c3 、2p2 > p3 、α 2 > α 3 、α1 + α3 < 1 所以答案为BD.1年前查看全部
- 有甲、乙两个容积相等的恒容密闭容器,向甲中通入6mol A和2mol B,向乙中通入1.5mol A、0.5mol B和
有甲、乙两个容积相等的恒容密闭容器,向甲中通入6mol A和2mol B,向乙中通入1.5mol A、0.5mol B和3mol C
(1)若平衡时,甲、乙两容器中A的物质的量相等,则x=_________;若平衡时,甲、乙两容器中A的物质的量不相等,则x=_________.
(2)平衡时甲、乙两容器中A、B的物质的量之比是否相等____________(填“相等”或“不相等”),平衡时甲中A的体积分数为____________.
(3)若平衡时两容器中的压强不相等,则两容器中压强之比为_____________. 长啸剑1年前1
长啸剑1年前1 -
 gilsa0870 共回答了15个问题
gilsa0870 共回答了15个问题 |采纳率86.7%(1)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,甲、乙为等效平衡,
若平衡时,甲、乙两容器中A的物质的量相等,则为完全等效平衡,将乙按化学计量数转化到左边满足n(A)=6mol、n(B)=2mol,则1.5+9/x=6,0.5+3/x=2,解得x=2;
若平衡时,甲、乙两容器中A的物质的量不相等,则压强不影响平衡移动,反应前后气体体积不变,则x=3+1=4,
故答案为:2;4;
(2)A与B的起始物质的量之比等于化学计量数之比,则平衡后A、B的物质的量之比为定值3:1;A、B的体积分数之和为1-0.2=0.8,故A的体积分数=0.8×0.75=0.6,
故答案为:相等;0.6;
(3)若平衡时两容器中的压强不相等,则压强不影响平衡移动,反应前后气体体积不变,则x=4,甲、乙混合气体的总的物质的量不变,压强之比等于物质的量之比,故甲、乙两容器内压强之比为(6+2)mol:(1.5+0.5+3)mol=8:5,
故答案为:P(甲):P(乙)=8:5.1年前查看全部
- 相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3mol H2,此时两容器的体积相等.
相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3mol H2,此时两容器的体积相等.
在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1KJ;B中NH3的体积分数为b,放出热量Q2KJ.问:a与b的大小关系,Q1和Q2的大小关系,Q1与92.4的大小关系(因为1mol N2和3mol H2反应的△H为-92.4KJ/mol) 请有才之人写出具体的步骤,我要最具体的步骤, zhongliaoning1年前1
zhongliaoning1年前1 -
 fu_rong57 共回答了18个问题
fu_rong57 共回答了18个问题 |采纳率88.9%这个反就是可逆反应的1年前查看全部
- 在一定温度下,有A,B两个容器,A是恒容密闭容器,B是恒压密闭容器.两容器起始状态完全相同,其中都充有NO2气体,如果只
在一定温度下,有A,B两个容器,A是恒容密闭容器,B是恒压密闭容器.两容器起始状态完全相同,其中都充有NO2气体,如果只考虑发生下列可逆反应:2NO2=N2O4,分别经过一段时间后,A,B都达到平衡.下列有关叙述正确的是( )
A.平衡反应速率:A>B B.平衡时NO2物质的量:B>A C.平衡时NO2的转化率:A>B D.平衡时N2O4物质的量:B>A ho3211231年前2
ho3211231年前2 -
 上只角小开 共回答了15个问题
上只角小开 共回答了15个问题 |采纳率100%D
A是恒容密闭容器,-----即容器体积不变,随反应进行,容器中压强会减小
B是恒压密闭容器----即有活塞,而且会向内运动,即容器的体积会减小
A.平衡反应速率:A>B -----错,平衡时A的体积大,相当于压强小,因此速率小
B.平衡时NO2物质的量:B>A ----错,B容器体积变小,相当于加压,平衡正向移动,生成的N2O4多,NO2则少
C.平衡时NO2的转化率:A>B ----错,B中的转化率大
D.平衡时N2O4物质的量:B>A----对1年前查看全部
- 一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)⇌3C(g),若反应开始时充入2mol A和2m
一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)⇌3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%.其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
A. 2.5mol C
B. 2 mol A、1 mol B和10 mol He(不参加反应)
C. 1.5 mol B和1.5 mol C
D. 2 mol A、3 mol B和3 mol C 欧阳灵1年前1
欧阳灵1年前1 -
 林音93 共回答了20个问题
林音93 共回答了20个问题 |采纳率80%解题思路:反应2A(g)+B(g)⇌3C(g)中,气体的体积前后相同,在一定温度下,在恒容密闭容器中得到平衡状态,只要满足物质全部转化为A、B,且满足n(A):n(B)=1:1,即可得到相同平衡状态,结合浓度对平衡移动的影响,只要加入的物质的量:n(A):n(B)>1:1,平衡后A的体积分数大于a%.反应2A(g)+B(g)⇌3C(g)中,气体的体积前后相同,在一定温度下,在恒容密闭容器中得到平衡状态,只要满足物质全部转化为A、B,且满足n(A):n(B)=1:1,就是等效平衡,结合浓度对平衡移动的影响,只要加入的...
点评:
本题考点: 等效平衡.
考点点评: 本题考查等效平衡问题,题目难度中等,本题注意与原配比数相比较,结合浓度对平衡移动的影响可进行判断.1年前查看全部
- 在恒温恒容容器中,可逆反应C(s)+H2O(g)=CO(g)+H2(g)不一定达平衡状态的是!
在恒温恒容容器中,可逆反应C(s)+H2O(g)=CO(g)+H2(g)不一定达平衡状态的是!
气体的压强不变,为什么这个不能,我觉得是一定啊! vfrs1年前1
vfrs1年前1 -
 dd岛啊六 共回答了24个问题
dd岛啊六 共回答了24个问题 |采纳率91.7%答案可能错了吧1年前查看全部
- 一定温度下,某一恒容密闭容器内有可逆反应:A(g)+3B(g)⇌2C(g),该反应进行到一定限度后达到化学平衡的标志是(
一定温度下,某一恒容密闭容器内有可逆反应:A(g)+3B(g)⇌2C(g),该反应进行到一定限度后达到化学平衡的标志是( )
A.单位时间内生成a mol物质A,同时生成3a mol物质B
B.物质C的生成速率和分解速率相等
C.容器内气体的密度不再随时间而改变
D.物质A、B、C的分子数之比为1:3:2 --舞--1年前1
--舞--1年前1 -
 游资游资 共回答了16个问题
游资游资 共回答了16个问题 |采纳率87.5%解题思路:根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.A、单位时间内生成a mol物质A,同时生成3a mol物质B,只要反应发生,一直有这样的等量关系,故A错误;
B、物质C的生成速率和分解速率相等,正逆反应速率相等,故B正确;
C、反应体系都是气体物质,体积是一个定值,密度始终不变,故C错误;
D、物质A、B、C的分子数之比为1:3:2,并不是不变的状态,故D错误;
故选B.点评:
本题考点: 化学平衡状态的判断.
考点点评: 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.1年前查看全部
- 为什么恒温恒容时,只要投料量"相当",则达到平衡时即为等效平衡?
 单眼皮的阿凡提1年前1
单眼皮的阿凡提1年前1 -
 yehongyun 共回答了10个问题
yehongyun 共回答了10个问题 |采纳率90%“等效平衡”是指在相同条件下的同一可逆反应里,建立的两个或多个化学平衡中,同种物质的含量相同(体积分数、质量分数或物质的量分数)或转化率相同(但物质的量,物质的量浓度等不一定相同),这些化学平衡均属等效平衡.
等效平衡的建立与途径无关,即相同条件下,同一可逆反应体系,不管从正反应开始,还是从逆反应开始,还是从正逆反应同时开始;不管是一次投料还是分批投料,只要是达到平衡时,任何相同物质的含量都相同的化学平衡互称等效平衡.
其核心是“各同种物质的含量相同或各同种物质的转化率相同”.1年前查看全部
- 高中化学反应平衡问题。就是 在一个恒容密闭容器中 什么样的反应方程式 可以用容器中气体密度不变做
高中化学反应平衡问题。就是 在一个恒容密闭容器中 什么样的反应方程式 可以用容器中气体密度不变做
高中化学反应平衡问题。就是 在一个恒容密闭容器中 什么样的反应方程式 可以用容器中气体密度不变做是否达到平衡的判断标准 比如反应物和生成物都是气体或反应物有固体等等 不知各位网友能否理解我所问的是什么?
 还我发卡1年前2
还我发卡1年前2 -
 suning365 共回答了15个问题
suning365 共回答了15个问题 |采纳率86.7%反应物和生成物中的一方有气体,一方有固体1年前查看全部
- (2007•南通二模)向甲乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB.相同条
(2007•南通二模)向甲乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB.相同条件下,发生下列反应:A(g)+B(g)⇌xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示:
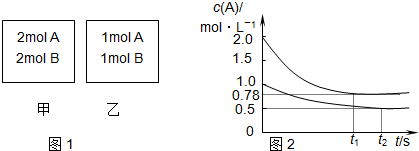
下列说法正确的是( )
A.x可能等于2也可能等于3
B.向平衡后的乙容器中充入氦气可使c(A)增大
C.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
D.若向甲容器中再充入2molA、2molB,则平衡时甲容器中0,78mol•L-1<c(A)<1.56mol•L-1 真难起名1年前1
真难起名1年前1 -
 你得到一个朋友 共回答了17个问题
你得到一个朋友 共回答了17个问题 |采纳率88.2%解题思路:由图象可知平衡时,甲容器平衡时,A的转化率为[2mol−0.78mol/2mol]=61%,乙容器内A的转化率为[0.5mol/1mol]=50%,甲容器内压强比乙容器内大,增大压强向正反应移动,增大压强平衡压强增大向着体积减小的方向移动,故:1+1>x,所以x=1.
A、由图象可知平衡时,甲容器平衡时,A的转化率为[2mol−0.78mol/2mol]=61%,乙容器内A的转化率为[0.5mol/1mol]=50%,甲容器内压强比乙容器内大,增大压强向正反应移动.若x=2,反应前后气体体积不变,甲、乙为等效平衡,转化率相等.
B、向平衡后的乙容器中充入氦气,容器内压强虽然增大,但反应混合物各组分的浓度不变,平衡不移动.
C、乙容器单独升温,平衡向逆反应进行,乙容器内A的转化率减小.
D、向甲容器中再充入2molA、2molB,可以等效为原平衡状态下压强增大一倍,平衡向正反应方向移动,A转化率增大,平衡移动目的是降低浓度增大趋势,但不能消除浓度增大,达新平衡时浓度比原平衡大.由图象可知平衡时,甲容器平衡时,A的转化率为[2mol−0.78mol/2mol]=61%,乙容器内A的转化率为[0.5mol/1mol]=50%,甲容器内压强比乙容器内大,增大压强向正反应移动,增大压强平衡压强增大向着体积减小的方向移动,故:1+1>X,所以x=1.
A、由上述分析可知x=1,若x=2,反应前后气体体积不变,甲、乙为等效平衡,转化率相等,故A错误;
B、向平衡后的乙容器中充入氦气,容器内压强虽然增大,但反应混合物各组分的浓度不变,平衡不移动,转化率不变,故B错误;
C、该反应为放热反应,将乙容器单独升温,平衡向吸热反应方向移动,即向逆反应方向移动,A的转化率比甲容器的转化率低,不可能使乙容器内各物质的体积分数与甲容器内的相同,故C错误;
D、向甲容器中再充入2molA、2molB,可以等效为原平衡状态下压强增大一倍,平衡向正反应方向移动,A转化率增大,所以平衡时甲容器中c(A)小于2倍原平衡中的c(A),平衡移动目的是降低浓度增大趋势,但不能消除浓度增大,达新平衡时浓度比原平衡大,所以平衡时甲容器中0.78mol/L<c(A)<1.56mol/L,故D正确;
故选:D.点评:
本题考点: 物质的量或浓度随时间的变化曲线.
考点点评: 本题考查平衡图象、等效平衡、外界条件对平衡影响、平衡计算等,难度中等,根据图象计算平衡时转化率,确定x值是解题的关键.1年前查看全部
- 化学问题:恒温恒容下通入惰气为什么速率不变
化学问题:恒温恒容下通入惰气为什么速率不变
我觉得奇怪哦,恒容的时候加入惰气那不是把里面的压强增大了吗?那不是应该改变? 全流通1年前1
全流通1年前1 -
 wrr_hn 共回答了19个问题
wrr_hn 共回答了19个问题 |采纳率94.7%压强确实是改变了,但只有当压强改变影响到反应物浓度时才会改变反应速率.1年前查看全部
- 容积均为1L的甲、乙两个恒容容器中,分别充入2molA、2molB和1molA、1molB,相同条件下,发生下列反应:A
容积均为1L的甲、乙两个恒容容器中,分别充入2molA、2molB和1molA、1molB,相同条件下,发生下列反应:A(g)+B(g)
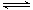 xC(g) △H<0。测得两容器中c(A)随时间t的变化如右图所示,下列说法错误的是
xC(g) △H<0。测得两容器中c(A)随时间t的变化如右图所示,下列说法错误的是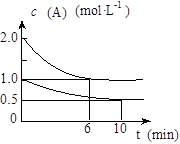
A.甲容器中A的反应速率为0.1mol/L·min
B.给甲容器加压可缩短反应达到平衡的时间
C.给乙容器升温可缩短反应达到平衡的时间
D.甲和乙的平衡转化率相等 狐沙沙1年前1
狐沙沙1年前1 -
 lang3000 共回答了19个问题
lang3000 共回答了19个问题 |采纳率84.2%A
1年前查看全部
- (2013•洛阳模拟)在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)⇌CO2(g)+H2(g).CO2(g)的平
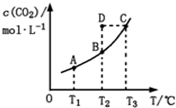 (2013•洛阳模拟)在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)⇌CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )
(2013•洛阳模拟)在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)⇌CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )
A.反应CO(g)+H2O(g)⇌CO2(g)+H2(g)的△H>0
B.在T2时,若反应处于状态D,则一定有ν正<ν逆
C.平衡状态A与C相比,平衡状态A的c(CO)小
D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2 Google测试员51401年前1
Google测试员51401年前1 -
 asunwuz 共回答了13个问题
asunwuz 共回答了13个问题 |采纳率100%解题思路:A、由图可知,温度越高平衡时c(CO2)越大,说明升高温度平衡向正反应移动;
B、T2时反应进行到状态D,c(CO2)高于平衡浓度,故反应向逆反应进行;
C、根据温度对平衡的影响,分析CO的浓度;
D、化学平衡常数只受温度影响,升高温度平衡向吸热反应移动,根据平衡移动判断温度对平衡常数的影响.A、由图可知,温度越高平衡时c(CO2)越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应进行,故正反应是吸热反应,即△H>0,故A正确;
B、T2时反应进行到状态D,c(CO2)高于平衡浓度,故反应向逆反应进行,则一定有υ(正)<υ(逆),故B正确;
C、平衡状态A与C相比,C点温度高,已知△H>0,升高温度平衡正移,CO浓度减小,所以A点CO浓度大,故C错误,
D、该反应正反应是吸热反应,升高温度平衡向正反应移动,化学平衡常数增大,故K1<K2,故D正确;
故选C.点评:
本题考点: 物质的量或浓度随时间的变化曲线.
考点点评: 本题考查温度对平衡移动的影响、对化学平衡常数的影响等,难度中等,注意曲线的各点都处于平衡状态.1年前查看全部
- 一定条件下存在反应:C(s)+H 2 O(g) CO(g)+H 2 (g)△H>0。向甲、乙、丙三个恒容容器中加入
一定条件下存在反应:C(s)+H 2 O(g)
 CO(g)+H 2 (g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H 2 O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
CO(g)+H 2 (g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H 2 O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。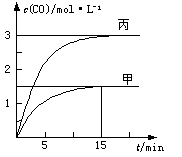
下列说法正确的是容器 甲 乙 丙 容积 0.5 L 0.5 L V 温度 T 1 ℃ T 2 ℃ T 1 ℃ 起始量 2 molC
1 molH 2 O1 molCO
1 molH 24 molC
2 molH 2 O
A.甲容器中,反应在前15 min的平均速率v(H 2 )="0.1" mol·L -1 ·min -1
B.丙容器的体积V<0.5 L
C.当温度为T 1 ℃时,反应的平衡常数K=2.25
D.乙容器中,若平衡时n(H 2 O)="0.4" mol,则T 1 < T 2 wugh1年前1
wugh1年前1 -
 太阳雨雾 共回答了12个问题
太阳雨雾 共回答了12个问题 |采纳率91.7%AB
1年前查看全部
- 在一定温度下,有A、B两个容器,A是恒容密闭容器,B是恒压密闭容器.两容器起始状态完全相同,其中都充有NO(2写在右下角
在一定温度下,有A、B两个容器,A是恒容密闭容器,B是恒压密闭容器.两容器起始状态完全相同,其中都充有NO(2写在右下角)气体,如果只考虑发生下列可逆反应:2NO(2写在右下角)【可逆符号】N(2写右下角)O(4写右下角),分别经过一段时间后,A、B都达到平衡,下列有关叙述正确的是(CD )
A 平均反应速率A>B
B 平衡时NO(2写右下角)的物质的量B>A
C平衡时NO(2写右下角)的转化率B>A
D平衡时N(2写右下角)O(4写右下角)的物质的量B>A
【注:已经知道答案选CD,我要问的是有关这道题的一个解题知识点:(我们班老师总结的):同一反应在不同的容器中,恒温恒压相当于在恒温恒容的基础上增大压强.这个规律是在任何情况下都成立吗?即如果正反应是体积增大的反应的时候还是成立的吗?这块小生不大明白, 情报局1年前1
情报局1年前1 -
 2005jie11 共回答了15个问题
2005jie11 共回答了15个问题 |采纳率86.7%你可以这样考虑:
此反应:2NO2 → N2 +2O2 由2体积的NO2 生成1体积氮气和2体积氧气,由2体积气体一共生成3体积气体,是气体体积增加的反应;记住压强增加,可逆反应的平衡向气体体积减小的方向移动.
A: 恒容就是体积不变,但是压强会变.B: 恒压就是压强不变.
而此反应是气体体积增加的反应,也就是反应进行中若容器容积不变则压强会变大.所以,A恒容增压,反应向逆反应方向移动,生成的氮气和氧气的体积比B小,反应速率也小.
但是,同一反应在不同的容器中,恒温恒压相当于在恒温恒容的基础上增大压强.这不对吧.应该是同一体积增大的反应在不同的容器中,恒容相当于在恒压的基础上增大压强.而体积增大的反应,恒容相当于在恒压的基础上增大压强.1年前查看全部
- 恒温恒容条件下,加2mol氨气,氨气转化率为x.若加3mol氨气,转化率是增加还是降低呢?
恒温恒容条件下,加2mol氨气,氨气转化率为x.若加3mol氨气,转化率是增加还是降低呢?
详细说说为什么 jerryyan20061年前1
jerryyan20061年前1 -
 20001208 共回答了21个问题
20001208 共回答了21个问题 |采纳率85.7%加入3mol氨气使氨气的总量增加,因为恒温恒容,所以压强增大,转化率也就增加1年前查看全部
- 对于氮气与氢气的反应,把两份2摩尔氮气和3摩尔氢气分别放入恒温恒压容器与恒温恒容容器中(温度相同),反应达到平衡后,氮气
对于氮气与氢气的反应,把两份2摩尔氮气和3摩尔氢气分别放入恒温恒压容器与恒温恒容容器中(温度相同),反应达到平衡后,氮气转化率哪个大,生成物氨气的浓度呢,能不能用化学平衡常数解释呢.请给出详细分析.
 小**碎不了石头1年前3
小**碎不了石头1年前3 -
 澹泊 共回答了22个问题
澹泊 共回答了22个问题 |采纳率100%N2(氮气)+3H2(氢气)?2NH3(氨)
上反应是气体分子数减少的反应.
1,恒温恒压容器中,随着反应的进行,气体分子数减少,但由于是恒压的,压强并不减小,促使反应继续向生成NH3的方向进行,因此氮气转化率相对要大,生成物氨气的浓度也高.
2,恒温恒容容器中,随着反应的进行,气体分子数减少,但由于是恒容的,压强就要减小,不利于反应向正反应方向进行,因此氮气转化率相对要小,生成物氨气的浓度也低.1年前查看全部
- 化学等效平衡很难的题两容器,起始体积相同,一个恒压,一个恒容.一个充3摩尔A,1摩尔B,另一个充a摩尔A,b摩尔B,c摩
化学等效平衡很难的题
两容器,起始体积相同,一个恒压,一个恒容.
一个充3摩尔A,1摩尔B,另一个充a摩尔A,b摩尔B,c摩尔C,达平衡时两容器压强相等,C的体积分数相等,则a,b,c的关系式如何?
反应式:3A+B=2C,为放热反应 wgh16333331年前1
wgh16333331年前1 -
 总会有情天 共回答了16个问题
总会有情天 共回答了16个问题 |采纳率87.5%答案:a=3b,c大于等于0.
由于“达平衡时两容器压强相等,C的体积分数相等”,可知这两个反应是等效的.
反应方程式:3A+B=2C,可知反应前后系数不等,所以,这种类型的反应要想达到等效平衡,必须满足:对应的反应物的量与对应的系数都成一定的比例.已知“充3摩尔A,1摩尔B”与“充a摩尔A,b摩尔B,c摩尔C”是等效的,可列:
3A+B==2C
3----1
a----b---c(可将cmolC看成1.5cmol的A和0.5cmol的B)
(a+1.5c)----(b+0.5c)----0
要想达到平衡,必须满足:
(a+1.5c)/3=(b+0.5c)/1
可解得:a=3b,与c的量无关,但同时要说明c大于等于零.1年前查看全部
- 一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)⇌3C(g),若反应开始时充入2mol A和2m
一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)⇌3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%.其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
A. 2.5mol C
B. 2 mol A、1 mol B和10 mol He(不参加反应)
C. 1.5 mol B和1.5 mol C
D. 2 mol A、3 mol B和3 mol C 痛并快乐着051年前1
痛并快乐着051年前1 -
 boymind 共回答了16个问题
boymind 共回答了16个问题 |采纳率100%解题思路:反应2A(g)+B(g)⇌3C(g)中,气体的体积前后相同,在一定温度下,在恒容密闭容器中得到平衡状态,只要满足物质全部转化为A、B,且满足n(A):n(B)=1:1,即可得到相同平衡状态,结合浓度对平衡移动的影响,只要加入的物质的量:n(A):n(B)>1:1,平衡后A的体积分数大于a%.反应2A(g)+B(g)⇌3C(g)中,气体的体积前后相同,在一定温度下,在恒容密闭容器中得到平衡状态,只要满足物质全部转化为A、B,且满足n(A):n(B)=1:1,就是等效平衡,结合浓度对平衡移动的影响,只要加入的物质的量:n(A):n(B)>1:1,平衡后A的体积分数大于a%,
A.2.5molC相当于[5/3]molA和[5/6]molB,二者的比值为2:1,大于1:1,则平衡后A的体积分数大于a%,故A正确;
B.当 2molA、1molB和10molHe(不参加反应)时,n(A):n(B)=2:1,大于1:1,但由于有10molHe的存在,则平衡后A的体积分数不一定大于a%,故B错误;
C.1.5molB和1.5molC,相当于1molA和2molB,n(A):n(B)=1:2,小于1:1,则平衡后A的体积分数小于a%,故C错误;
D.2molA、3molB和3molC,相当于4molA和4molB,二者的比值为4:4,等于1:1,则平衡后A的体积分数等于a%,故D错误,
故选A.点评:
本题考点: 等效平衡.
考点点评: 本题考查等效平衡问题,题目难度中等,本题注意与原配比数相比较,结合浓度对平衡移动的影响可进行判断.1年前查看全部
大家在问
- 1冰激凌加巧克力等于?提示 BQL+QKL=DW 呵呵 一直等到正确答案出现哦!
- 2放风筝的作文,必须自己写,不然每分哦!
- 3Tom said"I take a bus to Beijing today".转为间接引语句
- 4人们在围观时,为什么会自然地围成圆形呢?(用圆的知识)解释
- 5大肠杆菌和普通动植物细胞的结构的主要区别
- 6一氧化碳与四氧化三铁高温生成铁和二氧化碳,方程式是什么?要配平
- 7“需氧呼吸与厌氧呼吸的区别是葡萄糖是否进入线粒体”错哪了
- 8在一定温度下 2n2o3(g)=可逆=4no(g)+o2(g)平衡后恒容条件下通入一定量的氦气则n203d 的转化率如何
- 9在恒压密闭容器M中和恒容密闭容器N中,分别加入amolX和amoly,发生2X(g)+Y(s)=2Z(g)(可逆)
- 10描述磁场中各点磁场强弱和方向的物理量是什么
- 11"磁感应强度仅仅是描述磁场强弱的物理量"这句话对吗?说明理由!
- 12苹果经营户以2元/千克的价格购进一批苹果,以3元/千克的价格出售,每天可售出200千克,为了促销,减少库存,该经营户觉定
- 13关于物体运动的速度和加速度的关系,下列说法中正确的是
- 14旅行者1号在旅途中为什么不会被流星砸到,还有不会被别的星球吸引住吗?
- 15今年四年级寒假作业答案
