(2010•青浦区一模)假设某大肠杆菌含14N(N的质量数为14,下同)的DNA的相对分子质量为a,若将其长期培养在含1
 hljz2022-10-04 11:39:541条回答
hljz2022-10-04 11:39:541条回答A.
| (a+b) |
| 2 |
B.
| (a+b) |
| 4 |
C.
| (3a+b) |
| 4 |
D.
| (3b+a) |
| 4 |

已提交,审核后显示!提交回复
共1条回复
 泛音I灵魂 共回答了18个问题
泛音I灵魂 共回答了18个问题 |采纳率88.9%- 解题思路:长期培养在含15N的培养基中得到的DNA上,所有氮元素全是15N.设用15N的只有一个DNA分子的一个大肠杆菌培养在14N的培养基中,子二代应该是四个大肠杆菌,共四个DNA分子,八条DNA单链;其中两条是含15N的母链,六条新合成的含14N的子链.那么子二代DNA的相对分子质量平均为
.(3a+b) 4 假定原来是1个含有15N的DNA分子,其相对分子质量为b,则每条链的相对分子质量为[b/2],复制了2次得到子二代共4个DNA分子,这4个DNA分子共8条链,含有14N的每条链相对分子质量为[a/2],含有15N的每条链的相对分子质量为[b/2].这8条链,有2条是含有15N的,6条是含有14N的,因此总相对分子质量为[b/2]×2+[a/2]×6=3a+b.所以每个DNA的平均相对分子质量为
(3a+b)
4.
故选:C.点评:
本题考点: DNA分子的复制;DNA分子结构的主要特点.
考点点评: 本题难度中等,要求学生识记DNA分子复制的相关知识,考查学生对DNA分子复制相关计算的理解. - 1年前
相关推荐
- (2005•青浦区模拟)如图所示,质量为m的带电金属小球,用绝缘细线与质量为M(M=2m)的不带电木球相连,两球恰能在竖
 (2005•青浦区模拟)如图所示,质量为m的带电金属小球,用绝缘细线与质量为M(M=2m)的不带电木球相连,两球恰能在竖直向上的足够大且场强为E的匀强电场中,以速度v匀速竖直向上运动,当木球升至a点时,细线突然断裂,木球升至b点时速度为零.则木球速度为零时,金属球的速度大小为______,a、b之间的电势差为
(2005•青浦区模拟)如图所示,质量为m的带电金属小球,用绝缘细线与质量为M(M=2m)的不带电木球相连,两球恰能在竖直向上的足够大且场强为E的匀强电场中,以速度v匀速竖直向上运动,当木球升至a点时,细线突然断裂,木球升至b点时速度为零.则木球速度为零时,金属球的速度大小为______,a、b之间的电势差为Ev2 2g .Ev2 2g  董健华1年前1
董健华1年前1 -
 belief7213 共回答了19个问题
belief7213 共回答了19个问题 |采纳率84.2%解题思路:M与m组成的系统以速度v匀速竖直向上运动,说明它们的合力为0,故动量守恒;木球从a到b,只有重力做功,机械能守恒,从而求出木球上升的高度.(1)M与m组成的系统以速度v匀速竖直向上运动,说明它们的合力为0,故动量守恒:(M+m)v=mv′+M•0
代人数据求得:v′=3v
(2)木球从a到b,只有重力做功,所以−mgh=0−
1
2mv2
整理得:h=
v2
2g
a、b之间的电势差:Uab=E•h=
Ev2
2g
故答案为:3V,
Ev2
2g.点评:
本题考点: 匀强电场中电势差和电场强度的关系;动量定理.
考点点评: 该题能够根据以速度v匀速竖直向上运动判断出M与m组成的系统动量守恒是解题的关键.属于简单题.1年前查看全部
- (2005•青浦区)如图是某学生在实验室制取CO2并检验CO2性质的实验装置示意图,试回答:
(2005•青浦区)如图是某学生在实验室制取CO2并检验CO2性质的实验装置示意图,试回答:

(1)仪器名称:a长颈漏斗长颈漏斗b锥形瓶锥形瓶,c导气管导气管
(2)用化学方程式表示实验室制取CO2的反应原理CaCO3+2HCl=CaCl2+H2O+CO2↑CaCO3+2HCl=CaCl2+H2O+CO2↑
(3)该学生在实验过程中,盐酸的浓度较高,将A中产生的气体通入B中,观察到澄清石灰水一段时间内没有变浑浊,试分析其原因由于氯化氢与石灰水反应,氯化氢将石灰水全部消耗,故会看到澄清石灰水不浑浊由于氯化氢与石灰水反应,氯化氢将石灰水全部消耗,故会看到澄清石灰水不浑浊
(4)该学生用C瓶收集一瓶由装置A中产生的气体后,往瓶中倒人浓氢氧化钠溶液,迅速用事先帮好的一个小气球的胶塞塞紧,振荡,可观察到小气球气球逐渐胀大气球逐渐胀大,请写出C中反应的化学方程式CO2+2NaOH=Na2CO3+H2O、NaOH+HCl=NaCl+H2OCO2+2NaOH=Na2CO3+H2O、NaOH+HCl=NaCl+H2O. summerzmx1年前1
summerzmx1年前1 -
 聚光洒 共回答了19个问题
聚光洒 共回答了19个问题 |采纳率84.2%解题思路:(1)依据实验室常用仪器的认识解答此题;
(2)根据实验室是用碳酸钙和稀盐酸反应来制取二氧化碳进行解答;
(1)根据浓盐酸具有挥发性进行解答,由于二氧化碳气体中混有氯化氢,因此石灰水不会变浑浊;
(4)二氧化碳、氯化氢能与氢氧化钠反应,导致气球胀大.(1)由图示可知,仪器的名称为:a:长颈漏斗;b:锥形瓶;c:导气管;
(2)盐酸与大理石的主要成分碳酸钙反应,生成氯化钙、水和二氧化碳,故反应方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)浓盐酸具有挥发性,装置A中出来的二氧化碳中混有氯化氢,由于氯化氢与石灰水反应,氯化氢将石灰水全部消耗,故会看到澄清石灰水不浑浊;
(4)氢氧化钠与二氧化碳、氯化氢两种气体都会发生反应,使烧瓶内的气体压强减小,因此气球逐渐胀大,其反应的化学方程式为:CO2+2NaOH=Na2CO3+H2O、NaOH+HCl=NaCl+H2O.
故答案为:(1)a:长颈漏斗;b:锥形瓶;c:导气管;
(2)CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)由于氯化氢与石灰水反应,氯化氢将石灰水全部消耗,故会看到澄清石灰水不浑浊;
(4)气球逐渐胀大;CO2+2NaOH=Na2CO3+H2O、NaOH+HCl=NaCl+H2O.点评:
本题考点: 二氧化碳的实验室制法;二氧化碳的化学性质;酸的物理性质及用途;碱的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查意外实验现象的愿意分析以及氢氧化钠的化学性质,考查学生分析问题、解决问题的能力、综合运用知识的能力以及运用化学知识解决物理知识的运用能力.1年前查看全部
- (2010•青浦区二模)如图,要做一个圆锥形帐篷(不包括底面),底面直径6米,高4米,那么至少需要______平方米的帆
 (2010•青浦区二模)如图,要做一个圆锥形帐篷(不包括底面),底面直径6米,高4米,那么至少需要______平方米的帆布.
(2010•青浦区二模)如图,要做一个圆锥形帐篷(不包括底面),底面直径6米,高4米,那么至少需要______平方米的帆布.  lina00801年前1
lina00801年前1 -
 ff77777 共回答了22个问题
ff77777 共回答了22个问题 |采纳率90.9%C的蒸气密度是相同条件下氢气的22倍,相同条件下气体密度之比等于相对分子质量之比,所以C的相对分子质量是44,C能发生银镜反应,则C中含有醛基,所以C被还原生成A,A由C、H、O三种元素组成,所以C也由C、H、O三种元素组成,结合其相对分子质量知,C的结构简式为CH 3 CHO,A的结构简式为CH 3 CH 2 OH,在170℃条件下,乙醇发生消去反应生成B,则B的结构简式为CH 2 =CH 2 ,C被氧化生成D,则D为CH 3 COOH,乙醇和乙酸发生酯化反应生成E,E为CH 3 COOCH 2 CH 3 ,
(1)D为CH 3 COOH,其官能团名称是羧基,E的结构简式为CH 3 COOCH 2 CH 3 ,
故答案为:羧基;CH 3 COOCH 2 CH 3 ;
(2)①CH 3 CH 2 OH在浓硫酸作用下发生消去反应,反应的方程式为CH 3 CH 2 OH
浓 H 2 S O 4
△ CH 2 =CH 2 ↑+H 2 O,
故答案为:CH 3 CH 2 OH
浓 H 2 S O 4
△ CH 2 =CH 2 ↑+H 2 O;
②CH 3 CH 2 OH氧化生成CH 3 CHO,反应的方程式为2CH 3 CH 2 OH+O 2
催化剂
△ 2CH 3 CHO+2H 2 O,
故答案为:2CH 3 CH 2 OH+O 2
催化剂
△ 2CH 3 CHO+2H 2 O;
③C是乙醛,乙醛与银氨溶液反应的方程式CH 3 CHO+2Ag(NH 3 ) 2 OH
△
CH 3 COONH 4 +2Ag+3NH 3 +H 2 O,
故答案为:CH 3 CHO+2Ag(NH 3 ) 2 OH
△
CH 3 COONH 4 +2Ag+3NH 3 +H 2 O.1年前查看全部
- (2014•青浦区二模)在隔绝空气情况下,用木炭还原氧化铜.下列叙述正确的是( )
(2014•青浦区二模)在隔绝空气情况下,用木炭还原氧化铜.下列叙述正确的是( )
A.反应前后固体的质量保持不变
B.反应前后固体中铜元素的物质的量保持不变
C.反应中消耗的氧化铜与木炭的物质的量一定相等
D.反应后固体减轻的质量等于氧化铜中氧元素的质量 安逸的高傲1年前1
安逸的高傲1年前1 -
 binyyl 共回答了16个问题
binyyl 共回答了16个问题 |采纳率100%解题思路:根据木炭还原氧化铜的反应原理书写化学方程式,根据化学方程式C+2CuO
2Cu+CO2↑,并结合质量守恒定律进行分析,作出正确的判断.高温 .木炭还原氧化铜的化学反应方程式为:C+2CuO
高温
.
2Cu+CO2↑;
A、根据该反应方程式知,反应前固体的质量应等于反应后生成的铜的质量与二氧化碳的质量和,所以反应后固体的质量应减小,故错误;
B、根据质量守恒定律知,反应中前后同种元素的质量不变,故反应前后固体中铜元素的质量保持不变,正确;
C、根据该反应方程式知,反应中消耗的氧化铜与木炭的物质的量是2:1,故错误;
D、根据质量守恒定律知,反应前后固体减轻的质量等于反应后生成的二氧化碳的质量,故错误;
故选:B.点评:
本题考点: 碳的化学性质.
考点点评: 正确书写反应的化学方程式,并明确质量守恒定律的应用,是解答此题的关键.1年前查看全部
- (2012•青浦区一模)下列鉴别方法可行的是( )
(2012•青浦区一模)下列鉴别方法可行的是( )
A.用氨水鉴别Al3+、Mg2+和Ag+
B.用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32-
C.用水鉴别乙醇、甲苯、硝基苯
D.用KMnO4酸性溶液鉴别苯、甲苯、环己烷 3755717091年前1
3755717091年前1 -
 永不言弃的艳子 共回答了21个问题
永不言弃的艳子 共回答了21个问题 |采纳率90.5%解题思路:A、氨水与Al3+、Mg2+反应均生成沉淀;
B、Ba(NO3)2溶液与SO42-和CO32-反应均生成沉淀;
C、水与乙醇互溶,与甲苯、硝基苯分层;
D、KMnO4酸性溶液与苯、环己烷都不反应.A、氨水与Al3+、Mg2+反应均生成沉淀,现象相同,所以不能鉴别,故A错误;
B、Ba(NO3)2溶液与SO42-和CO32-反应均生成沉淀,现象相同,所以不能鉴别,故B错误;
C、水与乙醇互溶,水与甲苯混合后分层有机层在上面,水与硝基苯分层,有机层在下面,所以现象不同,能鉴别,故C正确;
D、KMnO4酸性溶液与苯、环己烷都不反应,现象相同,所以不能鉴别,故D错误.
故选C.点评:
本题考点: 物质的检验和鉴别的基本方法选择及应用.
考点点评: 本题考查了物质的鉴别,物质之间混合时具有不同的现象即可,题目难度不大,掌握常见物质的性质是解题的关键.1年前查看全部
- (2009•青浦区二模)某小组同学通过实验研究浸没在液体中的物体表面受到液体的压力大小与什么因素有关.他们把高为0.2米
 (2009•青浦区二模)某小组同学通过实验研究浸没在液体中的物体表面受到液体的压力大小与什么因素有关.他们把高为0.2米的实心圆柱体先后浸没在A、B、C三种液体中(ρA<ρB<ρC),并用力改变上表面到液面的距离h,如图所示.他们利用仪器测得圆柱体上 (或下)表面受到液体的压强,并利用公式求得上(或下)表面受到液体的压力,记录数据如表所示.
(2009•青浦区二模)某小组同学通过实验研究浸没在液体中的物体表面受到液体的压力大小与什么因素有关.他们把高为0.2米的实心圆柱体先后浸没在A、B、C三种液体中(ρA<ρB<ρC),并用力改变上表面到液面的距离h,如图所示.他们利用仪器测得圆柱体上 (或下)表面受到液体的压强,并利用公式求得上(或下)表面受到液体的压力,记录数据如表所示.
(1)分析比较实验序号1、2与3(或4、5、6或7、8与9)数据中的距离h和上、下表面受到液体压力F1、F2的关系及相关条件,可得出的初步结论是:浸没在同种液体中时,圆柱体上、下表面所受的液体压力与上、下表面所处的深度成正比浸没在同种液体中时,圆柱体上、下表面所受的液体压力与上、下表面所处的深度成正比.液体 液体A 液体B 液体C 实 验 序 号 1 2 3 4 5 6 7 8 9 液面到上表面的距离h(米) 0.02 0.04 0.06 0.02 0.04 0.06 0.02 0.04 0.06 上表面受到液体的压力F1(牛) 2 4 6 2.2 4.4 6.6 2.4 4.8 7.2 下表面受到液体的压力F2(牛) 22 24 26 24.2 26.4 28.6 26.4 28.8 31.2
(2)分析比较实验序号1、4与7(或2、5与8;或3、6与9)1、4与7(或2、5与8;或3、6与9)等数据中的距离h和上表面受到液体压力F1、F2关系及相关条件,可得出的初步结论是:当深度相同时,液体的密度越大,圆柱体上、下表面受到液体的压力越大.
(3)请进一步综合分析表中的数据及相关条件,并归纳结论.
(a)同一圆柱体浸没在同种液体中时,圆柱体上、下表面所受的液体压力差相等同一圆柱体浸没在同种液体中时,圆柱体上、下表面所受的液体压力差相等.
(b)液体密度越大,浸没在液体中的圆柱体上、下表面所受的液体压力差越大液体密度越大,浸没在液体中的圆柱体上、下表面所受的液体压力差越大. gy_19781年前1
gy_19781年前1 -
 viky2005 共回答了23个问题
viky2005 共回答了23个问题 |采纳率87%(1)序号1、2与3(或4、5与6或7、8与9)的实验中,h越大,F1、F2都越大,且比值不变,故得出:浸没在同种液体中时,圆柱体上、下表面所受的液体压力与上、下表面所处的深度成正比.
(2)观察表中的数据,符合深度相同、密度越大,圆柱体上、下表面受到的压力越大的实验次数有1、4与7(或2、5与8;或3、6与9).
(3)(a)单独分析同种液体中的数据,可得:同一圆柱体浸没在同种液体中时,圆柱体上、下表面所受的液体压力差相等;
(b)综合比较不同密度液体中上述压力差的大小,可得:液体密度越大,浸没在液体中的圆柱体上、下表面所受的液体压力差越大.
故答案为:(1)浸没在同种液体中时,圆柱体上、下表面所受的液体压力与上、下表面所处的深度成正比.
(2)1、4与7(或2、5与8;或3、6与9).
(3)(a)同一圆柱体浸没在同种液体中时,圆柱体上、下表面所受的液体压力差相等;
(b)液体密度越大,浸没在液体中的圆柱体上、下表面所受的液体压力差越大.1年前查看全部
- (2010•青浦区一模)将B型血人的红细胞和另一个人的血清混合,不发生凝集,则此血清供应者的血型可能为( )
(2010•青浦区一模)将B型血人的红细胞和另一个人的血清混合,不发生凝集,则此血清供应者的血型可能为( )
A.只可能是B型
B.A型或AB型
C.B型或O型
D.B型或AB型 Airycc1年前1
Airycc1年前1 -
 玫瑰价值 共回答了17个问题
玫瑰价值 共回答了17个问题 |采纳率94.1%解题思路:A型人有A型凝集原,B型凝集素;B型人有B型凝集原,A型凝集素;O型人有A和B型凝集素,无凝集原;AB型人有A和B型凝集原,无凝集素.O型血是“万能输血站”,AB型血是“谁都吃不消”.A型血的人的红细胞上有A凝集原,血清中含有抗B凝集素; B型血的人的红细胞上有B凝集原,血清中含有抗A凝集素; AB型血的人的红细胞上有A凝集原和B凝集原,血清中不含凝集素; O型血的人的红细胞上无凝集原,血清中含有抗A和抗B凝集素. 将B型血人的红细胞和另一个人的血清混合,不发生凝集,说明对方的血清中没有B型凝集素,而A型和O型均有B型凝集素,所以可能是B型或AB型.
故选:D.点评:
本题考点: 人体免疫系统在维持稳态中的作用.
考点点评: 本题考查血型的相关知识,意在考查学生的分析问题和解决问题的能力,需要耐心分析.1年前查看全部
- (2012•青浦区一模)将28.8g铜投入100mL浓硝酸中,最后铜有剩余,其NO3-离子物质的量变化如图所示,请回答下
 (2012•青浦区一模)将28.8g铜投入100mL浓硝酸中,最后铜有剩余,其NO3-离子物质的量变化如图所示,请回答下列问题:
(2012•青浦区一模)将28.8g铜投入100mL浓硝酸中,最后铜有剩余,其NO3-离子物质的量变化如图所示,请回答下列问题:
(1)开始反应时浓硝酸的物质的量浓度为______mol/L.
(2)铜与浓硝酸反应生成的气体在标准状况下的体积(不考虑NO2与N2O4的平衡)为______L.
(3)硝酸完全反应后消耗铜的物质的量n(Cu)是______mol.
(4)应再往此反应体系中滴加______mL 2mol/L的硫酸才能使剩余的铜恰好完全溶解.已知此过程中NO3-的还原产物为NO.
(5)a g铜全部溶于一定量的浓硝酸中,测得生成的气体在标准状况下的体积(不考虑NO2与N2O4的平衡)为b L,为消除污染,将生成的气体通入NaOH溶液中,气体被完全吸收.
已知:NO+NO2+2NaOH→2NaNO2+H2O 2NO2+2NaOH→NaNO3+NaNO2+H2O
如果NO、NO2混合气体用NOx表示,被NaOH溶液完全吸收时,x的取值范围______;生成NaNO2的物质的量是[a/64][a/64]mol;NaNO3的物质的量是([b/22.4]-[a/64])([b/22.4]-[a/64])mol.
(6)在常温下,把NO气体压缩到1.01×107Pa,再加热到50℃,发现气体的压强迅速下降,压强降至略小于原压强的[2/3],然后压强就不再改变.已知其中一种产物为N2O,则上述变化的化学方程式为______,______.气体的平均摩尔质量为M,则M的取值范围应该是______. liu31206021年前1
liu31206021年前1 -
 mmm888999 共回答了19个问题
mmm888999 共回答了19个问题 |采纳率89.5%解题思路:(1)根据开始时硝酸根的物质的量计算硝酸的浓度;
(2)利用氮元素守恒计算气体的物质的量,再根据V=nVm计算二氧化氮的体积;
(3)反应结束,溶液中溶质为硝酸铜,根据硝酸根计算消耗n(Cu);
(4)发生反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,据此计算消耗硫酸的物质的量,进而计算需要硫酸的体积;
(5)由方程式2NO2+2NaOH=NaNO2+NaNO3+H2O和NO+NO2+2NaOH=2NaNO2+H2O可知,NO单独不能被吸收,NO和NO2混合气体被NaOH溶液被完全吸收,满足n(NO2):n(NO)≥1,当n(NO2):n(NO)=1时x值最小,计算x的最小值,因为混有NO,所以x最大值<2,据此确定x取值范围;
纵观整个过程,Cu失去的电子等于硝酸生成亚硝酸钠时获得的电子,根据电子转移守恒计算n(NaNO2),根据N元素守恒计算n(NaNO3);
(6)在常温下,把NO气体压缩到1.01×107Pa,再加热到50℃,发现气体的压强迅速下降,压强降至略小于原压强的[2/3],然后压强就不再改变.已知其中一种产物为N2O,依据原子个数守恒可知该反应为:3NO=N2O十NO2,因为存在2NO2 N2O4,即生成的NO2又双聚成N2O4,导致气体分子数减少,压强降至略小于原压强的[2/3];
N2O4,即生成的NO2又双聚成N2O4,导致气体分子数减少,压强降至略小于原压强的[2/3];
若只发生反应:3NO=N2O十NO2,气体的平均摩尔质量最小,若二氧化氮完全转化为四氧化二氮时,气体的平均摩尔质量最大,据此计算解答.(1)由图可知,开始时n(NO3-)=1.0mol,则n(HNO3)=n(NO3-)=1.0mol,则c(HNO3)=[1.0mol/0.1L]=10mol/L,故答案为:10;
(2)由图可知,反应结束时,溶液中NO3-为0.6mol,根据氮元素守恒,生成气体的物质的量为1.0mol-0.6mol=0.4mol,标况下二氧化氮的体积为0.4mol×22.4L/mol=8.96L,故答案为:8.96;
(3)溶液中溶质为硝酸铜,由图可知,反应结束时,溶液中NO3-为0.6mol,故消耗n(Cu)=n(硝酸铜)=[0.6mol/2]=0.3mol,故答案为:0.3;
(4)28.8g铜的物质的量为[28.8g/64g/mol]=0.45mol,故剩余Cu为0.45mol-0.3mol=0.15mol,
3 Cu+2 NO3-+8 H+=3Cu2++2NO↑+4H2O
32 8
0.15mol n(H+)
则n(H+)=[0.15mol×8/3]=0.4mol,故n(H2SO4)=0.2mol,则需要硫酸体积为[0.2mol/2mol/L]=0.1L=100mL,
故答案为:100;
(5)由方程式可知,NO单独不能被吸收,NO和NO2混合气体被NaOH溶液被完全吸收,满足n(NO2):n(NO)≥1,当n(NO2):n(NO)=1时x值最小,x最小值为[2+1/2]=1.5,因为混有NO,所以x最大值<2,故x的取值范围为1.5≤x<2;
纵观整个过程,Cu失去的电子等于硝酸生成亚硝酸钠时获得的电子,根据电子转移守恒,n(NaNO2)=n(Cu)=[ag/64g/mol]=[a/64]mol,根据N元素守恒,可知n(NaNO3)=n(气体)=[bL/22.4L/mol]-[a/64]mol=([b/22.4]-[a/64])mol,
故答案为:1.5≤x<2;[a/64];([b/22.4]-[a/64]);
(6)在常温下,把NO气体压缩到1.01×107Pa,再加热到50℃,发现气体的压强迅速下降,压强降至略小于原压强的[2/3],然后压强就不再改变.已知其中一种产物为N2O,依据原子个数守恒可知该反应为:3NO=N2O十NO2,因为存在2NO2 N2O4,即生成的NO2又双聚成N2O4,导致气体分子数减少,压强降至略小于原压强的[2/3],
N2O4,即生成的NO2又双聚成N2O4,导致气体分子数减少,压强降至略小于原压强的[2/3],
若只发生反应:3NO=N2O十NO2,气体的平均摩尔质量最小,此时M=[3×30g/mol/2]=45g/mol,
若二氧化氮完全转化为四氧化二氮时,气体的平均摩尔质量最大,1molNO2得到0.5molN2O4,
则此时M=[1mol×44g/mol+0.5mol×92g/mol/1mol+0.5mol]=60g/mol,
综上分析,可知45g/mol<M<60g/mol,
故答案为:3NO=N2O十NO2;2NO2 N2O4;45g/mol<M<60g/mol.
N2O4;45g/mol<M<60g/mol.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学计算,属于拼合型题目,涉及守恒法、极限法的运用等,是对学生综合能力的考查,难度较大.1年前查看全部
- (2014•青浦区一模)从某些性质看,NH3与H2O相当,NH4+与H3O+相当,NH2-和OH-相当.下列有关化学方程
(2014•青浦区一模)从某些性质看,NH3与H2O相当,NH4+与H3O+相当,NH2-和OH-相当.下列有关化学方程式不正确的是( )
A.氯化铵与KNH2反应:NH4Cl+KNH2
KCl+2NH3↑△ .
B.二价活泼金属M(下同)与液氨反应:M+2NH3=M(NH2)2+H2↑
C.盐酸与MNH反应:2HCl+MNH=MCl2+NH3↑
D.氯化铵与MO反应:2NH4Cl+MO=M(NH2)2+2HCl+H2O 123娃哈哈1年前1
123娃哈哈1年前1 -
 骑单车的人 共回答了17个问题
骑单车的人 共回答了17个问题 |采纳率88.2%解题思路:NH3与H2O相当,NH4+与H3O+相当,NH2-和OH-相当.根据题意可从反应入手作出类推和判断.A中KNH2可看成KOH,反应正确,B中NH3可看成H2O,反应正确,C中M(NH2)2可看成MO,反应同样也正确,而D中若将NH4Cl看成H3OCl即HCl,则应有反应2NH4Cl+MO=MCl2+2NH3↑+H2O.解析:A、KHN2相当于KOH,氯化铵与KOH反应的化学方程式是:NH4Cl+KOH=KCl+NH3+H2O对比(A)反应,可知该化学方程式正确,故A正确;
B、NH3相当于H2O,二价活泼金属M与水反应的化学方程式是:M+2H2O=M(OH)2+H2↑对比(B)反应,可知该化学方程式正确,故B正确;
C、MNH相当于MO,盐酸与MO反应的化学方程式是:2HCl+MO=MCl2+H2O对比(C)反应,可知该化学方程式正确,故C正确;
D、NH4Cl相当于H3OCl(即HCl),H3OCl与MO反应的化学方程式是:2H3OCl+MO=MCl2+3H2O或2HCl+MO=MCl2+H2O,则NH4Cl与MO反应的化学方程式应为:2NH4Cl+MO=MCl2+2NH3+H2O可知,化学方程式D不正确,故D错误;
故选D.点评:
本题考点: 化学方程式的书写.
考点点评: 本题考查了NH3与H2O相当,NH4+与H3O+相当,NH2-和OH-相当的几组离子性质的类推应用,关键是建立类推思想,结合常见的反应对比分析比较,题目叫难,需要较强的类推能力.1年前查看全部
- (2012•青浦区二模)可用以下反应制备KIO3和K2H3IO6(高碘酸氢二钾):
(2012•青浦区二模)可用以下反应制备KIO3和K2H3IO6(高碘酸氢二钾):
①I2+2KClO3→2KIO3+Cl2
②KIO3+Cl2+3KOH→K2H3IO6+2KCl
最终制得的KIO3和K2H3IO6的物质的量之比x,若制得100molK2H3IO6,共消耗ymolKClO3,试确定y与x的关系式______. mm少尉1年前1
mm少尉1年前1 -
 简单kk 共回答了10个问题
简单kk 共回答了10个问题 |采纳率100%解题思路:由方程式可知,整个过程KClO3中Cl原子的物质的量等于I原子的物质的量,据此解答.制得的KIO3和K2H3IO6的物质的量之比x,若制得100molK2H3IO6,同时生成100xmolKIO3,
由方程式可知,整个过程KClO3中Cl原子的物质的量等于I原子的物质的量,故有:y=100x+100,
故答案为:y=100x+100.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应的有关计算,难度中等,注意利用原子守恒进行的计算,可以利用电子转移守恒进行计算,相对原子守恒比较麻烦,且表达式可能不同.1年前查看全部
- (2012•青浦区二模)重为8牛的小球静止悬挂在天花板上,用力的图示法在图中画出它所受的重力.
 carey2101年前0
carey2101年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 青浦区2012英语初三一模求答案(^O^)
青浦区2012英语初三一模求答案(^O^)
The...is that daily newspaper finish the whole process in one single day A discussion.B.DifferenceCdiffculty Ddecision
应填哪个词? zhidian_6111年前1
zhidian_6111年前1 -
 别朵大红花 共回答了26个问题
别朵大红花 共回答了26个问题 |采纳率96.2%我不知道你前面的语境,但在这句话里我感觉应该选c.我分析来源于in one single day在一天完成,所以应该是困难的意思;你看呢,如果不对请指教.1年前查看全部
- (2010•青浦区一模)下表是某兴趣小组“比较过氧化氢在不同条件下的分解”实验设计相关内容,下图为在最适温度下反应物浓度
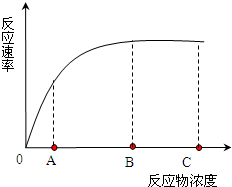 (2010•青浦区一模)下表是某兴趣小组“比较过氧化氢在不同条件下的分解”实验设计相关内容,下图为在最适温度下反应物浓度对酶促反应速率的影响.据图作答:
(2010•青浦区一模)下表是某兴趣小组“比较过氧化氢在不同条件下的分解”实验设计相关内容,下图为在最适温度下反应物浓度对酶促反应速率的影响.据图作答:
(1)该实验中,自变量是______、______ 等,因变量是H2O2分解反应的速率.实验组为______号.编号 加入材料 处理方法 实验现象 1 2mLH2O2液+2滴清水 无气泡 2 2mLH2O2液+2滴清水 90℃水浴加热 少量气泡,带火星的卫生香不复燃 3 2mLH2O2液+2滴质量分数为3.5%FeCl3液 较多气泡,带火星的卫生香复燃 4 2mLH2O2液+2滴肝脏研磨液 大量气泡,带火星的卫生香猛烈复燃
(2)比较1号和2号,你得出的结论是______.比较3号和4号,你得出的结论是______.
(3)该实验小组将2号试管中的“清水”改为“肝脏研磨液”,与1号比较后得出“高温使酶的活性下降”的结论,请对此作出评价______.如果按表中方法做了这个实验,结果试管3和4的现象无明显差异,实验失败的原因可能有哪些?______.
(4)如果在A到C浓度范围内,将反应温度均升高10℃,请在图上画出相应的曲线(用“…”画图).如果在B到C浓度范围内向反应混合物中都加入少量同样的酶,请在图上画出变化后的曲线,(用“-”画图).并给该曲线拟定一个合理的名称. 木才801年前1
木才801年前1 -
 86505391 共回答了16个问题
86505391 共回答了16个问题 |采纳率87.5%解题思路:本题是考查酶的高效性和影响酶促反应的因素.分析表格信息明确实验的自变量、因变量及实验原理,完成(1)、(2);分析问题给出的信息,结合表格内容按照实验设计的单一变量的原则对(3)进行分析与评价;分析曲线图,回忆影响酶促反应速率的因素完成(4).(1)分析表格中4组实验可知,本实验的自变量是温度、催化剂种类;其中1号是空白对照,2、3、4号试管是实验组.
(2)1号和2号试管的自变量是温度,因变量是气泡的数量,2号试管温度高,产生气泡,1号试管温度低,不产生气泡,说明化学反应速度受温度影响;
3号试管与4号试管比较,自变量的催化剂的种类,4号试管加入肝脏研磨液,产生的气泡量多,卫生香复燃猛烈,说明酶具有高效性.
(3)若实验小组将2号试管中的“清水”改为“肝脏研磨液”,与1号比较,存在两个自变量,不能遵循单一变量的原则,因此不能得出“高温使酶的活性下降”的结论,应该与4号对照,不能与1号对照;若按表中方法做了这个实验,结果试管3和4的现象无明显差异,实验失败,失败的原因可能是:
肝脏研磨液不新鲜,过氧化氢酶分解;温度控制不当;先做的第4组实验,未换滴管直接吸取FeCl3液,3试管中含有过氧化氢酶等.
(4)由题意可知,该曲线是在在最适温度下反应物浓度对酶促反应速率的影响,将反应温度均升高10℃,反应速率下降;由题图可知,BC段限制酶促反应速率的因素不再是反应物浓度,可能是酶的数量,如果在B到C浓度范围内向反应混合物中都加入少量同样的酶,酶的数量增加,反应速率加快.
故答案应为:
(1)温度、催化剂种类2、3、4
(2)化学反应速度受温度影响 酶的催化作用具有高效性
(3)应与4号试管对照(与1号对照不是单一变量)
肝脏研磨液不新鲜;温度控制不当;先做的第4组实验,未换滴管直接吸取FeCl3液
(4)反应速度随反应物浓度变化的关系画图见右
点评:
本题考点: 酶的特性;探究影响酶活性的因素.
考点点评: 本题的知识点是酶的高效性,温度、酶的数量、反应物浓度对酶促反应速率的影响,根据题干给出的信息分析出实验的目的、自变量、因变量是解题的突破口,对实验设计应遵循的原则的应用是解题的关键,本题的重点和难点是对实验的分析与评价及改变条件后反应速率变化的绘图.1年前查看全部
- (2008•青浦区二模)多数花卉适宜在微酸性土壤中生成,某盆花长势不好,经测定盆中土壤的pH为7.6,用稀硫酸亚铁溶液浇
(2008•青浦区二模)多数花卉适宜在微酸性土壤中生成,某盆花长势不好,经测定盆中土壤的pH为7.6,用稀硫酸亚铁溶液浇灌后,长势良好.这说明硫酸亚铁的pH( )
A.>7
B.<7
C.=7
D.无法确定 pxjghost1年前1
pxjghost1年前1 -
 sdcj 共回答了19个问题
sdcj 共回答了19个问题 |采纳率78.9%解题思路:该花长势不佳,土壤的pH为7.6,为碱性,用较稀的硫酸亚铁溶液浇灌后,长势良好,根据酸碱相互中和的性质,说明所施该溶液为酸性.根据溶液pH>7呈碱性;溶液pH<7呈酸性;溶液pH=7呈中性.故该花长势不佳,土壤的pH为7.6,为碱性,用硫酸亚铁溶液浇灌后,长势良好,根据酸碱相互中和的性质,说明所施该溶液为酸性,故硫酸亚铁溶液的pH<7.
故选B.点评:
本题考点: 溶液的酸碱性与pH值的关系.
考点点评: 改变溶液的pH有两种方法,一是稀释溶液,此时溶液的酸碱性不会改变;二是中和,此时溶液的酸碱性会随之改变.1年前查看全部
- (2014•青浦区二模)100多种元素能合理地组成庞大数量的物质,应用于我们的日常生活之中.用表中的元素组成适当的物质,
(2014•青浦区二模)100多种元素能合理地组成庞大数量的物质,应用于我们的日常生活之中.用表中的元素组成适当的物质,回答下列问题:
①请用物质名称或化学式填写:固态时可用于人工降雨的氧化物是______,会造成酸雨的主要物质是______,能与血液里的血红蛋白结合,造成人体中毒的气体是______.元素名称 碳 氧 硫 氯 钠 钙 元素符号 C O S Cl Na Ca
②光彩夺目的焰火离不开多种元素的焰色反应,表中钠元素的火焰呈______色.
③自来水厂应用活性炭、氯气等物质对水进行加工处理,其中活性炭起______作用,氯气的作用是______. lunwen1201年前1
lunwen1201年前1 -
 rsjf 共回答了15个问题
rsjf 共回答了15个问题 |采纳率100%解题思路:根据物质的组成、性质、用途进行分析①固态二氧化碳又叫干冰,升华时能吸收大量热量,可用于人工降雨;二氧化硫溶于水生成酸,能造成酸雨;能与血红蛋白结合引起中毒的是CO;
②焰色反应中,钠元素的焰色是黄色的;
③由于活性炭有吸附性,吸附池内的活性炭起吸附作用;氯气在自来水厂净水过程中起到杀菌消毒的作用;
故答案为:①二氧化碳;二氧化硫; 一氧化碳;
②黄;
③吸附;消毒杀菌点评:
本题考点: 二氧化碳的用途;一氧化碳的毒性;自来水的生产过程与净化方法;酸雨的产生、危害及防治.
考点点评: 本考点考查了常见气体和物质的用途,基础性比较强.初中阶段常见气体和常见物质的性质和用途要记牢,还要加强应用.1年前查看全部
- (2008•青浦区一模)设函数f(x)的定义域为[-4,4],其图象如图,那么不等式f(x)sinx≤0的解集为____
(2008•青浦区一模)设函数f(x)的定义域为[-4,4],其图象如图,那么不等式
≤0的解集为______.f(x) sinx 
 minniexu1年前1
minniexu1年前1 -
 xiaowu1188 共回答了11个问题
xiaowu1188 共回答了11个问题 |采纳率90.9%解题思路:根据函数的图象可得,f(x)小于0时,x的范围;f(x)大于0时,x的范围,;且根据正弦函数图象可知,sinx大于0时,x∈(-4,-π)∪(0,π);当sinx小于0时,x∈(-π,0),则把所求的式子化为f(x)与sinx异号,即可求出不等式的解集.由函数图象可知:当f(x)<0时,-4<x<-2,1<x<4,或;当f(x)>0时,-2<x<1;而sinx中的x∈[-4,4],当sinx>0时,x∈(-4,-π)∪(0,π);当sinx<0时,x∈(-π,0),则f(x)sinx≤0,可化为:f(x)≥0...
点评:
本题考点: 其他不等式的解法.
考点点评: 此题属于以余弦函数与已知函数的图象及单调性为平台,考查了其他不等式的解法,是一道综合题.1年前查看全部
- (2014•青浦区一模)实验室保存下列试剂,其中保存方法和理由描述都正确的是( )
(2014•青浦区一模)实验室保存下列试剂,其中保存方法和理由描述都正确的是( )
A.试剂浓硝酸,保存方法:密封保存在铁制容器中,理由:避免见光分解
B.试剂液溴,保存方法:密封保存在细口瓶中,理由:防止升华
C.试剂钠,保存方法:保存在煤油中,理由:防止与空气中水、氧气接触发生反应
D.试剂烧碱,保存方法:存放在磨口玻璃塞的广口瓶中,理由:防止与空气中氧气接触被氧化 Tears1101年前1
Tears1101年前1 -
 青衣折绿 共回答了18个问题
青衣折绿 共回答了18个问题 |采纳率83.3%解题思路:A.浓硝酸应保存在棕色试剂瓶中;
B.溴不发生升华;
C.钠与空气中水、氧气反应;
D.NaOH与玻璃中的二氧化硅反应生成硅酸钠,具有粘合性.A.浓硝酸易挥发,变成稀硝酸能和铁持续反应,不宜密封保存在铁制容器中,浓硝酸见光溶液分解,应该保存在棕色细口瓶并置于阴凉处,故A错误;
B.溴单质易挥发,应用水封法保存,故B错误;
C.钠与空气中水、氧气反应,钠的密度比煤油大,可保存在煤油中,故C正确;
D.NaOH与玻璃中的二氧化硅反应生成硅酸钠,具有粘合性,则应选橡皮塞,故D错误.
故选C.点评:
本题考点: 化学试剂的存放.
考点点评: 本题考查试剂的存放,明确物质的性质与保存方法的关系是解答本题的关键,题目难度不大.1年前查看全部
- (2014•青浦区一模)读世界某区域图.回答12-13题
(2014•青浦区一模)读世界某区域图.回答12-13题
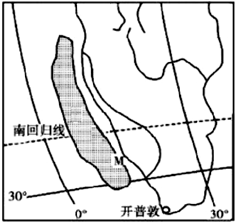
12.图中阴影部分是世界海雾的多发区域之一,该海域多雾的原因是( )
13.图中 M 处渔业资源丰富的原因是( )
A.寒暖流的交汇
B.上升流带来丰富的饵料
C.季节变化导致上下层海水间的运动
D.沿岸河流带来丰富的营养盐类 caiym1年前1
caiym1年前1 -
 baly-king 共回答了21个问题
baly-king 共回答了21个问题 |采纳率76.2%解题思路:这题主要考查渔场的形成原因.①寒暖流交汇:北海道渔场、北海渔场、纽芬兰渔场;②上升流:秘鲁渔场
根据图中的信息得出M 处洋流是本格拉寒流.本格拉寒流是上升流,由于上泛的海水含有丰富的营养盐类,有利于浮游生物繁殖,形成了渔场.A、根据图中的信息得出M 处洋流是本格拉寒流.此处无寒暖流交汇.故A错误;
B、根据图中的信息得出M 处洋流是本格拉寒流.本格拉寒流是上升流,由于上泛的海水含有丰富的营养盐类,有利于浮游生物繁殖,形成了渔场.故B正确;
C、M处位于亚热带海区,温度变化不大,没有明显的四季.故C错误;
D、根据图中的信息得出M 处洋流是本格拉寒流.本格拉寒流是上升流,由于上泛的海水含有丰富的营养盐类,有利于浮游生物繁殖,形成了渔场.故D错误;
故选:B.点评:
本题考点: 洋流对地理环境的影响.
考点点评: 这题主要考查渔场的形成原因.①寒暖流交汇:北海道渔场、北海渔场、纽芬兰渔场;②上升流:秘鲁渔场.难度不大.1年前查看全部
- (2012•青浦区二模)已知关于x的一元二次方程x2+bx+c=0有两个实数根,则下列关于判别式b2-4c的判断正确的是
(2012•青浦区二模)已知关于x的一元二次方程x2+bx+c=0有两个实数根,则下列关于判别式b2-4c的判断正确的是( )
A.b2-4c≥0
B.b2-4c>0
C.b2-4c=0
D.b2-4c<0 爽爽冰1年前1
爽爽冰1年前1 -
 擎天小猫 共回答了23个问题
擎天小猫 共回答了23个问题 |采纳率95.7%解题思路:根据一元二次方程根与系数的关系直接进行解答即可.∵关于x的一元二次方程x2+bx+c=0有两个实数根,
∴b2-4c≥0.
故选A.点评:
本题考点: 根的判别式.
考点点评: 本题考查的是一元二次方程根与系数的关系,一元二次方程ax2+bx+c=0(a≠0)的根与△=b2-4ac有如下关系:
①当△>0时,方程有两个不相等的两个实数根;
②当△=0时,方程有两个相等的两个实数根;
③当△<0时,方程无实数根.1年前查看全部
- (2008•青浦区二模)如图为四种元素原子的原子结构示意图,完成以下填空:
(2008•青浦区二模)如图为四种元素原子的原子结构示意图,完成以下填空:

(1)属于稀有元素原子结构的微粒是______(填字母序号).
(2)某元素形成的氧化物为RO,则R的原子结构示意图可能是______(填字母序号). lphwd8881年前1
lphwd8881年前1 -
 misouli 共回答了20个问题
misouli 共回答了20个问题 |采纳率85%解题思路:根据原子核电荷数=核内质子数=核外电子数,可知粒子中,属于原子的有哪些;根据阳离子的核内质子数>核外电子数,可知粒子中,属于阳离子的有哪些;根据质子数可以确定元素种类.(1)原子中,核内质子数等于核外电子数,B的质子数为10,为氖元素,属于稀有气体元素,故选B
(2)与氧元素形成的氧化物为RO,氧元素的化合价为-2价,则R在氧化物的化合价为+2价,R可以失去最外层两个电子而显正2价,因此R原子最外层有两个电子,故选C
故答案为:(1)B (2)C点评:
本题考点: 原子结构示意图与离子结构示意图;核外电子在化学反应中的作用.
考点点评: 解原子结构示意图与离子结构示意图的区别和联系;掌握核外电子在化学变化中的作用和得失电子的规律特点;掌握元素的概念.1年前查看全部
- (2010•青浦区二模)定义:如果数列{an}的任意连续三项均能构成一个三角形的三边长,则称{an}为“三角形”数列.对
(2010•青浦区二模)定义:如果数列{an}的任意连续三项均能构成一个三角形的三边长,则称{an}为“三角形”数列.对于“三角形”数列{an},如果函数y=f(x)使得bn=f(an)仍为一个“三角形”数列,则称y=f(x)是数列{an}的“保三角形函数”,(n∈N﹡).
(1)已知{an}是首项为2,公差为1的等差数列,若f(x)=kx,(k>1)是数列{an}的“保三角形函数”,求k的取值范围;
(2)已知数列{cn}的首项为2010,Sn是数列{cn}的前n项和,且满足4Sn+1-3Sn=8040,证明{cn}是“三角形”数列;
(3)[文科]若g(x)=lgx是(2)中数列{cn}的“保三角形函数”,问数列{cn}最多有多少项.
[理科]根据“保三角形函数”的定义,对函数h(x)=-x2+2x,x∈[1,A],和数列1,1+d,1+2d,(d>0)提出一个正确的命题,并说明理由. 阁老居1年前1
阁老居1年前1 -
 xxxokk 共回答了19个问题
xxxokk 共回答了19个问题 |采纳率94.7%解题思路:(1)先有条件得{an}是三角形数列,再利用f(x)=kx,(k>1)是数列{an}的“保三角形函数”,得到kn+kn+1>kn+2,解得k的取值范围;
(2)先利用条件求出数列{cn}的通项公式,再证明其满足“三角形”数列的定义即可;
(3)[文科]利用条件得到g(cn)是单调递减函数以及lgcn-1+lgcn>lgcn-2得,解此不等式找到对应的范围即可得出结论.
[理科]根据函数h(x)=-x2+2x,x∈[1,A]是数列1,1+d,1+2d(d>0)的“保三角形函数”,可以得到①1,1+d,1+2d(d>0)是三角形数列,所以1+1+d>1+2d,即o<d<1,②数列中的各项必须在定义域内,即1+2d≤A,③h(1),h(1+d),h(1+2d)是三角形数列;结论为在利用h(x)=-x2+2x,x∈[1,A]是单调递减函数,就可求出对应d的范围.(1)显然an=n+1,an+an+1>an+2对任意正整数都成立,
即{an}是三角形数列.(2分)
因为k>1,显然有f(an)<f(an+1)<f(an+2),
由f(an)+f(an+1)>f(an+2)得kn+kn+1>kn+2,解得k<
1+
5
2.
所以当k∈(1,
1+
5
2)时,f(x)=kx是数列{an}的“保三角形函数”.(5分)
(2)由4Sn+1-3Sn=8040得4Sn-3Sn-1=8040,两式相减得4cn+1-3cn=0
所以,cn=2010(
3
4)n−1,
经检验,此通项公式满足4Sn+1-3Sn=8040 (7分)
显然cn>cn+1>cn+2,因为cn+1+cn+2=2010(
3
4)n+2010(
3
4)n+1=•2010(
3
4)n−1>cn,
所以{cn}是“三角形”数列.(10分)
(3)[文科]因为g(cn)是单调递减函数,所以,由lgcn-1+lgcn>lgcn-2得
lg2010+(n-2)[3/4]lg+lg2010+(n-1)lg[3/4]>lg2010+(n-3)lg[3/4](14分)
化简得lg2010>nlg[3/4],解得n<26.4,
即数列{bn}最多有26项.(18分)
(3)[理科]探究过程:函数h(x)=-x2+2x,x∈[1,A]是数列1,1+d,1+2d(d>0)的“保三角形函数”,必须满足三个条件:
①1,1+d,1+2d(d>0)是三角形数列,所以1+1+d>1+2d,即o<d<1.
②数列中的各项必须在定义域内,即1+2d≤A.
③h(1),h(1+d),h(1+2d)是三角形数列.
由于h(x)=-x2+2x,x∈[1,A]是单调递减函数,所以h(1+d)+h(1+2d)>h(1),解得0<d<
5
5.点评:
本题考点: 数列的应用.
考点点评: 本题是在新定义下对数列的综合考查.关于新定义的题型,在作题过程中一定要理解定义,并会用定义来解题.1年前查看全部
- (2008•青浦区一模)直线l1:x+my+1=0与l2:x-y+2=0垂直,则m=______.
 dnangle20051年前1
dnangle20051年前1 -
 adai8888 共回答了16个问题
adai8888 共回答了16个问题 |采纳率93.8%解题思路:由l2:x-y+2=0的斜率等于1,可知直线l1 的斜率等于-1,即 [−1/m]=-1.∵l2:x-y+2=0的斜率等于1,直线l1:x+my+1=0与l2:x-y+2=0垂直,
故直线l1 的斜率等于-1,即 [−1/m]=-1,∴m=1,
故答案为 1.点评:
本题考点: 直线的一般式方程与直线的垂直关系.
考点点评: 本题考查两条直线垂直的条件:当两直线的斜率都存在时,两直线垂直的充要条件是斜率之积等于-1.1年前查看全部
- (2011•青浦区一模)下列物质中全部属于分泌蛋白的组合是( )
(2011•青浦区一模)下列物质中全部属于分泌蛋白的组合是( )
①胃蛋白酶②抗体③载体④呼吸氧化酶⑤雄激素⑥胰岛素.
A.①②③④
B.②③⑤⑥
C.①②⑥
D.①④⑥ tikoo831年前1
tikoo831年前1 -
 yzasd 共回答了21个问题
yzasd 共回答了21个问题 |采纳率95.2%解题思路:分泌蛋白的化学本质是蛋白质,由细胞中合成分泌到细胞外发挥其生理作用,具体合成和分泌途径是:在核糖体中合成,运输到内质网中加工,内质网边缘产生囊泡,逐渐与高尔基体膜融合,蛋白质继续在高尔基体中再加工,高尔基体边缘冒出小泡,运输到细胞膜并与之融合,释放出蛋白质.这过程需要线粒体提供能量.①胃蛋白酶是由细胞中合成,分泌到胃液中发挥作用,是分泌蛋白,①正确;
②抗体主要分布于血浆和血清中,由效应B细胞分泌的,是分泌蛋白,②正确;
③载体协助物质跨膜运输,如协助扩散和主动运输,分布在细胞膜上,不是分泌蛋白,③错误;
④呼吸作用发生在细胞内,相应的呼吸氧化酶也在细胞内,不是分泌蛋白,④错误;
⑤性激素是脂质中固醇类,不是分泌蛋白,⑤错误;
⑥胰岛素是激素,通过体液运输作用于相应的靶细胞,是分泌蛋白,⑥正确.
故选:C.点评:
本题考点: 蛋白质的结构和功能的综合.
考点点评: 本题考查了分泌蛋白的相关内容,意在考查考生理解所学知识的要点,把握知识间的内在联系的能力.1年前查看全部
- (2011•青浦区二模)某同学通过实验研究运动物体受到的阻力对物体运动状态改变的影响.他在水平桌面上分别铺上粗糙程度不同
(2011•青浦区二模)某同学通过实验研究运动物体受到的阻力对物体运动状态改变的影响.他在水平桌面上分别铺上粗糙程度不同的毛巾、棉布和木板,让小车自斜面顶端同一高度从静止开始滑下,观察到小车在不同表面运动的距离不同,且S1<S2<S3,如图(a)、(b)和(c)所示.请根据实验现象及相关条件,归纳得出初步结论.

(1)分析比较图(a)、(b)和(c)可得:______,速度减小得越慢,运动的距离越远.
(2)由上述实验推论可得:如果小车不受阻力,______. 81538001年前1
81538001年前1 -
 当我们混在了一起 共回答了16个问题
当我们混在了一起 共回答了16个问题 |采纳率93.8%解题思路:(1)通过实验主要比较小车在不同接触面上滑行距离的远近,接触面越光滑,小车受到的阻力越小;
(2)通过实验现象,再进一步进行科学推理,得出理想状态下的情况,即阻力无限减小,则运动距离就会无限增大.(1)图(a)、(b)和(c)中,接触面越来越光滑,对小车的阻力也越来越小,运动的距离也越来越远;(2)继续减小接触面的阻力,物体的运动距离将会继续增大,因此可推论出:如果小车不受阻力,物体的运动速度不变...
点评:
本题考点: 阻力对物体运动影响的探究实验.
考点点评: 物体所受阻力大小对运动状态的影响是本实验观察的重点,为了得出最终的推论,这是最后用到的研究方法,也常被称为理想实验法.1年前查看全部
- (2011•青浦区二模)如图,AB是⊙O的弦,点D是AB的中点,过B作AB的垂线交AD的延长线于C.
 (2011•青浦区二模)如图,AB是⊙O的弦,点D是
(2011•青浦区二模)如图,AB是⊙O的弦,点D是
的中点,过B作AB的垂线交AD的延长线于C.
AB
求证:AD=DC. xiawei20061年前1
xiawei20061年前1 -
 tenob625 共回答了14个问题
tenob625 共回答了14个问题 |采纳率85.7%1年前查看全部
- (2012•青浦区二模)甲、乙两小车同时同地同方向做匀速直线运动,它们的s-t图象分别如图(a)和(b)所示.经过12秒
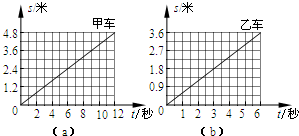 (2012•青浦区二模)甲、乙两小车同时同地同方向做匀速直线运动,它们的s-t图象分别如图(a)和(b)所示.经过12秒,两车的位置关系是( )
(2012•青浦区二模)甲、乙两小车同时同地同方向做匀速直线运动,它们的s-t图象分别如图(a)和(b)所示.经过12秒,两车的位置关系是( )
A.甲在乙前面1.2米处
B.甲在乙前面2.4米处
C.乙在甲前面1.2米处
D.乙在甲前面2.4米处 lthlthlth1年前1
lthlthlth1年前1 -
 我全 共回答了14个问题
我全 共回答了14个问题 |采纳率92.9%根据图象,经过12s,甲车行驶4.8m;乙车在6s内行驶了3.6m,因此12s行驶:3.6m×2=7.2m.因为甲、乙两小车同时同地同方向做匀速直线运动,所以12s时甲在乙的前面:7.2m-4.8m=2.4m处.
故选D.1年前查看全部
- (2010•青浦区一模)如图所示,用网球拍打击飞过来的网球,网球拍打击网球的力( )
 (2010•青浦区一模)如图所示,用网球拍打击飞过来的网球,网球拍打击网球的力( )
(2010•青浦区一模)如图所示,用网球拍打击飞过来的网球,网球拍打击网球的力( )
A.比球撞击球拍的力更早产生
B.与球撞击球拍的力同时产生
C.大于球撞击球拍的力
D.小于球撞击球拍的力 arany_janos1年前1
arany_janos1年前1 -
 mm821 共回答了17个问题
mm821 共回答了17个问题 |采纳率100%解题思路:用网球拍打击飞过来的网球过程中,根据牛顿第三定律分析网球拍打击网球的力与球撞击球拍的力的关系.用网球拍打击飞过来的网球过程中,网球拍打击网球的力与球撞击球拍的力是一对作用力与反作用力,根据牛顿第三定律得知,两个力是同时产生的,大小相等,方向相反.
故选B点评:
本题考点: 力的概念及其矢量性.
考点点评: 本题应用牛顿第三定律分析实际生活中力的关系.作用力与反作用力是同时产生、同时消失的.1年前查看全部
- (2008•青浦区二模)下列关于溶液说法正确的是( )
(2008•青浦区二模)下列关于溶液说法正确的是( )
A.溶液一定是无色透明的
B.溶质一定是固体
C.饱和溶液一定是浓溶液
D.不饱和溶液变成饱和溶液,其溶质质量百分比浓度不一定增大 ada1191年前1
ada1191年前1 -
 莫莫0325 共回答了23个问题
莫莫0325 共回答了23个问题 |采纳率87%解题思路:有些溶液是有颜色的;气体、固体、液体都可以作溶质;饱和溶液不一定是浓溶液;溶液是均一、稳定的混合物.A、硫酸铜溶液是蓝色的,氯化铁溶液是黄色的,说法错误;
B、溶质可以是固体,也可以不是如稀盐酸,溶质是氯化氢气体;说法错误;
C、饱和溶液不一定是浓溶液,如氢氧化钙的饱和溶液就是稀溶液.说法错误;
D、不饱和变为饱和可以通过改变温度则其溶质质量分数保持不变;说法正确;
故选D.点评:
本题考点: 溶液的概念、组成及其特点;饱和溶液和不饱和溶液相互转变的方法;浓溶液、稀溶液跟饱和溶液、不饱和溶液的关系.
考点点评: 明确溶液的特征、溶剂的种类、饱和溶液与浓稀溶液的关系是解答本题关健.溶液是均一稳定的混合物,溶剂不一定是水,饱和溶液不一定是浓溶液,不饱和溶液也不一定是稀溶液.1年前查看全部
- (m030•青浦区二模)下列运算正确的是( )
(m030•青浦区二模)下列运算正确的是( )
A.x2+x3=x5
B.x2•x3=x5
C.2x+3y=5xy
D.(x+y)2=x2+y2 because4u1年前1
because4u1年前1 -
 青山常在9 共回答了19个问题
青山常在9 共回答了19个问题 |采纳率94.7%解题思路:根据同底数幂相乘,底数不变指数相加,合并同类项法则和完全平方公式,对各选项计算后利用排除法求解.A、不是同类项,不能合并,故本选项错误;
B、02•03=0q,正确;
f、不是同类项,不能合并,故本选项错误;
D、应为(0+y)2=02+20y+y2,故本选项错误.
故选B.点评:
本题考点: 完全平方公式;合并同类项;同底数幂的乘法.1年前查看全部
- (2012•青浦区一模)在一固定容积的密闭容器中进行着反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其平衡常
 (2012•青浦区一模)在一固定容积的密闭容器中进行着反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其平衡常数K和温度的关系如下:
(2012•青浦区一模)在一固定容积的密闭容器中进行着反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其平衡常数K和温度的关系如下:
(1)该反应的正反应为______反应.(“吸热”或“放热”)t℃ 700 800 900 1000 1200 K 2.6 1.7 1.0 0.9 0.6
(2)平衡常数K表示的意义是______.
(3)能判断该反应是否已经达到化学平衡状态的是______
(a) 容器中密度不变 (b) 混合气体中CO浓度不变(c) v(H2)正=v(H2O)逆(d)c(CO2)=c(CO)
(4)该反应的逆反应速率随时间变化情况如图所示.
①从如图可知,在t1时改变了某种反应条件,反应在t2时达到平衡,改变的条件可能是______(选填编号).
a.升高温度 b.增大CO2的浓度c.减小CO2的浓度 d.使用催化剂
②如果在t3时增加CO2的量,t4时反应又处于新平衡状态,请在上图画出t3~t5时间段的v逆变化曲线. hp674667231年前1
hp674667231年前1 -
 干啥 共回答了19个问题
干啥 共回答了19个问题 |采纳率89.5%解题思路:(1)根据温度和平衡常数的变化关系确定反应的吸放热;
(2)平衡常数K是表示反应进行的程度大小的;
(3)化学平衡标志是正逆反应速率相同,各组分含量保持不变,各组分的浓度不随着时间的改变而改变,据此分析选项;
(4)①根据影响化学反应速率的因素来确定改变的条件;
②增加CO2的量,会促使平衡正向移动,正逆反应速率都要加快,据此回答.(1)根据温度和平衡常数的变化关系:温度升高,K降低,所以放应是放热的,故答案为:放热;
(2)平衡常数K的意义:是可逆反应进行程度的标志,一定温度下,K值越大,反应进行的程度越大,故答案为:K是可逆反应进行程度的标志,一定温度下,K值越大,反应进行的程度越大,反之则越小;
(3)(a) 容器中密度=[m/V],质量守恒,V始终不变化,所以密度始终不变,当密度不变了,不一定平衡,故a错误;
(b) 混合气体中CO浓度不变是平衡状态的特征,故b正确;
(c) v(H2)正=v(H2O)逆能说明正逆反应的速率是相等的,达到平衡,故c正确;
(d)c(CO2)=c(CO)不能说明正逆反应的速率是相等的,达到平衡,故d错误.
故答案为:bc;
(4)①从如图可知,在t1时改变了某种反应条件,反应在t2时达到平衡,改变的条件使速率变化离开原速率点了,应该是同时能让正逆反应速率加快的条件,故答案为:ad;
②在t3时增加CO2的量,会使得正逆反应速率都加快,逆反应速率在原来的基础上逐渐加快,图为 ,故答案为:
,故答案为: .
.点评:
本题考点: 化学反应速率变化曲线及其应用;化学平衡的影响因素;化学平衡状态的判断.
考点点评: 本题考查学生化学平衡状态的判断、平衡常熟的意义以及影响化学反应速率的因素等知识,注意知识的归纳和梳理是解题的关键,难度中等.1年前查看全部
- (2010•青浦区一模)近来有研究报告称:除去“普通水”里含有的氮气和氧气后,水的去污能力将大为加强.对此,下列理解不正
(2010•青浦区一模)近来有研究报告称:除去“普通水”里含有的氮气和氧气后,水的去污能力将大为加强.对此,下列理解不正确的是( )
A.“普通水”里含有氧分子
B.除去氧气后的水不再含有氧元素
C.“普通水”里含有氮分子
D.氮气和氧气在水中有一定的溶解性 爱到背叛1年前1
爱到背叛1年前1 -
 yinweiaini00 共回答了23个问题
yinweiaini00 共回答了23个问题 |采纳率87%解题思路:“普通水”中含有氮气和氧气,说明含有氮分子和氧分子,由于氧气能溶于水而使水中含有氧气,则氧元素会以化合态及游离态两种形式存在于水中.A、由于氧气能溶于水,所以水中含有氧气的分子,理解正确.故此选项错误.
B、除去氧气后的水中还有水中含有的氧元素存在,理解错误,故此选项正确.
C、普通水”中含有氮气,就含有氮分子,理解正确,故此选项错误.
D、氮气和氧气在水中有一定的溶解性,理解正确,故此选项错误.
故选B.点评:
本题考点: 分子、原子、离子、元素与物质之间的关系;水的组成.
考点点评: 本题考查物质的组成,学生应紧扣习题中的信息,利用好信息并结合所学知识来分析问题,能很好的训练学生对新信息的抽取和应用的能力.1年前查看全部
- (2010•青浦区二模)已知抛物线x2=3y上的两点A、B的横坐标恰是方程x2+px+q=0(p,q是实数)的两个实根,
(2010•青浦区二模)已知抛物线x2=3y上的两点A、B的横坐标恰是方程x2+px+q=0(p,q是实数)的两个实根,则直线AB的方程是 ______.
 liujin0007131年前1
liujin0007131年前1 -
 cym32 共回答了16个问题
cym32 共回答了16个问题 |采纳率81.3%解题思路:分别设出A和B的坐标,根据抛物线上两点的横坐标都是方程的解得到方程有两个不等的实数根,即△>0,列出p与q的关系式,在这个关系式成立时,分别把A和B的坐标代入抛物线解析式和方程中,分别消去平方项得到两等式③和④,根据两等式的特点即可得到直线AB的方程.设A(x1,y1),B(x2,y2),且方程有两个不同的解得到:△=p2-4q>0,把A的坐标代入抛物线解析式和已知的方程得:x12=3y1①,x12+px1+q=0②,①-②整理得:px1+3y1+q=0③;同理把B的坐标代入抛物线解析式和已知的...
点评:
本题考点: 抛物线的标准方程.
考点点评: 此题考查学生会求动点的轨迹方程,掌握一元二次方程有两个不相等的实数根的条件为△>0,是一道综合题.学生做题容易忽视△>0这个条件.1年前查看全部
- (2007•青浦区二模)已知关于x的方程x2+2mx+m2-m-1=0没有实数根,求m的取值范围.
 伤心的宠儿1年前1
伤心的宠儿1年前1 -
 西风学 共回答了27个问题
西风学 共回答了27个问题 |采纳率88.9%解题思路:根据△的意义得到△<0,即(2m)2-4(m2-m-1)<0,然后解不等式即可.∵方程x2+2mx+m2-m-1=0没有实数根,
∴△<0,即(2m)2-4(m2-m-1)<0,
解得m<-1.
∴m的取值范围是m<-1.点评:
本题考点: 根的判别式.
考点点评: 本题考查了一元二次方程ax2+bx+c=0(a≠0)的根的判别式△=b2-4ac:当△>0,方程有两个不相等的实数根;当△=0,方程有两个相等的实数根;当△<0,方程没有实数根.也考查了不等式的解法.1年前查看全部
- (2012•青浦区二模)取KClO3和MnO2的混合物16.60g加热至恒重,将反应后的固体加15g水充分溶解,剩余固体
(2012•青浦区二模)取KClO3和MnO2的混合物16.60g加热至恒重,将反应后的固体加15g水充分溶解,剩余固体6.55g (25℃),再加5g水充分溶解,仍剩余固体4.80g(25℃).
(1)若剩余的4.80g固体全是MnO2,则原混合物中KClO3的质量为______g(保留2位小数).
(2)若剩余的4.80g固体是MnO2和KC1的混合物,则25℃时KC1的溶解度为______.
原混合物中KClO3的质量为______g;所得KC1溶液的密度为l.72g/cm3,则溶液物质的量浓度为______mol/L(保留2位小数). 78nba1年前1
78nba1年前1 -
 budew 共回答了17个问题
budew 共回答了17个问题 |采纳率94.1%解题思路:(1)若剩余的4.80g固体全是MnO2,则原混合物的质量减去二氧化锰的质量为氯酸钾的质量;
(2)若剩余的4.80g固体是MnO2和KC1的混合物,则5g水溶解的氯化钾为6.55g-4.8g=1.75g,据此解答氯化钾的溶解度;
根据5g水溶解的氯化钾计算15g水溶解KCl的质量,进而计算混合物加热后剩余固体的质量,利用差量法计算生成的氧气的质量,根据方程式计算原混合物混合物中KClO3的质量;
所得的KCl溶液为饱和溶液,根据溶解度计算KCl的质量分数,利用c=[1000ρω/M]计算氯化钾溶液的物质的量浓度.(1)若剩余的4.80g固体全是MnO2,则原混合物中KClO3的质量为16.60g-4.80g=11.80g,
故答案为:11.80;
(2)若剩余的4.80g固体是MnO2和KC1的混合物,则5g水溶解的氯化钾为6.55g-4.8g=1.75g,故氯化钾的溶解度为1.75g×[100g/5g]=35g;
15g水溶解KCl的质量为1.75g×[15g/3g]=5.25g,混合物加热后剩余固体的质量为6.55g+5.25g=11.8g,加热固体生成的氧气质量为16.6g-11.8g=4.8g,则:
2KClO3
MnO2
.
△2KCl+3O2↑
245g 96g
m(KClO3) 4.8g
所以m(KClO3)=[245g×4.8g/96g]=12.25g,
所得的KCl溶液为饱和溶液,KCl的质量分数为[35g/100g+35g]=[35/135],KC1溶液的密度为l.72g/cm3,则氯化钾溶液的物质的量浓度为
1000×1.72×
35
135
74.5mol/L=5.99mol/L,
故答案为:35g;12.25;5.99.点评:
本题考点: 物质的量浓度的相关计算;溶解度、饱和溶液的概念;有关混合物反应的计算.
考点点评: 本题考查物质的量浓度、溶解度有关计算,难度中等,(2)中计算溶解度是解题的关键,注意掌握物质的量浓度与质量分数的关系.1年前查看全部
- (2010•青浦区二模)“海宝”是2010年世博会的吉祥物,其形象如图所示.在点缀上海街头的各种“海宝”中,有一座“海宝
 (2010•青浦区二模)“海宝”是2010年世博会的吉祥物,其形象如图所示.在点缀上海街头的各种“海宝”中,有一座“海宝”(材质均匀、实心)的质量为4.5×103千克,体积为3米3,与水平地面的接触面积为1.5米2,求其
(2010•青浦区二模)“海宝”是2010年世博会的吉祥物,其形象如图所示.在点缀上海街头的各种“海宝”中,有一座“海宝”(材质均匀、实心)的质量为4.5×103千克,体积为3米3,与水平地面的接触面积为1.5米2,求其
(1)密度ρ.
(2)重力大小G.
(3)对地面的压强p. 黑白射手1年前1
黑白射手1年前1 -
 小丸子平平 共回答了15个问题
小丸子平平 共回答了15个问题 |采纳率93.3%解题思路:(1)计算密度可直接根据密度公式ρ=[m/V]进行计算.
(2)根据公式G=mg可求重力.
(3)由题意可知,此时海宝对水平地面的压力即为其自身重力,然后根据压强公式P=[F/S],即可求出其对地面的压强.(1)ρ=[m/V]=
4.5×103千克
3米3=1.5×103千克/米3.
答:海宝的密度是1.5×103千克/米3.
(2)海宝的重力G=mg=4.5×103千克×9.8牛/千克=4.41×104牛.
答:海宝的重力为4.41×104牛.
(3)由于海宝放在水平地面,它对地面的压力F=G=4.41×104牛,
p=[F/S]=
4.41×104牛
1.5米2=2.94×104帕.
答:海宝对对地面的压强p为2.94×104帕.点评:
本题考点: 密度的计算;重力的计算;压强的大小及其计算.
考点点评: 此题涉及到的知识点较多,但是难度并不大,主要是压强,重力,密度等公式的灵活运用,通过此类题目的练习,进一步强化了基础知识.1年前查看全部
- (2012•青浦区二模)化学就在我们身边,他与我们的生活息息相关.请从石灰石、氦气、氧气、食盐、活性炭、甲烷、二氧化碳、
(2012•青浦区二模)化学就在我们身边,他与我们的生活息息相关.请从石灰石、氦气、氧气、食盐、活性炭、甲烷、二氧化碳、硝酸铵等物质中选出与下列用途相对应的物质,填写在空白处:
①可作家庭燃料的是______:
②可用作冰箱除味剂的是______;
③可充入霓虹灯内且通电时会发出有色光的气体是______;
④绿色植物进行光合作用吸收的是______;
⑤可用作建筑材料的是______. gzf-1681年前1
gzf-1681年前1 -
 san580091 共回答了15个问题
san580091 共回答了15个问题 |采纳率93.3%解题思路:甲烷是天然气的主要成分,可做燃料;
活性炭具有吸附作用,能够吸附色素和异味;
稀有气体通电时能够发出有颜色的光;
绿色植物进行光合作用吸收的是二氧化碳;
石灰石的成分为碳酸钙,常用于建筑材料,(4)天然气的主要成分是甲烷,可做燃料;故填:甲烷.
(5)可用作冰箱除味剂的是活性炭;故填:活性炭.
(6)可充入霓虹灯内且通电时会发出有色光的气体是氦气;故填:氦气.
(7)绿色植物进行光合作用吸收的是二氧化碳.故填:二氧化碳.
(8)石灰石的成分为碳酸钙,常用于建筑材料,故填:石灰石.点评:
本题考点: 常用燃料的使用与其对环境的影响;常见气体的用途;碳酸钠、碳酸氢钠与碳酸钙;碳单质的物理性质及用途;光合作用与呼吸作用.
考点点评: 物质的性质决定物质的用途,解答本题要掌握各种物质的性质,只有这样才能确定物质的用途.1年前查看全部
- (2011•青浦区一模)二氧化碳已逐渐成为一种备受关注的物质.
(2011•青浦区一模)二氧化碳已逐渐成为一种备受关注的物质.
(1)下图所示的三个实验中,实验1说明二氧化碳具有的性质是______;实验2瓶中发生反应的化学方程式为______;实验3中观察到的现象是______,大理石与稀盐酸反应的化学方程式为______.
(2)比较归纳是化学学习常用的一种方法.对三种物质的转化关系:C→CO2;CH4→CO2;CO→CO2,通过比较归纳,下列说法正确的是______(填数字序号).
①三种转化关系中发生的反应都属于化合反应
②三种转化关系中C、CH4、CO都能在点燃条件下转化为二氧化碳
(3)为解决温室效应加剧问题,科学家正在研究如下图所示的二氧化碳新的循环体系(部分生成物已略去).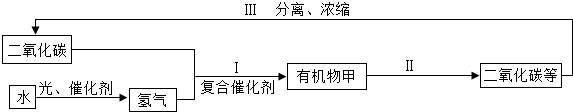
从图中分析得出的下列结论中,正确的是______(填数字序号).
①有机物甲可能含碳、氢、氧三种元素
②Ⅰ、Ⅱ、Ⅲ中都消耗了二氧化碳. 忘记等于想起1年前1
忘记等于想起1年前1 -
 天上天下1982 共回答了14个问题
天上天下1982 共回答了14个问题 |采纳率100%解题思路:(1)二氧化碳密度比空气大,不燃烧也不支持燃烧;与水反应生成碳酸;能与澄清的石灰水反应,使之变浑浊;常用大理石能与稀盐酸反应制取二氧化碳;
(2)①C→CO2,C在氧气中燃烧或与金属氧化物发生氧化还原反应都可转化为二氧化碳;
②CH4→CO2,CH4甲烷燃烧生成二氧化碳和水,水在常温下为液体;
③CO→CO2,CO在氧气中燃烧或与金属氧化物发生氧化还原反应都可转化为二氧化碳;
(3)理清图示中的各物质之间的转化关系,分析其中的变化过程.上图中的关键步骤是以水通电分解得到的氢气和二氧化碳为原料在复合催化剂的作用下转化为有机物甲.(1)实验1,把二氧化碳气体慢慢倒入放有燃着的蜡烛的烧杯中,下层蜡烛先灭,说明二氧化碳的密度比空气大、不燃烧和不支持燃烧的性质;
实验2,二氧化碳能与水反应生成碳酸,该反应的化学方程式为:H2CO3=H2O+CO2↑;
实验3,大理石能与稀盐酸反应生成二氧化碳,其反应方程式为:CaCO3+2HCl═CaCl2 +CO2↑+H2O,二氧化碳能与澄清的石灰水反应,使之变浑浊,故反应现象为:固体逐渐减少,有无色气泡产生,澄清石灰水变浑浊;
(2)C与CO都可以通过化合反应转化为二氧化碳,而CH4气体在氧气中燃烧生成两种物质二氧化碳和水不属于化合反应;故①不正确;三种物质C、CO、CH4都具有可燃性,点燃时燃烧都能生成二氧化碳,故②正确;
(3)①二氧化碳、氢气在复合催化剂作用下制取有机物甲,二氧化碳、氢气含有碳、氢、氧三种元素,根据质量守恒定律,有机物甲中可能含有碳、氢、氧三种元素;②Ⅰ、Ⅱ、Ⅲ中只有Ⅰ消耗了二氧化碳,故①正确;
故答案为:
(1)不燃烧也不支持燃烧,密度比空气大;CO2+H2O=H2CO3;固体逐渐减少,有无色气泡产生,澄清石灰水变浑浊;
CaCO3+2HCl═CaCl2 +CO2↑+H2O;
(2)②;
(3)①.点评:
本题考点: 探究二氧化碳的性质;自然界中的碳循环.
考点点评: 此题考查知识点的方式比较灵活,但并不是难题,同学们只要掌握二氧化碳的物理、化学性质以及与二氧化碳相关的问题就可以顺利完成该题,解题的关键是理清其中的转化关系.1年前查看全部
- (2013•青浦区一模)若圆柱的侧面展开图是一个正方形,则它的母线长和底面半径的比值是______.
 星光的翅膀1年前1
星光的翅膀1年前1 -
 事逝随风 共回答了20个问题
事逝随风 共回答了20个问题 |采纳率100%解题思路:圆柱的侧面展开为正方形,说明它的高与底面周长相等,则高为2πr,然后计算则它的母线长和底面半径的比值即可.因为圆柱的侧面展开为正方形,所以圆柱的高等于底面周长=2πr,
则它的母线长和底面半径的比值是2πr:r,化简为2π.
故答案为:2π.点评:
本题考点: 旋转体(圆柱、圆锥、圆台).
考点点评: 此题考查圆柱的侧面积,关键明白侧面展开为正方形的圆柱,它的高与底面周长相等.1年前查看全部
- (2012•青浦区二模)以下结构式错误的是( )
(2012•青浦区二模)以下结构式错误的是( )
A.H-C≡N
B.H-I-O
C.O=C=O
D.H-S-H wdktc1年前1
wdktc1年前1 -
 长假结束 共回答了17个问题
长假结束 共回答了17个问题 |采纳率94.1%A.H原子需要成1对共用电子对,满足稳定结构,C原子最外层有4个电子,应成4对共用电子对,N原子最外层有5个电子,应成3对共用电子对,结构式H-C≡N符合,故A正确;
B.H原子需要成1对共用电子对,满足稳定结构,I原子最外层有7个电子,应成1对共用电子对,O原子最外层有6个电子,应成2对共用电子对,故次碘酸的结构式为H-O-I,故B错误;
C.C原子最外层有4个电子,应成4对共用电子对,O原子最外层有6个电子,应成2对共用电子对,故二氧化碳分子中C原子与氧原子之间形成2对共用电子对,故C正确;
D.H原子需要成1对共用电子对,满足稳定结构,S原子最外层有6个电子,应成2对共用电子对,故硫化氢结构式为H-S-H,故D正确;
故选B.1年前查看全部
- (2013•青浦区二模)有关水分子变化的叙述正确的是( )
(2013•青浦区二模)有关水分子变化的叙述正确的是( )
A.冰,水为之而寒于水,说明水和冰是两种物质
B.电解水生成氢气与氧气,说明水分子可以再分解
C.水可以结成冰,说明水分子的化学性质发生改变
D.发生化学反应时,构成水分子的原子种类发生改变 冰豆浆1年前1
冰豆浆1年前1 -
 君子和而不同 共回答了22个问题
君子和而不同 共回答了22个问题 |采纳率90.9%解题思路:A、根据冰和水的组成考虑;B、根据电解水过程考虑;C、根据水结成冰属于物理变化考虑;D、根据在化学变化中原子的变化考虑.A、冰是水的固态,所以冰和水都是由水组成,属于同一种物质,故A错;
B、电解水时水分子分解成氢原子和氧原子,氢原子再结合成氢分子,氧原子结合成氧分子,所以电解水生成氢气与氧气,说明水分子可以再分解,故B正确;
C、水结成冰由液态变为固态,只是状态发生了变化,没有新物质生成,属于物理变化,水分子化学性质不变,故C错;
D、在化学变化中分子分成原子,原子再重新组合成新的分子,所以原子是化学变化中的最小粒子,所以发生化学反应时,构成水分子的原子种类没有改变,故D错.
故选B.点评:
本题考点: 分子的定义与分子的特性.
考点点评: 解答本题关键是要知道在化学变化中分子分成原子,原子再重新组合成新的分子,反应前后原子种类和数目不变.1年前查看全部
- (2012•青浦区二模)以下不符合工业生产事实的是( )
(2012•青浦区二模)以下不符合工业生产事实的是( )
A.金属铝:冶铁时作还原剂
B.生石灰:炼钢时作造渣材料
C.氨水:制硫酸时吸收尾气中SO2
D.铂铑合金:制硝酸时作催化剂 210411681年前1
210411681年前1 -
 轻烟喵喵 共回答了20个问题
轻烟喵喵 共回答了20个问题 |采纳率85%解题思路:A、冶炼铁通常利用比较便宜的CO作还原剂;
B、生石灰与二氧化硅反应生成硅酸钙,生成炉渣;
C、用氨水吸收尾气中的SO2,当吸收液中NH4HSO3达到一定浓度后,再与硫酸反应,放出的SO2可用作化工原料,循环利用,生成的硫酸铵可用作肥料;
D、氨的催化氧化利用铂铑合金作催化剂.A、冶炼铁通常利用比较便宜的C、CO作还原剂,故A不符合;
B、生石灰与二氧化硅反应生成硅酸钙,生成炉渣,故B符合;
C、工业上制取硫酸时排放的尾气中的SO2常采用氨吸收法,即先用氨水吸收尾气中的SO2,当吸收液中NH4HSO3达到一定浓度后,再与硫酸反应,放出的SO2可用作化工原料,循环利用,生成的硫酸铵可用作肥料,故C符合;
D、氨在铂铑合金作催化剂、加热条件下生成NO,NO氧化生成二氧化氮,二氧化氮与水反应可得硝酸,故D符合.
故选A.点评:
本题考点: 铝的化学性质;工业制取硫酸;工业制取硝酸.
考点点评: 本题考查学生对化学工业的掌握,比较基础,旨在考查学生对化学工业工业流程的理解掌握,以考查学生的识记为为主.1年前查看全部
- (2013•青浦区一模)如图所示,AB为竖直固定金属棒,金属杆BC重为G.长为L,并可绕过B点垂直纸面的水平轴无摩擦转动
 qinysoft1年前1
qinysoft1年前1 -
 mimi0000 共回答了18个问题
mimi0000 共回答了18个问题 |采纳率83.3%解题思路:由题,磁感应强度与时间成正比:B=kt,穿过ABC回路的磁通量均匀增大,产生恒定的电流,根据法拉第电磁感应定律求出感应电动势,由欧姆定律求出感应电流.由楞次定律判断感应电流的方向,由左手定则判断BC所受的安培力方向,当金属线AC中拉力恰为零,BC的力矩平衡,以B转轴,由力矩平衡条件求出安培力,得到B,即可求出t.由题,磁感应强度与时间成正比:B=kt,则
△B/△t]=k,根据法拉第电磁感应定律得感应电动势为:E=[△B/△t]•[1/2]BC•BCcos∠ABC•sin∠ABC=k[1/2]L•L•[4/5]•
3
5=0.24kL2
I=[E/R=
0.24kL2
R].
当金属线AC中拉力恰为零,BC的力矩平衡,以B转轴,由力矩平衡条件得:
G•[1/2]BC•sin∠ABC=F•[1/2]BC
解得安培力:F=[3/5]G
又F=BIL,B=kt,
联立解得:t=[5GR
2k2L3
故答案为:
0.24kL2/R],
5GR
2k2L3点评:
本题考点: 导体切割磁感线时的感应电动势;力的合成与分解的运用;安培力.
考点点评: 本题是难点之一是根据法拉第电磁感应定律求解感应电动势,二是运用力矩平衡求解安培力.1年前查看全部
- (2008•青浦区二模)检验马铃薯中含有淀粉所用的试剂是______
(2008•青浦区二模)检验马铃薯中含有淀粉所用的试剂是______
A、石蕊试液 B、碳酸试液 C、硝酸银溶液 D、碘水. yato91年前1
yato91年前1 -
 猫哥2006 共回答了13个问题
猫哥2006 共回答了13个问题 |采纳率100%解题思路:淀粉遇碘会变蓝色利用这一现象对淀粉进行检验.淀粉属含碳化合物,淀粉遇碘变蓝色是检验淀粉的常用方法,所以检验马铃薯中含有淀粉所用的试剂是碘水.
故答案为:D.点评:
本题考点: 鉴别淀粉、葡萄糖的方法与蛋白质的性质.
考点点评: 此题是对常见有机物淀粉进行的考查,主要是对淀粉的类别及检验进行的训练.1年前查看全部
- (2009•青浦区二模)如图所示,闭合电键S,灯L亮,一段时间后灯L熄灭.若电路中只有一处故障,且只发生在灯L或电阻R上
 (2009•青浦区二模)如图所示,闭合电键S,灯L亮,一段时间后灯L熄灭.若电路中只有一处故障,且只发生在灯L或电阻R上.正确的判断是( )
(2009•青浦区二模)如图所示,闭合电键S,灯L亮,一段时间后灯L熄灭.若电路中只有一处故障,且只发生在灯L或电阻R上.正确的判断是( )
A.灯L一定断路
B.电阻R一定断路
C.电流表示数为0时,电阻R一定断路
D.电压表示数为0时,灯L一定断路 亚丫TWO1年前1
亚丫TWO1年前1 -
 ldr13 共回答了21个问题
ldr13 共回答了21个问题 |采纳率90.5%读图可知,这是一个由灯泡和电阻R组成的串联电路,电压表测R两端的电压,电流表测串联电路中的电流.
A、B、灯断路可造成灯泡不亮,但电阻R断路同样可造成灯不亮,二者皆有可能,故不合题意;
C、电流表示数为零时,说明灯与电阻都没有电流流过,因此都存在断路的可能性,故不合题意;
D、灯断路时,整个电路不通,所以电压表示数一定为0;如果是R断路,电压表将与灯串联,此时,电压表接近电源电压,所以不会是R断路,故符合题意.
故选D.1年前查看全部
- (2011•青浦区二模)在图所示的电路中,电源电压保持不变.闭合电键S,电路正常工作,一段时间后,灯熄灭,且只有一只电表
 (2011•青浦区二模)在图所示的电路中,电源电压保持不变.闭合电键S,电路正常工作,一段时间后,灯熄灭,且只有一只电表的示数变大.若电路中只发生一处故障,且只发生在灯L或电阻R上,将两个用电器位置对换后,下列判断正确的是( )
(2011•青浦区二模)在图所示的电路中,电源电压保持不变.闭合电键S,电路正常工作,一段时间后,灯熄灭,且只有一只电表的示数变大.若电路中只发生一处故障,且只发生在灯L或电阻R上,将两个用电器位置对换后,下列判断正确的是( )
A.两电表的指针均无偏转,则L短路
B.两电表的指针均无偏转,则R短路
C.两电表的指针均发生偏转,则L短路
D.两电表的指针均发生偏转,则R短路 lzp_2111年前1
lzp_2111年前1 -
 小泳 共回答了17个问题
小泳 共回答了17个问题 |采纳率82.4%解题思路:判断电路故障问题,是中考题中常见的题型,在不能直接确定故障原因时,可以采用数学上的“反证法”,将选项逐一代入题干,检查是否符合题意.A 如果L短路,电压表和电流表示数都增大.此选项不符合题意;
B 如果R短路,灯泡会发光,电压表和电流表示数都增大.此选项不符合题意;
C 如果L短路,电压表相当于与导线并联示数减小,电路电阻减小电流表示数增大.此选项符合题意;
D 如果R短路,灯泡会发光,此选项不符合题意.
故选C点评:
本题考点: 电流表、电压表在判断电路故障中的应用.
考点点评: 电路故障问题是中考物理考查的热点,也是难点,一般题目设计的都是一处故障,原因只有两个:短路或开路.1年前查看全部
- (2010•青浦区二模)如图,要做一个圆锥形帐篷(不包括底面),底面直径6米,高4米,那么至少需要15π15π平方米的帆
 (2010•青浦区二模)如图,要做一个圆锥形帐篷(不包括底面),底面直径6米,高4米,那么至少需要15π15π平方米的帆布.
(2010•青浦区二模)如图,要做一个圆锥形帐篷(不包括底面),底面直径6米,高4米,那么至少需要15π15π平方米的帆布.  贾贾贾1年前1
贾贾贾1年前1 -
 翟泳 共回答了10个问题
翟泳 共回答了10个问题 |采纳率80%解题思路:要做一个圆锥形帐篷(不包括底面),先求母线长,再求出侧面积即可.由题意可知,圆锥的母线长为:5,圆锥的侧面积是
1
2×6π×5=15π
故答案为:15π点评:
本题考点: 旋转体(圆柱、圆锥、圆台).
考点点评: 本题考查圆锥的侧面积,是基础题.1年前查看全部
- (2005•青浦区)如图是某同学设计的两个实验室制取氢气的装置.
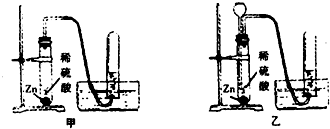 (2005•青浦区)如图是某同学设计的两个实验室制取氢气的装置.
(2005•青浦区)如图是某同学设计的两个实验室制取氢气的装置.
(1)与甲装置比较,乙装置的优点是______
(2)用上述装置和药品制取氢气,发生反应的化学方程式为______,若收集收氢气不纯,可能的原因是______(填序号).
A.导管口一有气泡就马上收集
B.装置漏气
C.收集气体的试管未装满水.
(3)若将上述装置的收集方法改为______后,还可以用于实验室制取二氧化碳气体. lblblsjlsy1年前1
lblblsjlsy1年前1 -
 蓝天下的思念 共回答了17个问题
蓝天下的思念 共回答了17个问题 |采纳率100%解题思路:(1)乙装置中有长颈漏斗,可以随时补充酸溶液;
(2)根据实验室制取用稀硫酸和锌粒反应制取氢气进行解答;如果导管口一有气泡就马上收集、装置漏气、收集气体的试管内未装满水,这些都能导致制取的氢气中混有空气使收集收氢气不纯;
(3)根据二氧化碳的密度不空气大,用向上排空气法收集;(1)乙装置中有长颈漏斗,可以随时补充酸溶液;
(2)实验室制取用稀硫酸和锌粒反应制取氢气,制取氢体的方程式为:Zn+H2SO4=ZnSO4+H2↑; 导致氢气不纯的原因很多:①导管口一有气泡就马上收集;②装置漏气;③收集气体的试管内未装满水,这些都能导致制取的氢气中混有空气;
(3)二氧化碳的密度比空气的大,用向上排空气法收集.
故答案为:(1)随时补充酸溶液;
(2)Zn+H2SO4=ZnSO4+H2↑; ABC;
(3)向上排空气.点评:
本题考点: 氢气的制取和检验;书写化学方程式、文字表达式、电离方程式.
考点点评: 实验室制取氢气用到长颈漏斗,可以通过长颈漏斗随时补充酸液,明确导致氢气不纯的原因.1年前查看全部
- (2009•青浦区一模)抛物线y=−12x2+3与y轴的交点坐标是______.
 louyiesly1年前1
louyiesly1年前1 -
 民大耍酷男 共回答了12个问题
民大耍酷男 共回答了12个问题 |采纳率91.7%解题思路:抛物线与y轴相交,即是x=0,代入求y.∵抛物线y=−
1
2x2+3与y轴的相交,
∴x=0.
将x=0代入y=−
1
2x2+3中得:
y=3.
故抛物线y=−
1
2x2+3与y轴的交点坐标是(0,3).点评:
本题考点: 二次函数图象上点的坐标特征.
考点点评: 考查二次函数图象上点的坐标特征.1年前查看全部
- (2012•青浦区二模)己知:2Fe3++2I-→2Fe2++I2,I2+2S2O32-→2I-+S4O62一氯化铁是常
(2012•青浦区二模)己知:2Fe3++2I-→2Fe2++I2,I2+2S2O32-→2I-+S4O62一氯化铁是常见的水处理剂.某氯化铁( FeCl3-6H2O)样品含有少量FeCl2杂质.现要测定其中FeCl3•6H2O的质量分数,实验按以下步骤进行:

(1)取少量氯化铁样品滴入50mL沸水中,加热片刻,液体呈现红褐色,反应的离子方程式______
(2)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有______、______(填仪器名称).
(3)操作II必须用到的仪器是______(选填编号);
a.50mL烧杯b.10mL量筒c.20mL量筒d.25mL滴定管
指示剂是淀粉溶液,则达到滴定终点的现象是______.
(4)滴定时,消耗浓度为0.1000mol/L的标准Na2S2O3溶液18.17mL.该样品中FeCl3•6H2O的质量分数为______.
(5)要把样品氯化铁中的少量FeCl2杂质除去,可用的试剂是______ (选填编号).
a.铁粉b.氯水c.溴水d.双氧水
(6)如果采用以下步骤测定氯化铁样品中铁元素的含量,完成下列填空.
①称量样品②加水溶觯③加足量氨水,沉淀 ④过滤 ⑤灼烧 ⑥称量并进行恒重操作.
还缺少的一步操作是______;在过滤前,需要检验是否沉淀完全,其操作是______
判断是否恒重的标准是______. tianya04241年前1
tianya04241年前1 -
 一棵尘土 共回答了23个问题
一棵尘土 共回答了23个问题 |采纳率95.7%解题思路:(1)氯化铁饱和溶液滴入沸水中加热生成氢氧化铁胶体;
(2)根据配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶;
(3)依据流程中溶液体积的精确度可知,100.00mL的溶液需要精密量具量取;碘遇淀粉变蓝色,随标准Na2S2O3溶液滴入和碘单质反应,溶液蓝色变为无色且半分钟不褪色;
(4)依据反应的定量关系计算得到,注意溶液体积的变化;
(5)要把样品氯化铁中的少量FeCl2杂质除去,需要加入氧化剂氧化亚铁离子为铁离子,但加入的氧化剂不能引入新的杂质;
(6)依据实验操作过程分析沉淀需要过滤后洗涤除去表面的杂质,检验是否沉淀完全,可以在上层清液中加入氨水观察是否有沉淀生成;沉淀称量恒重的标准是两次称量质量相同或相差不超过0.001g.(1)取少量氯化铁样品滴入50mL沸水中,加热片刻,液体呈现红褐色,生成的是氢氧化铁胶体,反应的离子方程式为Fe3++3H2O⇌Fe(OH)3+3H+,
故答案为:Fe3++3H2O⇌Fe(OH)3+3H+;
(2)因配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶,
故答案为:100mL容量瓶;胶头滴管;
(3)100.00mL的溶液需要精密量具量取,烧杯是粗略量取,量筒只能精确到0.1mL,所以用滴定管精确到0.01mL,选用滴定管量取溶液100.00mL的溶液;碘遇淀粉变蓝色,随标准Na2S2O3溶液滴入和碘单质反应,溶液蓝色变化为无色且半分钟不褪色,说明达到反应终点;
故答案为:d;溶液蓝色变化为无色且半分钟不褪色;
(4)2Fe3++2I-→2Fe2++I2,I2+2S2O32-→2I-+S4O62-,2FeCl3-6H2O~2Fe3+~I2~2S2O32-;滴定时,10.00ml溶液中碘单质消耗浓度为0.1000mol/L的标准Na2S2O3溶液18.17mL,FeCl3-6H2O的物质的量=0.1000mol/L×0.01817L=0.001817mol,该样品中100.00mL溶液中所含FeCl3•6H2O的物质的量为0.01817mol,质量分数=[0.01817mol×270.5g/mol/5.0g]×100%=98.3%;
故答案为:98.3%;
(5)要把样品氯化铁中的少量FeCl2杂质除去,需要加入氧化剂氧化亚铁离子为铁离子,但加入的氧化剂不能引入新的杂质;
a.铁粉和铁离子反应,不能和 亚铁离子反应,故a不符合;
b.氯水可以氧化亚铁离子为铁离子,且不引入新的杂质,故b符合;
c.溴水能氧化亚铁离子,但引入了溴离子,故c不符合;
d.双氧水可以氧化亚铁离子为铁离子,过氧化氢被还原为水,不引入杂质,故d符合;
故选bd;
(6)实验操作过程分析沉淀需要过滤后洗涤除去表面的杂质,检验是否沉淀完全,可以在上层清液中加入氨水观察是否有沉淀生成;沉淀称量恒重的标准是两次称量质量相同或相差不超过0.001g,
故答案为:洗涤;沉淀静置在层清液中,加入氨水溶液观察有无沉淀生成,若无沉淀生成证明沉淀完全;两次称量的质量相等或相差不超过0.001g.点评:
本题考点: 探究物质的组成或测量物质的含量;铁的氧化物和氢氧化物;中和滴定.
考点点评: 本题考查了物质组成和性质的实验验证和实验探究方法,铁及其化合物性质的分析应用,物质除杂,滴定实验测定物质含量的计算应用判断,题目难度中等.1年前查看全部
大家在问
- 1麻烦快些!1、He made some toys ( ) his little son ( please)2、I don
- 2甲乙两地相距600km,则6小时后相遇,若乙先3小时后相遇,甲5小时后相遇,
- 3英语翻译Ave.Independencia No.56,Cerro,La Habana,Cuba
- 4新建铁路里程前面DK是什么意思?
- 5(2005•盐城模拟)如图所示,两根等长直木棍AB和CD相互平行,斜靠在竖直墙壁上固定不动,一根水泥圆筒从木棍的上部匀速
- 6瓷片电容耐压1.5uR,
- 7反比例函数问题,读不懂题HI我M是反比函数y=6/x上移动点,只在0-3范围移动,BM‖x轴,AC‖y轴,当S四边形OA
- 8在“汶川大地震”中,救援人员用雷达式、热红外等多种生命探测仪搜救被困的同胞,其中热红外生命探测仪是利用红外线工作的,在黑
- 9我绝不放弃你 的英文怎么说?
- 10(2013•辽宁一模)如图所示,物体A的质量为2m,物体B的质量为m,A与地面间的动摩擦因数为μ,B与地面间的摩擦不计,
- 11荷叶咏文章中把荷花比作什么
- 12直角坐标系xOy中,圆C分别过点A(-1,0),B(1,2)两点,且圆心在直线2x-y=2上
- 13读一读,填一填. 读一读,填一填. Jack:When is your birthday,Mary?Mary:It's
- 14人类发展过程中的永恒主题是什么
- 15如图所示,矩形纸片ABCD中,AB=3 BC=4,现将C与A重合,是制片折叠压平,折痕为EF,求重叠部分面积,

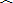

 (2013•青浦区一模)如图所示,AB为竖直固定金属棒,金属杆BC重为G.长为L,并可绕过B点垂直纸面的水平轴无摩擦转动,AC为轻质金属线,∠ABC=37°,∠ACB=90°,在图示范围内有一匀强磁场,其磁感应强度与时间成正比:B=k t,整个回路总电阻为R,则回路中感应电流I=
(2013•青浦区一模)如图所示,AB为竖直固定金属棒,金属杆BC重为G.长为L,并可绕过B点垂直纸面的水平轴无摩擦转动,AC为轻质金属线,∠ABC=37°,∠ACB=90°,在图示范围内有一匀强磁场,其磁感应强度与时间成正比:B=k t,整个回路总电阻为R,则回路中感应电流I=