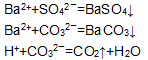有SO42-、CO32-、OH-、Cl-,如果只取一次该溶液,分别将四种离子鉴别出来,那么检验顺序是什么(原因
 zwleagle2022-10-04 11:39:541条回答
zwleagle2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 真诚的对话 共回答了17个问题
真诚的对话 共回答了17个问题 |采纳率94.1%- 先加入NH4NO3,鉴别出OH-(有刺激性气味气体产生);
再加入HNO3,鉴别出CO32-(有气泡产生);
再加入Ba(NO3)2,鉴别出SO42-(有白色沉淀);
最后加入AgNO3,鉴别出Cl-(有白色沉淀). - 1年前
相关推荐
- 离子反应习题1、某工厂排放的工业废水中可能含有K+、Ag+NH4+、Mg2+、SO42-、Cl-、NO3-、HCO3-等
离子反应习题
1、某工厂排放的工业废水中可能含有K+、Ag+NH4+、Mg2+、SO42-、Cl-、NO3-、HCO3-等离子.经检测废水呈明显的碱性,则可确定该厂废水中肯定不含有的离子组合是()
A.Ag+、K+、NO3-、HCO3-
B.K+、NH4+、NO3-、SO42-
C.Ag+、NH4+、Mg2+、HCO3-
D.K+、Mg2+、SO42-、Cl-
2、向含有下列离子的溶液中分别加入烧碱固体(溶液体积变化可忽略),能引起离子浓度减小的是()A、HCO3-B、Cl- C 、OH- D Cu2+ 30971421年前1
30971421年前1 -
 7155915 共回答了15个问题
7155915 共回答了15个问题 |采纳率100%C2..AD1年前查看全部
- 某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-.分别取样:①用pH计测试,溶液显弱酸性
某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-.分别取样:①用pH计测试,溶液显弱酸性
②加氯水和淀粉无明显现象.为确定该溶液的组成,还需检验的离子是( )
溶液显弱酸性,说明有NH4+(水解显酸性);加氯水和淀粉无明显现象排除I-、S2-.所以必需含有SO42-,故不能有Ba2+.Na+无法排除.
我想问那个显酸性可以是H2SO4吗 里面不是说有SO42-吗 zjuzxj1年前1
zjuzxj1年前1 -
 下午三点钟 共回答了16个问题
下午三点钟 共回答了16个问题 |采纳率93.8%不可以 因为硫酸是强酸,题目已经说了ph测试是显弱酸性1年前查看全部
- 一道关于离子的化学题某中性溶液中含有Na+、Zn2+、SO42-、Cl-四种离子.若Na+、Zn2+、Cl-的个数比为4
一道关于离子的化学题
某中性溶液中含有Na+、Zn2+、SO42-、Cl-四种离子.若Na+、Zn2+、Cl-的个数比为4:2:1,则Zn2+、SO42-的个数比为 lee58581年前2
lee58581年前2 -
 JenniferSu 共回答了20个问题
JenniferSu 共回答了20个问题 |采纳率90%因为是中性溶液,所以正负离子数要相等.
因为Na+加zn2+总数是8,所以cl-加SO42-的离子总数也要是8,即Na+ + zn2+ = CL-+SO42- .SO42- 带两个负离子,所以有 72个SO42-.所以答案是4:7.1年前查看全部
- 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.
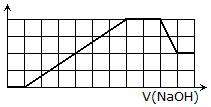
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如右所示,下列说法正确的是( )
A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B.原溶液中一定含有SO42-和Na+
C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D.反应最后形成的溶液中含有的溶质为Na2SO4
请把分析写上.我弄不明白的是为什么可溶性沉淀和不可溶性沉淀消耗的NaOH是一样多的,为什么不能存在Mg2+?那要是Al3+:Mg2+=2:3也不行么?怎么判断出来Fe3+和Al2+的物质的量之比是1:除此以外,溶液中应该是含有H+或者NH4+的吧?因为图像刚开始加入NaOH没有产生沉淀诶,可是我不知道到底是哪个……
 123zhengyi1年前4
123zhengyi1年前4 -
 hndanyan 共回答了22个问题
hndanyan 共回答了22个问题 |采纳率90.9%选C
根据图像,沉淀不是马上出现可知一定有离子与氢氧根反应不产生沉淀,有可能是铵根或氢离子,然后生成沉淀后溶解一定有铝离子,且沉淀不是马上溶解说明有离子与氢氧根反应不生成沉淀,这里可以确定前面是氢离子这里反应的是铵根离子.因为酸性条件氢氧根先发生中和,且氢离子大量存在情况下没有氢氧化铝生成的可能.根据坐标得生成沉淀用了6mol氢氧根其中有一半是氢氧化铝,另一半一定+3价.就是铁.溶液中需要正,负离子,故一定有阴离子,但不能确定到底是什么.1年前查看全部
- 加入氯水时,溶液略显黄色.对某酸性溶液(可能含有Br-,SO42-,SO32-,NA+)分别进行如下实验:1.加酸调制酸
加入氯水时,溶液略显黄色.
对某酸性溶液(可能含有Br-,SO42-,SO32-,NA+)分别进行如下实验:
1.加酸调制酸性,加热时放出的气体可以使品红溶液褪色
2.加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸
对于下列物质不能确认其在溶液中是否存在的是
A.NA+ B.SO42- C.BR- D.S032-
请问为什么? igtlgao1年前2
igtlgao1年前2 -
 绝望旧身影 共回答了27个问题
绝望旧身影 共回答了27个问题 |采纳率96.3%加酸调制酸性,加热时放出的气体可以使品红溶液褪色,说明含有SO3^2-,因为SO3^2-能与H+反应生成SO2使品红褪色;
而Cl2能将SO3^2-氧化为SO4^2-,因此溶液中原来即使无SO4^2-,由于Cl2的氧化能将SO3^2-转化为SO4^2-与Ba2+反应,也能生成BaSO4沉淀.
因此无法确定是否有SO4^2-1年前查看全部
- (江苏化学周练)在Al2(SO4)3、K2SO4和明矾的混和溶液中,如果c(SO42-)等于0.2mol/L,当加入等体
(江苏化学周练)在Al2(SO4)3、K2SO4和明矾的混和溶液中,如果c(SO42-)等于0.2mol/L,当加入等体积的0.2mol/L的KOH溶液时,生成的沉淀恰好溶解,则原和物中K+的物质的浓度为( )
A.0.2mol/L B.0.25mol/L C.0.45mol/L D.0.225mol/L 西部影视星空1年前3
西部影视星空1年前3 -
 y520988 共回答了20个问题
y520988 共回答了20个问题 |采纳率85%设原溶液为1L 加入1 LKOH后,所有的Al3+都转化为AlO2-反应时,4 mol的KOH与1 mol的Al3+反应掉所以原溶液中有0.05mol/L 的Al3+.原溶液中有0.2mol/LSO42-,根据正负电子平衡,有:3[Al3+]+[K+]=2[SO42-]k+的浓度为:(0.2×...1年前查看全部
- 高中化学,一道关于电解池的题2)如果粗盐中SO42-含量较高,必须添加试剂除去SO42-,则按添加试剂顺序,依次发生反应
高中化学,一道关于电解池的题
2)如果粗盐中SO42-含量较高,必须添加试剂除去SO42-,则按添加试剂顺序,依次发生反应的离子方程式为______________________________.
(3)在电解制得的NaOH中往往还含有一定量的NaCl,因此必需进行脱盐工序,脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过__________.冷却.__________(填写操作名称)除去NaCl.
(4)现有阳离子交换膜.阴离子交换膜.石墨电极和如下图所示电解槽,用氯碱工业中的离子交换膜技术原理,可通过电解电解饱和Na2SO4溶液的方法生产NaOH溶液和H2SO4溶液.则电极c为__________极(填“正”.“负”.“阴”.“阳”),b为__________离子交换膜(填“阴”.“阳”) 从第二题开始就不懂了,麻烦详细解释一下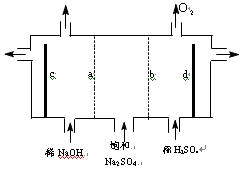
 fiercecobra1年前1
fiercecobra1年前1 -
 石头6482CDC 共回答了15个问题
石头6482CDC 共回答了15个问题 |采纳率86.7%1年前查看全部
- 某固体混合物含有NaCl、Na2SO4和NaNO3,某同学为将Cl-、SO42-、NO3
某固体混合物含有NaCl、Na2SO4和NaNO3,某同学为将Cl-、SO42-、NO3
-
相互分离开并测量三种盐的百分含量,实验时他首先称取10.0g固体溶于水配制成溶液,
然后按下图所示过程进行实验,请回答下列问题:
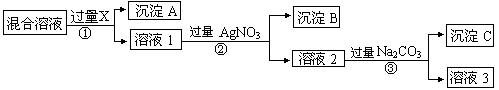
(1)试剂X化学式是:___________;加入过量Na2CO3的目的是___________________,溶液3中肯定含有___________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的______________________
(2)为确保得到的沉淀B中不含杂质,需要对沉淀进行洗涤,洗涤的方法是____________ _________________________,判断其已经洗涤干净的方法是___________________________ _____________________,若最终得到的干净沉淀物A、B的质量分别为4.66g、5.74g,则混合物中NaNO3的质量分数为______________,混合物中含有_______molNaCl
X是硝酸钡,A是硫酸钡,B是氯化银,C是碳酸钡和碳酸银
硫元素守恒:BaSO4~Na2SO4
233g 142g
4.66g 2.84g
氯元素守恒:AgCl~NaCl
143.5g 58.5g
5.74g 2.34g
那么硝酸钠的质量为10-2.84-2.34=4.82g
质量分数为4.82/10*100%=48.2%
n(NaCl)=0.04mol
溶液一中过量的BaCl2也会生成AgCl啊啊,为什么计算中不算呢? 颜夕雪1年前1
颜夕雪1年前1 -
 寂静后花园 共回答了10个问题
寂静后花园 共回答了10个问题 |采纳率90%过量的Ba(NO3)2,不是BaCl2.1年前查看全部
- 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如右所示,下列说法正确的是( )
A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B.原溶液中一定含有SO42-和Na+
C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D.反应最后形成的溶液中含有的溶质为Na2SO4
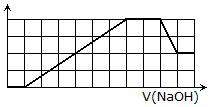
请详细解释一下为是么是铁 不是镁 若Mg:Al=3:、 acbdefg1年前1
acbdefg1年前1 -
 nbzxzzs 共回答了12个问题
nbzxzzs 共回答了12个问题 |采纳率100%因为由图线下降可知溶液中含有铝离子,氢氧化铝生成与溶解消耗氢氧根离子浓度比为3:1,生成这些沉淀消耗氢氧化钠为3格,由图中沉淀上升图线是一条直线可知溶液中的另外的离子生成沉淀时消耗氢氧根离子与铝离子相同,因此是正三价的铁离子.
望采纳.有什么不懂可追问.1年前查看全部
- 水质监测项目指标CN、As、Zn、Cr6+、Cd、Fe、Mn、F-、NO3-、SO42-、Cl-、Pb、Cu都指什么
 芸仔1年前1
芸仔1年前1 -
 cjj285 共回答了21个问题
cjj285 共回答了21个问题 |采纳率76.2%CN——氰化物
As——砷化物
Zn——锌含量
Cr6+——六价铬的含量(只有六价铬才有毒,三价铬无毒,所以只检测六价铬)
Cd——镉含量
Fe——铁含量
Mn——锰含量
F-——氟化物
NO3-——硝酸盐
SO42-——硫酸盐
Cl-——氯化物含量
Pb——铅含量
Cu——铜1年前查看全部
- 某地酸雨经检验除含H+外(OH-可忽略不计),还含有Na+、Cl-、NH4+、SO42-,其浓
 2007飞翔的鸽子1年前1
2007飞翔的鸽子1年前1 -
 月出惊山鸟 共回答了20个问题
月出惊山鸟 共回答了20个问题 |采纳率100%C(OH-)+C(Cl-)=C(NH4+)+2C(SO42+)
因为溶液用阳离子等于阴离子1年前查看全部
- 0.2 mol Al2(SO4)3中含有Al3+ mol、SO42- g,共含有 mol质子.
 houzi19761年前1
houzi19761年前1 -
 成不了往事 共回答了17个问题
成不了往事 共回答了17个问题 |采纳率88.2%0.2*2 0.2*3*96 0.2*2+(0.2+0.2*4)*31年前查看全部
- 超简单】在由水电离出的c(H+)=1×10-14mol?L-1的溶液中Cl-、SO42-、Na+、K+.
超简单】在由水电离出的c(H+)=1×10-14mol?L-1的溶液中Cl-、SO42-、Na+、K+.
【若在酸性条件下NO3-,形成HNO3氧化CL-这难道不对吗?】 不想留恋1年前1
不想留恋1年前1 -
 char_fen 共回答了21个问题
char_fen 共回答了21个问题 |采纳率71.4%在由水电离出的c(H+)=1×10-14mol/L 可能是酸性溶液也可能是碱性溶液.
HNO3不能氧化Cl-
所以这样的溶液一定共存1年前查看全部
- 某溶液中仅含有Na+、Mg2+、SO42-、Cl-四种离子(在线等解释……)
某溶液中仅含有Na+、Mg2+、SO42-、Cl-四种离子(在线等解释……)
某溶液中仅含有Na+、Mg2+、SO42-、Cl-四种离子, 其中Na+与Mg2+的个数比为4∶5, 则Cl-和SO42-的个数比为
①8∶3 ②3∶2 ③4∶1 ④1∶3
A.只有① B.只有①②④ C.只有②④ D.①②③④
貌似不选③,当Na+ 12个,Mg2+ 15个,Cl- 28个,SO42- 7个时不就行了……? 吃饱就是ff1年前2
吃饱就是ff1年前2 -
 wym_00001 共回答了17个问题
wym_00001 共回答了17个问题 |采纳率94.1%根据电荷守恒
c(Na+)+2c(Mg2+)=c(Cl-)+2c(SO42-)=4+10=14 把1234代入解,应该可以.1年前查看全部
- 用Na2CO3 BaCl2(Ba2+有毒)、盐酸三种药品除去食盐溶液中含有的CO32-和SO42-,得到纯净的NaCl溶
用Na2CO3 BaCl2(Ba2+有毒)、盐酸三种药品除去食盐溶液中含有的CO32-和SO42-,得到纯净的NaCl溶液,则加入药品的合理顺序为( )
(A)x05盐酸、BaCl2 Na2CO3
(B)x05BaCl2 盐酸、Na2CO3
(C)x05Na2CO3、盐酸、BaCl2
(D)x05BaCl2、Na2CO3、盐酸 袭峭1年前2
袭峭1年前2 -
 wahoogy 共回答了23个问题
wahoogy 共回答了23个问题 |采纳率87%选D,首先用BaCl2除去两种阴离子,此时BaCl2过量,再用Na2CO3除去BaCl2,最后用盐酸除去过量的Na2CO3,盐酸本身挥发掉,得到纯净的NaCl溶液.1年前查看全部
- 在硫酸铝、硫酸钾和明矾的混合溶液中,如果c(SO42-)=0.2mol/L,当加入等体积一定浓度的KOH溶液时,恰好使A
在硫酸铝、硫酸钾和明矾的混合溶液中,如果c(SO42-)=0.2mol/L,当加入等体积一定浓度的KOH溶液时,恰好使Al3+沉淀完全,则所得溶液中K+的物质的量浓度是( 0.2 )
注意:加入等体积一定浓度的KOH溶液时 浓度未知
THANK YOU 我行我宿哈1年前3
我行我宿哈1年前3 -
 lisa_duan826 共回答了21个问题
lisa_duan826 共回答了21个问题 |采纳率100%设原溶液的体积为VL,则加入氢氧化钾溶液的体积也为VL
根据题意可知:加入KOH恰好使溶液Al3+沉淀完全,则所得溶液中的溶质应为K2SO4
n(SO42-)=0.2mol/L*VL=0.2Vmol
所得溶液中c(SO42-)=0.2V/(V+V)=0.1mol/L
所得溶液中K+的物质的量浓度=2c(SO42-)=2*0.1mol/L=0.2mol/L1年前查看全部
- 某水样中要检验出H+ SO42- Cl- 离子
某水样中要检验出H+ SO42- Cl- 离子
丙同学认为以下做法能达到实验目的,但要控制试剂的用量:取少量溶液先滴加紫色石蕊试液,再加入氢氧化钡溶液,充分震荡后静置,取上层清液加入硝酸银.请说明丙同学如何控制试剂量 盡成﹌箜ɑ1年前1
盡成﹌箜ɑ1年前1 -
 zhankui85 共回答了19个问题
zhankui85 共回答了19个问题 |采纳率78.9%氢氧化钡适量,硝酸银过量1年前查看全部
- 今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据以上实验,回答下列问题
(1)一定不存在的离子是_____,不能确定是否存在的离子是____.
(2)试确定溶液中肯定存在的离子及其浓度(可不填满):
离子符号_______,浓度________;
离子符号_______,浓度________;
离子符号_______,浓度________.
(3)试确定K+是否存在______(填“是”或“否”),判断的理由是_____. 一定会801年前2
一定会801年前2 -
 yggdrasil 共回答了10个问题
yggdrasil 共回答了10个问题 |采纳率100%一定不存在的离子是NH4+ CO32-,SO42-,不确定Cl-
NH4+ 0.4molL-
SO42- 0.1molL-
SO32- 0.2molL-
是 溶液电中性,正负电荷守恒
第一份加入AgNO3有沉淀,可能含有Cl- SO42-.CO32-
第二份加足量NaOH有气体,一定含有NH4+,没有沉淀一定没有Mg2+.
第三份有沉淀后加酸沉淀部分溶解一定存在CO32-,SO42-,不存在Ba2+;
一定不存在的离子是NH4+ CO32-,SO42-,
1NH4+ -----1NH3 这样 氨气0.04mol,NH4+也0.04mol.
沉淀6.27g 其中有BaSO4的2.33克为0.01mol
有BaCO3为6.27-2.33=3.94g为0.02mol
因为溶液电中性,正负电荷守恒,
NH4+ 0.04mol+电荷 SO42- 0.02mol -电荷 SO32- 0.04mol -电荷
这样K+一定存在.1年前查看全部
- 01.某溶液中存在五种离子,其中 Cl-、SO42-、Fe3+、K+、R各离子的个数比为
01.某溶液中存在五种离子,其中 Cl-、SO42-、Fe3+、K+、R各离子的个数比为
2∶3∶1∶3∶1,则离子R为( )
A.-2价的碳酸根离子 B. Ba2+ C.Na+ D.Mg2+
02.在夏至这天,假设下列地区温度、光照强度相同且晴天,则同种植物制造有机物最多的地区是( )
A.哈尔滨 B.北京 C.上海 D.福州
03.吊在室内天花板上的电风扇,静止不动时对固定吊杆的拉力为T1,当电风扇在水
平面上匀速转动后,对固定吊杆的拉力为T2,那么这两种情况下的拉力大小相比较,
正确的是( )
A.T1>T2 B.T1=T2 C.T1 yanfan5251年前1
yanfan5251年前1 -
 hushjun 共回答了18个问题
hushjun 共回答了18个问题 |采纳率88.9%答案是DAAB
溶液中正负电荷应该相等,设各离子数是2a,3a,a,3a,a,R的化合价是M
所以2a*(-1)+3a*(-2)+a*(+3)+3a*(+1)+a*M=0解方程得M=+2.选项中有Ba2+,Mg2+,因为硫酸钡是沉淀,所以选D
因为有光照的时间白天温度和光照强度相同,所以白天制造的有机物相同,但晚上就不一样了,一下这四个城市,晚上温度:哈尔滨1年前查看全部
- 铅蓄电池正极反应PbO2 + 4H+ + SO42- + 2e -=== PbSO4 + 2H2O,左侧为什么4个h离子
铅蓄电池正极反应
PbO2 + 4H+ + SO42- + 2e -=== PbSO4 + 2H2O,左侧为什么4个h离子?这样如何写成方程式?(不是离子方程式) cormac1年前1
cormac1年前1 -
 哈儿和哈妹儿 共回答了13个问题
哈儿和哈妹儿 共回答了13个问题 |采纳率100%正极反应,是电化学方程的半反应,也就是,需要和负极反应的另一个半反应合起来,(消去电子相)写成了总的电池反应的离子方程式,才能改写成化学方程式.
离子方程式和化学式方程式之间的相互改写,没有电子,1年前查看全部
- 测得某溶液中仅含有Na+、Mg2+、SO42-、Cl-四种离子,其中Na+与Mg2+的个数比为4∶5,则Cl-和SO42
测得某溶液中仅含有Na+、Mg2+、SO42-、Cl-四种离子,其中Na+与Mg2+的个数比为4∶5,则Cl-和SO42-的个数比为
①8∶3 ②3∶2 ③4∶1 ④1∶3
A.只有① B.只有①②④ C.只有②④ D.①②③④ Doraemon1年前2
Doraemon1年前2 -
 leixf 共回答了19个问题
leixf 共回答了19个问题 |采纳率78.9%按照溶液整体是不带电荷的,也就是电荷中和,
Na+与Mg2+的个数比为4∶5,所以正电荷的个数为4x+10x=14x
所以对于Cl-和SO42-,可以分为2:6=1:3
或者4:5
或者6:4=3:2
或者8:3
或者10:2=5:1
可以明白这些组合,负电荷的总数也是14x
所以选B1年前查看全部
- 11、某溶液中只含有Na+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+
11、某溶液中只含有Na+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为
A.1∶2 B.1∶4 C.3∶4 D.3∶2
求过程. shonetang1年前3
shonetang1年前3 -
 OLD-BEE 共回答了23个问题
OLD-BEE 共回答了23个问题 |采纳率87%你都说电荷守恒,还做错了
是1:21年前查看全部
- 某 无色透明溶液与铝反应放出H2,该溶液中可能含有大量的H+、K+、Mg2+、Cl-、OH-、SO42-、CO32-,试
某 无色透明溶液与铝反应放出H2,该溶液中可能含有大量的H+、K+、Mg2+、Cl-、OH-、SO42-、CO32-,试推断:第一种情况,无色透明溶液中一定有________,可能有__________离子.第二种情况,无色透明溶液中一定有________,可能有__________离子.
OH-;K+、Cl-、SO42-、CO32-;H+;K+、Mg2+、Cl-、SO42-
第一种情况一定有OH-的时候可以存在的阳离子应该只有K+,为什么K+不是一定有呢
第二种情况一定有H+的时候可以存在的阴离子只有Cl-,为什么Cl-不是一定有呢 夏天下雨19821年前1
夏天下雨19821年前1 -
 汇熙 共回答了26个问题
汇熙 共回答了26个问题 |采纳率84.6%第一种的时候,阳离子只有K+.应该填在【一定有】那里,这个可能是出题人的原因.第二种情况:阴离子里除Cl-还有SO4 2-
很高兴为您解答满意请采纳(给好评)~~1年前查看全部
- 10.某溶液中含有大量的下列离子:Fe3+、SO42-、Al3+和M离子,且Fe3+、SO42-、Al3+和M离子的物质
10.某溶液中含有大量的下列离子:Fe3+、SO42-、Al3+和M离子,且Fe3+、SO42-、Al3+和M离子的物质的量之比为2∶4∶1∶1,则M离子可能是下列中的( )
A.Na+ B.I- C.S2- D.Cl-
为什么? 奥森1年前2
奥森1年前2 -
 经历过才会懂得 共回答了18个问题
经历过才会懂得 共回答了18个问题 |采纳率94.4%Fe3+、SO42-、Al3+和M离子的物质的量之比为2∶4∶1∶1,设M离子的带电量为x因为要总带电为0,所以
3*2+(-2)*4+3*1+x*1=0
x=-1
答案中BD都是,但因为Fe3+会把I-氧化成碘,两者不能共存于同一溶液
所以答案是D1年前查看全部
- 某无色溶液中可能含有Ca2+、Cl-、CO32-、SO42-、Na+、K+、MnO4-中的一种或几种,现做以下实验确定
某无色溶液中可能含有Ca2+、Cl-、CO32-、SO42-、Na+、K+、MnO4-中的一种或几种,现做以下实验确定
某无色溶液中可能含有Ca2+、Cl-、CO32-、SO42-、Na+、K+、MnO4-中的一种或几种,现做以下实验确定其组成:
(1)取少量溶液加入足量BaCl2溶液,产生大量白色沉淀,过滤。
(2)取上述白色沉淀加入足量稀HCl,沉淀部分溶解。
(3)取少量(1)中溶液加入AgNO3溶液和稀HNO3,产生白色沉淀不溶解。
(4)取原溶液做焰色反应,直接观察到火焰呈黄色。根据上面实验知原溶液中肯定有____________离子,肯定没有____________离子,可能有____________离子。 dxt1301年前2
dxt1301年前2 -
 sunflowercc 共回答了29个问题
sunflowercc 共回答了29个问题 |采纳率89.7%无色溶液,一定没有MnO4-
⑴判断一定有CO32-、SO42-中至少一种.一定没有Ca2+.
⑵判断一定有CO32-、SO42-
⑶一定有Cl-,但是原溶液中未必有Cl-(因为你加入了BaCl2)
⑷一定有Na+
因此,一定有:CO32-、SO42-、Na+
一定无:MnO4-、Ca2+
可能有:K+、Cl-1年前查看全部
- 某无色溶液中可能含有Ca2+、Cl-、CO32-、SO42-、Na+、K+、MnO4-中的一种或几种,现做以下实验确定其
某无色溶液中可能含有Ca2+、Cl-、CO32-、SO42-、Na+、K+、MnO4-中的一种或几种,现做以下实验确定其组成:
(1)取少量溶液加入足量BaCl2溶液,产生大量白色沉淀,过滤.
(2)取上述白色沉淀加入足量稀HCl,沉淀部分溶解.
(3)取少量(1)中溶液加入AgNO3溶液和稀HNO3,产生白色沉淀不溶解.
(4)取原溶液做焰色反应,直接观察到火焰呈黄色.根据上面实验知原溶液中肯定有____________离子,肯定没有____________离子,可能有____________离子. 我有几个朋友1年前1
我有几个朋友1年前1 -
 s123q 共回答了24个问题
s123q 共回答了24个问题 |采纳率87.5%原溶液中肯定有 Na+ SO42- CO32- Cl -
肯定没有 Ca2+ MnO4-
可能有 K+
溶液无色 说明一定没有MnO4-
1 溶液加入足量BaCl2溶液,产生大量白色沉淀,沉淀 可能是碳酸钡和硫酸钡
2 上述白色沉淀加入足量稀HCl,沉淀部分溶解说明必须有碳酸钡溶解了 部分二字就是说 没有溶解完 就是硫酸钡了 说明了必须含有 SO43- CO32- 因为Ca2+和碳酸根不能共存 所以绝对没有 钙离子
3 取少量(1)中溶液加入AgNO3溶液和稀HNO3说明必须有 氯离子Cl-
4)取原溶液做焰色反应,直接观察到火焰呈黄色 说明必须含有Na+
但是 Na K混合的时候 颜色反应表现出的显色 Na的黄色会压制K的紫色
同时含有钾元素和钠元素的话如果不透过蓝色钴玻璃看到的是黄色,透过蓝色钴玻璃看到的是紫色,因为不透过钴玻璃的话黄色会将紫色掩盖,而蓝色钴玻璃可以将黄色虑去却不能将紫色过滤,故而会看到紫色
所以可能含有的是K+1年前查看全部
- 某溶液中含有CH3COO-、SO42-、SO32-、HCO3-、CO32-等五种离子.将过量的Na2O2固体加入其中后,
某溶液中含有CH3COO-、SO42-、SO32-、HCO3-、CO32-等五种离子.将过量的Na2O2固体加入其中后,仍能大量存在的离子是
A.CH3COO-、SO42-、HCO3- B.SO42-、SO32-、CO32-
C.SO32-、HCO3-、SO42- D.CH3COO-、SO42-、CO32-
SO32-能和氢氧化钠反应吗?为什么? 小甜心-5201年前2
小甜心-5201年前2 -
 tt暮色深 共回答了16个问题
tt暮色深 共回答了16个问题 |采纳率100%Na2O2和水反应生成NaOH和氧气
HCO3-会与OH-反应,所以不存在
SO32-具有还原性,易被O2氧化,所以不存在
其它不变.所以选D1年前查看全部
- 某溶液中加入铝粉有氢气产生,该溶液中一定可以大量共存的离子组是( )A.Na+、NO3-、Cl-、SO42- B.Na+
某溶液中加入铝粉有氢气产生,该溶液中一定可以大量共存的离子组是( )A.Na+、NO3-、Cl-、SO42- B.Na+、K+、Ba2+、HCO3-C.Fe3+、H+、SO42-、Cl- D.Na+、K+、Cl-、SO42-
 石器知心1年前3
石器知心1年前3 -
 鼠宝宝3 共回答了22个问题
鼠宝宝3 共回答了22个问题 |采纳率90.9%某溶液中加入铝粉有氢气产生
有两种情况:强酸或者强碱
一定可以大量共存的离子组是,即不与强酸反应也不可以与强碱反应的
A.Na+、NO3-、Cl-、SO42-
不可以,有硝酸不可以产生氢气
B.Na+、K+、Ba2+、HCO3-
HCO3-酸碱性皆不可以存在
C.Fe3+、H+、SO42-、Cl-
Fe3+.碱性不存在
D.Na+、K+、Cl-、SO42-
可以1年前查看全部
- 对某酸性溶液(可能含有Br-,SO42-,H2SO3,NA+)分别进行如下实验:
对某酸性溶液(可能含有Br-,SO42-,H2SO3,NA+)分别进行如下实验:
③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸.对于下列物质不能确认其在溶液中是否存在的是 A. Br- B. SO42- C. H2SO3 D. NH4+.答案是B.不明白AB.为什么可以说明有B而没有A?我觉得氯水本来就是黄绿色的,加入之后本来就会有一点黄色?那就两个都不能检验了? happy若兰1年前2
happy若兰1年前2 -
 wshly1999 共回答了19个问题
wshly1999 共回答了19个问题 |采纳率94.7%这道题不是问不能确认的是哪种离子嘛,所以说选择B,因为如果溶液中含有H2SO3,在加入氯水后即使没有SO42-,再然后在加入BaCl2溶液时,也会产生的白色沉淀且不溶于稀硝酸.1年前查看全部
- 今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:AC
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,以下推测正确的是
A K+一定存在 B 100mL溶液中含0.01mol CO32-
C Cl-可能存在 D Ba2+一定不存在,Mg2+可能存在 llsldqr1年前1
llsldqr1年前1 -
 yuanshuzhang 共回答了16个问题
yuanshuzhang 共回答了16个问题 |采纳率93.8%第一步,加入银离子 说明可能有氯离子,硫酸根,碳酸根.第二步,加入碱,说明含有NH4+,且浓度为0.4mol/L.第三步,可能产生硫酸镁,碳酸镁,硫酸钡,碳酸钡.根据产生质量和盐酸洗涤后剩余质量,可知不含Mg2+.一定含有SO42-,CO32-.且CO32-浓度为0.2mol/L.SO42-为0.1mol/L .由上可知, 必含硫酸根,碳酸根,氨离子.必不含镁离子,钡离子(因为必有硫酸根,碳酸根).根据电荷守恒,必含K+.Cl-无法确定.1年前查看全部
- 加入铝单质能产生大量氢气的溶液:Na+、NO3—、SO42-、Cl- 为什么不能共存
 香如数11年前3
香如数11年前3 -
 superstar2001 共回答了19个问题
superstar2001 共回答了19个问题 |采纳率89.5%题目本身错误
加入铝单质能产生大量氢气的溶液,要么是酸性,要么是强碱性(因为铝是两性金属)
在酸性或强碱性条件下,Na+、NO3—、SO42-、Cl- 都能共存,没问题
如帮到了你,
【你的10分满意,我们团队的无限动力】1年前查看全部
- 经测定某溶液中含有大量Cu2+、SO42-、Cl-、6X(离子)四种离子,其中Cu2+、Cl-的个数比为1:1,则X可能
经测定某溶液中含有大量Cu2+、SO42-、Cl-、6X(离子)四种离子,其中Cu2+、Cl-的个数比为1:1,则X可能
A、Na2+ B、OH- C、NO3- D、Zn2+ 种子丛林1年前3
种子丛林1年前3 -
 caizhizhi123 共回答了19个问题
caizhizhi123 共回答了19个问题 |采纳率89.5%是Na+吧
选AC
你可以先假设Cu2+与Cl—均为1mol,把Cu2+与Cl—的电性中和,剩下1mol正电,这时硫酸根的量决定了剩下的离子
当硫酸根过量时,因为Cu2+与Cl—的个数为1:1,说明2价阳离子与一价阴离子为1:1,那么剩下的就是2价阴离子与一价阳离子1:1,剩下是为2价SO42—、所以另外一个为Na+ 而不是Zn2+
当硫酸根不足时,溶液呈正电,需要加入阴离子,但OH-加入后会产生沉淀(Cu2+ +2OH-==Cu(OH)2↓),与题意不符,故应为硝酸根1年前查看全部
大家在问
- 1一、填空:书架上第一层书的本数是第二层、第三层两层书的2/7,第一层书的本数是这三层书的(&
- 2怎么用英语问别人有多少个孩子?问别人有多少个小孩,由于不知道对方有几个小孩,所以不知道用单数还是复数.还有childre
- 3英语翻译用英语翻译以下一段话:我叫薛梓言.我12岁了,我有一个快乐的家庭,家里有爸爸妈妈和我.我爸爸很聪明,我妈妈很漂亮
- 4选一个数与5、14、3三个数组成比例,可选的数有( )、( )、( )
- 5急救阿 已知A(0.3)是椭圆x^/a^+y^/b^=1的一个端点
- 6(2011•随州)右表是某校生物兴趣小组的实验记录,该小组探究的课题是( ) 试管编号
- 7写出和为4的两个无理数.(只需要一对)
- 8十分钟必答17题 解方程 x^2+6x+5=0
- 9一本150页发故事书,第一天读了五分之二,第二天读了余下的三分之一.第二天读了多少页?
- 10at ist sole discretion
- 11例:not tall :short
- 12A~E的10个简单的英语名词,求学霸帮忙。谢谢!
- 13在不同的磁场中,磁场的强弱也可以用磁感线的密集程度来区分的
- 141.2x=(1.2+0.2)*(x-5) 这个方程怎么解~
- 15怎样洗去衣服上的碘水试剂?我在实验室实验时不小心将紫色点水试剂滴洒在白大褂之上,不知该如何清洗,像百度知道的朋友求教.