碱性锌锰电池,成份,正负极反应式总反应式.不用太复杂.苏教版
 ypwdd2022-10-04 11:39:540条回答
ypwdd2022-10-04 11:39:540条回答
已提交,审核后显示!提交回复
共0条回复
相关推荐
- MNO2-ZN碱性电池一份资料里 碱性锌锰电池的正极反应式为2MnO2+2H2O+2e-==2MnO(OH)+2OH-另
MNO2-ZN碱性电池
一份资料里 碱性锌锰电池的正极反应式为
2MnO2+2H2O+2e-==2MnO(OH)+2OH-
另一份资料里 又为
MnO2+2e-+2H2O=Mn(OH)2+2OH-
它们有什么区别 都是碱性电池
两个都对吗? 甜刁襟1年前1
甜刁襟1年前1 -
 hareluya8 共回答了16个问题
hareluya8 共回答了16个问题 |采纳率100%一般第一个正确,因为氢氧化锰极易被氧化为氢氧化氧锰.1年前查看全部
- 碱性锌锰电池中负极锌怎么失电子,是因为跟氢氧化钾反应吗?
 syale11年前1
syale11年前1 -
 jxjichaju 共回答了25个问题
jxjichaju 共回答了25个问题 |采纳率84%碱性锌锰电池中负极锌失电子与KOH关系不大.KOH是电解液,导电的.
这是一个原电池反应.
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
是锌失电子 二氧化锰得电子1年前查看全部
- 为什么碱性锌锰电池比普通锌锰电池性能好
 翠微居士1年前1
翠微居士1年前1 -
 canoe121 共回答了15个问题
canoe121 共回答了15个问题 |采纳率93.3%因为他的负极在电池内部,且金属在碱性环境下比在普通环境更稳定1年前查看全部
- 碱性锌锰电池.电解质为KOH,为什么正极质量不变.而负极增重.
 是男人了1年前2
是男人了1年前2 -
 常州菜 共回答了27个问题
常州菜 共回答了27个问题 |采纳率77.8%这个电池的工作原理是锌锰被koh氧化为正二价而沉淀
负极氧化正极还原氧化后沉淀的物质附着在负极表面使负极增重
而正极的碳不参与反应,质量自然也不会改变1年前查看全部
- 南孚电池是什么电池?碱性锌锰电池?
 rainer_ccb1年前4
rainer_ccb1年前4 -
 平淡亦是真 共回答了15个问题
平淡亦是真 共回答了15个问题 |采纳率100%碱性锌-锰干电池.
南孚电池的LR20、LR14、LR6、LR03、6LR61碱锰电池系列,均为无汞、无镉、无铅绿色环保产品.1年前查看全部
- 一般碱性锌锰电池的负极为什么使用汞齐锌粉,作用是什么?可否换为其他的添加剂?
 ambercatherine1年前2
ambercatherine1年前2 -
 蕴苒 共回答了22个问题
蕴苒 共回答了22个问题 |采纳率90.9%碱性电池的负极活件物质是金属锌,由其提供电子,产生电流.锌皮或锌箔在碱液中,但其比表面较小,含电解液性能差,低温和重负荷下使用极易钝化.而锌粉具有足够大的比表面,在碱性电液中也不易钝化.
而使用汞齐锌对电极性能有很大的作用,它能提高锌的析氢过电位,并使电池的防漏性能提高.同时碱性电池的锌粉必须严格控制重金属杂质,尤其是铁,因为铁不易汞齐,从而控制杂质含量.
汞由于其高毒性及污染性现在都在寻求其合适的替代物,包括各种氧化
物、氢氧化物或金属盐等无机物以及聚乙烯氧化物,聚乙二醇类,芳烃类多元醇等各种有机物.
无机物可以在电池液中加入In2O3或In(OH)3
至于有机类含聚氧乙烯基的较为被重视,这种基团表面活性剂在水中不电离,不受酸碱影响而且成本低,能够改善电池放电性能.
LZ可以查阅一下这方面的文献1年前查看全部
- 有关碱性锌锰电池的碱性锌锰电池比普通锌锰电池性能好,放电电流大.试从影响反应速率的因素分析其原因
 kobe668059331年前1
kobe668059331年前1 -
 iy_51 共回答了15个问题
iy_51 共回答了15个问题 |采纳率100%碱性锌锰电池用锌粉替代了原锌锰电池的锌壳,增大了反应物的接触面积,加快了反应速率,故放电电流大1年前查看全部
- 关于化学电池的方程式的书写例:碱性锌锰电池(负极:Zn 正极:Mno2 电解质:KoH)中,为什么正极反应是Mn02得两
关于化学电池的方程式的书写
例:碱性锌锰电池(负极:Zn 正极:Mno2 电解质:KoH)中,为什么正极反应是Mn02得两个电子?我记得应该电解质KOH中的K+得两个电子. chalkman1年前1
chalkman1年前1 -
 jk886 共回答了13个问题
jk886 共回答了13个问题 |采纳率84.6%你应该先写出来化学反应的总反应方程式 ,看哪种物质的化合价降低
比如说例题中的MnO2,反应后化合价降低 所以得电子 而K+ 不参加反应 所以没有得失电子.1年前查看全部
- 碱性锌锰电池的电极反应式正极:负极:总反应:
 楚歌笑狂人1年前1
楚歌笑狂人1年前1 -
 阳光女孩和艳 共回答了15个问题
阳光女孩和艳 共回答了15个问题 |采纳率86.7%以下是碱性锌锰干电池的反应(后附酸性锌锰干电池反应).
正极为阴极反应:
MnO2+H2O+e→MnO(OH)+OH-
MnO(OH)在碱性溶液中有一定的溶解度
MnO(OH)+H2O+OH-→Mn(OH)4-
Mn(OH)4-+e→Mn(OH)42-
负极为阳极反应:
Zn+2OH-→Zn(OH)2+2e
Zn(OH)2+2OH-→Zn(OH)42-
总的电池反应为:
Zn+MnO2+2H2O+4OH-→Mn(OH)42-+Zn(OH)42-
酸性锌锰干电池反应:
正极为阴极,锰由四价还原为三价
2MnO2+2H2O+2e→2MnO(OH)+2OH-
负极为阳极,锌氧化为二价锌离子:
Zn+2NH4Cl→Zn(NH3)2Cl2+2H++2e
总的电池反应为:
2MnO2+Zn+2NH4Cl→2MnO(OH)+Zn(NH3)2Cl21年前查看全部
- 现代生产、生活和国防中大量使用电池.下列有关电池的说法正确的是( ) A.碱性锌锰电池性能好于普通电池的原因是能反复使
现代生产、生活和国防中大量使用电池.下列有关电池的说法正确的是( ) A.碱性锌锰电池性能好于普通电池的原因是能反复使用 B.碱性锌锰电池的正极是MnO 2 ,当电池中有6.5gZn反应时,将产生0.2molMnOOH C.铅蓄电池放电时,负极的质量减少 D.使用碱性电解质的氢氧燃料电池,负极的电极反应是H 2 -2e - =2H +  z621571年前1
z621571年前1 -
 cra1457 共回答了22个问题
cra1457 共回答了22个问题 |采纳率86.4%A.)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大,但碱性锌锰干电池属于一次电池,故A错误;
B.碱性锌锰电池的总反应是:Zn+2MnO 2 +2H 2 O═2MnOOH+Zn(OH) 2 ,根据方程式知,当电池中有6.5gZn即0.1mol锌反应时,将产生0.2molMnOOH,故B正确;
C.铅蓄电池放电时,负极上铅失电子和硫酸根离子反应生成难溶性的硫酸铅,所以负极质量增大,故C错误;
D.碱性电解质的氢氧燃料电池中,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为:O 2 +2H 2 O+4e - =4OH - ,故D错误;
故选B.1年前查看全部
- 碱性锌锰电池的总反应为:Zn+2MnO 2 +2H 2 O=Zn(OH) 2 +2MnO(OH),下列说法不正确的是(&
碱性锌锰电池的总反应为:Zn+2MnO 2 +2H 2 O=Zn(OH) 2 +2MnO(OH),下列说法不正确的是()
A.该电池Zn为负极,MnO 2 为正极,电解质是KOH B.放电时外电路电流由Zn流向MnO 2 C.电池工作时OH - 向锌电极移动 D.该电池的正极反应为:MnO 2 +e - +H 2 O=MnO(OH)+OH —  cxjnt1年前1
cxjnt1年前1 -
 猪圈和猪在 共回答了26个问题
猪圈和猪在 共回答了26个问题 |采纳率100%B
本题考查电化学有关知识。从电池总反应式可知,Zn被氧化,为负极,MnO 2 被还原,为正极,电解质是KOH,A正确;放电时电流从正极MnO 2 流向负极Zn,B不正确;内电路,负极产生Zn 2+ ,电池工作时OH - 向锌电极移动,C正确;该电池的正极反应为:MnO 2 +e - +H 2 O=MnO(OH)+OH — ,D正确。1年前查看全部
- 碱性锌锰电池的总反应是:Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2,电解质是KOH.下列说法正确的是(
碱性锌锰电池的总反应是:Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2,电解质是KOH.下列说法正确的是( )
A.MnO2发生了氧化反应
B.MnOOH中Mn元素的化合价为+3
C.反应消耗0.65gZn,有0.01mol电子发生转移
D.电池正极的反应为:Zn+2OH--2e-═Zn(OH)2 希毛特洛夫1年前1
希毛特洛夫1年前1 -
 cgm660423 共回答了19个问题
cgm660423 共回答了19个问题 |采纳率89.5%解题思路:由碱性锌锰电池的总反应:Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2,可知电池的负极Zn是电子被氧化,电极反应式为:Zn+2OH--2e-═Zn(OH)2,正极MnO2得电子被还原生成MnOOH,反应式为2MnO2+2H2O+2e-═2MnOOH+2OH-,以此解答.A.由碱性锌锰电池的总反应:Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2,可知正极MnO2得电子被还原生成MnOOH,故A错误;B.MnOOH中O元素化合价为-2价,H元素化合价为+1价,根据化合价代数和为0,则Mn元素的化合价为+3,故B正...
点评:
本题考点: 常见化学电源的种类及其工作原理.
考点点评: 本题考查原电池工作原理,题目难度不大,本题注意根据电池总反应式判断正负极反应,注意电极反应式的书写.1年前查看全部
- 碱性锌锰电池的反应总式究竟是什么?我现在有两个版本:
碱性锌锰电池的反应总式究竟是什么?我现在有两个版本:
1、Zn + 2MnO2 + H2O = Zn(OH)2 + Mn2O3
2、Zn + MnO2 + H2O = ZnO + Mn(OH)2
究竟是哪个? mtiyu1年前1
mtiyu1年前1 -
 不在犹豫11 共回答了24个问题
不在犹豫11 共回答了24个问题 |采纳率87.5%一般写的是(1)
不过对于这种锰电池,总反应不要去记,题目中一定会告诉你的.因为Mn电池正极反应有很多版本.Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH 苏教版用的是这条总反应1年前查看全部
- 碱性锌锰电池的总反应是:Zn + 2MnO 2 + 2H 2 O =" 2MnOOH" + Zn(OH) 2 ,电解质是
碱性锌锰电池的总反应是:Zn + 2MnO 2 + 2H 2 O =" 2MnOOH" + Zn(OH) 2 ,电解质是KOH。下列说法正确的是
A.碱性锌锰电池是二次电池 B.MnO 2 发生了还原反应 C.反应消耗 0.65gZn,有0.01 mol电子发生转移 D.电池正极的反应为:Zn + 2 OH - –2e - =Zn(OH) 2  anquantongdao1年前1
anquantongdao1年前1 -
 chenjh99 共回答了14个问题
chenjh99 共回答了14个问题 |采纳率78.6%B
碱性锌锰电池不能反复充放电,是一次性电池,A不正确。原电池负极失去电子,发生氧化反应。正极得到电子,发生还原反应,D不正确。根据反应式可知,二氧化锰是氧化剂,发生还原反应,B正确。65g锌失去2mol电子,C不正确。所以答案选B。1年前查看全部
- 解析碱性锌锰电池的工作原理?
 夹肢窝较1年前1
夹肢窝较1年前1 -
 kanghua10620 共回答了21个问题
kanghua10620 共回答了21个问题 |采纳率90.5%碱性锌锰电池,以氢氧化钾水溶液等碱性物质作电解质的锌锰电池,是中性锌锰电池的改良型.使用电解二氧化锰作正极活性物质,与导电石墨粉等材料混和后压成环状,锌粉作负极活性物质,与电解液和凝胶剂混和制成膏状.结构与中性锌锰电池相反,负极在内,正极在外,也称反极结构,正/负极间用专用隔离纸隔开.
碱性锌锰电池也可根据用电器具的需要制成圆柱形、钮扣形或方形.该种电池大电流和连续放电性能优越,比普通锌锰电池容量高,低温性能好,是目前性能价格比最高的民用一次电池.特别适用于照相机、儿童玩具等大电流连续使用的器具.电化学体系用“L”表示.
以下是碱性锌锰干电池的反应(后附酸性锌锰干电池反应).
正极:2MnO2+2H2O+2e═2MnO(OH)+2OH
负极:Zn+2NH4Cl-2e═Zn(NH3)2Cl2+2H
总反应式:2MnO2+Zn+2NH4Cl═2MnO(OH)+Zn(NH3)2Cl2[1]1年前查看全部
- 下列说法正确的是 A.流水、风力是一次能源,电力、蒸汽是二次能源 B.普通锌锰电池是一次电池,碱性锌锰电池是二次电池 C
下列说法正确的是
A.流水、风力是一次能源,电力、蒸汽是二次能源 B.普通锌锰电池是一次电池,碱性锌锰电池是二次电池 C.同周期元素形成的简单离子中,原子序数越大的离子半径越小 D.原子核外电子层数越多,原子半径一定越大  心海飞翔1年前1
心海飞翔1年前1 -
 liuxueming 共回答了13个问题
liuxueming 共回答了13个问题 |采纳率92.3%A
1年前查看全部
- 为什么普通锌锰电池正极是石墨,而碱性锌锰电池的正极是二氧化锰
 ejeqwiij1年前1
ejeqwiij1年前1 -
 beastxy 共回答了17个问题
beastxy 共回答了17个问题 |采纳率100%石墨不参加电化学反应,有良好的导电性,具有吸附性和粘着性.掺入电芯中可以提高电芯的导电性.它粘着在多孔锰粉的周围吸收一定量的电液,使电芯保持一定的水分,可充分提高锰粉的利用率,但无论普通还是碱性锌锰电池,一般正极都是MnO2,是正极的活性物质,直接参加电化学反应,电子转换效率更高,使用寿命更长.1年前查看全部
- 碱性锌锰电池内部构造?
 6766931年前1
6766931年前1 -
 fjfhtgps 共回答了22个问题
fjfhtgps 共回答了22个问题 |采纳率81.8%以锌为负极,二氧化锰为正极,氢氧化钾溶液为电解液的原电池.简称碱锰电池,俗称碱性电池.
最普及的碱锰电池有圆筒形和纽扣形两种,此外还有方形和扁形等品种.圆筒结构电池(见图)的外壳为一带有正极帽的镀镍钢壳,它兼作正极集电体.壳内与之紧密接触的是用电解二氧化猛、石墨和碳黑压制成的正极环(阴极).中间填充由锌粉和凝胶碱液调制成的锌膏,即负极胶(阳极),其内插有一根黄铜集电体.正负极之间用耐碱吸液的隔离管隔离.负极集电体与负极帽相焊接,并套入塑料封圈.将此组合件插入钢壳并卷边密封,钢壳外用热缩性薄膜商标包住,即成为商品电池.纽扣式碱锰电池的结构和尺寸规格基本上与锌银扣式电池相同.碱性锌锰电池
电池内活性物质的典型配方(质量):正极为电解二氧化锰90~92%,石墨粉8~9%,乙炔炭黑0.1%;负极为汞齐锌粉88~90%,氧化锌5~7%,CMC钠盐3~4%,KOH溶液(外加)适量.电解液为8~12N KOH溶液,其中溶入适量氧化锌.1年前查看全部
- 碱性锌锰电池的正极反应式中为什么有水?
 儋州好啊好儋州1年前3
儋州好啊好儋州1年前3 -
 hylei001 共回答了21个问题
hylei001 共回答了21个问题 |采纳率81%正极反应为MnO2+H2O+e-―→MnOOH+OH-.这是根据双线桥得失电子守恒来配的,水是根据方程式配平,电子守恒,电荷守恒,元素守恒原则配出来的1年前查看全部
- 下列说法正确的是( )A.流水、风力是一次能源,电力、蒸汽是二次能源B.普通锌锰电池是一次电池,碱性锌锰电池是二次电池
下列说法正确的是( )
A.流水、风力是一次能源,电力、蒸汽是二次能源
B.普通锌锰电池是一次电池,碱性锌锰电池是二次电池
C.同周期元素形成的简单离子中,原子序数越大的离子半径越小
D.原子核外电子层数越多,原子半径一定越大 hmtthz1年前1
hmtthz1年前1 -
 小猪不厚道 共回答了19个问题
小猪不厚道 共回答了19个问题 |采纳率84.2%解题思路:A.一级能源是指可以从自然界直接获取的能源,如:水能、风能、太阳能、地热能、核能、化石燃料;由一级能源经过加工转换以后得到的能源,称为二级能源,例如:电能、蒸汽、煤气、汽油、柴油、水煤气、干馏煤气等;
B.一次电池是放电后不能再充电使其复原的电池,通电电池有正极、负极电解以及容器和隔膜等组成;二次电池又称为充电电池或蓄电池,是指在电池放电后可通过充电的方式使活性物质激活而继续使用的电池;
C.同周期元素形成的简单离子中,随着原子序数的增加,离子半径先减小,后增大;
D.影响的因素有三个:一是电荷数,二是核外电子数,三是电子层数.A.一级能源是指可以从自然界直接获取的能源,如:水能、风能、太阳能、地热能、核能、化石燃料;由一级能源经过加工转换以后得到的能源,称为二级能源,例如:电能、蒸汽、煤气、汽油、柴油、水煤气、干馏煤气等,故A正确;
B.一次电池是放电后不能再充电使其复原的电池,通电电池有正极、负极电解以及容器和隔膜等组成.例如普通锌锰电池、碱性锌锰电池等;二次电池又称为充电电池或蓄电池,是指在电池放电后可通过充电的方式使活性物质激活而继续使用的电池,例如铅蓄电池等,故B错误;
C.同周期元素形成的简单离子中,随着原子序数的增加,离子半径先减小,后增大,例如钠离子、镁离子、氯离子,故C错误;
D.影响的因素有三个:一是电荷数,二是核外电子数,三是电子层数,故原子核外电子层数越多,原子半径不一定越大,故D错误,
故选A.点评:
本题考点: 常见的能量转化形式;元素周期律的作用.
考点点评: 本题考查能源和电池的分类和元素周期律,难度不大.要注意平时知识的积累.1年前查看全部
- 无汞碱性锌锰电池的成分
 嘿仫嘿仫1年前2
嘿仫嘿仫1年前2 -
 bc7758 共回答了25个问题
bc7758 共回答了25个问题 |采纳率96%碱性锌锰电池 alkaline zinc-manganese battery
以锌为负极,二氧化锰为正极,氢氧化钾溶液为电解液的原电池.简称碱锰电池,俗称碱性电池.1年前查看全部
- 碱性锌锰电池的总反应是:Zn + 2MnO 2 + 2H 2 O =" 2MnOOH" + Zn(OH) 2 ,电解质是
碱性锌锰电池的总反应是:Zn + 2MnO 2 + 2H 2 O =" 2MnOOH" + Zn(OH) 2 ,电解质是KOH。下列说法正确的是
A.MnO 2 发生了氧化反应 B.MnOOH中Mn元素的化合价为+3 C.反应消耗 0.65gZn,有0.01 mol电子发生转移 D.电池正极的反应为:Zn + 2 OH - –2e - ===Zn(OH) 2  灰天猪1年前1
灰天猪1年前1 -
 ganaawwa 共回答了17个问题
ganaawwa 共回答了17个问题 |采纳率94.1%B
根据反应前后的化合价变化可知,二氧化锰中锰的化合价由+4价降低到+3价,所以二氧化锰是氧化剂,发生还原反应,A不正确。锌是还原剂,作负极,发生氧化反应,1mol锌失去2mol电子,C、D不正确。所以答案选B。1年前查看全部
- 碱性锌锰电池是一种常见的一次电池,应用非常广泛,其工作时发生如下反应:Zn+2MnO 2 +H 2 O=2MnOOH+Z
碱性锌锰电池是一种常见的一次电池,应用非常广泛,其工作时发生如下反应:Zn+2MnO 2 +H 2 O=2MnOOH+Zn(OH) 2 ,则( ) A.Zn为负极,MnO 2 为正极 B.MnO 2 为正极,Zn为负极 C.工作时电子由MnO 2 经外电路流向Zn极 D.Zn电极发生还原反应,MnO 2 电极发生氧化反应  杭州-小呆1年前1
杭州-小呆1年前1 -
 我和谁比 共回答了15个问题
我和谁比 共回答了15个问题 |采纳率100%A.Zn元素化合价升高,被氧化,应为负极,Mn元素化合价降低,被还原,MnO 2 为正极,故A正确;
B.由A分析可知Zn为负极,MnO 2 为正极,故B错误;
C.Zn为负极,MnO 2 为正极,电子由Zn经外电路流向MnO 2 极,故C错误;
D.由化合价变化可知,Zn电极发生氧化反应,MnO 2 电极发生含有反应,故D错误.
故选A.1年前查看全部
- 下列说法正确的是( )A.碱性锌锰电池是二次电池B.铅蓄电池是一次电池C.蓄电池是二次电池,它放电后可以再充电使活性物
下列说法正确的是( )
A.碱性锌锰电池是二次电池
B.铅蓄电池是一次电池
C.蓄电池是二次电池,它放电后可以再充电使活性物质获得再生
D.氢气、甲烷等燃料在燃料电池的内部进行燃烧,从而将化学能转化为电能 sody6281年前1
sody6281年前1 -
 kaixie03 共回答了16个问题
kaixie03 共回答了16个问题 |采纳率68.8%解题思路:A、依据一次电池是放电后不能进行使用,二次电池是放电后可以充电后继续使用;
B、铅蓄电池是二次电池,可以放电充电;
C、蓄电池是二次电池放电后可以充电重新使用;
D、燃料在两个电极上发生氧化还原反应把化学能转化为电能.A、一次电池是放电后不能进行使用,二次电池是放电后可以充电后继续使用,碱性锌锰电池是一次电池,故A错误;
B、铅蓄电池是二次电池,可以放电充电,故B错误;
C、蓄电池是二次电池放电后可以充电重新使用,使活性物质获得再生,故C正确;
D、燃料在两个电极上发生氧化还原反应把化学能转化为电能,不是在电池内部燃烧,故D错误;
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池的原理分析,电池分类,一次电池、二次电池的工作实质,掌握基础是关键,题目较简单.1年前查看全部
- 为什么碱性锌锰电池比普通的好
 蓝阿兔1年前1
蓝阿兔1年前1 -
 阳光真美 共回答了19个问题
阳光真美 共回答了19个问题 |采纳率89.5%简单说有以下四点:1、碱锰电池内部结构比普通锌锰电池好,更适合放电反应.2、碱锰电池使用的原材料纯度比普通锌锰电池使用的原材料纯度高.3、碱锰电池使用的原材料用量比普通锌锰电池使用的原材料用量多.4、碱锰电池...1年前查看全部
- 高中化学普通锌锰干电池有何缺点?相比之下碱性锌锰电池有何不同,做了什么改变?有何优点?
 aiyaya211年前1
aiyaya211年前1 -
 dany11 共回答了15个问题
dany11 共回答了15个问题 |采纳率100%普通锌锰干电池以氯化氨(酸性)为电解质,会腐蚀电池的锌筒且反应有氢气生成,所以容易造成电池膨胀及漏液现象.
碱性锌锰电池的电解质溶液是碱性的,不会腐蚀电池的锌筒且不产生气体,因此不会有漏液现象,而且提供的电流更加稳定和持久.1年前查看全部
- 碱性锌锰电池的总反应是:Zn+2MnO 2 +2H 2 O═2MnOOH+Zn(OH) 2 ,电解质是KOH.下列说法正
碱性锌锰电池的总反应是:Zn+2MnO 2 +2H 2 O═2MnOOH+Zn(OH) 2 ,电解质是KOH.下列说法正确的是( ) A.MnO 2 发生了氧化反应 B.MnOOH中Mn元素的化合价为+3 C.反应消耗0.65gZn,有0.01mol电子发生转移 D.电池正极的反应为:Zn+2OH - -2e - ═Zn(OH) 2  支持靓靓1年前1
支持靓靓1年前1 -
 玻璃鱼的小小幸福 共回答了15个问题
玻璃鱼的小小幸福 共回答了15个问题 |采纳率93.3%A.由碱性锌锰电池的总反应:Zn+2MnO 2 +2H 2 O═2MnOOH+Zn(OH) 2 ,可知正极MnO 2 得电子被还原生成MnOOH,故A错误;
B.MnOOH中O元素化合价为-2价,H元素化合价为+1价,根据化合价代数和为0,则Mn元素的化合价为+3,故B正确;
C.n(Zn)=0.01mol,有0.02mol电子发生转移,故C错误;
D.电池正极的反应为:2MnO 2 +2H 2 O+2e - ═2MnOOH+2OH - ,故D错误.
故选B.1年前查看全部
- 【选修2化学与技术】(20分)20-I(6分)下列有关叙述正确的是 A.碱性锌锰电池中,MnO 2 是催化剂 B.银锌纽
【选修2化学与技术】(20分)
20-I(6分)下列有关叙述正确的是
20-Ⅱ(14分)锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:A.碱性锌锰电池中,MnO 2 是催化剂 B.银锌纽扣电池工作时,Ag 2 O被还原为Ag C.放电时,铅酸蓄电池中硫酸浓度不断增大 D.电镀时,待镀的金属制品表面发生还原反应 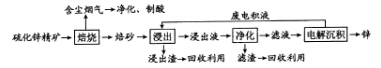
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为____。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_______操作.
(3)浸出液“净化”过程中加入的主要物质为________,其作用是__________________。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是____。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为____________________。
(6)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于 “升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为____。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌) 宁海人1年前1
宁海人1年前1 -
 其丽丽 共回答了17个问题
其丽丽 共回答了17个问题 |采纳率88.2%1年前查看全部
- 下列说法正确的是( )A.流水、风力是一次能源,电力、蒸汽是二次能源B.普通锌锰电池是一次电池,碱性锌锰电池是二次电池
下列说法正确的是( )
A.流水、风力是一次能源,电力、蒸汽是二次能源
B.普通锌锰电池是一次电池,碱性锌锰电池是二次电池
C.蔗糖、纤维素、淀粉、蛋白质都能燃烧且完全燃烧的产物相同
D.煤的干馏、煤的气化和液化均属于物理变化 赵春磊1年前1
赵春磊1年前1 -
 cartoonsh 共回答了19个问题
cartoonsh 共回答了19个问题 |采纳率94.7%解题思路:A.一级能源是指可以从自然界直接获取的能源,如:水能、风能、太阳能、地热能、核能、化石燃料;由一级能源经过加工转换以后得到的能源,称为二级能源,例如:电能、蒸汽、煤气、汽油、柴油、水煤气、干馏煤气等;
B.一次电池是放电后不能再充电使其复原的电池,通电电池有正极、负极电解以及容器和隔膜等组成;二次电池又称为充电电池或蓄电池,是指在电池放电后可通过充电的方式使活性物质激活而继续使用的电池;
C.蛋白质中含N元素;
D.有新物质生成的是化学变化.A.一级能源是指可以从自然界直接获取的能源,如:水能、风能、太阳能、地热能、核能、化石燃料;由一级能源经过加工转换以后得到的能源,称为二级能源,例如:电能、蒸汽、煤气、汽油、柴油、水煤气、干馏煤气等,故A正确;
B.一次电池是放电后不能再充电使其复原的电池,通电电池有正极、负极电解以及容器和隔膜等组成.例如普通锌锰电池、碱性锌锰电池等;二次电池又称为充电电池或蓄电池,是指在电池放电后可通过充电的方式使活性物质激活而继续使用的电池,例如铅蓄电池等,故B错误;
C.蛋白质中含N元素,燃烧除二氧化碳、水,还生成含N物质,而蔗糖、纤维素、淀粉完全燃烧的产物都只有二氧化碳和水,故C错误;
D.煤干馏可以得到煤焦油,煤焦油中含有甲烷、苯和氨等重要化工原料,属于化学变化;煤的气化是将其转化为可燃气体的过程,主要反应为碳与水蒸气反应生成H2、CO等气体的过程,有新物质生成,属于化学变化,故D错误.
故选A.点评:
本题考点: 煤的干馏和综合利用;清洁能源;淀粉的性质和用途;纤维素的性质和用途;氨基酸、蛋白质的结构和性质特点.
考点点评: 本题考查能源和电池的分类和有机物的性质等知识,难度不大.要注意平时知识的积累.1年前查看全部
- 原电池正负极反应例:碱性锌锰电池(负极:Zn 正极:Mno2 电解质:KoH)中,为什么正极反应是Mn02得两个电子?我
原电池正负极反应
例:碱性锌锰电池(负极:Zn 正极:Mno2
电解质:KoH)中,为什么正极反应是Mn02得两个电子?我记得应该电解质KOH中的K+得两个电子. aabbcc3021年前3
aabbcc3021年前3 -
 凤舞地狱 共回答了15个问题
凤舞地狱 共回答了15个问题 |采纳率93.3%因为MnO2的氧化性比K+强,MnO2的还原电位比K+还原电位高,先被还原,并且从总反应来看,就成了Zn还原K是一个自发进行的反应了负极为阳极反应:Zn+2OH-→Zn(OH)2+2eZn(OH)2+2OH-→Zn(OH)42-
正极为阴极反应:MnO2+H2O+e→MnO(OH)+OH-MnO(OH)在碱性溶液中有一定的溶解度MnO(OH)+H2O+OH-→Mn(OH)4-Mn(OH)4-+e→Mn(OH)42-总的电池反应为:Zn+MnO2+2H2O+4OH-→Mn(OH)42-+Zn(OH)42-
酸性锌锰干电池反应:正极为阴极,锰由四价还原为三价2MnO2+2H2O+2e→2MnO(OH)+2OH-负极为阳极,锌氧化为二价锌离子:Zn+2NH4Cl→Zn(NH3)2Cl2+2H++2e总的电池反应为:2MnO2+Zn+2NH4Cl→2MnO(OH)+Zn(NH3)2Cl21年前查看全部
- 碱性锌锰电池正极为什么是MNO2
 fychen1年前3
fychen1年前3 -
 yutrui 共回答了29个问题
yutrui 共回答了29个问题 |采纳率82.8%二氧化锰是去极剂,你在电极反应式里见到的二氧化锰是被并进去的
正:2NH4- +2e- ==2NH3↑+H2↑
负:Zn- 2e- ==Zn2+
正极反应中生成的氨气被电解质溶液吸收,氢气则需要被二氧化锰吸收(由电池反应放出的能量提供反应所需能量)H2+2MnO2==Mn2O3+H2O
所以正极写成:2MnO2+2NH4+ +2e- ==Mn2O3+H2O+2NH3↑1年前查看全部
- 碱性锌锰电池正负极电子式怎么书写
 9虫虫91年前2
9虫虫91年前2 -
 52wx 共回答了18个问题
52wx 共回答了18个问题 |采纳率94.4%以下是碱性锌锰干电池的反应(后附酸性锌锰干电池反应).
正极为阴极反应:
MnO2+H2O+e→MnO(OH)+OH-
MnO(OH)在碱性溶液中有一定的溶解度
MnO(OH)+H2O+OH-→Mn(OH)4-
Mn(OH)4-+e→Mn(OH)42-
负极为阳极反应:
Zn+2OH-→Zn(OH)2+2e
Zn(OH)2+2OH-→Zn(OH)42-
总的电池反应为:
Zn+MnO2+2H2O+4OH-→Mn(OH)42-+Zn(OH)42-1年前查看全部
- 碱性锌锰电池正极为什么与氢氧根离子反应
 日后相见1年前1
日后相见1年前1 -
 丁一依 共回答了18个问题
丁一依 共回答了18个问题 |采纳率94.4%正极:2MnO2+2H2O+2e-=2MnOOH(氢氧化氧锰)+2OH-1年前查看全部
- 碱性锌锰电池正极是锰元素在得电子还是水中的氢元素在得电子?
 wf1ove1年前3
wf1ove1年前3 -
 normal 共回答了20个问题
normal 共回答了20个问题 |采纳率90%锰元素在得电子1年前查看全部
- 碱性锌锰电池正极:2MnO2+2H2O+2e═2MnO(OH)+2OH-负极:Zn+2NH4Cl-2e═Zn(NH3)2
碱性锌锰电池
正极:2MnO2+2H2O+2e═2MnO(OH)+2OH-
负极:Zn+2NH4Cl-2e═Zn(NH3)2Cl2+2H
总反应式:2MnO2+Zn+2NH4Cl═2MnO(OH)+Zn(NH3)2Cl2
正极:2MnO2+2H2O+2e═2MnO(OH)+2OH-
负极:Zn+2OH--2e═Zn(OH)2
总反应式:2MnO2+Zn+2H2O═2MnO(OH)+Zn(OH)2
为什么碱性锌锰电池有两种不同啊、这两种有可比性吗?利用的氧化还原原理是属于什么反应的、2MnO2+Zn+2H2O═2MnO(OH)+Zn(OH)2像这样的感觉还没学过...
还有我不是很理解、Zn+2OH--2e代表着什么、是跟电解质反应?2MnO2+2H2O+2e是跟水反应?还是说那个电解质只是使他们反应的条件而已 4457816571年前1
4457816571年前1 -
 phone12 共回答了20个问题
phone12 共回答了20个问题 |采纳率80%1、第一个是用NH4Cl作电解质,第二个用KOH作电解质,第二个是真正的碱性电池.2、2MnO2+Zn+2H2O═2MnO(OH)+Zn(OH)2,高中阶段不用掌握.一般会作为信息,在题目中给出.3、Zn+2OH--2e代表着什么------本来负极的反应就是...1年前查看全部
大家在问
- 1被打乱的英语动物单词,帮忙写出正确的.
- 2SAT的申请地址怎么填写他老是说Please enter a valid mailing address.A valid
- 3若直线l在y轴上的截距为-2 l上横坐标分别是3, -4 的两点的线段长为14 则直线l的方程为
- 4不改变句意思,写两种说法 如果每个人都能像乔依那样献出一份爱心,什么困难都能解决.
- 5在2009年读书节活动期间,为了了解学校初三年级学生的课外阅读情况,小颖随机抽取初三年级部分同学进行调查,把得到的数据处
- 6分一为1,分母为X的绝对值减一,这个函数图像怎么画
- 7Why not go to Beijing by plane?用另一种方式表达.
- 8核反应堆的工作原理是利用中子轰击重核发生裂变反应,释放出大量核能.核反应方程式 23592U+n→
- 9’’良人’’的词语解释
- 10陈述句改为否定句
- 11请根据题意回答下列问题(在下列(1)(2)两小题中任选一题回答,若两小题都回答,则以第(1)小题的答案评定分数)
- 12数学题:函数y=根号x,的值域是R+吗?为什麼?
- 13分子间作用力与距离的关系曲线,已知CQ=PD.下列对这两条曲线的理解正确的是
- 14一个因数乘3,另一个因数除以2,积会怎样变化?
- 15的化学方程式.RT是所有的