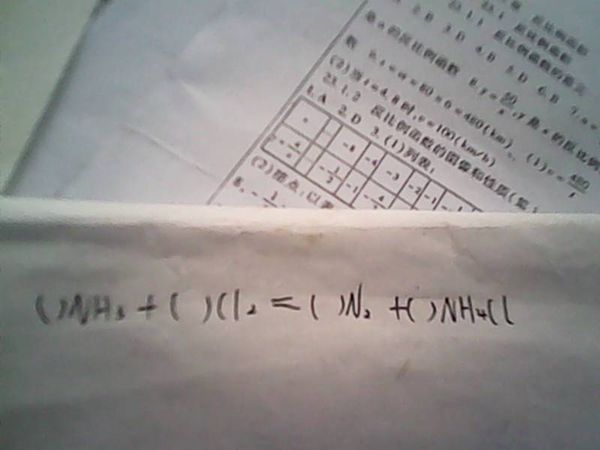求配平方程式!MgCl2'6H2O,HCl反应生成Mg(OH)Cl,MgCl2 和H2O有关的反应方程式!
 陈昌武2022-10-04 11:39:541条回答
陈昌武2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 limtwd 共回答了25个问题
limtwd 共回答了25个问题 |采纳率92%- 这个方程式就貌似不大对,HCl应该是生成物
基本反应是MgCl2+H2O=Mg(OH)Cl+HCl.
具体配平,那就要看反应条件的了,因为这个涉及到晶体. - 1年前
相关推荐
- (1995•广西)配平方程式:□NxO3+□Fe 高温 . □Fe3O4+□N2.
 076251年前1
076251年前1 -
 rainbown512 共回答了24个问题
rainbown512 共回答了24个问题 |采纳率91.7%解题思路:本题考查化学方程式的配平,可以利用原子在化学反应前后数目不变来配平.对比较复杂的反应一般可以用“定1法”进行快速配平.将Fe3O4的系数定为1,根据各元素的原子守恒可得各物质的系数依此为 [4/3],3,1,[2x/3],同乘以3变为整数系数即得各物质的系数为:4、9、3、2x.
故答案为:4、9、3、2x点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 配平方程式的方法很多,简单的反应可以利用质量守恒定律中的元素守恒直接观察配平,复杂的直接可以利用“定一法”进行配平.1年前查看全部
- KI+ O3 = KIO3 + O2配平方程式
 fhdgoisdfhoi1年前1
fhdgoisdfhoi1年前1 -
 alexpanrui 共回答了15个问题
alexpanrui 共回答了15个问题 |采纳率80%2KI+ 4O3 = 2KIO3 + 3O21年前查看全部
- 配平方程式 CU(IO3)2 +KI+6H2SO4 == CUI+I2+K2SO4 +H20
配平方程式 CU(IO3)2 +KI+6H2SO4 == CUI+I2+K2SO4 +H20
看过很多说明
KI中的I:部分未变,生成CuI,前后都是-1价.
----KI中的I:部分由-1价升高到0价.
----Cu(IO3)2中的I:+5价到0价.
----Cu(IO3)2中的Cu:+2价到+1价.
只是有些疑问 ,为什么 不可能是 CU(IO3)2中的I从+5变为0价 ,而 KI中的I一直不变 ,这种情况也是可能啊?
我知道这个反应是归中反应,但是归中只强调 向中间价态靠拢,难道归中反应中 ,无论是高价元素还是低价元素都必须参与反应吗? 八光aa1年前4
八光aa1年前4 -
 唐章勇 共回答了26个问题
唐章勇 共回答了26个问题 |采纳率96.2%你说的情况也是可能出现的,但在本题中,需要考虑本题的具体情况.
Cu(IO3)2中的Cu从+2价到+1价,这是毫无疑问的.
若按你所说,Cu(IO3)2中的I从+5变为0价,KI中的I一直不变,可以看到,只有化合价的降低,没有化合价的升高,这是不可能的.化合价有降必有升,本题中唯一可能的化合价升高的情况就是KI中的I部分由-1价升高到0价,因此配方程式必须按这样做才行.1年前查看全部
- 配平方程式KOCN+KOH+Cl2——CO2+N2+KCl+H2O
 0dr49adr1年前2
0dr49adr1年前2 -
 嚣张づ帅帅 共回答了26个问题
嚣张づ帅帅 共回答了26个问题 |采纳率88.5%你好,利用N元素和氯元素的化合价升降平衡配,可得
2KOCN+4KOH+3Cl2=2CO2+N2+6KCl+2H2O1年前查看全部
- 配平方程式NH3+NO==N2+H2ONH3+NO2==N2+H2O
 66mmm1年前1
66mmm1年前1 -
 vv草总舵主BOSS 共回答了24个问题
vv草总舵主BOSS 共回答了24个问题 |采纳率75%4NH3+6NO==5N2+6H2O
8NH3+6NO2==7N2+12H2O1年前查看全部
- 用双线桥法配平方程式上面的3*2*2中的3是不是表示一个原子化合价升3 第一个2表示形成了两个0
用双线桥法配平方程式
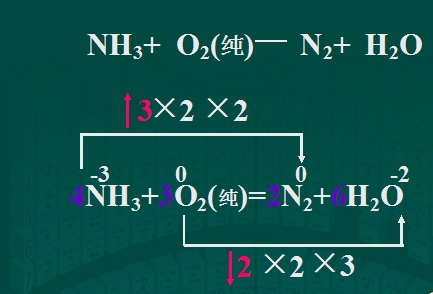
上面的3*2*2中的3是不是表示一个原子化合价升3
第一个2表示形成了两个0价原子
第二个2表示与下面的得电子数求最小公倍数?
下面的2*2*3中的第一个2是不是表示一个原子的化合价降2
第二个2表示有两个这样的原子价态发生变化
3表示与上面失电子数求最小公倍数?
为什么上面用的是生成物的原子个数(也就是第二个2),下面用的是反应物的原子个数(第二个2),一直没想通. cara52611年前1
cara52611年前1 -
 xianshidianti 共回答了21个问题
xianshidianti 共回答了21个问题 |采纳率90.5%氮气是每个分子含2个原子
不是看反应物还是生产物,是找含原子个数多的作参考
1.标电子转移或偏离数
明确标出得失电子数,格式为“得/失 发生氧化还原反应原子个数×单位原子得失电子数”
2.标化合价变化
一律标出化合价的变化,只有“化合价升高”“化合价降低”这两种写法,不可写为“升价”“降价”等
3.标出元素反应类型
一律标出元素所发生的反应,“被氧化”或“被还原”,其余写法均不正确
4.检查得失电子守恒
检查得失电子数是否相等,如不相等则重新分析.1年前查看全部
- 如何根据质量守恒和电荷守恒配平方程式?
如何根据质量守恒和电荷守恒配平方程式?
能举例子吗? goqoii1年前4
goqoii1年前4 -
 我的目标悍马 共回答了20个问题
我的目标悍马 共回答了20个问题 |采纳率85%比如:双水解,Al3+ + CO32- — Al(OH)3↓ + CO2↑
首先观察,发现方程式左边有离子,右边为分子,而分子是电中性的.根据电荷守恒,等号两边总电荷必须相同.为使左边也为电中性,将Al3+乘以2,CO32-乘以3.
写做:2Al3+ + 3CO32- — Al(OH)3↓ + CO2↑
再根据质量守恒,给右边也加上系数.
写做:2Al3+ + 3CO32- — 2Al(OH)3↓ + 3CO2↑
再观察,发现还不符合质量守恒定律,也就是等号左右两边原子种类和个数相同.根据反应是在水溶液中进行的,在左边补上H2O,并配平.
写做:2Al3+ + 3CO32- + 3H2O — 2Al(OH)3↓ + 3CO2↑
检查,等号两边原子种类个数相同,离子所带总电荷相同,至此配平结束.画成等号.
写做:2Al3+ + 3CO32- + 3H2O = 2Al(OH)3↓ + 3CO2↑
再比如:Fe3+ + Fe — Fe2+
根据电荷守恒,给左边Fe3+配上系数2,右边Fe2+配上系数3,根据质量守恒定律,检查两边原子种类个数相同,画上等号,配平结束.
写做:2Fe3+ + Fe = 3Fe2+1年前查看全部
- KMNO4+HCl+H2S——KCl+Mncl2+S+H2O 配平方程式
 gbj489241年前4
gbj489241年前4 -
 沉默的羔羊6 共回答了14个问题
沉默的羔羊6 共回答了14个问题 |采纳率92.9%2KMnO4+6HCl+H2S=2KCl+2MnCl2+S+4H2O1年前查看全部
- 配平方程式:Na2Sx+NaClO+NaOH=Na2SO4+NaCl+H2O(注:x为S的角标)
 lionye1年前2
lionye1年前2 -
 ybgggg 共回答了14个问题
ybgggg 共回答了14个问题 |采纳率100%系数中含有x,配平如下:
(2/x)Na2Sx + (6 + 2/x)NaClO + (4 - 4/x)NaOH == 2Na2SO4 + (6 + 2/x)NaCl + (2 - 2/x)H2O1年前查看全部
- 配平方程式 :FeS2+O2=SO2+Fe2O3
 泊咕噜1年前4
泊咕噜1年前4 -
 橡胶人体51 共回答了11个问题
橡胶人体51 共回答了11个问题 |采纳率81.8%系数法配平即可,先Fe
2xFeS2+O2=SO2+xFe2O3
然后S
2xFeS2+O2=4xSO2+xFe2O3
最后O
2xFeS2+(11x/2)O2=4xSO2+xFe2O3
然后把x和分数消去
4FeS2+11O2=8SO2+2Fe2O31年前查看全部
- 高中化学问题~~~配平方程式:()硫化铜+()HNO3=()CuSO4+()H2SO4+()NO2+()H2O解释一下:
高中化学问题~~~
配平方程式:()硫化铜+()HNO3=()CuSO4+()H2SO4+()NO2+()H2O
解释一下:硫化铜中的铜为+1价,S为X价,要求配平化学方程式.
这个具体应该怎么做?谢谢~(财富值只有2.不好意思没有悬赏分.) Exho1年前6
Exho1年前6 -
 endless皮皮 共回答了18个问题
endless皮皮 共回答了18个问题 |采纳率94.4%一,FeSO4+ HNO3= x Fe2(SO4)3+ y Fe(NO3)3+ NO+ H2O (x,y一定要选在含元素多的化合物上)
二,(2x+y)FeSO4+ HNO3= x Fe2(SO4)3+ y Fe(NO3)3+ NO+ H2O
此处看到S的总量等式前后对比一下,得出(2x+y)=3x,所以x=y,所以取x=1,y=1
三,3 FeSO4+ () HNO3= 1 Fe2(SO4)3+ 1 Fe(NO3)3+ () NO+ ()H2O
四,3 FeSO4+ (A) HNO3= 1 Fe2(SO4)3+ 1 Fe(NO3)3+ (A-3) NO+ (B)H2O (设HNO3的前面系数为A,则NO的系数为A减去Fe(NO3)3的N的数量)
五,B中由等式前后H的差计算得H2的值为=A/2,B中由等式前后O的差计算得O的值为=3*4+3A-3*4-3*3-(A-3)=2A-6,即A/2=2A-6,计算得A=4
我的方法的另外一种例子:
一,x CO + y Fe2O3 = Fe+CO2
二,x CO + y Fe2O3 = 2y Fe + x CO2 (看C和Fe的数量)
三,看等号前后的O的数量,前后要相等:x + 3y = 0 + 2x
四,解得3y=x,取x=3,y=1
我的方法经常是用在下面这种例子:
一,x KMnO4+ y K2SO3+ KOH=== K2MnO4+ K2SO4+ H2O
二,x KMnO4+ y K2SO3+ KOH=== x K2MnO4+ y K2SO4+ H2O (看Mn和S的数量对等)
三,x KMnO4+ y K2SO3+ (2x+2y-x-2y)KOH=== x K2MnO4+ y K2SO4+ H2O (此步把KOH中的K的数量算出来,是由反应式后的K数减反应式前的)
四,x KMnO4+ y K2SO3+ x KOH=== x K2MnO4+ y K2SO4+ (A) H2O 此步A算两次,H的数量等于反应式前后的差,即A=x/2,O的反应式前后差,即数量=4x+3y+x-4x-4y=x-y,所以A=x/2=x-y,此共识解成x=2y,即可算成x=2,y=1.
注意,我的方法是预先设定系数法,然后根据每个元素计算出其他系数,最终是得出H,O之类的比值或者是等式的前后差,每步都不能错,算出系数的具体值后请核对一下等式前后的元素总量是否守恒,算一算电荷是否守恒.1年前查看全部
- 归中反应与歧化反应不能交叉什么意思 怎么避免交叉 怎么解决这类问题【即怎么配平方程式】急
归中反应与歧化反应不能交叉什么意思 怎么避免交叉 怎么解决这类问题【即怎么配平方程式】急
请多举几个例子 并写清配平的过程 smilefish02261年前2
smilefish02261年前2 -
 stock_ 共回答了17个问题
stock_ 共回答了17个问题 |采纳率82.4%归中反应 同一元素的化合价由两边向中间价态移动 例2H2S+SO2=2S+2H2O
歧化反应 同一元素的化合价由中间向两边价态移动 CL2+H2O=HCL+HCLO 3NO2+H2O=2HNO3+NO
生成物与反应物的化合价一旦交叉生成物就会再参加反应,最终生成物与反应物的化合价不会交叉(详细可见大学教材)
解决过程:标价态,看价态的改变情况.主要是要多做题目,找感觉.1年前查看全部
- CrI3+Cl2+_=K2Cr2O7+KCl+H20+KIO4完成并配平方程式
CrI3+Cl2+_=K2Cr2O7+KCl+H20+KIO4完成并配平方程式
急呀.今天就要要! xxzs1年前1
xxzs1年前1 -
 slimpiggy 共回答了20个问题
slimpiggy 共回答了20个问题 |采纳率90%2CrI3+27Cl2+62KOH=K2Cr2O7+54KCl+31H20+6KIO41年前查看全部
- 配平方程式KOCN+KOH+Cl2——CO2+N2+KCl+H2O xiexie
 xiaodongxiaoxi1年前1
xiaodongxiaoxi1年前1 -
 甲子1984 共回答了18个问题
甲子1984 共回答了18个问题 |采纳率88.9%2KOCN+4KOH+3Cl2=2CO2+N2+6KCl+2H2O
1、先标出化合价升降:
+4-3 0 +4 0 -1
KOCN+KOH+Cl2——CO2+N2+KCl+H2O
升3×2 降1×2
2、用最小公倍数配平氧化还原部分:
2KOCN+KOH+3Cl2=CO2+N2+KCl+H2O
3、用观察法配平其它原子:
2KOCN+4KOH+3Cl2=2CO2+N2+6KCl+2H2O1年前查看全部
- 化学的配平方程式还有摩尔质量.急要.最好明天就要!
化学的配平方程式还有摩尔质量.急要.最好明天就要!
现有一瓶标签以破损的过氧化氢溶液,为测定瓶内溶液中溶解的质量分数,去34克该溶液于分液漏斗A中,锥形瓶B中加入一定量的二氧化锰.不同时间电子天平的读数如下表所示(不考虑H2O溢出)
反应时间/MIN 0 1 2 3
装置+过氧化氢溶液+二氧化锰/g 335,70 333.78 332.64 332.58
4 5 6
332.50 332.50 332.50
请根据要求回答问题:
1.发生反应的化学式方程( )
2.生成氧气的物质的量为( )mol
3.根据上述氧气的量计算分解过氧化氢的物质的量(根据化学式方程列示计算) llf_19821年前1
llf_19821年前1 -
 妖狐小乖 共回答了19个问题
妖狐小乖 共回答了19个问题 |采纳率84.2%1.2H2O2=MnO2=2H2O+O2(气体符号)
2.由题可知生成O2的质量为335,70 -332.50=3.2g
所以O2的物质的量为3.2/32=0.1(mol)
3.2H2O2=MnO2=2H2O+O2
0.2mol ← ← ← 0.1mol1年前查看全部
- 请根据电子得失配平方程式:NH4Cl+Fe2O3→FeCl3+Fe+N2+H2O
 原醉231年前3
原醉231年前3 -
 百家书屋 共回答了18个问题
百家书屋 共回答了18个问题 |采纳率88.9%N由-3升到0,失3电子,由于生成N2,所以每生成一个N2失去6电子Fe由+3降到0,降3最小公倍数为6N2写1,Fe配22NH4Cl+Fe2O3→FeCl3+2Fe+1N2+H2O为了配Cl,两边同时乘以3:6NH4Cl+Fe2O3→FeCl3+6Fe+3N2+H2O根据Cl元素配FeCl3系数为2: 6NH4Cl+Fe2O3→2FeCl3+6Fe+3N2+H2O根据Fe元素配Fe2O3系数为4: 6NH4Cl+4Fe2O3→2FeCl3+6Fe+3N2+H2O最后朽氢和氧,6NH4Cl+4Fe2O3===2FeCl3+6Fe+3N2+12H2O1年前查看全部
- 【化学】氧化还原反应用电子得失配平方程式
【化学】氧化还原反应用电子得失配平方程式
①KMnO4+H2O2+H2SO4→K2SO4+MnSO4+O2↑+H2O
②FeSO4+HNO3→Fe(NO3)3+Fe2(SO4)3+N2O+H2O
请详细说明如何用电子守恒来配平,最好有能很简单理解的过程.
此外歧化反应怎么配平比较方便?
回答对给50分,歧化反应配平问题方法好用额外50分,如果有实例,视情况给20-50分! shanying21年前1
shanying21年前1 -
 6944jxjs 共回答了17个问题
6944jxjs 共回答了17个问题 |采纳率100%+7 -1 +2 KMnO4+H2O2+H2SO4→K2SO4+MnSO4+O2↑+H2O 使化合价升降相等 Mn +7-------------------- +2 降5 乘以2 KMnO4 MnSO4系数都为2x09O -1--------------- 0 升2 乘以5 O2系数为5•x09观察配平其他系数R...1年前查看全部
- 配平方程式N2H4+Cu(OH)2=N2+H2O+Cu2O
 金色火1年前4
金色火1年前4 -
 大后天仍然台 共回答了16个问题
大后天仍然台 共回答了16个问题 |采纳率100%N2H4+4Cu(OH)2=N2+6H2O+2Cu2O ,氮从-2价变到0价,铜从+2价变到+1价,氮、铜的比必须是1:2,所以N2H4和Cu(OH)2的比必须是1:4,生成物根据反应物配平1年前查看全部
- 求一道化学配平方程式!( )Fe2O3+( )CO--高温--( )Fe+( )CO2
 源于春天1年前9
源于春天1年前9 -
 rachelyam 共回答了18个问题
rachelyam 共回答了18个问题 |采纳率94.4%( )Fe2O3+( )CO--高温--( )Fe+( )CO2
氧化还原反应实质是电子的得失,要遵守电子守护定律
这个先搞清楚化合价
Fe从+3到0,那就是一个Fe2O3得到6e-
C从+2到+4,那就是一个CO失去2e-
找出最少公倍数,是6
6/6==1,6/2=3
所以Fe2O3配1,CO配3,
再根据原子守恒
Fe配2,CO2配3
答案是
Fe2O3+3CO==高温==2Fe+3CO2
不明白可以密我1年前查看全部
- 配平方程式的1题已知M元素的碳酸盐能发生如下的反应:_____MCO3+_______O2====_____MxOy+_
配平方程式的1题
已知M元素的碳酸盐能发生如下的反应:
_____MCO3+_______O2====_____MxOy+________(条件加热)
完成该反应方程式
问下哦,就是:空格里的物质填什么呢?怎么想到呢? dorothy8211年前1
dorothy8211年前1 -
 wgp139 共回答了23个问题
wgp139 共回答了23个问题 |采纳率91.3%2xMCO3+(y-x)O2==加热==2MxOy+2xCO2
碳酸盐加热会生成CO2,例如CaCO3=高温=CaO+CO2↑1年前查看全部
- 大家配平方程式的步骤是什么 先电荷守恒再原子守恒吗
 爱上你的香味1年前2
爱上你的香味1年前2 -
 Shambhala 共回答了21个问题
Shambhala 共回答了21个问题 |采纳率100%先电荷守恒再原子守恒
举例FeCl3+Fe==FeCl2
先标出化合价改变的元素化合价
3+.0.2+
FeCl3+Fe==FeCl2
再标出化合价前后怎么升降
3+.0.2+
FeCl3.+.Fe.==.FeCl2
降1价.升2价
再将升降的系数交换:
2FeCl3.+.1 Fe.==.FeCl2
最后通过观察配平
2FeCl3.+.Fe.==.3FeCl21年前查看全部
- 高一化学方程式在下是广西的.上了高中还不懂得化学方程式到底怎么写.很头疼的一个问题,除了会配平方程式外,其他就不懂了.例
高一化学方程式
在下是广西的.
上了高中还不懂得化学方程式到底怎么写.很头疼的一个问题,除了会配平方程式外,其他就不懂了.例如:H²+O²=H²O.不知道写得对不对,一直有一个疑问,为什么不是H²O²,而是H²O?
好吧,我真的不懂.但求各位大侠帮个忙,把高一的全部化学方程式例给我!地区是广西省,要上年印的新课本的化学方程式,麻烦写详细点.别把旧的那些发给我呀!我真的很需要!谢谢! 131140252791年前4
131140252791年前4 -
 vbvb555 共回答了23个问题
vbvb555 共回答了23个问题 |采纳率95.7%2H2+O2=2H2O
硬要说为什么不是产生过氧化氢的话,就是条件不行.过氧化氢的结构比较复杂,过氧根不是那么容易合成,而且氢不够下面的碱金属活泼.像Na K 等常温在空气中就可以和氧气反应成普通氧化物,燃烧就可以生成过氧化物,而氢气燃烧才变成氧化物.
其实很多人(包括我)都不知道为什么会化合出这样的东西,只是因为这科算是经验学科,好多东西都是前人总结出来的.
置于方程式的话,找老师要吧,或者自己总结也可以.(因为我不是广西的,也不再是高中生了)1年前查看全部
- CH3OH+O2-----CO2+O2怎么配平方程式?
CH3OH+O2-----CO2+O2怎么配平方程式?
CH3OH+3/ 2 O2→CO2+2H2O
尤其不知道其中的3/ 2 是怎么来的, hannover771年前5
hannover771年前5 -
 尸体鸭 共回答了16个问题
尸体鸭 共回答了16个问题 |采纳率81.3%CH3OH+O2→CO2+H2O
反应前一个甲醇(CH3OH)分子中有氢原子有4个,而反应后一个水(H2O)分子中含有2个氢原子,所以在水分子前面添加计量数2,
CH3OH+O2→CO2+2H2O
反应前含有3个氧原子,而反应后含有4个氧原子,
所以在O2前面添加计量数3/ 2 ,使得反应前O2分子中含有3个的氧原子个数再加上CH3OH中的一个氧原子,共计4个氧原子.
CH3OH++3/ 2O2→CO2+2H2O
但是分子个数没有分数,所以在方程式的两边要乘上2,得:
2CH3OH++3O2→2CO2+4H2O1年前查看全部
- 化学的化合价口诀和原子团化合价?如何配平方程式?
 追忆少年1年前1
追忆少年1年前1 -
 挺恶的情 共回答了20个问题
挺恶的情 共回答了20个问题 |采纳率90%化合价口决一:
一价氟氯溴碘氢, 还有金属钾钠银.
二价氧钡钙镁锌, 铝三硅四都固定.
氯氮变价要注意 ,一二铜汞一三金.
二四碳铅二三铁, 二四六硫三五磷.
常见元素的主要化合价二:
氟氯溴碘负一价;正一氢银与钾钠.
氧的负二先记清;正二镁钙钡和锌.
正三是铝正四硅;下面再把变价归.
全部金属是正价;一二铜来二三铁.
锰正二四与六七;碳的二四要牢记.
非金属负主正不齐;氯的负一正一五七.
氮磷负三与正五;不同磷三氮二四.
硫有负二正四六;边记边用就会熟.
化合价口诀三:
一价氢氯钾钠银;二价氧钙钡镁锌,
三铝四硅五氮磷;二三铁二四碳,
二四六硫都齐;铜汞二价最常见.
常见根价口诀:
一价铵根硝酸根;氢卤酸根氢氧根.
高锰酸根氯酸根;高氯酸根醋酸根.
二价硫酸碳酸根;氢硫酸根锰酸根.
暂记铵根为正价;负三有个磷酸根.
化学反应方程式配平法
1 有机物反应,先看H右下角的数字,而无机物先看O的数字,一般是奇数的配2,假如不够可以翻倍
2 碳氢化合物的燃烧,先看H、C,再看O,它的生成物一般为水和二氧化碳
3 配平的系数如果有公约数要约分为最简数
4 电荷平衡,对离子方程式 在离子方程式中,除了难溶物质、气体、水外,其它的都写成离子形式,SO,(1)让方程两端的电荷相等
(2)观察法去配平水、气体
5 还有一些不用配平,注意先计算再看是否需要配平
常用的配平化学方程式的方法有:
1最小公倍数法:
在配平化学方程式时,观察反应前后出现”个数”较复杂的元素,先进行配平.先计算出反应前后该元素原子的最小公倍数,用填化学式前面化学计量数的方法,对该原子进行配平,然后观察配平其他元素的原子个数,致使化学反应中反应物与生成物的元素种类与原子个数都相等.
例如:教材介绍的配平方法,就是最小公倍数法.在P+O2――P2O5反应中先配氧:最小公倍数为10,得化学计量数为5与2,P+5O2――2P2O5;再配平磷原子,4P+5O2==2P2O5.
2观察法:
通过对某物质的化学式分析来判断配平时化学计量数的方法.
例如:配平Fe2O3+CO――Fe+CO2.在反应中,每一个CO结合一个氧原子生成CO2分子,而Fe2O3则一次性提供三个氧原子,因而必须由三个CO分子来接受这三个氧原子,生成三个CO2分子即Fe2O3+3CO――Fe+3CO2,最后配平方程式Fe2O3+3CO==2Fe+3CO2,这种配平方法是通过观察分析Fe2O3化学式中的氧原子个数来决定CO的化学计量数的,故称为观察法.
3奇数变偶数法:
选择反应前后化学式中原子个数为一奇一偶的元素作配平起点,将奇数变成偶数,然后再配平其他元素原子的方法称为奇数变偶数法.
例如:甲烷(CH4)燃烧方程式的配平,就可以采用奇数变偶数法:CH4+O2――H2O+CO2,反应前O2中氧原子为偶数,而反应后H2O中氧原子个数为奇数,先将H2O前配以2将氧原子个数由奇数变为偶数:CH4+O2――2H2O+CO2,再配平其他元素的原子:CH4+2O2==2H2O+CO2.
4归一法:
找到化学方程式中关键的化学式,定其化学式前计量数为1,然后根据关键化学式去配平其他化学式前的化学计量数.若出现计量数为分数,再将各计量数同乘以同一整数,化分数为整数,这种先定关键化学式计量数为1的配平方法,称为归一法.
例如:甲醇(CH3OH)燃烧化学方程式配平可采用此法:CH3OH+O2――H2O+CO2,显然决定生成H2O与CO2的多少的关键是甲醇的组成,因而定其计量数为1,这样可得其燃烧后生成H2O与CO2的分子个数:CH3OH+O2――2H2O+CO2.然后配平氧原子:CH3OH+3/2O2===2H2O+CO2,将各计量数同乘以2化分为整数:2CH3OH+3O2==4H2O+2CO2.
需要注意的是,不论用何种方法配平化学方程式,只能改动化学式前面的化学计量数,而决不能改动化学式中元素右下角的数字.因为改动元素符号右下角的数字即意味着改动反应物与生成物的组成,就可能出现根本不存在的物质或改变了原有化学变化的反应物或生成物,出现根本不存在的化学变化.
5电荷平衡法:这种方法对离子方程式最有用.在离子方程式中,除了难溶物质、气体、水外,其它的都写成离子形式,首先让方程两端的电荷相等,再用观察法去配平水、气体等.这种方法一般不失手.但对氧化还原方程式却太好用.
6氧化还原法:这种方法是针对氧化还原方程式来说的.在这里记住:“化合价升高失去氧化还原剂”.与之对应的是“化合价降低得到还原氧化剂”.具体用法是:
(1)在元素的化合价的变化的元素上部标出它的化合价,分清谁的升高,谁的降低.
(2)相同元素之间用线连起,找出并标上升高的电荷数或降低的电荷数.
(3)找最小公倍数,并分别乘在升高或降低的电荷数后.
(4)配平:把各自相乘的最小公倍数写在各自的化学式前(即系数).并注意这些化合价变化的元素在化学变化前后是否相等,一般来说,如果不相等,是整倍数地差.
(5)配合观察法,将其它的确良如水、生成的不溶物等配平.
7分数法配平
(1)首先在单质存在的一边中,选定一个比较复杂的化学式,假定此化学式的系数为1.
(2)在其他化学式前面分别配上一个适当的系数(可以是分数),把除单质元素以外的其他元素的原子数目配平.
(3)然后,在单质化学式前面配上适当的系数(可以是分数),把单质元素的原子数目配平.
(4)最后,把方程式中各化学式前的系数同时扩大适当的倍数,去掉各系数的分母,化学方程式就配平了.1年前查看全部
- 氧化还原反应(配平方程式)(1)_KNO3+_S+_C=_K2S+_CO2+_N2(2)_Br2+_CO3(2-)=_B
氧化还原反应(配平方程式)
(1)_KNO3+_S+_C=_K2S+_CO2+_N2
(2)_Br2+_CO3(2-)=_Br(-)+_BrO3(-)+_CO2
(3)_Cu2S+_H(+)+_HNO3(-)=_Cu(2+)+_NO+_S+_H2O
(4)_Fe+_NO2(-)+_OH(-)=_FeO2(2-)+_NH3+_H2O
(5)_P+_CuSO4+_H2O=_Cu3P+_H3PO4+_H2SO4 chihuan1年前9
chihuan1年前9 -
 怕怕的郁闷 共回答了13个问题
怕怕的郁闷 共回答了13个问题 |采纳率100%2KNO3+S+3C=K2S+3CO2+N2
3Br2+3CO3(2-)=5Br(-)+BrO3(-)+3CO2
3Cu2S+16H(+)+4NO3(-)=6Cu(2+)+4NO+3S+8H2O
3Fe+NO2(-)+5OH(-)=3FeO2(2-)+NH3+H2O
11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4
做的时候注意化学价的变化1年前查看全部
- SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平方程式,答案上另一种物质是氢气,可是为什么呢
SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平方程式,答案上另一种物质是氢气,可是为什么呢
怎么判断它能够生成氢气呢 低情商男生1年前1
低情商男生1年前1 -
 李博雅 共回答了19个问题
李博雅 共回答了19个问题 |采纳率78.9%SiHCl3中的H原子参与氧化还原反应,利用化合价的升降
根据氧化还原原理,Si的化合价升高,做还原剂,那么另一产物只能做氧化剂,
化合价应该降低,如果是生成Cl2的话,化合价由-1到0,升高了,不符合实际.
所以只能填H2.Si由+2到+4,H由+1到0
SiHCl3+3H2O==H2SiO3+3HCl+H21年前查看全部
- 用最小公倍数法配平方程式1.H2O2=H2O+O22.CAH2+2H2O=CA(OH)2+H23.KCLO3_KCH+3
用最小公倍数法配平方程式
1.H2O2=H2O+O2
2.CAH2+2H2O=CA(OH)2+H2
3.KCLO3_KCH+3O2
我不知道怎么看那个得失电子 duchunlei1年前3
duchunlei1年前3 -
 ilv_guo 共回答了25个问题
ilv_guo 共回答了25个问题 |采纳率92%1.h2o2中,o的化合价为-1,水中的o为-2,o2的化合价为0,所以o分别降低1个和升高1个电子,所以h2o和o2的o原子个数比为1:1,o2中有2个,h2o中有1个,所以h2o前配2,所以h2o2前配2.1年前查看全部
- 氧化还原反应以配平方程式FeS2+ O2 ----Fe2O3 + SO22 Cu+ HNO3(稀)---Cu(NO3)2
氧化还原反应以配平方程式
FeS2+ O2 ----Fe2O3 + SO2
2 Cu+ HNO3(稀)---Cu(NO3)2+ NO+ H2O
3 Cu+ HNO3(浓)---Cu(NO3)2+ NO2+ H2O
4 Cu2O+ HNO3(稀)---Cu(NO3)2+ NO+ H2O
5 FeBr2+ Cl2----FeBr3+ FeCl3 FeCl3+ Na2S----S+ FeS+ NaCl
6 Na2O2+ H2O— NaOH+ O2 KO2 + H2O— KOH+ O2
7 NH3+ O2----NO+ H2O NH3+ NO----N2+ H2O
8 NH3+ Cl2----N2+ NH4Cl NH3+ Cl2----N2+ HCl
9 KMnO4+ HCl--- KCl+ MnCl2+ Cl2+ H2O
10 Cu2S+ HNO3--- Cu(NO3)2+ NO+ H2O+ S
11 As2S3+ HNO3 + H2O+ ---- H2SO4+ H3AsO4 + NO
12 Fe3C+ HNO3 + H2O+ ---- CO2+ Fe(NO )3+ NO2
13 Cl2+ NaOH----NaCl+ NaClO3+ H2O
14 Fe(NO )3---- Fe2O3+ NO2+ O2
15 (NH4)2PtCl6---- Pt+ NH4Cl+ HCl+ N2
16 Ca(OH)+ S---CaSx+ CaS2O3+ H2O
17 C2H2+ KMnO4+ H2SO4-- K2SO4+ MnSO4+ HCOOH+ H2O
18 P+ CuSO4+ H2O----H3PO4+ Cu3P+ H2SO4
19 K2Cr2O7+ Fe3O4+ H2SO4----K2SO4+ Fe2(SO4)3+ Cr2(SO4)3+ H2O
20 H2S+ KMnO4+ H2SO4----S+ K2SO4+ MnSO4+ H2O
21 BaSO3+ HNO3 -----BaSO4+ NO+ H2O
22 Fe(OH)2+ HNO3 ----- Fe(NO )3+ NO+ H2O
23 FeS2+ HNO3 ----- Fe(NO )3+ S+ NO+ H2O
24 Zn+ HNO3----Zn(NO3)2+ N2O+ H2O
25 Zn+ HNO3----Zn(NO3)2+ NH4NO3+ H2O
26 FeSO4+ KNO3+ H2SO4---- K2SO4+ Fe2(SO4)3+ NO+ H2O
27 Na2B4O7+ NH4Cl----NaCl+ B2O3+ BN+ ( ) sun1881年前2
sun1881年前2 -
 小白兔痛扁大灰狼 共回答了23个问题
小白兔痛扁大灰狼 共回答了23个问题 |采纳率91.3%这问题和傻哎,如果有一个Fe反应,那当然在后面也会有一个铁出来,把2价电子和3价电子分开1年前查看全部
- 已知起氧化作用的HNO3和起还原作用的铁的物质的量之比3:4完成并配平方程式
已知起氧化作用的HNO3和起还原作用的铁的物质的量之比3:4完成并配平方程式
____ Fe + ____ HNO3=====_____ Fe(NO3)3 +____ N2O+ ___ H2O 放纵的自我1年前4
放纵的自我1年前4 -
 xyysusie 共回答了19个问题
xyysusie 共回答了19个问题 |采纳率78.9%8Fe + 30HNO3===== 8Fe(NO3)3 +3N2O+15H2O
HNO3的作用有氧化剂和酸的作用,被氧化的Fe和被还原的HNO3比为4:3=8(8Fe):3x2(3N2O)1年前查看全部
- 配平方程式,请写出具体步骤:H2O2+Cr2(SO4)3+KOH-K2CrO4+K2SO4+H20
 黑桃老King1年前1
黑桃老King1年前1 -
 aashyy 共回答了22个问题
aashyy 共回答了22个问题 |采纳率100%3 H2O2+ 1 Cr2(SO4)3+ 10 KOH = 2 K2CrO4+ 3 K2SO4+ 8 H20
根据化合价升降总和相等.
H2O2降1*2e-
Cr2(SO4)3升3*2e-1年前查看全部
- 写出下列方程式:(注明反应的条件,并配平方程式)
写出下列方程式:(注明反应的条件,并配平方程式)
①乙炔燃烧2C2H2+5O2
4CO2+2H2O点燃 .2C2H2+5O2
4CO2+2H2O点燃 .
②乙烯与水反应CH2=CH2+H2O
CH3CH2OH催化剂 CH2=CH2+H2O
CH3CH2OH催化剂
③乙烷与氯气生成一氯乙烷C2H6+Cl2
C2H5Cl+HCl光照 C2H6+Cl2
C2H5Cl+HCl光照
④1,3-丁二烯与氯气发生1,4-加成______
⑤CH3CH=CHCH3 加聚反应______. yigenahai1年前0
yigenahai1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- ( )C2H4+( )O2===( )H2O +( )CO2配平方程式
 moon16681年前1
moon16681年前1 -
 紅豆豆 共回答了21个问题
紅豆豆 共回答了21个问题 |采纳率90.5%C2H4+3O2=2H2O+2CO21年前查看全部
- 起还原作用的铁和起氧化作用的硝酸的物质的量之比为8:6 完成并配平方程式
起还原作用的铁和起氧化作用的硝酸的物质的量之比为8:6 完成并配平方程式
____ Fe + ____ HNO3=====_____ Fe(NO3)3 +____ ______+ ___ H2O 佳期兰渚东1年前1
佳期兰渚东1年前1 -
 寒琪2006 共回答了25个问题
寒琪2006 共回答了25个问题 |采纳率88%8Fe+30HNO3=8Fe(NO3)3+15H2O+3N2O1年前查看全部
- 化学方程式配平问题用代定系数法配平方程式:C2H2+O2~CO2+H2O 设C2H2前的化学计量数为a,O2前的化学计量
化学方程式配平问题
用代定系数法配平方程式:C2H2+O2~CO2+H2O 设C2H2前的化学计量数为a,O2前的化学计量数为b,CO2前的计量数为c,H2O前的计量数为d,根据质量守恒定律有:2a=c,2a=2d,2b=2c+d,怎样解此方程组?
 linowang1年前1
linowang1年前1 -
 mingyuanrack 共回答了15个问题
mingyuanrack 共回答了15个问题 |采纳率86.7%恩,将第三个式子里的c,d用a表示出来,再代入第三个式之中,解出b=5/2a.再将c=2a,d=a,b=5/2a代入方程,约去a,整数化,即可.1年前查看全部
- 请帮忙用完成以下化学的配平方程式.
请帮忙用完成以下化学的配平方程式.
①( )H2+( )N2------( )NH3
②( )Al+( )O2-------( )Al2O3
③( )Fe+( )O2--------Fe3O4
④( )P+( )O2------( )P2O5 bee12341年前4
bee12341年前4 -
 longhumen88 共回答了23个问题
longhumen88 共回答了23个问题 |采纳率82.6%①(3)H2+(1)N2==(2)NH3
②(2)Al+(3)O2==(2)Al2O3
③(3)Fe+(2)O2==(1)Fe3O4
④(4)P+(5)O2==(2)P2O51年前查看全部
- ( )NaOH+( )H2SO4=( )Na2SO4+( )H2O( )AL+( )=( )AL203的配平方程式 怎么
( )NaOH+( )H2SO4=( )Na2SO4+( )H2O( )AL+( )=( )AL203的配平方程式 怎么填呀
 huanghongyun1年前1
huanghongyun1年前1 -
 SMD638 共回答了17个问题
SMD638 共回答了17个问题 |采纳率88.2%(2 )NaOH+(1 )H2SO4=( 1)Na2SO4+(2 )H2O
(4)AL+( 3)O2=(2 )AL2031年前查看全部
- 配平方程式谢谢--FeCl3+ Cu---- FeCl2+ CuCl2 KMnO4+ HCl= KCl+ MnCl2+
配平方程式谢谢
--FeCl3+ Cu---- FeCl2+ CuCl2 KMnO4+ HCl= KCl+ MnCl2+ Cl2+ H2O S+ H2SO4= SO2+ H2O
Cu+ HNO3= Cu(NO3)2+ NO+ H2O
NO2+ H2O= NO+ HNO3 FeS2+ O2=Fe2O3+ SO2
NH3+ Cl2= N2+ NH4Cl Al+ Fe3O4= Al2O3+ Fe
C2H6O + O2=C2H4O+ H2O 天上天云1年前4
天上天云1年前4 -
 老砖 共回答了18个问题
老砖 共回答了18个问题 |采纳率94.4%2FeCl3+ Cu==2 FeCl2+ CuCl2
2KMnO4+ 16HCl= 2KCl+ 2MnCl2+ 5Cl2+ 8H2O
S+ 2 H2SO4= 3SO2+ 2H2O
3Cu+ 8 HNO3= 3 Cu(NO3)2+ 2 NO+ 4 H2O
3NO2+H20=2HNO3+NO
4FeS2+11O2=2Fe2O3+8SO2
8NH3+ 3Cl2== 6NH4Cl+N2
8Al+3Fe3O4=9Fe+4Al2O3
2C2H6O +O2=2C2H4O+2H2O1年前查看全部
- 配平方程式KMnO4+FeSO4+H2O=Fe(OH)3+MnO2+Fe2(SO4)3+K2SO4
 gnyin1年前2
gnyin1年前2 -
 layalei 共回答了19个问题
layalei 共回答了19个问题 |采纳率89.5%6KMnO4+18FeSO4+12H2O=8Fe(OH)3+6MnO2+5Fe2(SO4)3+3K2SO41年前查看全部
- 氧化还原反应如何配平方程式?举个例子
 zhangfagui1年前1
zhangfagui1年前1 -
 cockeye 共回答了18个问题
cockeye 共回答了18个问题 |采纳率100%万恶的氧化还原~
例:NH4NO3→N2+HNO3+H2O
方法:电子转移守恒
首先观察元素价态,NH4NO3中的氮有两个价态,分别是铵根中的-3和硝酸根中的+5,再看右边,N2中氮是0价,硝酸中试+5,而氧和氢左右价态一直没有改变,这既是说,这个氧化还原其实是氮的归宗反应
-3价到0价,升高3价;+5到0价降低5价;
3*5=5*3也就是说,有5个铵根被氧化就应该有3个硝酸根被还原
所以,NH4NO3配5,现在铵根有5个,硝酸根有5个,硝酸根多了2个
于是右边的硝酸就配2,到这里,电子就守恒了
再根据原子个数守恒,N2就配2,只剩下水了,还是根据原子个数,配9
这样就平了
5NH4NO3=2N2+2HNO3+9H2O
这个方法对所有氧化还原反应都实用,只要你记住一开始分析每个元素的化合价.再仔细根据升降平衡,问题就很简单了1年前查看全部
- 如何配平方程式,有什么方法?
 紫丁香_oo1年前1
紫丁香_oo1年前1 -
 相-思-比-梦-长 共回答了19个问题
相-思-比-梦-长 共回答了19个问题 |采纳率89.5%原子守恒、质量守恒,电子守恒1年前查看全部
- 算电子转移要配平方程式吗得失电子数是在方程式配平情况下才相等对吗还有电子转移和得失电子数有什么区别和联系啊
 wuquanxin1年前1
wuquanxin1年前1 -
 ID在ss被封了 共回答了23个问题
ID在ss被封了 共回答了23个问题 |采纳率87%是的,因为一方失去N个电子,另一方一定得到N个电子,所以要配平后才能算!
电子转移:特指电子从还原剂转移到氧化剂的过程!
得失电子数:是一种数目,指的是氧化剂的电子数和还原剂是电子数!1年前查看全部
- 如何用电子守恒法配平方程式
 岛内价电子商城1年前1
岛内价电子商城1年前1 -
 早熟6号 共回答了23个问题
早熟6号 共回答了23个问题 |采纳率87%反应中还原剂化合剂升高总数(失去电子总数)和氧化剂化合价降低总数(得到电子总数)相等, 反应前后各种原子个数相等. 下面常用配平方法 观察法 观察法适用于简单的氧化-还原方程式配平.配平关键是观察反应前后原子...1年前查看全部
- 化学氧化还原反应的内容,离子法配平方程式的方法和类型
 干扰来源1年前1
干扰来源1年前1 -
 nana1234 共回答了21个问题
nana1234 共回答了21个问题 |采纳率95.2%标出化学价,然后看得失电子数比,根据比例配平,主意电荷守恒,陪不平就补水1年前查看全部
- 写出并配平方程式如题,SO2与CaCO3和空气中的氧气相互作用,生成CaSO和CO2
 michaelliang1年前1
michaelliang1年前1 -
 xxsj121212 共回答了15个问题
xxsj121212 共回答了15个问题 |采纳率100%so2+CaCO3+O2=CaSO+CO2
不可能反应吧!全是得到电子,哪里来的啊?S有+4到0,O由0到-2,全是得到的电子.不可能啊!这个也不可能在空气中发生反应吧,除非有水,SO2先和O2氧化加水的H2SO4,再和CaCO3反应,但是结过也得不到CaSO啊!1年前查看全部
- 配平方程式 谢谢啦 1,( )C2H5OH+( )O2点燃( )CO2+( )H2O
配平方程式 谢谢啦 1,( )C2H5OH+( )O2点燃( )CO2+( )H2O
配平方程式 谢谢啦 1,( )C2H5OH+( )O2点燃( )CO2+( )H2O 2 ( ) KMnO4加热( )K2MnO4+( )MnO2+( )O2 3 ( )CuSO4+( )NaOH==( )Cu(OH)2+___(补充产物,并标明计量数) 庄伟荣1年前0
庄伟荣1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 用的反应化学公式再用之前要先配平方程式吗?
用的反应化学公式再用之前要先配平方程式吗?
例如电解水,为什么是2H2+O2 =2H2O,而不是H2+O2=H2O? 晓诗1年前1
晓诗1年前1 -
 yiyi61813 共回答了25个问题
yiyi61813 共回答了25个问题 |采纳率96%肯定了,这叫物质守恒!
比如
2H2+O2 =2H2O
反应式前面是四个H,两个O.后面也是四个H,两个O.
而对于
H2+O2=H2O
反应式前面是2个H,两个O,但是后面呢是2个H,一个O.
物质不守恒!1年前查看全部
大家在问
- 1一个长方形均匀铝箔纸怎样用天平和刻度尺测厚度?
- 2曾经沧海难为水………后面有一句话是这么说的,两情若是长久时又何必朝朝暮暮.请问各位大神谁能知道这个完整的一句话是怎么说的
- 3藻类苔藓蕨类的生活环境?形态结构?作用及关系?
- 4根据提供的两句话,续写第三句话并仿写第四句话。
- 5求以椭圆x2/8+y2/5=1的焦点为顶点,以椭圆的顶点为焦点的双曲线方程.
- 6菠菜与菠菜叶中的dna是一样的吗?如何用菠菜提取dna?
- 7为什么核外电子运动规律与物理学中的宏观物体的运动规律不一样
- 8bank note yields如何翻译?谢谢
- 9五年级班长竞选稿(100字) 我是才转来这个班的新生,所以还没当过这个班的班长!非常急!快一点!
- 10钝角在第三象限吗.为什么
- 11does she teacher us science哪错了
- 12what how感叹句后面不是 主语+谓语吗?为什么我见到一些感叹句 主语+谓语部分还有宾语啊?如 they give
- 13阅读下文,完成文后各题。(甲)旧历的年底毕竟最像年底,村镇上不必说,就在天空中也显出将到新年的气象来,灰白色的沉重的晚云
- 14(a²,a+1)与(1,b)关于x轴对称,求a,b值? (2a+3b,a-b)与(3,2b)关于y轴对称,求a
- 15英语翻译【摘要】21世纪开始,随着科技的快速发展,网络也越来越离不开人们的生活,Internet已渗入到我们社会生活的各