前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有多少种?)
 tellmetoread2022-10-04 11:39:541条回答
tellmetoread2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 阿村 共回答了13个问题
阿村 共回答了13个问题 |采纳率84.6%- 5
H Be O AI Ge - 1年前
相关推荐
- 前四周期中基态原子中未成对电子数最多的元素是什么?
前四周期中基态原子中未成对电子数最多的元素是什么?
如题. monica丽云1年前1
monica丽云1年前1 -
 netohot 共回答了15个问题
netohot 共回答了15个问题 |采纳率100%铬 Cr 有6个未成对电子1年前查看全部
- 下图中,a、b、c、d、e为元素周期表中前四周期的一部分元素,下列有关叙述正确的是( )
下图中,a、b、c、d、e为元素周期表中前四周期的一部分元素,下列有关叙述正确的是( )
a b c d e
A.元素b位于ⅥA族,有+6、-2两种常见化合价
B.五种元素中,元素e的性质最稳定
C.原子半径有d>c>b
D.元素e参与形成的化合物可以作为一种半导体材料 独旅1年前1
独旅1年前1 -
 dvb9059 共回答了17个问题
dvb9059 共回答了17个问题 |采纳率88.2%D
1年前查看全部
- (2012•泰州二模)已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.G的简单阴离子
 (2012•泰州二模)已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同;T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于原子晶体;在元素周期表中Z元素位于第10列.
(2012•泰州二模)已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同;T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于原子晶体;在元素周期表中Z元素位于第10列.
回答下列问题:
(1)Z的核外电子排布式是______.
(2)X以及与X左右相邻的两种元素,其第一电离能由小到大的顺序为______.
(3)QR2分子中,Q原子采取______杂化,写出与QR2互为等电子体的一种分子的化学式:______.
(4)分子式为Q2G6R的物质有两种,其中一种易溶于水,原因是______;T的氯化物的熔点比Y的氯化物的熔点高,原因是______.
(5)据报道,由Q、X、Z三种元素形成的一种晶体具有超导性,其晶体结构如右图所示.晶体中距每个X原子周围距离最近的Q原子有______个. queenying1年前1
queenying1年前1 -
 银色飞马 共回答了16个问题
银色飞马 共回答了16个问题 |采纳率87.5%解题思路:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.G的简单阴离子最外层有2个电子,则G为氢元素;Q原子最外层电子数是内层电子数的两倍,则Q原子有2个电子层,最外层电子数为4,故Q为碳元素;X元素最外层电子数与最内层电子数相同,原子序数大于碳元素,最外层电子数为2,应处于第三周期,故X为Mg元素;T2R的晶体类型是离子晶体,T为+1价、R为-2价,结合原子序数可知,T为Na元素、R为氧元素;Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于原子晶体,则Y为Si元素;在元素周期表中Z元素位于第10列,则Z为Ni元素,据此解答.G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.G的简单阴离子最外层有2个电子,则G为氢元素;Q原子最外层电子数是内层电子数的两倍,则Q原子有2个电子层,最外层电子数为4,故Q为碳元素;X元素最外层电子数与最内层电子数相同,原子序数大于碳元素,最外层电子数为2,应处于第三周期,故X为Mg元素;T2R的晶体类型是离子晶体,T为+1价、R为-2价,结合原子序数可知,T为Na元素、R为氧元素;Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于原子晶体,则Y为Si元素;在元素周期表中Z元素位于第10列,则Z为Ni元素,
(1)Z为Ni元素,原子核外电子数为28,Ni的核外电子排布式是:1s22s22p63s23p63d84s2,
故答案为:1s22s22p63s23p63d84s2;
(2)同周期自左而右第一电离能呈增大趋势,但Mg原子3s能级容纳两个电子,处于全满稳定状态,电子能量降低,第一电离能高于Al元素,故第一电离能Na<Al<Mg,
故答案为:Na<Al<Mg;
(3)CO2分子中碳原子成2个C=O双键,没有孤电子对,故碳原子采取sp杂化,CO2互为等电子体的一种分子的化学式:N2O(或CS2等),
故答案为:sp;N2O(或CS2等);
(4)分子式为C2H6O的物质有两种,其中一种易溶于水,该物质为乙醇,由于乙醇分子与水分子形成氢键,故易溶于水,
氯化钠属于离子晶体,四氯化硅属于分子晶体,离子晶体的熔点一般高于分子晶体,
故答案为:乙醇分子与水分子形成氢键;氯化钠属于离子晶体,四氯化硅属于分子晶体,离子晶体的熔点一般高于分子晶体;
(5)利用均摊法确定Q原子个数,每个X原子被两个晶胞共用,每个晶胞含有一个Q原子,所以晶体中距每个X原子周围距离最近的Q原子有2个,
故答案为:2.点评:
本题考点: 位置结构性质的相互关系应用;元素电离能、电负性的含义及应用;晶胞的计算;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查位置结构性质关系、核外电子排布规律、第一电离能、杂化理论、等电子体、晶体类型与性质、晶胞计算等,题目较为综合,推断元素是解题的关键,难度中等,旨在考查学生对基础知识的理解掌握.1年前查看全部
- 蚊子的奇怪姿势蚊子属于昆虫,有六条腿,蚊子落下后为什么只有前四条腿着地,而后两条腿向后上方反翘,姿势很特别,这是为什么呢
蚊子的奇怪姿势
蚊子属于昆虫,有六条腿,蚊子落下后为什么只有前四条腿着地,而后两条腿向后上方反翘,姿势很特别,这是为什么呢? 全能lily1年前4
全能lily1年前4 -
 亚皮 共回答了25个问题
亚皮 共回答了25个问题 |采纳率92%它翘起的两条腿是用来感知外界的危险的1年前查看全部
- 一个物体的初速度是2m/s.以0.5m/s的加速度做匀加速直线运动,求:1:物体在三秒末的速度.2:物体在前四...
一个物体的初速度是2m/s.以0.5m/s的加速度做匀加速直线运动,求:1:物体在三秒末的速度.2:物体在前四...
一个物体的初速度是2m/s.以0.5m/s的加速度做匀加速直线运动,求:1:物体在三秒末的速度.2:物体在前四秒的位移. sjb1234567891年前4
sjb1234567891年前4 -
 yng2449 共回答了22个问题
yng2449 共回答了22个问题 |采纳率81.8%1、Vt=Vo+at
=2+0.5×3m/s
=3.5m/s
2、S=Vot+at²/2
=2×4+0.5×4²/2m
=12m1年前查看全部
- [化学--选修物质结构与性质]已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大.其中A、C原
[化学--选修物质结构与性质]
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大.其中A、C原子的L层有2个未成对电子.D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构.F3+离子M层3d轨道电子为半满状态.请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出F原子的电子排布式______,F位于周期表______区.
(2)A、B、C的第一电离能由小到大的顺序为______.
(3)F和M(质子数为25)两元素的部分电离能数据列于下表:
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难.对此,你的解释是______、______;元素 M F 电能
(kJ•mol-1)I1 717 759 I2 1509 1561 I3 3248 2957
(4)已知F晶体的堆积方式与金属钾相同,则F晶胞中F原子的配位数为______,一个晶胞中F原子的数目为______.
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因______.熔点/K 沸点/K 标准状况时在水中的溶解度 H2S 187 202 2.6 H2C2 272 423 以任意比互溶  zhouzhou88411年前1
zhouzhou88411年前1 -
 花葬蝴蝶 共回答了20个问题
花葬蝴蝶 共回答了20个问题 |采纳率90%解题思路:A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大.
A、C原子的L层有2个未成对电子,为碳元素和氧元素,原子序数A<C,所以A为C元素,C为O元素;B的原子序数介于A与C之间,所以B为N元素;
D的二价阳离子与C的阴离子具有相同的电子层结构,D为Mg元素,D与E同主族,原子序数D<E,则E为Ca元素;
F3+离子M层3d轨道电子为半满状态,则F为Fe元素.A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大.A、C原子的L层有2个未成对电子,为碳元素和氧元素,原子序数A<C,所以A为C元素,C为O元素;B的原子序数介于A与C之间,所以B为N元素;
D的二价阳离子与C的阴离子具有相同的电子层结构,D为Mg元素,D与E同主族,原子序数D<E,则E为Ca元素;
F3+离子M层3d轨道电子为半满状态,则F为Fe元素.
即A为C元素,B为N元素,C为O元素,D为Mg元素,E为Ca元素,F为Fe元素.
(1)F为Fe元素,核内有26个质子,原子的电子排布式为1s22s22p63s23p63d64s2,位于d区.
故答案为:1s22s22p63s23p63d64s2;d.
(2)A为C元素,B为N元素,C为O元素,同周期元素从左到右元素的第一电离能逐渐减小,则C元素的最小,由于N的2p轨道电子为半充满状态,难以失去电子,第一电离能大于O,所以第一电离能从大到小的顺序为:N>O>C.
故答案为:N>O>C.
(3)F为Fe元素,M为Mn元素,Mn2+的3d轨道电子排布为半满状态较稳定,而Fe2+的3d轨道电子数为6,不是较稳定状态,所以气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.
故答案为:Mn2+的3d轨道电子排布为半满状态较稳定,而Fe2+的3d轨道电子数为6,不是较稳定状态.
(4)Fe晶体的堆积方式与金属钾相同,金属钾为体心立方结构,则Fe晶胞中Fe原子的配位数为8,;晶胞中F原子的数目为1+8×[1/8]=2.
故答案为:8;2.
(5)H2C2为H2O2,氧元素电负性很强,H2O2分子间存在氢键,所以熔沸点比H2S高;氧元素电负性很强,H2O2分子与水分子可形成氢键,所以与任意比互溶.
故答案为:氧元素电负性很强,H2O2分子间存在氢键,所以熔沸点比H2S高,H2O2分子与水分子可形成氢键,所以与任意比互溶.点评:
本题考点: 原子结构与元素周期律的关系;元素电离能、电负性的含义及应用;配合物的成键情况;金属晶体.
考点点评: 本题考查了电子排布式的书写、电离能大小的判断、氢键等知识点,难度较大,能根据构造原理书写电子排布式.1年前查看全部
- 在元素周期表中前四周期的五种元素的位置关系如图所示。若B元素的核电荷数为Z,则五种元素的核电荷数之和为
在元素周期表中前四周期的五种元素的位置关系如图所示。若B元素的核电荷数为Z,则五种元素的核电荷数之和为

A.5Z B.5Z+18 C.5Z+10 D.5Z+8  sam1012241年前1
sam1012241年前1 -
 雪南山 共回答了25个问题
雪南山 共回答了25个问题 |采纳率88%C
1年前查看全部
- W、X、Y、Z是元素周期表中前四周期元素,它们在周期表中的相对位置如图所示.下列有关叙述中不正确的是( )
 W、X、Y、Z是元素周期表中前四周期元素,它们在周期表中的相对位置如图所示.下列有关叙述中不正确的是( )
W、X、Y、Z是元素周期表中前四周期元素,它们在周期表中的相对位置如图所示.下列有关叙述中不正确的是( )
A.Z元素一定是金属元素
B.X、Y、W一定是主族元素
C.若Y的单质既能与强酸溶液反应又能与强碱溶液反应,则W为ⅡA元素
D.Z既可能在第三周期,也可能在第四周期 love宝LOVE1年前1
love宝LOVE1年前1 -
 幻神 共回答了14个问题
幻神 共回答了14个问题 |采纳率78.6%解题思路:W、X、Y、Z是元素周期表中前四周期元素,根据它们在周期表中的相对位置知X、Y、Z、W可能分别是H、Be、Al、Li元素,也可能是X位于第二周期的第IA、IIA、IIIA、IVA、VA、VI族元素,根据元素在周期表中的位置来分析解答.W、X、Y、Z是元素周期表中前四周期元素,根据它们在周期表中的相对位置知X、Y、Z、W可能分别是H、Be、Al、Li元素,也可能是X位于第二周期的第IA、IIA、IIIA、IVA、VA、VI族元素,
A.Z元素可能是非金属元素,如Kr元素,故A错误;
B.X、Y、W分别为第一周期和第二周期或第二、第三周期元素,所以它们一定是主族元素,故B正确;
C.若Y的单质既能与强酸溶液反应又能与强碱溶液反应,Y为Al元素,则W是Mg元素,W为ⅡA元素,故C正确;
D.如果X位于第一周期,则Z位于第三周期,如果X位于第二周期,则Z位于第四周期,故D正确;
故选A.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查了元素周期表和元素周期律的综合应用,同时考查学生对元素周期表结构的掌握、考查学生发散思维能力,采用假设方法进行分析解答,题目难度不大.1年前查看全部
- A、B、C、D、E、F、G、H八种前四周期元素,原子序数依次增大,化合物甲由A、D、E三种元素组成,常温下0.1mol/
A、B、C、D、E、F、G、H八种前四周期元素,原子序数依次增大,化合物甲由A、D、E三种元素组成,常温下0.1mol/L甲溶液的pH=13;B、F同主族,F是重要的半导体材料。G为前四周期单电子数最多的元素,H最外层电子数与G相同。
(1)G的元素符号是_________原子的价电子排布图为______________
(2)短周期元素I与F性质相似,晶体类型相同,基本单元如图所示,可表示为I 12 ,则其基本结构中含有正三角形的个数为____________
(3)C与其同族相邻元素J所形成的简单气态氢化物键角大小关系_______________(用 化学式表示)原因_____________________________
(4)B与D两元素组成的常见无机粒子中,其空间构型可能是 (填写序号)。
a.直线型 b.平面三角形 c.三角锥形 d.正四面体
(5)H原子晶体堆积模型为________________,若其密度为ρg/cm 3 阿伏伽德罗常数为N A ,求最近两个H原子间的距离为_________________pm(列出计算式) kdnrie1年前1
kdnrie1年前1 -
 Foolvia 共回答了14个问题
Foolvia 共回答了14个问题 |采纳率78.6%(1) Cr (1分) 3d 5 4s 1 (1分)
(2)20 (1分)
(3)NH 3 >PH 3 (1分) 原因:N中心原子的电负性大,使得NH 3 中成键电子对偏向中心原子N,则成键电子对间产生的斥力增大,键角增大。 (2分)
(4)ab (2分)
(5)面心立方最密堆积 (1分) 略 (1分)
1年前查看全部
- 周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,已知A原子2p轨道有3个未成对电子;化合物B 2 E
周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,已知A原子2p轨道有3个未成对电子;化合物B 2 E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期形成的单质中是最高的;F 2 + 核外各电子层电子均已充满。
根据以上信息回答下列问题:
(1)写出D原子核外电子排布式:____________________________________________。
(2)A、B、C、D的第一电离能由小到大的顺序为________________________________(用元素符号表示)。
(3)B的氯化物的熔点比D的氯化物的熔点________(填“高”或“低”);理由是_______________________________________________________。
(4)E的最高价氧化物分子的空间构型是________,是________(填“极性”或“非极性”)分子。
(5)E、F形成的某种化合物有如图所示的晶体结构:该化合物化学式为________;E原子配位数为________________________________________________。
 mmapplepopo1年前1
mmapplepopo1年前1 -
 yulong2006 共回答了24个问题
yulong2006 共回答了24个问题 |采纳率91.7%(1)1s 2 2s 2 2p 6 3s 2 3p 2 (2)Na<Al<Si<N
(3)高 NaCl是离子晶体,SiCl 4 是分子晶体
(4)平面正三角形 非极性 (5)ZnS 4
根据信息提示可知,元素A的原子核外电子排布为1s 2 2s 2 2p 3 ,故A为N;E元素原子核外电子排布为1s 2 2s 2 2p 6 3s 2 3p 4 ,故E为S;由C元素在地壳中的含量可知,C为Al;根据B 2 E为离子晶体,且B元素原子序数介于7与13之间,故B为Na;根据D单质的熔点特点可知,D为Si;F为Zn。(1)Si为第14号元素,核外电子排布式为1s 2 2s 2 2p 6 3s 2 3p 2 。(2)同周期元素第一电离能从左到右呈现逐渐增大的趋势,故第一电离能:Na<Al<Si<P,同主族元素从上到下则呈现逐渐减小的趋势,故第一电离能:P<N,因此第一电离能:Na<Al<Si<N。(3)NaCl为离子晶体,而SiCl 4 为分子晶体,故熔点:NaCl>SiCl 4 。(4)SO 3 分子的空间构型为平面正三角形,SO 3 具有很好的对称性,是非极性分子。(5)S原子居于晶胞的8个顶点和6个面心,故一个晶胞中含有的S原子数为8×1/8+6×1/2=4,Zn原子居于晶胞内部,Zn原子个数为4,故该化合物的化学式为ZnS;分析该晶胞结构可知,S原子的配位数为4。1年前查看全部
- (2013•南昌一模)[化学一-选修物质结构与性质]周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,
 (2013•南昌一模)[化学一-选修物质结构与性质]周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,已知A原子2P轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期形成的单质中是最高的;F2+离子核外各亚层电子均已充满.
(2013•南昌一模)[化学一-选修物质结构与性质]周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,已知A原子2P轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期形成的单质中是最高的;F2+离子核外各亚层电子均已充满.
根据以上信息回答下列问题:
(1)写出D原子核外电子排布式______;
(2)A、B、C、D的第一电离能由小到大的顺序为______;(用元素符号表示)
(3)B的氯化物的熔点比D的氯化物熔点______;(填“高”或“低”)理由是______;
(4)E的最高价氧化物分子的空间构型是______;是______分子;(填“极性”或“非极性”)
(5)E、F形成的某种化合物有如图所示的晶体结构:该化合物化学式为______;(a)中E原于配位数为______. sweet198509201年前1
sweet198509201年前1 -
 当风经过的时候 共回答了23个问题
当风经过的时候 共回答了23个问题 |采纳率82.6%解题思路:周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,A原子2P轨道有3个未成对电子,A原子核外电子排布式为1s22s22p3,则A是N元素;C元素是地壳中含量最高的金属元素,则C是Al元素;E原子核外的M层中只有两对成对电子,E原子核外电子排布式为1s22s22p63s23p4,E是S元素;化合物B2E的晶体为离子晶体,B显+1价为第IA族元素,B的原子序数大于N元素、小于Al元素,所以B是Na元素;结合原子序数可知D处于第三周期,D单质的晶体熔点在同周期形成的单质中是最高的,单质为原子晶体,所以D是Si元素;F2+离子核外各亚层电子均已充满,F原子序数大于S元素,则处于第四周期,F2+离子核外电子排布式为1s22s22p63s23p63d10,故F原子核外电子数为30,则F是Zn元素,据此解答.周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,A原子2P轨道有3个未成对电子,A原子核外电子排布式为1s22s22p3,则A是N元素;C元素是地壳中含量最高的金属元素,则C是Al元素;E原子核外的M层中只有两对成对电子,E原子核外电子排布式为1s22s22p63s23p4,E是S元素;化合物B2E的晶体为离子晶体,B显+1价为第IA族元素,B的原子序数大于N元素、小于Al元素,所以B是Na元素;结合原子序数可知D处于第三周期,D单质的晶体熔点在同周期形成的单质中是最高的,单质为原子晶体,所以D是Si元素;F2+离子核外各亚层电子均已充满,F原子序数大于S元素,则处于第四周期,F2+离子核外电子排布式为1s22s22p63s23p63d10,故F原子核外电子数为30,则F是Zn元素,
(1)D是Si元素,硅原子核外有14个电子,根据构造原理知,其基态原子核外电子排布式为:1S22S22P63S23P2,
故答案为:1S22S22P63S23P2;
(2)A、B、C、D分别是N、Na、Al、Si元素,同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,同一主族中,元素的第一电离能随着原子序数的增大而减小,所以第一电离能:Na<Al<Si<P,P<N,
所以这几种元素的第一电离能大小顺序是:Na<Al<Si<N,
故答案为:Na<Al<Si<N;
(3)B的氯化物是NaCl,D的氯化物是SiCl4,氯化钠是离子晶体,四氯化硅是分子晶体,离子晶体的熔点大于分子晶体,故答案为:高;NaCl是离子晶体,SiCl4是分子晶体;
(4)E是S元素,SO3分子S原子含有3个σ键且不含孤电子对,所以为平面正三角形结构,三氧化硫分子中正负电荷重心重合,为非极性分子,故答案为:平面正三角形; 非极性;
(5)①E是S元素,F是Zn元素,S原子个数=8×[1/8+6×
1
2]=4,Zn原子个数=4,所以该晶胞中S、Zn原子个数之比=4:4=1:1,所以其化学式为ZnS,故答案为:ZnS;
②根据图知,每个S原子连接4个Zn原子,所以其配位数是4,
故答案为:4.点评:
本题考点: 位置结构性质的相互关系应用;晶胞的计算.
考点点评: 本题考查了物质结构和性质,正确推断元素是解本题关键,利用均摊法、元素周期律等知识点来分析解答,难点是S原子配位数的判断,难度中等.1年前查看全部
- 前四周期电负性最小的元素是?
 nunuba1年前1
nunuba1年前1 -
 guoyong_tj 共回答了13个问题
guoyong_tj 共回答了13个问题 |采纳率84.6%电负性最小,当然是金属性最强的咯,那麼就是碱金属的K呗1年前查看全部
- a~e是元素周期表中前四周期元素,请根据表中信息回答下列问题:
 a~e是元素周期表中前四周期元素,请根据表中信息回答下列问题:
a~e是元素周期表中前四周期元素,请根据表中信息回答下列问题:
(1)a在周期表中的位置为______.元素 元素相关信息 a 其单质的熔点97.81℃,沸点882.9℃,在氧气中燃烧得到淡黄色固体 b 原子核外有7种运动状态不同的电子 c 电负性最大 d 一种核素的质量数为35,中子数为18 e 基态原子的核外电子排布中未成对的电子数最多
(2)b的基态原子中,有电子运动的原子轨道有______个,核外电子按能量不同可分为______种.
(3)用小黑点在图中标出b、c及其同周期相邻元素的第一电离能的相对位置,注明相应的元素符号(图中黑点为电负性最大的c).
(4)配合物甲由e3+与水分子、元素d构成,已知该配合物中e3+的配位数为6.在含有0.1mol甲的溶液中加入AgNO3溶液至过量,经过滤、洗涤、干燥后,得到28.7g白色沉淀.则甲的电离方程式为______. caxa9271年前1
caxa9271年前1 -
 dsfrhh 共回答了18个问题
dsfrhh 共回答了18个问题 |采纳率94.4%解题思路:a.单质熔点97.81℃,沸点882.9℃,在氧气中燃烧得到淡黄色固体,则a是Na元素;
b.原子核外有7种运动状态不同的电子,则b是N元素;
c.电负性最大的元素是F,则c是F;
d.一种核素的质量数为35,中子数为18,质子数为17,故d是Cl;
e.前四周期元素原子核外电子排布中未成对电子数最多的元素,故元素原子3d、4s均为半满,元素原子的价电子构型为3d54s1,则其基态原子的核外电子排布式[Ar]3d54s1,原子核外共24个电子,为Cr元素;据此解答各小题即可.a.单质熔点97.81℃,沸点882.9℃,在氧气中燃烧得到淡黄色固体,则a是Na元素;
b.原子核外有7种运动状态不同的电子,则b是N元素;
c.电负性最大的元素是F,则c是F;
d.一种核素的质量数为35,中子数为18,质子数为17,故d是Cl;
e.前四周期元素原子核外电子排布中未成对电子数最多的元素,故元素原子3d、4s均为半满,元素原子的价电子构型为3d54s1,则其基态原子的核外电子排布式[Ar]3d54s1,原子核外共24个电子,为Cr元素;
(1)a是Na,位于周期表中的位置第三周期IA族,故答案为:第3周期IA族;
(2)N原子的核外电子排布为:1s22s22p3,s轨道2个,p轨道3个,电子被分为三个能级,故答案为:5;3;
(3)b、c元素分别为N、F,其周期中元素相邻分别为C、O和Ne,由于非金属性越强,其第一电离能越大,且N元素的P轨道为半充满状态,故N比O的第一电离能要大,表现在图中,即: ,故答案为:
,故答案为: ;
;
(4)配合物甲由Cr3+与水分子、元素Cl构成,该配合物中Cr3+的配位数为6,在含有0.1mol甲的溶液中加入AgNO3溶液至过量,经过滤、洗涤、干燥后,得到28.7g白色沉淀,故氯化银的物质的量为:[28.7g/143.5g/mol]=0.2mol,故1mol甲中含有自由移动的氯离子为2mol,故甲的化学式为[Cr(H2O)5Cl]Cl2,其电离方程式为[Cr(H2O)5Cl]Cl2=[Cr(H2O)5Cl]2++2Cl-,故答案为:[Cr(H2O)5Cl]Cl2=[Cr(H2O)5Cl]2++2Cl-.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题主要考查的是元素的推断以及原子轨道、能级、离子方程式的有关计算等,综合性较强.1年前查看全部
- 【急!要前四单元的题目,越多越好,如果好的话就加分!【第一单元:勾股定理;第二单元:实数;第三单元:图形的平移和旋转第四
【急!
要前四单元的题目,越多越好,如果好的话就加分!
【第一单元:勾股定理;
第二单元:实数;
第三单元:图形的平移和旋转
第四单元:四边形性质搜索】 wyzlhy1年前1
wyzlhy1年前1 -
 605328 共回答了20个问题
605328 共回答了20个问题 |采纳率95%我们的也是人教版
为啥前四单元和你们不一样?
表示无能为力1年前查看全部
- (2010•宜宾模拟)如图为元素周期表前四周期的一部分,W、X、Y、Z是元素周期表中前四周期元素,它们在周期表中的相对位
 (2010•宜宾模拟)如图为元素周期表前四周期的一部分,W、X、Y、Z是元素周期表中前四周期元素,它们在周期表中的相对位置如表中所示.下列有关叙述中正确的是( )
(2010•宜宾模拟)如图为元素周期表前四周期的一部分,W、X、Y、Z是元素周期表中前四周期元素,它们在周期表中的相对位置如表中所示.下列有关叙述中正确的是( )
A.Z元素一定是金属元素
B.X、Y、W一定是主族元素
C.W的氢化物的沸点一定比X的氢化物的沸点高
D.Z既可能在三周期,也可能在四周期 ly04561年前1
ly04561年前1 -
 空木葬花 共回答了18个问题
空木葬花 共回答了18个问题 |采纳率94.4%解题思路:由于ⅡA、ⅢA族在周期表中不相邻,根据W、X、Y、Z在周期表中的位置可知,X不可能是处于第一周期,且四元素是元素周期表中前四周期元素,则X位于第二周期,W、Y处于第三周期,Z处于第四周期,且X、W至少从ⅢA族起,结合元素周期律及元素化合物性质解答.由于ⅡA、ⅢA族在周期表中不相邻,根据W、X、Y、Z在周期表中的位置可知,X不可能是处于第一周期,且四元素是元素周期表中前四周期元素,则X位于第二周期,W、Y处于第三周期,Z处于第四周期,且X、W至少从ⅢA族起,
A.X、W至少从ⅢA族起,Z处于第四周期,其最外层电子数大于4,Z一定为非金属性元素,可能为As、Se、Br等,故A错误;
B.X位于第二周期,W、Y处于第三周期,由在周期表中的位置可知,最外层电子数一定小于8,故一定为主族元素,故B正确;
C.X为N或O时,水分子之间、氨气分子之间都存在氢键,沸点高于W的氢化物,故C错误;
D.Z一定处于第四周期,故D错误,
故选:B.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查位置性质关系应用,难度中等,为易错题目,学生容易忽略ⅡA、ⅢA族在周期表中不相邻,注意整体把握元素周期表的结构.1年前查看全部
- A、B、C、D、E都是周期表中前四周期的元素.已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素
 A、B、C、D、E都是周期表中前四周期的元素.已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大.B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区.C元素原子的外围电子层排布式为nsn-1npn-1. D原子M能层为全充满状态,且最外层无成对电子,E为第四周期未成对电子数最多的元素.请回答下列问题:
A、B、C、D、E都是周期表中前四周期的元素.已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大.B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区.C元素原子的外围电子层排布式为nsn-1npn-1. D原子M能层为全充满状态,且最外层无成对电子,E为第四周期未成对电子数最多的元素.请回答下列问题:
(1)写出E基态原子的电子排布式______;E在周期表中的位置是______,其基态原子有______种能量不同的电子.
(2)某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了______.
(3)已知A和C形成的化合物X中每个原子的最外层均为8电子稳定结构,则X的化学式为______,X是一种超硬物质,耐磨损、抗腐蚀能力强,推测X的晶体类型为______.
(4)B的单质与A的最高价含氧酸的稀溶液反应,能将A还原至最低价态,写出该反应的化学方程式______.
(5)已知D晶体的粒子堆积方式为面心立方最密堆积,若该晶体中一个晶胞的边长为a cm,则D晶体的密度为[256a3NA  xinxin545201年前1
xinxin545201年前1 -
 只坚14持 共回答了23个问题
只坚14持 共回答了23个问题 |采纳率87%解题思路:A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,这说明A是N元素;
B的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区,所以B是Mg元素;
C元素原子的外围电子层排布式为nsn-1npn-1,s能级最多排列2个电子,所以n=3,则C是Si元素;
D原子M能层为全充满状态,且最外层无成对电子,则D是Cu元素;
E为第四周期未成对电子数最多的元素,则E是Cr元素.
(1)E是Cr元素,其原子核外有24个电子,根据构造原理书写Cr基态原子的电子排布式;
Cr在周期表中的位置是第四周期第VIB族,其基态原子有几种能级就有几种能量的原子;
(2)该排布图违反了能量最低原理;
(3)A是N元素、C是Si元素,A和C形成的化合物SiC中每个原子的最外层均为8电子稳定结构,则X的化学式为Si3N4,原子晶体熔沸点较高、硬度大,耐磨损、腐蚀;
(4)Mg的单质与N的最高价含氧酸的稀溶液硝酸反应,能将A还原至最低价态,为铵盐,根据反应物和生成物书写方程式;
(5)Cu晶体的粒子堆积方式为面心立方最密堆积,该晶胞中Cu原子个数=6×[1/2]+8×[1/8]=4,其晶胞体积V=a3cm3,其密度ρ=[m/V];
若Cu的原子半径为r,则Cu的体积为r3,由原子空间利用率进行计算.A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,这说明A是N元素;
B的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区,所以B是Mg元素;
C元素原子的外围电子层排布式为nsn-1npn-1,s能级最多排列2个电子,所以n=3,则C是Si元素;
D原子M能层为全充满状态,且最外层无成对电子,则D是Cu元素;
E为第四周期未成对电子数最多的元素,则E是Cr元素;
(1)E是Cr元素,其原子核外有24个电子,根据构造原理知Cr基态原子的电子排布式为1s22s22p63s23p63d54s1;
Cr在周期表中的位置是第四周期第VIB族,其基态原子有几种能级就有几种能量的原子,其原子核外有7种能级,所以有7种能量不同的电子,
故答案为:1s22s22p63s23p63d54s1;第4周期第ⅥB族;7;
(2)该排布图违反了能量最低原理,故答案为:能量最低原理;
(3)A和C形成的化合物X中每个原子的最外层均为8电子稳定结构,由于Si位于第ⅣA族,氮元素位于第ⅤA族,则X的化学式Si3N4;根据X的物理性质可知形成的晶体是原子晶体,
故答案为:Si3N4;原子晶体;
(4)氮元素的最低价是-3价,所以其还原产物是硝酸铵,则反应的化学方程式是4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O,
故答案为:4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O;
(5)Cu晶体的粒子堆积方式为面心立方最密堆积,该晶胞中Cu原子个数=6×[1/2]+8×[1/8]=4,其晶胞体积V=a3cm3,其密度ρ=[m/V]=
M
NA×4
Vg/cm3=[256
a3NAg/cm3;
根据晶胞结构可知,4r=
2a,解得a=2
2r,
则晶胞立方体的体积为a3=(2
2r)3,
晶胞中4个金属原子的体积为4×
4/3]r3,
所以此晶胞中原子空间占有率是
4×
4
3r3
(2
2r)3,
故答案为:[256
a3NA;
4×
4/3r3
(2
2r)3].点评:
本题考点: 晶胞的计算;位置结构性质的相互关系应用.
考点点评: 本题考查位置结构性质的相互关系及应用,涉及晶胞计算、构造原理、晶体类型判断等知识点,侧重考查分析、计算能力,难点是晶胞计算,特别是空间利用率的计算,题目难度中等.1年前查看全部
- 已知:X、Y、Z、W都是周期表中前四周期的元素,它们的核电荷数依次增大.X的简单阴离子最外层有2个电子,Y原子最外层电子
 已知:X、Y、Z、W都是周期表中前四周期的元素,它们的核电荷数依次增大.X的简单阴离子最外层有2个电子,Y原子最外层电子数是内层电子数的两倍,Z的原子序数是Y的两倍,在元素周期表中W元素位于第11列.
已知:X、Y、Z、W都是周期表中前四周期的元素,它们的核电荷数依次增大.X的简单阴离子最外层有2个电子,Y原子最外层电子数是内层电子数的两倍,Z的原子序数是Y的两倍,在元素周期表中W元素位于第11列.
回答下列问题:
(1)Z原子核外有______种不同运动状态的电子.
(2)X、Y、Z、W中,在周期表中位于p区的元素是______(填元素符号).
(3)W原子基态电子排布式为______.
(4)Z以及与Z左右相邻的两种元素,这三种元素第一电离能由大到小的顺序是______(填元素符号,用“>”表示).
(5)Y2X4分子中,Y原子采取______杂化,推算Y2X4分子中σ键与π键数目之比为______.
(6)据报道,由Y、Z、W三种元素形成的一种晶体具有超导性,其晶体结构如图.晶体中与每个W原子距离最近的Y原子有______个.
(7)直接蒸干WCl2溶液得不到WCl2晶体,而是得到黑色固体,请你结合化学用语给出简要解释______. tianling8461年前1
tianling8461年前1 -
 rr阿蒙 共回答了16个问题
rr阿蒙 共回答了16个问题 |采纳率75%解题思路:X、Y、Z、W都是周期表中前四周期的元素,它们的核电荷数依次增大.X的简单阴离子最外层有2个电子,则X为H元素,Y原子最外层电子数是内层电子数的两倍,Y原子只能有2个电子层,最外层电子数为4,则Y为C元素;Z的原子序数是Y的两倍,其原子序数为12,则Z为Mg,在元素周期表中W元素位于第11列,则W为Cu元素.X、Y、Z、W都是周期表中前四周期的元素,它们的核电荷数依次增大.X的简单阴离子最外层有2个电子,则X为H元素,Y原子最外层电子数是内层电子数的两倍,Y原子只能有2个电子层,最外层电子数为4,则Y为C元素;Z的原子序数是Y的两倍,其原子序数为12,则Z为Mg,在元素周期表中W元素位于第11列,则W为Cu元素,
(1)Z为Mg元素,原子核外有12个电子,核外有12种不同运动状态的电子,故答案为:12;
(2)H、C、Mg、Cu中,在周期表中位于p区的元素是C,故答案为:C;
(3)W为Cu,原子核外电子数为29,根据能量最低原理与洪特规则,原子基态电子排布式为1s22s22p63s23p63d104s1,故答案为:1s22s22p63s23p63d104s1;
(4)与Mg左右相邻的两种元素,为Na、Al,三种元素同周期,随原子序数增大元素第一电离能呈增大趋势,但Mg元素原子3s能级容纳2个电子,为全满稳定状态,能量较低,较难失去电子,第一电离能高于同周期相邻元素,故第一电离能Mg>Al>Na,
故答案为:Mg>Al>Na;
(5)C2H4分子中,C原子成3个σ键、不含孤对电子,杂化轨道数目为3,N原子采取sp2杂化,推算C2H4分子中有4个C-H、1个C=C双键,双键中含有1个σ键、1个π键,故C2H4分子中σ键与π键数目之比=5:1,
故答案为:sp2;1:5;
(6)W原子位于顶角上,晶体中与每个W原子距离最近的Y原子位于体心,每个W原子为8个晶胞共用,故与W原子距离最近的Y原子共用8个,
故答案为:8;
(7)CuCl2溶液中存在平衡:CuCl2+2H2O⇌Cu(OH)2+2HCl,加热蒸发,HCl挥发,促进水解彻底进行,得到Cu(OH)2,Cu(OH)2受热分解得到CuO,故得不到CuCl2晶体,而是得到黑色固体
故答案为:CuCl2溶液中存在平衡:CuCl2+2H2O⇌Cu(OH)2+2HCl,加热蒸发,HCl挥发,促进水解彻底进行,得到Cu(OH)2,Cu(OH)2受热分解得到CuO.点评:
本题考点: 位置结构性质的相互关系应用;晶胞的计算.
考点点评: 本题考查物质结构与性质,涉及核外电子排布、电离能、杂化轨道、化学键、晶胞结构、盐类水解等,题目比较综合,侧重对基础知识的巩固运用,推断元素是解题关键,难度中等.1年前查看全部
- 下图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题 (1)根据元素原子的外围电子排布特征,元
下图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题 
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,①元素位于周期表的________区。
(2)②、⑥两元素形成的化合物的空间构型为________,其中心原子的杂化轨道类型为________。
(3)写出元素⑧基态原子的电子排布式________________。
(4)⑧的二价阳离子与过量的④的氢化物的水化物作用的离子方程式为:________________________。
(5)元素⑦与CO可形成的X(CO) 5 型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为
103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于________晶体(填晶体类型)。
(6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH 3 间结合的作用力为________。
(7)金属⑦的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为________。
 快走开烦cc啦1年前1
快走开烦cc啦1年前1 -
 花无所依 共回答了17个问题
花无所依 共回答了17个问题 |采纳率100%(1)s
(2)平面正三角形;sp 2 杂化
(3)1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 或 [Ar] 3 d 10 4 s 1
(4)Cu 2+ +4NH 3 =[Cu(NH 3 ) 4 ] 2+
(5)分子晶体
(6)配位键
(7)2:11年前查看全部
- (2012•梧州模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大.其中A原子核外有三个未成
 (2012•梧州模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大.其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原予核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(2012•梧州模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大.其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原予核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的核外电子排布式是______,A、B、C、D的第一电离能由小到大的顺序为______.
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是______;
(3)A的最高价含氧酸根离子中,其中心原子采取______杂化,D的低价氧化物分子的空间构型是______.
(4)A、E形成某种化合物的晶胞结构如下图所示,则其化学式为______;(每个球均表示1个原子) yhlp_11261年前1
yhlp_11261年前1 -
 xiaolity 共回答了17个问题
xiaolity 共回答了17个问题 |采纳率100%解题思路:C元素是地壳中含量最高的金属元素,所以C是Al元素,D原予核外的M层中有两对成对电子,且D的原子序数大于C,所以D是S元素,E原子核外最外层只有1个电子,其余各层电子均充满,且E是前四周期的元素,E的原子序数大于16,所以Cu元素,A原子核外有三个未成对电子,且原子序数小于13,所以A是N元素,A与B可形成离子化合物B3A2,且B的原子序数大于A小于C,所以B是Mg元素.C元素是地壳中含量最高的金属元素,所以C是Al元素,D原予核外的M层中有两对成对电子,且D的原子序数大于C,所以D是S元素,E原子核外最外层只有1个电子,其余各层电子均充满,且E是前四周期的元素,E的原子序数大于16,所以Cu元素,A原子核外有三个未成对电子,且原子序数小于13,所以A是N元素,A与B可形成离子化合物B3A2,且B的原子序数大于A小于C,所以B是Mg元素.
(1)E的原子序数是29,为Cu元素,其原子核外电子排布式为:1s22s22p63s23p63d104s1,Mg、Al、S元素是同一周期元素,同一周期元素的第一电离能逐渐增大,但镁的第一电离能大于铝的第一电离能,同一主族的第一电离能随着原子序数的增大而减小,所以N元素的第一电离能大于P元素,P元素第一电离能大于S元素,所以Mg、Al、S、N元素的第一电离能由小到大的顺序为Al<Mg<S<N,
故答案为:1s22s22p63s23p63d104s1,Al<Mg<S<N;
(2)氯化镁是离子晶体,氯化铝是分子晶体,所以离子晶体的熔点远大于分子晶体的熔点,故答案为:氯化镁是离子晶体,氯化铝是分子晶体;
(3)NO3-中价层电子对=3+[1/2](5+1-3×2)=3,所以采取sp2杂化,D的低价氧化物是SO2,SO2的价层电子对=2+[1/2](6-2×2)=3,含有一个孤电子对,所以分子空间构型是V形,
故答案为:sp2,V形;
(4)该晶胞中白色球个数=[1/8×8=1,黑色小球个数=12×
1
4]=3,N元素形成的负价是-3价,所以该晶胞中含有3个亚铜离子1个N离子,所以其化学式为Cu3N,故答案为:Cu3N.点评:
本题考点: 原子结构与元素周期律的关系.
考点点评: 本题以元素的推断考查了分子空间构型的判断、原子的杂化方式的判断等知识点,注意同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA和第IIIA族、第VA族和第VIA族之间异常,为易错点.1年前查看全部
- 前四周期元素X,Y,Z,M,N原子序数依次增大,其中有两种是金属元素,X单质是密度最小的物质,Y原子最外层
前四周期元素X,Y,Z,M,N原子序数依次增大,其中有两种是金属元素,X单质是密度最小的物质,Y原子最外层
前四周期元素X、Y、Z、M、N原子序数依次增大,其中有两种是金属元素,X单质是密度最小的物质,Y原子最外层电子数是次外层的两倍,Z单质是大气中的一种气体,豆科植物常温下能将之转化为化合物.M元素的p电子总数比s电子总数多1,N是一种生命元素,人体缺少该元素会发生贫血,使人脸色萎黄.
请根据上述信息,回答下列问题:
(1)写出M原子基态电子排布式 .
(2)直线型分子Y2Z2中所有原子都达到8电子稳定结构,其中δ键、键之比是 .
(3)上述五种元素能形成的晶体类型有 (填编号).
①原子晶体②分子晶体③离子晶体④金属晶体
(4)已知:298 K时固体M在氧气中燃烧生成1 mol M203固体时,放出热量1676.2 kJ;固
体N在氧气中燃烧生成1 mol N304固体时,放出热量1118.4 kJ.请写出298 K时,由M
单质与Z304反应的热化学方程式:
(5)在沸水中加入N的某高价盐饱和溶液可以得到一种红褐色的液体,向该液体中逐滴加入含Z的最高价氧化物的水化物溶液直至过量的过程中发生的现象是____ . gzchenyx1年前2
gzchenyx1年前2 -
 wjt7 共回答了20个问题
wjt7 共回答了20个问题 |采纳率100%X单质是密度最小的物质,则X是H
Y原子最外层电子数是次外层的两倍,则Y是C
豆科植物常温下能将Z转化为化合物,所以Z是氮N
M元素的p电子总数比s电子总数多1,所以M是Al
人体缺少N元素会发生贫血,N是Fe
(1)1s2 2s2 2p6 3s2 3p1 或 [Ne] 3s2 3p1
(2)Y2Z2是(CN)2,即N≡C-C≡N,所以δ键、π键之比3︰4
(3)①②③④ ,举例子:金刚石,NH3,AlH3,Fe
(4)8 Al(s) + 3 Fe3O4(s) = 9 Fe(s) + 4 Al2O3(s);△H= -3349.6KJ/mol
(5)先出现沉淀,然后沉淀溶解 (先聚沉在中和溶解)1年前查看全部
- 下表为元素周期表中前四周期的部分元素(从左到右按原子序数递增排列,部分涉及到的元素未给出元素符号),根据要求回答下列各小
下表为元素周期表中前四周期的部分元素(从左到右按原子序数递增排列,部分涉及到的元素未给出元素符号),根据要求回答下列各小题:
(1)在以上表格中所有元素里基态原子的电子排布中4s轨道上只有1个电子的元素有______(填元素名称).
(2)根据元素原子的外围电子排布的特征,可将元素周期表前四周期元素分成4个区域,分别为s区、p区、d区、ds区,则属于s区的元素有______种,属于d区的元素有______种.第二周期元素中除Ne外电负性由高到低的三种元素依次是______,电离能由高到低的三种元素依次是______.
(3)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
回答下列问题:元素 Mn Fe 电离能
( kJ•mol-1)I1 717 759 I2 1509 1561 I3 3248 2957
Mn元素的电子排布式为______,
Fe2+的价电子排布图为______,
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是:______. luckly8001年前1
luckly8001年前1 -
 大眼睛卡通 共回答了18个问题
大眼睛卡通 共回答了18个问题 |采纳率94.4%解题思路:(1)基态原子的电子排布中4s轨道上只有1个电子的元素为:3d轨道上没有电子但4s轨道上有一个电子的元素、3d轨道上有5个电子且4s轨道上有1个电子的元素、3d轨道上有10个电子且4s轨道上有1个电子的元素;
(2)s区的元素为第IA、IIA族元素;d区的元素为除了第IB、IIB族元素外的过渡元素;同一周期元素中,元素的电负性随着原子序数的增大而增大;同一周期元素,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以电离能由高到低的;
(3)Mn元素的原子序数是24号元素,其原子核外有24个电子,根据构造原理书写其基态原子核外电子排布式;
过渡元素中,其价电子为3d和4s上电子,根据构造原理书写其价电子排布式;
原子轨道处于半满、全满、全空时能量更低稳定.(1)3d轨道上没有电子但4s轨道上有一个电子的元素为K、3d轨道上有5个电子且4s轨道上有1个电子的元素为Cr、3d轨道上有10个电子且4s轨道上有1个电子的元素为Cu,
故答案为:钾、铬、铜;
(2)s区的元素为第IA、IIA族元素,所以该周期表中属于s区的元素有:H、Li、Be、Na、Mg、K、Ca;
d区的元素为除了第IB、IIB族元素外的过渡元素,该周期表中有Sc Ti V Cr Mn Fe Co Ni,共8种元素;同一周期元素中,元素的电负性随着原子序数的增大而增大,所以二周期元素中电负性大小顺序是F、O、N;
同一周期元素,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以二周期元素中电离能由高到低的三种元素依次是:F、N、O,
故答案为:7;8;F、O、N;F、N、O;
(3)Mn元素的原子序数是24号元素,其原子核外有24个电子,根据构造原理书写其基态原子核外电子排布式为[Ar]3d54s2;
过渡元素中,其价电子为3d和4s上电子,亚铁离子核外有24个电子,根据构造原理知其价电子排布图为 ;
;
Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少;
故答案为:[Ar]3d54s2; ;由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少.
;由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查了元素周期表和元素周期律的综合应用,涉及核外电子排布式的书写、电负性大小的判断、第一电离能大小的判断等知识点,根据元素周期律来分析解答即可,题目难度不大.1年前查看全部
- A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.A原子核外电子分处三个不同能级,
 A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.A原子核外电子分处三个不同能级,且每个能级上排布的电子数相同;C原子p轨道上成对电子数等于未成对电子数;D是电负性最大的元素;E原子是元素周期表上第一个4S能级有两个电子的原子;F的核外电子数等于A、B、C、D的电子数之和.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.A原子核外电子分处三个不同能级,且每个能级上排布的电子数相同;C原子p轨道上成对电子数等于未成对电子数;D是电负性最大的元素;E原子是元素周期表上第一个4S能级有两个电子的原子;F的核外电子数等于A、B、C、D的电子数之和.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
(1)比较B、C的第一电离能:B______C(选填“<”或“>”),某元素形成的离子与单质B3互为等电子体,其化学式为______.
(2)将D的单质通入氢氧化钠溶液中,可得到CD2.CD2是一种无色、几乎无味的剧毒气体,可用于火箭工程助燃剂等.请回答下列问题:
①CD2中O原子的杂化轨道类型是______,CD2分子的空间构型为______.
②与H2O分子相比,CD2分子的极性更______(填“大”或“小”),原因是______.
(3)F元素原子的核外电子排布式是______;F的高价离子能与B的简单氢化物形成配位数为4的配离子的化学式为______.
(4)A和E形成的晶体结构如右图所示,其晶体的化学式是______;该晶体中化学键的类型是:______. Mourinho-ln1年前1
Mourinho-ln1年前1 -
 yimeng0202 共回答了16个问题
yimeng0202 共回答了16个问题 |采纳率81.3%解题思路:A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.A原子核外电子分处三个不同能级,且每个能级上排布的电子数相同,则A原子核外电子排布为1s22s22p2,则A为C元素;D是电负性最大的元素,则D为F元素;C原子p轨道上成对电子数等于未成对电子数,原子序数小于氟元素,故其外围分子排布为2s22p4,则C为O元素;B原子序数介于碳元素、氧元素之间,则B为N元素;E原子是元素周期表上第一个4s能级有两个电子的原子,则E为Ca元素;F的核外电子数等于A、B、C、D的电子数之和,则其核外电子数=6+7+8+9=30,则F为Zn元素,据此解答.A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.A原子核外电子分处三个不同能级,且每个能级上排布的电子数相同,则A原子核外电子排布为1s22s22p2,则A为C元素;D是电负性最大的元素,则D为F元素;C原子p轨道上成对电子数等于未成对电子数,原子序数小于氟元素,故其外围分子排布为2s22p4,则C为O元素;B原子序数介于碳元素、氧元素之间,则B为N元素;E原子是元素周期表上第一个4s能级有两个电子的原子,则E为Ca元素;F的核外电子数等于A、B、C、D的电子数之和,则其核外电子数=6+7+8+9=30,则F为Zn元素,
(1)N元素原子2p能级容纳3个电子,处于半满稳定状态,能量降低,第一电离能高于同周期相邻元素,故第一电离能N>O;某元素形成的离子与单质O3互为等电子体,其化学式为NO2-,
故答案为:>;NO2-;
(2)①OF2中O原子价层电子对数=2+[6−1×2/2]=4,氧原子含有2对孤对电子,故O原子采取sp3杂化,FO2分子为V型结构,
故答案为:sp3;V型;
②氧和氟的电负性差小于氧和氢的电负性差,故与H2O分子相比,OF2分子的极性更小,
故答案为:小;氧和氟的电负性差小于氧和氢的电负性差;
(3)F为Zn元素,原子核外有30个电子,故其核外电子排布式是1s22s22p63s23p63d104s2;F的高价离子为Zn2+,能与B的简单氢化物NH3形成配位数为4的配离子的化学式为[Zn(NH3)4]2+,
故答案为:1s22s22p63s23p63d104s2;[Zn(NH3)4]2+;
(4)C和Ca形成的晶体,根据其晶体结构可知,晶胞中Ca原子数目=1+12×[1/4]=4,C原子数目=2×8×[1/8]+2×6×[1/2]=8,Ca原子与C原子数目之比为4:8=1:2,故其化学式是CaC2,属于离子化合物,碳原子之间形成共价键,含有离子键、共价键,
故答案为:CaC2;离子键、共价键.点评:
本题考点: 位置结构性质的相互关系应用;晶胞的计算.
考点点评: 本题综合考查物质结构与性质,涉及核外电子排布规律、杂化理论与分子结构、电离能、电负性、配合物、晶胞计算等,难度中等,注意掌握利用均摊法进行晶胞计算,侧重对知识的运用,需要学生全面注意基础知识.1年前查看全部
- 前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有多少种
 华硕电脑1年前1
华硕电脑1年前1 -
 wangsg1234 共回答了17个问题
wangsg1234 共回答了17个问题 |采纳率94.1%H,c,o ,p,fe1年前查看全部
- X、Y、Z、W、R、Q是原子序数依次增大的前四周期的六种元素,元素X是周期表中原子半径最小的元素;Y、Z位于第二周期且Y
X、Y、Z、W、R、Q是原子序数依次增大的前四周期的六种元素,元素X是周期表中原子半径最小的元素;Y、Z位于第二周期且Y的第一电离能比Z大,Z原子的核外成对电子的数目是未成对电子数的3倍;W原子核外有16种运动状态不同的电子,R元素有一种质量数为56中子数为30的一种核素;Q在同周期主族元素中原子半径最小.请回答下列问题:
(1)Q位于元素周期表第______周期______族,Q的基态原子的核外电子排布式为______.
(2)Y、Z的简单气态氢化物中较稳定的是______(填化学式,下同),熔沸点较高的是______;Y、Z、W的简单阴离子半径从大到小的顺序是:______(用离子符号表示).
(3)X和Z、X和W均可形成具有18电子的分子,它们在溶液中反应后溶液会变浑浊,反应的化学方程式为______.
(4)由X、Y、Z、W和R五种元素组成的相对分子质量为392的化合物B,1mol B中含有6mol结晶水.对化合物B进行如下实验:
a.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体;一段时间白色沉淀变为灰绿色,最终变为红褐色.
b.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解.由实验a、b推知B的化学式为______. sunoliu1年前1
sunoliu1年前1 -
 adventurer 共回答了17个问题
adventurer 共回答了17个问题 |采纳率88.2%解题思路:X、Y、Z、W、R、Q是原子序数依次增大的前四周期的六种元素,元素X是周期表中原子半径最小的元素,则X为H元素;Y、Z位于第二周期且Y的第一电离能比Z大,Z原子的核外成对电子的数目是未成对电子数的3倍,原子核外电子排布为1s22s2p4,则Z为O元素,可推知Y为N元素;W原子核外有16种运动状态不同的电子,则W为S元素;R元素有一种质量数为56中子数为30的一种核素,质子数为56-30=26,则R为Fe;Q在同周期主族元素中原子半径最小,结合原子序数可知Q处于第四周期,则Q为Br,据此解答.X、Y、Z、W、R、Q是原子序数依次增大的前四周期的六种元素,元素X是周期表中原子半径最小的元素,则X为H元素;Y、Z位于第二周期且Y的第一电离能比Z大,Z原子的核外成对电子的数目是未成对电子数的3倍,原子核外电子排布为1s22s2p4,则Z为O元素,可推知Y为N元素;W原子核外有16种运动状态不同的电子,则W为S元素;R元素有一种质量数为56中子数为30的一种核素,质子数为56-30=26,则R为Fe;Q在同周期主族元素中原子半径最小,结合原子序数可知Q处于第四周期,则Q为Br,
(1)Q为Br元素,处于第四周期ⅦA族,其基态原子的核外电子排布式为 1s22s22p63s23p63d104s24p5,
故答案为:四、ⅦA;1s22s22p63s23p63d104s24p5;
(2)非金属性O>S,故氢化物稳定性H2O>H2S,水分子之间存在氢键,沸点高于硫化氢,电子层结构相同核电荷数越大,离子半径越小,电子层越多离子半径越大,故离子半径S2->N3->O2-,
故答案为:H2O;H2O;S2->N3->O2-;
(3)H与O、H与S均可形成18个电子的分子,分别为H2O2与H2S,H2O2具有强氧化性,与H2S反应生成S与H2O,反应方程式为:H2O2+H2S=S↓+2H2O,
故答案为:H2O2+H2S=S↓+2H2O;
(4)向B的溶液中加入过量浓NaOH溶液并加热,产生白色沉淀和无色有刺激性气味的气体,白色沉淀迅速变为灰绿色,最终变为红褐色,说明B中含有Fe2+和NH4+,另取少量B的溶液,向其中加入过量BaCl2溶液时产生白色沉淀,再加入稀盐酸沉淀不溶解,说明B中含有SO42-,结合B的相对分子质量和结晶水个数可知B的化学式为(NH4)2Fe(SO4)2•6H2O,
故答案为:(NH4)2Fe(SO4)2•6H2O.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题考查位置结构性质的关系及应用,涉及核外电子排布、元素周期律、氢键、半径比较、元素化合物推断等,需要学生具备扎实的基础,题目难度中等.1年前查看全部
- 初一(1)班的同学入学后,纷纷向班主任李老师要他家的电话号码,以方便联系。李老师幽默的说:“我家的电话是八位数,其中前四
初一(1)班的同学入学后,纷纷向班主任李老师要他家的电话号码,以方便联系。李老师幽默的说:“我家的电话是八位数,其中前四位数字相同,后四位数字是连续自然数,全部数字的和恰好等于号码的最后两位数。并且这个号码的后面五位数字也是连续自然数。”请问李老师家的电话号码是多少?
 circling1年前4
circling1年前4 -
 lianhai827 共回答了16个问题
lianhai827 共回答了16个问题 |采纳率75%88887654
由题意可设:此8位数为:A A A A (A-1) (A-2) (A-3) (A-4) ①
或者: A A A A (A+1) (A+2) (A+3) (A+4) ②
由①: A+A+A+...1年前查看全部
- (2011•安庆二模)元素X、Y、Z、W位于元素周期表中前四周期,原子序数依次增大.其相关信息如表:
(2011•安庆二模)元素X、Y、Z、W位于元素周期表中前四周期,原子序数依次增大.其相关信息如表:
请回答:元素 相 关 信 息 X 基态原子核外有三个能级,每个能级的电子数都相等 Y Y与Z不在同一周期,其原子核外未成对电子数比电子层数多1 Z 可与W形成两种化合物,且水溶液均呈酸性 W 是地壳中质量百分含量第二的金属元素
(1)W的基态原子核外电子排布式是______.Y单质分子中含______个π键,试比较Y与同周期相邻的两种元素的第一电离能大小关系______>______>______.(填元素符号)
(2)X与Z形成的最简单的化合物是一种优良的溶剂,它是由______(填“极性”、“非极性”) 键构成的______(填“极性”、“非极性”)分子
(3)一定条件下Z与Y可形成YZ3,YZ3与水反应可生成一种弱酸和一种弱碱,试写出该反应的方程式______.
(4)X所形成的一种晶体具有高硬度、高熔点特性,属于______(填“分子”、“原子”或“离子”)晶体,该晶体结构中X-X-X键角为______. qbdyjntm1年前1
qbdyjntm1年前1 -
 ypl2077 共回答了12个问题
ypl2077 共回答了12个问题 |采纳率100%解题思路:元素X、Y、Z、W位于元素周期表中前四周期,原子序数依次增大.X基态原子核外有三个能级,每个能级的电子数都相等,则其核外电子排布式为1s22s22p2,故X为碳元素;W是地壳中质量百分含量第二的金属元素,则W为Fe元素;Z可与W形成两种化合物,且水溶液均呈酸性,则Z为Cl;Y与Z不在同一周期,结合原子序数可知,Y处于第二周期,Y原子核外未成对电子数比电子层数多1,则未成对电子数为3,故其核外电子排布式为1s22s22p3,则Y为氮元素,据此解答.元素X、Y、Z、W位于元素周期表中前四周期,原子序数依次增大.X基态原子核外有三个能级,每个能级的电子数都相等,则其核外电子排布式为1s22s22p2,故X为碳元素;W是地壳中质量百分含量第二的金属元素,则W为Fe元素;Z可与W形成两种化合物,且水溶液均呈酸性,则Z为Cl;Y与Z不在同一周期,结合原子序数可知,Y处于第二周期,Y原子核外未成对电子数比电子层数多1,则未成对电子数为3,故其核外电子排布式为1s22s22p3,则Y为氮元素,
(1)W为Fe,原子核外有26个电子,其基态原子核外电子排布式是1s22s22p63s23p63d64s2.Y单质分子为N2,分子中形成N≡N三键,含2个π键.同周期自左而右元素第一电离能呈增大趋势,但N元素2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故元素第一电离能N>O>C,
故答案为:1s22s22p63s23p63d64s2;2;N;O;C;
(2)C与Cl形成的最简单的化合物是一种优良的溶剂为CCl4,为正四面体对称结构,是由极性键构成的非极性分子,
故答案为:极性;非极性;
(3)NCl3与水反应可生成一种弱酸和一种弱碱,生成NH3•H2O与HClO,反应方程式为NCl3+4H2O=NH3•H2O+3HClO,
故答案为:NCl3+4H2O=NH3•H2O+3HClO;
(4)C元素所形成的一种晶体具有高硬度、高熔点特性,属于原子晶体,该晶体结构每个C原子与周围4个C原子形成正四面体结构,C-C键角为109°28′,
故答案为:原子;109°28′.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题考查结构位置性质关系应用,涉及核外电子排布、电离能、分子结构与性质、晶体类型与结构等,难度中等,(3)中注意根据信息推断,实质发生水解反应.1年前查看全部
- (2012•合肥三模)已知A、B、C、D、E五种元素属于周期表中前四周期元素,其核电荷数依次增大.A原子 的2
(2012•合肥三模)已知A、B、C、D、E五种元素属于周期表中前四周期元素,其核电荷数依次增大.A原子 的2p轨道半充满;B单质在空气中燃烧,生成一种淡黄色固体;C元素是地壳中含量最 高的金属元素;D单质晶体的熔点在同周期元素形成的单质中最高;E原子核外最外层 电子数与B相同,内层均充满.根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为(用元素符号表示)______;E基态原子核外电子排布式为______.
(2)A、D的简单氢化物稳定性较大的为(用化学式表示,下同)______;B的氯化物熔点比D的氯化物熔点______(填高或低),理由是______.
(3)C的氧化物与B的最髙氧化物的水化物反应的离子方程式为______.
(4)火箭中常用A2H4作燃料,AO2作助燃剂,已知0.25molA2H4 (g)在AO2中燃烧生成 一种无污染的气体液态水,放出70.95kJ热量,则该反应的热化学方程式为______. swjtu9917331年前1
swjtu9917331年前1 -
 LY-泽uu萌芽 共回答了19个问题
LY-泽uu萌芽 共回答了19个问题 |采纳率78.9%解题思路:A、B、C、D、E五种元素属于周期表中前四周期元素,其核电荷数依次增大.A原子的2p轨道半充满,A原子核外电子排布为1s22s22p3,则A为氮元素;B单质在空气中燃烧,生成一种淡黄色固体,则B为Na元素;C元素是地壳中含量最高的金属元素,则C为Al元素;D单质晶体的熔点在同周期元素形成的单质中最高,其晶体为原子晶体,其原子序数大于Al元素、则D为Si元素;E原子核外最外层电子数与B相同,内层均充满,则E原子核外电子排布为1s22s22p63s23p63d104s1,E为Cu元素,据此解答.A、B、C、D、E五种元素属于周期表中前四周期元素,其核电荷数依次增大.A原子的2p轨道半充满,A原子核外电子排布为1s22s22p3,则A为氮元素;B单质在空气中燃烧,生成一种淡黄色固体,则B为Na元素;C元素是地壳中含量最高的金属元素,则C为Al元素;D单质晶体的熔点在同周期元素形成的单质中最高,其晶体为原子晶体,其原子序数大于Al元素、则D为Si元素;E原子核外最外层电子数与B相同,内层均充满,则E原子核外电子排布为1s22s22p63s23p63d104s1,E为Cu元素,
(1)同周期自左而右第一电离能呈增大趋势,同主族自上而下第一电离能减小,故第一电离能Na<Al<Si<N;E原子核外最外层电子数与Na相同,内层均充满,则E原子核外电子排布为1s22s22p63s23p63d104s1,
故答案为:Na<Al<Si<N;1s22s22p63s23p63d104s1;
(2)A、D的简单氢化物分别为NH3、SiH4,非金属性N>Si,故NH3更稳定;
B的氯化物为NaCl,D的氯化物为SiCl4,NaCl为离子晶体而SiCl4为分子晶体,故NaCl的熔点更高,
故答案为:NH3;高;NaCl为离子晶体而SiCl4为分子晶体;
(3)C的氧化物为Al2O3,B的最高氧化物的水化物为NaOH,二者反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)火箭中常用N2H4作燃料,NO2作助燃剂,0.25molN2H4 (g)在NO2中燃烧生成一种无污染的气体及液态水,应是氮气,放出70.95kJ热量,则2molN2H4 (g)反应放出的热量为70.95kJ×[2mol/0.25mol]=567.6kJ,故该反应的热化学方程式为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-567.6kJ/mol,
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-567.6kJ/mol.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题以元素推断为载体,考查结构位置性质关系、核外电子排布规律、元素周期律、晶体类型与性质、热化学方程式书写等,推断元素是解题关键,需要学生全面掌握基础知识,难度中等.1年前查看全部
- X Y Z W 均为周期表中前四周期元素 其原子序数依次增大 X2- 和Y+有相同的核外电子数
X Y Z W 均为周期表中前四周期元素 其原子序数依次增大 X2- 和Y+有相同的核外电子数
z的氢化物的沸点比起上一周期同族元素氢化物沸点低 W为金属元素 X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质 请说明X Y Z W 分别是什么 山西广鑫1231年前3
山西广鑫1231年前3 -
 展翼高飞 共回答了20个问题
展翼高飞 共回答了20个问题 |采纳率90%X:O Y:Na Z:Cl W:Mn1年前查看全部
- (13分)下表为元素周期表中前四周期的部分元素(从左到右按原子序数递增排列,部分涉及到的元素未给出元素符号),根据要求回
(13分)下表为元素周期表中前四周期的部分元素(从左到右按原子序数递增排列,部分涉及到的元素未给出元素符号),根据要求回答下列各小题:

(1)在以上表格中所有元素里基态原子的电子排布中4s轨道上只有1个电子的元素有 (填元素名称)。
(2)根据元素原子的外围电子排布的特征,可将元素周期表前四周期元素分成4个区域,分别为s区、p区、d区、ds区,,则属于s区的元素有_______种,属于d区的元素有_______种。第二周期元素中除Ne外电负性由高到低的三种元素依次是_______,电离能由高到低的三种元素依次是_______。
(3)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:回答下列问题:元素 Mn Fe 电离能
( kJ·mol-1)I1 717 759 I2 1509 1561 I3 3248 2957
Mn元素的电子排布式为____________________________________,
Fe 2+ 的电子排布图为__________________________
比较两元素的I 2 、I 3 可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个 电子难。对此,你的解释是:_____________________________ 磊子ii1年前1
磊子ii1年前1 -
 江苏ssrr 共回答了28个问题
江苏ssrr 共回答了28个问题 |采纳率92.9%(1)钾、铬、铜(3分)。(各1分,错一个,扣一个正确,扣完为止)
(2)7种,(1分)8种。(1分)
氯、硫、磷, (1分)氯、磷、硫。(1分)(顺序答反不得分)
(3)1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 ,1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 (2分)
由Mn 2+ 转化为Mn 3+ 时,3d能级由较稳定的3d 5 半充满状态转为不稳定的3d 4 状态需要的能量较多;而Fe 2+ 到Fe 3+ 时,3d能级由不稳定的3d 6 到稳定的3d 5 半充满状态,需要的能量相对要少。(2分)
(1)考查元素周期表的结构和原子核外电子的排布规律。根据构造原理可知4s轨道上只有1个电子的元素是K、Cr和 Cu。
(2)除ds区外,区的名称来自于构造原理最后填入电子的能级的符号,即s区包括第IA和ⅡA,共2列。p区包括第ⅢA到第 Ⅶ A 以及0族,共6列。D区包括第3列到第10列,共8列。ds区包括第11和12列,共2列。非金属性越强,电负性越大,第一电离能也越大,非金属性是Cl>S>P,所以电负性是Cl>S>P。由于P原子的3p轨道属于半充满,属于第一电离能是Cl>P>S。
(3)根据构造原理可以写出锰元素的电子排布,即1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 ,Fe 2+ 的电子排布图为1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 。由于Mn 2+ 的3d轨道属于半充满,比较稳定,所以再失去1个电子所需要的能量就高。而Fe 2+ 的3d轨道上有6个电子,Fe 3+ 的3d轨道上有5个电子,属于不充满比较稳定,因此3d能级由不稳定的3d 6 到稳定的3d 5 半充满状态,需要的能量相对要少。1年前查看全部
- [化学选修-物质结构与性质](13分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中
[化学选修-物质结构与性质](13分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F 3+ 离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)A的氢化物的分子空间构型是 ,其中心原子采取 杂化,属于 ( 填“极性分子”和“非极性分子”)。
(3)F和M(质子数为25)两元素的部分电离能数据列于下表:比较两元素的I 2 、I 3 可知,气态M 2 + 再失去一个电子比气态F 2 + 再失去一个电子难。对此,你的解释是 ;元素 M F 电离能
(kJ·mol - 1 )I 1 717 759 I 2 1509 1561 I 3 3248 2957
(4)晶体熔点:DC EC(填“<、=、>”),原因是 。
(5)H 2 S和C元素的氢化物(分子式为H 2 C 2 )的主要物理性质比较如下:H 2 S和H 2 C 2 的相对分子质量基本相同,造成上述物理性质差异的主要原因 ?熔点/K 沸点/K 标准状况时在水中的溶解度 H 2 S 187 202 2.6 H 2 C 2 272 423 以任意比互溶
(6)已知某化合反应,在反应过程中只有σ键的断裂与生成,写出符合要求的化学方程式
(写一个)。 1只特立独行的猪1年前1
1只特立独行的猪1年前1 -
 独剑舞孤影 共回答了19个问题
独剑舞孤影 共回答了19个问题 |采纳率94.7%(1)C<O<N(2分)
(2)正四面体 sp 3 杂化 非极性分子 (3分)
(3)Mn 2+ 的3d轨道电子排布为半满状态较稳定 (2分)
(4)> MgO与CaO都为离子晶体,Mg 2+ 半径小于Ca 2+ ,则MgO的晶格能大于CaO,所以熔点高 (2分)
(5)H 2 O 2 分子间存在氢键(1分),与水分子可形成氢键(1分)。
(6)略 (2分)
略1年前查看全部
- 已知:A、B、C、D、E为周期表中前四周期的五种元素,它们的原子序数依次增大.A的基态原子有3个不同的能级,各能级中电子
已知:A、B、C、D、E为周期表中前四周期的五种元素,它们的原子序数依次增大.A的基态原子有3个不同的能级,各能级中电子数相等;B的基态原子2p能级上的未成对电子数与A原子的相同;B2-离子与 C2+离子具有相同的稳定电子层结构;D有“生物金属”之称,D4+离子和氩原子的核外电子排布相同;E的基态原子的价电子排布式为3d84s2.
请回答下列问题:

(1)A、B、C三种元素的电负性由大到小的顺序是______(填元素符号).
(2)在D的单质晶体中,原子的堆积方式与Mg同,则其堆积方式是______,D原子的配位数是______.
(3)氢气是理想的清洁能源,E元素与镧(La)元素的合金可作储氢材料,该合金的晶胞如上图所示,晶胞中心有一个E原子,其他E原子都在晶胞面上,则该晶体的化学式为______.已知该晶体的密度为d g•cm-3,其晶胞的边长为a cm,则该物质的摩尔质量是______.(阿伏伽德罗常数用NA表示) xlx36361年前0
xlx36361年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2014•安徽三模)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加.相关信息如表所示,根据推
(2014•安徽三模)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加.相关信息如表所示,根据推断回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)C在周期表中位于第______周期第______族,E基态原子核外电子排布式是______A A的最高价氧化物对应的水化物化学式为H2AO3 B B元素的第一电离能比同周期相邻两个元素都大 C C原子在同周期原子中半径最大(稀有气体除外),其单质焰色为黄色 D D的基态原子最外层电子排布式为3s23p2 E E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满
(2)A、B、D三种元素电负性由大到小排列顺序为______,其中A的最高价氯化物构成晶体的微粒间作用力为______
(3)A和B的最简单氢化物中较稳定的是______(填化学式).B的最简单氢化物和E的黑色氧化物固体在加热时可反应,写出其反应方程式3CuO+2NH3
N2+3Cu+3H2O△ .3CuO+2NH3
N2+3Cu+3H2O△ .
(4)E的单质和过氧化氢在稀硫酸中可反应,有人将这个反应设计成原电池,请写出正极反应方程式______
(5)煤燃烧产生的烟气中有B的氧化物,会引起严重的环境问题,因此,常用AH4催化还原以消除污染,已知:
AH4(g)+2BO2(g)═B2(g)+AO2(g)+2H2O(g)△H1=-867kJ/mol
2BO2(g)⇌B2O4(g)△H2=-56.9kJ/mol
写出AH4和B2O4反应的热化学方程式______. lyjandhope1年前1
lyjandhope1年前1 -
 wubihan 共回答了17个问题
wubihan 共回答了17个问题 |采纳率82.4%解题思路:A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加,C原子在同周期原子中半径最大(稀有气体除外),其单质焰色为黄色,则C为Na;A的最高价氧化物对应的水化物化学式为H2AO3,最高正价为+4,原子序数小于Na,故A为碳元素;B的原子序数介于碳、氧之间,则B为N元素,第一电离能高于碳、氧;D的基态原子最外层电子排布式为3s23p2,则D为Si;E与C位于不同周期,原子序数对C(Na),则E处于第四周期,E原子核外最外层电子数与C相同,其余各层电子均充满,原子核外电子数=2+8+18+1=29,则E为Cu,据此解答.A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加,C原子在同周期原子中半径最大(稀有气体除外),其单质焰色为黄色,则C为Na;A的最高价氧化物对应的水化物化学式为H2AO3,最高正价为+4,原子序数小于Na,故A为碳元素;B的原子序数介于碳、氧之间,则B为N元素,第一电离能高于碳、氧;D的基态原子最外层电子排布式为3s23p2,则D为Si;E与C位于不同周期,原子序数对C(Na),则E处于第四周期,E原子核外最外层电子数与C相同,其余各层电子均充满,原子核外电子数=2+8+18+1=29,则E为Cu,
(1)C为Na,在周期表中位于第三周期第ⅠA族,E为Cu,基态原子核外电子排布式是:1s22s22p63s23p63d104s1,
故答案为:三、ⅠA;1s22s22p63s23p63d104s1;
(2)C、N、Si同周期,随原子序数增大电负性增大,同主族自上而下电负性减小,故电负性由大到小顺序为:N>C>Si,其中A的最高价氯化物为CCl4,形成分子晶体,构成晶体的微粒间作用力为:范德华力,
故答案为:N>C>Si;范德华力;
(3)非金属性C<N,故最简单氢化物中NH3较稳定,氨气与CuO反应生成Cu氮气与水,其化学反应方程式 为:3CuO+2NH3
△
.
N2+3Cu+3H2O,
故答案为:NH3;3CuO+2NH3
△
.
N2+3Cu+3H2O;
(4)Cu的单质和过氧化氢在稀硫酸中可反应,正极发生还原反应,过氧化氢在正极获得电子,在氢离子参与反应下生成水,正极电极反应式为:H2O2+2e-+2H+=2H2O,
故答案为:H2O2+2e-+2H+=2H2O;
(5)已知:①、CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol
②、2NO2(g)⇌N2O4(g)△H2=-56.9kJ/mol
由盖斯定律,①-②得:CH4(g)+N2O4(g)═N2(g)+CO2(g)+2H2O(g)△H=-810.1kJ/mol,
故答案为:CH4(g)+N2O4(g)═N2(g)+CO2(g)+2H2O(g)△H=-810.1kJ/mol.点评:
本题考点: 位置结构性质的相互关系应用;不同晶体的结构微粒及微粒间作用力的区别;热化学方程式.
考点点评: 本题考查结构性质位置关系应用,题目比较综合,涉及核外电子排布、电负性、原电池、热化学方程式等,侧重考查学生对知识的迁移应用,难度中等.1年前查看全部
- 在元素周期表中的前四周期,两两相邻的五种元素如图所示.若B元素的核电荷数为a,则五种元素的核电荷总数之和可能为( )
在元素周期表中的前四周期,两两相邻的五种元素如图所示.若B元素的核电荷数为a,则五种元素的核电荷总数之和可能为( )
①5a、②5a+18、③5a+10、④5a+8.
 A. 只有①、③
A. 只有①、③
B. 只有①
C. 只有③
D. 全部 kxwlxl1年前2
kxwlxl1年前2 -
 浪迹oo-33 共回答了15个问题
浪迹oo-33 共回答了15个问题 |采纳率86.7%解题思路:由四种元素在周期表中的位置可知,D、B、E分别在周期表的第二、三、四周期,根据同主族元素的原子序数的差值可解答该题.由四种元素在周期表中的位置可知,D、B、E分别在周期表的第二、三、四周期,若B元素的核电荷数为a,
则A的原子序数为a-1,C的原子序数为a+1,D的原子序数为a-8,E的原子序数为a+18,
则五种元素的核电荷总数之和为a+a-1+a+1+a-8+a+18=5a+10,
故选C.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题考查元素周期表知识,题目难度不大,本题注意把握元素周期表的结构特点,为常考查的知识,注意把握元素周期表的组合规律.1年前查看全部
- 现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总
现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:
(1)写出C、D、E三种原子第一电离能由大到小的顺序为______.
(2)A原子与B、C、D原子形成最简单化合物的稳定性由强到弱的顺序为______,根据价层电子对互斥理论预测BA 2 D的分子构型为______.
(3)某蓝色晶体,其结构特点是X 2+ 、X 3+ 离子分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个BC - .与A同族且相差两个周期的元素R的离子位于立方体的恰当位置上.根据其结构特点可知该晶体的化学式为(用最简正整数表示)______
(4)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如右图所示),其中3种离子晶体的晶格能数据如下表:
根据表格中的数据:判断KCl、MgO、TiN 三种离子晶体熔点从高到低的顺序是______.MgO晶体中一个Mg 2+ 周围和它最邻近且等距离的O 2- 有______个.离子晶体 NaCl KCl CaO 晶格能/kJ•mol -1 786 715 3401
(5)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V 2 O 5 和Cr 2 O 3 中,适合作录音带磁粉原料的是______.
 yhbjxww1年前1
yhbjxww1年前1 -
 sahtj 共回答了18个问题
sahtj 共回答了18个问题 |采纳率88.9%根据B的s能级上电子总数等于p能级上电子总数的2倍,则电子排布式为:1s 2 2s 2 2p 2 ,故为C,B、C、D、E、A五种非金属元素原子半径依次减小,,则为同周期,故B为N,C为O,D为F,A为H,
(1)同周期从左到右第一电离能依次增大,但是在第ⅤA族的氮原子,p轨道上半充满状态稳定,不易失去电子,故答案为:F>N>O;
(2)C、N、O原子的得电子能力O>N>C,得电子能力越强,其氢化物的稳定性越强,根据价层电子对互斥理论,NH 2 O的中心原子的杂化方式为sp 2 杂化,为平面三角形,故答案为:H 2 O>NH 3 >CH 4 ;平面三角形;
(3)X原子的M能层上有4个未成对电子,则电子排布式为:1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 ,故为Fe,BC - 为CN - ,与A同族且相差两个周期的元素R即为Na,根据立方体结构,每个晶胞中含有钠、铁、和氢氰根的个数为:1、2、6,分子式为:NaFe 2 (CN) 6 ,故答案为:NaFe 2 (CN) 6 ;
(4)晶格能越大则晶体熔点越高,则TiN>MgO>KCl,MgO晶体类型为立方体,其中一个Mg 2+ 周围和它最邻近且等距离的O 2- 有6个,故答案为:TiN>MgO>KCl;6;
(5)金属铬离子比钒离子Cr 2 O 3 含未成对电子多,则磁性大,磁记录性能越好,故答案为:Cr 2 O 3 .1年前查看全部
- 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是
同一周期的非金属元素.化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为.
(2)B的氢化物的分子空间构型是.其中心原子采取杂化.
(3)写出化合物AC2的电子式;一种由B、C组成的化合物与AC2互为等电子体,其化学式为.
(4)E的核外电子排布式是,ECl3形成的配合物的化学式为.
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是. 流离态1年前1
流离态1年前1 -
 liulifei0601234 共回答了18个问题
liulifei0601234 共回答了18个问题 |采纳率100%E为Cr
B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高,它们为N,O,F中的两个
AC₂为非极性分子,A,B,C为同一周期的非金属元素,C为O,A为C; B只能是N
化合物DC的晶体为离子晶体,D只能是Mg或Ca; D的二价阳离子与C的阴离子具有相同的电子层结构.D是Mg
(1) 第一电离能由小到大的顺序为:C < O < N
(2) NH₃三角椎形; N:sp³杂化
(3) :O::C::O:(氧上还有一对电子,不好敲,请自己画)
CO₂有6+8*2 = 22个电子,N₂O与CO₂互为等电子体
(4) 1s² 2s² 2p⁶ 3s² 3p⁶ 3d⁵ 4s¹
Cr[(NH₃)₄(H₂O)₂]Cl₃
(5)
4Mg+10HNO₃(极稀)=4Mg(NO₃)₂+NH₄NO₃+3H₂O1年前查看全部
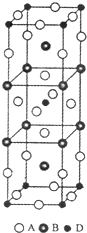
- 前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子总数相差为8
 前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子总数相差为8;与B位于同一周期的C和D,它们的价电子层排布中未成对电子数分别为4和2,且原子序数相差为2.
前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子总数相差为8;与B位于同一周期的C和D,它们的价电子层排布中未成对电子数分别为4和2,且原子序数相差为2.
回答下列问题:
(1)D2+的价层电子排布图为______.
(2)四种元素中第一电离能最小的是______,电负性最大的是______(填元素符号).
(3)A、B和D三种元素组成的化合物的一个晶胞如图所示.则该化合物的化学式为______;
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有______;该化合物中存在一个复杂离子,该离子的化学式为______,配体是______. fish1671年前1
fish1671年前1 -
 吾之最爱 共回答了14个问题
吾之最爱 共回答了14个问题 |采纳率100%解题思路:前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有一个,并且A-和B+的电子数相差为8,A属于第VIIA族元素,B属于第IA族元素,且A的原子序数小于B,则A是F元素,B是K元素;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2,且C和D的原子序数大于B,C的原子序数小于D,则C是Fe元素,D是Ni元素,结合物质结构和性质解答.前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有一个,并且A-和B+的电子数相差为8,A属于第VIIA族元素,B属于第IA族元素,且A的原子序数小于B,则A是F元素,B是K元素;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2,且C和D的原子序数大于B,C的原子序数小于D,则C是Fe元素,D是Ni元素,
(1)D2+的价层电子为3d电子,根据能量最低原理、保里不相容原理及洪特规则知,其价电子排布图为 ,
,
故答案为 ;
;
(2)元素的金属性越强其第一电离能越小,元素的非金属性越强,其电负性越大,这四种元素中金属性最强的是K元素,非金属性最强的元素是F,所以第一电离能最小的是K,电负性最大的是F,
故答案为:K;F;
(3)该晶胞中A原子个数=16×
1
4+4×
1
2+2=8,B原子个数=8×[1/4]+2=4,D原子个数=8×[1/8]+1=2,所以该化合物的化学式为K2NiF4,故答案为:K2NiF4;
(4)A-、B+和C3+三种离子组成的化合物的K3FeF6,该物质中阴阳离子间存在离子键,铁原子和氟原子间存在配位键,该化合物中存在一个复杂离子,该离子的化学式为[FeF6]3-,配位体是F-,故答案为:离子键和配位键;[FeF6]3-;F-.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题考查物质结构和性质,正确推断元素是解本题关键,难度中等,注意化学式的确定中,各中原子被几个晶胞共用,为易错点,难点是(3)的计算.1年前查看全部
- 现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总
 现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:
现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:
(1)写出C、D、E三种原子第一电离能由大到小的顺序为______.
(2)A原子与B、C、D原子形成最简单化合物的稳定性由强到弱的顺序为______,根据价层电子对互斥理论预测BA2D的分子构型为______.
(3)某蓝色晶体,其结构特点是X2+、X3+离子分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个BC-.与A同族且相差两个周期的元素R的离子位于立方体的恰当位置上.根据其结构特点可知该晶体的化学式为(用最简正整数表示)______
(4)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如右图所示),其中3种离子晶体的晶格能数据如下表:
根据表格中的数据:判断KCl、MgO、TiN 三种离子晶体熔点从高到低的顺序是______.MgO晶体中一个Mg2+周围和它最邻近且等距离的O2-有______个.离子晶体 NaCl KCl CaO 晶格能/kJ•mol-1 786 715 3401
(5)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和Cr2O3中,适合作录音带磁粉原料的是______. 清浅一笑1年前1
清浅一笑1年前1 -
 八省巡按 共回答了21个问题
八省巡按 共回答了21个问题 |采纳率85.7%解题思路:(1)同周期从左到右第一电离能依次增大,但是在第ⅤA族出现特殊性;
(2)原子的得电子能力越强,其氢化物的稳定性越强;
(3)立方体的每条棱上的一个BC-被两个晶胞分摊,X2+、X3+离子分别占据立方体互不相邻的顶点,每个顶点被4个.晶胞分摊,立方体体心处的离子占整个晶胞;
(4)晶格能越大则晶体熔点越高,MgO晶体类型为立方体,其中一个Mg2+周围和它最邻近且等距离的O2-有6个;
(5)金属铬离子含未成对电子多,则磁性大,磁记录性能越好.根据B的s能级上电子总数等于p能级上电子总数的2倍,则电子排布式为:1s22s22p2,故为C,B、C、D、E、A五种非金属元素原子半径依次减小,则为同周期,故B为C,C为O,D为F,A为H,
(1)同周期从左到右第一电离能依次增大,但是在第ⅤA族的氮原子,p轨道上半充满状态稳定,不易失去电子,故答案为:F>N>O;
(2)C、N、O原子的得电子能力O>N>C,得电子能力越强,其氢化物的稳定性越强,根据价层电子对互斥理论,CH2O的中心原子的杂化方式为sp2杂化,为平面三角形,故答案为:H2O>NH3>CH4;平面三角形;
(3)X原子的M能层上有4个未成对电子,则电子排布式为:1s22s22p63s23p63d64s2,故为Fe,BC-为CN-,与A同族且相差两个周期的元素R即为Na,根据立方体结构,每个晶胞中含有钠、铁、和氢氰根的个数为:1、2、6,分子式为:NaFe2(CN)6,故答案为:NaFe2(CN)6;
(4)晶格能越大则晶体熔点越高,则TiN>MgO>KCl,MgO晶体类型为立方体,其中一个Mg2+周围和它最邻近且等距离的O2-有6个,故答案为:TiN>MgO>KCl;6;
(5)金属铬离子比钒离子Cr2O3含未成对电子多,则磁性大,磁记录性能越好,故答案为:Cr2O3.点评:
本题考点: 原子结构与元素的性质;元素电离能、电负性的含义及应用;晶体的类型与物质熔点、硬度、导电性等的关系;晶胞的计算.
考点点评: 本题是一道结构化学模块知识题目,综合性较强,难度较大.1年前查看全部
- (2013•黄山三模)W、X、Y、Z是元素周期表中前四周期的四种元素,它们的原子序数依次递增.请结合下表中的信息,回答下
(2013•黄山三模)W、X、Y、Z是元素周期表中前四周期的四种元素,它们的原子序数依次递增.请结合下表中的信息,回答下列问题:
(1)Z位于元素周期表第______周期第______族;W的第一电离能比其同周期相邻的元素______(填“低”、“高”、“不确定”);X元素的基态原子价电子排布式______.W 基态原子核外有三个能级,P级能电子处在半充满状态 X 常见的金属,在周期表中的中期序数与族序数相等 Y 气态氢化物及其最高价氧化物对应的水化物均为强酸 Z 存在总质量数为56,中子数为30的核数
(2)W、X、Y三种元素的简单离子半径的大小关系是______(请用离子符号表示).
(3)Y的气态氢化物的沸点是同族元素形成的气态氢化物中最______(填高或低);原因是______.
(4)Z元素存在多种氧化物,X的单质与Z2O3反应是快速制取Z单质的常用方法,已知每转移1mol电子,放出aKJ热量,请写出上述反应的热化学方程式:2Al(s)+Fe2O3(s)
AL2O3(s)+2Fe(s)△H=-6aKJ/mol高温 .2Al(s)+Fe2O3(s).
AL2O3(s)+2Fe(s)△H=-6aKJ/mol高温 .
(5)可以利用W的氢化物在一定条件下,使空气污染物之一的WO2转化为参与大气循环的物质.请写出一个符合上述条件的反应方程:______. Irene_琳琳1年前1
Irene_琳琳1年前1 -
 _小_七 共回答了17个问题
_小_七 共回答了17个问题 |采纳率88.2%解题思路:四种短周期元素W、X、Y、Z的原子序数依次增大,W元素基态原子核外有三个能级,P级能电子处在半充满状态,因为1s22s22p3则W为氮元素;X常见的金属,在周期表中的周期序数与族序数相等,则X为Al元素;Y气态氢化物及其最高价氧化物对应的水化物均为强酸,故Y为Cl元素;Z存在总质量数为56,中子数为30的核数,原子序数为26,则Z为Fe元素,据此解答.四种短周期元素W、X、Y、Z的原子序数依次增大,W元素基态原子核外有三个能级,P级能电子处在半充满状态,因为1s22s22p3则W为氮元素;X常见的金属,在周期表中的周期序数与族序数相等,则X为Al元素;Y气态氢化物及其最高价氧化物对应的水化物均为强酸,故Y为Cl元素;Z存在总质量数为56,中子数为30的核数,原子序数为26,则Z为Fe元素,据此解答.
(1)铁位于元素周期表第四周期第Ⅷ族;同一周期第一电离能从左向右整体增大,但第ⅡA>ⅢA,ⅤA>ⅥA特殊,所以N的第一电离能比其同周期相邻的元素O高,
Al元素的基态原子价电子排布式为:3S23P1
故答案为:四,Ⅷ,高,3S23P1
(2)根据电子层数越大半径越大,电子层数相同时,核电荷数越大,半径越小,可以判断W、X、Y三种元素的简单离子半径的大小关系是C1->N3->AL3+
故答案为:C1->N3->Al3+
(3)氯的同族有F、Cl、Br、I,其氢化物的沸点与有没有氢键和相对分子质量有关,在同族里只有HF分子间存在氢键故HF沸点最高,其余看相对分子质量,HCl的相对分子质量最小,所以最低,故答案为:低,HF分子间存在氢键,其余分子间作用力都比HCL大;
(4)根据热化学方程式的书写步骤①写化学方程式②标状态③计算△H,根据每转移1mol电子,放出aKJ热量则热化学方程式为:2Al(s)+Fe2O3(s)
高温
.
AL2O3(s)+2Fe(s)△H=-6a KJ/mol,故答案为:2Al(s)+Fe2O3(s)
高温
.
AL2O3(s)+2Fe(s)△H=-6a KJ/mol
(5)根据反应前后原子守恒及其信息转化为参与大气循环的物质,则方程式为:6NO2+8NH3=7N2+12H2O,故答案为:6NO2+8NH3=7N2+12H2O.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题考查结构性质位置关系、沸点比较、元素化合物性质等,难度中等,推断元素是解题关键.1年前查看全部
- (2012•开封一模)已知:A-F都是周期表中前四周期的元素,它们的原子序数依次增大.其中A、C原子的L层有2个未成对电
(2012•开封一模)已知:A-F都是周期表中前四周期的元素,它们的原子序数依次增大.其中A、C原子的L层有2个未成对电子.D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构.F3+离子的M层3d轨道电子为半充满状态.请根据以上信息,回答下列问题:(答题时,用所对应的元素符号表示)
(1)A、B、C的电负性由小到大的顺序为______.
(2)D元素的原子核外共有______种不同运动状态的电子、______种不同能级的电子.
(3)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因是______.AC2中心原子的杂化方式为______,某离子与AC2互为等电子体,且能用于鉴别F3+,写出该离子的电子式______.熔点 沸点 标准状况时在水中的溶解度 H2S 187 202 2.6 H2C2 272 423 以任意比互溶
(4)写出E的电子排布式:______.
(5)F和X(质子数为25)两元素的部分电离能数据列于表:
比较两元素的I2、I3可知,气态X2+再失去一个电子比气态F2+再失去一个电子难.对此,你的解释是______.元素 X F 电离能kJ•mol-1 I1 717 759 I2 1509 1561 I3 3248 2957  2006lb1年前0
2006lb1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 已知A、B、C、D、E、F都是周期表中前四周期的元素。它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与
已知A、B、C、D、E、F都是周期表中前四周期的元素。它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F 3+ 离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出C原子的价层电子排布图 ,F位于周期表 区。
(2)A、B、C的第一电离能由小到大的顺序为 。(写元素符号)
(3)F和质子数为25的M的部分电离能数据列于下表
比较两元素的I 2 、I 3 可知,气态M 2+ 再失去一个电子比气态F 2+ 再失去一个电子难。对此,你的解释是 。元素 M F 电离能(kJ·mol -1 ) I 1 717 759 I 2 1509 1561 I 3 3248 2957
(4)晶胞中F原子的配位数为 ,若F原子的半径为rcm,则F晶体的密度为 (用含r的表达式表示),该晶胞中原子空间利用率为 。
(5)H 2 S和C元素的氢化物(分子式为H 2 C 2 的主要物理性质比较如下
H 2 S和H 2 C 2 的相对分子质量基本相同,造成上述物理性质差异的主要原因 。熔点/K 沸点/K 标准状况时在水中的溶解度 H 2 S 187 202 2.6 H 2 C 2 272 423 比任意比互溶  猫咪仔1年前1
猫咪仔1年前1 -
 ahuaxuan 共回答了13个问题
ahuaxuan 共回答了13个问题 |采纳率92.3%1年前查看全部
- D的基态原子在前四周期元素的基态原子中单电子最多D是什么元素?
 枪手771年前1
枪手771年前1 -
 rr等于狗 共回答了27个问题
rr等于狗 共回答了27个问题 |采纳率88.9%B Al都是基态原子中单电子最多的元素1年前查看全部
- (14分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对
(14分)
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F 3 + 离子M层3d轨道电子为半满状态。
请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出A、B、C三种元素电负性由大到小的顺序 。
(2)由A、B、C和氢四种元素组成的某种离子晶体,1mol该晶体含有配位键2mol,该晶体的化学式是 。
(3)F和Mn(锰)两元素的部分电离能数据列于下表:预测a b(填“大于”、“小于”、“等于”),理由是
元素 Mn F 电离能
( )
)I 1 717 759 I 2 1509 1561 I 3 a b
(4)AC 2 分子中σ键和π键数目比为 ;
(5)H 2 S和C元素的氢化物(分子式为H 2 C 2 )的主要物理性质比较如下:
H 2 S和H 2 C 2 的相对分子质量基本相同,造成上述物理性质差异的主要原因是:熔点/K 沸点/K 标准状况时在水中的溶解度 H 2 S 187 202 2.6 H 2 C 2 272 423 以任意比互溶
② 熔点、沸点差异的主要原因
②在水中的溶解度差异的主要原因 西湖二集1年前1
西湖二集1年前1 -
 粗茶淡饭920 共回答了28个问题
粗茶淡饭920 共回答了28个问题 |采纳率92.9%(14分)每空2分(1)O>N>C (2)(NH 4 ) 2 CO 3
(3)大于 ;锰离子的3d轨道电子排布为半满状态,较稳定。 (4) 1:1
(5)①过氧化氢分子之间存在氢键 ②过氧化氢分子与水分子之间可以形成氢键
1年前查看全部
- (14分) X、Y、Z、W是元素周期表中前四周期四种常见的元素。已知:W基态原子有7个轨道填充了电子;Y与Z原子最外层的
(14分)
X、Y、Z、W是元素周期表中前四周期四种常见的元素。已知:W基态原子有7个轨道填充了电子;Y与Z原子最外层的电子数相同,但Y的原子半径比Z小;ZY 2 和Y 3 都具有漂白性,它们分子的空间构型都是V型;X的合金在生活中有非常广泛的用途,X分别与Y、Z形成化合物甲、乙,在甲、乙中X的质量分数分别为72.4%和63.64%;丙是由X、Y、Z三种元素组成的一种常见的还原剂,在溶液中反应1个阳离子失去1个电子。
(1)W基态原子的最外层(价层)的电子排布式为 ;X 3+ 最外层电子数为 ;Y、Z、W三种单质与Y、W两元素形成的化合物四种物质的熔点从高到低的排序是 。(填化学式)
(2)写出在溶液中,丙与酸性高锰酸钾反应的离子方程式: 。
(3)检验ZY 2 的方法是(写出操作步骤和实验现象) 。
(4)高温下甲与W单质剧烈反应。在25℃、101kPa下测得每转移3mol e - 放热416.4kJ该反应的热化学方程式是 。 hsbhsb7701年前1
hsbhsb7701年前1 -
 wbb1984 共回答了24个问题
wbb1984 共回答了24个问题 |采纳率91.7%(1)3s 2 3p 1 、13(各1分共2分)、Al 2 O 3 、 、 Al 、S、 O 2 (或O 3 ) (3分)
(2)8H + +5Fe 2+ +MnO 4 - =4H 2 O+5Fe 3+ +Mn 2+ (3分)
(3)方法一:将气体通入品红溶液,溶液褪色,然后加热,溶液又现红色;方法二:将气体通入溴水,溴水褪色,再向溶液中滴入BaCl 2 溶液,有白色沉淀产生。(2分)(其他答案合理也可得分)(4)3Fe 3 O 4 (s)+8Al(s)=" 4" Al 2 O 3 (s)+9 Fe (s);∆=-3331.2kJ/mol(4分)
S、p能级分别有一个、三个轨道,现W基态原子有7个轨道填充了电子,则1s2s2p3s共6个轨道填满了电子,3p只能有一个电子,所以W为Al ,最外层电子排布为3s 2 3p 1 ;Y与Z原子最外层的电子数相同,说明同主族又Y的原子半径比Z小且ZY 2 和Y 3 都具有漂白性,它们分子的空间构型都是V型,推知Y、Z分别为O 、S;X的合金在生活中有非常广泛的用途,X分别与O、S形成化合物甲、乙,丙是由X、Y、Z三种元素组成的一种常见的还原剂,在溶液中反应1个阳离子失去1个电子,推知X为Fe不是Al,Fe 3+ 最外层电子数为13,Fe 2+ 可被MnO 4 - 氧化。n(Fe)/n(O)=" 72.4/56:27.6/16=3/4" ,甲为Fe 3 O 4 ;n(Fe)/n(S)=63.64/56:36.36/32=1:1,乙为FeS;丙是FeSO 4 。Y、Z、W三种单质与Y、W两元素形成的化合物四种物质分别为O 2 (或O 3 ) 、 、S、Al、Al 2 O 3 ,其中Al 2 O 3 为原子晶体熔点最高,Al为金属晶体熔点次之,O 2 (或O 3 ) 、 、S为分子晶体,熔点从高到低的排序是Al 2 O 3 、 、 Al 、S、 O 2 (或O 3 ),SO 2 的检验可用品红溶液或用溴水(或氯水)将其氧化为SO 4 2- ,再检验SO 4 2- 即可,高温下甲与W单质剧烈反应。在25℃、101kPa下测得每转移3mol e - 放热416.4kJ,则生成9 mol Fe转移24mol e - ,放热3331.2kJ。1年前查看全部
- 英语老师特别烦我在我们班英语算好的从没出过前四,自从换了老师以后她就老看不惯我,虽然我上课不听讲但我的成绩依然不变还更好
英语老师特别烦
我在我们班英语算好的从没出过前四,自从换了老师以后她就老看不惯我,虽然我上课不听讲但我的成绩依然不变还更好了.她上课老讲语法太烦,我一般都凭语感来,这次快生物会考了我上课写生物.她就当着全班的面讽刺我说什么我要是NB就考个六级,卧槽,我忍了她太久了,这次我真的生气了,怎么办 gch3151年前1
gch3151年前1 -
 蓝草天空 共回答了21个问题
蓝草天空 共回答了21个问题 |采纳率90.5%哈哈,谁上学的时候没有讨厌的老师啊.我上学的时候也不听英语课,都是自己看自己的英文小说,杂志什么的.老师都不管.我觉得最好的方法就是置之不理.反正你的成绩也不错,他也不能把你怎么办.他要是在让你去考六级,你要么不理,如果真的想让他下不来台,你可以反问他,他上学的时候六级考了多少,或者有没有考过专八,考过的话过了没有,多少分数过的.
因为以我的经验,很多高中的老师英语水平也不是非常好的.工作的时候发现,英语专业毕业出来的大多数人水平也不过如此.
不过这种方法比较冒险哈.1年前查看全部
- m是由中学化学常见的3种前四周期元素组成的常见盐,为了测定m的性质,
 我是我猪猪的猪猪1年前0
我是我猪猪的猪猪1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 高中化学题,Y是元素周期表中前四周期的元素,常温常压下,
 倾151年前1
倾151年前1 -
 张霆 共回答了20个问题
张霆 共回答了20个问题 |采纳率95%题目不全a1年前查看全部
- m是由中学化学常见的3种前四周期元素组成的常见盐不含结晶水
 枯灯1年前1
枯灯1年前1 -
 对月痛哭的猪 共回答了14个问题
对月痛哭的猪 共回答了14个问题 |采纳率78.6%碳酸钠、硫酸钠、氯化钙1年前查看全部
- Y是元素周期表中前四周期的元素,常温常压下,
Y是元素周期表中前四周期的元素,常温常压下,
Y单质是淡黄色固体,常在火山口附近沉积.那么Y是什么元素啊. 二年二班柳小椒1年前1
二年二班柳小椒1年前1 -
 刘洋123 共回答了12个问题
刘洋123 共回答了12个问题 |采纳率100%s 硫1年前查看全部
- X、Y、Z、W是元素周期表中前四周期的常见元素,其相关信息如下表;
X、Y、Z、W是元素周期表中前四周期的常见元素,其相关信息如下表;
(1)X位于元素周期表第______族.X的一种单质熔点很高,硬度很大,则这种单质的晶体属于______晶体.元素 相关信息 X X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 Y 原子最外层电子数是次外层的三倍 Z 单质及其化合物的焰色反应为黄色 W W元素基态原子的M层全充满,N层只有一个电子
(2)X与Y中电负性较强的是(填元素符号)______;XY2的电子式是______,分子中存在______个σ键.
(3)Z2Y2中含有的化学键类型有______.阴、阳离子的个数比为______.
(4)W的基态原子核外电子排布式是______.
(5)废旧印刷电路板上有W的单质A.用H2O2和H2SO4的混合溶液可溶出印刷电路板上的A.已知:
A(s)+H2SO4(aq)═ASO4(aq)+H2(g)△H=+64.4kJ•mol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196.4kJ•mol-1
H2(g)+[1/2]O2(g)═H2O(l)△H=-285.8kJ•mol-1
请写出A与H2SO4、H2O2反应生成ASO4(aq)和H2O(l)的热化学方程式(A用化学式表示):______. 黑侠0071年前0
黑侠0071年前0 -
 共回答了个问题
共回答了个问题 |采纳率
大家在问
- 1化简方程下根号x^2+(y+3)^2+根号x^+(y-1)^2=10
- 2囡囡"的读音?
- 3idl是什么意思
- 4指出下列句子所用的修辞格。(3分)
- 5懂英语的进来啊?一.用所给词的适当形式填空,一空一词 1.What are _____(this)?They are t
- 6如图,AB是⊙O的直径,CB是⊙O的切线,D是⊙O上一点,CD是延长线与BA的延长线交于点E,且CD=CB.
- 7数列98,73,56,37,()
- 8cet 4 求翻译And by then people were just happy to have a decent
- 9N的化合价为5的时候 其氧化物的化学式
- 10Come take a look,leave a footprint,I wish a happy day!这说的什么.
- 11下列化合物H2O,H2O2,Ca(OH)2,Na2O,Na2O2,I2,NaCl,NaOH中,只含有离子键的是 ,只含有
- 12词义辨析effect,affect,influence,impact,impress有例句分析更好
- 13学校买来5箱桔子,共80千克,平均分给4个班.
- 14硫在氧气中燃烧生成二氧化硫的化学方程式
- 15初二数学题平面直角坐标系如果直线y=-2x-1与直线y=3x+m相交于第3象限,请确定实数m的取值范围



