1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强
 yanfeng09952022-10-04 11:39:541条回答
yanfeng09952022-10-04 11:39:541条回答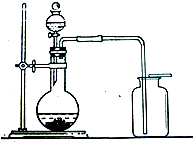 1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强烈的刺鼻气味.1810年,英国化学家戴维确定这种气体为氯气(Cl2).氯气有剧毒,密度比空气大,约为空气密度的2.5倍,能溶于水,氯气的化学性质活泼,能与水、金属、碱等发生化学反应,氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠(NaClO).
1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强烈的刺鼻气味.1810年,英国化学家戴维确定这种气体为氯气(Cl2).氯气有剧毒,密度比空气大,约为空气密度的2.5倍,能溶于水,氯气的化学性质活泼,能与水、金属、碱等发生化学反应,氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠(NaClO).(1)舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一.请补充完善其反应的化学方程式:MnO2+4HCl(浓)
| ||
(2)小明用上述反应制取氯气,设计了右图所示装置,请指出其中的问题,并提出改进的方法______.
(3)如果需要获得干燥的氯气,可选用的干燥剂是______(填写序号).
A.碱石灰B.浓硫酸C.氢氧化钠
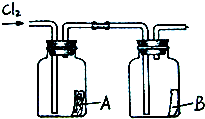
(4)如右图所示,将干燥的氯气依次通过盛有干燥红纸条的集气瓶A和盛有湿润红纸条的集气瓶B.发现瓶A中的红纸没有变化,而瓶B中的红纸退色了.据此,你能获得什么结论?
你能推断使红纸退色的物质可能是______;理由是______.

已提交,审核后显示!提交回复
共1条回复
 默默无盐 共回答了15个问题
默默无盐 共回答了15个问题 |采纳率93.3%- 解题思路:本题是一道信息情景题,做题的要求其实在题目中都基本告诉了,只要稍加思考即可得出答案:
(1)利用了质量守恒定律中的反应前后原子种类、数目不变进行解题;
(2)二氧化锰与浓盐酸反应的条件是加热,应将圆底烧瓶置于酒精灯上加热;氯气有毒,应增加尾气吸收装置;
(3)氯气是酸性气体,所以选择酸性的干燥剂;
(4)根据盐酸没有漂白作用,所以其漂白作用的是氯气与水的生成物;(1)根据质量守恒定律可知反应前后原子的种类、原子的数目不变,可以推出生成物是MnCl2
(2)二氧化锰与浓盐酸反应的条件是加热,应将圆底烧瓶置于酒精灯上加热;氯气有毒,应增加尾气吸收装置.
(3)氯气是酸性气体,所以干燥气体常用的是浓硫酸,故答案为:B
(4)氯气与水反应生成盐酸和次氯酸,盐酸没有漂白作用,故是次氯酸具有漂白作用.故答案为:次氯酸;氯气与水反应生成盐酸和次氯酸,盐酸没有漂白作用,故是次氯酸具有漂白作用.点评:
本题考点: 实验探究物质的性质或变化规律;实验室制取气体的思路;根据浓硫酸或烧碱的性质确定所能干燥的气体;质量守恒定律及其应用.
考点点评: 信息情景题看似比较难是书本没有的新知识,其实是比较容易做的题目,需要读好题目的有效的信息,提炼出来. - 1年前
相关推荐
- 1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓)⇌MnCl
1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓)⇌MnCl2+Cl2↑+2H2O.现将23.2g含MnO2的质量分数为75%的软锰矿石与200克36.5%的浓盐酸(过量)完全反应(杂质不参加反应).把反应后所得溶液稀释成400ml.计算(保留3位有效数字):
(1)生成的Cl2的体积(标准状况).
(2)参加反应的HCl的物质的量.
(3)稀释后溶液Cl-的物质的量浓度是多少. 我缺钱ing1年前1
我缺钱ing1年前1 -
 百日缘 共回答了13个问题
百日缘 共回答了13个问题 |采纳率69.2%解题思路:(1)根据质量分数计算软锰矿中二氧化锰的质量,再根据n=mM计算二氧化锰的物质的量,根据方程式计算生成的氯气的物质的量,利用V=nVm计算氯气的体积;(2)根据方程式计算参加反应的HCl的物质的量;(3)计算HCl总质量,根据n=mM计算HCl总物质的量,根据氯原子守恒,可知n(Cl-)=n总(HCl)-2n(Cl2),根据c=nV计算稀释后液中Cl-的物质的量浓度.(1)23.2g含MnO2的质量分数为75%的软锰矿石中MnO2的物质的量为:[23.2g×75%/87g/mol]=0.200mol,则:
MnO2+4HCl(浓)
△
.
MnCl2+Cl2↑+2H2O
1 1
0.2mol n(Cl2)
所以n(Cl2)=0.2mol,故V(n(Cl2)=0.2mol×22.4L/mol=4.48L,
答:标准状况下生成的Cl2的体积为4.48L;
(2)由方程式可知,参加反应的HCl的物质的量为0.200mol×4=0.800mol,
答:参加反应的HCl为0.800mol;
(3)HCl总质量=200g×36.5%,HCl总物质的量=[200g×36.5%/36.5g/mol]=2mol,根据氯原子守恒,可知n(Cl-)=n总(HCl)-2n(Cl2)=2mol-0.2mol×2=1.6mol,稀释后液中Cl-的物质的量浓度=[1.6mol/0.4L]=4.00mol/L,
答:稀释后液中Cl-的物质的量浓度为4.00mol/L.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查根据方程式的计算,旨在考查学生对基础知识的理解掌握,(3)中注意利用原子守恒进行解答,难度中等.1年前查看全部
- 1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO 2 )和浓盐酸混合加热能制取氯气:MnO 2 +4HCl(浓)M
1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO 2 )和浓盐酸混合加热能制取氯气:MnO 2 +4HCl(浓)MnCl 2 +Cl 2 ↑+2H 2 O.现将23.2g含MnO 2 的质量分数为75%的软锰矿石与足量10mol/L浓盐酸完全反应(杂质不参加反应).把反应后所得溶液稀释成200ml.计算:
(1)生成的Cl 2 的体积(标准状况).
(2)参加反应的浓盐酸的体积.
(3)稀释后溶液中MnCl 2 的物质的量浓度. 摇摇再喝1年前1
摇摇再喝1年前1 -
 lutaihei 共回答了20个问题
lutaihei 共回答了20个问题 |采纳率95%(1)23.2g含MnO 2 的质量分数为75%的软锰矿石中MnO 2 的物质的量为: 23.2g×75% 87g/mol =0.2mol,则:MnO 2 +4HCl(浓) △ . MnCl 2 +Cl 2 ↑+2H 2 O1...1年前查看全部
- 1774年,法国科学家拉瓦锡发现了金属燃烧后余下的“空气”不支持燃烧和呼吸,这些剩余的空气实际上主要是( )
1774年,法国科学家拉瓦锡发现了金属燃烧后余下的“空气”不支持燃烧和呼吸,这些剩余的空气实际上主要是( )
A. 氮气
B. 氧气
C. 二氧化碳
D. 氦气 我心疲惫1年前3
我心疲惫1年前3 -
 _楼兰_ 共回答了17个问题
_楼兰_ 共回答了17个问题 |采纳率94.1%解题思路:根据空气的成分及各成分的性质分析.空气的主要成分是氮气和氧气,氧气能供给呼吸和支持燃烧,氮气不支持燃烧和呼吸.空气的主要成分是氮气和氧气,氧气能供给呼吸和支持燃烧,金属在空中燃烧,是与氧气发生反应;氮气的性质稳定不与金属反应,二氧化碳和氦气的含量较少,所以,剩余的空气实际上主要是氮气.由以上分析可知,A正确,B、C、D错误.
故选A.点评:
本题考点: 空气组成的测定.
考点点评: 本题的难度不大,了解了空气的成分及各成分的性质即可分析解答.1年前查看全部
- 1774年,瑞典化学家谁最早发现了氯气
 我爱咖啡1年前3
我爱咖啡1年前3 -
 axiloy 共回答了21个问题
axiloy 共回答了21个问题 |采纳率90.5%是卡尔·威尔海姆·舍勒(Carl Wilhelm Scheele)1年前查看全部
- 阅读下面短文并回答问题:1773年和1774年,舍勒和普利斯特里先后发现了一种新的气体,后经拉瓦锡确认,它是空气的组成成
阅读下面短文并回答问题:
1773年和1774年,舍勒和普利斯特里先后发现了一种新的气体,后经拉瓦锡确认,它是空气的组成成分,这就是我们现已经熟知的氧气.氧气即无颜色又无气味,充满了我们周围的空间.它供生物呼吸,支持燃烧.不过,氧气也能腐蚀钢铁和许多金属,使它们生锈.我们还知道水中也溶有氧气,只是其溶解量不大.
该段文字中,描述氧气物理性质的是:______,描述氧气化学性质的是:______. 低调害虫1年前1
低调害虫1年前1 -
 adcfeg 共回答了13个问题
adcfeg 共回答了13个问题 |采纳率100%物质不需要通过化学变化就能表现出来的性质叫物理性质,如颜色、状态、气味、熔沸点、密度、硬度等,故描述氧气物理性质的是无颜色又无气味,不易溶于水;
物质在发生化学变化时所表现出来的性质叫化学性质,例如氧气能支持燃烧、氧气能供人呼吸、氧气可使钢铁制品生锈都必须通过化学变化才能表现出来,都是化学性质.
故答案为:无颜色又无气味,不易溶于水;能支持燃烧、供给呼吸、使钢铁制品生锈.1年前查看全部
- 1774年,瑞典化学家舍勒用二氧化锰和浓盐酸反应制得氯气,从而发现了氯元素,此反应为MnO2+4HCl
1774年,瑞典化学家舍勒用二氧化锰和浓盐酸反应制得氯气,从而发现了氯元素,此反应为MnO2+4HCl
MnCl2+2H2O+Cl2↑,通常状况下,氯气呈黄绿色,有刺激性气味,有毒.结合所给装置回答下列问题:△ .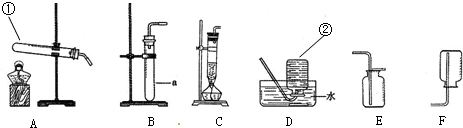
(1)写出标号仪器的名称:①______;②______.
(2)实验室制取氯气的发生装置是______.
(3)收集氯气只能用E装置,说明氯气密度______空气(填“大于”或“小于”);且______溶于水(填“能”或“不能”). 王千忍1年前1
王千忍1年前1 -
 882323 共回答了17个问题
882323 共回答了17个问题 |采纳率82.4%解题思路:(1)根据常用仪器回答;
(2)结合题目所给信息,根据反应物的状态和反应条件选择发生装置;
(3)用向上排空气法收集的气体,说明其密度比空气大,且不与空气中气体发生反应;不能用排水法收集的气体说明气体能溶于水,或与水发生化学反应.(1)根据常用仪器可知标号仪器分别是试管、集气瓶;
故答案为:试管;集气瓶;
(2)结合题目所给信息,MnO2+4HCl
△
.
MnCl2+2H2O+Cl2↑,由此可知制取氯气是由固体和液体反应,且需加热,故选C发生装置;
故答案为:C;
(3)用向上排空气法收集的气体,说明其密度比空气大,且不与空气中气体发生反应;不能用排水法收集的气体说明气体能溶于水,或与水发生化学反应;
故答案为:大于;能.点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;实验操作注意事项的探究;常用气体的收集方法.
考点点评: 能熟练掌握装置的选取方法并会灵活应用是解答此题的关键,较好的考查了学生分析信息、应用知识解决问题的能力.1年前查看全部
- 1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO 2 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,
1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO 2 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强烈的刺鼻气味.1810年,英国化学家戴维确定这种气体为氯气(Cl 2 ).氯气有剧毒,密度比空气大,约为空气密度的2.5倍,能溶于水,氯气的化学性质活泼,能与水、金属、碱等发生化学反应,氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠(NaClO).
(1)舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一.请补充完善其反应的化学方程式:MnO 2 +4HCl(浓)
2H 2 O+______+Cl 2 ↑.△ .
(2)小明用上述反应制取氯气,设计了右图所示装置,请指出其中的问题,并提出改进的方法______.
(3)如果需要获得干燥的氯气,可选用的干燥剂是______(填写序号).
A.碱石灰B.浓硫酸C.氢氧化钠
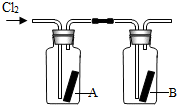
(4)如右图所示,将干燥的氯气依次通过盛有干燥红纸条的集气瓶A和盛有湿润红纸条的集气瓶B.发现瓶A中的红纸没有变化,而瓶B中的红纸退色了.据此,你能获得什么结论?
你能推断使红纸退色的物质可能是______;理由是______.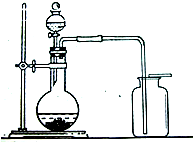
 我猜我是鱼1年前1
我猜我是鱼1年前1 -
 一个hh走TY 共回答了12个问题
一个hh走TY 共回答了12个问题 |采纳率83.3%(1)根据质量守恒定律可知反应前后原子的种类、原子的数目不变,可以推出生成物是MnCl 2
(2)二氧化锰与浓盐酸反应的条件是加热,应将圆底烧瓶置于酒精灯上加热;氯气有毒,应增加尾气吸收装置.
(3)氯气是酸性气体,所以干燥气体常用的是浓硫酸,故答案为:B
(4)氯气与水反应生成盐酸和次氯酸,盐酸没有漂白作用,故是次氯酸具有漂白作用.故答案为:次氯酸;氯气与水反应生成盐酸和次氯酸,盐酸没有漂白作用,故是次氯酸具有漂白作用.1年前查看全部
- 1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓)
1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O.现将17.4gMnO2与200克36.5%的浓盐酸(过量)完全反应.把反应后所得溶液稀释成400ml.计算(保留3位有效数字要求写出计算过程):(相对原子质量Mn:55O:16H:1Cl:35.5)△ .
(1)生成的Cl2的体积(标准状况).
(2)参加反应的HCl的物质的量.
(3)稀释后溶液Cl-的物质的量浓度是多少? lonser1年前1
lonser1年前1 -
 woodplay 共回答了18个问题
woodplay 共回答了18个问题 |采纳率88.9%解题思路:(1)盐酸过量,二氧化锰完全反应,n(MnO2)=[17.4g/87g/mol]=0.2mol,结合反应的方程式计算.
(2)n(MnO2)=[17.4g/87g/mol]=0.2mol,由方程式可知参加反应的HCl的物质的量;
(3)根据Cl元素守恒计算反应后溶液中的n(Cl-),根据c=[n/V]计算浓度.n(MnO2)=[17.4g/87g/mol]=0.2mol,n(HCl)=[200g×36.5%/36.5g/mol]=2mol,
(1)MnO2+4HCl(浓)
△
.
MnCl2+Cl2↑+2H2O
1mol 1mol
0.2molx
x=0.200mol,
故生成的氯气的体积为0.2 mol×22.4L•mol-1=4.48L.
答:生成的Cl2的体积为4.48L;
(2)MnO2+4HCl(浓)
△
.
MnCl2+Cl2↑+2H2O
1mol 4mol
0.200mol y
y=0.800mol,
答:参加反应的HCl的物质的量为0.800mol;
(3)n(HCl)=[200g×36.5%/36.5g/mol]=2mol,生成0.2molCl2,
由Cl元素守恒可知反应后溶液中n(Cl-)=2mol-0.2mol×2=1.6mol,
则c=[n/V]=[1.6mol/0.4L]=4.00mol/L,
答:稀释后溶液Cl-的物质的量浓度是4.00mol/L.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查学生根据方程式的计算、物质的量浓度等,侧重于学生的分析能力和计算能力的考查,为高频考点,难度不大,注意基础知识的掌握.1年前查看全部
- 单分子膜法测定阿伏加德罗常数1774年,英国科学家Franklin在皇家学会上宣读论文时提到:"把4.9cm3油脂放到水
单分子膜法测定阿伏加德罗常数
1774年,英国科学家Franklin在皇家学会上宣读论文时提到:"把4.9cm3油脂放到水面上,立即使水面平静下来,并令人吃惊的蔓延开去,使2.0×103m2水面看起来象玻璃那样光滑".
(1)已知油脂在水面上为单分子层,假设油脂的摩尔质量为M,每个油脂分子的横截面积为Acm2,取该油脂mg,配成体积为VmmL的苯溶液,将该溶液滴加到表面积为Scm2的水中,若每滴溶液的体积为VdmL,当滴入第d滴油脂苯溶液时,油脂的苯溶液恰好在水面上不再扩散,则阿伏加得罗常数NA的表达式为NA= ;
(2)水面上铺一层油(常用十六醇,十八醇,只有单分子厚),在缺水地区的实际意义是
根据题意,每个油脂分子的横截面积为Acm2,水的表面积为Scm2,可知油脂分子的个数为N=S/A,又滴入第d滴油脂苯溶液时,油脂的苯溶液恰好在水面上不再扩散,故扩散的油脂的苯溶液的总体积为V=Vd×(d-1),又因将质量为mg的油脂配制成体积为VmmL的苯溶液,所以VmL该油脂的苯溶液的质量为[m Vd(d-1)]/ Vm;所以S/A=[m Vd(d-1) NA]/(M Vm);故NA= (VmSM)/[mA Vd(d-1)];
为什么公式中要除以M
不是油脂的苯溶液的质量为[m Vd(d-1)]/ Vm么
[m Vd(d-1)]/ Vm不是苯溶液的质量,是苯挥发后水面上油脂膜中油脂的质量、?
请问为什么 kkhb3j71年前1
kkhb3j71年前1 -
 安泥的雨 共回答了18个问题
安泥的雨 共回答了18个问题 |采纳率94.4%[m Vd(d-1)]/ Vm不是苯溶液的质量,是苯挥发后水面上油脂膜中油脂的质量,除以摩尔质量得到的是油脂的物质的量,就是摩尔数.摩尔数才等于分子个数除以阿伏加得罗常数.NA的定义就是每摩尔物质所含微粒个数.
质量为mg的油脂配制成体积为VmmL的苯溶液,溶液的浓度是m/Vm.在水面上滴的液体的体积是Vd(d-1),两个相乘得到的是溶质的质量,而不是溶液的质量.1年前查看全部
- 1774年,英国科学家Franklin在皇家学会上宣读论文时提到:"把4.9cm3油脂放到水面上,立即使水面平静下来,并
1774年,英国科学家Franklin在皇家学会上宣读论文时提到:"把4.9cm3油脂放到水面上,立即使水面平静下来,并令人吃惊的蔓延开去,使2.0×103m2水面看起来象玻璃那样光滑".
(1)已知油脂在水面上为单分子层,假设油脂的摩尔质量为M,每个油脂分子的横截面积为Acm2,取该油脂mg,配成体积为VmmL的苯溶液,将该溶液滴加到表面积为Scm2的水中,若每滴溶液的体积为VdmL,当滴入第d滴油脂苯溶液时,油脂的苯溶液恰好在水面上不再扩散,则阿伏加得罗常数NA的表达式为NA= ;
(2)水面上铺一层油(常用十六醇,十八醇,只有单分子厚),在缺水地区的实际意义是
根据题意,每个油脂分子的横截面积为Acm2,水的表面积为Scm2,可知油脂分子的个数为N=S/A,又滴入第d滴油脂苯溶液时,油脂的苯溶液恰好在水面上不再扩散,故扩散的油脂的苯溶液的总体积为V=Vd×(d-1),又因将质量为mg的油脂配制成体积为VmmL的苯溶液,所以VmL该油脂的苯溶液的质量为[m Vd(d-1)]/ Vm;所以S/A=[m Vd(d-1) NA]/(M Vm);故NA= (VmSM)/[mA Vd(d-1)];根据科学家Franklin在皇家学会上宣读论文时提到的内容容易得出⑵的实际意义为减少水分的蒸发
这里想请问为什么扩散的油脂的苯溶液的总体积为V=Vd×(d-1),明明只有d滴,d滴乘以每滴就行了为什么d还要减1? 稻花香香1年前1
稻花香香1年前1 -
 a335205 共回答了18个问题
a335205 共回答了18个问题 |采纳率88.9%到d-1滴的时候刚好滴满,所以d滴落下来之后才不会扩散.
如果d滴的时候滴满的话,那么因为d-1滴时还没有滴满,所以d滴还会扩散.1年前查看全部
- 1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO 2 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,
1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO 2 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强烈的刺鼻气味.1810年,英国化学家戴维确定这种气体为氯气(Cl 2 ).氯气有剧毒,密度比空气大,约为空气密度的2.5倍,能溶于水,氯气的化学性质活泼,能与水、金属、碱等发生化学反应,氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠(NaClO).
(1)舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一.请补充完善其反应的化学方程式:MnO 2 +4HCl(浓) 2H 2 O+_______+Cl 2 ↑.
2H 2 O+_______+Cl 2 ↑.
(2)小明用上述反应制取氯气,设计了下图所示装置,请指出其中的问题,并提出改进的方法______________________________________________.
(3)如果需要获得干燥的氯气,可选用的干燥剂是_____________(填写序号).
A.碱石灰
B.浓硫酸
C.氢氧化钠
(4)如下图所示,将干燥的氯气依次通过盛有干燥红纸条的集气瓶A和盛有湿润红纸条的集气瓶B.发现瓶A中的红纸没有变化,而瓶B中的红纸退色了.据此,你能获得什么结论?你能推断使红纸退色的物质可能是______;理由是_____________.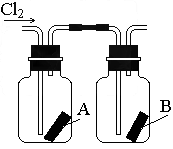
 jeffpjf1年前1
jeffpjf1年前1 -
 听雨小楼1 共回答了18个问题
听雨小楼1 共回答了18个问题 |采纳率88.9%(1)MnCl 2
(2)二氧化锰与浓盐酸反应的条件是加热,应将圆底烧瓶置于酒精灯上加热;氯气有毒,应增加尾气吸收装置.
(3)B
(4)次氯酸;氯气与水反应生成盐酸和次氯酸,盐酸没有漂白作用,故是次氯酸具有漂白作用.1年前查看全部
- 1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓)MnCl2
1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O.现将23.2g含MnO2的质量分数为75%的软锰矿石与足量10mol/L浓盐酸完全反应(杂质不参加反应).把反应后所得溶液稀释成200ml.计算:
(1)生成的Cl2的体积(标准状况).
(2)参加反应的浓盐酸的体积.
(3)稀释后溶液中MnCl2的物质的量浓度. 风中_蔷薇1年前1
风中_蔷薇1年前1 -
 185910033 共回答了20个问题
185910033 共回答了20个问题 |采纳率90%解题思路:(1)根据质量分数计算软锰矿中二氧化锰的质量,再根据n=[m/M]计算二氧化锰的物质的量,根据方程式计算生成的氯气的物质的量,利用V=nVm计算氯气的体积;
(2)根据方程式计算参加反应的HCl的物质的量,再根据V=[n/c]计算参加反应的浓盐酸的体积;
(3)消耗前后氯化锰的物质的量不变,由方程式可知n(MnCl2)=n(MnO2),根据c=[n/V]计算稀释后液中MnCl2的物质的量浓度.(1)23.2g含MnO2的质量分数为75%的软锰矿石中MnO2的物质的量为:[23.2g×75%/87g/mol]=0.2mol,则:
MnO2+4HCl(浓)
△
.
MnCl2+Cl2↑+2H2O
1 1
0.2mol n(Cl2)
所以n(Cl2)=0.2mol,故V(n(Cl2)=0.2mol×22.4L/mol=4.48L,
答:标准状况下生成的Cl2的体积为4.48L;
(2)由方程式可知,参加反应的HCl的物质的量为0.2mol×4=0.8mol,故参加反应的浓盐酸的体积为[0.8mol/10mol/L]=0.08L,
答:参加反应的浓盐酸的体积是0.08L;
(3)消耗前后氯化锰的物质的量不变,由方程式可知n(MnCl2)=n(MnO2)=0.2mol,将反应后所得溶液稀释成200mL,稀释后液中MnCl2的物质的量浓度为[0.2mol/0.2L]=1mol/L,
答:稀释后液中MnCl2的物质的量浓度为1mol/L.点评:
本题考点: 化学方程式的有关计算;物质的量浓度的相关计算;氯气的实验室制法.
考点点评: 本题考查根据方程式的计算、常用化学计量数的有关计算,比较基础,旨在考查学生对基础知识的理解掌握.1年前查看全部
- 1774年瑞典化学家舍勒用软锰矿(主要成分是二氧化锰)和浓盐酸共热得到黄绿色气体.甲、乙两个同学分别采取上述反应原理,各
1774年瑞典化学家舍勒用软锰矿(主要成分是二氧化锰)和浓盐酸共热得到黄绿色气体.甲、乙两个同学分别采取上述反应原理,各制取一瓶氯气,并用其验证Cl2与水反应产物的性质.甲、乙同学采用的装置如下图所示,回答下列问题:
(1)写出实验中制备氯气的化学方程式MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O△ .MnO2+4HCl(浓).
MnCl2+Cl2↑+2H2O△ .
(2)对于乙同学的实验装置,要停止实验,其操作顺序是______.
①停止加热②取出集气瓶盖好③将导管加装防倒吸装置后伸入到烧碱溶液中
(3)甲、乙两同学分别向收集到的氯气中加入适量的水,充分振荡后分成两份,均做了以下两个实验.实验操作、现象、结论记录如下:
请你填写下表,评价甲、乙同学实验①、②的结论(填合理或不合理):实验序号 实验操作 现象 结论 ① 加品红溶液 溶液褪色 氯气与水反应的产物有漂白性 ② 加入NaHCO3粉末 有无色气泡产生 氯气与水反应的产物具有较强的酸性
若不合理,理由是______实验序号 甲 乙 ① ②
(4)实验中甲、乙两同学均发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气.针对上述现象,甲、乙两同学对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通入HCl气体,加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体混合,加热
①实验b的目的是______;实验c的目的是______.
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成.由此得出影响氯气生成的原因是______. juneaszhao1年前1
juneaszhao1年前1 -
 魔羯座MM 共回答了28个问题
魔羯座MM 共回答了28个问题 |采纳率75%解题思路:(1)盐酸二氧化锰在加热条件下反应生成氯气、氯化锰和水;
(2)按照实验操作安全及尾气处理要求:乙同学停止实验应先取出集气瓶,将多余的氯气通入氢氧化钠,最后停止加热;
(3)甲同学用向上排空气法收集氯气,因为氯化氢具有挥发性,所以收集的氯气中含有大量的氯化氢,氯化氢与碳酸氢钠反应生成二氧化碳气体,对氯水成分的检验造成干扰;乙同学制备的氯气中无氯化氢不会对氯水中的氯化氢的检验造成干扰;
(4)①氯化钠固体电离产生氯离子,加入氯化钠固体,改变氯离子浓度;硫酸电离产生大量氢离子,加入浓硫酸实际改变氢离子浓度;
②依据实验现象分析实验结论.(1)实验室制备氯气的方程式为:MnO2+4HCl(浓)
△
.
MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)
△
.
MnCl2+Cl2↑+2H2O;
(2)氯气有毒不能排放到空气中,先停止加热容易发生倒吸,所以乙同学的实验装置,要停止实验,其操作顺序为:先取出集气瓶,将多余的氯气通入氢氧化钠,最后停止加热;
故答案为:②③①;
(3)甲同学用向上排空气法收集氯气,因为氯化氢具有挥发性,所以收集的氯气中含有大量的氯化氢,氯化氢与碳酸氢钠反应生成二氧化碳气体,对氯水成分的检验造成干扰;乙同学制备的氯气中无氯化氢不会对氯水中的氯化氢的检验造成干扰;
故答案为:
实验序号甲乙
①合理合理
②不合理合理因为甲同学收集的氯气中含有大量的氯化氢杂质,溶于水时也会与碳酸氢钠粉末反应而产生气泡;
(4)①b加入氯化钠固体,改变氯离子浓度;c加入浓硫酸,改变的是氢离子的浓度;
故答案为:探究氯离子浓度对反应的影响;探究氢离子浓度对反应的影响;
②a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成,由此得出影响氯气生成与氢离子浓度大小有关,故答案为:氢离子浓度大小.点评:
本题考点: 氯气的实验室制法;氯、溴、碘的性质实验.
考点点评: 本题为实验评价,题目难度中等,明确反应的原理,实验设计的目的是解题关键.1年前查看全部
- 1774年,瑞典化学家舍勒用二氧化锰和浓盐酸反应制得氯气,从而发现了氯元素,此反应为MnO 2 +4HCl
1774年,瑞典化学家舍勒用二氧化锰和浓盐酸反应制得氯气,从而发现了氯元素,此反应为MnO 2 +4HCl
MnCl 2 +2H 2 O+Cl 2 ↑,通常状况下,氯气呈黄绿色,有刺激性气味,有毒.结合所给装置回答下列问题:△ . 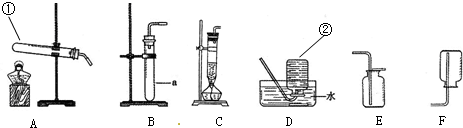
(1)写出标号仪器的名称:①______;②______.
(2)实验室制取氯气的发生装置是______.
(3)收集氯气只能用E装置,说明氯气密度______空气(填“大于”或“小于”);且______溶于水(填“能”或“不能”). 夫子修道而趋1年前1
夫子修道而趋1年前1 -
 大红肚兜 共回答了18个问题
大红肚兜 共回答了18个问题 |采纳率77.8%(1)根据常用仪器可知标号仪器分别是试管、集气瓶;
故答案为:试管;集气瓶;
(2)结合题目所给信息,MnO 2 +4HCl
△
.
MnCl 2 +2H 2 O+Cl 2 ↑,由此可知制取氯气是由固体和液体反应,且需加热,故选C发生装置;
故答案为:C;
(3)用向上排空气法收集的气体,说明其密度比空气大,且不与空气中气体发生反应;不能用排水法收集的气体说明气体能溶于水,或与水发生化学反应;
故答案为:大于;能.1年前查看全部
- 1774年,瑞典化学家舍勒发现软锰矿石(主要成分是Mno2)与浓盐酸混合加热能制取Cl2;
1774年,瑞典化学家舍勒发现软锰矿石(主要成分是Mno2)与浓盐酸混合加热能制取Cl2;
MnO2+4HCl(浓)═MnCl2+2H2O+Cl2↑现将23.2g含MnO2的质量分数为75%的软锰矿石与足量12mol/L浓盐酸完全反应(杂质不参加反应)计算
(1)生成的Cl2的体积(标准状况).
(2)参加反应的浓盐酸的体积 还猪脚脚1年前1
还猪脚脚1年前1 -
 kenkenlove 共回答了18个问题
kenkenlove 共回答了18个问题 |采纳率100%MnO2的质量=23.2*75%=17.4g
MnO2的物质的量n=m/M=17.4/87=0.2mol
MnO2+4HCl(浓)═MnCl2+2H2O+Cl2↑
1 4 1
0.2mol n(HCl) n(Cl2)
1.n(Cl2)=0.2mol
Cl2的体积V=n*Vm=0.2*22.4=4.48L
2.n(HCl)=0.8mol
浓盐酸的体积V=n/c=0.8/12=0.667L=667mL
答:(1)生成的Cl2的体积是4.48L
(2)参加反应的浓盐酸的体积是667mL1年前查看全部
- (2011•常州模拟)1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了
 (2011•常州模拟)1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强烈的刺鼻气味.1810年,英国化学家戴维确定这种气体为氯气(Cl2).氯气有剧毒,密度比空气大,约为空气密度的2.5倍,能溶于水,氯气的化学性质活泼,能与水、金属、碱等发生化学反应,氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠(NaClO).
(2011•常州模拟)1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强烈的刺鼻气味.1810年,英国化学家戴维确定这种气体为氯气(Cl2).氯气有剧毒,密度比空气大,约为空气密度的2.5倍,能溶于水,氯气的化学性质活泼,能与水、金属、碱等发生化学反应,氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠(NaClO).
(1)舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一.请补充完善其反应的化学方程式:MnO2+4HCl(浓)
2H2O+______+Cl2↑.△ .
(2)如果需要获得干燥的氯气,可选用的干燥剂是______(填写序号).
A.碱石灰B.浓硫酸C.氢氧化钠
(3)氯气与氢氧化钠溶液反应的方程式______.
(4)如图所示,将干燥的氯气依次通过盛有干燥红纸条的集气瓶A和盛有湿润红纸条的集气瓶B.发现瓶A中的红纸没有变化,而瓶B中的红纸退色了.查阅资料:红纸条放入稀盐酸中没有变化.据此,你能获得什么结论?你能推断使红纸退色的物质可能是______;理由是______. cwen881年前1
cwen881年前1 -
 sunyq 共回答了14个问题
sunyq 共回答了14个问题 |采纳率92.9%解题思路:本题是一道信息情景题,做题的要求其实在题目中都基本告诉了,只要稍加思考即可得出答案,(1)利用了质量守恒定律中的反应前后原子种类、数目不变进行解题;(2)干燥剂有多种,常用来干燥气体的是浓硫酸;(4)从题目可知氯气与水反应生成盐酸和次氯酸,而盐酸没有漂白作用,所以是次氯酸具有漂白作用.(1)根据质量守恒定律可知反应前后原子的种类、原子的数目不变,可以推出生成物是MnCl2;
(2)干燥气体常用的是浓硫酸;
(3)题干中已经告知了反应物、生成物直接书写即可;
(4)氯气与水反应生成盐酸和次氯酸,盐酸没有漂白作用,故是次氯酸具有漂白作用.
故答案:(1)MnCl2
(2)B
(3)Cl2+2NaOH=NaCl+NaClO+H2O
(4)次氯酸 氯气与水反应生成盐酸和次氯酸,盐酸没有漂白作用,故是次氯酸具有漂白作用.点评:
本题考点: 实验探究物质的性质或变化规律;根据浓硫酸或烧碱的性质确定所能干燥的气体;书写化学方程式、文字表达式、电离方程式.
考点点评: 信息情景题看似比较难是书本没有的新知识,其实是比较容易做的题目,需要读好题目的有效的信息,提炼出来.1年前查看全部
- 1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强
 1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强烈的刺鼻气味.1810年,英国化学家戴维确定这种气体为氯气(Cl2).氯气有剧毒,密度比空气大,约为空气密度的2.5倍,能溶于水,氯气的化学性质活泼,能与水、金属、碱等发生化学反应,氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠(NaClO).
1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强烈的刺鼻气味.1810年,英国化学家戴维确定这种气体为氯气(Cl2).氯气有剧毒,密度比空气大,约为空气密度的2.5倍,能溶于水,氯气的化学性质活泼,能与水、金属、碱等发生化学反应,氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠(NaClO).
(1)舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一.请补充完善其反应的化学方程式:MnO2+4HCl(浓)
2H2O+MnCl2MnCl2+Cl2↑.△ .
(2)小明用上述反应制取氯气,设计了右图所示装置,请指出其中的问题,并提出改进的方法二氧化锰与浓盐酸反应的条件是加热,应将圆底烧瓶置于酒精灯上加热,氯气有毒,应增加尾气吸收装置二氧化锰与浓盐酸反应的条件是加热,应将圆底烧瓶置于酒精灯上加热,氯气有毒,应增加尾气吸收装置.
(3)如果需要获得干燥的氯气,可选用的干燥剂是BB(填写序号).
A.碱石灰B.浓硫酸C.氢氧化钠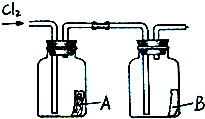
(4)如右图所示,将干燥的氯气依次通过盛有干燥红纸条的集气瓶A和盛有湿润红纸条的集气瓶B.发现瓶A中的红纸没有变化,而瓶B中的红纸退色了.据此,你能获得什么结论?
你能推断使红纸退色的物质可能是次氯酸次氯酸;理由是氯气与水反应生成盐酸和次氯酸,盐酸没有漂白作用,故是次氯酸具有漂白作用氯气与水反应生成盐酸和次氯酸,盐酸没有漂白作用,故是次氯酸具有漂白作用. 啊拉丁神兔1年前1
啊拉丁神兔1年前1 -
 taivy 共回答了22个问题
taivy 共回答了22个问题 |采纳率81.8%(1)根据质量守恒定律可知反应前后原子的种类、原子的数目不变,可以推出生成物是MnCl2
(2)二氧化锰与浓盐酸反应的条件是加热,应将圆底烧瓶置于酒精灯上加热;氯气有毒,应增加尾气吸收装置.
(3)氯气是酸性气体,所以干燥气体常用的是浓硫酸,故答案为:B
(4)氯气与水反应生成盐酸和次氯酸,盐酸没有漂白作用,故是次氯酸具有漂白作用.故答案为:次氯酸;氯气与水反应生成盐酸和次氯酸,盐酸没有漂白作用,故是次氯酸具有漂白作用.1年前查看全部
- 1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO 2 )的过程中,将它与浓盐酸混合加热,产生了一种黄
1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO 2 )的过程中,将它与浓盐酸混合加热,产生了一种黄
1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO 2 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强烈的刺鼻气味.1810年,英国化学家戴维确定这种气体为氯气(Cl 2 ).氯气有剧毒,密度比空气大,约为空气密度的2.5倍,能溶于水,氯气的化学性质活泼,能与水、金属、碱等发生化学反应,氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠(NaClO).
(1)舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一.请补充完善其反应的化学方程式:MnO 2 +4HCl(浓)
2H 2 O+______+Cl 2 ↑.△ .
(2)小明用上述反应制取氯气,设计了右图所示装置,请指出其中的问题,并提出改进的方法______.
(3)如果需要获得干燥的氯气,可选用的干燥剂是______(填写序号).
A.碱石灰B.浓硫酸C.氢氧化钠
(4)如右图所示,将干燥的氯气依次通过盛有干燥红纸条的集气瓶A和盛有湿润红纸条的集气瓶B.发现瓶A中的红纸没有变化,而瓶B中的红纸退色了.据此,你能获得什么结论?
你能推断使红纸退色的物质可能是______;理由是______.
 zxzr6101年前1
zxzr6101年前1 -
 zmin99 共回答了15个问题
zmin99 共回答了15个问题 |采纳率86.7%(1)根据质量守恒定律可知反应前后原子的种类、原子的数目不变,可以推出生成物是MnCl 2
(2)二氧化锰与浓盐酸反应的条件是加热,应将圆底烧瓶置于酒精灯上加热;氯气有毒,应增加尾气吸收装置.
(3)氯气是酸性气体,所以干燥气体常用的是浓硫酸,故答案为:B
(4)氯气与水反应生成盐酸和次氯酸,盐酸没有漂白作用,故是次氯酸具有漂白作用.故答案为:次氯酸;氯气与水反应生成盐酸和次氯酸,盐酸没有漂白作用,故是次氯酸具有漂白作用.1年前查看全部
- 1774年.瑞典化学家舍勒用二氧化锰和浓盐酸反应制得氯气,从而发现了氯元素,此反应为MnO 2 +4HCl MnCl 2
1774年.瑞典化学家舍勒用二氧化锰和浓盐酸反应制得氯气,从而发现了氯元素,此反应为MnO 2 +4HCl  MnCl 2 +2H 2 O+X↑。通常状况下,氯气呈黄绿色,有刺激性气味,有毒,密度是空气的2.5倍。回答下列问题:
MnCl 2 +2H 2 O+X↑。通常状况下,氯气呈黄绿色,有刺激性气味,有毒,密度是空气的2.5倍。回答下列问题:
(1)X的化学式为
(2)氯气能溶于水,且和水能反应,生成盐酸和次氯酸(HClO),则反应的化学方程式为
(3)实验室收集氯气应用 法收集。 JIFENGWAN1年前1
JIFENGWAN1年前1 -
 联想的 共回答了15个问题
联想的 共回答了15个问题 |采纳率100%1年前查看全部
大家在问
- 1已知一个长方形的周长是45cm,一边长是acm,则这个长方形的面积是——
- 2设a,b是非零向量,则向量a与b的夹角
- 3阅读下面这首词,完成后面各题。法曲献仙音·咏铁马同云臣赋①[清]陈维崧赤兔无成,乌骓不逝,屈作小廊
- 4对于平衡体系,mA(气)+nB(气)⇌pC(气)+qD(气)+Q有下列判断,其中正确的是( )
- 5初中作文《其实,这不难》我写的是一片叶子,经历一场暴风雨后为了能给大地做贡献,宁可装点大地等情节体现{改变一点点}的主题
- 6修改病句“市38中的学生唱着嘹亮的歌声走进会场”
- 71.一副扑克牌(取出两张王牌)小明说:一副扑克牌去掉两张王,还剩下多少张呢?一次至少要拿出多少张,才能保证至少有两张是同
- 8求以You still don't know my heart为题的英语作文
- 9—Will you please he
- 10playing tennis is his favourite sport同义句he()play
- 11选择适当的方法解下列方程组。(每小题5分,共10分)
- 12在单位圆的圆周上随机取三点A、B、C,求 是直角三角形的概率?
- 13步行一千米多长时间
- 14分子的质量一定比构成此分子的原子的质量大,那么铁分子的质量比铁原子的质量大吗?
- 15从甲地到乙地的某次快车中途要停靠8个大站,铁路局要为这次快车准备______种不同的车票,这些车票中有______种不相

