脱硝工艺中不同的催化剂种类是否对应不同的氮氧化物(NO)浓度?
 water_mark2022-10-04 11:39:541条回答
water_mark2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 雪丝地里 共回答了17个问题
雪丝地里 共回答了17个问题 |采纳率94.1%- 如果你在企业做催化剂选型,答案就是跟浓度无关.
如果你在学校做文章,答案就是跟浓度有关.
细节不解释了 参照选把 - 1年前
相关推荐
- 烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点.
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点.
(1)烟气脱硫、脱硝的环境意义是______;
(2)一种选择性催化脱硝(NO2)的原理为:6NO2+8NH3
7N2+12H2O催化剂 .
①上述反应中被还原的元素是______(填元素符号),反应中每转移3mol电子,生成标准状况下N2的体积为______;
光
②超音速飞机排放的尾气是平流层中NOx的主要来源.它们破坏臭氧层的主要机理为:
Ⅰ、O3
O+O2光
Ⅱ、NO+O3→NO2+O2
Ⅲ、NO2+O→NO+O2
上述反应中NOx所起的作用是______;
(3)下表列出了2种燃煤烟气脱硫方法的原理.
①方法Ⅰ中用氨水吸收燃煤烟气中的SO2转化为NH4HSO3,是利用了SO2的______性质(选填字母编号)方法Ⅰ 用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4 方法Ⅱ 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫
A.漂白性B.氧化性C.还原性D.酸性氧化物
②方法Ⅱ主要发生了下列反应:
2CO(g)+SO2(g)═S(g)+2CO2(g)△H1=8.0kJ•mol-1
2H2(g)+SO2(g)═S(g)+2H2O(g)△H2=90.4kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H3=-566.0kJ•mol-1
某企业脱硫前每天排放含SO2体积分数为m,体积n升的尾气(折算成标准状况),若回收利用,理论上可以回收[32mn/22.4][32mn/22.4]克硫一天. aizhihuo821年前1
aizhihuo821年前1 -
 lonely666 共回答了14个问题
lonely666 共回答了14个问题 |采纳率85.7%解题思路:(1)烟气脱硫、脱硝可以防止酸雨的发生;
(2)①反应中氨气中的N元素由-3价升高为0价,据此计算转移3mol电子参加反应的氨气的物质的量,再根据方程式计算生成的氮气,根据V=nVm计算氮气的体积;
②将三个反应加和得到总反应;
(3)①氨水吸收燃煤烟气中的SO2转化为NH4HSO3,为酸性氧化物与碱的反应;
②mnL为二氧化硫的体积,代入n=
,n(S)=n(SO2),代入m=nM计算质量.V Vm (1)烟气脱硫、脱硝可以防止酸雨的发生,
故答案为:防止酸雨的发生;
(2)①反应中氨气中的N元素由-3价升高为0价,失去电子被还原,由反应可知,转移24mol电子,生成7mol氮气,则转移3mol电子,生成3mol×[7/24]×22.4L/mol=19.6L,
故答案为:N;19.6L;
②将三个反应加和得到总反应为2O3
光
3O2,则反应中NOx所起的作用是催化剂,
故答案为:催化剂;
(3)①氨水吸收燃煤烟气中的SO2转化为NH4HSO3,为酸性氧化物与碱的反应,则体现SO2的酸性氧化物性质,
故答案为:D;
②mnL为二氧化硫的体积,n(S)=n(SO2)=[mnL/22.4L/mol]=[mn/22.4]mol,m(S)=[mn/22.4]mol×32g/mol=[32mn/22.4]g,
故答案为:[32mn/22.4].点评:
本题考点: 二氧化硫的污染及治理.
考点点评: 本题考查氧化还原反应和热化学反应等,为高频考点,把握习题中的信息及反应中元素的化合价变化为解答的关键,侧重分析能力及知识迁移应用能力的考查,氧化还原反应的计算、反应热的计算为解答的难点,题目难度不大.1年前查看全部
- SCR法(选择性催化还原技术)是一种以NH3作为还原剂,将烟气中NOx分解成无害的N2和H2O的干法脱硝技术,反应原理为
SCR法(选择性催化还原技术)是一种以NH3作为还原剂,将烟气中NOx分解成无害的N2和H2O的干法脱硝技术,反应原理为:①6NO+4NH3═5N2+6H2O;②6NO2+8NH3═7N2+12H2O;③NO+NO2+2NH3═2N2+3H2O.下列说法正确的是( )
A.汽车尾气中含有NOx,NOx是引起温室效应的主要气体之一
B.N2中π键与σ键之比为1:2
C.反应③中每生成标况下的22.4 L N2转移电子数1.5NA
D.NH3的沸点比PH3的沸点高 lovecdy1年前1
lovecdy1年前1 -
 好迷茫啊 共回答了18个问题
好迷茫啊 共回答了18个问题 |采纳率94.4%解题思路:A.NOX主要来自于汽车尾气的排放,温室效应是由于全球二氧化碳等气体的排放量不断增加,导致地球平均气温不断上升的现象;
B.共价单键是σ键,共价三键中含有2个π键1个σ键;
C.根据氮元素化合价的变化来分析;
D.利用相对分子质量分析分子间作用力,并注意氨气分子中有氢键.A.NOx是汽车尾气中的主要污染物之一,二氧化碳是大气中的主要温室气体,故A错误;
B.N2中,存在N≡N,有1个σ键和2个π键,π键与σ键之比为2:1,故B错误;
C.N元素的化合价变化为NO中+2→0化合价降低,NO2中+4→0化合价降低,NH3中-3→0化合价升高,每生成22.4LN2,转移电子数3NA,故C错误;
D.因结构相似时,相对分子质量越大,分子间作用力越大,但氨气分子间还存在氢键,则NH3的沸点高于PH3,故D正确;
故选D.点评:
本题考点: 氮的氧化物的性质及其对环境的影响;氢键的存在对物质性质的影响;氧化还原反应.
考点点评: 本题考查氮的氧化物、氮气、有关氮元素的氧化还原以及物质熔沸点的比较,侧重考查物质的结构与性质,明确氮气分子结构σ键和π键是解本题关键,题目难度中等.1年前查看全部
- SNCR脱硝技术是否先进
 小鸟锯大树1年前1
小鸟锯大树1年前1 -
 snow609 共回答了15个问题
snow609 共回答了15个问题 |采纳率80%SNCR指选择性非催化还原.
该技术一般采用炉内喷氨、尿素或氢氨酸作为还原剂还原 NOx .由于该工艺不用催化剂,因此必须在高温区加入还原剂.还原剂喷入炉膛温度为 850 1100℃ 的区域,迅速热分解成 NH3,与烟气中的NOx反应生成N2和水.
但是,NOx排放量达不到100mg/Nm3以下.一般还要加装烟气尾部脱硝装置(SCR),组成SNCR/SCR联合脱硝工艺.
目前主流是直接上SCR.使用催化剂催化还原.1年前查看全部
- 火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现
火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.
(1)脱硝.利用甲烷催化还原NOx:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
甲烷直接将NO2还原为N2的热化学方程式为______.
(2)脱碳.将CO2转化为甲醇:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H3
①在一恒温恒容密闭容器中充入1mol CO2和3mol H2进行上述反应.测得CO2和CH3OH(g)浓度随时间变化如图1所示.回答:0~10min内,氢气的平均反应速率为______mol/(L•min);第10min后,保持温度不变,向该密闭容器中再充入1mol CO2(g)和1mol H2O(g),则平衡______(填“正向”、“逆向”或“不”)移动.
②如图2,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源来电解300mL某NaCl溶液,正极反应式为______.在电解一段时间后,NaCl溶液的pH值变为13(假设NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为______mol.
③取五份等体积的CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图3所示,则上述CO2转化为甲醇的反应的△H3______0(填“>”、“<”或“=”).
(3)脱硫.燃煤废气经脱硝、脱碳后,与一定量氨气、空气反应,生成硫酸铵.硫酸铵水溶液呈酸性的原因是______(用离子方程式表示);室温时,向(NH4)2SO4,溶液中滴人NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系c(Na+)______c(NH3•H2O).(填“>”、“<”或“=”) 可爱木炭火锅1年前1
可爱木炭火锅1年前1 -
 魇之灵 共回答了14个问题
魇之灵 共回答了14个问题 |采纳率85.7%解题思路:(1)根据盖斯定律,利用已知化学反应方程式乘以某个系数相加或相减,构造出目标化学反应方程式,该化学反应的焓变即为已知化学反应方程式的焓变乘以某个系数相加或相减得到.
(2)①先根据图表,利用v=[△c/△t] 计算v(CO2),再利用各物质的反应速率之比等于计量数之比,确定v(H2);该温度下该反应的K=
,并据此判断;c(CH3OH)c(H2O) c(CO2)c3(H2)
②在甲醇燃料电池中,在正极放点的为氧气,结合酸性的电解质溶液,即写出正极反应;NaCl溶液的pH值变为13,即可求出电解池中放电的H+的物质的量为0.03mol,即电解池的阴极得0.03mol电子,根据流经四个电极的电量相等,从而得出消耗甲醇的量.
③由图可知最高点反应到达平衡,到达平衡后,温度越高,φ(CH3OH)越小,升高平衡向逆反应进行,据此判断;
(3)(NH4)2SO4为强酸弱碱盐,水解显酸性.滴人NaOH溶液至溶液呈中性,根据物料守恒和电荷守恒列式即得出Na+和NH3•H2O浓度的关系.(1)因盖斯定律,不管化学反应是一步完成还是分几步完成,其反应热是相同的.两式相加除2,可得
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol
(2)①由图可知,10min时,反应已经达平衡,△c(CO2)=1.00mol/L-0.25mol/L=0.75mol/L,所以10min内,v(CO2)=
△c(CO2)
△t=[0.75mol/L/10min]=0.075mol/(L•min),反应速率之比等于计量数之比,故v(H2)=3v(CO2)=3×0.075mol/(L•min)=0.225mol/(L•min),
∵根据图象可知:c(CO2)平衡=0.25mol/L,c(CH3OH)平衡=0.75mol/L,因为CO2的起始浓度为1mol/L而加入的物质的量为1mol,所以可知容器的体积为1L,再根据反应CO2(g)+3H2(g) CH3OH(g)+H2O可求得,c(H2)平衡=[3mol/1L]-3×0.75=0.75mol/L,c(H2O)平衡=c(CH3OH)平衡=0.75mol/L,
CH3OH(g)+H2O可求得,c(H2)平衡=[3mol/1L]-3×0.75=0.75mol/L,c(H2O)平衡=c(CH3OH)平衡=0.75mol/L,
该温度下该反应的K=
c(CH3OH)c(H2O)
c(CO2)c3(H2)=[0.75mol/L×0.75mol/L
0.25mol/L×(0.75mol/L)3=
16/3],保持温度不变,
向该密闭容器中再充入1mol CO2(g)和1mol H2O(g)时,比值
c(CH3OH)c(H2O)
c(CO2)c3(H2)=[0.75mol/L×1.75mol/L
1.25mol/L×(0.75mol/L)3=
112/45]<[16/3],所以平衡要向正反应方向移动,
故答案为:0.225;正向;
②在甲醇燃料电池(电解质溶液为稀硫酸)中,正极发生还原反应,即O2放电,根据电解质溶液为酸性溶液,得出正极反应为:O2+4e-+4H+=2H2O;
NaCl溶液的pH值变为13,即得出△n(OH-)=(10-1-10-7)×0.3L=0.03mol=△n(H+),根据电解池中阴极的电极反应2H++2e-=H2↑可知:
电解池的阴极得0.03mol电子.而流经四个电极的电量相等,根据燃料电池的负极反应CH3OH-6e-+H2O=CO2+6H+可知CH3OH~6e-,故失0.03mol电子时消耗0.005mol甲醇.
故答案为:O2+4e-+4H+=2H2O; 0.005
③由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,说明升高温度平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H3<0,故答案为:<;
(3)(NH4)2SO4为强酸弱碱盐,NH4+水解显酸性:NH4++H2O NH3•H2O+H+
NH3•H2O+H+
向(NH4)2SO4,溶液中滴人NaOH溶液至溶液呈中性,根据电荷守恒可得:C(NH4+)+C(Na+)+C(H+)=C(OH-)+2C(SO42-) ①
根据物料守恒列式可得:C(NH4+)+C(NH4•H2O)=2C(SO42-) ②
将①②联立即得:C(Na+)=C(NH4•H2O),
故答案为:NH4++H2O NH3•H2O+H+;=
NH3•H2O+H+;=点评:
本题考点: 热化学方程式;化学电源新型电池;反应速率的定量表示方法;化学平衡的影响因素;离子浓度大小的比较.
考点点评: 本题考查了热化学方程式的书写、平衡的移动以及平衡常数的计算、原电池和电解池等内容,综合性较强,难度较大.1年前查看全部
- 茂名石化新建的脱硝装置采用什么为原料的,脱硝的意义是什么?
 silentsoun1年前2
silentsoun1年前2 -
 shifting 共回答了15个问题
shifting 共回答了15个问题 |采纳率93.3%茂名石化脱硝和脱硫是一体化设计,不同于常规火电的SCR技术,石化采用了臭氧化技术和湿法洗涤工艺技术,技术来源美国Belco公司,原理是让含有酸性气体和催化剂粉尘的烟气在洗剂塔内与氢氧化钠溶液逆向充分接触反应,除去烟气中的含硫气体、氮氧化物气体并洗涤烟尘等污染物,从而实现净化烟气的目的.系统包括脱硝、烟气洗涤吸收和脱硫废水处理等.
系统总投资14471.05万元,设计处理能力317873标立方米/小时,处理后,硫化物脱除率超过95%,氮氧化物脱除率达70%以上,粉尘浓度小于45 毫克/标立方米.茂名石化每年可减少二氧化硫排放5015.6 吨,减少氮氧化物排放968.77吨,减少烟尘排放411.6吨.1年前查看全部
- (2010•盐城模拟)NOX是生成光化学烟雾、破坏臭氧层和形成酸雨的前驱气体之一.烟道气中氮氧化物可采用氨气催化脱硝,右
 (2010•盐城模拟)NOX是生成光化学烟雾、破坏臭氧层和形成酸雨的前驱气体之一.烟道气中氮氧化物可采用氨气催化脱硝,右图是相同流速不同温度下的脱硝率,反应方程式可表示为2NH3(g)+NO(g)+NO2(g)⇌2N2(g)+3H2O(g),下列说法正确的是( )
(2010•盐城模拟)NOX是生成光化学烟雾、破坏臭氧层和形成酸雨的前驱气体之一.烟道气中氮氧化物可采用氨气催化脱硝,右图是相同流速不同温度下的脱硝率,反应方程式可表示为2NH3(g)+NO(g)+NO2(g)⇌2N2(g)+3H2O(g),下列说法正确的是( )
A.脱硝的适宜温度约400℃左右
B.平衡时,其他条件不变,升高温度该反应的平衡常数增大
C.其他条件不变,使用高效催化剂,脱硝率增大
D.单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡 深谷玄1年前1
深谷玄1年前1 -
 willlas 共回答了15个问题
willlas 共回答了15个问题 |采纳率93.3%解题思路:A、分析图象在400°C,脱硝率最大;
B、图象分析400°C后升高温度脱硝率减小,说明温度升高平衡逆向进行,正向反应是放热反应;
C、催化剂改变反应速率,不改变化学平衡;
D、单位时间内消耗一氧化氮物质的量和消耗氮气物质的量之比为1:2说明正逆反应速率相同.A、分析图象在400°C,脱硝率最大,所以脱硝的适宜温度约400℃左右,故A正确;
B、图象分析400°C后升高温度脱硝率减小,说明温度升高平衡逆向进行,正向反应是放热反应,平衡时,其他条件不变,升高温度该反应的平衡常数减小,故B错误;
C、催化剂改变反应速率,不改变化学平衡,脱硝率不变,故C错误;
D、单位时间内消耗一氧化氮物质的量和消耗氮气物质的量之比为1:2说明正逆反应速率相同,反应达到平衡,故D正确;
故选AD.点评:
本题考点: 化学平衡的影响因素;氮的氧化物的性质及其对环境的影响.
考点点评: 本题考查了图象分析判断,影响化学平衡影响因素,平衡常数的理解应用,平衡标志分析应用,题目难度中等.1年前查看全部
- 低脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)=2N2(g)+3H2O
低脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)=2N2(g)+3H2O(g
回答下列问题 (1)该反应中的氧化剂是,还原剂是什么(2)反应中每生成2个N2分子,转移电子为几个 sunny775211年前1
sunny775211年前1 -
 color365 共回答了25个问题
color365 共回答了25个问题 |采纳率96%1、所在元素化合价降低的物质是氧化剂:NO和NO2
2、所在元素化合价升高的物质为还原剂:NH3
3、氧化剂得电子数=还原剂失电子数,故用氧化剂还原剂计算都可以.
本题中用还原剂计算更有方便,生成2个N2分子,需要氧化4个NH3分子,每个NH3分子中的N原子升3价(即失去3个电子),故4个NH3分子共失去电子3×4=121年前查看全部
- (2014•东营二模)火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题.对燃煤废气进行脱硝、脱
 (2014•东营二模)火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.
(2014•东营二模)火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.
(1)脱硝.利用甲烷催化还原NOx:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
甲烷直接将NO2还原为N2的热化学方程式为______.
(2)脱碳.将CO2转化为甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H3
①在一恒温恒容密闭容器中充入1mol CO2和3mol H2进行上述反应.测得CO2和CH3OH(g)浓度随时间变化如图1所示.回答:0~10min内,氢气的平均反应速率为______mol/(L•min);第10min后,保持温度不变,向该密闭容器中再充入1mol CO2(g)和1mol H2O(g),则平衡______(填“正向”、“逆向”或“不”)移动.
②取五份等体积的CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇的反应的△H3______0(填“>”、“<”或“=”).
(3)脱硫.利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得.NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
①由表判断,NaHSO3溶液显______性,用化学平衡原理解释:______.n(SO32-):n(HSO3-) 91:9 1:1 9:91 pH 8.2 7.2 6.2
②当溶液呈中性时,离子浓度关系正确的是(选填字母):______.
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-) laure_351年前1
laure_351年前1 -
 金慕雪 共回答了13个问题
金慕雪 共回答了13个问题 |采纳率76.9%(1)因盖斯定律,不管化学反应是一步完成还是分几步完成,其反应热是相同的.两式相加,可得
2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ/mol,
故答案为:2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ/mol;
(2)①由图可知,10min时,反应已经达平衡,△c(CO2)=1.00mol/L-0.25mol/L=0.75mol/L,所以10min内,v(CO2)=
△c(CO2)
△t=[0.75mol/L/10min]=0.075mol/(L•min),反应速率之比等于计量数之比,故v(H2)=3v(CO2)=3×0.075mol/(L•min)=0.225mol/(L•min),
∵根据图象可知:c(CO2)平衡=0.25mol/L,c(CH3OH)平衡=0.75mol/L,因为CO2的起始浓度为1mol/L而加入的物质的量为1mol,所以可知容器的体积为1L,再根据反应CO2(g)+3H2(g) CH3OH(g)+H2O可求得,c(H2)平衡=[3mol/1L]-3×0.75=0.75mol/L,c(H2O)平衡=c(CH3OH)平衡=0.75mol/L,
CH3OH(g)+H2O可求得,c(H2)平衡=[3mol/1L]-3×0.75=0.75mol/L,c(H2O)平衡=c(CH3OH)平衡=0.75mol/L,
该温度下该反应的K=
c(CH3OH)平衡c(H2O)平衡
c(CO2)平衡c3(H2)平衡=[0.75mol/L×0.75mol/L
0.25mol/L×(0.75mol/L)3=
16/3],保持温度不变,向该密闭容器中再充入1mol CO2(g)和1mol H2O(g)时,比值
c(CH3OH)c(H2O)
c(CO2)c3(H2)=[0.75mol/L×1.75mol/L
1.25mol/L×(0.75mol/L)3=
112/45]<[16/3],所以平衡要向正反应方向移动,
故答案为:0.225;正向;
②由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H3<0,故答案为:<;
(3)①由表格中的数据可知,溶液呈酸性,HSO3-越多,酸性越强,是因为溶液中存在:HSO3- ⇌SO32-+H+; HSO3-+H2O
⇌SO32-+H+; HSO3-+H2O ⇌H2SO3+OH-电离程度大于水解程度,溶液显酸性,
⇌H2SO3+OH-电离程度大于水解程度,溶液显酸性,
故答案为:酸;溶液中存在:HSO3- ⇌SO32-+H+; HSO3-+H2O
⇌SO32-+H+; HSO3-+H2O ⇌H2SO3+OH-电离程度大于水解程度,故溶液显酸性;
⇌H2SO3+OH-电离程度大于水解程度,故溶液显酸性;
②吸收液呈中性时,溶质为亚硫酸钠和亚硫酸氢钠,电离与水解的程度相等,
a.由电荷守恒可知,c(H+)+c(Na+)=2c(SO32-)+c(HSO3-)+c(OH-),中性溶液则c(H+)=c(OH-),则c(Na+)=2c(SO32-)+c(HSO3-),故a正确;
b.SO32-+H2O⇌HSO3-+OH-,HSO3-⇌H++SO32-,亚硫酸两步水解,则离子1年前查看全部
- (2010•泰州三模)烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点.
(2010•泰州三模)烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点.
(1)烟气脱硫、脱硝的环境意义是______.
(2)选择性催化还原法的脱硝原理为:6NOx+4x NH3
(3+2x)N2+6xH2O催化剂 .
①上述反应中每转移3mol电子,生成标准状况下N2的体积为[16.8+11.2x/x][16.8+11.2x/x]L.
②已知:2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ•mol-1
N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1
N2(g)+O2(g)=2NO(g)△H=-180.5kJ•mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的△H=______.
(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示.
①写出该脱硝原理总反应的化学方程式:6NO+3O2+2C2H4
3N2+4CO2+4H2O催化剂 .6NO+3O2+2C2H4.
3N2+4CO2+4H2O催化剂 .
②为达到最佳脱硝效果,应采取的条件是______.
 zh19191年前1
zh19191年前1 -
 yxw19830510 共回答了13个问题
yxw19830510 共回答了13个问题 |采纳率92.3%解题思路:(1)烟气脱硫、脱硝可以防止酸雨的发生;
(2)①反应中氨气中的N元素由-3价升高为0价,据此计算转移3mol电子参加反应的氨气的物质的量,再根据方程式计算生成的氮气,根据V=nVm计算氮气的体积;
②根据盖斯定律,利用已知热化学方程式乘以合适的系数进行加减,反应热也乘以相应的系数进行相应的计算;
(2)①图1可知,在催化剂的作用下,C2H4与NO、O2反应最终生成N2、CO2、H2O;
②为达到最佳脱硝效果,应满足脱硝率高,负载率低,适宜的温度.(1)烟气脱硫、脱硝可以防止酸雨的发生;
故答案为:防止酸雨的发生;
(2))①反应中氨气中的N元素由-3价升高为0价,转移3mol电子参加反应的氨气的物质的量为[3mol/3]=1mol,根据方程式可知生成的氮气的物质的量为
1mol×(3+2x)
4x=[3+2x/4x]mol,氮气的体积为[3+2x/4x]mol×22.4L/mol=[16.8+11.2x/x]L,
故答案为:[16.8+11.2x/x];
②、已知:①2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ•mol-1
②N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1
③N2(g)+O2(g)=2NO(g)△H=-180.5kJ•mol-1
由盖斯定律,①×3-②×2-③×3得6NO(g)+4NH3(g)=5N2(g)+6H2O(g),
故△H=3×(-483.6kJ•mol-1)-2×(-92.4kJ•mol-1)-3×(-180.5kJ•mol-1)=-724.5kJ•mol-1,
故答案为:-724.5kJ•mol-1;
(3)①图1可知,在催化剂的作用下,C2H4与NO、O2反应最终生成N2、CO2、H2O,反应总方程式为6NO+3O2+2C2H4
催化剂
.
3N2+4CO2+4H2O,
故答案为:6NO+3O2+2C2H4
催化剂
.
3N2+4CO2+4H2O;
②由图可知,b曲线的最高点处,脱硝率高,负载率低,适宜的温度,适合条件为350℃、负载率3%,
故答案为:350℃、负载率3%.点评:
本题考点: 用盖斯定律进行有关反应热的计算;化学平衡的调控作用;常见的生活环境的污染及治理.
考点点评: 本题以烟气的脱硫和脱硝为载体,考查环境保护、氧化还原反应计算、反应热计算、方程式书写以阅读获取信息等,题目难度中等,本题注意把握数据处理和图象分析.1年前查看全部
- (2012•厦门一模)使用SNCR脱硝技术的原理是4NO(g)+4NH3(g)+O2(g)⇌4N2+6H2O(g),下图
(2012•厦门一模)使用SNCR脱硝技术的原理是4NO(g)+4NH3(g)+O2(g)⇌4N2+6H2O(g),下图是其在密闭体系中研究反应条件对烟气脱硝效率的实验结果.下列说法正确的是( )
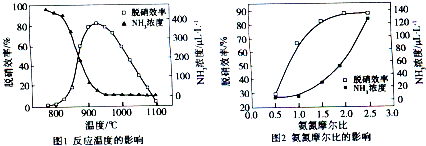
A.从图1判断,该反应的正反应方向是放热反应
B.从图2判断,减少氨气的浓度有助于提高NO的转化率
C.从图1判断,脱硝的最佳温度约为925℃
D.从图2判断,综合考虑脱硝效率和运行成本最佳氨氮摩尔比应为2.5 fbbjoo1年前1
fbbjoo1年前1 -
 kenlja 共回答了14个问题
kenlja 共回答了14个问题 |采纳率100%解题思路:由图1可知,氨气的浓度越大,脱硝效率越高,升高温度,脱硝效率先增大后减小,同时氨气的浓度越小,应综合考虑反应的平衡移动问题;由图2可知,增大氨气的浓度,脱硝效率增大,以此解答该题.A.如仅考虑脱硝效率越高,升高温度,脱硝效率先增大后减小,说明升高温度平衡向逆向移动,正反应放热,但如从氨气的浓度变化的角度考虑,升高温度氨气的浓度降低,说明反应向正向移动,则正反应为吸热反应,二者矛盾,不能说明正反应为放热反应,故A错误;
B.从图2判断,增大氨气的浓度有助于提高NO的转化率,故B错误;
C.从图1判断,脱硝的最佳温度约为925℃,此时脱硝效率最大,故C正确;
D.从图2判断,综合考虑脱硝效率和运行成本最佳氨氮摩尔比应为2.0,2.0~2.5时脱硝效率变化不大,故D错误.
故选C.点评:
本题考点: 化学平衡的调控作用;化学平衡的影响因素.
考点点评: 本题考查化学平衡的影响,侧重于化学与工业生产的关系,有利于培养学生的良好的科学素养,提高学生学习的积极性,难度中等,注意把握图象的曲线变化特点.1年前查看全部
- 烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点.
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点.
(1)选择性催化还原法的脱硝原理为:6NOx+4xNH3
(3+2x)N2+6xH2O催化剂 .
①上述反应中每转移3mol电子,生成标准状况下N2的体积为______L.
②已知:2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ•mol-1
N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1
N2(g)+O2(g)=2NO(g)△H=-180.5kJ•mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的△H=______.
(2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度,负载率(分子筛中催化剂的质量分数)的关系如图2所示.
①写出该脱硝原理总反应的化学方程式:______.
②为达到最佳脱硝效果,应采取的条件是______. 流星001年前1
流星001年前1 -
 乐薄薄 共回答了14个问题
乐薄薄 共回答了14个问题 |采纳率92.9%解题思路:(1)①反应中氨气中的N元素由-3价升高为0价,据此计算转移3mol电子参加反应的氨气的物质的量,再根据方程式计算生成的氮气,根据V=nVm计算氮气的体积;
②根据盖斯定律,利用已知热化学方程式乘以合适的系数进行加减,反应热也乘以相应的系数进行相应的计算;
(2)①图1可知,在催化剂的作用下,C2H4与NO、O2反应最终生成N2、CO2、H2O;
②为达到最佳脱硝效果,应满足脱硝率高,负载率低,适宜的温度.(1)①反应中氨气中的N元素由-3价升高为0价,转移3mol电子参加反应的氨气的物质的量为[3mol/3]=1mol,根据方程式可知生成的氮气的物质的量为
1mol×(3+2x)
4x=[3+2x/4x]mol,氮气的体积为[3+2x/4x]mol×22.4L/mol=[16.8+11.2x/x]L,
故答案为:[16.8+11.2x/x];
②已知:①2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ•mol-1
②N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1
③N2(g)+O2(g)=2NO(g)△H=-180.5kJ•mol-1
由盖斯定律,①×3-②×2-③×3得6NO(g)+4NH3(g)=5N2(g)+6H2O(g),
故△H=3×(-483.6kJ•mol-1)-2×(-92.4kJ•mol-1)-3×(-180.5kJ•mol-1)=-724.5kJ•mol-1,
故答案为:-724.5kJ•mol-1;
(2)①图1可知,在催化剂的作用下,C2H4与NO、O2反应最终生成N2、CO2、H2O,反应总方程式为6NO+3O2+2C2H4
催化剂
.
3N2+4CO2+4H2O,
故答案为:6NO+3O2+2C2H4
催化剂
.
3N2+4CO2+4H2O;
②(6)由图可知,b曲线的最高点处,脱硝率高,负载率低,适宜的温度,适合条件为350℃、负载率3%,故答案为:350℃、负载率3%.点评:
本题考点: 用盖斯定律进行有关反应热的计算;化学平衡的调控作用.
考点点评: 本题以烟气的脱硫和脱硝为载体,考查环境保护、氧化还原反应计算、反应热计算、方程式书写以阅读获取信息等,题目难度中等,本题注意把握数据处理和图象分析.1年前查看全部
- 低温脱硝技术可用于处理废气中的氮氧化物
低温脱硝技术可用于处理废气中的氮氧化物
A选项是怎么回事,没看懂.
为什么反应会逆向进行,为什么平衡常数会减小? 大海水的晨晨1年前1
大海水的晨晨1年前1 -
 ce45321c680500b0 共回答了22个问题
ce45321c680500b0 共回答了22个问题 |采纳率100%反应是放热反应,升温虽然会使正反应和逆反应的速度都增加,但根据勒夏特列原理,升温使化学平衡向吸热的方向移动,说的通俗点就是逆反应增加的速度大于正反应增加的速度.根据平衡常数的计算方法,当然会变小啦.1年前查看全部
- 低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)180℃催化剂
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)
2N2(g)+3H2O(g)△H<0在恒容的密闭容器中,下列有关说法正确的是( )180℃ 催化剂
A. 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B. 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率增大
C. 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡
D. 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 行者无绪1年前1
行者无绪1年前1 -
 superdxw 共回答了20个问题
superdxw 共回答了20个问题 |采纳率100%解题思路:A、平衡常数只受温度影响,从平衡移动的方向判断平衡常数的变化;
B、可逆反应中,加入一种反应物,平衡向正方向移动,以此判断转化率变化;
C、反应达到平衡时,不同物质表示的正、逆反应速率之比等于化学计量数之比;
D、催化剂能加快反应速率,但不影响平衡的移动.A、正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,故A错误;
B、增大一个反应物浓度,其它反应物转化率增大,故B正确;
C、单位时间内消耗NO和N2的物质的量比为1:2时,等于化学计量数之比,反应到达平衡,故C正确.
D、使用催化剂平衡不移动,废气中氮氧化物的转化率不变,故D错误.
故选BC.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查外界条件对化学反应速率的影响、平衡状态的判断等,做题时注意平衡常数的变化以及平衡状态的判断方法.1年前查看全部
- 使用SNCR脱硝技术的原理是4NO(g)+4NH3(g)+O2(g)?4N2+6H2O(g),下图是其在密闭体系中研究反
使用SNCR脱硝技术的原理是4NO(g)+4NH3(g)+O2(g)?4N2+6H2O(g),下图是其在密闭体系中研究反应条件
使用SNCR脱硝技术的原理是4NO(g)+4NH3(g)+O2(g)?4N2+6H2O(g),下图是其在密闭体系中研究反应条件对烟气脱硝效率的实验结果.下列说法正确的是( )
A.从图1判断,该反应的正反应方向是放热反应
B.从图2判断,减少氨气的浓度有助于提高NO的转化率
C.从图1判断,脱硝的最佳温度约为925℃
D.从图2判断,综合考虑脱硝效率和运行成本最佳氨氮摩尔比应为2.5
 Subway_R1年前1
Subway_R1年前1 -
 wokaoqwe 共回答了15个问题
wokaoqwe 共回答了15个问题 |采纳率93.3%A.如仅考虑脱硝效率越高,升高温度,脱硝效率先增大后减小,说明升高温度平衡向逆向移动,正反应放热,但如从氨气的浓度变化的角度考虑,升高温度氨气的浓度降低,说明反应向正向移动,则正反应为吸热反应,二者矛盾,不能说明正反应为放热反应,故A错误;
B.从图2判断,增大氨气的浓度有助于提高NO的转化率,故B错误;
C.从图1判断,脱硝的最佳温度约为925℃,此时脱硝效率最大,故C正确;
D.从图2判断,综合考虑脱硝效率和运行成本最佳氨氮摩尔比应为2.0,2.0~2.5时脱硝效率变化不大,故D错误.
故选C.1年前查看全部
- 氨气选择性脱硝反应的最适氨氮比为什么是2
 ghh05301年前1
ghh05301年前1 -
 8徐华8 共回答了10个问题
8徐华8 共回答了10个问题 |采纳率100%SNCR和SCR的氨氮摩尔比设计是根据还原反应的原理而决定,你说的肯定是非催化还原即SNCR,因为与SCR相比,SNCR不用催化剂,把还原剂如氨、尿素雾化或非雾化状态下喷入温度为850-1100℃的炉膛区域,还原剂热分解成NH3并与烟气中NOx反应生成N2和H2O,在特定的温度和氧存在的条件下,还原剂与NOx的反应优于于其他反应而进行。
合理的氨氮摩尔比是获得高的脱硝效率、低的氨逃逸率和稳定的脱硝性能的重要影响因素,但从SCR、SNCR反应式、原理、温度影响可知:SCR最佳氨氮摩尔比接近为1,而SNCR反应在外界环境条件变化时氨氮摩尔比合理值也随之变化,而且SNCR喷氨区也就是炉膛中的NOx分布很不均匀,想获得接近最佳氨氮摩尔比几乎是不可能的,所以SNCR反应的氨氮摩尔比要高于SCR,约为1.5左右,2有点高了。1年前查看全部
- 火力发电厂产生大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可
火力发电厂产生大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.
(1)脱硝.利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
甲烷直接将NO2还原为N2的热化学方程式为______.
(2)脱碳.将CO2转化为甲醇的化学方程式为: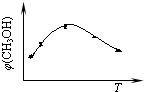
CO2+3H2 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,tmin后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图所示,则上述合成甲醇的反应的逆反应为______反应(填“放热”或“吸热”).
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度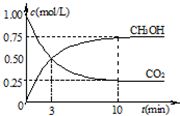 随时间变化如图所示.下列说法正确的是______
随时间变化如图所示.下列说法正确的是______
A.10min后,向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时c(CH3OH)=1.5mol•L-1
B.0~10min内,氢气的平均反应速率为0.075mol•L-1•min-1
C.达到平衡时,氢气的转化率为75%
D.该温度下,反应的平衡常数的值为3/16
E.升高温度将使n(CH3OH)/n(CO2)减小
③能说明CO2(g)+3H2(g) CH3OH(g)+H2O(g)达到平衡状态的是______
CH3OH(g)+H2O(g)达到平衡状态的是______
A.生成甲醇的速率与生成水的速率相等
B.v(H2)=3v(CH3OH)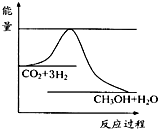
C.恒容容器中,体系的压强不再改变
D.恒容容器中,混合气体密度不再发生改变
④右图表示反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,达到平衡后,采取下列措施中能使c(CH3OH)增大的是______.
CH3OH(g)+H2O(g)进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,达到平衡后,采取下列措施中能使c(CH3OH)增大的是______.
A.使用新高效催化剂B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来D.再充入1mol CO2和3mol H2
⑤甲醇燃料电池结构如图所示,其工作时正极的电极反应式可表示为______.
(3)脱硫.某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥.
硫酸铵溶液的pH<7,其原因为:______(用离子方程式表示);在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na+)______c(NO3-)(选填“大于”、“等于”或“小于”) kerr-com1年前1
kerr-com1年前1 -
 weihe1983 共回答了22个问题
weihe1983 共回答了22个问题 |采纳率95.5%解题思路:(1)根据已知反应和目标反应及盖斯定律来计算反应热,并书写热化学反应方程式;
(2)①由图可知,最高点以后随温度的升高,甲醇的体积分数减小,则正反应为放热反应;
②根据化学平衡的三段法计算来分析;
③根据化学平衡的特征“等”与“定”来分析;
④能使c(CH3OH)增大,则化学平衡应正向移动,以此来分析;
⑤甲醇燃料电池中,负极为甲醇,正极为氧气,正极发生还原反应;
(3)硫酸铵溶液的pH<7,利用盐类水解来分析;硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,利用电荷守恒来分析离子浓度的关系.(1)由①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1,
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1,
根据盖斯定律可知,[①+②/2]可得CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),
则△H=
△H1+△H2
2=-867 kJ/mol,
即热化学反应方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol;
(2)①由图可知,最高点以后随温度的升高,甲醇的体积分数减小,则正反应为放热反应,则该反应的逆反应为吸热反应,
故答案为:吸热;
②CO2+3H2 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
开始 1 3 0 0
转化0.75 2.25 0.75 0.75
平衡 0.25 0.75 0.75 0.75
A.10min后,向该密闭容器中再充入1mol CO2和3molH2,化学平衡正向移动,则再次达到平衡时
c(CH3OH)>1.5mol•L-1,故A错误;
B.0~10min内,氢气的平均反应速率为[2.25mol/L/10min]=0.225mol•L-1•min-1,故B错误;
C.达到平衡时,氢气的转化率为[2.25mol/L/3mol/L]×100%=75%,故C正确;
D.该温度下,反应的平衡常数的值为[0.75×0.75/0.25×0.75]=3,故D错误;
E.该反应为放热反应,升高温度化学平衡逆向移动,则将使n(CH3OH)/n(CO2)减小,故E正确;
故答案为:CE;
③A.生成甲醇的速率与生成水的速率相等,只能说明正反应的关系,无法确定正逆反应速率的关系,故A错误;
B.由v(H2)=3v(CH3OH)可知,反应速率之比等于化学计量数之比,但无法确定是否达到平衡,故B错误;
C.该反应为反应前后体积不等的反应,则在恒容容器中,体系的压强不再改变,化学反应达到平衡,故C正确;
D.恒容容器中,混合气体密度不再发生改变,因质量与体积始终不变,则密度一直不变,不能作为判断平衡的方法,故D错误;
故答案为:C;
④A.使用新高效催化剂,化学平衡不移动,则c(CH3OH)不变,故A错误;
B.充入He(g),使体系压强增大,但体积不变,反应体系中的浓度不变,化学平衡不移动,故B错误;
C.将H2O(g)从体系中分离出来,能使化学平衡正向移动,使c(CH3OH)增大,故C正确;
D.再充入1mol CO2和3molH2,压强增大,化学平衡正向移动,则c(CH3OH)增大,故D正确;
故答案为:CD;
⑤甲醇燃料电池中,正极为氧气,正极发生还原反应,则正极反应式为O2+4e-+4H+=2H2O,故答案为:O2+4e-+4H+=2H2O;
(3)由题意可知,硫酸铵溶液的pH<7,硫酸铵为强酸弱碱盐,则铵根离子水解显酸性,水解离子反应为NH4++H2O NH3•H2O+H+,
NH3•H2O+H+,
硝酸铵溶液中滴加适量的NaOH溶液,由电荷守恒可知,c(NH4+)+c(Na+)+c(H+)=c(NO3-)+c(OH-),而pH=7,则c(H+)=c(OH-),
所以c(NH4+)+c(Na+)=c(NO3-),即c(Na+)<c(NO3-),故答案为:NH4++H2O NH3•H2O+H+;小于.
NH3•H2O+H+;小于.点评:
本题考点: 用盖斯定律进行有关反应热的计算;吸热反应和放热反应;化学电源新型电池;化学平衡的影响因素;化学平衡状态的判断.
考点点评: 本题综合性强,难度较大,主要考查反应热、化学平衡、原电池、盐类水解等知识,注重对高考考点的考查,(2)为学生解答的难度和易错点.1年前查看全部
- 电厂可以脱硫,脱硝,脱汞,除碳,水处理,除了这些以外,还能做哪些环保项目.
 只为偶遇1年前5
只为偶遇1年前5 -
 闲听夜雨 共回答了14个问题
闲听夜雨 共回答了14个问题 |采纳率92.9%环保分为三大部分,固体、液体、气体的治理与防治.气体包括烟气和粉尘.你可以对号入座看还有什么污染没有治理.
由于不知道是那种类型的电厂,不太清楚,大体上看的话,还有除尘,固废的话,可以外运,不用自己做环保项目处理.1年前查看全部
- 水泥厂的烟气如何脱硝
 一二三三二一1年前1
一二三三二一1年前1 -
 helong321 共回答了20个问题
helong321 共回答了20个问题 |采纳率100%选择性催化剂还原烟气脱硝技术(SCR)是采用垂直的催化剂反应塔与无水氨,从燃煤燃烧装置及燃煤电厂的烟气中除去氮氧化物(NOx).具体为采用氨(NH3)作为反应剂,与锅炉排出的烟气混合后通过催化剂层,在催化剂层,在催化剂的作用下将NOx还原分解成无害的氮气(N2)和水(H2O).该工艺脱硝率可达90%以上,NH3逃逸低于5ppm,设备使用效率高,基本上无二次污染,是目前世界上先进的电站烟气脱硝技术,在全球烟气脱硝领域市场占有率高达98%.
二、SCR烟气脱硝技术工艺原理 4NH3+4NO+O2->4N2+6H2O
8NH3+6NO2->7N2+12H2O
三、SCR烟气脱硝技术工艺流程SCR反应器通常布置在燃煤和燃油电厂的固态排渣或液态排渣锅炉的烟气
下游,位于锅炉出口和空气预热器之间,此时气体温度为300~4000C,是脱硝
反应的最佳温度区间,一般利用氨作为反应剂,烟气在进入脱硝反应器之前,首
先将NH3和空气的混合气体(氨气5%)导入,氨气由许多精密喷嘴均匀分配在烟气通道的横断面上,烟气由上向下流动,催化剂上表面保持一定的温度,NOx在催化剂表面和氨气反应生成N2和H2O,而作为空气组成部分的N2和H2O对大气不会产生污染.经过脱硝设备处理后的烟气再经过锅炉尾部空气预热器进入布置在烟气下游的电除尘器或脱硫系统.
千年古道 锦绣江山1年前查看全部
- (2012•镇江)如图为用乙烯(C2H4)处理NO脱硝的原理.
 (2012•镇江)如图为用乙烯(C2H4)处理NO脱硝的原理.
(2012•镇江)如图为用乙烯(C2H4)处理NO脱硝的原理.
(1)写出吸附反应的化学方程式______.
(2)写出解吸反应的化学方程式6NO2+2C2H4
4CO2+4H2O+3N2催化剂 .6NO2+2C2H4.
4CO2+4H2O+3N2催化剂 . awqs123451年前1
awqs123451年前1 -
 baby12345baby 共回答了21个问题
baby12345baby 共回答了21个问题 |采纳率95.2%解题思路:根据题中给的反应物、生成物及质量守恒定律写出方程式,注意反应条件,配平等.(1)由图知,一氧化氮和氧气反应生成二氧化氮,反应的化学方程式为:2NO+O2=2NO2
(2)由图知,二氧化氮和乙烯在催化剂的作用下反应生成二氧化碳、水和氮气,反应的化学方程式为:6NO2+2C2H4
催化剂
.
4CO2+4H2O+3N2点评:
本题考点: 防治空气污染的措施;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要是理解图示,找出反应物、生成物,根据质量守恒定律写出方程式,把握住方程式的写法是本题的关键.1年前查看全部
- 火力发电厂释放出大量的氮氧化物(NO x )、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处
火力发电厂释放出大量的氮氧化物(NO x )、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.
(1)脱硝.利用甲烷催化还原NO x :
CH 4 (g)+4NO 2 (g)=4NO(g)+CO 2 (g)+2H 2 O(g)△H 1 =-574kJ•mol -1
CH 4 (g)+4NO(g)=2N 2 (g)+CO 2 (g)+2H 2 O(g)△H 2 =-1160kJ•mol -1
甲烷直接将NO 2 还原为N 2 的热化学方程式为______.
(2)脱碳.将CO 2 转化为甲醇的热化学方程式为:CO 2 (g)+3H 2 (g)═CH 3 OH(g)+H 2 O(g)△H 3
①取五份等体积的CO 2 和H 2 的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH 3 OH) 与反应温度T的关系曲线如图1所示,则上述CO 2 转化为甲醇的反应的△H 3 ______0(填“>”、“<”或“=”).
②在一恒温恒容密闭容器中充入1mol CO 2 和3mol H 2 ,进行上述反应.测得CO 2 和CH 3 OH(g)的浓度随时间变化如图2所示.试回答:0~10min内,氢气的平均反应速率为______mol/(L•min);该温度下,反应的平衡常数的值为______;第10min后,向该容器中再充入1mol CO 2 和3mol H 2 ,则再次达到平衡时CH 3 OH(g)的体积分数______(填变大、减少、不变).
(3)脱硫.某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥.硫酸铵和硝酸铵的水溶液的pH<7,其原因用离子方程式表示为______;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na + )+c(H + )______c(NO 3 - )+c(OH - )(填写“>”“=”或“<”) 刺鸟腹语录1年前1
刺鸟腹语录1年前1 -
 天天6170 共回答了23个问题
天天6170 共回答了23个问题 |采纳率95.7%(1)已知:①CH 4 (g)+4NO 2 (g)=4NO(g)+CO 2 (g)+2H 2 O(g)△H 1 =-574kJ•mol -1 ②CH 4 (g)+4NO(g)=2N 2 (g)+CO 2 (g)+2H 2 O(g)△H 2 =-1160kJ•mol -1 则CH 4 (g)+2NO 2 (g)=N 2 ...1年前查看全部
- 脱硝催化剂用多少量?烟气量40万立方米/小时 含氮氧化物1141毫克/立方米 要求脱硝后氮氧化物100毫克/每立方米 需
脱硝催化剂用多少量?
烟气量40万立方米/小时 含氮氧化物1141毫克/立方米 要求脱硝后氮氧化物100毫克/每立方米 需要用催化剂多少量?什么催化剂? 陈大炮1年前1
陈大炮1年前1 -
 amethysta 共回答了19个问题
amethysta 共回答了19个问题 |采纳率94.7%你还是找个催化剂厂家帮你算一下,催化剂的选型和工艺不同用量也是不一样的.1年前查看全部
- 火力发电厂释放出的大量氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃烧废气进行脱硝、脱碳和脱硫等处理,
火力发电厂释放出的大量氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃烧废气进行脱硝、脱碳和脱硫等处理,可实验绿色环保、节能减排、废物利用.
(1)脱硝:利用甲烷催化还原NOx;
CH4(g)+4NO2(g)=CO2(g)+2H2O(g)△H1=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
甲烷直接将NO2还原为N2的热化学方程式为______.
(2)脱碳:将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H<0
CH3OH(g)+H2O(g)△H<0
T℃时,取2mol CO2和4mol H2混合,加入到1L恒容密闭容器中,发生上述反应,10分钟后达到平衡时测得甲醇的体积分数为25%,计算氢气的转化率______.T℃时该反应的化学平衡常数K=______;升高温度,K______.(选填“增大”“减小”“不变”)
(3)脱硫:某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物.设烟气中SO2、NO2的物质的量为1:1,写出该反应的化学方程式(不要求配平)______.将生成的硫酸铵和硝酸铵的混合物溶解于水,室温下测得溶液的pH小于7,其原因是______. 过年去媳妇1年前1
过年去媳妇1年前1 -
 XIAYE1994 共回答了15个问题
XIAYE1994 共回答了15个问题 |采纳率93.3%解题思路:(1)根据盖斯定律,不管化学反应是一步完成还是分几步完成,其反应热是相同的,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关.
(2)根据化学平衡计算三步曲,求出参加反应氢气的物质的量,计算氢气的转化率;根据化学平衡常数概念,代入数据,求出常数;根据温度对对化学平衡的影响.
(3)根据题目信息,抓住质量守恒,写出化学方程式;考虑盐类的水解.(1)因盖斯定律,不管化学反应是一步完成还是分几步完成,其反应热是相同的.两式相加,可得
2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ/mol
故答案为:2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ/mol
(2)CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H<0
CH3OH(g)+H2O(g)△H<0
起始(mol) 2 4 0 0
反应(mol) X3X XX
10分钟后(mol) 2-X 4-3X X X
甲醇的体积分数为[X/2-X+4-3X+X+X]×100%=25%可得:X=1
所以氢气的转化率为:[3/4]×100%=75%,
平衡常数K=
C(CH3OH)C(H2O)
C(CO2)C3( H2) =[1×1/1×1]=1
升高温度,平衡向吸热的方向移动,即逆向移动,K减小.
故答案为:75%;1;减小;
(3)由题目信息可知反应为NH3、O2、SO2、NO2、H2O,生成物为(NH4)2SO4、NH4NO3,
由此可写出方程式为NH3+O2+SO2+NO2+H2O→(NH4)2SO4+NH4NO3,
故答案为:NH3+O2+SO2+NO2+H2O→(NH4)2SO4+NH4NO3
(4)因铵盐要发生水NH4++H2O NH3•H2O+H+,故答案为:NH4++H2O
NH3•H2O+H+,故答案为:NH4++H2O NH3•H2O+H+
NH3•H2O+H+
点评:
本题考点: 二氧化硫的污染及治理;热化学方程式;化学平衡的计算;氮的氧化物的性质及其对环境的影响.
考点点评: 本题从多个角度对化石燃料进行了全面的考查,培养了学生分析问题的能力.1年前查看全部
- 烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点.
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点.
(1)烟气脱硫、脱硝的环境意义是______.
(2)选择性催化还原法的脱硝原理为:6NOx+4x NH3
(3+2x)N2+6xH2O催化剂 .
上述反应中每转移3mol电子,生成标准状况下N2的体积为[16.8+11.2x/x][16.8+11.2x/x]L.
(3)目前,科学家正在研究一种以乙烯(C2H4)作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示.
①写出该脱硝原理总反应的化学方程式:6NO+3O2+2C2H4
3N2+4CO2+4H2O催化剂 .6NO+3O2+2C2H4.
3N2+4CO2+4H2O催化剂 .
②为达到最佳脱硝效果,应采取的条件是______. 遇见自已1年前1
遇见自已1年前1 -
 wangquanai5 共回答了16个问题
wangquanai5 共回答了16个问题 |采纳率81.3%解题思路:(1)硫的氧化物、氮的氧化物是形成酸雨的主要成因,烟气脱硫、脱硝可以防止酸雨的发生;
(2)反应中氨气中的N元素由-3价升高为0价,据此计算转移3mol电子参加反应的氨气的物质的量,再根据方程式计算生成的氮气,根据V=nVm计算氮气的体积;
(3)①图1可知,在催化剂的作用下,C2H4与NO、O2反应最终生成N2、CO2、H2O,据此写出反应的总方程式;
②为达到最佳脱硝效果,应满足脱硝率高,负载率低,适宜的温度.(1)烟气脱硫、脱硝可以降低硫的氧化物、氮的氧化物含量,防止酸雨的发生,
故答案为:防止酸雨的发生;
(2))反应中氨气中的N元素由-3价升高为0价,化合价升高3价,泽尔转移3mol电子参加反应的氨气的物质的量为:[3mol/3]=1mol,根据方程式可知生成的氮气的物质的量为:1mol×[3+2x/4x]=[3+2x/4x]mol,
氮气的体积为:[3+2x/4x]mol×22.4L/mol=[16.8+11.2x/x]L,
故答案为:[16.8+11.2x/x];
(3)①根据图1可知,在催化剂的作用下,C2H4与NO、O2反应最终生成N2、CO2、H2O,反应总方程式为:6NO+3O2+2C2H4
催化剂
.
3N2+4CO2+4H2O,
故答案为:6NO+3O2+2C2H4
催化剂
.
3N2+4CO2+4H2O;
②由图可知,b曲线的最高点处,脱硝率高,负载率低,温度温度适宜,适宜适合条件为350℃、负载率3%,
故答案为:350℃、负载率3%.点评:
本题考点: 氧化还原反应的计算;氮的氧化物的性质及其对环境的影响.
考点点评: 本题以烟气的脱硫和脱硝为载体,考查环境保护、氧化还原反应计算、方程式书写等知识,题目难度中等,本题注意把握数据处理和图象分析.1年前查看全部
- 选择性催化还原法脱硝和选择性非催化还原法脱硝有何区别
 城河街1年前3
城河街1年前3 -
 中西色彩 共回答了13个问题
中西色彩 共回答了13个问题 |采纳率92.3%选择催化还原法 (SCR)
用NH3作还原剂将NOx催化还原为N2;烟气中的氧气很少与NH3反应,放热量小,效率90%以上
选择性非催化还原法 (SNCR)
在高温和没有催化剂的情况下,通过烟道气流中产生的氨自由基与NOx反应;烟气中的氧参与反应,放热量大,效率30%—50%1年前查看全部
- 火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,
火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.
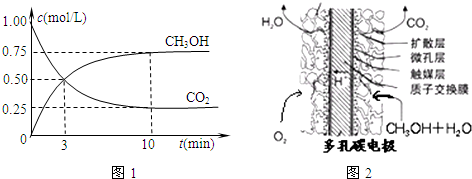
(1)脱硝.利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
甲烷直接将NO2还原为N2的热化学方程式为______.
(2)脱碳.将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g);△H3<0
①在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图1所示.下列说法正确的是______(填字母代号).
A.第10min后,向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时c(CH3OH)=1.5mol•L-1
B.0~10min内,氢气的平均反应速率为0.075mol/(L•min)
C.达到平衡时,氢气的转化率为75%
D.该温度下,反应的平衡常数的值为[3/16]
E.升高温度将使
减小n(CH3OH) n(CO2)
②甲醇燃料电池结构如图2所示.其工作时正极的电极反应式可表示为:______.
(3)脱硫.某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥.硫酸铵和硝酸铵的水溶液的pH<7,其中原因可用一个离子方程式表为:______;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中:c(Na+)+c(H+)______c(NO3-)+c(OH-)(填写“>”“=”或“<”). 冷月心蓝1年前1
冷月心蓝1年前1 -
 25只蜜蜂 共回答了20个问题
25只蜜蜂 共回答了20个问题 |采纳率95%解题思路:(1)利用盖斯定律分析;
(2)①A、再充入1mol CO2和3mol H2,可等效为开始体积变为原来的2倍,加入2mol CO2和6mol H2,平衡后,再将体积压缩为原来的体积,增大压强平衡向体积减小的方向移动,即向正反应移动,反应物的转化率增大;
B、利用v=[△n/△t]计算v(H2)判断;
C、根据转化率的定义计算判断;
D、该温度下该反应的K=
,代入数据计算;[CH3OH][H2O] [CO2][H2]3
E、该反应为放热反应,升高温度平衡向逆反应进行,n(CH3OH)减小,n(CO2)增大.
②正极上氧化剂得电子发生还原反应;
(3)强酸弱碱盐易水解而使其溶液呈酸性,根据电荷守恒判断.(1)已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
不管化学反应是一步完成还是分几步完成,其反应热是相同的.两式相加,可得
2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ/mol
即CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1;
(2)①由图2可知,开始二氧化碳的浓度为1.0mol/L,开始容器中充入1mol CO2和3mol H2,所以开始氢气的浓度为3.0mol/L,容器体积为[1.0mol/1.0mol/L]=1L.
平衡时,甲醇的浓度为0.75mol/L
CO2(g)+3H2(g)
一定条件
CH3OH(g)+H2O(g)
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.250.75 0.75
平衡(mol/L):0.25 0.750.75 0.75
A、通过上述计算可知二氧化碳的转化率为[0.75mol/L/1.0mol/L]×100%=75%,再充入1mol CO2和3mol H2,可等效为开始体积变为原来的2倍,加入2mol CO2和6mol H2,平衡后,再将体积压缩为原来的体积,增大压强平衡向体积减小的方向移动,即向正反应移动,反应物的转化率增大,所以再次达到平衡时c(CH3OH)>1.5mol/L,故A错误;
B、10分钟内,氢气的平均反应速率为v(H2)=[2.25mol/L/10min]=0.225mol/(L•min),故C错误;
C.通过上述计算可知氢气的转化率为[2.25mol/L/3mol/L]×100%=75%,故C正确;
D、该温度下该反应的K=
[CH3OH][H2O]
[CO2][H2]3=[0.75×0.75
0.25×(0.75)3=
16/3],故D错误;
E、该反应为放热反应,升高温度平衡向逆反应进行,n(CH3OH)减小,n(CO2)增大,所以n(CH3OH)/n(CO2)值减小,故E正确.
故选:CE;
②正极上氧气得电子和氢离子反应生成水,所以电极反应式为:O2+4e-+4H+=2H2O,故答案为:O2+4e-+4H+=2H2O;
(3)硫酸铵和硝酸铵都是强酸弱碱盐,铵根离子易水解而使其溶液呈酸性,水解离子方程式为:NH4++H2O⇌NH3•H2O+H+,溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒,则c(Na+)+c(H+)+c(NH4+)=c(NO3-)+c(OH-),所以c(Na+)+c(H+)<c(NO3-)+c(OH-),
故答案为:NH4++H2O⇌NH3•H2O+H+;<.点评:
本题考点: 二氧化硫的污染及治理;热化学方程式;化学电源新型电池;化学平衡建立的过程;氮的氧化物的性质及其对环境的影响.
考点点评: 本题考查了盖斯定律、原电池原理、化学平衡、盐类水解等知识点,难点是化学平衡的有关计算,有关化学平衡的计算是考试热点,难度中等.1年前查看全部
- 请问,锅炉脱硝SCR法中,氨的逃逸是指什么,
请问,锅炉脱硝SCR法中,氨的逃逸是指什么,
是反应器密封不严,氨气泄漏到烟道外?
还是氨未经过反应,就从反应器尾部排出? realn1年前1
realn1年前1 -
 我就爱qq点 共回答了9个问题
我就爱qq点 共回答了9个问题 |采纳率100%就是喷氨过量了,不能完全反应,剩下的氨会随着烟气进空预器造成腐蚀1年前查看全部
大家在问
- 1这题怎么做啊百度和数学的朋友们第一个回答的一定给采纳
- 2氯化铁与氯化亚铁有什么区别
- 3英语作文 my favorite music
- 410.7.3怎么相加相减等于5
- 5下列关于物质跨膜运输的叙述中,错误的是( )
- 6【 】花 【 】门,【 】教【】流,【 】平【 】稳,填数字
- 7跪求广州版八年级上册目标评价手册终结性测试题答案 重酬
- 8下列各项中,属于利得的是() A出租无形资产取得的收益 B出售无形资产取得的净收益 C销售商品取得
- 9来看看这两句话什么意思表达了什么情感.
- 10下面是大雄作息时间的扇形统计图.
- 11(2014•汕尾)如图所示是分别测量定值电阻R和小灯泡L两端电压和通过的电流后得到的U-I关系图线.由图可知,定值电阻R
- 12根据汉语完成下面句子 他冒着生命危险把那个溺水儿童救了上来.He saved the child
- 13(2012•杨浦区二模)已知反比例函数y=k−1x的图象在第二、四象限内,那么k的取值范围是k<1k<1.
- 14When I saw a lot of people gathering over there,I went over
- 15一件有关规则的事,〔400字,“写事啊”〕
