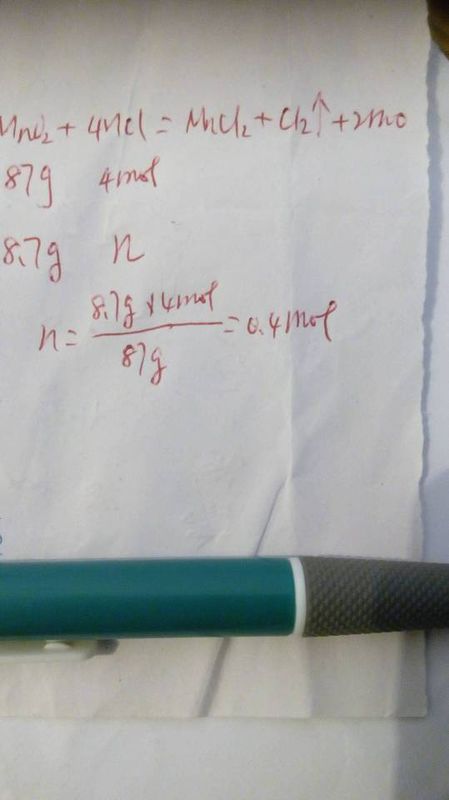将8.7克二氧化碳与120ml 10mol/L盐酸混合加热
 binyu5202022-10-04 11:39:541条回答
binyu5202022-10-04 11:39:541条回答
将8.7克二氧化碳与120ml 10mol/L盐酸混合加热
(1)理论上可生成氯气多少升
(2)如果不考虑氯化氢因挥发而损失,那么把反映后的溶液稀释到500ml,取出50ml,该50ml溶液中氯离子的物质的量浓度是多少?
(1)理论上可生成氯气多少升
(2)如果不考虑氯化氢因挥发而损失,那么把反映后的溶液稀释到500ml,取出50ml,该50ml溶液中氯离子的物质的量浓度是多少?

已提交,审核后显示!提交回复
共1条回复
 stanley_duhd 共回答了22个问题
stanley_duhd 共回答了22个问题 |采纳率90.9%- (1)CO2+2HCl=CO+Cl2+H2O
跟据方程可有产生Cl2 (标况)为5.04L
(2)由(1)方程得可剩HCl 约0.80 MOL
由题可有C(CL-)=0.80*(50/500)=0.08(MOL/L) - 1年前
相关推荐
- 8.7克MnO2与含14.6克HCl的浓盐酸共热,可生成氯气的质量为?
8.7克MnO2与含14.6克HCl的浓盐酸共热,可生成氯气的质量为?
8.7克MnO2与含14.6克HCl的浓盐酸共热,可生成氯气的质量为?
A.14.2g
B.7.1g
C.7.14.2g
D. 机会成本1年前2
机会成本1年前2 -
 andersonzuo 共回答了15个问题
andersonzuo 共回答了15个问题 |采纳率73.3%MnO2+4HCl(浓)=MnCl2+2H2O+CL2↑
87 146 71
8.7g 14.6g m
87 146 71
--- = ---- = --
8.7g 14.6g m
解得m=7.1g1年前查看全部
- 只需要几个单位换成.条件:100卡路里= 5盎司 且含有70IU一勺奶粉=2盎司 (约8.7克) 可兑出60ML奶我孩子
只需要几个单位换成.
条件:100卡路里= 5盎司 且含有70IU
一勺奶粉=2盎司 (约8.7克) 可兑出60ML奶
我孩子每天喝大概880ML奶
这880ML奶里含有多少IU slmswlp1年前4
slmswlp1年前4 -
 小布丁饼干 共回答了21个问题
小布丁饼干 共回答了21个问题 |采纳率90.5%880/30*14=410.66666661年前查看全部
- 8.7克二氧化锰加入100ML 12 MOL/L的浓盐酸中,有多少HCL被氧化
 6ttfrddccc1年前1
6ttfrddccc1年前1 -
 kiki0521 共回答了17个问题
kiki0521 共回答了17个问题 |采纳率94.1%首先M(MnO2)=87g/mol,则n(MnO2)=0.1mol;n(HCl)=1.2mol,可以知道MnO2反应完全.
在反应MnO2+4HCl(浓)==== MnCl2+Cl2+2H2O中,由于生成Cl2的系数为1,可以知道被氧化的HCl的系数应为2(Cl守恒),所以0.1molMnO2氧化了0.2molHCl.1年前查看全部
- 某同学将一实际质量为8.7克食盐放在天平上称重,但将砝码和食盐的位置放反了,则该同学所称得的结果是多少
 张建丰1年前5
张建丰1年前5 -
 jj盲肠 共回答了20个问题
jj盲肠 共回答了20个问题 |采纳率80%1.3克
砝码最小5克,游码为3.7克
砝码与食盐放反,所以实际质量为
5-3.7=1.3(克)1年前查看全部
- 在测定硫酸铜晶体结晶水质量分数的实验中得到的数据如表(已知坩埚质量为8.7克)
在测定硫酸铜晶体结晶水质量分数的实验中得到的数据如表(已知坩埚质量为8.7克)
次 数x051x052x053x054x055
坩埚和硫酸铜晶体总质量(g)x0510.7x0510.1x059.8x059.8x059.8
则该实验测得硫酸铜晶体中结晶水的质量分数为 爱你是错误吗1年前1
爱你是错误吗1年前1 -
 大嗓门 共回答了20个问题
大嗓门 共回答了20个问题 |采纳率90%根据第一次的数据可以知道晶体质量为2g,再由后面结果可知,水被完全蒸发后的硫酸铜质量为1.1g,那么水就是0.9g啦,所以原来晶体中水的质量分数就是45%1年前查看全部
- 8.7克MnO2与过量的浓盐酸反应,求产生的氯气有多少克;反应的HCl为多少摩尔?其中被氧化的HCl为多少克?
8.7克MnO2与过量的浓盐酸反应,求产生的氯气有多少克;反应的HCl为多少摩尔?其中被氧化的HCl为多少克?
MnO2+4HCL(浓)==加热==MnCL2+CL2↑+2H2O,现把8.7克MNO2 大树个的两棵蛋蛋1年前1
大树个的两棵蛋蛋1年前1 -
 klzcy 共回答了19个问题
klzcy 共回答了19个问题 |采纳率68.4%MnO2+4HCL(浓)==加热==MnCL2+CL2↑+2H2O,
87g 4mol 71g
8.7g =0.4mol =7.1g
反应中参加反应的HCl为0.4mol,其中被氧化的HCl为1/2x0.4=0.2mol,另外的一半盐酸显酸性与Mn^2+结合了.1年前查看全部
- 用8.7克二氧化锰和60g百分之36.5的浓盐酸供热制取氯气,问:1.标准状况下可生成氯气的体积是多少?2.将反应
用8.7克二氧化锰和60g百分之36.5的浓盐酸供热制取氯气,问:1.标准状况下可生成氯气的体积是多少?2.将反应
制取氯气,问:1.标准状况下可生成氯气的体积是多少?2.将反应后溶液稀释至1L后取出30ML,在这30ML溶液中加入足量的硝酸银溶液,可得到氯化银沉淀的质量是多少克 西纬1年前1
西纬1年前1 -
 dittoditto 共回答了24个问题
dittoditto 共回答了24个问题 |采纳率100%V(Cl2)=22.4*8.7/87=2.24L
n(HCl)=60*36.5%/36.5=0.6mol
n(Cl-)=0.6-0.1*2=0.4mol
m(AgCl)=143.5*0.4*30/1000=1.722g1年前查看全部
- 将KMNO4和KCLO3的混合物56.1克加热充分后,剩余的残渣中有MNO2 8.7克
将KMNO4和KCLO3的混合物56.1克加热充分后,剩余的残渣中有MNO2 8.7克
生成氧气多少克?急, 晒太阳_斗oo1年前3
晒太阳_斗oo1年前3 -
 hx52155811 共回答了21个问题
hx52155811 共回答了21个问题 |采纳率100%解,反应中生成二氧化锰,并且作为氯酸钾的催化剂.质量不变.
设混合物中KMnO4的质量为X克,高锰酸钾加热放出氧气的质量为A克.氯酸钾放出氧气的质量为B克.
2KMnO4=K2MnO4+MnO2+O2
316 87 32
X 8.7 A
解得X=31.6克,A=3.2克.
那混合物中氯酸钾的质量24.5克.
2KClO3=MnO2=2KCl+3O2
245 96
24.5 B
245/24.5=96/B
解得B=9.6克.
总共放出的氧气的质量为A+B=3.2+9.6=12.8克.
答.…………1年前查看全部
- 有氯化镁和硫酸钠20克,溶解后与氢氧化钠溶液充分反应,生成沉淀8.7克,
有氯化镁和硫酸钠20克,溶解后与氢氧化钠溶液充分反应,生成沉淀8.7克,
如果可以写一下格式 .原子质量:(H1 O16 Na23 Mg24 S32 Cl35.5) qq过河1年前2
qq过河1年前2 -
 在楚一方 共回答了17个问题
在楚一方 共回答了17个问题 |采纳率88.2%设氯化镁的质量为m.
2NaOH+MgCl2=2NaCl+Mg(OH)2
95g 58g
m 8.7g
95g/58g=m /8.7g
解得m=14.25g
-----------后面自己再做做.1年前查看全部
- 问问学堂8.7克Mno2和120ml10mol/L的盐酸作用制取cl2,把完全反应后的溶液稀释至1.0L后取出20ml在
问问学堂8.7克Mno2和120ml10mol/L的盐酸作用制取cl2,把完全反应后的溶液稀释至1.0L后取出20ml在这20ml的
硝酸银溶液,可得氯化银多少克? Angela11111年前1
Angela11111年前1 -
 东北虎2008 共回答了16个问题
东北虎2008 共回答了16个问题 |采纳率93.8%总共Cl-有1.2mol
减少Cl-的就生成了Cl2逃走的 根据化学方程式可以算出逃走Cl2 0.1mol 所以减少0.1*2=0.2
剩余的Cl- 1.2-0.2=1mol
取出来的溶液只有原来的1/50,含有Cl- 0.02mol 产生AgCl 0.02mol 质量=2.871年前查看全部
- 化学方程式:Mn02+4HCL(浓)=MnCL2+Cl2^+2H2O,取8.7克Mn02与足量浓盐酸发生制氯气,计算参加
化学方程式:Mn02+4HCL(浓)=MnCL2+Cl2^+2H2O,取8.7克Mn02与足量浓盐酸发生制氯气,计算参加反应的HCl有多少mol?

 7205251年前1
7205251年前1 -
 sunday199818 共回答了10个问题
sunday199818 共回答了10个问题 |采纳率100%1年前查看全部
大家在问
- 1英语翻译1.当被要求回答这个难题时,我不知所措.(be at a loss)2.外边有一大群人集合反对战争.(prote
- 2某同学仿照“探究小车速度随时间变化的规律”这一实验,利用如图所示的装置测量重物做自由落体运动的加速度。 (1)对该实验装
- 3污水处理及再生水利用的调查问卷您好!我正在进行一项关于污水处理及再生水利用的调查报告.为了更好的了解居民用水情况、对污水
- 4某市自来水收费如下:不超出6吨,每吨2元;超出6吨少于10吨,每吨4元,超出10吨,每吨8元.某居民3,4月共用水15吨
- 5改为同义句(wang hong likes geography best.
- 6有理数乘法,先确定符号,再把各个因数的绝对值相乘,作为——
- 7一辆客车和一辆货车同时从甲城开往乙城,已知客车与货车的速度比是5:4,如果客车到达乙城要2小时
- 8随身带某物用英语怎么说
- 9甲水池有水69吨,乙水池有水36吨,如果甲水池中的水以每分钟2吨的速度流入乙水池,那么多少分钟后
- 10直线方程中的一般式方程,AX+BY+C=0,这里直线在y轴上的截距和在x轴上的截距公式分别是什么啊
- 11军训的感言 作文
- 12用两个带有十二生肖的成语写成一段话
- 13求一篇英语作文,写的是深圳的变化,题目是《Changes in SHenzhen》,不要太多,6句就好了
- 14什么方法背诵文言文《孙权劝学》快急!
- 15一列快车从甲站到乙站要5小时,一列慢车从乙站到甲站要8小时,快车先行2小时后,慢车才出发,两车相遇时,