电化学法的分类电化学法制备薄膜时,电沉积和电泳沉积的区别?采用电化学法制备功能薄膜的分类
 kk200210552022-10-04 11:39:542条回答
kk200210552022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 zjszy 共回答了15个问题
zjszy 共回答了15个问题 |采纳率93.3%- 先把化学方程式转化成离子式,再把失电子的“拿”出来,剩下的就是得电子的,这就是写电化学法的最简单方法.
- 1年前
 美丽空间1 共回答了174个问题
美丽空间1 共回答了174个问题 |采纳率- 电沉积是通过电极反应而沉积,电泳沉积是通过胶体电泳而沉积。
- 1年前
相关推荐
- 以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图:
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图: 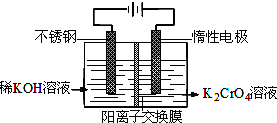
下列说法不正确的是( )A.在阴极区,发生的电极反应为:2H 2 O+2e - ═2OH - +H 2 ↑ B.在阳极区,通电后溶液逐渐由黄色变为橙色,是因为阳极区H + 浓度增大,使平衡2 C r
+2H + ═ C r 2O -4
+H 2 O向右移动O 2-7 C.该制备过程总反应的化学方程式为:4K 2 CrO 4 +4H 2 O
2K 2 Cr 2 O 7 +4KOH+2H 2 ↑+2O 2 ↑通电 . D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为α= d 2  水间梦1年前1
水间梦1年前1 -
 aaron444 共回答了16个问题
aaron444 共回答了16个问题 |采纳率93.8%A、根据题意可知:电极均为惰性电极,在阴极室,水得电子变成氢气,电极反应为:2H 2 O+2e - =2OH - +H 2 ↑,故A正确;
B、阳极室水失去电子,电极反应为:2H 2 O-4e - =4H + +O 2 ↑,使阳极区氢离子浓度增大,平衡右移,故B正确;
C、总制备方程式为4K 2 CrO 4 +4H 2 O
电解
.
2K 2 Cr 2 O 7 +4KOH+2H 2 ↑+O 2 ↑,故C正确;
D、设加入反应容器内的K 2 CrO 4 为1mol,反应过程中有xmol K 2 CrO 4 转化为K 2 Cr 2 O 4 ,则阳极区剩余K 2 CrO 4 为(1-x)mol,对应的n(K)=2(1-x)mol,n(Cr)=(1-x)mol,生成的K 2 Cr 2 O 4 为
x
2 mol,对应的n(K)=xmol,n(Cr)=xmol,根据:K与Cr的物质的量之比为d,解得x=2-d,转化率为
2-d
1 ×100% =2=d,故D错误;
故选D.1年前查看全部
- 以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
下列说法不正确的是
A.在阴极式,发生的电极反应为:2H 2 O+2e -  2OH ― +H 2 ↑
2OH ― +H 2 ↑B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H + 浓度增大,使平衡2 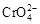 +2H +
+2H + 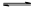
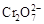 +H 2 O向右移动
+H 2 O向右移动C.该制备过程总反应的化学方程式为:4K 2 CrO 4 +4H 2 O  2K 2 Cr 2 O 7 +4KOH+2H 2 ↑+2O 2 ↑
2K 2 Cr 2 O 7 +4KOH+2H 2 ↑+2O 2 ↑D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为α= 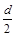
 z1010l1年前1
z1010l1年前1 -
 zz894286 共回答了22个问题
zz894286 共回答了22个问题 |采纳率86.4%D 本题是电解法在制备物质中的具体应用。分析该制备时,重点要把握其中的K 2 CrO 4 在转变为K 2 Cr 2 O 7 的过程中没有发生化合价的变化,所以要抓住是由于溶液的pH变化实现目标物的合成,制备的过程是...1年前查看全部
- 以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图:下列说法不正确的是( )
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图:下列说法不正确的是( )
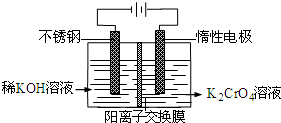 A. 在阴极式,发生的电极反应为:2H2O+2e-=2OH-+H2↑
A. 在阴极式,发生的电极反应为:2H2O+2e-=2OH-+H2↑
B. 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+⇌Cr2O72-+H2O向右移动
C. 该制备过程总反应的化学方程式为:4K2CrO4+4H2O
2K2Cr2O7+4KOH+2H2↑+O2↑通电 .
D. 测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为1-[d/2] zhzhzhlj1年前4
zhzhzhlj1年前4 -
 威廉母猪 共回答了19个问题
威廉母猪 共回答了19个问题 |采纳率84.2%解题思路:A、阴极上得电子发生还原反应,氢离子放电;
B、阳极上水失电子生成氧气和氢离子,氢离子浓度增大导致平衡移动,根据氢离子浓度的变化判断溶液颜色的变化;
C、将阳极室、阴极室发生的反应加合可得总的反应式,注意阴极室还发生反应衡2CrO42-+2H+═Cr2O72-+H2O;
D、根据原子守恒计算其转化率.A、电极均为惰性电极,在阴极室发生还原反应,水得电子变成氢气,电极反应为:2H2O+2e-=2OH-+H2↑,故A正确;
B、阳极室发生氧化反应,水失去电子放电,电极反应为:2H2O-4e-=4H++O2↑,阳极区氢离子浓度增大,平衡右移,故B正确;
C、阴极电极反应为:4H2O+4e-=4OH-+2H2↑,阳极反应为:2H2O-4e-=4H++O2↑,4CrO42-+4H+═2Cr2O72-+2H2O,故总制备方程式为4K2CrO4 +4H2O
电解
.
2K2Cr2O7 +4KOH+2H2↑+O2↑,故C正确;
D、设加入反应容器内的K2CrO4为1mol,反应过程中有xmol K2CrO4转化为K2Cr2O7,则阳极区剩余K2CrO4为(1-x)mol,对应的n(K)=2(1-x)mol,n(Cr)=(1-x)mol,生成的K2Cr2O7为[x/2]mol,对应的n(K)=xmol,n(Cr)=xmol,根据:K与Cr的物质的量之比为d,
2(1−x)+x
1−x+x=d,解得x=2-d,转化率为[2−d/1]×100%=2-d,故D错误;
故选D.点评:
本题考点: 电解原理.
考点点评: 本题考查了电解原理,难点是计算转化率,根据原子守恒即可计算其转化率,根据阴阳极上发生的反应类型写出相应的电极反应式.1年前查看全部
- (2012•浙江)以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图:下列说法不正确的是( )
 (2012•浙江)以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图:下列说法不正确的是( )
(2012•浙江)以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图:下列说法不正确的是( )
A.在阴极式,发生的电极反应为:2H2O+2e-=2OH-+H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+⇌Cr2O72-+H2O向右移动
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O
2K2Cr2O7+4KOH+2H2↑+O2↑通电 .
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为1-[d/2] yunguiliu1年前1
yunguiliu1年前1 -
 dahailove_13 共回答了14个问题
dahailove_13 共回答了14个问题 |采纳率92.9%解题思路:A、阴极上得电子发生还原反应,氢离子放电;
B、阳极上水失电子生成氧气和氢离子,氢离子浓度增大导致平衡移动,根据氢离子浓度的变化判断溶液颜色的变化;
C、将阳极室、阴极室发生的反应加合可得总的反应式,注意阴极室还发生反应衡2CrO42-+2H+═Cr2O72-+H2O;
D、根据原子守恒计算其转化率.A、电极均为惰性电极,在阴极室发生还原反应,水得电子变成氢气,电极反应为:2H2O+2e-=2OH-+H2↑,故A正确;
B、阳极室发生氧化反应,水失去电子放电,电极反应为:2H2O-4e-=4H++O2↑,阳极区氢离子浓度增大,平衡右移,故B正确;
C、阴极电极反应为:4H2O+4e-=4OH-+2H2↑,阳极反应为:2H2O-4e-=4H++O2↑,4CrO42-+4H+═2Cr2O72-+2H2O,故总制备方程式为4K2CrO4 +4H2O
电解
.
2K2Cr2O7 +4KOH+2H2↑+O2↑,故C正确;
D、设加入反应容器内的K2CrO4为1mol,反应过程中有xmol K2CrO4转化为K2Cr2O7,则阳极区剩余K2CrO4为(1-x)mol,对应的n(K)=2(1-x)mol,n(Cr)=(1-x)mol,生成的K2Cr2O7为[x/2]mol,对应的n(K)=xmol,n(Cr)=xmol,根据:K与Cr的物质的量之比为d,
2(1−x)+x
1−x+x=d,解得x=2-d,转化率为[2−d/1]×100%=2-d,故D错误;
故选D.点评:
本题考点: 电解原理.
考点点评: 本题考查了电解原理,难点是计算转化率,根据原子守恒即可计算其转化率,根据阴阳极上发生的反应类型写出相应的电极反应式.1年前查看全部
- 以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图:下列说法不正确的是( ) A.在阴极式,发生的电极反应为:2
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图:下列说法不正确的是( ) A.在阴极式,发生的电极反应为:2H 2 O+2e - =2OH - +H 2 ↑ B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H + 浓度增大,使平衡2CrO 4 2- +2H + ⇌Cr 2 O 7 2- +H 2 O向右移动 C.该制备过程总反应的化学方程式为:4K 2 CrO 4 +4H 2 O
2K 2 Cr 2 O 7 +4KOH+2H 2 ↑+O 2 ↑通电 . D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为1- d 2 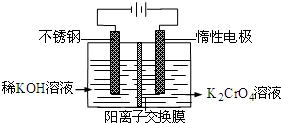
 怡萦1年前1
怡萦1年前1 -
 songyuezhu 共回答了20个问题
songyuezhu 共回答了20个问题 |采纳率90%A、电极均为惰性电极,在阴极室发生还原反应,水得电子变成氢气,电极反应为:2H 2 O+2e - =2OH - +H 2 ↑,故A正确;
B、阳极室发生氧化反应,水失去电子放电,电极反应为:2H 2 O-4e - =4H + +O 2 ↑,阳极区氢离子浓度增大,平衡右移,故B正确;
C、阳极电极反应为:4H 2 O+4e - =4OH - +2H 2 ↑,阳极反应为:2H 2 O-4e - =4H + +O 2 ↑,4CrO 4 2- +4H + ═2Cr 2 O 7 2- +2H 2 O,故总制备方程式为4K 2 CrO 4 +4H 2 O
电解
.
2K 2 Cr 2 O 7 +4KOH+2H 2 ↑+O 2 ↑,故C正确;
D、设加入反应容器内的K 2 CrO 4 为1mol,反应过程中有xmol K 2 CrO 4 转化为K 2 Cr 2 O 4 ,则阳极区剩余K 2 CrO 4 为(1-x)mol,对应的n(K)=2(1-x)mol,n(Cr)=(1-x)mol,生成的K 2 Cr 2 O 4 为
x
2 mol,对应的n(K)=xmol,n(Cr)=xmol,根据:K与Cr的物质的量之比为d,
2(1-x)+x
1-x+x =d ,解得x=2-d,转化率为
2-d
1 ×100%=2-d,故D错误;
故选D.1年前查看全部
- 重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂。工业上以铬酸钾(K 2 CrO 4 )为原料,采用电化学法制备重铬
重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂。工业上以铬酸钾(K 2 CrO 4 )为原料,采用电化学法制备重铬酸钾(K 2 Cr 2 O 7 )。制备装置如下图所示(阳离子交换膜只允许阳离子透过):

制备原理:2CrO 4 2- (黄色)+2H +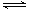 Cr 2 O 7 2- (橙色)+H 2 O
Cr 2 O 7 2- (橙色)+H 2 O
(1)通电后阳极室产生的现象为 ,其电极反应式是 。
(2)该制备过程总反应的离子方程式可表示为4CrO 4 2- +4H 2 O="2" Cr 2 O 7 2- + 4OH - +2H 2 ↑+O 2 ↑,若实验开始时在右室中加入38.8g K 2 CrO 4 ,t分钟后测得右室中K与Cr的物质的量之比为3:2,则溶液中K 2 CrO 4 和K 2 Cr 2 O 7 的物质的量之比为 ;此时电路中转移电子的物质的量为 。 光棍1号1年前1
光棍1号1年前1 -
 yfh99 共回答了15个问题
yfh99 共回答了15个问题 |采纳率80%(每空2分,共8分)
(1)阳极产生无色气体,溶液由黄色逐渐变为橙色;
4OH - -4e - =O 2 ↑+2H 2 O 或2H 2 O-4e - =O 2 ↑+4H +
(2)2:1 ; 0.1 mol
1年前查看全部
- 利用化石燃料开采、加工过程产生的H2S废气通过电化学法制取氢气的工艺如图,下列说法不正确的是( )
利用化石燃料开采、加工过程产生的H2S废气通过电化学法制取氢气的工艺如图,下列说法不正确的是( )

A.反应池中的离子方程式:2Fe3++S2-=2Fe2++S↓
B.该工艺优点之一是FeCl3溶液可循环利用
C.电解池中惰性电极C1为阳极
D.电解池总反应的化学方程式:2FeCl2+2HCl
2FeCl3+H2↑通电 . 小喃5271年前1
小喃5271年前1 -
 来看 共回答了21个问题
来看 共回答了21个问题 |采纳率100%解题思路:反应池中发生氧化还原反应为H2S+2FeCl3=2FeCl2+S↓+2HCl,电解池中亚铁离子失去电子,氢离子得到电子,电解总反应的离子方程式为2Fe2++2H+
2Fe3++H2↑,以此解答该题.通电 .A.由装置可知反应池中的反应物为H2S和FeCl3,生成物S和Fe2+,则反应的化学方程式为H2S+2FeCl3=2FeCl2+S↓+2HCl,离子方程式为2Fe3++H2S=2Fe2++S↓+2H+,故A错误;
B.电解池中生成的FeCl3可作为反应池的反应物,则FeCl3溶液可循环利用,故B正确;
C.C1极生成Fe3+,应发生氧化反应,为阳极,C2极生成氢气,为阴极,发生还原反应,故C正确;
D.电解池中亚铁离子失去电子,氢离子得到电子,电解总反应为2FeCl2+2HCl
通电
.
2FeCl3+H2↑,故D正确.
故选A.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题综合考查电解以及元素化合物知识,为高频考点,侧重于学生的分析能力的考查,注意把握题给信息,掌握电极方程式的书写,难度不大.1年前查看全部
- 以铬酸钾为原料,电化学法制备重铬酸钾…求方程式
以铬酸钾为原料,电化学法制备重铬酸钾…求方程式
阳极的材料是不绣钢,阴是惰性电极…中间有离子交换模,左边是KOH.右边是k2cro4溶液.求阴极室的电极反应室 梦幻失落1年前1
梦幻失落1年前1 -
 3lrfkhq 共回答了17个问题
3lrfkhq 共回答了17个问题 |采纳率82.4%2K2CrO4 + 2H+ = K2Cr2O7 + H2O
从铬酸钾制备重铬酸钾,氧化态没有变化,只是需要外界酸碱度的变化.没有弄明白题目到底想做什么.不需要什么电化学法啊.1年前查看全部
大家在问
- 1牛字旁加建(牛建)怎么念?
- 2电化学中的氧化态,还原态怎么确定
- 3speak to sb.与say to sb.的区别
- 4最外层电子数大于4的原子一定属于非金属元素吗?
- 5好想飞向蓝天,可是我缺少飞往蓝天的那一双翅膀(用英语怎么说)
- 6浓盐酸和亚硫酸钠反应制二氧化硫气体方程式
- 7"有甲,乙两只水桶.把甲桶里的半桶水到入乙桶,刚好装了乙桶的2分之3,再把乙桶的水倒出6分之1后,还剩15千克.
- 8东西的英语单词怎么拼?
- 9锌与盐酸反应,溶液颜色有变化反应么
- 10下字下面一个心读什么字
- 11my future 英语作文,包含翻译
- 12寻找 的英语单词是怎么写?
- 13知道直角三角形两锐角的度数求两锐角对边长度的计算公式
- 14不想找用英文怎么说
- 15“不一会儿,就做完了清洁.”这句话的英语怎么说?
