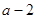阴离子、阳离子、两性离子、非离子表面活性剂在洗发水中的合理结构与作用
 zt21com2022-10-04 11:39:543条回答
zt21com2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 jintianhao123521 共回答了17个问题
jintianhao123521 共回答了17个问题 |采纳率94.1%- 这个太复杂了,你如果为了做洗发水完全没必要研究什么结构问题,除非你有志于诺贝尔奖,把几种表面活性剂的特性掌握就够了
- 1年前
 yanziduoduo 共回答了20个问题
yanziduoduo 共回答了20个问题 |采纳率- 清洁,护发,柔软,去除油脂污垢是一个比较复杂的过程,它与上面提到的润湿、起泡等作用均有关。还有很多方面,不是说阴离子、阳离子、两性离子、非离子表面活性剂在洗发水中的合理结构与作用那么简单,是一个很复杂的知识。
- 1年前
 半若薄弱米 共回答了1个问题
半若薄弱米 共回答了1个问题 |采纳率- 回答得不错
- 1年前
相关推荐
- 离子反应的题某溶液中含有大量Fe2+ Fe3+ Mg2+和NH4+,其中该溶液呈强酸性,则该溶液中可以大量存在的阴离子是
离子反应的题
某溶液中含有大量Fe2+ Fe3+ Mg2+和NH4+,其中该溶液呈强酸性,则该溶液中可以大量存在的阴离子是:
A 硫酸根 B 硝酸根
C 氢氧根 D 碳酸根
答案是A
CD知道肯定错了,问题是为什么硝酸根不行? 0091101年前4
0091101年前4 -
 君君小妞 共回答了20个问题
君君小妞 共回答了20个问题 |采纳率95%硝酸根在强酸条件显强氧化性,可以把Fe2+ 氧化成Fe3+.所以,酸性条件下,硝酸根不能与Fe2+ 大量共存.1年前查看全部
- (2010•安徽)将0.01mol下列物质分别加入100mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液
(2010•安徽)将0.01mol下列物质分别加入100mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)
①Na2O2②Na2O③Na2CO3④NaCl( )
A. ①>②>③>④
B. ①>②>④>③
C. ①=②>③>④
D. ①=②>③=④ ▂▃雨▃▂1年前4
▂▃雨▃▂1年前4 -
 qhtfspz 共回答了17个问题
qhtfspz 共回答了17个问题 |采纳率88.2%解题思路:等物质的量的Na2O2与Na2O分别于水反应生成等物质的量的NaOH,消耗的水的量相同,生成的OH-浓度相同,均约为0.2mol/L,Na2CO3因水解,使阴离子浓度稍增大:CO32-+H2O⇌HCO3-+OH-.由①反应为2Na2O2+2H2O=4NaOH+O2↑,②反应为Na2O+H2O=2NaOH溶于水,二者消耗的水的量相同,生成等物质的量的NaOH,故生成的OH-浓度相同,均约为0.2mol/L,故为①=②;
③中碳酸根水解使得阴离子浓度稍大于④,而④中NaCl的浓度为0.1mol/L,故答案为C.点评:
本题考点: 离子浓度大小的比较;氧化还原反应;盐类水解的应用.
考点点评: 这是一道多年的陈题,对学生守恒思想的考查,是一道典型的“计而不算”的计算题.注意溶液中的化学反应.1年前查看全部
- (2009•湘潭一模)某离子晶体的晶体结构中最小重复单元如图所示:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,
 (2009•湘潭一模)某离子晶体的晶体结构中最小重复单元如图所示:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为( )
(2009•湘潭一模)某离子晶体的晶体结构中最小重复单元如图所示:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为( )
A.B2A
B.BA2
C.B7A4
D.B4A7 marry-小蓉儿1年前1
marry-小蓉儿1年前1 -
 xiaole0212 共回答了24个问题
xiaole0212 共回答了24个问题 |采纳率87.5%解题思路:A位于晶胞的体内,共8个,B位于晶胞的顶点和面心,可利用均摊法计算.A位于晶胞的体内,共8个,B位于晶胞的顶点和面心,晶胞中B的个数为8×[1/8]+6×[1/2]=4,
则B与A的离子个数为4:8=1:2,则化学式为BA2,
故选B.点评:
本题考点: 晶胞的计算.
考点点评: 本题考查晶胞的计算,题目难度不大,解答该类题目注意组成粒子在晶胞的分布,注意均摊法的计算方法的应用.1年前查看全部
- 如何计算阳离子阴离子个数?例如:测得某溶液含CU2+,K+,SO42-,CI四种离子,其中阳离子的个数比为:CU2:K+
如何计算阳离子阴离子个数?
例如:测得某溶液含CU2+,K+,SO42-,CI四种离子,其中阳离子的个数比为:CU2:K+=3:4,则SO42与CI得个数比为? wweigege1年前1
wweigege1年前1 -
 小点声 共回答了14个问题
小点声 共回答了14个问题 |采纳率100%根据正负电荷守恒
因为CU2+:K+=3:4,则设正电荷一共7xmol
则负电荷一共7xmol,又因为阴阳离子数相等
所以SO42与CI得个数比为3:41年前查看全部
- 离子通常可以单独存在?下列说法中正确的是( )A.阳离子一定是金属原子失去电子形成的B.离子通常可以单独存在C.阴离子都
离子通常可以单独存在?
下列说法中正确的是( )
A.阳离子一定是金属原子失去电子形成的
B.离子通常可以单独存在
C.阴离子都是非金属原子得到电子后形成的
D.离子是带电的原子或原子团 joyeelee1年前4
joyeelee1年前4 -
 cola883 共回答了17个问题
cola883 共回答了17个问题 |采纳率88.2%正确答案D
A错,比如NH4+
B错,离子一般成对出现,即电离出一个阴离子同时电离出一个阳离子
C错,有很多金属的离子团,比如MnO4-
D正确,这是离子的定义1年前查看全部
- 阴离子和金属放电顺序我们资料书一般都有介绍,当活泼金属作为阳极时一般都是活泼金属失去电子,那么像铜这种不活泼的金属又该怎
阴离子和金属放电顺序
我们资料书一般都有介绍,当活泼金属作为阳极时一般都是活泼金属失去电子,那么像铜这种不活泼的金属又该怎么办呢?(例子:铜铁氯化钠电解池,铜作为阳极却是氯离子放电,也就是说铜被当做惰性电极,是因为铜和氯化钠,铜和水都无法反应的原因吗?) 皓月狂刀1年前1
皓月狂刀1年前1 -
 恋爱宝贝001 共回答了26个问题
恋爱宝贝001 共回答了26个问题 |采纳率96.2%铜铁氯化钠电解池,铜作为阳极,不是氯离子放电.仍是铜放电变为铜离子.
不活泼的电极一般有:Au Pt 石墨等.金属Mg Al FePb Cu Ag 等是活性电极.
上述活性电极之所以先于溶液中阴离子失电子(放电),归根于其还原性强于有关阴离子.1年前查看全部
- 怎样的是氢分子,氢原子,阴离子,阳离子
怎样的是氢分子,氢原子,阴离子,阳离子
用化学方程式表示 adu3151年前4
adu3151年前4 -
 俏兰 共回答了19个问题
俏兰 共回答了19个问题 |采纳率94.7%氢分子 H2 氢原子H 阴离子H- 阳离子 H+
看来你化学没学好啊,只能用化学符号来表示,这里不存在方程式,我已经用化学符号表示了1年前查看全部
- 离子交换色谱柱分离极弱酸阴离子时为什么要使用碱性淋洗液
 Antonyli1年前1
Antonyli1年前1 -
 tao826yan 共回答了24个问题
tao826yan 共回答了24个问题 |采纳率100%就得知道其原理:
离子色谱是利用相反电荷之间的相互作用来分离的,当检测物质带负电荷时,要选择阴离子色谱柱,阴离子色谱柱带正电荷的配基,进行阴离子-阳离子交换,结合带负电荷的分子
我们的瑞伊缔洗液也是弱碱性1年前查看全部
- 下列有关量的比值一定等于2比1的是 A由氧化钠,过氧化钠组成的混合物中阳离子阴离子的数目
下列有关量的比值一定等于2比1的是 A由氧化钠,过氧化钠组成的混合物中阳离子阴离子的数目
下列有关量的比值一定等于2比1的是
A 由氧化钠,过氧化钠组成的混合物中阳离子与阴离子数目比
B 2摩尔/L 氯化钙溶液 与 1摩尔/L 氯化钙溶液 中溶质物质的量比
C等物质的量的钾,过氧化钠分别与足量的水反应产生气体的体积比
D100毫升 百分之98 硫酸溶液 与100毫升 百分之49的硫酸溶液中溶质质量比 hzx831年前1
hzx831年前1 -
 爱左情右 共回答了14个问题
爱左情右 共回答了14个问题 |采纳率100%答案啊 是A Na2O 中阴离子是O2-,过氧化钠中阴离子是过氧根离子 (O2 后面带2-)
所以不管怎么混合,阳离子比阴离子都是2:1
B 不告诉体积 无法求
C 1:1
D 密度不一样 所以质量比不是2:11年前查看全部
- (12分) 有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子:(每种物质只含一种阳离子和一种阴离子且互不重复
(12分) 有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子:(每种物质只含一种阳离子和一种阴离子且互不重复)
阳离子 Na + 、Ba 2+ 、NH 4 + 、K + 阴离子 CH 3 COO - 、Cl - 、OH - 、SO 4 2 -
已知:①A、C溶液的pH均大于7,B溶液的pH小于7,A、B溶液中水的电离程度相同;D溶液焰色反应显黄色。
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成有刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A的名称是____________。
(2)用离子方程式表示A的水溶液显碱性的原因______________________________。
(3)25 ℃时pH=9的A溶液和pH=9的C溶液中水的电离程度较小的是________(填写A或C的化学式)。
(4)25 ℃时用惰性电极电解D的水溶液,一段时间后溶液的pH________7(填“>”、“<”或“=”)。
(5)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为__________________________________________________。
(6)室温时在一定体积0.2 mol·L -1 的C溶液中,加入一定体积的0.1 mol·L -1 的盐酸时,混合溶液的pH=13,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是________。 恋上一杯水1年前1
恋上一杯水1年前1 -
 披个ss看回帖 共回答了21个问题
披个ss看回帖 共回答了21个问题 |采纳率85.7%1年前查看全部
- 阴离子和负电子 阳离子和正电荷 有什么区别
阴离子和负电子 阳离子和正电荷 有什么区别
如题 zbsd788111年前4
zbsd788111年前4 -
 又是个大东东 共回答了22个问题
又是个大东东 共回答了22个问题 |采纳率90.9%阴离子是单个原子或几个原子结合在一起,又从外界得到了电子,所以带有负电荷
至于负电子,在中学阶段所说的电子都是带负电的,就是在原子核外不停运动的粒子
阳离子和阴离子是一个道理,单个原子或者几个原子结合在一起,失去了电子,所以带正电
原子或原子团失去了电子,带有的就是正电荷1年前查看全部
- 甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离
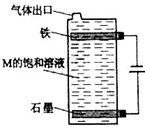 甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离子差8个电子.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L也能与Z的水溶液反应生成盐;丙、戊可组成化合物M.请回答下列问题:
甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离子差8个电子.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L也能与Z的水溶液反应生成盐;丙、戊可组成化合物M.请回答下列问题:
(1)戊离子的结构示意图为______.
(2)写出由甲乙两元素形成的化合物中,既含有极性键又含有非极性键的物质的结构式______;该物质与空气在碱性条件下可构成燃料电池,该电池放电时,负极的反应式为______.
(3)戊的单质与X反应生成的Y和Z的物质的量之比为2:4,反应中被氧化的物质与被还原的物质的物质的量之比为______.
(4)写出少量Z的稀溶液滴入过量L的稀溶液中发生反应的离子方程式:______.
(5)按如图电解M的饱和溶液,写出该电解池中发生反应的总反应方程式:NaCl+H2O
NaClO+H2↑电解 .NaCl+H2O.将充分电解后所得溶液逐滴加入到酚酞试液中,观察到得现象是______.
NaClO+H2↑电解 . longyan1111年前1
longyan1111年前1 -
 zxcdxj 共回答了13个问题
zxcdxj 共回答了13个问题 |采纳率92.3%甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝,则X为NH3,甲为H,乙为N;甲、丙处于同一主族,结合原子序数可知,丙为Na;戊的负一价阴离子与丙的阳离子差8个电子,戊的负一价阴离子核外电子数为18,则戊为Cl;氯气与氨气反应生成氮气,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1,则Y为NH4Cl、Z为HCl;丁的单质既能与丙(Na)元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z(HCl)的水溶液反应生成盐N,丁为两性金属,则丁为Al元素,故L为NaAlO2;丙、戊组成化合物M为NaCl,用石墨作阳极、铁作阴极,电解氯化钠水溶液,生成氢气、氯气与氢氧化钠,氯气与氢氧化钠反应生成氯化钠与次氯酸钠,
(1)Cl-的结构示意图为: ,故答案为:
,故答案为: ;
;
(2)H、N两元素形成的化合物中,既含有极性键又含有非极性键的物质为N2H4,其结构式为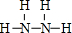 ,负极反应氧化反应,N2H4在负极失去电子,碱性条件下生成氮气与水,负极电极反应式为N2H4+4OH--4e-=N2↑+2H2O,
,负极反应氧化反应,N2H4在负极失去电子,碱性条件下生成氮气与水,负极电极反应式为N2H4+4OH--4e-=N2↑+2H2O,
故答案为: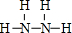 ;N2H4+4OH--4e-=N2↑+2H2O;
;N2H4+4OH--4e-=N2↑+2H2O;
(3)氯气与氨气反应生成的NH4Cl和HCl的物质的量之比为2:4,则NH3与Cl2反应的化学方程式:4NH3+3Cl2═N2+2NH4Cl+4HCl,在反应中氨气做还原剂,氯气做氧化剂,被氧化的物质氨气只占反应掉的一半,被氧化的物质氨气与被还原的物质氯气物质的量之比=2:3,
故答案为:2:3;
(4)将少量的盐酸滴入过量NaAlO2溶液中发生反应的离子方程式为AlO2-+H++H2O═Al(OH)3↓,
故答案为:AlO2-+H++H2O═Al(OH)3↓;
(5)电解饱和氯化钠溶液,反应的方程式为:2NaCl+2H2O
电解
.
2NaOH+Cl2↑+H2↑,同时发生反应Cl2+2NaOH=NaCl+NaClO+H2O,故该电解池中发生反应的总反应方程式为:NaCl+H2O
电解
.
NaClO+H2↑,电解后得到NaClO溶液,显碱性,且具有强氧化性,滴入酚酞溶液中,观察到溶液变红后褪色,
故答案为:NaCl+H2O
电解
.
NaClO+H2↑;溶液变红后褪色.1年前查看全部
- 某元素R的阴离子R 2 - 核外共有a个电子,核内有b个中子,则表示R原子组成符号正确的是 A.
某元素R的阴离子R 2 - 核外共有a个电子,核内有b个中子,则表示R原子组成符号正确的是
A.  R
RB.  R
RC.  R
RD.  R
R 大胡子老林1年前1
大胡子老林1年前1 -
 若相惜121 共回答了15个问题
若相惜121 共回答了15个问题 |采纳率100%1年前查看全部
- 用化学用语按下列要求填空:(1)碳酸钠中的阴离子______;氯化亚铁中的阳离子______;最轻的氧化物______;
用化学用语按下列要求填空:
(1)碳酸钠中的阴离子______;
氯化亚铁中的阳离子______;
最轻的氧化物______;
溶于水后显碱性的气体______.
(2)实验室用稀硫酸与锌粒反应制取氢气:______.
(3)长期存放石灰水的甁壁上会出现一层白膜,其形成的原因是______;该白膜可用稀盐酸除去,其原理是______. iseem1年前1
iseem1年前1 -
 uestcfrank 共回答了20个问题
uestcfrank 共回答了20个问题 |采纳率85%解题思路:(1)离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字.相对分子质量最小的氧化物是水;溶于水后显碱性的气体有氨气.
(2)根据反应物和生成物及质量守恒定律进行分析解答.
(3)根据氢氧化钙和二氧化碳的反应及碳酸钙与盐酸的反应进行分析.(1)离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字.碳酸钠中的阴离子是碳酸根离子,可表示为:CO32-;氯化亚铁中的阳离子的亚铁离子,可表示为:Fe2+;最轻(相对分子质量最小)的氧化物是水,其化学式为:H2O.氨气溶于水后显碱性,化学式为:NH3;
(2)稀硫酸与锌粒生成硫酸锌和氢气,反应方程式为:Zn+H2SO4=ZnSO4+H2↑;
(3)长期存放石灰水的甁壁上会出现一层白膜,其形成的原因氢氧化钙与二氧化碳反应生成了碳酸钙沉淀,反应方程式为:CO2+Ca(OH)2═CaCO3↓+H2O;该白膜可用稀盐酸除去,其原理是碳酸钙能与盐酸发生反应生成可溶性的氯化钙及水、二氧化碳,反应方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑.
故答案为:(1)CO32-Fe2+H2ONH3(2)Zn+H2SO4=ZnSO4+H2↑
(3)CO2+Ca(OH)2═CaCO3↓+H2OCaCO3+2HCl═CaCl2+H2O+CO2↑点评:
本题考点: 化学符号及其周围数字的意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,主要考查同学们对常见化学用语(分子符号、化学式、离子符号、化学方程式等)的书写和理解能力.1年前查看全部
- 某元素原子的质量数为A,它的阴离子Xn-核外有x个电子,w克这种元素的原子核内中子数为( )
某元素原子的质量数为A,它的阴离子Xn-核外有x个电子,w克这种元素的原子核内中子数为( )
A.
molw(A−x+n) A
B.
molw(A+x−n) A
C.
molA(A−x+n) W
D.
molA(A−x−n) A  天之恋1年前1
天之恋1年前1 -
 琦琪哈鱼 共回答了15个问题
琦琪哈鱼 共回答了15个问题 |采纳率93.3%解题思路:先利用n=[m/M]计算原子的物质的量,再由阴离子中质子数=核外电子数-电荷数求出质子数,最后利用质子数与中子数之和等于质量数来计算中子数;w克这种元素的原子的物质的量为[w/A]mol,阴离子Xn-核外有x个电子,则质子数为x-n,中子数为A-(x-n)=A-x+n,则w克这种元素的原子核内中子数为[w/A]mol×(A-x+n)=
w(A−x+n)
A;
故选:A.点评:
本题考点: 质量数与质子数、中子数之间的相互关系.
考点点评: 本题考查学生利用原子构成的简单计算,明确原子的物质的量的计算是解答本题的关键,注意质量数在数值上等于摩尔质量.1年前查看全部
- 7.8克Na2O2含有的阴离子数是多少?
 独来读网01年前4
独来读网01年前4 -
 网兜兜 共回答了18个问题
网兜兜 共回答了18个问题 |采纳率88.9%Na2O2的相对原子量是(23+16)*2=78
所以是0.1mol的Na2O2
因为O2(2-)是一个阴离子团,所以又的阴离子数是0.1mol,约6.02*10^22个1年前查看全部
- 等体积的下列溶液,阴离子的总浓度最大的是( )
等体积的下列溶液,阴离子的总浓度最大的是( )
A.0.2 mol•L-1K2S
B.0.1 mol•L-1Ba(OH)2
C.0.2 mol•L-1NaCl
D.0.2 mol•L-1(NH4)2SO4 钓得寒江1年前1
钓得寒江1年前1 -
 似雪飘落 共回答了20个问题
似雪飘落 共回答了20个问题 |采纳率90%解题思路:溶液中阴离子的物质的量浓度=盐的浓度×化学式中阴离子个数,以及阴离子是否发生水解据此分析解答.0.2 mol•L-1K2S、0.1 mol•L-1Ba(OH)2、0.2 mol•L-1NaCl、0.2 mol•L-1(NH4)2SO4中阴离子的浓度都为0.2 mol•L-1,但K2S因水解,使阴离子浓度稍增大:S2-+H2O⇌HS-+OH-,故选:A....
点评:
本题考点: 物质的量浓度.
考点点评: 本题考查了溶液中阴离子物质的量浓度的计算,难度不大,需要注意的是能够水解的离子.1年前查看全部
- 我是想说,如果PH值达到6-9之间.怎样确定增加阴离子(PAM)的量
 无腿蜈蚣1年前3
无腿蜈蚣1年前3 -
 tanze216 共回答了15个问题
tanze216 共回答了15个问题 |采纳率93.3%你的问题问得不是太详细
什么叫怎么确定阴离子的量
加入多少数量根据调试的结果来确定
每种污水的投加量都不一样1年前查看全部
- 纯净水为什么不能导电电解质是溶于水溶液中或在熔融状态下就能够导电(电解离成阳离子与阴离子)并产生化学变化的化合物.水是电
纯净水为什么不能导电
电解质是溶于水溶液中或在熔融状态下就能够导电(电解离成阳离子与阴离子)并产生化学变化的化合物.水是电解质为什么不能导电 离离原上火1年前1
离离原上火1年前1 -
 大床头柜 共回答了18个问题
大床头柜 共回答了18个问题 |采纳率88.9%水是弱电解质,只能电离出极少的氢离子和氢氧根离子,所以导电性很弱,但它是可以导电的,只不过用我们实验的导电装置测不到(灯泡不亮),用灵敏电流计可以测到电流.1年前查看全部
- CaH2晶体中的阳离子与阴离子的个数比
 1234098001年前1
1234098001年前1 -
 mugege 共回答了17个问题
mugege 共回答了17个问题 |采纳率88.2%1:2
Ca为正二价,H为负一价1年前查看全部
- 水是不是氧化物,什么是阴离子,什么是阳离子
 向前快跑1年前1
向前快跑1年前1 -
 xxxx3214 共回答了22个问题
xxxx3214 共回答了22个问题 |采纳率95.5%水 是氧化物 阴离子是指原子由于外界作用得到一个或几个电子,使其最外层电子数达到稳定结构 阳离子是指原子由于外界作用失去一个或几个电子,使其最外层电子数达到8个或2个电子的稳定结构.1年前查看全部
- 孔雀石绿、甲基橙、亚甲基蓝染料分别是阴离子染料还是阳离子染料?
 海浪w1年前1
海浪w1年前1 -
 倚风流云 共回答了17个问题
倚风流云 共回答了17个问题 |采纳率70.6%孔雀石绿是带有阳电子的阴离子染料,其余两个是阳离子染料.1年前查看全部
- 下列说法正确的是( )A.电离时能生成H+的化合物是酸B.水溶液显碱性的物质是碱C.电解质电离时产生的阴离子全部是OH
下列说法正确的是( )
A.电离时能生成H+的化合物是酸
B.水溶液显碱性的物质是碱
C.电解质电离时产生的阴离子全部是OH-的化合物是碱
D.能与碱发生反应生成水的化合物是酸 乌溜溜5191年前1
乌溜溜5191年前1 -
 zz赌民zz1 共回答了17个问题
zz赌民zz1 共回答了17个问题 |采纳率82.4%解题思路:A、电离出来的阳离子全部是H+的化合物是酸;
B、强碱弱酸盐的水溶液显碱性;
C、碱在溶液中电离的阴离子只有氢氧根离子;
D、酸性氧化物与碱也可以反应.A、电离出来的阳离子全部是H+的化合物是酸,但是电离时能生成H+的化合物不一定是酸,可能是酸式盐,如硫酸氢钠,故A错误;
B、强碱弱酸盐的水溶液显碱性,如碳酸钠在溶液显碱性,碳酸钠属于盐,故B错误;
C、碱在溶液中电离的阴离子只有氢氧根离子,如氢氧化钠在溶液中电离出来的阴离子只有氢氧根离子,故C正确;
D、酸性氧化物与碱也可以反应,如二氧化硫属于酸性氧化物,它与氢氧化钠反应生成亚硫酸钠,故D错误.
故选C.点评:
本题考点: 电解质在水溶液中的电离;酸、碱、盐、氧化物的概念及其相互联系.
考点点评: 本题考查了酸、碱的概念和性质、盐的水解,题目主要考查了学生对基本概念的理解和应用,题目难度不大.1年前查看全部
- (18分)根据下图回答问题:(1)A图是某离子化合物的晶胞(组成晶体的一个最小重复单位),阳离子位于中间,阴离子位于8个
(18分)根据下图回答问题:
(1)A图是某离子化合物的晶胞(组成晶体的一个最小重复单位),阳离子位于中间,阴离
子位于8个顶点,该化合物中阳、阴离子的个数比是_______________。
(2)B图表示构成NaCl晶体的一个晶胞,通过想像与推理,可确定一个NaCl晶胞中含Na +
和Cl - 的个数分别为_______________、_______________。
(3)C图是金刚石的晶体结构,C 60 、金刚石和石墨三者的关系是_______________。
硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅硅单键的数目约是_______________N A 个。二氧化硅的结构相当于在硅晶体结构中每个硅—硅单键之间插入一个氧原子。二氧化硅的空间网状结构中,硅、氧原子形成的最小环上原子数目是_______________。A.同分异构体 B.同素异形体 C.同系物 D.同位素
(4)石墨晶体结构如D图所示,每一层由无数个正六边形构成,则平均每一个正六边形所占有的碳原子数为_______________,“C—C”键数为_______________。
(5)足球烯C 60 结构形如足球,如E图,则C 60 中有_______________个六边形,_______________个五边形。固态时,C 60 属于_______________ (填“离子”、“原子”或“分子”)晶体,C 60 分子中含有双键的数目是_______________。
(6)晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体,如F图。其中含有
20个等边三角形和一定数目的顶角,每个顶角上各有1个原子。试观察F图,推断这个基本结构单元所含硼原子个数、键角、“B—B”键的个数依次为______________、_______________、_______________。 xuzhiwei1991111年前1
xuzhiwei1991111年前1 -
 lsy2003 共回答了20个问题
lsy2003 共回答了20个问题 |采纳率100%(1)1∶1 (2)4 4 (3)B 2 12 (3)2 3
(5)20 12 分子 30 (6)12 60° 30
(1)阳离子数=1,阴离子数=8× =1,即个数比为
=1,即个数比为 。
。
(2)Na + 个数=8× +6×
+6× =4,Cl - 个数=12×
=4,Cl - 个数=12×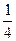 +1=4。
+1=4。
(3)由同一种元素形成的不同单质互称为同素异形体。如红磷、白磷;O 2 、O 3 等。1 mol Si原子形成4 mol Si—Si键,而1 mol Si—Si键为2 mol Si原子共用,所以1 mol Si原子实际“占有”Si—Si键为4 mol× ="2" mol,即为2N a 个。硅晶体最小环上有6个硅原子,每2个硅原子之间插入1个O原子,则共插入6个O原子,所以形成的最小环为12元环。
="2" mol,即为2N a 个。硅晶体最小环上有6个硅原子,每2个硅原子之间插入1个O原子,则共插入6个O原子,所以形成的最小环为12元环。
(4)一个正六边形中C原子数=6× =2,C—C键数=6×
=2,C—C键数=6× =3。
=3。
(5)B原子数=20×3× =12。等边三角形,键角为60°。B—B键数=20×3×
=12。等边三角形,键角为60°。B—B键数=20×3× =30。
1年前查看全部
=30。
1年前查看全部
- 从H、S、O、Ca四种元素中,选择适当的元素填写符合下列要求的化学式:一种带一个单位负电荷的阴离子
 蓝色露珠1年前3
蓝色露珠1年前3 -
 玖伍 共回答了12个问题
玖伍 共回答了12个问题 |采纳率100%OH-、HS-、HSO4-、H-、O2-(超氧根离子)1年前查看全部
- 电解质溶液中,阴离子阳离子均以水合离子形式存在,如H离子结合H2O形成H3O-,下面书写错误的是
电解质溶液中,阴离子阳离子均以水合离子形式存在,如H离子结合H2O形成H3O-,下面书写错误的是
A.CuSO4=Cu﹙2+﹚+SO4﹙2-﹚ B.Hcl+H2o=H3O﹙+﹚+Cl﹙-﹚ C.NaHSO4=Na﹙+﹚+HSO4﹙-﹚ D· NaHCO3=Na﹙+﹚+HCO3﹙-﹚ dengaspl1年前1
dengaspl1年前1 -
 eastlifer 共回答了28个问题
eastlifer 共回答了28个问题 |采纳率92.9%C项错误,高中阶段认为硫酸氢根离子在水中完全电离,所以应拆开
NaHSO4+H2O==Na(+)+H3O(+)+SO4(-)1年前查看全部
- 一个阳离子 一个阴离子 他们的电子数和质子数都相等.可能吗.举例说明、
 green6543211年前4
green6543211年前4 -
 刚想换手机 共回答了21个问题
刚想换手机 共回答了21个问题 |采纳率85.7%不可能
如果电子数相等,那么阳离子的质子数必定多
我先回答的~1年前查看全部
- (问下面这句话为什么错了):在NAHCO3溶液中加入与其等物质的量的NAOH溶液中,阴离子只有CO3 2- 和OH-
 54fd5d22d11年前4
54fd5d22d11年前4 -
 vg8en4k 共回答了19个问题
vg8en4k 共回答了19个问题 |采纳率89.5%NaHCO3+NaOH=Na2CO3+H2O
因为NaHCO3和NaOH物质的量相等,
所以两者恰好完全反应,生成物为Na2CO3和水
但CO32-会水解,CO32- + H2O=HCO3- + OH-
水解产生少量HCO3-,所以阴离子还有HCO3-1年前查看全部
- 与氖原子核外电子排布相同的阳离子,跟与氩原子核外电子排布相同的阴离子所形成的化合物化学式是
与氖原子核外电子排布相同的阳离子,跟与氩原子核外电子排布相同的阴离子所形成的化合物化学式是
1.CCl4 2.Na2S 3.KCl 4.KF
为什么?
在多电子原子中,能量最高的电子是
A.离原子核最近的电子
B.一定是第1电子层的电子
C.在化学反应中最易失去的电子
D.在化学反应中最难失去的电子
第1题选择题我更改清楚点
A.CCl4
B.Na2S
C.KCl
D .KF 陈加强1年前3
陈加强1年前3 -
 moses_han 共回答了17个问题
moses_han 共回答了17个问题 |采纳率76.5%与氖原子核外电子排布相同的阳离子
意思就是失去电子后的离子和氖相同,所以必定是下一个周期的金属元素.
Na Mg Al
与氩原子核外电子排布相同的阴离子
意思就是得到电子后离子的电子排部与氩相同,所以必定是本周期的非金属元素.
P S Cl
所以选Na2S
第二题选C
能量高表示不稳定,容易失去
电子层数越高能量越高
A B都是能量最低的
D难失去也表示能量低1年前查看全部
- 常用LAS阴离子废水处理方法有哪些?
 nanrem1年前1
nanrem1年前1 -
 籽籽的天空 共回答了20个问题
籽籽的天空 共回答了20个问题 |采纳率95%常用LAS阴离子废水处理方法有:
1、膜分离法
是利用膜的高渗透选择性来分离溶液中的溶剂和溶质.可用膜分离中的超滤和纳滤技术来处理LAS废水.
2混凝处理法
常用于表面活性剂废水处理的混凝剂有铁盐、铝盐及有机聚合物类.混凝反应不仅能去除废水中胶体颗粒和吸附在胶体表面上的LAS,还可与溶解在水相中的LAS形成难溶性的沉淀.
3、催化氧化法
催化氧化法是对传统化学氧化法的改进与强化.常用的Fenton试剂氧化即为催化氧化法的一种,属均相氧化法.处理时,如果铁盐浓度较高,LAS的去除主要靠絮凝作用;浓度低时,则主要靠氧化作用.近年来,催化氧化法又出现了多相催化氧化法和光催化氧化法.
4、泡沫分离法
是向废水中通入空气,生成气泡,使废水中的LAS吸附于气泡表面,升至水面富集形成泡沫层,除去泡沫层,将LAS从废水中浓缩分离出来的过程.
5、吸附分离法
常用的吸附剂包括活性炭、吸附树脂、硅藻土及高岭土等各种固体物料.对LAS废水用活性炭法处理效果较好,常温下对LAS的吸附容量可达到55.8mg/g.但活性炭再生能耗大,且再生后吸附能力亦有不同程度降低,因而其应用受到限制.
6、生物氧化法
生物法是LAS废水的主要处理方法,包括活性污泥法、生物膜及UASB等.可降解LAS的菌种包括邻单胞菌属的革兰氏阴性杆菌、黄单胞菌属的革兰氏阴性短杆菌等生物氧化法可直接处理偏碱性的LAS废水,设备简单,处理能力大,出水的pH值符合排放要求.
7、微电解法
复极性固定床电解法是一种较新型的水处理方法,它是在电解反应器中填充粒子,外加直流电场,使其中的导电粒子复极化而形成无数微小的电解单位,污染物被吸附到粒子表面发生电化学反应而被氧化除去的过程.
8、吸附法
常用的吸附剂主要包括活性炭、吸附树脂、硅藻土、高岭土等.常温下对表面活性剂废水用活性炭法处理效果较好,活性炭对LAS废水的吸附容量可达到55.8mg/g,活性炭吸附符合Freundlich公式.活性炭再生能耗大,且再生后吸附能力亦有不同程度的降低,因而限制了其应用.用吸附树脂处理表面活性剂废水,其优点是吸附速度快、稳定性好、再生容易,主要缺点是预处理较繁琐,一次性投资大.1年前查看全部
- 2核10电子的阴离子 啥意思
 觳鹱醐1年前1
觳鹱醐1年前1 -
 请用大脑想 共回答了18个问题
请用大脑想 共回答了18个问题 |采纳率88.9%两个原子形成的10电子微粒1年前查看全部
- 试分析离子晶体中,阴离子扩散系数一般都小于阳离子扩散系数的原因.
 家乡的早餐1年前1
家乡的早餐1年前1 -
 ShowSolo 共回答了18个问题
ShowSolo 共回答了18个问题 |采纳率94.4%阳离子的扩散系数通常比阴离子大.因为阳离子失去了它们的价电子,它们的离子半径比阴离子小,因而更易扩散.例如,在NaCl中,氯离子的扩散激活能约是钠离子的2倍. 看看这个,http://wlxt.xhu.edu.cn/UploadFiles/course/clkxjc2005/WebCourse/chapter4/c4-s8.asp.htm1年前查看全部
- 有A、B、C、D四种可溶性离子化合物,它们的阳离子是Ag+、Na+、Mg2+、Cu2+,阴离子是Cl-、OH-、NO3-
有A、B、C、D四种可溶性离子化合物,它们的阳离子是Ag+、Na+、Mg2+、Cu2+,阴离子是Cl-、OH-、NO3-、SO42-(每种离子只能用一次)现将溶液两两混合,记录现象如下:A+B→白色沉淀;2B+D→白色沉淀;C+D→蓝色沉淀则A、B、C、D的化学式分别是______、______、______、______.
 qq1096072111年前2
qq1096072111年前2 -
 jonem 共回答了23个问题
jonem 共回答了23个问题 |采纳率87%解题思路:题设各离子中能组合为白色沉淀的物质有AgCl、Mg(OH)2;又D与其他物质反应产生一种白色沉淀、一种蓝色沉淀,题设各离子中能组合为蓝色沉淀的物质只有Cu(OH)2,这样可以确定D中含OH-,从而确定D为NaOH;再由“B+D→白色沉淀”确定B为MgCl2;由A、B反应情况确定A为AgNO3;由C、D反应情况确定C为CuSO4.题设各离子中能组合为白色沉淀的物质有AgCl、Mg(OH)2;又D与其他物质反应产生一种白色沉淀、一种蓝色沉淀,题设各离子中能组合为蓝色沉淀的物质只有Cu(OH)2,这样可以确定D中含OH-,从而确定D为NaOH;再由“B+D→白色沉淀”确定B为MgCl2;由A、B反应情况确定A为AgNO3;由C、D反应情况确定C为CuSO4.故四种物质分别为AgNO3、MgCl2、CuSO4、NaOH,
故答案为:AgNO3;MgCl2;CuSO4;NaOH.点评:
本题考点: 物质的检验和鉴别的实验方案设计.
考点点评: 本题考查物质的检验和鉴别,为高频考点,把握发生的反应及习题中的信息为解答的关键,侧重分析、推断能力的考查,注意白色沉淀、蓝色沉淀为推断的突破口,题目难度不大.1年前查看全部
- X、Y、Z、W四种短周期元素,若X的阳离子与Y的阴离子具有相同的电子层结构,W的阳离子氧化性强于等电荷的X阳离子的氧化性
X、Y、Z、W四种短周期元素,若X的阳离子与Y的阴离子具有相同的电子层结构,W的阳离子氧化性强于等电荷的X阳离子的氧化性,Z的阴离子半径大于等电荷的Y的阴离子半径,且Z离子所带电荷数的绝对值是W离子的两倍,W离子与Z离子的电子层相差两层.试推断这四种元素X_______,Y_________,Z_________,W_______.
 dy6141年前4
dy6141年前4 -
 dol3k 共回答了22个问题
dol3k 共回答了22个问题 |采纳率86.4%X、Y、Z、W四种短周期元素,Z离子所带电荷数的绝对值是W离子的两倍,一般可得z离子和y离子带两个单位的负电荷,又因为Z的阴离子半径大于等电荷的Y的阴离子半径,所以z为硫元素、y为氧元素.同时说明w离子带一个单位的正电...1年前查看全部
- 根据下列微粒的结构示意图判断,表示阴离子的是( )
根据下列微粒的结构示意图判断,表示阴离子的是( )
A.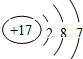
B.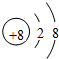
C.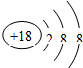
D.
 半佛僧人1年前1
半佛僧人1年前1 -
 naruto0912 共回答了15个问题
naruto0912 共回答了15个问题 |采纳率73.3%解题思路:根据当核电荷数=质子数=核外电子数,为原子;当核电荷数=质子数>核外电子数,为阳离子;当核电荷数=质子数<核外电子数,为阴离子;进行解答.由微粒结构示意图可知:
A.核电荷数=质子数=核外电子数=17,为原子.故A不符合题意;
B.核电荷数=质子数=8<核外电子数=10,为阴离子.故B符合题意;
C.核电荷数=质子数=核外电子数=18,为原子.故C不符合题意;
D.核电荷数=质子数=核外电子数=19,为原子.;故D不符合题意.
故选B.点评:
本题考点: 原子结构示意图与离子结构示意图.
考点点评: 本题考查学生根据当核电荷数、质子数与核外电子数的关系辨别微粒种类方法的掌握与应用的能力.1年前查看全部
- 电解质溶液中,阴离子和阳离子均以水合离子形式存在,如H+可以结合一个水分子形成H3O+.下列物质的电离方程式错误的是(
电解质溶液中,阴离子和阳离子均以水合离子形式存在,如H+可以结合一个水分子形成H3O+.下列物质的电离方程式错误的是( )
A.CuSO4═Cu2++SO42−
B.HCl+H2O═H3O++Cl-
C.NaHCO3═Na++HCO3−
D.NaHSO4═Na++HSO+SO4− 科小月1年前1
科小月1年前1 -
 萨娜优啦 共回答了20个问题
萨娜优啦 共回答了20个问题 |采纳率95%解题思路:用化学式和离子符号表示电离过程的式子,称为电离方程式,表示物质溶解于水时电离成离子的化学方程式;可根据质量守恒定律及电荷守恒来检查电离方程式书写的正误.A、该电离方程式符合电荷守恒、离子符号正确,该电离方程式书写完全正确.
B、该电离方程式符合电荷守恒、离子符号正确,该电离方程式书写完全正确.
C、该电离方程式符合电荷守恒、离子符号正确,该电离方程式书写完全正确.
D、硫酸氢钠的电离方程式应为:NaHSO4═Na++HSO4-.
故选D.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查电离方程式的书写,掌握电离方程式的书写方法是正确解答本题的关键.1年前查看全部
- 简单非金属阴离子只有还原性,而金属阳离子不一定只有氧化性?
简单非金属阴离子只有还原性,而金属阳离子不一定只有氧化性?
什么是简单非金属阴离子?S2-是吗那他不既有还原型又有氧化性吗但答案这个选项又是对的 hazaline1年前2
hazaline1年前2 -
 男炎之隐 共回答了23个问题
男炎之隐 共回答了23个问题 |采纳率91.3%S2-化合价为-2已经最低了,所以没有氧化性,只有还原性1年前查看全部
- 等体等浓度NaCl溶液和CH3COONa溶液中的阴离子总数比较,那种溶液中的阴离子总数多?Why?
 liarfu1年前1
liarfu1年前1 -
 普洛提亚 共回答了16个问题
普洛提亚 共回答了16个问题 |采纳率100%NaCl溶液中的阴离子浓度比较大
一楼说的一样多,那是没有考虑NaCl溶液中水的电离.CH3COO-水解成CH3COOH和OH- 水解部分被OH-抵消 相当于把水电离的OH-都算在内!
从电荷守恒角度来看:
NaCl溶液中的阴离子浓度为:c(Cl-) + c(OH-) = c(Na+) + c(H+)
CH3COONa溶液中的阴离子浓度为:
c(CH3COO-)+ c(OH-) = c(Na+) + c(H+)
等体等浓度NaCl溶液和CH3COONa溶液中的Na+浓度是相等的.而因为NaCl溶液呈中性.CH3COONa溶液中呈碱性,所以NaCl溶液中的H+浓度大于CH3COONa溶液中的H+浓度..
那么:c(Cl-) + c(OH-) > c(CH3COO-)+ c(OH-) 所以NaCl溶液中的阴离子浓度比较大!1年前查看全部
- 怎样最容易判断是阴离子和阳离子Y和最容易判断化合物,氧化物、单质、纯净物,混合物
 小马过河-01年前3
小马过河-01年前3 -
 allenwxy 共回答了25个问题
allenwxy 共回答了25个问题 |采纳率92%带正电荷的是阳离子,带负电荷的是阴离子.
由多种元素组成的纯净物是化合物
只有氧元素和其他一种元素组成的化合物是氧化物
只由一种元素组成的纯净物是单质
只含有一种物质的是纯净物
含有多种物质的是混合物1年前查看全部
- 化学电极反应中得注意负极生成的阳离子能否和电解质中的阴离子共存,不能共存则写入反应式中,为什么呢
化学电极反应中得注意负极生成的阳离子能否和电解质中的阴离子共存,不能共存则写入反应式中,为什么呢
Zn Cu Hcl原电池中Zn离子不能和Cl离子共存,可以生成Zncl,Cl离子怎么不写到电极反应式中呢? 窗子的aa1年前1
窗子的aa1年前1 -
 niunai80_hh 共回答了15个问题
niunai80_hh 共回答了15个问题 |采纳率100%Zn离子和Cl离子可以共存啊,ZnCl2在溶液中是以离子存在的 ,ZnCl2在熔融态也是有着很好的导电性能,虽然Zn和Al一样都是两性金属,但是氯化铝是共价化合物,熔融态不导电,但是氯化锌是可以的,这一点你可以搜百科:http://baike.baidu.com/view/525735.htm1年前查看全部
- 下列有关电化学知识的叙述正确的是( ) A.原电池中,溶液中的阴离子向正极移动 B.电解法提纯铜时,一定用纯铜作阴极
下列有关电化学知识的叙述正确的是( )
A.原电池中,溶液中的阴离子向正极移动 B.电解法提纯铜时,一定用纯铜作阴极 C.电解池中,阳极本身一定不参加反应 D.电解池工作时,阳极上不一定析出物质  幸福村的不幸福哦1年前1
幸福村的不幸福哦1年前1 -
 wang_god 共回答了22个问题
wang_god 共回答了22个问题 |采纳率72.7%BD
原电池中,阴离子移向负极,阳离子移向正极;电解池中,如果阳极是活泼金属,那么阳极就参加反应;电解池工作时,阳极上可能有物质析出,如Cl - 放电生成Cl 2 ,也可能没有物质析出。1年前查看全部
- 碱的定义是在水溶液中电离出的阴离子全是氢氧根离子 那超强碱为什么不含氧元素
碱的定义是在水溶液中电离出的阴离子全是氢氧根离子 那超强碱为什么不含氧元素
例如 叔丁基锂 化学式是C4H9Li 黄油球1年前1
黄油球1年前1 -
 yaozongchen 共回答了22个问题
yaozongchen 共回答了22个问题 |采纳率100%你所说的碱的定义是属于酸碱电离理论的:它由阿伦尼乌斯提出,在水溶液中电离出的阳离子全部是氢离子的化合物叫做酸,在水溶液中电离出的阴离子全部是氢氧根离子的化合物叫做碱
超强碱的判断定义依据是路易斯酸碱理论:Lewis给出了更为广泛的酸碱理论,凡是能接受电子对的物质都是酸,凡是能给出电子对的物质都是碱.
比如硼酸能接受水中氢氧根上的电子而呈酸性,为典型的路易斯酸,氨分子上有孤对电子,为路易斯碱
叔丁基锂中的叔丁基负离子有很强的给出电子对的能力,接受外界的氢离子或其他亲电物质,所以
叫路易斯碱,超强碱一般是比氢氧根离子碱性更强的物质,它们能与水中氢离子结合,最后大多均生成溶液里的“最强碱”(OH-)1年前查看全部
- 若使含有AG+、MG2+、BA2+溶液中的阴离子逐渐沉淀,选择的试剂1是——
若使含有AG+、MG2+、BA2+溶液中的阴离子逐渐沉淀,选择的试剂1是——
沉淀1是——
选择的试剂2是——
沉淀2是——
选择的试剂3是——
沉淀3是——
别人问我的·
她说是阴离子没错`` 小小鸟_111年前3
小小鸟_111年前3 -
 j0691 共回答了10个问题
j0691 共回答了10个问题 |采纳率100%试剂1是——NaCl
沉淀1是——AgCl
选择的试剂2是——Na2SO4
沉淀2是——BaSO4
选择的试剂3是——NaOH
沉淀3是—Mg(OH)21年前查看全部
- 某溶液中含有 SiO32-、SO32- 、AlO2- 、NO3- 等四种阴离子,若向其中加入过量的盐酸溶液,充分反应,一
某溶液中含有 SiO32-、SO32- 、AlO2- 、NO3- 等四种阴离子,若向其中加入过量的盐酸溶液,充分反应,一段时间后,再加入过量的 NaOH 溶液,则 溶液中一定大量减少的阴离子是( ) A.NO3- B. SiO32- C.SO32-D.AlO2-
 Caryli82711年前2
Caryli82711年前2 -
 舞者狂野 共回答了21个问题
舞者狂野 共回答了21个问题 |采纳率76.2%3SO32- +2NO3-+2H+=3SO42-+2NO+H2O
答案AC1年前查看全部
- 盐酸盐是含氯离子的化合物还是阴离子只有氯离子的化合物?
 bluetrace1年前1
bluetrace1年前1 -
 西门有恨 共回答了16个问题
西门有恨 共回答了16个问题 |采纳率100%金属离子与氯离子的化合物1年前查看全部
- 0.1mol OH-1的质量跟多少克氢氧化钙含有相同数目的阴离子?
 那些记忆1年前1
那些记忆1年前1 -
 尚三74 共回答了18个问题
尚三74 共回答了18个问题 |采纳率94.4%0.1mol OH-1的质量
0.1*17===1.7克
多少克氢氧化钙含有相同数目的阴离子?
0.05mol氢氧化钙有相同的阴离子的,
0.05*74==3.7克1年前查看全部
- 量子理论的N个问题,1离子化合物呈共价性所需的条件中,阴离子的半径要大,这号理解,那为什么书上说阴离子的电荷量(char
量子理论的N个问题,
1离子化合物呈共价性所需的条件中,阴离子的半径要大,这号理解,那为什么书上说阴离子的电荷量(charge实在不会翻)也要大呢?
2 SO2和SO3离子(-2假)的立体性状,即如何判断的?
3当一个分子中有5组成键电子对,并且没有孤电子对(lone pairs)时,分子的立体形状是什么样的?
4键角(bond angle)该怎么算啊?
5冰的密度为什么比水小?
6如何确定我没见过的分子的形状啊?比如BF3,PH3,CLF3,这些该怎么判断呢?
7一些比较奇怪的现象?为什么一个分子内部有4个成键电子对,0个孤电子对时形状就是正四面体(tetrahedral)?还有,电子对相对于中心原子的位子到底故不固定?如果3个成键电子对,2个孤电子对,形状就是T型,按VSEPR理论那就是说2个孤电队与成键电子对是在同一平面内,且在院子的同一边,为什么是这样的位置关系啊?
请先回答4,6,7 题
应为是从英文直接反过来的,有些词可能会翻错.
1那请问价电子数和分子的形状关系是固定的,例如3个价电子一定是平面三角形?
2孤电子对的位置如何确定?就比如水分子,假设以O原子为原点,做三维坐标轴,两个H原子相对放在XY平面内,可是根据水的形状看另两对孤对电子则是在O原子的同一边,使得两个与H的键弯曲。但为什么这两个孤对电子不会是沿Z轴排列,一个在O上,一个在O下,那么整个分子的形状就不会改变了?难道说孤对电子的位置也是固定的?
3就是SO2,和SO3(—2)的立体结构图,还有T型分子,我的习题说他们是平面的(planar),但是我用VSEPR判断出的根本就不是平面啊!
分肯定是会加的! wengzhangnn1年前1
wengzhangnn1年前1 -
 来亲普 共回答了18个问题
来亲普 共回答了18个问题 |采纳率88.9%4.键角(bond angle)是共价化合物的属性,一般的算法可以用余弦定理做.
6.可以根据VSEPR模型判断,方法:
价电子对数(n) 立体结构 范例 杂化类型
n=2 直线形 CO2 SP
n=3 平面三角形 CH2O SP2
n=4 正四面体形 CH4 SP3
判断价电子对数的方法:价电子对数= σ键数 + 孤对电子对数
如 BF3,结构式是 F-B-F 有3个 σ键,没有孤对电子,则BF3为平面三角形
I
F (且3个σ键相等也可以说是正三角形)
同理,PH3 ,P最外层有1对孤对电子对,和3个σ键,则为正四面体形(这是VSEPR模型),实际是PH3的立体结构是三角锥形(用VSEPR模型判断后要减去孤对电子对的影响,如H2O,VSEPR模型是正四面体形,但O有2对孤对电子对,所以就成了V行,其实原理很简单,就相当于孤对电子的排斥作用使直线弯曲变成V行.)
CLF3?
7.价电子有排斥作用,至于4个成键电子对,0个孤电子对时形状就是正四面体的问题我个人的看法是:4个σ键组成立体结构的稳定性应该较好,要是3个σ键,就算三角形,稳定性也是很好的.还有可能是为了能量最低化,可以想一下4个σ键如果是在同一平面的话,键角之和是360,平均也就是90,而像正四面体形键角的109.28,这样能量低.你说的T行也不一定要在用一平面(不好说,空间想象能力,想明白就行了.)
5.这和氢键有关系吧,水结成冰,氢键使之空间结构有序,导致体积增大(质量不变),所以密度减小.
(我也是高二学生,能力有限,如果你还不明白,我个人认为还是回归书本的好,选修3 物质的结构与性质》.累死了.)1年前查看全部
- 1升0.1摩尔每升NaHCO3溶液中含有的阴离子数目为0.1NA 为什么错了 看明白定好
1升0.1摩尔每升NaHCO3溶液中含有的阴离子数目为0.1NA 为什么错了 看明白定好
1升0.1摩尔每升NaHCO3溶液中含有的阴离子数目为0.1NA 为什么错了 看明白定好评 nvliang1年前1
nvliang1年前1 -
 zhuhj_4775 共回答了11个问题
zhuhj_4775 共回答了11个问题 |采纳率72.7%溶液中有氢氧根离子有HCO3-少量电离出的CO3-则阴离子远大于0.1NA1年前查看全部
- 英语翻译利用离子色谱法(IC)对莆田市的PM2.5中的水溶性阴离子(F-、Cl-、No3-、So42-)进行了分析测定,
英语翻译
利用离子色谱法(IC)对莆田市的PM2.5中的水溶性阴离子(F-、Cl-、No3-、So42-)进行了分析测定,并对相关的条件进行探讨.通过对采样滤膜的比较,发现用过氯乙烯滤膜优于超细玻璃纤维滤膜;通过对提取方法的比较,发现用超声波提取效果优于加热搅拌提取和静置提取;通过提取效率的实验,发现用超声波提取两次试液就已经提取完全.同时实验表明,莆田PM2.5浓度已经轻微超标,且其中的水溶性阴离子主要为No3-、So42-,No3-主要来源为汽车尾气排放,So42-则是由于煤的燃烧. man20021年前1
man20021年前1 -
 戳我下載 共回答了15个问题
戳我下載 共回答了15个问题 |采纳率80%The water solubleanions(F-,Cl-,No3-,So42-)in PM2.5in Putianwere measured and analyzedusingion chromatography(IC),and relevant factors were discussed.By comparison ofsampling filtermembranes, it was foundthat perchloroethylenefiltermembrane is better than the ultra-fine glassfiber filtermembrane;by comparison of theextraction methods,it was found thatthe effect in ultrasonic extractionmethod is better than that ofheatingand stirring extractionmethod andstaticextraction method;by theexperimentof extraction efficiency,it was found thatthe desired solutionis fully extractedin two extractions withthe ultrasonic extraction method.It was also indicated in the experiments thatthe PM2.5 concentration in Putianexceeded the standardslightly,in which thewater solubleanions were mainlyNo3-and So42-: the No3-mainly came from vehicle emissionswhile the So42-came from the combustion of coal.1年前查看全部
大家在问
- 1银离子、二价锌离子、二价镍离子的分离与鉴定
- 2by plane怎么造句
- 3以“时间是构成生命的材料”为中心论点的议论文
- 4溶解度是100g溶液中溶质的质量还是100g溶剂中含的溶质的质量
- 5we need someone to help with the work.请问不定式为什么是做定语,而不是宾补和状语?
- 6一辆汽车3\4小时行了60千米,每小时行多少千米
- 7一批彩电,经过两次降价后价格由原来的每台2250元降为1440元.则平均每次降价的百分率为多少?
- 8如图是一张生物概念图,有关分析不正确的是 [ ] A.A、B是体液调节和
- 9“在不远的将来”用英语怎么讲?
- 10I hope that our talk has given you some insights ___ the kin
- 11一个自然数各位上的数字之和是6,而且各位数字都不同,符合这样条件的自然数一共有多少个?要简便
- 121.It is still a question_____we shall have our sports meetin
- 13短文综合填空(本大题满分11分,每空1分)
- 14某中学高二有1000名学生,中段考数学成绩服从正态分布N(85,25),则这1000名学生中75分以下的人数共有多少人
- 15用英语描写一次旅游经历