“烂板液”是制印刷锌板时,用稀HNO 3 腐蚀锌板后得到的废液,主要含Zn(NO 3 ) 2 和由自来水带进的Cl -
 好想化为妖精2022-10-04 11:39:541条回答
好想化为妖精2022-10-04 11:39:541条回答| “烂板液”是制印刷锌板时,用稀HNO 3 腐蚀锌板后得到的废液,主要含Zn(NO 3 ) 2 和由自来水带进的Cl - 、Fe 3+ 等杂质离子。在实验室中由“烂板液”制取ZnSO 4 ·7H 2 O的过程如下 |
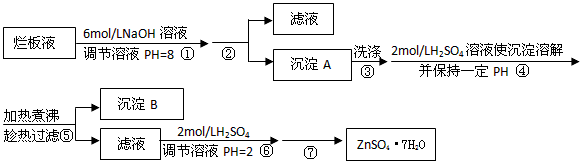 |
| 已知有关金属离子形成氢氧化物沉淀时的pH见下表 |
 |
| ⑴第①反应是使Zn 2+ 、Fe 3+ 沉淀,检验Fe 3+ 是否沉淀完全的操作是____________。 ⑵第②步操作中需要的玻璃仪器有____________。 ⑶第④步中PH应保持在____________范围内。 ⑷第⑥步调节溶液PH=2的目的是____________。 ⑸操作⑦包含3个基本实验操作,它们是蒸发浓缩、____________和过滤。 |

已提交,审核后显示!提交回复
共1条回复
 草月花妤 共回答了18个问题
草月花妤 共回答了18个问题 |采纳率100%- ⑴取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe 3+ 沉淀完全
⑵漏斗、玻璃棒、烧杯
⑶3.2~6.4
⑷抑制Zn 2+ 水解
⑸冷却结晶 - 1年前
相关推荐
- “烂板液”是制印刷锌板时,用稀HNO 3 腐蚀锌板后得到的废液,主要含Zn(NO 3 ) 2 和由自来水带进的Cl -
“烂板液”是制印刷锌板时,用稀HNO 3 腐蚀锌板后得到的废液,主要含Zn(NO 3 ) 2 和由自来水带进的Cl - 、Fe 3+ 等杂质离子.在实验室中由“烂板液”制取ZnSO 4 •7H 2 O的过程如下: 
已知有关金属离子形成氢氧化物沉淀时的PH见下表:
(1)第①反应是使Zn 2+ 、Fe 3+ 沉淀,检验Fe 3+ 是否沉淀完全的操作是______.离子 开始沉淀时的PH 完全沉淀时的PH Fe 3+ 1.9 3.2 Zn 2+ 6.4 8.0
(2)第②步操作中需要的玻璃仪器有______.
(3)第④步中PH应保持在______.
(4)第⑥步调节溶液PH=2的目的是______.
(5)操作⑦包含3个基本实验操作,它们是______、______和过滤. 我是长颈鹿1年前1
我是长颈鹿1年前1 -
 夕阳晚风 共回答了12个问题
夕阳晚风 共回答了12个问题 |采纳率100%(1)用SCN - 检验Fe 3+ 是否有剩余,故答案为:取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe(OH) 3 沉淀完全;
(2)过滤需要用到玻璃仪器有漏斗、玻璃棒、烧杯,故答案为:漏斗、玻璃棒、烧杯;
(3)第④步目的是使Fe 3+ 完全沉淀,Zn 2+ 不沉淀故应调节PH为3.2~6.4,故答案为:3.2~6.4;
(4)锌离子易水解生成氢氧化锌,酸性条件下可抑制锌离子的水解,故答案为:抑制Zn 2+ 水解;
(5)操作⑦包括蒸发浓缩,冷却结晶,过滤,故答案为:蒸发浓缩;冷却结晶(或降温结晶).1年前查看全部
- “烂板液”是制印刷锌板时,用稀HNO 3 腐蚀锌板后得到的废液,主要含Zn(NO 3 ) 2 和由自来水带进的Cl -
“烂板液”是制印刷锌板时,用稀HNO 3 腐蚀锌板后得到的废液,主要含Zn(NO 3 ) 2 和由自来水带进的Cl - 、Fe 3+ 等杂质离子。在实验室中由“烂板液”制取ZnSO 4 ·7H 2 O的过程如下:

已知有关金属离子形成氢氧化物沉淀时的pH见下表:(1)沉淀B的主要成分是 。离子 开始沉淀时的pH 完全沉淀时的pH Fe 3+ 1.9 3.2 Zn 2+ 6.4 8.0
(2)第②步操作中需要的玻璃仪器有 。
(3)第④步中pH应保持在 范围内。
(4)第⑥步调节溶液pH=2的目的是 。
(5)操作⑦包含3个基本实验操作,它们是蒸发浓缩、 和过滤。 决波步景1年前1
决波步景1年前1 -
 lym830119 共回答了16个问题
lym830119 共回答了16个问题 |采纳率81.3%⑴Fe(OH) 3 ⑵漏斗、玻璃棒、烧杯⑶3.2~6.4⑷抑制Zn 2+ 水解⑸冷却结晶(或降温结晶) 略 ...1年前查看全部
- 制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”.“烂板液”中含硝酸锌外,还含有自来水带入的Cl-和Fe3+.
制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”.“烂板液”中含硝酸锌外,还含有自来水带入的Cl-和Fe3+.在实验室里,用“烂板液”制取ZnSO4•7H2O的过程如下:
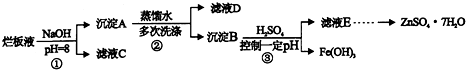
(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是______.
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠.写出Zn(OH)2被溶解的离子方程式______.
(3)滤液D中除了含有OH-离子外,还含有的阴离子有______(填离子符号).
(4)若滤液E的pH=4,c(Zn2+)=2mol•L-1,c(Fe3+)=2.6×l0-9mol•L-1,能求得的溶度积是______(填选项).A、Ksp[Zn(OH)2]B、Ksp[Zn(OH)2和Ksp[Fe(OH)3]C、Ksp[Fe(OH)3]
(5)步骤③要控制pH在一定范围.实验室用pH试纸测定溶液pH的方法是:______.
(6)已知:①Fe(OH)3(s)⇌Fe3+(aq)+OH-(aq)△H=aKJ•mol-1 ②H2O(1)⇌H+(aq)+OH-(aq)△h=bKJ•mol-1请写出Fe3+发生水解反应的热化学方程式______.
若①的溶度积常数为KSP,②的离子积常数为KW,Fe3+发生水解反应的平衡常数K=K 3wKsp .(用含KSP、KW的代数式表示)K 3wKsp  寻找中1年前1
寻找中1年前1 -
 mayyj 共回答了18个问题
mayyj 共回答了18个问题 |采纳率88.9%解题思路:(1)若稀硝酸腐蚀锌板时还原产物为N2O,则反应的方程式为4Zn+10HNO3=4Zn(NO3)2+N2O↑+5H2O,根据方程式判断氧化剂与还原剂的物质的量之比;
(2)根据反应物和生成物确定反应的离子方程式;
(3)固体具有吸附性,沉淀A可吸附溶液中的Cl-、NO3-等离子,则滤液中应含有Cl-、NO3-;
(4)滤液E的pH=4,得到的沉淀为Fe(OH)3,只能计算Fe(OH)3的溶度积;
(5)测定溶液pH时,将pH试纸放在玻璃片上,用玻璃棒蘸取待测液点在试纸中间,待颜色变化稳定后与比色卡对比你,读出读数即可;
(6)利用盖斯定律计算反应热,可写出Fe3+发生水解反应的热化学方程式,利用①②平衡常数可确定Fe3+发生水解反应的平衡常数.(1)若稀硝酸腐蚀锌板时还原产物为N2O,则反应的方程式为4Zn+10HNO3=4Zn(NO3)2+N2O↑+5H2O,由方程式可知反应中HNO3为氧化剂,Zn为还原剂,当4molZn参加反应时,有2molHNO3被还原,则氧化剂与还原剂的物质的量之比1:2,故答案为:1:2;
(2)Zn(OH)2溶解生成四羟基合锌酸钠,反应的离子方程式为Zn(OH)2+2OH-=[Zn(OH)4]2-,故答案为:Zn(OH)2+2OH-=[Zn(OH)4]2-;
(3)固体具有吸附性,沉淀A可吸附溶液中的Cl-、NO3-等离子,则滤液中应含有Cl-、NO3-,故答案为:Cl-、NO3-;
(4)滤液E的pH=4,得到的沉淀为Fe(OH)3,只能计算Fe(OH)3的溶度积,故答案为:C;
(5)测定溶液pH时,将pH试纸放在玻璃片上,用玻璃棒蘸取待测液点在试纸中间,待颜色变化稳定后与比色卡对比,读出读数即可,注意不能事先湿润试纸,更不能将试纸插在溶液中,
故答案为:将pH试纸放在玻璃片上,用玻璃棒蘸取待测液点在试纸中间,待颜色变化稳定后与比色卡对比,读出读数;
(6)Fe3+发生水解反应的方程式为Fe3++3H2O⇌Fe(OH)3+3H+,
已知①Fe(OH)3(s)⇌Fe3+(aq)+3OH-(aq)△H=aKJ•mol-1
②H2O(l)⇌H+(aq)+OH-(aq)△H=bKJ•mol-1,
则利用盖斯定律将②×3-①可得Fe3+(aq)+3H2O(l)⇌Fe(OH)3(aq)+3H+(aq)△H=(3b-a)KJ•mol-1,
则Fe3+发生水解反应的平衡常数K=
K3w
Ksp,
故答案为:Fe3+(aq)+3H2O(l)⇌Fe(OH)3(aq)+3H+(aq)△H=(3b-a)KJ•mol-1;
K3w
Ksp.点评:
本题考点: 金属的回收与环境、资源保护;用盖斯定律进行有关反应热的计算;盐类水解的原理;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查物质的制备,为高考常见题型,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握题给信息,答题时注意审题,难度中等.1年前查看全部
- (2009•宝安区模拟)“烂板液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含少量的Cl-、Fe3+),某化学兴
(2009•宝安区模拟)“烂板液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含少量的Cl-、Fe3+),某化学兴趣小组拟用“烂板液”制取Zn(NO3)2•6H2O的过程如图:
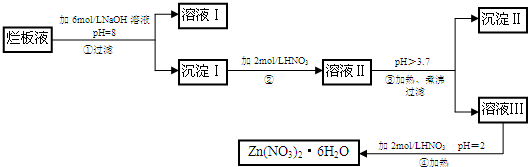
已知:Zn(NO3)2•6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2溶液能与碱反应,得到的产物有两性.回答下列问题:
(1)“烂板液”中溶质的主要成分是______(填化学式),若稀硝酸腐蚀锌板产物的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式:______
(2)在操作①中保持pH=8的目的是______.
(3)沉淀Ⅰ的主要成分是______.
(4)操作③中加热煮沸的目的是______;此步操作的理论依据是______.
(5)操作④保持pH=2的目的是______;此步操作中所用的主要仪器有:______. 9qq1221年前1
9qq1221年前1 -
 最快不过光光跑36 共回答了19个问题
最快不过光光跑36 共回答了19个问题 |采纳率84.2%解题思路:“烂板液”中含有大量的锌离子、氢离子、硝酸根离子和少量的Cl-、Fe3+,加入氢氧化钠调节溶液的PH=8使铁离子、锌离子完全沉淀,然后在沉淀Ⅰ中加硝酸溶解,溶液Ⅱ中含有大量锌离子、氢离子、硝酸根离子和少量的铁离子,调节溶液的PH使铁离子沉淀,溶液Ⅲ是硝酸锌溶液,在酸性条件下加热浓缩蒸发结晶,得到Zn(NO3)2•6H2O是一种无色晶体.
(1)烂板液”中溶质的主要成分是Zn(NO3)2,此时硝酸很稀,硝酸中的氮被还原+1价;
(2)使锌离子完全转化为氢氧化锌,PH不大,如果PH加大氢氧化锌两性又溶解;
(3)Zn2+、Fe3+完全沉淀生成相应的氢氧化物;
(4)热煮沸促使Fe3+完全水解;
(5)锌离子易水解生成氢氧化锌,操作④包括蒸发浓缩,冷却结晶,过滤.“烂板液”中含有大量的锌离子、氢离子、硝酸根离子和少量的Cl-、Fe3+,加入氢氧化钠调节溶液的PH=8使铁离子、锌离子完全沉淀,然后在沉淀Ⅰ中加硝酸溶解,溶液Ⅱ中含有大量锌离子、氢离子、硝酸根离子和少量的铁离子,调节溶液的PH使铁离子沉淀,溶液Ⅲ是硝酸锌溶液,在酸性条件下加热浓缩蒸发结晶,得到Zn(NO3)2•6H2O是一种无色晶体.
(1)烂板液”中溶质的主要成分是Zn(NO3)2,此时硝酸很稀,硝酸中的氮被还原+1价,发生的化学反应为4Zn+10HNO3=4Zn(NO3)2+N2O↑+5H2O,
故答案为:Zn(NO3)2、4Zn+10HNO3=4Zn(NO3)2+N2O↑+5H2O;
(2)使锌离子完全转化为氢氧化锌,PH不大,如果PH加大氢氧化锌两性又溶解,故答案为:防止生成的Zn(OH)2溶解;
(3)Zn2+、Fe3+完全沉淀生成相应的氢氧化物,故答案为:Fe(OH)3、Zn(OH)2;
(4)热煮沸促使Fe3+完全水解,原理是温度越高,水解程度越大,故答案为:促使Fe3+完全水解、温度越高,水解程度越大;
(5)锌离子易水解生成氢氧化锌,酸性条件下可抑制锌离子的水解,操作④包括蒸发浓缩,冷却结晶,过滤,所用的主要仪器有蒸发皿、酒精灯、铁架台、玻璃棒,
故答案为:抑制Zn2+水解生成Zn(OH)2;蒸发皿、酒精灯、铁架台、玻璃棒.点评:
本题考点: 常见金属元素的单质及其化合物的综合应用.
考点点评: 本题考查氢氧化锌的两性、过滤的仪器、沉淀的生成、盐类的水解等,难度不大,注意锌离子易水解生成氢氧化锌,酸性条件下可抑制锌离子的水解.1年前查看全部
- “烂板液”是制印刷锌板时,用稀HNO 3 腐蚀锌板后得到的废液,主要含Zn(NO 3 ) 2 和由自来水带进的
“烂板液”是制印刷锌板时,用稀HNO 3 腐蚀锌板后得到的废液,主要含Zn(NO 3 ) 2 和由自来水带进的
Cl - 、Fe 3+ 等杂质离子。在实验室中由“烂板液”制取ZnSO 4 ·7H 2 O的过程如下
已知有关金属离子形成氢氧化物沉淀时的PH见下表 
(1)第①反应是使Zn 2+ 、Fe 3+ 沉淀,检验Fe 3+ 是否沉淀完全的操作是____________________________。
(2)第②步操作中需要的玻璃仪器有_______________。
(3)第④步中PH应保持在_______________范围内。
(4)第⑥步调节溶液PH=2的目的是______________________________。
(5)操作⑦包含3个基本实验操作,它们是蒸发浓缩、_______________和过滤。 907891年前1
907891年前1 -
 网为媒 共回答了12个问题
网为媒 共回答了12个问题 |采纳率58.3%(1)取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe 3+ 沉淀完全。
(2)漏斗、玻璃棒、烧杯
(3)3.2~6.4
(4)抑制Zn 2+ 水解
(5)冷却结晶1年前查看全部
大家在问
- 1一件商品原价1800元,先降价10%,再提价10%出售,还是1800元吗?如果不是那么是亏本还是盈利了呢?
- 2a、b、c是三个不同自然数,且a+b+c=18,则a×b×c最大值为( )
- 3为什么汽车要限速?功能与势能的相互转换来回答!
- 4英语翻译1.你的建议对我们的帮助极大 2.今年早上浴室没有水压(pressure) 3.她刚进来的时候她抬头瞥了他一眼(
- 5题目是这样的:当速率为30m/s的西风正吹时,相对于地面,向东、向西和向北传播的声音的速率各是多大?已知声音在空气中传播
- 62414示差折光检测器中的RIU模式怎么改为410模式
- 7证明:(2L+M)×(M+2N)÷(M+N+L)÷(M+N+L)
- 8(2011•绍兴县)将圆柱体的侧面展开,将得不到( )
- 9解方程组a-b+c=3、a+b+c=3、4a+2b+c=6
- 10一次函数y=k1x+b的图像经过点(0,-4)且与正比例函数y=k2x的图像交于点(2,-1)
- 11设X是离散型随机变量,则其概率分布律 应满足什么性质?
- 12初三化学 若用加热氯酸钾的方法制取氧气,要搜集到200ml氧气,计算计算理论上需要消耗氯酸钾的质量.(已知氧气在该实验条
- 13,质量M=4Kg的小车放在光滑的水平面上,在小车右端放一个质量m=1Kg的小物体.小物块与小车间的动摩擦因素u=0.1,
- 14a是自然数,19a8aa是一个六位数,这个数一定是( )的倍数
- 15下列各句中,划线的词语运用正确的一项是( ) A.近日各处人员有不告假而行者,有 久假不归 、托
