0.02mol·L-1的HCN溶液与0.02mol·L-1的NaCN溶液等体积混合,不考虑任何变化 那么HCN溶液、Na
 mingshixuan2022-10-04 11:39:542条回答
mingshixuan2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 安堇 共回答了21个问题
安堇 共回答了21个问题 |采纳率90.5%- 因为溶液体积增大了一倍,而溶质的量不变,因此浓度变为原来的二分之一了.
- 1年前
 wsk9911 共回答了159个问题
wsk9911 共回答了159个问题 |采纳率- 溶液等体积混合时,体积为原体积的两倍,但是一般因为物质微粒间有间隙,混合后体积可能在两倍基础上有所变化(略大或略小),“不考虑任何变化”即是说不考虑溶液混合后可能引起的体积微小变化,这是中学阶段常用的假设,在实际计算中也可忽略不计。因溶液体积为原来的两倍,自然浓度为原来的1/2...
- 1年前
相关推荐
- 一种液态有机物一种液态有机物0.02mol在氧气中完全燃烧,生成0.72g水和标准状况下的二氧化碳气体0.896L;等物
一种液态有机物
一种液态有机物0.02mol在氧气中完全燃烧,生成0.72g水和标准状况下的二氧化碳气体0.896L;等物质的量的此有机物与足量碳酸钠反应,放出的二氧化碳气体在标准状况下的体积是0.224L。求该有机物的分子式和结构简式。 as70691年前4
as70691年前4 -
 丹参片护心 共回答了27个问题
丹参片护心 共回答了27个问题 |采纳率85.2%该有机物燃烧生产二氧化碳和水,
水的摩尔数是0.04 (0.72/18),对应原来的氢原子是0.08摩尔.
二氧化碳的摩尔数0.04 (0.896/22.4),对应原来化合物中碳的摩尔数是0.04.
所以该化合物中,氢原子数是碳原子数的2 倍.
假设分子中碳原子个数为n,则氢原子个数为2n.假设含氧原子为x.则该化合物的分子式可写为CnH2nOx
根据燃烧反应,0.02摩尔该化合物生产0.04摩尔的水和0.04摩尔的二氧化物,则1摩尔该化合物可生成2摩尔的二氧化碳和2摩尔的水.
配平的反应式可表示如下:
CnH2nOx + [(6-x)/2]O2 = 2CO2 + 2H2O
这样,n = 2.而使(6-x)/2为整数的最小的x值为2.因此该化合物的分子式为C2H4O2.
等物质的量的此有机物与足量碳酸钠反应,放出的二氧化碳气体在标准状况下的体积是0.224L,即0.01摩尔,所以该化合物应该是一元羧酸.符合C2H4O2分子式的一元羧酸为乙酸.结构简式为CH3COOH.
配平的反应方程式为:
Na2CO3 + 2CH3COOH = 2CH3COONa + CO2 + H2O
所以:
该化合物的分子式为C2H4O2
该化合物的结构简式为CH3COOH.乙酸,或醋酸.1年前查看全部
- 将0.03mol Cl2缓缓通入含0.02mol H2SO3和0.02mol HBr的混合
将0.03mol Cl2缓缓通入含0.02mol H2SO3和0.02mol HBr的混合溶液中,在此过程溶液的c(H+)与Cl2用量的关系示意图是(溶液的体积视为不变)( )
A.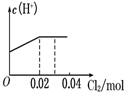
B.
C.
D.
 晓晨必胜1年前2
晓晨必胜1年前2 -
 hnkl 共回答了16个问题
hnkl 共回答了16个问题 |采纳率75%解题思路:亚硫酸根离子与溴离子都具有还原性,但是亚硫酸根离子还原性强于溴离子,通入氯气后,氯气首先氧化H2SO3为H2SO4,H2SO3反应完毕,然后再氧化Br-,由于Br-全部转变Br2,所以HBr和H2SO3都完全被氧化.亚硫酸根离子与溴离子都具有还原性,但是亚硫酸根离子还原性强于溴离子,通入氯气后,氯气首先氧化H2SO3为H2SO4,H2SO3反应完毕,然后再氧化Br-.
氯气氧化亚硫酸生成硫酸:
Cl2 +H2SO3 +H2O=H2SO4 +2HCl
0.02mol 0.02mol 0.02mol 0.04mol
H2SO3为弱酸,生成两种强酸:H2SO4和HCl,c(H+)增大,H2SO3反应完毕,消耗 Cl20.02mol,Cl2过量0.01mol,然后再氧化Br-:
Cl2 +2HBr=Br2 +2HCl
0.01mol 0.02mol
HBr全部被氯气氧化转变为Br2 和HCl,HCl和HBr都是强酸,所以c(H+)不变;
故选:A.点评:
本题考点: 氯气的化学性质.
考点点评: 本题考查了氯气的性质已经有关氧化还原反应的计算,明确亚硫酸根离子与溴离子还原性强弱顺序是解题关键,难度不大.1年前查看全部
- 1g乙醇完全燃烧生成二氧化碳,液态水时放出29.713KJ热量,计算燃烧0.02mol乙醇放出的热量能使100g水的温度
1g乙醇完全燃烧生成二氧化碳,液态水时放出29.713KJ热量,计算燃烧0.02mol乙醇放出的热量能使100g水的温度升高多少?
 jessica6705301年前1
jessica6705301年前1 -
 keliana12 共回答了22个问题
keliana12 共回答了22个问题 |采纳率81.8%0.02mol乙醇是46*0.02=0.92克
释放的热量是29.713KJ*0.92=27.34kj
水的比热是11年前查看全部
- 如下图两个电解槽中,A、B、C、D均为石墨电极.如果电解过程中共有0.02mol电子通过,下列叙述中正确的是( )
如下图两个电解槽中,A、B、C、D均为石墨电极.如果电解过程中共有0.02mol电子通过,下列叙述中正确的是( )
A.甲烧杯中A极上最多可析出铜0.64g
B.甲烧杯中B极上电极反应式为:
4OH——4e—=2H2O+O2↑
C.乙烧杯中滴入酚酞试液,D极附近变红
为什么两个都是电解池呢?为什么C对呢,右边那个池子里的OH-不是应该都向C移动么,既然OH-都移到C那了,那么D那即使有H+生成但没有OH-应该不变色么为什么还会变 -暴风雪-1年前2
-暴风雪-1年前2 -
 锦州大事 共回答了21个问题
锦州大事 共回答了21个问题 |采纳率85.7%因为接有电源,所以两者均是电解池.
Cu2+ +2e-==Cu
------2-----64
------0.02---m
m=0.64g1年前查看全部
- (2012•青浦区二模)取研细的KClO3、I2各0.02mol置于锥形瓶中,在不断摇动的情况下,慢慢加入浓盐酸,直到I
(2012•青浦区二模)取研细的KClO3、I2各0.02mol置于锥形瓶中,在不断摇动的情况下,慢慢加入浓盐酸,直到I2完全消失,没有气体产生.将锥形瓶置于冰水中,有橙红色晶体A析出,剩余溶液中只检出K+和Cl-.取少量A放入试管中,发现A在常温下就会有升华现象.若将A水浴加热,产生红棕色液体B和黄绿色气体.
(1)试确定A的化学式.______
(2)能否确定B的化学式?说明理由.______. robert20041年前1
robert20041年前1 -
 sxjczqq 共回答了14个问题
sxjczqq 共回答了14个问题 |采纳率92.9%解题思路:(1)根据元素守恒确定A中含有的元素,再根据得失电子数相等确定A的化学式;
(2)可以从元素守恒、原子的结构、元素化合价等方面分析.(1)A是共价化合物,含氯不含钾,且含碘0.04mol,设A中碘的化合价是x,根据电子守恒0.02×6=0.04x,x=3,所以A的化学式为ICl3,答:A的化学式为ICl3;
(2)可以确定,B的化学式为ICl,因为两种原子最外层电子都达到8电子稳定结构,答:可以确定,B的化学式为ICl,因为两种原子最外层电子都达到8电子稳定结构.点评:
本题考点: 氯、溴、碘及其化合物的综合应用.
考点点评: 本题考查化学式的确定,根据元素守恒、氧化还原反应中得失电子数相等来分析解答即可,难度较大.1年前查看全部
- 把0.02mol/LHAc溶液和0.01mol/LNaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是( )
把0.02mol/LHAc溶液和0.01mol/LNaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是( )
A. c(Ac-)>c(Na+)
B. c(HAc)>c(Ac-)
C. 2c(H+)=c(Ac-)-c(HAc)
D. c(HAc)+c(Ac-)=0.01mol•L-1 痛又奈何1年前1
痛又奈何1年前1 -
 打oo天才5 共回答了14个问题
打oo天才5 共回答了14个问题 |采纳率92.9%解题思路:0.02mol/LHAc溶液和0.01mol/LNaOH溶液等体积混合,则实质上是0.005mol/LHAc溶液和0.005mol/LNaAc溶液,该溶液显酸性,然后利用电荷守恒及物料守恒等来分析离子浓度的关系.A、因混合后为0.005mol/LHAc溶液和0.005mol/LNaAc溶液,该溶液显酸性,c(H+)>c(OH-),由电荷守恒关系可得c(H+)+c(Na+)=c(Ac-)+c(OH-),则c(Ac-)>c(Na+),故A正确;
B、混合后为0.005mol/LHAc溶液和0.005mol/LNaAc溶液,酸的电离大于盐的水解,则c(Ac-)>c(HAc),故B错误;
C、由电荷守恒c(H+)+c(Na+)=c(Ac-)+c(OH-),物料守恒关系c(HAc)+c(Ac-)=2c(Na+),则2c(H+)=(Ac-)+2 c(OH-)-c(HAc),故C错误;
D、因混合后为0.005mol/LHAc溶液和0.005mol/LNaAc溶液,由物料守恒可知c(HAc)+c(Ac-)=c(Na+)×2=0.01mol/L,故D正确;
故选AD.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算;离子浓度大小的比较.
考点点评: 本题考查溶液中离子的浓度关系,明确混合后溶液的溶质是解答的关键,并注意一般酸与盐的混合溶液中溶液显酸性来解答即可,学会合理应用电荷守恒及物料守恒来解题,题目难度中等.1年前查看全部
- 把0.02mol/LHAc溶液和0.01mol/LNaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是( )
把0.02mol/LHAc溶液和0.01mol/LNaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是( )
A.c(Ac-)>c(Na+)
B.c(HAc)>c(Ac-)
C.2c(H+)=c(Ac-)-c(HAc)
D.c(HAc)+c(Ac-)=0.01mol•L-1 太_阳_以_西1年前1
太_阳_以_西1年前1 -
 gu_sumercool 共回答了27个问题
gu_sumercool 共回答了27个问题 |采纳率100%解题思路:0.02mol/LHAc溶液和0.01mol/LNaOH溶液等体积混合,则实质上是0.005mol/LHAc溶液和0.005mol/LNaAc溶液,该溶液显酸性,然后利用电荷守恒及物料守恒等来分析离子浓度的关系.A、因混合后为0.005mol/LHAc溶液和0.005mol/LNaAc溶液,该溶液显酸性,c(H+)>c(OH-),由电荷守恒关系可得c(H+)+c(Na+)=c(Ac-)+c(OH-),则c(Ac-)>c(Na+),故A正确;
B、混合后为0.005mol/LHAc溶液和0.005mol/LNaAc溶液,酸的电离大于盐的水解,则c(Ac-)>c(HAc),故B错误;
C、由电荷守恒c(H+)+c(Na+)=c(Ac-)+c(OH-),物料守恒关系c(HAc)+c(Ac-)=2c(Na+),则2c(H+)=(Ac-)+2 c(OH-)-c(HAc),故C错误;
D、因混合后为0.005mol/LHAc溶液和0.005mol/LNaAc溶液,由物料守恒可知c(HAc)+c(Ac-)=c(Na+)×2=0.01mol/L,故D正确;
故选AD.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算;离子浓度大小的比较.
考点点评: 本题考查溶液中离子的浓度关系,明确混合后溶液的溶质是解答的关键,并注意一般酸与盐的混合溶液中溶液显酸性来解答即可,学会合理应用电荷守恒及物料守恒来解题,题目难度中等.1年前查看全部
- 在1.0L0.02mol/LHAC溶液中,加多少固体NaAc才能使[H+]为 6.5mol/L
 麻花辫子兰兰1年前2
麻花辫子兰兰1年前2 -
 buyinggai 共回答了17个问题
buyinggai 共回答了17个问题 |采纳率88.2%把[H+]为 6.5mol/L 改为10^-5mol/L好么,计算方法如下:
溶液的[H+]为10^-5mol/L 溶液的PH=5根据
PH=PKa[H+]-lg[HAc]/[NaAC]
5=4.757-lg[HAc]/[NaAC]
lg[HAc]/[NaAC]=-0.243
[HAC]/[NaAC]=0.57
那么需要醋酸钠0.02/0.57=0.035摩尔,质量是0.35×82=2.88克1年前查看全部
- 0.02mol/L硫酸还是c(h+)=0.1mol/L的溶液 酸性比较强?
 ynhlvm1年前2
ynhlvm1年前2 -
 zengwei9808 共回答了16个问题
zengwei9808 共回答了16个问题 |采纳率87.5%0.02mol/L的硫酸中氢离子浓度为0.04mol/L,所以当然是氢离子浓度等于0.1mol/L的酸性强了1年前查看全部
- 0.01mol的碳酸钠与0.02mol盐酸反映生成二氧化碳,加下列哪种物质可以减慢速率而不影响CO2的生成
0.01mol的碳酸钠与0.02mol盐酸反映生成二氧化碳,加下列哪种物质可以减慢速率而不影响CO2的生成
A:BACL2 B:K2SO4 C:KOH D:NAHCO3
说明一下原因哈.
我化学一直不好.. sumida1年前9
sumida1年前9 -
 hzstarraw 共回答了17个问题
hzstarraw 共回答了17个问题 |采纳率70.6%A加入BaCl2后,生成了BaCO3,是一种沉淀,使得溶液中碳酸根离子的浓度减小,使反应物的浓度下降,速率减慢,但一边反应,BaCO3一边溶解,释放出碳酸根离子,使总体反应的碳酸根离子数不变,所以不影响CO2生成.1年前查看全部
- 铁铝合金与稀硝酸反应0.04mol铁和0.02mol铝与适量稀硝酸溶液反应,生成0.05mol一氧化氮
 huahuadan8031年前1
huahuadan8031年前1 -
 lxiia7516 共回答了19个问题
lxiia7516 共回答了19个问题 |采纳率100%产生0.02molAl3+ 0.03molFe2+ 0.01molFe3+1年前查看全部
- 某烃A 0.02mol在氧气中充分燃烧后,生成物依次通过浓硫酸和碱石灰,浓硫酸质量增加1.8g,碱石灰增重4.
某烃A 0.02mol在氧气中充分燃烧后,生成物依次通过浓硫酸和碱石灰,浓硫酸质量增加1.8g,碱石灰增重4.4g.该烃的气体对H2的相对密度是35.
(1)烃A的分子式为______.
(2)烃A燃烧的化学方程式为2C5H10+15O2
10CO2+10H2O点燃 2C5H10+15O2.
10CO2+10H2O点燃
(3)若烃A能使溴水褪色,在催化剂作用下与H2加成,其加成产物分子中含有3个甲基,则A可能的结构简式为______(写出两种即可);其中一种分子中,所有碳原子都在同一平面内,用键线式表示它______,它发生加聚反应的化学方程式为______. hf9231年前1
hf9231年前1 -
 紫焱ZY 共回答了12个问题
紫焱ZY 共回答了12个问题 |采纳率83.3%解题思路:(1)某烃A 0.02mol在氧气中充分燃烧后,生成物依次通过浓硫酸和碱石灰,浓硫酸质量增加1.8g为水的质量,水的物质的量=[1.8g/18g/mol]=0.1mol,碱石灰增重4.4g为二氧化碳的质量,其物质的量=[4.4g/44g/mol]=0.1mol,根据原子守恒可知烃A的分子式为C5H10;
(2)烃完全燃烧生成二氧化碳与水;
(3)若烃A能使溴水褪色,在催化剂作用下与H2加成,则A含有1个C=C双键,其加成产物分子中含有3个甲基,故加成产物为异戊烷,还原双键确定A的可能结构;
其中一种分子中,所有碳原子都在同一平面内,其中有一种分子中,所有碳原子都在同一平面内,对应烯烃应为(CH3)2C=CH-CH3,据此解答.(1)某烃A 0.02mol在氧气中充分燃烧后,生成物依次通过浓硫酸和碱石灰,浓硫酸质量增加1.8g为水的质量,水的物质的量=[1.8g/18g/mol]=0.1mol,碱石灰增重4.4g为二氧化碳的质量,其物质的量=[4.4g/44g/mol]=0.1mol,根据原子守恒可知,烃A的分子中C原子数目=[0.1mol/0.02mol]=5、H原子数目=[0.1mol×2/0.02mol]=10,故烃A的式为C5H10,
故答案为:C5H10;
(2)烃C5H10完全燃烧生成二氧化碳与水,化学方程式为:2C5H10+15O2
点燃
10CO2+10H2O,
故答案为:2C5H10+15O2
点燃
10CO2+10H2O;
(3)若烃A能使溴水褪色,在催化剂作用下与H2加成,则A含有1个C=C双键,其加成产物分子中含有3个甲基,故加成产物为异戊烷,则A可能的结构简式为: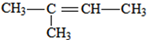 、
、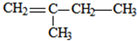 、
、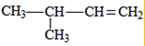 ;
;
以上结构简式中,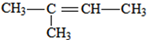 可以看作甲基取代了乙烯中的三个氢原子,所有其分子中所有碳原子共平面,其用键线式为:
可以看作甲基取代了乙烯中的三个氢原子,所有其分子中所有碳原子共平面,其用键线式为: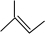 ,
,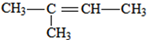 发生加聚反应的方程式为:
发生加聚反应的方程式为: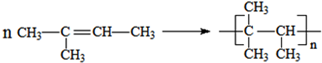 ,
,
故答案为: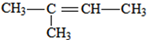 、
、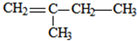 、
、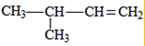 (任意两种);
(任意两种); ;
;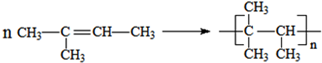 .
.点评:
本题考点: 有关有机物分子式确定的计算;有机物实验式和分子式的确定.
考点点评: 本题考查了有机物分子式确定、同分异构体等,侧重于同分异构体、有机物性质的考查,为高考常见题型,题目难度中等.1年前查看全部
- 0.02mol/LHAc与0.2mol/LHCl等体积混合的PH值为多少
0.02mol/LHAc与0.2mol/LHCl等体积混合的PH值为多少
理论PH值怎么算? 7754248781年前3
7754248781年前3 -
 锅后超级大丑B 共回答了25个问题
锅后超级大丑B 共回答了25个问题 |采纳率92%盐酸是强酸,可以强烈抑制醋酸的电离,所以这种混合可以看成盐酸的稀释过程.既然是等体积混合,混合后盐酸浓度为0.1mol/L,所以ph=11年前查看全部
- 酸性高锰酸钾溶液能氧化铵根吗那关于0.1mol的(NH4)2Fe(SO4)2.6H2O和0.02mol的酸性高锰酸钾溶液
酸性高锰酸钾溶液能氧化铵根吗
那关于0.1mol的(NH4)2Fe(SO4)2.6H2O和0.02mol的酸性高锰酸钾溶液的反应的离子方程式为什么没有牵扯到铵根的氧化呢?
离子方程式是:5Fe2+ + MnO4- + 8H+ =5Fe3+ + Mn2+ + 4H2O bjyw5281年前3
bjyw5281年前3 -
 老豆干 共回答了15个问题
老豆干 共回答了15个问题 |采纳率86.7%酸性高锰酸钾具有强氧化性,而二价铁离子具有还原性,铵根还原性很弱,所以反应优先,轮不到铵根反应.1年前查看全部
- 水解与电离的题0.02mol/L的HCN溶液与0.02mol/LNaCN溶液等体积混合,已知该混合溶液中c(Na+)>c
水解与电离的题
0.02mol/L的HCN溶液与0.02mol/LNaCN溶液等体积混合,已知该混合溶液中c(Na+)>c(CN-),用>, guhongying1111年前2
guhongying1111年前2 -
 dcsbecfxi10a8 共回答了18个问题
dcsbecfxi10a8 共回答了18个问题 |采纳率100%上楼1 2 对
3 =
体积混合 浓度为0.02mlo/L1年前查看全部
- 高一计算离子浓度和pH值.急.分别计算0.02mol,L-1和0.2mol,L-1的CH3COOH溶液的H+浓度和溶液的
高一计算离子浓度和pH值.急.
分别计算0.02mol,L-1和0.2mol,L-1的CH3COOH溶液的H+浓度和溶液的pH,并对结果做出简单分析. yangfeng10201年前4
yangfeng10201年前4 -
 longshao110119 共回答了19个问题
longshao110119 共回答了19个问题 |采纳率94.7%HAc = H+ + Ac-
c 0 0
c-x x x
设醋酸起始浓度为c,电离出H+浓度为x,Ac-浓度为x
查表可知醋酸pKa=4.76,即Ka=10^(-4.76)=1.74*10^(-5)
∴Ka=x*x/(c-x)
因c>>x,∴c-x≈c,即Ka=x^2/c
∴x=√(cKa)
对于0.02mol/L的溶液,c=0.02mol/L
代入得x=[H+]=√[0.02*1.74*10^(-5)]=5.9*10^(-4) mol/L
pH=-lg[H+]=-lg[5.9*10^(-4)]=3.23
对于0.2mol/L的溶液,c=0.2mol/L
代入得x=[H+]=√[0.2*1.74*10^(-5)]=1.9*10^(-3) mol/L
pH=-lg[H+]=-lg[1.9*10^(-3)]=2.73
从所得结果看,溶液浓度增加10倍,pH降低0.5个单位1年前查看全部
- 以石墨为阳极、铁为阴极电解200mL氯化钠溶液.当转移了0.02mol电子后停止电解.若溶液体积前后不变,
以石墨为阳极、铁为阴极电解200mL氯化钠溶液.当转移了0.02mol电子后停止电解.若溶液体积前后不变,
则溶液pH为几? haj7211年前1
haj7211年前1 -
 云卷芳菲 共回答了16个问题
云卷芳菲 共回答了16个问题 |采纳率81.3%2NaCL+2H2O=2NaOH+H2+CL2
这个反应进行1mol,电子转移2mol,所以这个反应进行了0.01mol
此时,产生NaOH0.02mol
OH-浓度是0.1mol每升,所以H+离子浓度等于10的-13次mol每升,PH=131年前查看全部
- 在氟化氢溶液中,已电力的氟化氢为0.02mol,未电离的氟化氢为0.18mol,求该溶液中氟化氢的电离度
 ee一支花1年前1
ee一支花1年前1 -
 openwing 共回答了17个问题
openwing 共回答了17个问题 |采纳率94.1%已电力氟化氢0.02mol/已电力氟化氢0.02mol+未电力氟化氢0.18mol=10%1年前查看全部
- 含有1mol电子的硫酸物质的量是() A 1mol B 0.1mol C 0.01mol D 0.02mol
 xiaoyerain1年前1
xiaoyerain1年前1 -
 亚平宁之风 共回答了15个问题
亚平宁之风 共回答了15个问题 |采纳率100%选D.分子的电子数等于原子的电子数之和,原子所含的电子数等于核电荷数.
1个H2SO4含有2个H原子、1个S原子和4个O原子.
1个H原子含有1个电子,1个S原子含有16个电子,1个O原子含有8个电子.
所以1个H2SO4含有的电子数为2+16+8*4=50
所以1mol硫酸含有50mol电子,则含有1mol电子的硫酸物质的量是1/50=0.02mol1年前查看全部
- 0.01mol的NH4CL与0.02mol的NaOH溶于水配成1升溶液
0.01mol的NH4CL与0.02mol的NaOH溶于水配成1升溶液
(OH-)=(H+)+((NH4+)-(NH3·H2O))/2
为什么 滴水耳环1年前1
滴水耳环1年前1 -
 刹那黄昏 共回答了18个问题
刹那黄昏 共回答了18个问题 |采纳率94.4%根据电荷守恒有c(Cl-)+c(OH-)=c(H+)+c(NH4+)+c(Na+)和c(Na+)=2[c(NH4+)+c(NH3·H2O)]及c(Cl-)=c(NH4+)+c(NH3·H2O).将后面的两个式子带入第一个式子,最后得到:(OH-)=(H+)+2(NH4+)+(NH3·H2O)1年前查看全部
- 0.02mol/L醋酸与0.02mol/LNaOIH溶液等体积混,PH多少?
 堪破世情堪破胆1年前3
堪破世情堪破胆1年前3 -
 samantha1995 共回答了21个问题
samantha1995 共回答了21个问题 |采纳率81%PH大于7,无法求出准确值来.
理由:醋酸和NAOH反应后生成CH3COONA,氢离子和氢氧根中和生成水,醋酸钠中醋酸根水解显碱性,所以PH大于71年前查看全部
- 把0.02mol/LHAc溶液和0.01mol/LNaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是( )
把0.02mol/LHAc溶液和0.01mol/LNaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是( )
A. c(Ac-)>c(Na+)
B. c(HAc)>c(Ac-)
C. 2c(H+)=c(Ac-)-c(HAc)
D. c(HAc)+c(Ac-)=0.01mol•L-1 yy之佳1年前2
yy之佳1年前2 -
 璎紫 共回答了30个问题
璎紫 共回答了30个问题 |采纳率76.7%解题思路:0.02mol/LHAc溶液和0.01mol/LNaOH溶液等体积混合,则实质上是0.005mol/LHAc溶液和0.005mol/LNaAc溶液,该溶液显酸性,然后利用电荷守恒及物料守恒等来分析离子浓度的关系.A、因混合后为0.005mol/LHAc溶液和0.005mol/LNaAc溶液,该溶液显酸性,c(H+)>c(OH-),由电荷守恒关系可得c(H+)+c(Na+)=c(Ac-)+c(OH-),则c(Ac-)>c(Na+),故A正确;
B、混合后为0.005mol/LHAc溶液和0.005mol/LNaAc溶液,酸的电离大于盐的水解,则c(Ac-)>c(HAc),故B错误;
C、由电荷守恒c(H+)+c(Na+)=c(Ac-)+c(OH-),物料守恒关系c(HAc)+c(Ac-)=2c(Na+),则2c(H+)=(Ac-)+2 c(OH-)-c(HAc),故C错误;
D、因混合后为0.005mol/LHAc溶液和0.005mol/LNaAc溶液,由物料守恒可知c(HAc)+c(Ac-)=c(Na+)×2=0.01mol/L,故D正确;
故选AD.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算;离子浓度大小的比较.
考点点评: 本题考查溶液中离子的浓度关系,明确混合后溶液的溶质是解答的关键,并注意一般酸与盐的混合溶液中溶液显酸性来解答即可,学会合理应用电荷守恒及物料守恒来解题,题目难度中等.1年前查看全部
- 在氯化镁和氯化铝的混合液中,镁离子的物质的量为0.02mol,氯离子的物质的量为0.16mol.要使镁离子全部转化为沉淀
在氯化镁和氯化铝的混合液中,镁离子的物质的量为0.02mol,氯离子的物质的量为0.16mol.要使镁离子全部转化为沉淀分离出来,至少需要加入2mol/L氢氧化钠溶液的体积为多少mL?
 chengao20031年前2
chengao20031年前2 -
 zmkmpp 共回答了11个问题
zmkmpp 共回答了11个问题 |采纳率90.9%设在氯化镁和氯化铝的混合液中含铝离子的物质的量为X
根据电荷守恒得:
0.02mol*2+X*3=0.16mol*1
X=0.04mol
设使铝离子转化成偏铝根离子需要氢氧化钠溶液的体积为Y、使镁离子转化成沉淀需要氢氧化钠溶液的体积为Z
Al^3+ + 4OH^-=AlO2^-+2H2O
1 4
0.04mol 2mol/L*Y
Y=0.08L=80ml
Mg^2+ + 2OH^-=Mg(OH)2↓
1 2
0.02mol 2mol/L*Z
Z=0.02L=20ml
至少需要加入2mol/L氢氧化钠溶液的体积=80ml+20ml=100ml
答:至少需要加入2mol/L氢氧化钠溶液的体积为100mL1年前查看全部
- 将0.01molCH3COONa和0.02molHCI溶于水形成1L混合溶液请给出答案解析
 taicw1年前3
taicw1年前3 -
 资三ss 共回答了22个问题
资三ss 共回答了22个问题 |采纳率81.8%CH3COONa+HCl=CH3COOH+NaCl
CH3COOH NaCl HCl 都是0.01mol/L1年前查看全部
- 高一化学题,快!1.MgCl2·xH2O的晶体2.03克与足量的硝酸银溶液反应,生成沉淀0.02mol,则MgCl2·x
高一化学题,快!
1.MgCl2·xH2O的晶体2.03克与足量的硝酸银溶液反应,生成沉淀0.02mol,则MgCl2·xH2O晶体中x的数值是()
A.2 B.4 C.6 D.8
2.实验室用排空气法收集氨气,测得瓶内气体在同温同压下与氢气的密度之比为10,则所得气体中氨气与空气的体积比为()
A.1:1 B.3:1 C.1:3 D.1:2
拜托给下过程好吗?谢谢 mooneysbay1年前2
mooneysbay1年前2 -
 zjk712034 共回答了12个问题
zjk712034 共回答了12个问题 |采纳率100%1.加入硝酸银得到的沉淀为AgCl,n(MgCl2·xH2O)=1/2n(AgCl)=0.01mol,M(MgCl2·xH2O)=m(MgCl2·xH2O)/n(MgCl2·xH2O)=2.03/0.01=203=95+18*x;求得x=6,选C
2.M(混合物):M(H2)=10;M(混合物)=20;M(NH3)=17;M(空气)=29;设体积比为X,
X/(1+X)*17+1/(1+X)*29=20,解得X=3,选B1年前查看全部
- 向一升0.02mol每升的氢氧化钙溶液中通入一定量二氧化碳,充分反应后得到1克固体,计算通入的二氧化碳在标况下的体积.
 逍遥No1年前3
逍遥No1年前3 -
 生为mm 共回答了20个问题
生为mm 共回答了20个问题 |采纳率85%产物为0.01mol碳酸氢钙和0.01mol碳酸钙故需要0.03mol二氧化碳 即 0.672L 二氧化碳1年前查看全部
- 急求:高一化学:向一升0.02mol每升的氢氧化钙溶液中通入一定量二氧化碳,充分反
急求:高一化学:向一升0.02mol每升的氢氧化钙溶液中通入一定量二氧化碳,充分反
高一化学:向一升0.02mol每升的氢氧化钙溶液中通入一定量二氧化碳,充分反应后得到1克固体,计算通入的二氧化碳在标况下的体积. lpkhao1年前3
lpkhao1年前3 -
 霄宇 共回答了19个问题
霄宇 共回答了19个问题 |采纳率89.5%首先求的此固体为CaCO3沉淀,∴n(CaCO3)=1g/ 100g/mol=0.01mol,
∵化学方程式为
Ca(OH)2+CO2===CaCO3↓+H2O,
n(CO2) 0.01mol
∴n(CO2):0.01mol=1:1,
∴n(CO2)=0.01mol,
∴V(CO2)[S.T.P.]=22.4L/mol×0.01mol=0.224L.1年前查看全部
- 用力向半透明膜将0.02mol·L-1蔗糖溶液和0.02mol·LNaCL溶液隔开,在相同温度下会发生
用力向半透明膜将0.02mol·L-1蔗糖溶液和0.02mol·LNaCL溶液隔开,在相同温度下会发生
A水分子从蔗糖向NaCL溶液渗透 B Na+从NaCL想蔗糖溶液渗透
C水分子从NaCL向蔗糖溶液渗透 C蔗糖分子从蔗糖溶液向NaCL溶液渗透 TY_Cruz1年前2
TY_Cruz1年前2 -
 秋秋1234 共回答了11个问题
秋秋1234 共回答了11个问题 |采纳率90.9%B
这里因为氯化钠能电离出氯离子跟钠离子,所以渗透压较高.而水分子跟钠离子氯离子都能通过半透膜,于是选B.(此时水分子从蔗糖到氯化钠)1年前查看全部
- 在100mL 2mol/L CH3COOH溶液中加0.02molNaOH固体 醋酸电离度=1%,求CH3COOH CH3
在100mL 2mol/L CH3COOH溶液中加0.02molNaOH固体 醋酸电离度=1%,求CH3COOH CH3COO- OH- H+浓度
 aspppppu1年前1
aspppppu1年前1 -
 songlli 共回答了29个问题
songlli 共回答了29个问题 |采纳率82.8%CH3COOH + NaOH === CH3COONa + H2O
1 mol 1mol
0.02 mol 0.02mol.0.02mol
剩余 CH3COOH 物质的量 0.2 mol - 0.02 mol = 0.18 mol
0.18 mol × 1% = 0.0018 mol
C(CH3COOH) = 1.782 mol /L
C(CH3COO-) = 0.2 mol/L
C(H+) = 0.018 mol/L
C(OH-) = 1×10-14/0.018
= 5.6×10-13 mol/L1年前查看全部
- 由一道化学题引发的思考,急这道题是这样的:向50mL0.018mol/L的AgNO3溶液中,加入50mL0.02mol/
由一道化学题引发的思考,急
这道题是这样的:向50mL0.018mol/L的AgNO3溶液中,加入50mL0.02mol/L的盐酸,生成了沉淀.如果溶液中[Ag+]、[Cl-]的乘积是一个常数:[Ag+][Cl-]=1.0×10-10,求:
(1)沉淀生成后溶液中[Ag+]是多少?
(2)沉淀生成后溶液的pH值是多少?
我主要要问第一小题,首先要算出溶液中[Cl-],但我觉得[Cl-]可能来源于多余的HCl但也可来源于生成的AgCl溶解一小部分后电离的Cl-,虽然AgCl溶解得少,但是盐酸多余的也少,那计算时要不要考虑生成的AgCl溶解一小部分后电离的Cl-?
但我问了老师,他说不用考虑,还有答案上也没考虑,怎么办啊? Isaac_Mai1年前1
Isaac_Mai1年前1 -
 hyzx11 共回答了16个问题
hyzx11 共回答了16个问题 |采纳率100%反应后剩余盐酸的浓度为0.001 mol/L,也就是[Cl-]为0.001 mol/L,那么[Ag+]为1.0*10-7 mol/L,即AgCl电离产生的Cl-只有盐酸电离产生的Cl-的万分之一,考虑不考虑结果都是一样的.1年前查看全部
- 计算题 求详解苹果中含有苹果酸,测得其相对分子质量为134,取0.02mol苹果酸,使其完全燃烧,将燃烧后的产物先后通过
计算题 求详解
苹果中含有苹果酸,测得其相对分子质量为134,取0.02mol苹果酸,使其完全燃烧,将燃烧后的产物先后通过足量的无水氯化钙和碱石灰,两者分别增重3.52g和1.08g.则分子中C、H原子的个数比为?苹果酸的分子式为? greenhsc1年前1
greenhsc1年前1 -
 erggz 共回答了22个问题
erggz 共回答了22个问题 |采纳率95.5%题目数据反了吧.
co2重3.52g,即0.08mol,水为1.08g,0.06mol
c:h为8::12.(2:3).0.08mol和o.12mol1年前查看全部
- 在1.0L0.02mol/LHAC溶液中,加多少固体NaAc才能使[H+]为 6.5乘10的负5次方mol/L
 linmy1年前1
linmy1年前1 -
 HAO123COM 共回答了14个问题
HAO123COM 共回答了14个问题 |采纳率100%帮你算算
pH=pKa+lgc盐/c酸
-lg(6.5*10^-5)=4.76+lgx/ 0.02
x=0.0053mol
醋酸钠质量0.0053*82=0.43g1年前查看全部
- 0.02mol/L的HCN溶液与0.02mol/LNaCN溶液等体积混合,已知混合溶液中c(CN-)<c(Na+),则下
0.02mol/L的HCN溶液与0.02mol/LNaCN溶液等体积混合,已知混合溶液中c(CN-)<c(Na+),则下列关系中,正确的是
A、c(Na+)>c(CN-)>(OH-)>c(H+) B、c(HCN)+c(CN-)=0.04mol/L
C、c(Na+)+c(H+)=c(CN-)+c(OH-) D、c(CN-)>c(HCN)
————————————————————————————
我知道水解程度大电离程度 可是以我的思考如下
NaCN首先全部电离为离子再进行水解.因为水解是微弱的所以只有少部分CN-水解
剩余大部分CN-
所以我认为c(CN-)>c(HCN) 但违背了水解程度大电离程度
我们老师告诉等号的方程式全写出来再比较 简单的爱着你1年前1
简单的爱着你1年前1 -
 aanee 共回答了8个问题
aanee 共回答了8个问题 |采纳率100%[Na+]>]CN]
根据电荷守恒则:[Na+]+[H+]=[CN-]+[OH-]→C正确
则有[OH-]>[H+]
溶液中所有离子浓度大小关系就[Na+]>[CN-]>[OH-]>[H+],A正确
根据物料守恒,n(HCN)+n(CN-)=0.04V(V=混合溶液体积),溶液等体积混合即便不考虑提及变化[HCN]+[CN-]=0.02mol/L,B错误
因为溶液显碱性[OH-]>[H+],证明CN-的水解程度大于电离程度,[HCN]>[CN-],D错误
大部分的盐水解是一小部分,但不全都是.1年前查看全部
- 将0.02mol某烃与一定量氧气充分反应后,将生成的产物先通过装有足量浓硫酸的洗气瓶,洗气瓶增重2.16g;再通
将0.02mol某烃与一定量氧气充分反应后,将生成的产物先通过装有足量浓硫酸的洗气瓶,洗气瓶增重2.16g;再通
将0.02mol某烃与一定量氧气充分反应后,将生成的产物先通过装有足量浓硫酸的洗气瓶,洗气瓶增重2.16g;再通过装有足量碱石灰的干燥管,干燥管增重2.64g;最后与足量的灼热氧化铜充分反应后,氧化铜固体质量减轻0.64g。
(1)求该烃的分子式
(2)氧气的质量
(3)若该烃的一氯代物只有一种,求其名称 jinshan20001年前1
jinshan20001年前1 -
 希望123 共回答了18个问题
希望123 共回答了18个问题 |采纳率94.4%(1)设烃为CxHy
n(H2O)=2.16/18=0.12(mol)
n(CO2)=2.64/44=0.06(mol)
CO+Cu---->CO2+Cu △m
1 16
x 0.64
差量法得n(CO)=0.04(mol)
所以n(C)=0.1(mol) n(H)=2n(H2O)=0.24(mol)
x=0.1/0.02=5 y=0.12/0.02=12
C5H12
(2)
0.06molCO2 0.04molCO 0.12molH2O
生成物中氧原子个数为 0.06*2+0.04+0.12=0.28mol
n(O2)=n(O)/2=0.14(mol)
(3)
新戊烷1年前查看全部
- 一道有关配位滴定的计算题ph=5.5时,用0.02mol/L的EDTA滴定含有0.02mol/LMg2+和0.02mol
一道有关配位滴定的计算题
ph=5.5时,用0.02mol/L的EDTA滴定含有0.02mol/LMg2+和0.02mol/LZn2+溶液中的Zn2+.Zn2+能否被准确滴定?并计算化学计量点时pZn是多少?(ph=5.5时,lg酸效应系数=5.5,lgZn配合物的稳定常数=16.5,lgMg配合物的稳定常数=8.7) 逍遥的大鱼1年前1
逍遥的大鱼1年前1 -
 rfvcxzaq 共回答了21个问题
rfvcxzaq 共回答了21个问题 |采纳率95.2%答:
【1】Zn2+ 能被准确滴定:是依据正确滴定 条件决定的.
因为 logk*(ZnY) = 16.5 - 5.5 = 10.5 大于8 ;
logk*(MgY) = 8.7 - 5.5 = 2.2 小于3 .
【2】 计算化学计量点时 pZn是多少:
[ZnY] = 0.02/2 = 0.01 [Zn] =[Y]
k*(ZnY)= [ZnY] /[Zn] *[Y] = [ZnY] / [Zn] ^2
[Zn] = { [ZnY] / k*(ZnY) } ^1/2 ={0.01/3.16x10^10 } = {3.16 x10^-13}^1/2 = 5.62x10^-7
pZn = -log [Zn] = -log (5.62x10^-7) = 6.251年前查看全部
- 100ml0.02mol/LCa(OH)2溶液,吸收CO2后产生沉淀0.1g,此时被吸收的二氧化碳在标准状况下的体积可能
100ml0.02mol/LCa(OH)2溶液,吸收CO2后产生沉淀0.1g,此时被吸收的二氧化碳在标准状况下的体积可能是
 飘渺凝香1年前1
飘渺凝香1年前1 -
 changrn 共回答了17个问题
changrn 共回答了17个问题 |采纳率88.2%一种是正好二氧化碳是0.001mol,所以体积是0.0224L
另一种是先沉淀出来0.002mol,然后再通入二氧化碳,使沉淀溶解0.001mol,所以这时通入二氧化碳总共0.003mol,体积是0.0672L1年前查看全部
- 缓冲溶液 KH2PO4-KCL 0.02mol/l PH7.0 的配方
 arroow1年前1
arroow1年前1 -
 神威老黄 共回答了26个问题
神威老黄 共回答了26个问题 |采纳率96.2%应该是KH2PO4-KOH,配制出的溶液为H2PO4^-/HPO4^2-缓冲溶液,才有可能PH=7.0
PH=PKa2-lg[H2PO4^-]/[HPO4^2-]
7.0=7.2-lg[H2PO4^-]/[HPO4^2-]
lg[H2PO4^-]/[HPO4^2-]=0.2
[H2PO4^-]/[HPO4^2-]=1.58
配制一升溶液,需要
无水磷酸二氢钾136×0.02=2.72克
需要氢氧化钾56×0.02×1/2.58=0.43克
称取无水磷酸二氢钾2.72克,氢氧化钾0.43克,与水配制成一升溶液即可.1年前查看全部
- 0.02molH2S存在于200mL2.0mol•L-1的盐酸中,H2S是以分子的形式存在还是以H+和S2-的形式存
0.02molH2S存在于200mL2.0mol•L-1的盐酸中,H2S是以分子的形式存在还是以H+和S2-的形式存
 胖妞妞的姐妹淘1年前1
胖妞妞的姐妹淘1年前1 -
 boboy6216 共回答了17个问题
boboy6216 共回答了17个问题 |采纳率94.1%以分子存在绝大多数 因为强酸抑制弱酸电离1年前查看全部
- 0.02mol硫酸配置方法
 c7ubn1年前1
c7ubn1年前1 -
 攸奕 共回答了20个问题
攸奕 共回答了20个问题 |采纳率90%不可能配准,只能配出近似的溶液
标定出具体的浓度
量取0.6mL浓硫酸,缓缓注入1000mL水中,冷却,摇匀.c(1/2H2SO4)/(mol/L)=0.021年前查看全部
- 向0.02mol的硫酸铝溶液中加入30ml氢氧化钠溶液 充分反应得到0.78克沉淀 求氢氧化钠物质的量浓度(2个答案
 teamos1年前2
teamos1年前2 -
 小脚香香 共回答了24个问题
小脚香香 共回答了24个问题 |采纳率91.7%1、氢氧化钠不足,即铝元素以氢氧化铝和铝离子的形式存在
n(NaOH)=(0.78÷78)×3=0.03mol
c(NaOH)=0.03÷0.03=1mol/L
2、氢氧化钠较多,即铝元素以氢氧化铝和偏铝酸根的形式存在
n(NaOH)=0.02×2×4-(0.78÷78)=0.15mol
c(NaOH)=0.15÷0.03=5mol/L1年前查看全部
- 在含有0.02molMgCl2和0.02molAlCl3的混合溶液中,主要存在哪些离子
在含有0.02molMgCl2和0.02molAlCl3的混合溶液中,主要存在哪些离子
向此混合溶液中加入100ml1mol/L NaOH溶液,溶液中什么离子增加,什么离子减少,继续加入50ml 1mol/L NaOH溶液后,溶液中主要存在什么离子? 138948407531年前1
138948407531年前1 -
 astrit 共回答了17个问题
astrit 共回答了17个问题 |采纳率100%含有0.02molMgCl2和0.02molAlCl3的混合溶液中,主要存在Mg2+、Cl-、Al3+离子;
100ml1mol/L NaOH溶液含NaOH:0.1mol,刚好与Mg2+、Al3+完全反应;溶液中Na+离子增加,Mg2+、Al3+离子减少;
继续加入50ml 1mol/L NaOH溶液(NaOH:0.05mol,与Al(OH)3完全反应后还有剩余),溶液中主要存在:Cl-、Na+、AlO2-、OH-离子.1年前查看全部
- 【化学·电离平衡】将0.03molCl2缓缓通入含0.02molH2SO3和0.02molHBr的混合溶液中,在此过程中
【化学·电离平衡】将0.03molCl2缓缓通入含0.02molH2SO3和0.02molHBr的混合溶液中,在此过程中,溶液
将0.03molCl2缓缓通入含0.02molH2SO3和0.02molHBr的混合溶液中,在此过程中,溶液中的c(H+)与Cl2用量的关系示意图是(设溶液的体积不改变)

从左至右分别是ABCD
我选的是C,但是答案是D【求两者区别及详解】 飘扬的跳投1年前2
飘扬的跳投1年前2 -
 哈哈xin 共回答了17个问题
哈哈xin 共回答了17个问题 |采纳率94.1%此题应选A
因为氯气是氧化剂,H2SO3和HBr都是还原剂,但H2SO3还原性大于和HBr,所以氯气先氧化H2SO3,当H2SO3完全被氧化后才能氧化HBr.亚硫酸是弱电解质,反应后生成的硫酸和盐酸,硫酸与氯化氢都是强电解质,所以通入氯气后,氢离子浓度先增大.反应的化学方程式为:
H2SO3 +Cl2+H2O=2HCl+H2SO4
1 1 2 1
0.02mol 0.02mol 0.04mol 0.02mol
根据上面的化学方程式可知02molH2SO3和消耗0.02molCl2,横坐标由0到0.02摩尔时,氢离子浓度增大,剩余氯气恰好与0.02molHBr反应
Cl2+2HBr=2HCl+Br2
,由于氯化氢和溴化氢都是强电解质,所以由0.02mol到0.03mol时,氢离子浓度是不变的,题中只给了0.03摩尔氯气,如果0.03摩尔氯气之后再通入氯气,氢离子浓度要增加的.因此选A
希望我的回答能对你的学习有帮助!1年前查看全部
- 0.02mol的NaCl溶液和0.02mol的CH3COOH溶液哪个沸点高?
 性能需求1年前1
性能需求1年前1 -
 elliottchang 共回答了20个问题
elliottchang 共回答了20个问题 |采纳率90%不一定对.我的分析:
NaCl溶液的沸点高.
CH3COOH溶液加热后挥发(小部分分解) ,溶液浓度下降.沸点降低.1年前查看全部
- 如图两个电解槽中,A、B、C、D均为石墨电极.若电解过程中共有0.02mol电子通过,下列叙述中正确的是( )
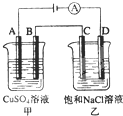 如图两个电解槽中,A、B、C、D均为石墨电极.若电解过程中共有0.02mol电子通过,下列叙述中正确的是( )
如图两个电解槽中,A、B、C、D均为石墨电极.若电解过程中共有0.02mol电子通过,下列叙述中正确的是( )
A.甲烧杯中A极上最多可析出铜0.64g
B.甲烧杯中B极上电极反应式4OH--4e-=2H2O+O2↑
C.烧杯中C极上电极反应式为4H++4e-=2H2↑
D.乙烧杯中滴入酚酞试液,D极附近先变红 桉桉桉1年前1
桉桉桉1年前1 -
 xxwmj 共回答了18个问题
xxwmj 共回答了18个问题 |采纳率66.7%解题思路:电解时,甲烧杯中:A极(阳极)反应式为4OH--4e-=2H2O+O2↑,B极(阴极)反应式为:Cu2++2e-=Cu,乙烧杯中:C极(阳极)反应式为2Cl--2e-=Cl2↑,D极(阴极)反应式为2H++2e-=H2↑,以此解答该题.A.A极(阳极)反应式为4OH--4e-=2H2O+O2↑,生成氧气,不能析出铜,故A错误;
B.甲烧杯中B极上电极反应式为:Cu2++2e-=Cu,故B错误;
C.烧杯中C极上电极反应式为2Cl--2e-=Cl2↑,故C错误;
D.D极(阴极)反应式为2H++2e-=H2↑,由于H+放电,打破了水的电离平衡,导致D极附近溶液呈碱性(有NaOH生成),故D正确.
故选D.点评:
本题考点: 电解原理.
考点点评: 本题综合电解原理知识,侧重于电极方程式的判断和书写,明确电极反应为解答该题的关键,学习中注意把握书写方法,题目难度中等.1年前查看全部
- 1.某一金属1.56克跟足量盐酸反应,生成氢气0.02mol.求该金属的相对原子质量.
1.某一金属1.56克跟足量盐酸反应,生成氢气0.02mol.求该金属的相对原子质量.
2.2.3克钠溶于多少克水中,才能使每10个水分子中溶有一个钠离子. vdfvvvv1年前1
vdfvvvv1年前1 -
 红袖添娇 共回答了19个问题
红袖添娇 共回答了19个问题 |采纳率84.2%1.某一金属1.56克跟足量盐酸反应,生成氢气0.02mol.求该金属的相对原子质量.
若产物为+2价的
金属---H2
X-----1
1.56---0.02
X=78
若产物为+1价的
金属---H2
2X-----1
1.56---0.02
X=39
若产物为+3价的
金属---H2
2X-----3
1.56---0.02
X=117
应该是钾39
2.2.3克钠溶于多少克水中,才能使每10个水分子中溶有一个钠离子.
2Na----2H2O
46-------36
2.3------X
X=1.8克
2.3克的钠的物质的量=2.3/23=0.1mol
则水的物质的量=0.1*10=1摩尔,质量=1*18=18克
再加上反应用去的水,需要水的总质量=18+1.8=19.8克1年前查看全部
- 将0.02molNaOH固体加到100ml蒸馏水中,求溶液里各种离子浓度的大小
 分享mm分享mm1年前2
分享mm分享mm1年前2 -
 突然掉眼泪 共回答了19个问题
突然掉眼泪 共回答了19个问题 |采纳率100%是离子浓度的大小比较吧
[NA+]等于[0H-]大于[H+]
[Na+]=[OH-]=0.2mol/L,[H+]=5乘10的-14次方mol/L1年前查看全部
- 以石墨为阳极、铁为阴极电解200mL氯化钠溶液.当转移了0.02mol电子后停止电解.
以石墨为阳极、铁为阴极电解200mL氯化钠溶液.当转移了0.02mol电子后停止电解.
以石墨为阳极、铁为阴极电解200mL氯化钠溶液.当转移了0.02mol电子后停止电解.若溶液体积前后不变,求混合均匀后的PH 为什么只看氢氧根,不看氢离子,为什么消耗的氢氧根就等于生成的氢离子(氢氧根是水电离出来的啊,根据勒夏特列原理,怎么可能相等),无奈、、 帖军zz1年前1
帖军zz1年前1 -
 复仇者的眼泪 共回答了22个问题
复仇者的眼泪 共回答了22个问题 |采纳率90.9%这道题你需要根据转移电子的物质的量来推算出生成OH-的物质的量
的确,水电离得到H+和OH-,但是在反应过程中H+得到电子变为H2而逸出了.而OH-留在溶液里.
但是不管再怎么反应,反应的后OH-和H+的浓度之积依然等于Kw.
电解氯化钠溶液的化学反应方程式为:
2NaCl+2H2O=通电=2NaOH+H2↑+Cl2↑
每有1mol氢气生成,会转移电子2mol.
当转移了0.02mol电子,生成氢气的物质的量就是0.01mol.得到氢氧化钠的物质的量也是0.02mol
所以得知OH-的浓度为0.02/0.2=0.1mol/L=1×10^-1mol/L
根据Kw常数可知H+离子的浓度为1×10^-13mol/L
所以根据pH的定义可知混合均匀后的pH值为131年前查看全部
- 化学沉淀溶解平衡的题 向50mL 0.018mol/L AgNO3溶液中加入50mL 0.02mol
化学沉淀溶解平衡的题 向50mL 0.018mol/L AgNO3溶液中加入50mL 0.02mol
向50mL 0.018mol/L AgNO3溶液中加入50mL 0.02mol/L的盐酸生成沉淀。已知Ksp( AgCl)=1.8× 10-10,则生成沉淀后溶液中的c(Ag+)与pH分别为
[ ]
A. 1.8×10-7 mol/L,2
B. 1×10-7 mol/L,2
C. 1. 8×10-7 mol/L,3
D. 1×10-7 mol/L,3
氯离子消耗了0.009 银离子同样也消耗了0.009 这样的话,银离子浓度不是为0了么? 你的温柔hu1年前1
你的温柔hu1年前1 -
 Lebron_N70 共回答了30个问题
Lebron_N70 共回答了30个问题 |采纳率93.3%(1)Ag+和Cl-等物质的量反应,所以混合后溶液中剩余Cl-的浓度为0.001 mol/L(注意等体积混合,浓度减半)
因为C(Ag+)·C(Clˉ)=1.0×10ˉ10,而 Cl-的浓度为0.001 mol/L,所以Ag+浓度为1×10^-7 mol/L
(2)混合后剩余的HCl浓度为0.001 mol/L,所以pH=31年前查看全部
- 为什么0.015mol的CU 和0.02mol的hmo3反应hno3是稀溶液,给我个原因呗,不然这道题可能会因为方程式列
为什么0.015mol的CU 和0.02mol的hmo3反应hno3是稀溶液,给我个原因呗,不然这道题可能会因为方程式列错从而打错.
 幽忧虫虫1年前1
幽忧虫虫1年前1 -
 主敢 共回答了18个问题
主敢 共回答了18个问题 |采纳率88.9%你这个题目不完整吧...CU和浓硝酸和稀硝酸都能反应的
要判断是浓是稀,1可以看浓度,2可以看产物!1年前查看全部
大家在问
- 1一次口算测试,小明做对19题,算错1题。小明这次口算的正确率是多少?
- 2六年级三班的同学订阅了三种书刊,其中80%的人订了《小学生作文》,75%订阅了《小灵通》,60%的
- 3大气层受什么力的作用
- 4不规则形容词的比较级和最高级形式有哪些?
- 5恒温恒压下化学可逆反应平衡后若增加一种反应物量,反应物的转化率变化情况
- 6初二 英语 不懂 请详细解答,谢谢! (20 19:55:50)
- 7松树金龟子精品句子赏析
- 8《答谢中书书》一文,作者是怎样运用动静结合
- 9青色的梦英文解释?请问青色的梦英文怎么解释啊
- 10哪些介词后面加动词ing形式
- 11告别2014迎接2015译为英文
- 12怎样把一个左边是三点水右边是七的汉字打出来
- 13Taking this kind of medicine,if ________,will possibly do hi
- 14关于虚拟语气虚拟条件句时,从句的动词中如果有be ,那一律变为were,那么as if后面用was 还是 were呢?它
- 15一个平行四边形,底是 一个平行四边形,底是8厘米,高是2厘米,如果底不变,高增加2厘米,则面积增加 ( );如果底
