将燃着的镁条伸入盛有二氧化碳的集气瓶中,镁条继续剧烈燃烧,反应的化学方程式:2Mg+CO 2 2MgO+C,下列有关叙述
 楚菡2022-10-04 11:39:541条回答
楚菡2022-10-04 11:39:541条回答 将燃着的镁条伸入盛有二氧化碳的集气瓶中,镁条继续剧烈燃烧,反应的化学方程式:2Mg+CO 2  2MgO+C,下列有关叙述错误的是 2MgO+C,下列有关叙述错误的是 |
| [ ] |
| A.该反应中CO 2 是氧化剂 B.镁着火时不能用CO 2 扑灭 C.该反应中Mg的化合价改变 D.该反应中碳是还原剂 |

已提交,审核后显示!提交回复
共1条回复
 上班猪 共回答了18个问题
上班猪 共回答了18个问题 |采纳率83.3%- D
- 1年前
相关推荐
- 请问二氧化碳能与镁条反应吗?是镁在二氧化碳的燃烧吗?
 muddle_No11年前1
muddle_No11年前1 -
 木公木公 共回答了16个问题
木公木公 共回答了16个问题 |采纳率93.8%可以反应,但必须先在空气中将镁条点燃,再伸入装有二氧化碳的集气瓶中,会观察到镁条不但没熄灭,而且燃烧更加旺盛,反应结束会瓶中会有黑色的碳和白色的氧化镁.二氧化碳本身是不会支持燃烧的,这个试验可以证明维持燃烧并不一定需要氧气1年前查看全部
- 化学方程试10条红磷或白磷在空气中燃烧木炭在空气或氧气中燃烧硫磺在空气或氧气中燃烧镁条在空气或氧气中燃烧铁丝在氧气中燃烧
化学方程试10条
红磷或白磷在空气中燃烧
木炭在空气或氧气中燃烧
硫磺在空气或氧气中燃烧
镁条在空气或氧气中燃烧
铁丝在氧气中燃烧
氢气和氧化铜加热反应
双氧水制氧气
氯酸钾和二氧化锰混合加热制氧气
高锰酸钾制氧气
电解水 Felixand1年前5
Felixand1年前5 -
 taxd 共回答了10个问题
taxd 共回答了10个问题 |采纳率90%4P+5O2=2P2O5
C+O2=CO2
S+O2=SO2
2Mg+O2=2MgO
3Fe+2O2=Fe3O4
H2+CuO=H2O+Cu
2H2O2=2H2O+O2(气体箭头) 催化剂MnO2
2KClO3=2KCl+3O2(气体箭头) 催化剂MnO2
2KMnO4=K2MnO4+MnO2+O2(气体箭头)
2H20=2H2+O2
燃烧的条件都是点燃
6个开始条件依次是:加热,催化剂,加热和催化剂,加热,通电1年前查看全部
- 镁条在二氧化硫中燃烧
 g3gaw1年前1
g3gaw1年前1 -
 ll痘子 共回答了19个问题
ll痘子 共回答了19个问题 |采纳率94.7%3Mg(过量) + SO2 =点燃= 2MgO + MgS
2Mg + SO2(过量) =点燃= 2MgO + S1年前查看全部
- 下列不发生化学变化的是( ) A.镁条在空气中燃烧 B.氢氧化钠溶液与氯化镁溶液混和产生白色沉淀 C.小苏打中滴入稀盐
下列不发生化学变化的是( ) A.镁条在空气中燃烧 B.氢氧化钠溶液与氯化镁溶液混和产生白色沉淀 C.小苏打中滴入稀盐酸产生气泡 D.冬天空气中的水蒸气凝结成霜  FENGRAO1年前1
FENGRAO1年前1 -
 君中驴花 共回答了27个问题
君中驴花 共回答了27个问题 |采纳率96.3%A、镁条在空气中燃烧的过程中有新物质氧化镁生成,属于化学变化.故选项错误;
B、氢氧化钠溶液与氯化镁溶液混和产生白色沉淀的过程中有新物质氢氧化镁生成,属于化学变化.故选项错误;
C、小苏打中滴入稀盐酸产生气泡的过程中有新物质氯化钠、水、二氧化碳等生成,属于化学变化.故选项错误;
D、冬天空气中的水蒸气凝结成霜的过程中只是状态发生改变,没有新物质生成,属于物理变化.故选项正确;
故选D.1年前查看全部
- 将Mg条投入盛有稀HCl的容器里,产生H2的速率与下列因素:①盐酸浓度 ②温度 ③镁条的表面积
将Mg条投入盛有稀HCl的容器里,产生H2的速率与下列因素:①盐酸浓度 ②温度 ③镁条的表面积 ④容器的密闭情况 ⑤溶液中c(Cl-)大小,有关系的是( )
A. ①②
B. ③④
C. ①②③④
D. ①②③④⑤ 如松鼠般跳跃1年前4
如松鼠般跳跃1年前4 -
 男人结构 共回答了20个问题
男人结构 共回答了20个问题 |采纳率95%解题思路:反应的实质为2H++Mg═Mg2++H2↑,影响化学反应速率的因素有固体的表面积,H+浓度和温度,以此解答该题.反应的实质为2H++Mg═Mg2++H2↑,
①盐酸浓度改变,反应速率改变,故①正确;
②温度改变,改变活化分子的百分数,反应速率改变,故②正确;
③镁带的表面积不同,反应速率不同,故③正确;
④容器的密闭情况不同,压强不同,反应速率不同,故④正确;
⑤氯离子不参加反应,溶液的氯离子浓度对反应速率无影响,故⑤错误.
故选C.点评:
本题考点: 化学反应速率的影响因素.
考点点评: 本题考查化学反应速率的因素,为高考高频考点,侧重于学生的分析能力和基础知识的考查,有利于化学科学素养的培养和提高学生学习的积极性,难度不大,注意外界条件对反应速率的影响原因的理解.1年前查看全部
- 用化学用语表示下列物质或反应:(1)氢氧化钙:______;(2)镁条用砂纸打磨后放入氧气中,过一会儿,光亮的镁条变暗,
用化学用语表示下列物质或反应:
(1)氢氧化钙:______;
(2)镁条用砂纸打磨后放入氧气中,过一会儿,光亮的镁条变暗,反应的化学方程式是______;
(3)硝酸钡溶于水电离出的离子______;
(4)某硫的氧化物中硫元素的化合价为+6价,该氧化物是______. chenaniu1年前1
chenaniu1年前1 -
 江山88 共回答了24个问题
江山88 共回答了24个问题 |采纳率95.8%(1)氢氧化钙的化学式写法:金属元素在左边,氢氧根在右边,可以写出化学式Ca(OH) 2 .
(2)镁条用砂纸打磨后放入氧气中,过一会儿,光亮的镁条变暗,镁与氧气发生氧化反应:2Mg+O 2 ═2MgO
(3)硝酸钡溶于水电离出的离子Ba 2+ ,NO 3 - ,所以电离方程式为:Ba(NO 3 ) 2 ═Ba 2+ +2NO 3 -
(4)设硫的氧化物的化学式为:S X O Y ,已知硫元素的化合价为+6价,氧元素的化合价为-2价,所以(+6X)+(-2Y)=0即
X
Y =
1
3
所以硫的氧化物的化学式为S 1 O 3 ,1省略不写,则硫的氧化物的化学式为SO 3.
故答为:(1)Ca(OH) 2
(2)2Mg+O 2 ═2MgO
(3)Ba(NO 3 ) 2 ═Ba 2+ +2NO 3 -
(4)SO 31年前
91年前查看全部
- 为什么镁条化学方程式是这样的呢?Mg+O2====MgO
为什么镁条化学方程式是这样的呢?Mg+O2====MgO
我要详细的讲解.
还有为什么水电解2H2O=====O2↑+2H2↑,要加箭头呢?
还有一个木炭在氧气中燃烧的化学方程式. vensen0071年前6
vensen0071年前6 -
 陈永彬 共回答了22个问题
陈永彬 共回答了22个问题 |采纳率81.8%第一个就不对
2Mg+O2====2MgO
镁是正2价,氧是负2价,结合成产物应该是1:1
箭头表示反应物中没有气体而生成物中尤其
C+O2=CO21年前查看全部
- 欲在室温和1.01×105Pa条件下测定镁的相对分子质量,请利用下图给定的仪器(盛放镁条的隔板有小孔)组装成一套实验装置
欲在室温和1.01×105Pa条件下测定镁的相对分子质量,请利用下图给定的仪器(盛放镁条的隔板有小孔)组装成一套实验装置(每种仪器只允许用一次).请回答下列问题:
(1)装置A中的分液漏斗中盛放的液体是
水
,其作用是
使A瓶中的气体进入E瓶,增大E瓶中的气压,将稀盐酸压入B装置与Mg发生化学反应;
;
(2)假设气流方向由左向右,则各仪器的接口连接的先后顺序为(填小字母)
a、h、g、b、c、f、e、d
;
(3)连接好仪器后,要进行的操作有以下几步:①待仪器B中的物质恢复到室温时,测得量筒C中水的体积(若假设将测定的体积换算为标准状况下为VmL);②擦掉镁条表面的氧化膜,将其置于天平上称量(假定其质量为mg),并将其投入试管B中;③检查各装置的气密性;④旋开仪器A上分液漏斗的活塞,当镁条完全溶解时再关闭活塞.上述几步操作的先后顺序为
③②④①
;
(4)若未将试管B冷却至室温就测量量筒C中水的体积,这将会使所得镁的相对原子质量数据(选填“偏高”或“偏低”或“无影响”)
偏低
;
(5)若未擦净镁条表面氧化膜就进行实验,这将会使所测镁的相对原子质量数据(选填“偏高”或“偏低”或“无影响”)
偏高
我认为第一题分液漏斗中的物质也可以是氢氧化钠.少杯中的物质是水,氢氧化钠溶解放热,也能使E瓶气压增大~ 我的想法对么?
第五题中没有擦净氧化膜,硫酸与氧化镁反应后仍然可以与镁条反应,那么生成的氢气质量不是不变么?怎么会偏高呢?

. XX爱OO1年前4
XX爱OO1年前4 -
 陈幸福 共回答了23个问题
陈幸福 共回答了23个问题 |采纳率95.7%你的想法是错误的,分液漏斗不可以装固体,
当然会变,MgO与硫酸反应不生成气体.
是偏高,
Mg+H2SO4=MgSO4+H2(?)
MgO+H2SO4=MgSO4+H2O
假如固体有mg,气体有nmol,那理论上是m/n,但因为有MgO,产生的气体会变少,所以是偏高.懂了么?1年前查看全部
- 将镁条在二氧化碳中燃烧.的生成物置于足量稀盐酸中可观察到的现象是什么?
 xmy45111年前5
xmy45111年前5 -
 妇炎洁 共回答了21个问题
妇炎洁 共回答了21个问题 |采纳率100%2Mg+CO2=点燃==2MgO+C
MgO+2HCl==MgCl2+H2O
C(黑色)不与盐酸反应
MgO白色固体溶解
如还有疑问~欢迎追问1年前查看全部
- 化学快···········镁条与硫酸铜溶液反应的实验现象 反应类型
 zhu77301年前10
zhu77301年前10 -
 耀眼的nn 共回答了19个问题
耀眼的nn 共回答了19个问题 |采纳率84.2%镁条表面产生气泡,有黑色固体在镁条表面及烧杯底部生成;
Mg+CuSO4+2H2O=MgSO4+Cu(OH)2↓+H2↑
Mg+CuSO4=MgSO4+Cu【置换反应】1年前查看全部
- 下列化学反应能产生吸热现象的为1镁条与稀盐酸2碳与二氧化碳3碳酸钙与盐酸4木炭与氧气为什么
 海泉涛涛1年前2
海泉涛涛1年前2 -
 海尔斯 共回答了15个问题
海尔斯 共回答了15个问题 |采纳率86.7%燃烧、中和、金属氧化、铝热反应、较活泼的金属与酸反应、由不稳定物质变为稳定物质的反应
根据这句话可以推断出1、3、4都是放热反应.至于2,这是个特殊例子.
吸热反应
(1) ①几个常见的反应,如:
2NH4Cl(s)+Ba(OH)2·8H2O(s)=BaCl2+2NH3↑+10H2O
C+H2O(g)=CO+H2
C(s)+CO2(g)=2CO
②多数的分解反应,如:
CaCO3=(高温)CaO+CO2↑
CuSO4·5H2O=CuSO4+5H2O
③一些物质的溶解,如硝酸铵溶解等.(也可说是盐类的水解,此时必为吸热反应.如:铵根水解即为放热)
(2)特殊吸热反应
①C+CO2=2CO
②I2+H2=2HI(此反应为可逆反应,因为生成的碘化氢不稳定)1年前查看全部
- 等质量的两根镁条,第一根在足量氧气中燃烧,第二根在足量氮气中燃烧.为什么两根镁条失去电子一样多
等质量的两根镁条,第一根在足量氧气中燃烧,第二根在足量氮气中燃烧.为什么两根镁条失去电子一样多
请说明理由. 柠檬茶sally1年前3
柠檬茶sally1年前3 -
 vodka102 共回答了14个问题
vodka102 共回答了14个问题 |采纳率100%每个Mg反应后都变成了Mg2+(因为镁条不足量).
也就是每个Mg都失去2个电子,而Mg的质量相等,个数也就相等.
纯手打~希望能帮到您~有不懂的欢迎追问~1年前查看全部
- 用含0.2molHCL的盐酸溶液100mL,与足量的镁条充分反应.反应的化学方程式为:Mg+2HCL=MgCL2+H2
用含0.2molHCL的盐酸溶液100mL,与足量的镁条充分反应.反应的化学方程式为:Mg+2HCL=MgCL2+H2
试计算:1,生成的H2的质量 2,将生成的MgCL2溶液稀释到400mL,求此溶液中MgCL2的物质的量浓度
 mzlightsun1年前1
mzlightsun1年前1 -
 dhh078 共回答了27个问题
dhh078 共回答了27个问题 |采纳率85.2%n(H2)=1/2n(HCl)=0.5*0.2mol=0.1mol
m(H2)=M(H2)*n(H2)=2g/mol*0.1mol=0.2g
n(MgCl2)=1/2(HCl)=0.5*0.2mol=0.1mol
c(MgCl2)=n(MgCl2)/V=0.1mol/0.4L=0.25mol/L1年前查看全部
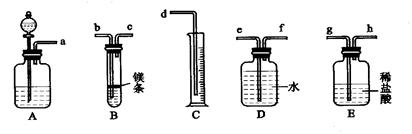
- 请根据下列实验仪器图回答问题.(1)写出仪器名称:a______,d______.(2)做镁条燃烧实验时,夹持镁条用__
请根据下列实验仪器图回答问题.
(1)写出仪器名称:a______,d______.
(2)做镁条燃烧实验时,夹持镁条用______(填字母代号).
(3)用b量取液体时,视线应与______保持水平.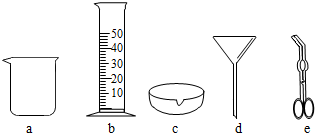
 我已经rr1年前1
我已经rr1年前1 -
 grass5 共回答了24个问题
grass5 共回答了24个问题 |采纳率70.8%(1)图中a是烧杯,d是漏斗.
故答案为:烧杯;漏斗.
(2)镁条燃烧放出大量的热量,因此夹持镁条用坩埚钳;
故答案为:e.
(3)用量筒量取液体时,视线与凹液面的最低处保存水平.
故答案为:凹液面最低处.1年前查看全部
- (2004•聊城)在空气中点燃镁条,镁与氧气反应的同时还可以与空气中的氮气、二氧化碳反应.镁与二氧化碳反应的化学方程式如
(2004•聊城)在空气中点燃镁条,镁与氧气反应的同时还可以与空气中的氮气、二氧化碳反应.镁与二氧化碳反应的化学方程式如下:
2Mg+CO2
2MgO+C,该反应属于( )反应.高温 .
A.分解
B.化合
C.置换
D.复分解 ronghualou1年前1
ronghualou1年前1 -
 金之帆 共回答了25个问题
金之帆 共回答了25个问题 |采纳率84%解题思路:根据反应类型的概念:化合反应是指两种或者多种物质反应变成一种物质的化学反应;
分解反应是指一种物质生成两种或者多种物质的化学反应;
置换反应是指一种单质和一种化合物生成另一种单质和另一种化合物的化学反应;
复分解反应是指由两种化合物互相交换成分,生成另外两种化合物的反应,进行判定根据四个化学反应类型的概念可知,2Mg+CO2
高温
.
2MgO+C是一种单质和一种化合物生成另一种单质和另一种化合物的化学反应,属于置换反应;
故选C.点评:
本题考点: 反应类型的判定.
考点点评: 掌握初中化学中四个基本反应类型的概念,并且能够判断某个化学反应的反应类型.1年前查看全部
- 镁和酸的反应为什么要把镁条卷起来求大神帮助
 救世主1234561年前5
救世主1234561年前5 -
 冰木棉 共回答了18个问题
冰木棉 共回答了18个问题 |采纳率66.7%镁的化学性质比较活波,与酸反应速率很快,迅速产生大量的热,把它卷起来,可以减少与酸的接触面积,减慢反应速率.1年前查看全部
- 在下列事件中,什么因素影响了化学反应速率?(1)集气瓶中有H2和Cl2的混合气体,在瓶外点嘫镁条时发生爆炸 __ (2)
在下列事件中,什么因素影响了化学反应速率?(1)集气瓶中有H2和Cl2的混合气体,在瓶外点嘫镁条时发生爆炸 __ (2)黄铁矿煅烧粉碎成细小的矿粒___ (3)KL晶体和HgcL2晶体混合后无明显现象,一起投入水中,很快生成红色HgL2___
 shaoqing1061年前2
shaoqing1061年前2 -
 白云松林 共回答了18个问题
白云松林 共回答了18个问题 |采纳率94.4%温度 物质表面积 催化剂1年前查看全部
- 下列说法正确的是( ) A.铝在空气中耐腐蚀,所以铝是不活泼金属 B.点燃的镁条插入盛有CO 2 的集气瓶中,立即熄灭
下列说法正确的是( )
A.铝在空气中耐腐蚀,所以铝是不活泼金属 B.点燃的镁条插入盛有CO 2 的集气瓶中,立即熄灭 C.铝在高温下能还原锰、铁、铬等金属氧化物得到金属 D.因为镁和铝在空气中都能形成氧化膜,所以镁铝都不能溶于浓硝酸  旖旎五月1年前1
旖旎五月1年前1 -
 f027 共回答了15个问题
f027 共回答了15个问题 |采纳率93.3%C
由于铝活泼,在其表面极易被氧化生成一层致密的氧化膜,因此金属铝耐腐蚀,A不正确;镁可以在CO 2 中燃烧,生成氧化镁和碳,B不正确;铝在浓硝酸中发生钝化,但镁不能,所以选项D不正确,答案选C。1年前查看全部
- 下列反应中既属于氧化还原反应又属于放热反应的是( )。 A.氢氧化钾与硫酸的反应 B.锌与盐酸反应放出氢气 C.镁条在
下列反应中既属于氧化还原反应又属于放热反应的是( )。
A.氢氧化钾与硫酸的反应 B.锌与盐酸反应放出氢气 C.镁条在空气中燃烧 D.Ba(OH) 2 ·8H 2 O与NH 4 Cl反应  lunhui1年前1
lunhui1年前1 -
 dengfuyun 共回答了22个问题
dengfuyun 共回答了22个问题 |采纳率90.9%BC
A是放热反应但不是氧化还原反应;B、C既属于氧化还原反应又属于放热反应;D属于吸热反应但不属于氧化还原反应。1年前查看全部
- “通过镁条可以在氮气中燃烧”你对燃烧又有何新的认识?
“通过镁条可以在氮气中燃烧”你对燃烧又有何新的认识?
怎么回答 一个人走左看右看1年前2
一个人走左看右看1年前2 -
 何叶萧萧 共回答了21个问题
何叶萧萧 共回答了21个问题 |采纳率100%燃烧不一定是氧化反应1年前查看全部
- 点燃镁条作信号弹化学反应的文字表达式
 吃萝卜的鱼1年前2
吃萝卜的鱼1年前2 -
 kakabrz1 共回答了18个问题
kakabrz1 共回答了18个问题 |采纳率77.8%镁+氧气 点燃 氧化镁
=====1年前查看全部
- 10.6克部分被氧化的镁条,和质量分数为14.6%的盐酸恰好完全反应,生成氧气0.4克,则:(1)镁带中氧化镁的质量分数
10.6克部分被氧化的镁条,和质量分数为14.6%的盐酸恰好完全反应,生成氧气0.4克,则:(1)镁带中氧化镁的质量分数是多少?(2)参加反应的盐酸的质量是多少?(3)反应后溶液的质量分数是多少?
 hnpanf1年前1
hnpanf1年前1 -
 weirukawa 共回答了18个问题
weirukawa 共回答了18个问题 |采纳率83.3%Mg + 2HCl = MgCl2 + H2↑
24 73 95 2
x y z 0.4g
x=4.8g
y=14.6g
z=19g
1.m(Mg)=4.8g
m(MgO)=10.6-4.8g=5.8g
a1%=5.8/10.6 *100%=54.7%
2.m(HCl)=14.6/14.6%=100g
3.MgO + 2HCl = MgCl2 + H2O
40 95
5.8 q
q=13.775g
m(MgCl2)=19+13.775=32.775
a2%=32.775/(100+10.6-0.4)=29.7%1年前查看全部
- 镁条在空气中易被氧化,有一根在空气中放置一段时间的镁条样品,其质量为2.56g,把该样品与足量的稀硫酸反应得到氢气0.1
镁条在空气中易被氧化,有一根在空气中放置一段时间的镁条样品,其质量为2.56g,把该样品与足量的稀硫酸反应得到氢气0.18g.请计算:
(1)样品中未被氧化的镁的质量是多少?
(2)该镁条未被氧化时的质量是多少? 杉浦1年前4
杉浦1年前4 -
 lf6623 共回答了15个问题
lf6623 共回答了15个问题 |采纳率93.3%解题思路:(1)镁与稀硫酸反应生成氢气,根据化学方程式和生成氢气的质量,列出比例式,就可计算出样品未被氧化的镁的质量;
(2)根据“镁条样品质量-未被氧化的镁的质量=氧化镁质量”,然后利用氧化镁中镁的质量分数,计算出氧化镁中镁的质量,再加上未被氧化的镁的质量即可.(1)设样品中未被氧化的镁的质量为x,
Mg+H2SO4=MgSO4+H2↑
24 2
X 0.18g
∴[24/2=
x
0.18g],
解之得:x=2.16g;
(2)样品中MgO的质量=2.56g-2.16g=0.40g,
样品被氧化前的质量=2.16g+0.40g×[24/24+16]×100%=2.40g.
答:(1)样品中未被氧化的镁的质量是2.16g;
(2)样品被氧化前的质量是2.40g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查学生运用化学方程式和元素的质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- 镁是一种银色有金属关泽的金属.镁条长期暴露在空气中会产生一种灰黑色物质,由此
 29071年前2
29071年前2 -
 bobonong 共回答了22个问题
bobonong 共回答了22个问题 |采纳率90.9%mgo1年前查看全部
- 某校研究性学习小组用如图装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中的水的体积约占集气瓶容积的7
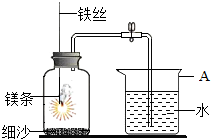 某校研究性学习小组用如图装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中的水的体积约占集气瓶容积的70%.
某校研究性学习小组用如图装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中的水的体积约占集气瓶容积的70%.
(1)图中A仪器的名称是______,燃烧、冷却后打开止水夹,水能进入广口瓶的原因是______.
(2)如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最 多不超过其容积的______%,现进入集气瓶中水的体积约为其容积的70%,根据空气的组成可推出减少的气体中有氮气.
【发现问题】氮气是怎么减少的呢?
【假设一】氮气与镁条反应而减少.
【假设二】______(只要求写出一条).
【查阅资料】镁条在氮气中能燃烧,产物为氮化镁(Mg3N2).氮化镁中氮的化合价是______.镁条还可以在二氧化碳气体中燃烧生成碳和氧化镁,该反应的类型______.
(3)通过以上探究,你对燃烧的有关知识有了什么新的认识:______. bainiweishi1年前1
bainiweishi1年前1 -
 thry54ge 共回答了14个问题
thry54ge 共回答了14个问题 |采纳率100%解题思路:本题能使同学们体会到实验探究的一般过程,通过实验分析可知:图中A仪器的名称是烧杯,燃烧、冷却后打开止水夹,水能进入广口瓶的原因是:镁与空气中的气体反应,瓶内压强减少,因此水能进入广口瓶;如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的21%,现进入集气瓶中水的体积约为其容积的70%,根据空气的组成可推出减少的气体中有氮气,氮气是怎么减少的呢?猜想二:氮气能溶于水或氮气与水反应等;氮化镁(Mg3N2)中,镁元素的化合价是+2价,因此氮元素的化合价是-3价;镁和二氧化碳气体在点燃的条件下生成碳和氧化镁,该反应属于置换反应;通过以上探究,对燃烧的新认识是:燃烧不一定有氧气参加;镁条失火,不能用氮气和二氧化碳灭火等.(1)通过实验分析可知:图中A仪器的名称是烧杯,燃烧、冷却后打开止水夹,水能进入广口瓶的原因是:镁与空气中的气体反应,瓶内压强减少,因此水能进入广口瓶;故答案为:烧杯;镁与空气中的气体反应,瓶内压强减少,因此水能进入广口瓶;
(2)如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的21%,现进入集气瓶中水的体积约为其容积的70%,根据空气的组成可推出减少的气体中有氮气,氮气是怎么减少的呢?猜想二:氮气能溶于水或氮气与水反应等;氮化镁(Mg3N2)中,镁元素的化合价是+2价,因此氮元素的化合价是-3价;镁和二氧化碳气体在点燃的条件下生成碳和氧化镁,该反应属于置换反应;故答案为:21;氮气能溶于水;-3价;置换反应;
(3)通过以上探究,对燃烧的新认识是:燃烧不一定有氧气参加;镁条失火,不能用氮气和二氧化碳灭火等;故答案为:燃烧不一定有氧气参加;镁条失火,不能用氮气和二氧化碳灭火等点评:
本题考点: 实验探究物质的性质或变化规律;空气的成分及各成分的体积分数;有关元素化合价的计算;反应类型的判定;燃烧与燃烧的条件.
考点点评: 本考点既考查了实验步骤的设计,又考查了化合价和燃烧的条件等,还对实验进行了评价,综合性比较强.实验探究题是近几年中考的热点之一,它包括实验方法和过程的探究,实验结论和实验规律的探究等.本题通过实验资料和实验分析,得到了正确的结论,属于结论性探究.同学们要具体分析,综合掌握.1年前查看全部
- 铝热反应的装置中,为什么镁条会引起氯酸钾分解,氯酸钾会引发铝热反应.
 vvde烟灰111年前1
vvde烟灰111年前1 -
 xsfpy 共回答了14个问题
xsfpy 共回答了14个问题 |采纳率92.9%镁条点燃是放热的,氯酸钾受热分解出氧气,促使镁条燃烧更充分,放出热量更多,此时氧化铁被加热到熔融状态,金属铝置换出铁单质1年前查看全部
- 在集气瓶内放入一装有少量酒精的坩埚内的酒精 再将镁条伸入集气瓶内点燃可看到镁条剧烈燃烧 在瓶底白色固体粉末中夹杂这少量黑
在集气瓶内放入一装有少量酒精的坩埚内的酒精 再将镁条伸入集气瓶内点燃可看到镁条剧烈燃烧 在瓶底白色固体粉末中夹杂这少量黑色固体 瓶内壁附着一些黑色固体 甲同学将生产物去除 用足量的盐酸处理 发现白色物质溶解 黑色物质不容 他猜测黑色物质是原镁条中所含的杂质.乙同学没有轻易赞同甲同学的意见 他推断这黑色物质是C 问:1 点燃坩埚中的酒精 对后续实验作用和影响 2设计一个实验验证甲同学的猜想是否正确!
 hpvvv1年前1
hpvvv1年前1 -
 涅磐淮海 共回答了18个问题
涅磐淮海 共回答了18个问题 |采纳率88.9%1.黑色固体增加很多.因为酒精燃烧后消耗大量的氧气,生成大量的二氧化碳,所以Mg与氧气反应生成的氧化镁减少,与二氧化碳反应生成的氧化镁增多,同时生成的碳增多
2.把同样的镁条在纯氧气中燃烧,没有出现黑色固体,所以证明黑色固体不是镁中杂质1年前查看全部
- 镁条在二氧化碳中燃烧的化学方程式属于什么反应
 594361年前2
594361年前2 -
 白金小葵 共回答了12个问题
白金小葵 共回答了12个问题 |采纳率100%置换反应 氧化还原反应1年前查看全部
- 1克镁条在空气中完全燃烧,生成物质量为多少?
 zxc1969821年前5
zxc1969821年前5 -
 乖乖隆嘀咚 共回答了19个问题
乖乖隆嘀咚 共回答了19个问题 |采纳率73.7%因为Mg和O2.CO2.N2都反应 所以质量不确定
2Mg+O2==2MgO
2Mg+CO2==2MgO+C
3Mg+N2==Mg3N2
约为5/3克吧.1年前查看全部
- 取一段镁条,除去氧化膜,浸入稀盐酸,足量镁条与一定量稀盐酸反应,镁与盐酸生成H2的量与时间关系如图,请画出反应速率(ml
取一段镁条,除去氧化膜,浸入稀盐酸,足量镁条与一定量稀盐酸反应,镁与盐酸生成H2的量与时间关系如图,请画出反应速率(ml/min)与时间(min)关系
图自己画的,原来图画乱了,凑合看吧纵坐标ml,横坐标min
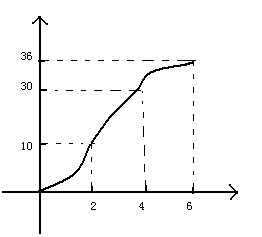
另:谁能告诉我0秒的速率是多少, ziyewuge1年前3
ziyewuge1年前3 -
 b4fgkjlhldfs 共回答了24个问题
b4fgkjlhldfs 共回答了24个问题 |采纳率95.8%化学反应速率=浓度变化/反应时间
我们所说的反应速率,是指某段时间内的平均反应速率,而不是即时速率
如题,如果是0秒的话,浓度变化为0,此时的反应速率就是01年前查看全部
- 硫的燃烧和镁条在空气中燃烧的化学公式是什么(初中化学)
 清塘荷韵4582461年前4
清塘荷韵4582461年前4 -
 k100c 共回答了21个问题
k100c 共回答了21个问题 |采纳率90.5%S+O2==点燃==SO2
2Mg+O2==点燃==2MgO(初中只要求镁和氧气反应)1年前查看全部
- 下列物质:①氮气②镁条③二氧化锰④液氧⑤食盐水⑥石灰水⑦氧化铜⑧氯酸钾⑨空气⑩冰水共存物
下列物质:①氮气②镁条③二氧化锰④液氧⑤食盐水⑥石灰水⑦氧化铜⑧氯酸钾⑨空气⑩冰水共存物
混合物 纯净物
单质 化合物
氧化物 arhh210531年前2
arhh210531年前2 -
 hude22 共回答了26个问题
hude22 共回答了26个问题 |采纳率80.8%混合物 5.6.9 纯净物 1、2、3、4、7、8、10
单质 1、2、4 化合物 3、7、8、10
氧化物3、7、10(注意⑧氯酸钾不是氧化物,氧化物只有两种元素组成的纯净物)1年前查看全部
- 小科发现取自实验室的镁条表面有黑色物质,黑色物质是什么?会不会是镁条缓慢氧化后产生的氧化镁?
 zz猫猫1年前1
zz猫猫1年前1 -
 烟上舞蹈 共回答了15个问题
烟上舞蹈 共回答了15个问题 |采纳率73.3%(1)小科把磨去黑色物质的镁带放在______(填化学式)中燃烧,结果得到的是白色固体.由此,他得出结论:黑色物质不是氧化镁.
(2)进一步查阅资料后获知,任何固体颗粒直径小到一定量,颜色都是黑色的.如纯净的铁块是银白色的,而铁粉是黑色的.由此,小可认为原来的结论______.
A.正确 B.不正确 C.可能不正确
(3)小科又开始进一步的探究……
此探究过程给你的启示是____________________________________.
解析 题目考查科学方法的探索,依照题中所给条件分析作答,合理即可.(1)O2(2)C(3)科学结论是在反复质疑的过程中形成的(在科学方法、科学精神和科学本质等方面有感悟的均可)1年前查看全部
- 在氯化铵溶液中加入镁条会产生气泡得原因?用离子方程式表示
 ailemon1年前2
ailemon1年前2 -
 唐铭轩 共回答了19个问题
唐铭轩 共回答了19个问题 |采纳率100%NH4+ +H2O=可逆=NH3·H2O+H+
Mg+2H+=Mg2+ +H2↑1年前查看全部
- 镁条在氧气中燃烧的现象和铝箔在氧气中燃烧的现象又什么不同?
 Coffiya1年前1
Coffiya1年前1 -
 缘来份往 共回答了19个问题
缘来份往 共回答了19个问题 |采纳率84.2%镁在空气中燃烧,产生耀眼的强光,生成白色固体MgO.
铝在氧气中燃烧,产生更为耀眼的强光,放出大量的热,生成灰色固体Al2O3.1年前查看全部
- 4.8g镁条在空气中充分燃烧,需要消耗多少克氧气?需要空气的体积是多少?(氧气密度为1.429g/L)
 捣乱x031年前1
捣乱x031年前1 -
 maiduo45 共回答了18个问题
maiduo45 共回答了18个问题 |采纳率77.8%2Mg + O2 ==点燃== 2MgO
2×24g ∶ 32g
4.8g ∶ m
需要消耗氧气 m=3.2g
需要氧气的体积是 3.2g÷1.429g/L=2.24L
需要空气的体积是 2.24÷21%=10.7﹙升﹚1年前查看全部
- 将镁条用砂纸打磨后,放入沸水中,再向溶液中滴加酚酞溶液的化学方程式
 linww12111年前5
linww12111年前5 -
 liuwenyu 共回答了28个问题
liuwenyu 共回答了28个问题 |采纳率92.9%Mg+2H2O=Mg(OH)2+H2(↑)
酚酞会变成粉红色,和高中的Na加入冷水的反应是一样的只不过没那么剧烈.1年前查看全部
- 在做镁条燃烧实验时,用于夹持镁条的仪器是( ) A.弹簧夹 B.坩埚钳 C.铁夹 D.试管夹
 零落瓢城1年前1
零落瓢城1年前1 -
 langlee 共回答了22个问题
langlee 共回答了22个问题 |采纳率81.8%A、弹簧夹的作用主要是用来夹持橡皮管,如验证氧气的实验中用来夹住导气管,保持装置的气密性;
B、坩埚钳一般用来夹持坩埚加热,或往热源中取、放坩埚,在初中化学中也常用作给固体物质加热的夹持工具,如实验室加热铜、高温煅烧石灰石、镁条燃烧等实验中;
C、铁夹一般是配合铁架台使用,用来夹持试管等反应装置;
D、试管夹的主要作用是用来夹持试管.
故选B.1年前查看全部
- 我知道点燃后的镁条可以放在二氧化碳中燃烧并发生化学反应,但镁条可以在二氧化碳中点燃吗?
 竹梦天使1年前4
竹梦天使1年前4 -
 hehuadegen 共回答了23个问题
hehuadegen 共回答了23个问题 |采纳率95.7%要看你的点火器了,比如用电弧点燃,是可行的.1年前查看全部
- 相同浓度相同体积的盐酸和醋酸分别与镁条反应,哪个反应速度快,为什么?
 monika19811年前5
monika19811年前5 -
 lyz_313 共回答了13个问题
lyz_313 共回答了13个问题 |采纳率84.6%当然是盐酸快了,最后是盐酸先结束反应.因为镁与酸反应的本质是镁与溶液中的H+发生置换反应生成H2.同浓度的盐酸和醋酸,前者溶液中H+浓度大(强弱酸的区别知道吧)所以盐酸反应快.如果题目改为相同PH的盐酸与醋酸,那就...1年前查看全部
- (2013•丽水)某同学为比较镁和铝的金属活动性强弱,将两块表面积相同并除去氧化膜的镁条、铝条分别与相同体积、相同质量分
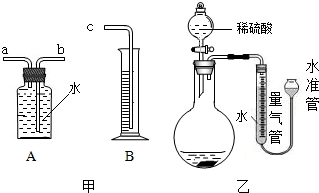 (2013•丽水)某同学为比较镁和铝的金属活动性强弱,将两块表面积相同并除去氧化膜的镁条、铝条分别与相同体积、相同质量分数的稀硫酸反应,测定两种金属与稀硫酸反应得到相同体积氢气所需要的时间.
(2013•丽水)某同学为比较镁和铝的金属活动性强弱,将两块表面积相同并除去氧化膜的镁条、铝条分别与相同体积、相同质量分数的稀硫酸反应,测定两种金属与稀硫酸反应得到相同体积氢气所需要的时间.
(1)利用图甲中A、B仪器可以组装一套实验室测量氢气体积的装置,该装置导管的连接顺序是______.
(2)图乙中量气管和水准管也可以用来测量氢气体积,为了准确地测量氢气体积,在读取量气管中液面读数的过程中,应注意______(填字母编号).
A、读数时视线与凹液面最低处相平
B、读数前应上下移动水准管,待两管液面相平再读数
C、保持水准管静止,待水准管中液面不再上升时再读数. bridget_tsi1年前1
bridget_tsi1年前1 -
 aicgliu 共回答了15个问题
aicgliu 共回答了15个问题 |采纳率73.3%解题思路:(1)根据氢气不易溶于水,通过排水法把水排入量筒内,量筒内水的体积就是收集到氢气的体积分析;
(2)在测量氢气体积时,为了使测量更为准确,要注意上下移动水准管,使左右两管的液面相平,以使量气管中的气压与大气气压相等,读数时视线应与左管内凹液面最低处相平,以减少观察误差.(1)利用等量代替的方法,量筒内水的体积就是收集到氢气的体积可知该装置导管的连接顺序是:b接c;
(2)读数时,要注意视线应于量气管凹液面的最低处保持水平;每次读数前应上下移动水准管,待两管液面相平再读数是为了防止水的压强造成的误差;故选AB.
故答案为:(1)b接c;(2)AB.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了量气的方法,关键是把握实验原理和操作方法,注重压强知识的运用及读数的方法.1年前查看全部
- 欲在室温和1.01×10 5 Pa条件下测定镁的原子量。请利用下图给定的仪器(盛放镁条的隔板有小孔)组成一套实验装置(每
欲在室温和1.01×10 5 Pa条件下测定镁的原子量。请利用下图给定的仪器(盛放镁条的隔板有小孔)组成一套实验装置(每种仪器只允许用一次)。请回答下列问题:
⑴假设气流方向由左向右,则各仪器的接口连接的先后顺序为a→ → →b→c→f→e→d(填写字母)。
⑵装置A中的分液漏斗中盛放的液体是 ,作用是 。
⑶连好仪器后,要进行的操作步骤有以下几步:
① 待仪器B中的物质恢复至室温时,测量量筒C中水的体积(假设将测定的体积换算成标准状况下为VmL);
② 擦掉镁条表面的氧化膜,将其置于天平上称量(假设其质量为mg),并将其投入试管B 中;
③ 检查各装置的气密性;
④ 旋开仪器A上分液漏斗的活塞,当镁条完全溶解时再关闭活塞。
上述几步操作的先后顺序是 。(2分)
⑷若未将试管B冷却至室温就测量量筒C中水的体积,这将会使所测镁的相对原子质量的数据(填偏高、偏低和无影响) 。
⑸若未擦净镁条表面氧化膜就进行实验,这将会使所测镁的相对原子质量的数据(填偏高、偏低和无影响) 。
⑹甲、乙、丙三位同学用下图装置来测定一定质量的镁完全反应后生成氢气的体积:
实验步骤如下:
① 检查装置的气密性;
② 向试管B中加入镁条;
③ 准确操作,记录C中液面刻度(C为带有刻度的量气管,D为可上下移动的水准管);
④ 由A向B中滴加稀盐酸至过量;
⑤ B中不在有气体产生并恢复至室温后,准确操作,记录C中液面刻度,计算得到气体的体积为Vml
Ⅰ、甲同学检查该装置气密性的方法是连接好装置,从D管注水,C、D两管液面形成高度差,做好标记,一段时间后,两边高度差 (填“变大”、“变小”或“不变”),说明气密性良好。为使测得的气体体积更精确,记录C中液面刻度时,除使视线与凹液面的最低处相平、冷至室温外,还应 ;
Ⅱ、甲同学认为镁带在实验前应打磨,目的是 ;
Ⅲ、通常实验前须估算药品用量,如果实验过程中,发现盐酸的量不足,应中途加酸还是重新实验: ;理由是 。
Ⅳ、以上是乙、丙两位同学所用实验装置,在步骤⑤读数时所处的稳定状态图,则将会对实验结果产生的影响是(假设其余步骤完善且操作准确无误):乙 ,丙 (填“偏大”、“偏小”或“无影响”)。 水儿的家1年前1
水儿的家1年前1 -
 忘记密码uu 共回答了16个问题
忘记密码uu 共回答了16个问题 |采纳率100%⑴h、g(1分)水使A瓶中的气体进入E瓶,增大E瓶中的气压,将稀盐酸压入B装置与Mg发生化学反应;
⑶③②④① (2分)⑷偏低 ⑸偏高
⑹不变调节D管,使CD两管中液面相平
Ⅱ、除去表面的氧化层;
Ⅲ、重新实验因为中途加酸,装置中的气体会逸出
Ⅳ、偏小偏大
(1)E图中气体应该从长管进来,否则就会将液体压出去了。
(2)装置A中的分液漏斗中盛放的液体是水,其作用是可以使A瓶中的气体进入E瓶,增大E瓶中的气压,将稀盐酸压入B装置与Mg发生化学反应;
(3)先后顺序为③②④①
(4)若未将试管B冷却至室温,会导致测量的气体偏多,也就会使测得的相对原子质量会偏少,
(5)若未擦净镁条表面氧化膜就进行实验,则所测得气体质量会偏少,也就会使测得的相对原子质量会偏大,
(6)高度差不变,就说明气密性良好。调节D管,使CD两管中液面相平,这样可以消除液体压强的影响。
镁表面有氧化膜,不除掉会影响测量结果。
因为中途加酸,装置中的气体会逸出,就会使测量结果不准确。
乙同学的装置图右边液面高,就会使右边压强比左边大,会使左边测得的气体体积偏小,所以乙同学的测量结果偏小,丙同学的装置左边是密闭的,当盐酸流下后会使左边气压变小,所以最终使测量结果偏高大。1年前查看全部
- 有一根在空气中放置一段时间的镁条样品,其质量为2.56g,将该样品投入到50g足量稀盐酸中,充分反应后称得混合物的质量为
有一根在空气中放置一段时间的镁条样品,其质量为2.56g,将该样品投入到50g足量稀盐酸中,充分反应后称得混合物的质量为52.38g.(1)样品中未被氧化的没镁的质量是多少(2)该镁条未被氧化时的质量是多少
 wtuynfce7501年前1
wtuynfce7501年前1 -
 一柄断剑 共回答了22个问题
一柄断剑 共回答了22个问题 |采纳率90.9%生成氢气的质量为 2.56g+50g-52.38g=0.18g
Mg+2HCl=MgCl2+H2
24 2
x 0.18g
24/x=2/0.18g
x=2.16g
(1)样品中未被氧化的镁的质量是 2.16g
氧化镁中镁的质量为 (2.56g-2.16g)*24/40=0.24g
(2)该镁条未被氧化时的质量是 2.16g+0.24g=2.4g1年前查看全部
- 某校化学课外活动小组在探究“二氧化碳真的在任何情况下都不支持燃烧吗?”这一问题时,他们设计了下列实验:①将燃着的镁条放入
某校化学课外活动小组在探究“二氧化碳真的在任何情况下都不支持燃烧吗?”这一问题时,他们设计了下列实验:①将燃着的镁条放入二氧化碳气体中,发现镁条仍在燃烧,大家十分兴奋.观察生成物,除白色物质外,还有黑色物质.②将弯成螺旋状的细铁丝中插上一支燃着的火柴棒放人二氧化碳中,发现立即熄灭.请根据同学们的实验回答下列问题.
(1)写出镁条在CO2中反应的化学方程式______;
(2)做铁丝在CO2中燃烧的实验目的是______;
(3)通过镁、铁在CO2中燃烧的实验,你得出什么结论?______;
(4)通过镁可以在CO2中燃烧这个实验,你对燃烧的条件又有什么新的认识?______. 极品阑珊1年前1
极品阑珊1年前1 -
 13的小可爱13 共回答了19个问题
13的小可爱13 共回答了19个问题 |采纳率100%解题思路:弄清二氧化碳的性质,理解燃烧的实质,并认识某些知识的相对性和实用性.(1)根据实验可知镁条可以在二氧化碳中燃烧,能生成白色物质和黑色物质,根据元素的守恒可知生成了氧化镁和碳,故答案为:2Mg+CO2
点燃
.
2MgO+C
(2)做铁丝在CO2中燃烧的实验是为了与做镁在CO2中燃烧的实验进行对照,故答案为:对照实验;
(3)通过对比实验可知:二氧化碳不能支持铁的燃烧,但可支持镁的燃烧,说明二氧化碳并不是支持所有物质的燃烧,故答案为:二氧化碳不支持铁的燃烧,但可支持镁燃烧,即二氧化碳不是在任何情况下都不支持燃烧
(4)通过这个实验可知,二氧化碳也可以支持某些物质的燃烧,并不是必须有氧气参与,故答案为:燃烧不一定有氧气参与点评:
本题考点: 实验探究物质的性质或变化规律;科学探究的基本方法;书写化学方程式、文字表达式、电离方程式;燃烧与燃烧的条件.
考点点评: 主要对燃烧、燃烧的某些条件作了一系列的探究,从而认识物质的某些性质,培养学生分析问题、解决问题的能力.1年前查看全部
- (2010•丹东)在集气瓶内放入一装有少量酒精(C2H5OH)的蒸发皿,先点燃蒸发皿内的酒精,再将经打磨过的光亮镁条伸入
 (2010•丹东)在集气瓶内放入一装有少量酒精(C2H5OH)的蒸发皿,先点燃蒸发皿内的酒精,再将经打磨过的光亮镁条伸入集气瓶内点燃.可看到镁条剧烈燃烧,在瓶底白色固体粉末中夹杂着少量黑色固体,瓶内壁也附着一些黑色固体.(如图)
(2010•丹东)在集气瓶内放入一装有少量酒精(C2H5OH)的蒸发皿,先点燃蒸发皿内的酒精,再将经打磨过的光亮镁条伸入集气瓶内点燃.可看到镁条剧烈燃烧,在瓶底白色固体粉末中夹杂着少量黑色固体,瓶内壁也附着一些黑色固体.(如图)
甲同学将生成物取出,用足量的盐酸处理,结果发现白色物质溶解,黑色物质不溶.由此他猜测:黑色物质是原来镁条中所含的杂质.
乙同学没有轻易赞同甲同学的意见,他通过查找资料,知道镁与空气中三种人们熟知的气体都会发生反应.他推断:这黑色物质是碳.
请回答下列问题:
(1)先点燃蒸发皿内的酒精,对后续实验的作用和影响是
①______;②______.
(2)实验中,在集气瓶底铺一层细砂的作用是______.
(3)请设计-个实验:验证甲同学的猜想是否正确.实验的方法是______.
(4)写出集气瓶内发生反应的化学方程式:①C2H5OH+3O2
2CO2+3H20点燃 .C2H5OH+3O2;
2CO2+3H20点燃 .
②2Mg+O2
2MgO点燃 .2Mg+O2;③
2MgO点燃 .2Mg+CO2
2Mg0+C(写3Mg+N2点燃 .
Mg3N2也可)点燃 .2Mg+CO2.
2Mg0+C(写3Mg+N2点燃 .
Mg3N2也可)点燃 . kencpj1年前1
kencpj1年前1 -
 abcbca 共回答了26个问题
abcbca 共回答了26个问题 |采纳率96.2%解题思路:运用镁的化学性质和题中信息结合课本上相关知识既能较快得出正确答案.如(1)先点燃酒精,燃烧放出大量的热并且生成二氧化碳,从而引燃镁条,生成的二氧化碳和镁反应.(2)做铁丝实验时试剂瓶铺有细砂作用一样.(3)镁条能与盐酸反应,若镁条全反应没有剩余,证明不含杂质.(4)瓶内反应有:酒精燃烧,镁条与氧气反应,镁条与氮气反应.(1)先点燃酒精,燃烧放出大量的热并且生成二氧化碳故答案:①便于引燃镁条;②酒精燃烧产生的二氧化碳聚集在集气瓶内,为镁与较多的二氧化碳反应创造条件.
在验证氧气与铁反应的实验中也在集气瓶底铺少量的细砂,作用和这里是一样的,故(2)答案:避免集气瓶因受热不均而破裂(或防止温度太高炸裂瓶底).
镁条中若含有杂质不能和酸反应,故(3)答案:将镁条直接与过量(或足量)的盐酸反应,镁条完全溶解,若无黑色物质残留,说明甲同学的猜测不能成立.
题中信息告诉我们镁与空气中三种人们熟知的气体都会发生反应,(4)答案:酒精燃烧:C2H5OH+3O2
点燃
.
2CO2+3H20
镁条燃烧:2Mg+O2
点燃
.
2MgO,2Mg+CO2
点燃
.
2Mg0+C(写3Mg+N2
点燃
.
Mg3N2也可)点评:
本题考点: 实验探究物质的组成成分以及含量;实验操作注意事项的探究;化学实验方案设计与评价;书写化学方程式、文字表达式、电离方程式.
考点点评: 典型的信息给予题,只有熟练掌握物质的性质才能正确快速的得出正确答案.1年前查看全部
- 镁条有一部分被氧化,用这种镁条0.4克与足量稀盐酸反应,在标准状况下收集到0.336 升氢气.求此
镁条有一部分被氧化,用这种镁条0.4克与足量稀盐酸反应,在标准状况下收集到0.336 升氢气.求此
镁条有一部分被氧化,用这种镁条0.4克与足量稀盐酸反应,在标准状况下收集到0.336
升氢气.求此镁条的纯度 ljyyyyyyy1年前1
ljyyyyyyy1年前1 -
 ggld096c 共回答了15个问题
ggld096c 共回答了15个问题 |采纳率93.3%Mg+2HCl=H2+MgCl2
24 22.4
X 0.336
24/X=22.4/0.336 x=0.36g
0.36/0.4X100%=90%1年前查看全部
- 镁与氧气在常温下反应么?镁条可以在点燃的条件下与氧气反应在常温下可以么?不是金属燃烧,是说它们常温发生氧化反应
 doom-sol1年前3
doom-sol1年前3 -
 mariaselfheaven 共回答了29个问题
mariaselfheaven 共回答了29个问题 |采纳率89.7%不能,金属燃烧反应通常都需要加热
氧化反应在常温下是可以进行的1年前查看全部
- 在空气中加热铜粉有气体生成吗下列各组物质,在敞口容器里发生反应,容器内物质的总质量在反应前后不变的是( )A.镁条放入盐
在空气中加热铜粉有气体生成吗
下列各组物质,在敞口容器里发生反应,容器内物质的总质量在反应前后不变的是( )
A.镁条放入盐酸中
B.高锰酸钾固体受热分解
C.硫酸铜溶液中加入氢氧化钠溶液
D.在空气中加热铜粉 珍韶华_ff1年前4
珍韶华_ff1年前4 -
 uu的文学青年 共回答了16个问题
uu的文学青年 共回答了16个问题 |采纳率81.3%C,加热铜粉生成氧化铜,黑色固体1年前查看全部
- (2009•朝阳)某校研究性学习小组用如图装置进行镁条在空气中燃烧的实验.当燃烧停止、冷却后打开止水夹、进入集气瓶中水的
(2009•朝阳)某校研究性学习小组用如图装置进行镁条在空气中燃烧的实验.当燃烧停止、冷却后打开止水夹、进入集气瓶中水的体积约占集气瓶体积的70%.请回答:
(1)如图A仪器的名称是烧杯烧杯;冷却后打开止水夹,水能进入集气瓶的原因是镁条燃烧消耗了集气瓶内的气体,使瓶内的压强减小镁条燃烧消耗了集气瓶内的气体,使瓶内的压强减小.
(2)如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的2121%.现进入集气瓶中水的体积约为其容积的70%,根据空气的组成可推出减少的气体中有氮气.
【发现问题】氮气是怎么减少的呢?
【作出假设】氮气与镁条反应而减少.
【查阅资料】镁条在氮气中能燃烧,产物为氮化镁(Mg3N2)固体.请你写出该反应的化学方程式3Mg+N2
Mg3N23Mg+N2点燃 .
Mg3N2,氮化镁中氮元素的化合价为-3-3价.点燃 .
【交流反思】通过上述探究,你对燃烧的有关知识有了什么新的认识?(写一条即可)燃烧不一定都需要有氧气参加燃烧不一定都需要有氧气参加. 維拉1年前1
維拉1年前1 -
 骑猪逛夜市 共回答了17个问题
骑猪逛夜市 共回答了17个问题 |采纳率88.2%(1)基本仪器之一烧杯;原因同课本中“探究空气中氧气含量”实验原理相同,固体燃烧消耗了集气瓶内的气体,使瓶内的压强减小
(2)如果只和空气中氧气反应那么不会超过21%,因为空气中氧气占21%;“镁条在氮气中能燃烧,产物为氮化镁(Mg3N2)固体”由化学方程式书写步骤可写出;镁通常显+2价,在化合物中,化合价的代数之和为0,可计算出氮化合价.通过此实验可知,燃烧不一定需要氧气;氮气也未必不支持燃烧
故正确答案:
(1)烧杯;镁条燃烧消耗了集气瓶内的气体,使瓶内的压强减小
(2)21
【查阅资料】3Mg+N2
点燃
.
Mg3N2;-3
【交流反思】燃烧不一定都需要有氧气参加(或氮气也能支持某些物质的燃烧)1年前查看全部
大家在问
- 11、一只空瓶子的质量是200g,装满水后总质量为500g,装满某种液体后总质量是740g,求这种液体的密度
- 2下列物质与格林试剂反应的产物是.
- 3英语翻译昨天,他好像生我的气了.(seem,angry)在美国别人能听懂你的话吗?(make,understand)我学
- 42.C语言中逗号表达式(b=2*6,b*3),b+7的值为?
- 5英语翻译‘Each in its own way was unforgettable.It would be diffi
- 6you should prevent such a silly mistake____again
- 7综合实践活动。(7分)金秋十月,向阳中学举办了第五届校运会,请你按要求完成以下各题。小题1:体育组准备在看台上悬挂一条标
- 8英语翻译knock0ut 2(这句可能不是英文)this is to remind you to register yo
- 9加倍咒正确发音拼音嗡 桑巴 Ra 桑巴 Ra,波玛纳萨 Ra,玛哈臧巴 巴吽帕的所哈.特别是;波玛纳萨 Ra,玛哈臧巴
- 10(9分)如图,质量分别为 、 的两个小球A、B静止在地面上方,B球距地面的高度h=0.8m,A球在B球的正上方。 先将B
- 11下面这些短语怎么造句?have classes have fun with have to hear from hear
- 12商朝人都是商人吗?
- 137.5斤白糖能完全溶解在1斤开水里吗
- 14教子无方枉为人表什么意思
- 15car accessories是什么意思
