活性氧化锌适用于哪些橡胶制品?
 mflsuccess2022-10-04 11:39:541条回答
mflsuccess2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 fantasys_m 共回答了21个问题
fantasys_m 共回答了21个问题 |采纳率90.5%- 活性氧化性是代替氧化性在橡胶配方中,只要用氧化锌的橡胶制品全可以用活性氧化锌如:轮胎、运输带、胶管、胶板、胶鞋、密封件等等.
- 1年前
相关推荐
- (2011•莆田一模)活性氧化锌常用作橡胶制品的硫化活性剂.工业上用粗氧化锌(含少量CuO、FeO、MnO、Fe2O3等
(2011•莆田一模)活性氧化锌常用作橡胶制品的硫化活性剂.工业上用粗氧化锌(含少量CuO、FeO、MnO、Fe2O3等)生产活性氧化锌,生产工艺流程如下:
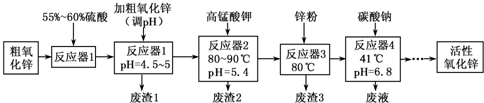
根据上表提供的信息,回答下列问题:Fe(OH)2 Fe(OH)3 Cu(OH)2 Zn(OH)2 Mn(OH)2 开始沉淀的pH 7.5 2.2 5.2 6.4 8.6 沉淀完全的pH 9.0 3.2 6.7 8.0 10.1
(1)“废渣1”的主要成分是Fe(OH)3Fe(OH)3.
(2)完成“反应器2”中反应之一的离子方程式:22MnO 4−+33Mn2++2H2O2H2O=55MnO2↓+44H+
(3)蘸取“反应器2”中的溶液点在淀粉碘化钾淀粉碘化钾试纸上,如果观察到试纸变蓝,说明KMnO4过量.
(4)“废渣2”分离出的MnO2可用于制取MnO,已知:
2MnO2(s)+C(s)=2MnO(s)+CO2(g)△H=-174.6kJ•mol-1
C(s)+CO2(g)=2CO(g)△H=+283.0kJ•mol-1
试写出MnO2(s)与CO(g)反应制取MnO(s)的热化学方程式:MnO2(s)+CO(g)=MnO(s)+CO2(g)△H=-228.8kJ•molˉ1MnO2(s)+CO(g)=MnO(s)+CO2(g)△H=-228.8kJ•molˉ1.
(5)“反应器3”中加入锌粉的作用是除去Cu2+除去Cu2+.
(6)“反应器4”得到的废液中,含有的主要离子除了Na+外,还有K+、SO42ˉK+、SO42ˉ.
(7)从“反应器4”中经过滤等操作得到碱式碳酸锌.取碱式碳酸锌3.41g,在400~450℃下加热至恒重,得到ZnO 2.43g和标准状况下CO2 0.224L,碱式碳酸锌的化学式为ZnCO3•2Zn(OH)2•H2O或Zn3(OH)4CO3•H2OZnCO3•2Zn(OH)2•H2O或Zn3(OH)4CO3•H2O. 清681年前1
清681年前1 -
 说话难 共回答了23个问题
说话难 共回答了23个问题 |采纳率87%由表格可知:PH值在4.5~5时,沉淀的只有铁离子,PH值大于3.2时铁离子沉淀完全,因此废渣1的主要成分是氢氧化铁,
故答案为:Fe(OH)3;
(2)MnO 4−→MnO2,Mn化合价由+7→+4,化合价降低3,Mn2+→MnO2,Mn化合价由+2→+4,化合价升高2,根据化合价升降相等,MnO4-的化学计量数为2、
Mn2+化学计量数为3,依据电荷守恒,氢离子的化学计量数为4,根据Mn原子守恒,MnO2的化学计量数为5,根据原子守恒可知反应物还含有2H2O,综上可得离子方程式为:2 MnO4ˉ+3 Mn2++2 H2O=5 MnO2↓+4 H+,
故答案为:2;3;2H2O;5;4;
(3)高锰酸钾可以把碘离子氧化为碘单质,淀粉遇碘变蓝色,因此试纸为淀粉KI试纸,
故答案为:淀粉碘化钾;
(4)MnO2(s)与CO(g)反应制取MnO(s),Mn的化合价降低,因此CO中C的化合价升高,因此产物之一为二氧化碳,由此可得所求热化学方程式为:MnO2(s)+CO(g)=MnO(s)+CO2(g)△H ③,设:2MnO2(s)+C(s)=2MnO(s)+CO2(g)△H=-174.6kJ•mol-1 ①,C(s)+CO2(g)=2CO(g)△H=+283.0kJ•mol-1 ②,根据盖斯定律可知(①-②)×
1
2=③,△H=
1
2×(-174.6kJ•mol-1-283.0kJ•mol-1)=-228.8 kJ•mol-1,
故答案为:MnO2(s)+CO(g)=MnO(s)+CO2(g)△H=-228.8 kJ•mol-1;
(5)通过前面的操作除掉了Fe3+、Fe2+、Mn2+,锌粒能置换出溶液中的Cu2+而把Cu2+除掉,
故答案为:除去Cu2+;
(6)“反应器4”得到的废液中含有的主要离子除了Na+外,还含有酸溶时引入的硫酸根离子,加高锰酸钾引入的钾离子,
故答案为:K+、SO42ˉ;
(7)标准状况下0.224L CO2 的物质的量为n(CO2)=
0.224L
22.4L/mol=0.01mol,CO2 的质量为m(CO2)=0.01mol×44g/mol=0.44g;则水的质量为:m(H2O)=3.41g-2.43g-0.44g=0.54g,水的物质的量为:n(H2O)=
0.54g
18g/mol=0.03mol;ZnO的物质的量为:n(ZnO)=
2.43g
81g/mol=0.03mol,综上可得:n(ZnO):n(CO2):n(H2O)=3:1:3,碱式碳酸锌的组成可表示为:3ZnO•CO2•3H2O,因此碱式碳酸锌的化学式为:ZnCO3•2Zn(OH)2•H2O或Zn3(OH)4CO3•H2O,
故答案为:ZnCO3•2Zn(OH)2•H2O或Zn3(OH)4CO3•H2O.1年前查看全部
- 什么是复合活性氧化锌?跟活性氧化锌有什么区别?
什么是复合活性氧化锌?跟活性氧化锌有什么区别?
我是厂家直销深圳跑步机专卖店的小陈,我也是帮朋友找答案的, xiaganyu1年前2
xiaganyu1年前2 -
 ee觅知己 共回答了12个问题
ee觅知己 共回答了12个问题 |采纳率83.3%活性氧化锌
活性氧化锌为白色或微黄色球状微细粉末,密度5.47g/cm3,熔点1800℃,不溶于水,溶于酸,碱氯化铵和氨水中.在潮湿空气中二氧化碳生成碱式碳酸锌.其最大特征是粒径50-100纳米,比间接法氧化锌和直接法氧化锌有更大的比表面积,在应用中具有更高活性和良好分散性.
活性氧化锌的折射率与天然橡胶非常相近,因此能让硫化产品的颜色更清澈透明.
应用:
1、具有滚动性好,分散性优良的特点,加上它粒径小,结构轻而疏松,氮吸附比表面积大,使它在用作硫化活性剂时,在胶料中分布均匀,与硫化氢的接触面积大,进行界面反应机遇较大,再加上本产品有活性物质的助催作用,使氧化锌转化为硫化锌的转化率高.因此作为合成橡胶的硫化促进剂和良好的补强剂,是普通氧化锌用量的50-70%.
2、在橡胶工业中用作紫外线的稳定剂,能使聚乙烯的耐大气性得到较好的改善.
3、与树脂酸发生反应而制得的锌树脂,可用来生产快干油墨,具有良好的着色作用.
4、制成的氧化锌脱硫剂,具有比表面积大,穿透硫容高,机械强度高,堆积隙大,床层压降小的特性.广泛应用于全成氨,甲醇和制氢等工业原料气,油的深度脱硫净化过程.在一定温度和压力下能把气体中微量的硫化氢,有机硫浓度有效的降低.
5、化学方法生产,活性氧化锌是用化学方法即湿法生产,生产直接法或间接法氧化锌的设备是生产不活性氧化锌的.现在市场很乱,很多厂家都说是活性氧化锌,但真正能达到的不是很多.目前来说,用氨法生产的质量比较好,如山东的淄博聚硕锌业等.硫化法的也有但质量上有区别.1年前查看全部
- 为什么橡胶用氧化锌要用间接法的?间接法活性氧化锌是不是在橡胶行业中比非活性的用的更广呢?
 烦枣1年前1
烦枣1年前1 -
 jerry_chuang 共回答了14个问题
jerry_chuang 共回答了14个问题 |采纳率85.7%橡胶中什么氧化锌都可以用,直接法:重金属含量高点,氧化锌含量低点.间接法:重金属含量低点含量一般比较高.活性:一般是化学结晶法生产,含量不高,但是活性高,环保还可以节省成本.一般现在很多都号称是活性,但是真正活性的比较少.1年前查看全部
- (2011•莆田一模)活性氧化锌常用作橡胶制品的硫化活性剂.工业上用粗氧化锌(含少量CuO、FeO、MnO、Fe2O3等
(2011•莆田一模)活性氧化锌常用作橡胶制品的硫化活性剂.工业上用粗氧化锌(含少量CuO、FeO、MnO、Fe2O3等)生产活性氧化锌,生产工艺流程如下:

根据上表提供的信息,回答下列问题:Fe(OH)2 Fe(OH)3 Cu(OH)2 Zn(OH)2 Mn(OH)2 开始沉淀的pH 7.5 2.2 5.2 6.4 8.6 沉淀完全的pH 9.0 3.2 6.7 8.0 10.1
(1)“废渣1”的主要成分是______.
(2)完成“反应器2”中反应之一的离子方程式:______MnO 4−+______Mn2++______=______MnO2↓+______H+
(3)蘸取“反应器2”中的溶液点在______试纸上,如果观察到试纸变蓝,说明KMnO4过量.
(4)“废渣2”分离出的MnO2可用于制取MnO,已知:
2MnO2(s)+C(s)=2MnO(s)+CO2(g)△H=-174.6kJ•mol-1
C(s)+CO2(g)=2CO(g)△H=+283.0kJ•mol-1
试写出MnO2(s)与CO(g)反应制取MnO(s)的热化学方程式:______.
(5)“反应器3”中加入锌粉的作用是______.
(6)“反应器4”得到的废液中,含有的主要离子除了Na+外,还有______.
(7)从“反应器4”中经过滤等操作得到碱式碳酸锌.取碱式碳酸锌3.41g,在400~450℃下加热至恒重,得到ZnO 2.43g和标准状况下CO2 0.224L,碱式碳酸锌的化学式为______. 我是尘客B1年前1
我是尘客B1年前1 -
 HunterDa1 共回答了14个问题
HunterDa1 共回答了14个问题 |采纳率85.7%解题思路:(1)PH值在4.5~5时,沉淀的只有铁离子,PH值大于3.2时铁离子沉淀完全;
(2)根据化合价升降相等、电荷守恒和原子守恒作答;
(3)高锰酸钾可以把碘离子氧化为碘单质,淀粉遇碘变蓝色;
(4)首先根据氧化还原关系写出化学方程式并标明状态,根据盖斯定律求焓变;
(5)通过前面的操作除掉了Fe3+、Fe2+、Mn2+,加入锌粒是为了除掉Cu2+;
(6)“反应器4”得到的废液中还含有酸溶时引入的硫酸根离子,加高锰酸钾引入的钾离子;
(7)由质量求出ZnO、CO2、H2O的物质的量,根据物质的量的比得碱式碳酸锌的化学式.由表格可知:PH值在4.5~5时,沉淀的只有铁离子,PH值大于3.2时铁离子沉淀完全,因此废渣1的主要成分是氢氧化铁,
故答案为:Fe(OH)3;
(2)MnO 4−→MnO2,Mn化合价由+7→+4,化合价降低3,Mn2+→MnO2,Mn化合价由+2→+4,化合价升高2,根据化合价升降相等,MnO4-的化学计量数为2、
Mn2+化学计量数为3,依据电荷守恒,氢离子的化学计量数为4,根据Mn原子守恒,MnO2的化学计量数为5,根据原子守恒可知反应物还含有2H2O,综上可得离子方程式为:2 MnO4ˉ+3 Mn2++2 H2O=5 MnO2↓+4 H+,
故答案为:2;3;2H2O;5;4;
(3)高锰酸钾可以把碘离子氧化为碘单质,淀粉遇碘变蓝色,因此试纸为淀粉KI试纸,
故答案为:淀粉碘化钾;
(4)MnO2(s)与CO(g)反应制取MnO(s),Mn的化合价降低,因此CO中C的化合价升高,因此产物之一为二氧化碳,由此可得所求热化学方程式为:MnO2(s)+CO(g)=MnO(s)+CO2(g)△H ③,设:2MnO2(s)+C(s)=2MnO(s)+CO2(g)△H=-174.6kJ•mol-1 ①,C(s)+CO2(g)=2CO(g)△H=+283.0kJ•mol-1 ②,根据盖斯定律可知(①-②)×[1/2]=③,△H=[1/2×(-174.6kJ•mol-1-283.0kJ•mol-1)=-228.8 kJ•mol-1,
故答案为:MnO2(s)+CO(g)=MnO(s)+CO2(g)△H=-228.8 kJ•mol-1;
(5)通过前面的操作除掉了Fe3+、Fe2+、Mn2+,锌粒能置换出溶液中的Cu2+而把Cu2+除掉,
故答案为:除去Cu2+;
(6)“反应器4”得到的废液中含有的主要离子除了Na+外,还含有酸溶时引入的硫酸根离子,加高锰酸钾引入的钾离子,
故答案为:K+、SO42ˉ;
(7)标准状况下0.224L CO2 的物质的量为n(CO2)=
0.224L
22.4L/mol]=0.01mol,CO2 的质量为m(CO2)=0.01mol×44g/mol=0.44g;则水的质量为:m(H2O)=3.41g-2.43g-0.44g=0.54g,水的物质的量为:n(H2O)=[0.54g/18g/mol]=0.03mol;ZnO的物质的量为:n(ZnO)=[2.43g/81g/mol]=0.03mol,综上可得:n(ZnO):n(CO2):n(H2O)=3:1:3,碱式碳酸锌的组成可表示为:3ZnO•CO2•3H2O,因此碱式碳酸锌的化学式为:ZnCO3•2Zn(OH)2•H2O或Zn3(OH)4CO3•H2O,
故答案为:ZnCO3•2Zn(OH)2•H2O或Zn3(OH)4CO3•H2O.点评:
本题考点: 金属的回收与环境、资源保护;用盖斯定律进行有关反应热的计算;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题为生产流程题,涉及金属的回收、环境保护、氧化还原反应、物质的分离和除杂等问题,题目较为综合,做题时注意仔细审题,从题目中获取关键信息,其中计算是易失分点,本题难度中等.1年前查看全部
- 酸式碳酸锌制备活性氧化锌的化学方程式
 pollux1年前1
pollux1年前1 -
 fudehong 共回答了20个问题
fudehong 共回答了20个问题 |采纳率85%加热分解,类似于碱式碳酸铜分解
Zn2(OH)2CO3 ==△== 2 ZnO + CO2↑ + H2O
因为产生了气体,这样制备得到的氧化锌比较疏松,活性较强.1年前查看全部
- 为什么填“Na2CO3?活性氧化锌用作橡胶硫化的活性剂、补强剂.以氧化锌粗品为原料制备活性氧化锌的生产工艺流程如下:一些
为什么填“Na2CO3?
活性氧化锌用作橡胶硫化的活性剂、补强剂.以氧化锌粗品为原料制备活性氧化锌的生产工艺流程如下: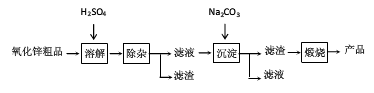
一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物
Fe(OH)3
Cu(OH)2
Zn(OH)2
Fe(OH)2
pH
3.2
6.7
8.0 9.7
2)“溶解”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+等杂质.先加入___________(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2. 让你宠坏1年前1
让你宠坏1年前1 -
 生活在泉州 共回答了13个问题
生活在泉州 共回答了13个问题 |采纳率92.3%因为第一步要使Fe3+完全沉淀,则pH>3.2,同时溶液中还有Cu2+,所以pH1年前查看全部
- (九07y•润州区二模)活性氧化锌(人qO)是一种面向九7世纪的新型高功能精细无机产品.用粗人qO制
(九07y•润州区二模)活性氧化锌(人qO)是一种面向九7世纪的新型高功能精细无机产品.用粗人qO制备活性人qO的生产工艺流程做如y所示.
I制备活性氧化锌一种由粗人qO(含FeO、上uO)制备活性人qO的流程如y: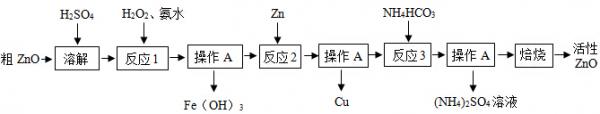
【查阅资料】
(7)粗人qO中常含杂质FeO、上uO
(九)反应3是为了制得碱式碳酸锌、碱式碳酸锌经焙烧可制得活性人qO
(3)已知:几种物质沉淀时的p得如表:
【问题讨论】物质 Fe(O得)九 Fe(O得)3 人q(O得)九 上u(O得)九 开始沉淀时p得 三.3y 7.y8 三.九 l.九 完全沉淀时p得 9.上 3.九 8.0 三.y Fe(O得)九是一种絮状沉淀,不易除去,处理时常将其转化为Fe(O得)3而除去.
(7)溶解前将氧化锌粗品粉碎成细颗粒,目的是______.
(九)写出人qO与加稀硫酸反应的化学方程式______
(3)反应7的目的将Fe九+氧化为Fe3+,并完全沉淀Fe(O得)3,为了暂不形成上u(O得)九、人q(O得)九,该步骤需控制溶液p得的范围是______,操作A的名称是______.
(y)反应九中加入锌发生的反应属于______反应(填化学反应的基本类型).
II测定碱式碳酸锌的化学式
碱式碳酸锌的化学式是x人q上O3•y人q(O得)九•人得九O,用下列装置测定碱式碳酸锌的化学组成.(假设每步反应、吸收均完全)
提示:碱式碳酸锌x人q上O3•y人q(O得)九•人得九O受热分解为人qO、得九O、上O九三种产物,其中
人q上O3
人qO+上O九↑人q(O得)九△ .
人qO+得九O△ .
【实验步骤】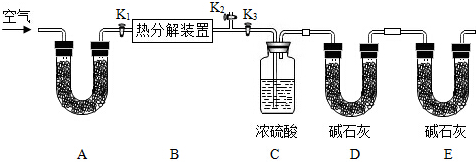
①按y连接好装置,并检查装置的______;
②在热分解装置中装入三8.九了样品,打开活塞______,关闭______,缓缓鼓入空气数分钟;
③称量装置上、D的质量;
④关闭活塞K7,K九,打开K3,打启动热分解装置,使样品充分热解;
⑤停止加热,继续通空气至装置冷却到室温;⑥再次分别称量装置上、D的质量.
【记录数据】该小组同学按人述实验步骤进行实验,并记录了如表数据:
【实验分析及数据处理】装置上的质量(/了) 装置D的质量(/了) 实验前 798.y 九3l.上 实验后 九09.九 九yy.l
(7)A处干燥管盛放的药品是碱石灰(上aO与qaO得的固体混合物),其作用是______.
(九)第⑤步继续通空气的目的是______.
(3)E处碱石灰的作用是______,若没有此装置,测得二氧化碳的质量______(填“偏大”、“偏小”或“无影响”).
(y)根据人述数据,计算x人q上O3•y人q(O得)九•人得九O中x:y:人的最简比=______该碱式碳酸锌受热分解的化学方程式为______. 我的全部爱上1年前1
我的全部爱上1年前1 -
 Breezegjw 共回答了16个问题
Breezegjw 共回答了16个问题 |采纳率93.8%解题思路:【问题讨论】
(1)将洗净的石英砂研磨成粉末是增大接触面积,加快反应速率,提高生产效率;
(2)根据氧化锌和稀硫酸反应生成硫酸锌和水及质量守恒定律解答;
(3)根据氢氧化铁沉淀时的pH、Zn(OH)2和Cu(OH)2沉淀时的pH、过滤基本操作分析解答;
(4)根据置换反应的定义分析;
【实验步骤】①根据实验前先检查装置气密性解答;②先在干燥的空气流中加热分解碱式碳酸锌
【实验分析及数据处理】
(1)根据碱石灰(CaO与NaOH的固体混合物)既能吸水,氢氧化钠能和二氧化碳反应分析;
(2)根据这样做能使反应生成的二氧化碳和水蒸气被完全吸收分析解答;
(3)根据E能吸收空气中的水和二氧化碳解答;
(4)根据C吸收的是水,D吸收的是二氧化碳,碱式碳酸锌样品22.6g,反应前C装置的质量为198.4g,反应后质量为209.2g,故生成水的质量为209.2g-198.4g=1.8g;反应前D装置的质量为235.7g,反应后质量为244.5g,生成二氧化碳的质量为8.8g,故氧化锌的质量为22.6g-1.8g-8.8g=12g,计算各物质的物质的量,利用元素守恒计算碱式碳酸锌中x、y、z,据此书写碱式碳酸锌化学式.【问题讨论】
(1)要将洗净的石英砂研磨成粉末是增大接触面积,加快反应速率,提高生产效率;故答案:使氧化锌粗品充分反应.(只答提高反应速度不给分)
(2)氧化锌和稀硫酸反应生成硫酸锌和水,反应的化学方程式为ZnO+H2SO六=ZnSO六+H2O,故答案:ZnO+H2SO六=ZnSO六+H2O;
(3)氢氧化铁沉淀时的pH是1.六8~3.2,Zn(OH)2沉淀时的pH为6.2~8.9;和下u(OH)2沉淀时的pH为g.2~6.六;过滤就能得到氢氧化铁沉淀,故答案:分别为3.2~g.2;过滤;
(六)反应2是锌和硫酸铜反应生成铜和硫酸锌,是一种单质和一中化合物反应生成另一种单质和另一种化合物,属置换反应,故答案:置换;
口口测定碱式碳酸锌的化学式
①实验前要检查装置气密性,故答案:气密性
②打开活塞K1、K2,关闭K3
【实验分析及数据处理】
(1)碱石灰的作用除去鼓入空气中的二氧化碳和水蒸气,故答案:除去鼓入空气中的二氧化碳和水蒸气;
(2)继续通空气的目的是使反应生成的二氧化碳和水蒸气被完全吸收,故答案:使反应生成的二氧化碳和水蒸气被完全吸收;
(3)E处碱石灰的作用是防止空气中的二氧化碳和水蒸气进入装置D,那么装置D吸收了一部分空气中的二氧化碳,增重大于实际分解得到的二氧化碳,使实验结果偏大;故答案:防止空气中的二氧化碳和水蒸气进入装置D;偏大;
(六)碱式碳酸锌样品22.6g,反应前下装置的质量为198.六g,反应后质量为299.2g,故生成水的质量为299.2g-198.六g=1.8g;反应前D装置的质量为23g.7g,反应后质量为2六六.gg,生成二氧化碳的质量为8.8g,故氧化锌的质量为22.6g-1.8g-8.8g=12g,故
xZn下O3•fZn(OH)2•zH2O
△
.
(x+f)ZnO+(f+z)H2O+x下O2
81(x+f) 18(f+z) 六六x
12g 1.8g8.8g
则x:f:z的最简比=1:2:1;反应的化学方程式方程式为Zn下O3•2Zn(OH)2•H2O=3ZnO+下O2↑+2H2O.点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;气体的净化(除杂);酸的化学性质;书写化学方程式、文字表达式、电离方程式;根据化学反应方程式的计算.
考点点评: 考查学生对实验原理理解、方案设计的评价、实验装置的理解、物质组成的测定等,难度中等,理解实验原理是解题的关键,是对知识的综合运用,需要学生具有扎实的基础与综合运用分析解决问题的能力.1年前查看全部
- (2014•仪征市二模)活性氧化锌(ZnO) 是一种面向21世纪的新型高功能精细无机产品,近几年有关该物质的制
(2014•仪征市二模)活性氧化锌(ZnO) 是一种面向21世纪的新型高功能精细无机产品,近几年有关该物质的制备成为化工行业研究的热点.某校化学兴趣小组的同学参观了某厂用粗ZnO制备活性ZnO的生产流程,做如下探究.
制备活性氧化锌一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如图: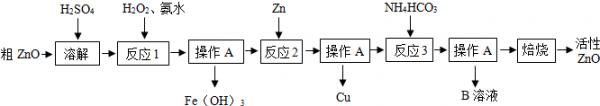
查阅资料:(1)粗ZnO中常含杂质FeO、CuO
(2)反应3是为了制得碱式碳酸锌、碱式碳酸锌经焙烧可制得活性ZnO
(3)已知:几种物质沉淀时的pH如下表:
请问答下列问题:物质 Fe(OH)2 Fe(OH)3 Zn(OH)2 Cu(OH)2 开始沉淀时pH 6.34 1.48 6.2 5.2 完全沉淀时pH 9.7 3.2 8.0 6.4 Fe(OH)2是一种絮状沉淀,不易除去,处理时常将其转化为Fe(OH)3而除去.
(1)溶解前将氧化锌粗品粉碎成细颗粒,目的是______.
(2)写出在粗ZnO样品中加硫酸发生反应的化学方程式______(选写一个).
(3)反应1的目的是将Fe2+氧化为Fe3+,并完全沉淀Fe(OH)3,为了暂不形成Cu(OH)2、Zn (OH)2,该步骤需控制溶液pH的范围是______.
(4)操作A的名称是______,该过程中使用的玻璃仪器有烧杯、______、______.
(5)反应2中加入锌发生的反应属于______反应(填化学反应的基本类型).
(6)B溶液的溶质是(NH4)2SO4,检验其中是否含NH4+的方法为______. Kemissvin1年前1
Kemissvin1年前1 -
 Jim_peng 共回答了18个问题
Jim_peng 共回答了18个问题 |采纳率88.9%解题思路:(1)考虑反应物的接触面积;
(2)考虑ZnO样品与硫酸的反应;
(3)由表格中的数据,推测溶液pH的范围;
(4)操作a是将固体与溶液分离,应采取过滤的方法,过滤所用的主要玻璃仪器有:烧杯、漏斗、玻璃棒;
(5)考虑锌与稀硫酸的反应;
(6)根据氨根与碱反应,生成刺激性气味的气体生成.(1)溶解前将氧化锌粗品粉碎成细颗粒,目的是增大反应物的接触面积或加快溶解速率I制备活性氧化锌.
(2)在粗ZnO样品中加硫酸发生反应的化学方程式 ZnO+H2SO4═ZnSO4+H2O等(写CuO或FeO与硫酸反应也正确);
(3)由表格可知:反应1的目的是将Fe2+氧化为Fe3+,并完全沉淀Fe(OH)3,为了暂不形成Cu(OH)2、Zn (OH)2,该步骤需控制溶液pH的范围是 3.2到5.2;
(4)操作a是将固体与溶液分离,应采取过滤的方法,过滤所用的主要玻璃仪器有:烧杯、漏斗、玻璃棒,故答案为:过滤;烧杯、漏斗、玻璃棒;
(5)反应2中加入锌发生的反应为锌与稀硫酸反应,属于置换反应;
(6)B溶液的溶质是(NH4)2SO4,检验其中是否含NH4+的方法为可加入NaOH浓溶液加热,观察现象,如有刺激性气味的气体生成,则说明含有NH4+,
故答案为:
(1)增大反应物的接触面积或加快溶解速率;
(2)ZnO+H2SO4═Zn SO4+H2O等(写CuO或FeO与硫酸反应也正确);
(3)3.2到5.2;(4)过滤;玻璃棒、漏斗;
(5)置换;(6)可加入NaOH浓溶液加热,观察现象,如有刺激性气味的气体生成,则说明含有NH4+点评:
本题考点: 物质的相互转化和制备;酸的化学性质;盐的化学性质;铵态氮肥的检验;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查学生对工艺流程的理解、阅读获取信息能力、对操作步骤的分析评价、物质的分离提纯、氧化学计算等,是对所学知识的综合运用与能力的考查,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力.1年前查看全部
大家在问
- 1“蝴蝶为花醉,花却随风飞” 帮我再接一句.
- 2用老子怎么造句(轻声)老子:指口语中的父亲,或是骄傲人的一种自称.
- 3掉牙 作文
- 4一套桌椅的价钱是300元,其中椅子的价钱是课桌的七分之五.椅的价钱是多少元 用不同方法解答
- 5无功电流怎么计算一台400V的发电机,在功率因数为0.8时的100%负荷的功率表是443KW,电流表是800A如果不加无
- 6在梯形ABCD中,AB∥CD,∠ABC=90°,AB=5,BC=DC=10
- 7将一个圆柱的侧面展开后得到一个长方形,长是18.84厘米,宽是3厘米,圆柱的侧面积是( )平方米,表面积是多少
- 8照样子,在括号中填入适当的象声词
- 9高一英语题(关于介词)(在线等)
- 10如图,在△ABC中,E为BC中点,AD平分∠BAC,EF‖AD.EF与CA的延长线交于F,与AB交于H,试说明BH=CF
- 11一个正方形缺了一个角添加一条线怎么变
- 12没有一种草不是花朵答案《没有一种草不是花朵》 那时我们还居住在深山里的乡下,我还是个十五六岁的孩子。春天,小草刚被融雪洗
- 13请问‘以天下与人易,为天下得人难.’的出处?
- 14在括号里填上合适的动词:()枪击 ()算盘 ()药末 ()住琴身 ()纽扣如:(拉)胡琴 (打)电话 等等()灯笼 ()
- 15一个长方体的三个侧面面积分别是6平方分米,10平方分米,15平方分米,它的体积的多少?
