捕碳技术(主要指捕获CO 2 )在降低温室气体排放中具有重要的作用。
 期待你到来2022-10-04 11:39:541条回答
期待你到来2022-10-04 11:39:541条回答| 捕碳技术(主要指捕获CO 2 )在降低温室气体排放中具有重要的作用。 目前NH 3 和(NH 4 ) 2 CO 3 已经被用作工业捕碳剂,它们与CO 2 可发生如下可逆反应: 反应Ⅰ:2NH 3 (l)+H 2 O(l)+CO 2 (g)  (NH 4 ) 2 CO 3 (aq) △ H 1 (NH 4 ) 2 CO 3 (aq) △ H 1 反应Ⅱ:NH 3 (l)+H 2 O(l)+CO 2 (g)  (NH 4 ) 2 HCO 3 (aq) △ H 2 (NH 4 ) 2 HCO 3 (aq) △ H 2 反应Ⅲ:(NH 4 ) 2 CO 3 (aq)+H 2 O(l)+CO 2 (g)  2(NH 4 ) 2 HCO 3 (aq) △ H 3 2(NH 4 ) 2 HCO 3 (aq) △ H 3 请回答下列问题: (1) △ H 3 与 △ H 1 、 △ H 2 之间的关系是: △ H 3 。 (2)为研究温度对(NH 4 ) 2 CO 3 捕获CO 2 效率的影响,在某温度T 1 下,将一定量的(NH 4 ) 2 CO 3 溶液置于密闭容器中,并充入一定量的CO 2 气体(用氮气作为稀释剂),在t时刻,测得容器中CO 2 气体的浓度。然后分别在温度为T 2 、T 3 、T 4 、T 5 下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得CO 2 气体浓度,得到趋势图(见图1)。则: ① △ H 3 0(填>、=或<)。 ②在T 1 ~T 2 及T 4 ~T 5 二个温度区间,容器内CO 2 气体浓度呈现如图1所示的变化趋势, 其原因是 。 ③反应Ⅲ在温度为 T 1 时,溶液pH随时间变化的趋势曲线如图2所示。当时间到达 t 1 时,将该反应体系温度上升到 T 2 ,并维持该温度。请在图中画出 t 1 时刻后溶液的pH变化总趋势曲线。  (3)利用反应Ⅲ捕获CO 2 ,在(NH 4 ) 2 CO 3 初始浓度和体积确定的情况下,提高CO 2 吸收量的措施有 (写出2个)。 (4)下列物质中也可能作为CO 2 捕获剂的是 。
|

已提交,审核后显示!提交回复
共1条回复
 心情ffA 共回答了20个问题
心情ffA 共回答了20个问题 |采纳率85%- (1)2 △ H 2 - △ H 1
(2)①<
②T 1 -T 2 区间,化学反应未达到平衡,温度越高,化学反应的速率越快,所以CO 2 被捕获的量随温度升高而提高。T 4 -T 5 区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,所以不利于CO 2 的捕获。
③
(3)降低温度;增加CO 2 浓度(或分压)
(4)B、D
(1)将反应Ⅰ倒过来书写:
(NH 4 ) 2 CO 3 (aq) 2NH 3 (l)+ H 2 O (l)+ CO 2 (g) —△ H 1
2NH 3 (l)+ H 2 O (l)+ CO 2 (g) —△ H 1
将反应Ⅱ×2:
2NH 3 (l)+ 2H 2 O (l)+ 2CO 2 (g) 2NH 4 HCO 3 (aq) 2△ H 2
2NH 4 HCO 3 (aq) 2△ H 2
得:(NH 4 ) 2 CO 3 (aq) + H 2 O (l)+ CO 2 (g) 2NH 4 HCO 3 (aq) △ H 3 =2△ H 2 —△ H 1
2NH 4 HCO 3 (aq) △ H 3 =2△ H 2 —△ H 1
(2)由图1可知:在温度为 T 3 时反应达平衡,此后温度升高, c (CO 2 )增大,平衡逆向移动,说明反应Ⅲ是放热反应(△ H 3 <0)。在 T 3 前反应未建立平衡,无论在什么温度下(NH 4 ) 2 CO 3 (aq)总是捕获CO 2 ,故 c (CO 2 )减小。反应Ⅲ在温度为 T 1 时建立平衡后(由图2可知:溶液pH不随时间变化而变化),迅速上升到 T 2 并维持温度不变,平衡逆向移动,溶液pH增大,在 T 2 时又建立新的平衡。
(3)根据平衡移动原理,降低温度或增大 c (CO 2 )
(4)具有碱性的物质均能捕获CO 2 ,反应如下:Na 2 CO 3 +CO 2 +H 2 O=2NaHCO 3 ;HOCH 2 CH 2 NH 2 +CO 2 +H 2 O= HOCH 2 CH 2 NH 3 + HCO 3 — 。
【考点定位】考查热化学方程式书写,化学反应速率、化学平衡移动和化学方程式书写等。 - 1年前
相关推荐
- (2014•呼伦贝尔二模)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用,目前NH3和(NH4)2CO3
(2014•呼伦贝尔二模)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用,目前NH3和(NH4)2CO3已经被用作工业捕碳剂.
(1)已知CO2与NH3 经过两步反应可生成尿素,两步反应的能量变化示意图如图:
则NH3(g) 与CO2(g) 反应生成尿素的热化学方程式为______.
(2)已知CO2与(NH4)2CO3反应如下:(NH4)2CO3(aq)+H2O(l)+CO2(g)⇌2NH4HCO3(aq)△H<0,该反应在温度为T1时,溶液的pH随时间变化的趋势曲线如图1所示.当时间达到t1时,将该反应体系温度迅速上升到T2,并维持该温度,在t2达到新的平衡.请在图1中画出t1时刻后溶液的pH变化总趋势曲线.在(NH4)2CO3初始浓度不变的情况下,提高CO2吸收量的措施有:______,______(写出2个)
(3)工业上也可用CO2与H2反应生成甲醇,其反应为:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ/mol.在T℃下,将1mol CO2和2mol H2充入0.5L恒容密闭容器中,测得H2的物质的量随时间的变化情况如图2所示.
①按曲线计算反应从0到4min时,v(H2)=______.
②在T℃时,若仅改变某一外界条件时,测得H2的物质的量随时间的变化情况如图2曲线Ⅱ所示,则改变的外界条件为______.反应按曲线Ⅱ进行,计算达到平衡时容器中c(CO2)=______.
③判断该反应达到平衡的依据为______ (填正确选项的字母)
A.混合气体的平均相对分子质量不随时间改变
B.3v(H2)正=v(CH3OH)逆
C.混合气体的压强不随时间改变
D.单位时间内生成CH3OH和H2O的物质的量相同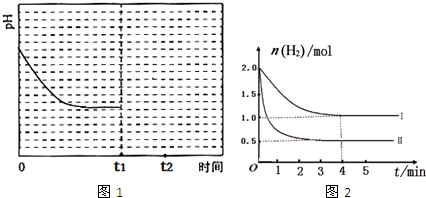
 假行僧CQTV1年前1
假行僧CQTV1年前1 -
 遗忘中成长 共回答了17个问题
遗忘中成长 共回答了17个问题 |采纳率88.2%解题思路:(1)根据盖斯定律,结合图象分析计算得到所需热化学方程式;
(2)反应Ⅲ在温度为T1时建立平衡后(由图2可知:溶液pH不随时间变化而变化),迅速上升到T2并维持温度不变,平衡逆向移动,溶液pH增大,在T2时又建立新的平衡,根据平衡移动原理分析;
(3)①依据图象分析,结合反应速率V=[△c/△t]计算氢气反应速率;
②根据到达平衡的时间减少,氢气也减少,说明改变了二氧化碳的浓度,先计算出曲线 I达到平衡时的平衡常数,根据温度不变,平衡常数不变再计算出曲线II达到平衡时CO2的浓度;
③依据反应平衡标志是正逆反应速率相同,各组分含量不变分析选项.(1)由图示可知,将两个反应相加可得2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-134 kJ/mol;故答案为:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-134 kJ/mol;(2)反应Ⅲ在温度为T1时建立平衡后...
点评:
本题考点: 热化学方程式;化学平衡的影响因素;化学平衡状态的判断;化学平衡的计算.
考点点评: 本题考查了热化学方程式书写方法,化学反应速率、化学平衡状态影响因素分析应用,平衡计算的理解应用,平衡常数计算分析,掌握基础是关键,题目难度中等.1年前查看全部
大家在问
- 1已知关于x的方程x2-(k+1)x+1/4k2+1=0,根据下列条件,分别求出K的值.
- 29、找下面的例子,在括号里填上适当的词语. 例如:改造(思想) 辅导 ( )
- 3瘦骨嶙峋系咩意思呢?
- 4已知:如图,AC=BD,∠CAB=,∠DBA.求证:(2)BC=AD,∠C=∠D.
- 5先是四道选择题哈:第一道:What is the weather like?It is going to_______A
- 6甲烷和乙醇燃烧产物都是二氧化碳和水是否可以由此证明甲烷和乙醇都是由碳元素和氢元素组成的碳氢化合物
- 71、They each _____ an English-Chinese dictionary
- 8my father can make some model planes.(把 can改成is)怎么做?
- 9play with的用法
- 10the train__leave at 5:00 p.m.,we can't be late for it.
- 11养猪场前年养猪9头.去年又增养99头.今年再增养999多3头.这个养猪场今年养猪多少头
- 12麻烦看一下这个句子,我这样分析对吗》?
- 13藏族群众大多信仰的宗教是( )
- 14有一个负载电阻值为R,当将它接在20V的直流电源上时,消耗的电功率为P,若将R接在图5中的变压器的次级电路中消耗的电功率
- 15问那个邮递员的爱好是什么的英文
