放热反应一定要在低温下进行,吸热反应则必须加热.说出例子
 shijuren2022-10-04 11:39:541条回答
shijuren2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 **男人保护品种 共回答了20个问题
**男人保护品种 共回答了20个问题 |采纳率100%- 不是,放热反应:铝热反应需要高温,但是放热反应
吸热反应:氯化铵和氢氧化钙的反应,不需加热 - 1年前
相关推荐
- 已知N2+3H2⇌2NH3为放热反应,对该反应的下列说法中正确的是( )
已知N2+3H2⇌2NH3为放热反应,对该反应的下列说法中正确的是( )
A.N2的能量一定高于NH3
B.H2的能量一定高于NH3
C.N2和H2的总能量一定高于NH3的总能量
D.因该反应为放热反应,故不必加热就可发生 huinc1年前1
huinc1年前1 -
 fthrdwwa 共回答了30个问题
fthrdwwa 共回答了30个问题 |采纳率100%解题思路:A、反应是放热反应,结合反应热来判断产物、反应物物质的能量高低;
B、根据反应还是放热的,结合反应热来判断产物、反应物物质的能量高低;
C、反应物的能量高于生成物的能量时,反应是放热反应;
D、有的放热反应也需要一定的条件才可以发生.A、当所有反应物的能量高于生成物的能量时,反应是放热反应,所以N2+3H2⇌2NH3为放热反应,说明氨气和氢气的能量高于氨气,但是不能说明N2的能量一定高于NH3,故A错误;
B、当所有反应物的能量高于生成物的能量时,反应是放热反应,所以N2+3H2⇌2NH3为放热反应,说明氨气和氢气的能量高于氨气,但是不能说明H2的能量一定高于NH3,故B错误;
C、反应是放热反应,所以反应物的能量高于生成物的能量,即N2和H2的总能量一定高于NH3的总能量,故C正确;
D、并不是说所有的放热反应不必加热就可发生,如氨的合成需要高温高压催化剂才能发生,故D错误.
故选C.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查反应的热效应与物质能量的关系,题目难度不大,注意知识的归纳和整理是关键.1年前查看全部
- 化学反应需加热才能发生的放热反应有什么
 成小1年前1
成小1年前1 -
 绿茶6677 共回答了12个问题
绿茶6677 共回答了12个问题 |采纳率83.3%化学反应需加热(点燃)才能发生的放热反应最主要的是物质的燃烧,如氢气的燃烧甲烷的燃烧,一氧化碳的燃烧等等.燃烧反应要先点燃.此外,铝热反应也是需加热才能发生的放热反应.1年前查看全部
- 焓变小于0一定是放热反应,已知某反应的焓变小于0,下列叙述正确的是A该反应一定是放热反应B该放映一定是吸热反应C该反应反
焓变小于0一定是放热反应,
已知某反应的焓变小于0,下列叙述正确的是
A该反应一定是放热反应
B该放映一定是吸热反应
C该反应反应物的总能量一定大于生成物的总能量
D该反应生成物的总能量一定大于反应物的总能量
单选 不做大多数1年前3
不做大多数1年前3 -
 yh_2006 共回答了21个问题
yh_2006 共回答了21个问题 |采纳率85.7%要是一定要单选的话就选C,说明这题出的比较偏,认为反应后的能量不光是按我们通常说的以热量形式放出,可能以光能或其他能量形式放出1年前查看全部
- 下列反应中既属于氧化还原反应又属于放热反应的是( )
下列反应中既属于氧化还原反应又属于放热反应的是( )
A.氢氧化钾与硫酸的反应
B.锌与盐酸反应放出氢气
C.碳还原氧化铜
D.Ba(OH)2•8H2O与NH4Cl反应 2757089791年前1
2757089791年前1 -
 空涩风琴 共回答了32个问题
空涩风琴 共回答了32个问题 |采纳率93.8%解题思路:含元素化合价变化的反应,为氧化还原反应;反应物总能量大于生成物总能量,则反应为放热反应,以此来解答.A.反应生成硫酸钾和水,为中和反应,没有元素的化合价变化,为非氧化还原反应,且为放热反应,故A不选;
B.反应生成氯化锌和氢气,Zn、H元素的化合价变化,为氧化还原反应,且为放热反应,故B选;
C.为氧化还原反应,但为吸热反应,故C不选;
D.为非氧化还原反应,也为吸热反应,故D不选;
故选B.点评:
本题考点: 氧化还原反应;吸热反应和放热反应.
考点点评: 本题考查氧化还原反应和反应中的热效应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应、吸热反应判断的考查,注意归纳常见的放热、吸热反应及从元素化合价角度分析,题目难度不大.1年前查看全部
- 下列变化中,属于放热反应的是石灰石受热分解 木炭的不完全燃烧 二氧化碳与红热碳反应生成一氧化碳 炭在高温下与水蒸气反应生
下列变化中,属于放热反应的是
石灰石受热分解
木炭的不完全燃烧
二氧化碳与红热碳反应生成一氧化碳
炭在高温下与水蒸气反应生成一氧化碳和氢气 天鹰翔云1年前1
天鹰翔云1年前1 -
 0628林 共回答了18个问题
0628林 共回答了18个问题 |采纳率88.9%木炭的不完全燃烧1年前查看全部
- 填空:用热力学函数符号表示下列状态的热力学特征,恒温恒压条件下,放热反应的(1)小于零;
填空:用热力学函数符号表示下列状态的热力学特征,恒温恒压条件下,放热反应的(1)小于零;
填空:用热力学函数符号表示下列状态的热力学特征,恒温恒压条件下,放热反应的( )小于零;标准状态,298.15K时,稳定单质的( )和( )等于零;在0K时,纯净完美晶体的( )等于零;自发进行的反应( )小于零. 坠天羽翼1年前1
坠天羽翼1年前1 -
 Sweetpea 共回答了22个问题
Sweetpea 共回答了22个问题 |采纳率95.5%第一个是△H,第二个是标准摩尔焓变,第三个是标准摩尔熵,第四个是△G.1年前查看全部
- 自发进行的反应一定是( )A. 吸热反应B. 放热反应C. 熵增加反应D. 熵增加或者放热反应
 未激活1641年前2
未激活1641年前2 -
 zengsean 共回答了16个问题
zengsean 共回答了16个问题 |采纳率93.8%解题思路:自发进行的反应符合△H-T△S<0,依据判断依据分析选项;反应自发进行需要焓变、熵变、温度共同决定.A、吸热反应△H>0,若△S<0,反应一定是非自发进行的反应,故A不符合;
B、放热反应△H<0,若△S>0,高温可能非自发反应,故B不符合;
C、熵增加反应,放热反应△H<0,若△S>0,高温可能非自发反应,故C不符合;
D、熵增加或者放热反应,△S>0,△H<0,△H-T△S<0,故D符合;
故选:D.点评:
本题考点: 焓变和熵变.
考点点评: 本题考查了反应自发进行的判断依据,反应焓变、熵变、温度共同决定反应是否自发进行,题目较简单.1年前查看全部
- 吸热反应比放热反应好在哪里?辩论要用,可以从很多角度来,不一定局限于化学方面,经济生活也可以
 jy029174201年前2
jy029174201年前2 -
 爱吃豆腐 共回答了25个问题
爱吃豆腐 共回答了25个问题 |采纳率92%吸热反应容易控制反应速度.1年前查看全部
- CaCO3 + 2HCl == CaCl2 + H2O + CO2↑吸热反应还是放热反应?为什么?
 kangchuang1年前2
kangchuang1年前2 -
 gmgh294548 共回答了19个问题
gmgh294548 共回答了19个问题 |采纳率84.2%反应物的总能量>生成物的总能量 化学反应放出热量
反应物的总能量1年前查看全部
- 遇空气发生缓慢放热反应的黑色粉末是什么?
遇空气发生缓慢放热反应的黑色粉末是什么?
最近病了输液,医院卖一种给药液加热的小东西.是一个可以缠绕输液管的塑料棒,密封在塑料袋里.打开密封的塑料袋后,塑料棒就自动发热.我观察后发现,塑料棒上有很多通气孔,塑料棒里面填满了一种黑色的粉末.我想肯定是黑色粉末与空气发生化学反应,并且放热,放热过程不剧烈,能持续放热一天,也可能掺杂有催化剂控制放热过程.谁能想到这是一种什么物质啊?闻不到气味. xiaomt1年前2
xiaomt1年前2 -
 吕小猫1015 共回答了20个问题
吕小猫1015 共回答了20个问题 |采纳率90%Fe+C1年前查看全部
- 过氧化氢和二氧化碳反应生成氧气是放热反应还是吸热反应啊?
 玲兴1年前4
玲兴1年前4 -
 行云_如水 共回答了19个问题
行云_如水 共回答了19个问题 |采纳率94.7%过氧化氢,是一种氧化物,在医院有.不过反应生成氢气,与二氧化碳无关.仅仅是自身被,催化而已.催化剂作用下,有氧生成1年前查看全部
- 如何判断反应是否为吸热反应还是放热反应?
如何判断反应是否为吸热反应还是放热反应?
如果反应物所具有的总能量大于生成物所具有的总能量,反应物转化为生成物时放出热量,这是放热反应.
如果反应物所具有的总能量小于生成物所具有的总能量,反映物就需要吸收热量才能转化为生成物,这是吸热反应.
但是如何才能判断出 反应物的总能量大于或小于生成物的总能量呢?请举例 cdzcs1年前1
cdzcs1年前1 -
 6d453cb41e0921a7 共回答了14个问题
6d453cb41e0921a7 共回答了14个问题 |采纳率92.9%查表
每个物质都有它的融化热、汽化热与比热容
①从绝对零度开始,到它的现在温度所吸收的热量就是固体的内能
②从绝对零度开始,到它的熔点所吸收的热量+熔化热+上升到现在温度所需要的热量=液体的内能
③从绝对零度开始,到它的熔点所吸收的热量+熔化热+从熔点到沸点需要的热量+汽化热+上升到现在温度所需要的热量=气体的内能
用前后内能比较久可以知道是吸热还是放热了1年前查看全部
- 根据化学平衡移动判断可逆反应的正反应是放热反应
 小新跑跑1年前1
小新跑跑1年前1 -
 夏日莲莲 共回答了16个问题
夏日莲莲 共回答了16个问题 |采纳率81.3%我一般记个口诀:升吸降放.
意思就是升高温度,若正反应为吸热反应,则平衡正向移动.
降低温度,若正反应为放热反应,则平衡正向移动.1年前查看全部
- 放热反应降温后平衡移动问题如果正反应放热,比如说N2+3H2=2NH3+Q,那么降温后平衡向正反应方向移动,那么应该是正
放热反应降温后平衡移动问题
如果正反应放热,比如说N2+3H2=2NH3+Q,那么降温后平衡向正反应方向移动,那么应该是正反应速率减小得比逆反应小才对啊,为什么是大呢 zxnet20041年前1
zxnet20041年前1 -
 huangyi_110 共回答了27个问题
huangyi_110 共回答了27个问题 |采纳率85.2%正反应速率大于逆反应速率,反应正向移动.
降温是正逆反应速率同时降低,但逆反应速率降低更快,所以反应正向移动.1年前查看全部
- 水结冰是吸热反应还是放热反应
 jr3691年前3
jr3691年前3 -
 zeruelni 共回答了13个问题
zeruelni 共回答了13个问题 |采纳率84.6%凝固,放热反应.1年前查看全部
- 20.在容积固定的密闭容器中存在如下反应:A(g)+3B(g)2C(g),正反应是放热反应.某研究小组研究了其他条件不变
20.在容积固定的密闭容器中存在如下反应:A(g)+3B(g)2C(g),正反应是放热反应.某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
下列判断一定错误的是( )
A.图Ⅰ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
注:请具体解释各个选项答案是A,B..请解释原因
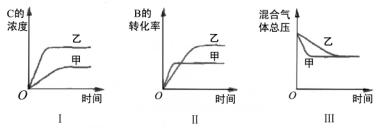
 身宪玄成1年前1
身宪玄成1年前1 -
 破晓px 共回答了21个问题
破晓px 共回答了21个问题 |采纳率95.2%图一的向上曲线应该重合
B,增大压强,化学平衡向气体体积减少方向进行,甲在上面
C.升高温度,化学平衡向吸热方向进行,逆反应方向,对.
D.总压不会变,甲催化效率高,所以比较斜,对.1年前查看全部
- 高一化学反应中的热量的表达符号吸热反应和放热反应的符号,再举一些例子说明哪些是放热反应哪些是吸热反应 还有化学反应速率与
高一化学反应中的热量的表达符号
吸热反应和放热反应的符号,再举一些例子说明哪些是放热反应哪些是吸热反应 还有化学反应速率与反应限度的一些重要概念 Relationship1年前4
Relationship1年前4 -
 AJTDMW06 共回答了17个问题
AJTDMW06 共回答了17个问题 |采纳率82.4%Q可以表示放出的热量
△H放热时是吸热反应
如: C(固)+H2O(气)=CO(气)+H2(气)-131.3kJ
当吸热 v逆 正向 v正.< v逆 逆向
浓度: 其他条件不变, 增大反应物浓度或减小生成物浓度, 正向移动 反之
压强: 其他条件不变,对于反应前后气体,总体积发生变化的反应,增大压强,平衡向气体体积缩小的方向移动, 反之…
温度: 其他条件不变,温度升高,平衡向吸热方向移动 反之…
催化剂: 缩短到达平衡的时间,但平衡的移动无影响
勒沙特列原理:如果改变影响化学平衡的一个条件,平衡将向着减弱这种改变的方向发生移动
化学反应限度:
1、概念:化学反应限度就是研究可逆反应所能达到的最大程度.
2、可逆反应:在同一反应条件下,既能向正反应方向进行,又能向逆反应方向进行的化学反应.
3、说明:
(1)绝大多数反应都有一定的可逆性.一个反应是可逆反应的必需条件:在同一反应条件下进行.
(2)可逆反应在一定条件下进行到一定程度时,正反应速率和逆反应速率相等,反应物与生成物的浓度不再发生变化,反应达到化学平衡状态.
(3)化学平衡时一种动态平衡.在化学平衡状态下化学反应仍进行,但是反应混合物的组成保持一致,当反应条件改变时,原化学平衡状态被破坏,一段时间后会达到新的平衡.1年前查看全部
- 氢气在氧气中燃烧生成水蒸气是一个放热反应,且反应生成1molH2O(g)时放出的热量为Qkj,若反应过程中破坏1mol氢
氢气在氧气中燃烧生成水蒸气是一个放热反应,且反应生成1molH2O(g)时放出的热量为Qkj,若反应过程中破坏1mol氢气的H----H键需消耗能量Q1kj,破坏1mol氧气中的O===O键需消耗能量Q2kj,则下列说法中正确的是
A在整个化学反应过程中有2Q1+Q2=2Q
B根据能量守恒有Q1+Q2=Q
C由水蒸气分解为氢气和氧气的△H=(Q-Q1-Q2)kj
D形成1molH---O键放出的能量为[(2Q1+Q2+2Q)/A]kj
为什么不是C, hyf5131年前1
hyf5131年前1 -
 蓝精灵hui 共回答了16个问题
蓝精灵hui 共回答了16个问题 |采纳率93.8%水蒸气分解为氢气和氧气可以看作氢气在氧气中燃烧生成水蒸气的逆过程,所以△H=+QKJ1年前查看全部
- 可逆反应a+b=2c 放热反应 升高温度,减少压强速率怎么变
 枫致1年前1
枫致1年前1 -
 青风名月 共回答了16个问题
青风名月 共回答了16个问题 |采纳率87.5%升高温度,逆反应增强,减小压强反应速率不变1年前查看全部
- 下列有关化学反应与能量的说法中正确的是( ) A.Ba(OH) 2 •8H 2 O与NH 4 Cl反应是放热反应 B.
下列有关化学反应与能量的说法中正确的是( ) A.Ba(OH) 2 •8H 2 O与NH 4 Cl反应是放热反应 B.铝热反应是放热反应 C.镁与盐酸反应是吸热反应 D.2个H变成氢分子(H-H)需吸收能量  深海悠然1年前1
深海悠然1年前1 -
 zhengli93 共回答了18个问题
zhengli93 共回答了18个问题 |采纳率94.4%A、Ba(OH) 2 •8H 2 O与NH 4 Cl反应是吸热反应,故A错误;
B、铝热反应是放热反应,故B正确;
C、镁与盐酸反应是放热反应,故C错误;
D、2个H变成氢分子(H-H)需放出能量,故D错误.
故选B.1年前查看全部
- 下列变化过程,属于放热反应的是( )
下列变化过程,属于放热反应的是( )
①生石灰与水反应
②酸碱中和反应
③浓H2SO4稀释
④固体氢氧化钠溶于水
⑤H2在Cl2中燃烧
⑥醋酸电离
⑦NH4Cl晶体与Ba(OH)2•8H2O混合搅拌
A.①②⑤
B.①②③④⑤
C.①③④
D.⑥⑦ 肥猪仔1年前1
肥猪仔1年前1 -
 windtalkes 共回答了22个问题
windtalkes 共回答了22个问题 |采纳率86.4%解题思路:根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱),C或氢气做还原剂时的反应.①生石灰跟水反应生成熟石灰属于放热反应;
②酸碱发生中和反应是放热反应;
③浓硫酸稀释要放热,但不是放热反应;
④固体氢氧化钠溶于水放热,但不是放热反应;
⑤H2在Cl2中燃烧是放热反应;
⑥醋酸电离吸热;
⑦NH4Cl晶体与Ba(OH)2•8H2O反应是吸热反应;
故选A.点评:
本题考点: 吸热反应和放热反应.
考点点评: 本题主要考查化学反应的热量变化,应注重归纳中学化学中常见的吸热或放热的反应,对于常见的吸热过程和放热过程不是化学变化,题目难度不大.1年前查看全部
- 某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题 (1)在A
某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题 
(1)在A装置中用固体二氧化锰与浓盐酸在加热条件下制取氯气,反应原理为:
MnO 2 +4HCl(浓) MnCl 2 +Cl 2 ↑+2H 2 O,请在该反应方程式中标出电子转移方向和数目,
MnCl 2 +Cl 2 ↑+2H 2 O,请在该反应方程式中标出电子转移方向和数目,
_________________________并指出氧化剂为_______________,还原剂为________________
(2)漂白粉将在U形管中产生,其化学方程式是____________________________
(3)C装置的作用是____________________________
(4)此实验所得漂白粉的有效成分偏低。该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应
①温度较高时氯气与消石灰反应生成Ca(ClO 3 ) 2 ,为避免此副反应的发生,可采取的措施是
____________________________
②试判断另一个副反应(用化学方程式表示)____________________________为避免此副反应的发生,可将装置作何改进____________________________ lawmanhu1年前1
lawmanhu1年前1 -
 江湖一担挑 共回答了16个问题
江湖一担挑 共回答了16个问题 |采纳率81.3%1年前查看全部
- 下列反应中既属于氧化还原反应又属于放热反应的是( )。 A.氢氧化钾与硫酸的反应 B.锌与盐酸反应放出氢气 C.镁条在
下列反应中既属于氧化还原反应又属于放热反应的是( )。
A.氢氧化钾与硫酸的反应 B.锌与盐酸反应放出氢气 C.镁条在空气中燃烧 D.Ba(OH) 2 ·8H 2 O与NH 4 Cl反应  lunhui1年前1
lunhui1年前1 -
 dengfuyun 共回答了22个问题
dengfuyun 共回答了22个问题 |采纳率90.9%BC
A是放热反应但不是氧化还原反应;B、C既属于氧化还原反应又属于放热反应;D属于吸热反应但不属于氧化还原反应。1年前查看全部
- 下列说法不正确的( )A.物质燃烧总是放热的B.大多数化合反应都是放热的,大多数分解反应都是吸热的C.有些放热反应在引
下列说法不正确的( )
A.物质燃烧总是放热的
B.大多数化合反应都是放热的,大多数分解反应都是吸热的
C.有些放热反应在引发反应时必须加热
D.放热反应在反应发生时都不需要加热 狮子对我说1年前1
狮子对我说1年前1 -
 liliantsr 共回答了12个问题
liliantsr 共回答了12个问题 |采纳率83.3%A、所有的燃烧反应都是放热反应,故A正确;
B、大多数化合反应都是放热反应,大多数分解反应都是吸热反应,故B正确;
C、铝热反应是放热反应,但必须加热才能发生,故C正确;
D、铝热反应是放热反应,但必须加热才能发生,故D错误;
故选D.1年前查看全部
- 吸放热反应的计算C、CO、CH4、C2H5OH是常用燃料,它们每1mol分别完全燃烧生成CO2(g)和H2O(l)时,放
吸放热反应的计算
C、CO、CH4、C2H5OH是常用燃料,它们每1mol分别完全燃烧生成CO2(g)和H2O(l)时,放出的热量依次为393.5kJ,283.0kJ,890.3kJ,1366.8kJ.相同质量的这四种燃料,完全燃烧时放出热量最多的是
A.C B.CO C.CH4 D.C2H5OH 第一次的MJ1年前2
第一次的MJ1年前2 -
 77bb 共回答了17个问题
77bb 共回答了17个问题 |采纳率88.2%C 把这个热值除上它所对应物的相对分子质量 比较大小即可1年前查看全部
- 化学常见吸热反应和放热反应?
 bbbvfgh1年前1
bbbvfgh1年前1 -
 黄军山山贼 共回答了20个问题
黄军山山贼 共回答了20个问题 |采纳率100%( 一般需要加热的化学反应是吸热反应 ,无需加热自发进行的反应是放热反应.) 常见吸热: 大多数的分解反应 氯化钙固体与氢氧化钡晶体的反应 金属氧化物与CO,C,H2的还原反应 C+CO2===2CO H2+I2===HI 还有些不是化学反应的过程,如弱电解质的电离,铵盐溶于水,熔化、气化、升华,断裂化学键. 常见放热: 大部分化合反应 强酸或强碱对应的氧化物的水合反应 铝热反应 中和反应 金属与酸或水的反应 还有些不是化学反应的过程,如强酸或强碱溶于水,凝固、液化、凝华,形成化学键.1年前查看全部
- 下列各反应均为放热反应,同温同压下下列各热化学方程式中△H最小的是( )
下列各反应均为放热反应,同温同压下下列各热化学方程式中△H最小的是( )
A.2A(l)+B (l)═2C(g)△H1
B.2A(g)+B (g)═2C(g)△H2
C.2A(g)+B ( g )═2C(l)△H3
D.2A(l)+B (l)═2C(l)△H4 航灯1年前1
航灯1年前1 -
 帘外春风 共回答了24个问题
帘外春风 共回答了24个问题 |采纳率87.5%解题思路:反应物的总能量高于生成物的总能量,为放热反应,反应热符号为“-”,反应物的总能量越高,生成物的总能量越低,反应放出的热量越多,反应热越小,结合物质的状态进行判断,同一物质的能量g>l>s.各反应中对应物质的物质的量相同,同一物质的能量g>l>s,所以反应物的总能量为:B=C>A=D,生成物的能量为:A=B>C=D,反应为放热反应,反应物的总能量越高,生成物的总能量越低,反应放出的热量越多,故C放出的热量最多,反应热符号为“-”,反应放出的热量越多,反应热越小,故C的反应热最小,
故选C.点评:
本题考点: 热化学方程式.
考点点评: 本题考查物质能量、物质状态与反应热的关系,难度不大,注意根据能量守恒理解物质能量与反应热关系,注意反应热比较包含符号进行比较.1年前查看全部
- 化学如何辨别吸热与放热反应课本上说,旧化学键断裂吸收能量,即反应物吸收能量,生成物即新的化学键释放能量,E表示总能量,但
化学如何辨别吸热与放热反应
课本上说,旧化学键断裂吸收能量,即反应物吸收能量,生成物即新的化学键释放能量,E表示总能量,但E反>E生,则吸收能量,为吸热反应,E反<E生,则放出能量即放热反应,我就是不太明白,这和前面所说的生成物放出能量,反应物吸收能量怎么理解的,怎么我觉得有点矛盾,不太理解,哪位化学爱好者帮我解下疑惑, 一片两片三四片—1年前4
一片两片三四片—1年前4 -
 sgsoldog 共回答了17个问题
sgsoldog 共回答了17个问题 |采纳率94.1%历程:反应物→旧化学键断裂(吸热E1)→形成新化学键(放热E2)→生成物
1.若E1>E2,则说明旧键断裂吸收的能量比新键形成放出的能量多,故吸热居于主导,表现吸热.另外,这同时也说明反应物的能量比生成物低,即E反1年前查看全部
- 如何从宏观角度判断一个反应是吸热反应还是放热反应
 水央央1年前2
水央央1年前2 -
 世上最丑 共回答了15个问题
世上最丑 共回答了15个问题 |采纳率86.7%1 从常识判断反应后温度是否变高,变高则为放热;
2 一般的,如果生产物多于反应物的,那么为放热;
3 如果反应中发光或发出声响,则为放热.1年前查看全部
- 关于怎么判断方程式为吸热还是放热反应?
关于怎么判断方程式为吸热还是放热反应?
1.NH4H+H20=H2气体+NH3H20 为什么是放热反应?
2.怎么判断方程式为吸热还是放热反应?(说的简练一些,不要太多理论) 铜铁豌豆1年前5
铜铁豌豆1年前5 -
 不知道不要说 共回答了20个问题
不知道不要说 共回答了20个问题 |采纳率95%⒈常见吸热反应:
①盐类的水解
②弱电解质的电离
③大多数分解反应
④三个特殊的化合反应
H2+I2=△=2HI N2+O2=放电=2NO CO2+C=高温=2CO
⑤两个特殊的置换反应
C(s)+H2O(g)=高温=CO(g)+H2(g) CuO(s)+H2(g)=高温=Cu(s)+H2O(g)
⑥Ba(OH)2•8H2O晶体与NH4Cl晶体的反应
⑦硝酸铵的溶解(物理变化)
⒉常见放热反应
①燃烧 (燃烧是指任何发光发热的剧烈的化学反应,并不一定需要氧气的参与)
②中和反应
③金属与酸的反应
④一般的化合反应(除上述三个特例)
重点讨论的三个平衡:N2、H2合成NH3、SO2催化氧化生成SO3、NO2二聚为N2O4均为放热反应
⑤一般的置换反应(除上述两个特例)
⑥碱性氧化物(如Na2O、K2O)、强碱溶于水
⑦浓硫酸的稀释1年前查看全部
- 化学反应工程原理可逆放热反应如何选择操作温度
 laiyabing1年前2
laiyabing1年前2 -
 suntime2003 共回答了15个问题
suntime2003 共回答了15个问题 |采纳率73.3%水浴加热1年前查看全部
- 已知反应C+O 2 ═CO 2 为放热反应,对该反应的下列说法正确的是( ) A.C的能量一定高于CO 2 B.O 2
已知反应C+O 2 ═CO 2 为放热反应,对该反应的下列说法正确的是( ) A.C的能量一定高于CO 2 B.O 2 的能量一定高于CO 2 C.C和O 2 的能量一定高于CO 2 的能量 D.C和O 2 的能量一定低于CO 2 的能量  水悠悠u1年前1
水悠悠u1年前1 -
 风一样逝去 共回答了17个问题
风一样逝去 共回答了17个问题 |采纳率88.2%因反应C+O 2 ═CO 2 为放热反应,所以C和O 2 的能量和一定高于CO 2 的能量,但不能用某一个反应物和某一个生成物能量进行对比,故C选项正确.1年前查看全部
- 为什么该反应是放热反应?为什么X是氯化铵?Na2O2的作用是与HCl反应生成O2,为什么要生成O2?HCl哪来的?
为什么该反应是放热反应?为什么X是氯化铵?Na2O2的作用是与HCl反应生成O2,为什么要生成O2?HCl哪来的?
某兴趣小组用题27图装置探究氨的催化氧化.
(1)氨催化氧化的化学方程式为___________________.
(2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是_________反应(填“吸热”或“放热”).
(3)为保证在装置4中观察到红棕色气体,装置3应装入_________;若取消3,在4中仅观察到大量白烟,原因是___________________.
(4)为实现氨催化氧化,也可用装置5替换装置_________(填装置代号);化合物X为_________(只写一种),Na2O2的作用是___________________.
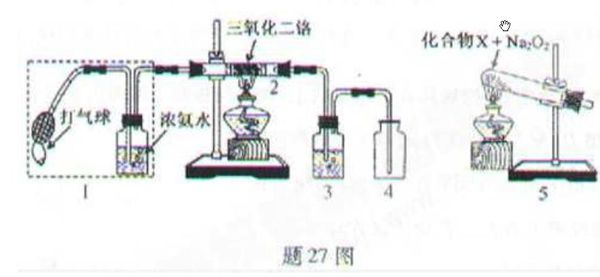
 jichoo1年前1
jichoo1年前1 -
 __hahahnje__ 共回答了18个问题
__hahahnje__ 共回答了18个问题 |采纳率94.4%1.4NH3+5O2=4NO+6H2O(俗称4546反应)
2.保持红热说明是放热反应.
3.保证在装置4中观察到红棕色气体,装置3应装入 (浓硫酸) ;若取消3,在4中仅观察到大量白烟,原因是 (反应生成的水、一氧化氮、氧气反应生成硝酸酸雾和未反应完全的氨气发生反应)
4.实现氨催化氧化,也可用装置5替换装置 (1) (填装置代号);化合物X为 (NH4Cl)(只写一种),Na2O2的作用是 (氧气发生并且在氨气反应中充当碱).
根据反应(1)看到生成一氧化氮反应一定要有氧气,HCl就是通过氯化铵分解得到的,1年前查看全部
- 理论上可用于设计成原电池的化学反应都是放热反应,下列可设计成原电池的是 [
理论上可用于设计成原电池的化学反应都是放热反应,下列可设计成原电池的是 [ ]A.NaOH+HCl=NaCl+H 2 O
B.Ba(OH) 2 ·8H 2 O+2NH 4 Cl=BaCl 2 +2NH 3 ↑+10H 2 O
C.CaO+H 2 O=Ca(OH) 2
D.CH 4 +2O 2 =CO 2 +2H 2 O 乐悠鱼1年前1
乐悠鱼1年前1 -
 wei1006wei 共回答了15个问题
wei1006wei 共回答了15个问题 |采纳率100%D1年前查看全部
- 如图是关于反应A2(g)+3B2(g)⇌2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( )
 如图是关于反应A2(g)+3B2(g)⇌2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( )
如图是关于反应A2(g)+3B2(g)⇌2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( )
A.升高温度
B.增大压强
C.增大反应物浓度
D.使用催化剂 rain46461年前1
rain46461年前1 -
 niannian321 共回答了13个问题
niannian321 共回答了13个问题 |采纳率84.6%解题思路:由图象可知,t时正反应速率和逆反应速率都增大,且正反应速率大于逆反应速率,平衡向正反应方向移动,以此解答该题.A.升高温度,平衡向逆反应方向移动,逆反应速率大于正反应速率,故A错误;
B.反应物气体的体积大于生成物气体的体积,增大压强,正逆反应速率都增大,正反应速率大于逆反应速率,故B正确;
C.增大反应物浓度,逆反应速率在原来的基础上逐渐增大,与图象不符,故C错误;
D.使用催化剂,平衡不移动,正逆反应速率相等,故D错误.
故选B.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查化学平衡的影响因素,难度不大,为高频考点和常见题型,注意把握反应的特征,学习中注意相关基础知识的积累.1年前查看全部
- 下列说法正确的是( )A.在常温下,放热反应一般能自发进行,吸热反应都不能自发进行B.NH4HCO3(s)═NH3(g
下列说法正确的是( )
A.在常温下,放热反应一般能自发进行,吸热反应都不能自发进行
B.NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 流金岁月1101年前1
流金岁月1101年前1 -
 都叫我花花 共回答了24个问题
都叫我花花 共回答了24个问题 |采纳率87.5%解题思路:A、某些吸热反应也可以自发进行,依据△H-T△S<0分析判断;
B、反应焓变大于0,熵变大于0,反应向熵变增大的方向进行;
C、依据反应自发进行的判断依据△H-T△S<0分析;
D、催化剂改变反应速率不改变化学平衡;A、某些吸热反应也可以自发进行,依据△H-T△S<0分析,△H>0,△S>0,常温下可以△H-T△S<0,如氢氧化钡晶体和氯化铵反应,是吸热反应,常温下可以蒸发进行,故A错误;
B、反应焓变大于0,熵变大于0,反应向熵变增大的方向进行,NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ/mol,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向,故B正确;
C、依据反应自发进行的判断依据△H-T△S<0分析,反应自发进行需要焓变、熵变和温度共同决定,故C错误;
D、催化剂改变反应速率不改变化学平衡,使用催化剂不可以改变化学反应进行的方向,故D错误;
故选B.点评:
本题考点: 焓变和熵变.
考点点评: 本题考查了反应自发进行的分析判断,注意反应特征和焓变、熵变的分析判断,掌握基础是关键,题目较简单.1年前查看全部
- 下列说法正确的是( )A. 需要加热的化学反应都是吸热反应B. 中和反应都是放热反应C. 原电池是将电能转化为化学能的
下列说法正确的是( )
A. 需要加热的化学反应都是吸热反应
B. 中和反应都是放热反应
C. 原电池是将电能转化为化学能的一种装置
D. 水力发电是将化学能转化为电能的过程 巨风大侠1年前1
巨风大侠1年前1 -
 sy1681 共回答了17个问题
sy1681 共回答了17个问题 |采纳率100%解题思路:A.吸热反应实质是反应物所具有的总能量低于生成物所具有的总能量;
B.中和反应都是放热反应;
C.原电池是将化学能转化为电能的一种装置;
D.水力发电是将重力势能转化为电能的过程.A.放热反应有的需加热,有的不需加热.如木炭的燃烧是一个放热反应,但需要点燃,点燃的目的是使其达到着火点.再如铝热反应也是,故A错误;
B.所有的中和反应都是放热反应,故B正确;
C.原电池是将化学能转化为电能的装置,故C错误;
D.水力发电是将重力势能转化为电能的过程,故D错误.
故选B.点评:
本题考点: 吸热反应和放热反应;常见的能量转化形式.
考点点评: 该题考查了吸热反应与放热反应,能量变化的原因.需正确理解放热吸热的本质,是解题的关键.1年前查看全部
- 升高温度,化学平衡会向着吸热反应的方向移动,此时放热反应的反应速率会减小吗?
 小香1591年前2
小香1591年前2 -
 欧阳淼 共回答了23个问题
欧阳淼 共回答了23个问题 |采纳率95.7%温度升到,化学反应速率增加 因此放热反应的反应速率也是增加的1年前查看全部
- 盐类的水解反应有放热的吗老师讲的是大多数的盐类的水解反应是吸热反应,那么谁知道有哪些盐类的水解反应是放热反应.我们有一道
盐类的水解反应有放热的吗
老师讲的是大多数的盐类的水解反应是吸热反应,那么谁知道有哪些盐类的水解反应是放热反应.我们有一道判断题说“中和反应都是放热反应,盐类的水解反应都是吸热反应”老师说这个是错的,谁知道错在哪里了?
 边城白云1年前1
边城白云1年前1 -
 daniel_liu911 共回答了24个问题
daniel_liu911 共回答了24个问题 |采纳率83.3%你的老师说错了.
中和反应一定包含H+ OH-=H2O的过程,该反应放热,即使是弱酸或者弱碱电离需要吸收能量,也不会有H+和OH-结合时放出的能量多.
盐的水解是中和反应的逆反应,中和反应放热,水解反应一定吸热.1年前查看全部
- 已知1摩尔氢气和1摩尔碘气可逆生成2摩尔碘化氢气体正反应为放热反应,有相同容积的的定容密闭容器甲和乙,
已知1摩尔氢气和1摩尔碘气可逆生成2摩尔碘化氢气体正反应为放热反应,有相同容积的的定容密闭容器甲和乙,
甲中加入氢气和碘气各0.1摩尔,乙中加入碘化氢0.2摩尔,相同温度下分别达到平衡.欲使用甲中碘化氢的浓度大于乙中碘化氢的平衡浓度,应采取的措施是
A:甲、乙提高相同的温度
B:甲中加入0.1摩尔氦,乙不变
C:甲降低温度,乙不变
D:甲增加0.1摩尔氢气,以增加0.1摩尔碘气 ede00801年前2
ede00801年前2 -
 伊典儿 共回答了16个问题
伊典儿 共回答了16个问题 |采纳率93.8%这两个容器内的反应是等效的 写写方程式就知道了
C 正反应吸热 升温向正反应方向移动 HI变多 C对
这样A就错了
B 加压对反应没影响
D 加了之后对平衡的影响是一样的 所以还是等效的 加H2和加I2是一样的1年前查看全部
- 对于反应2CO(g)+O2(g)⇌2CO2(g)(正反应为放热反应),在一定条件下建立化学平衡后,下列各条件变化时,能使
对于反应2CO(g)+O2(g)⇌2CO2(g)(正反应为放热反应),在一定条件下建立化学平衡后,下列各条件变化时,能使平衡正向移动的是( )
A.恒温恒容通入He
B.再通入少量CO2
C.温度升高
D.加压 降落凡间1年前1
降落凡间1年前1 -
 dayubird 共回答了24个问题
dayubird 共回答了24个问题 |采纳率95.8%解题思路:对于反应2CO(g)+O2(g)⇌2CO2(g)(正反应为放热反应),该反应中,气体的化学计量数减少,反应放热,改变下列条件,可以使平衡向着正反应方向移动的因素是降温,增大反应物浓度、加压等.A、恒温恒容通入He,总压增大,分压不变,平衡不动,故A错误;
B、再通入少量CO2 ,增大生成物浓度,平衡逆向进行,故B错误;
C、反应是放热反应,温度升高,平衡逆向进行,故C错误;
D、反应前后气体体积减小,加压平衡向气体体积减小的方向进行,平衡正向进行,故D正确;
故选D.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查化学平衡的影响因素,题目难度不大,解答时首先分析化学方程式的特征,特别是反应前后气体的化学计量数关系以及反应的吸、放热问题.1年前查看全部
- 在a、b两个相同的容器中,分别加入相同量的A和B,发生可逆反应:A(g)+3B(g)⇌2C(g)(正反应为放热反应),两
在a、b两个相同的容器中,分别加入相同量的A和B,发生可逆反应:A(g)+3B(g)⇌2C(g)(正反应为放热反应),两容器中C的体积分数与时间的关系如图所示,则a、b两线不同的可能原因是( ) A.a的温度高于b B.a使用了催化剂,而b未用 C.a的压强大于b D.a的温度低于b 
 小赖菜1年前1
小赖菜1年前1 -
 望穿秋水123 共回答了17个问题
望穿秋水123 共回答了17个问题 |采纳率76.5%A、反应是放热反应,温度改变平衡移动发生移动,平衡混合物中的物质体积分数改变,故A不符合;
B、使用催化剂只改变反应速率,不改变化学平衡,能缩短达到平衡的时间,故B符合;
C、反应是气体体积变化的反应,压强改变平衡移动,平衡混合物中的物质体积分数改变,故C不符合;
D、反应是放热反应,温度改变平衡移动发生移动,平衡混合物中的物质体积分数改变,故D不符合;
故选B.1年前查看全部
- 下列说法或表示方法不正确的是( ) A.燃料的燃烧反应都是放热反应 B.绿色植物进行光合作用时,能把光能转化为化学能
下列说法或表示方法不正确的是( ) A.燃料的燃烧反应都是放热反应 B.绿色植物进行光合作用时,能把光能转化为化学能 C.分子的热稳定性主要取决于分子内化学键的键能大小,与分子间作用力无关 D.已知:N 2 (g)+3H 2 (g)⇌2NH 3 (g)△H=-92.4kJ•mol -1 ,则说明相同条件下,在密闭容器中,1molN 2 和3molH 2 混合充分反应后放热92.4kJ  andyjane1年前1
andyjane1年前1 -
 Glass_guo 共回答了18个问题
Glass_guo 共回答了18个问题 |采纳率88.9%A.燃料的燃烧反应都是放热反应,故A正确;
B.绿色植物进行光合作用时,能把光能转化为化学能,故B正确;
C.分子的热稳定性主要取决于分子内化学键的键能大小,与分子间作用力无关,故C正确;
D.N 2 (g)+3H 2 (g)⇌2NH 3 (g)△H=-92.4kJ•mol -1 ,则说明相同条件下,在密闭容器中,1molN 2 和3molH 2 混合充分反应后放热小于92.4kJ,故D错误;
故选:D;1年前查看全部
- 某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应)。
某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应)。

据此回答下列问题:
(1) 在A装置中用固体二氧化锰与浓盐酸在加热条件下制取氯气,若在标准状态下收集到33.6L的氯气,则被氧化的HCl的物质的量是 。
(2) 漂白粉将在U形管中产生,其化学方程式是 。
(3) C装置的作用是 。
(4) 此实验所得漂白粉的有效成分偏低。该学生经分析并查阅资料发现,主要原因是在U
形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO 3 ) 2 ,为避免此副反应的发生,可采取的措
施是 。
② 试判断另一个副反应为(用化学方程式表示) 。
为避免此副反应的发生,可将装置作何改进 。
(5) 家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是( )A.食盐 B.食醋 C.烧碱 D.纯碱  Edsin1年前1
Edsin1年前1 -
 zhkczzk 共回答了12个问题
zhkczzk 共回答了12个问题 |采纳率91.7%(14分)(每空各2分)
(1) 3mol
(2) 2Cl 2 +2Ca(OH) 2 ="=" CaCl 2 +Ca(ClO) 2 +2H 2 O
(3) 吸收未反应完的氯气,防止污染空气
(4) ①将U形管置于冷水浴中(或冷却B装置)
②Ca(OH) 2 +2HCl ="=" CaCl 2 +2H 2 O
在A和B之间连接一个装有饱和食盐水的洗气瓶
(5) B
1年前查看全部
- 下列说法正确的是( )A.需要加热才能发生的反应一定是吸热反应B.任何放热反应在常温条件下一定能发生反应C.反应物和生
下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物具有的总能量的相对大小决定了反应是放热还是吸热
D.吸热反应一定要加热才能发生 WANGNEI1年前1
WANGNEI1年前1 -
 zhang0312 共回答了14个问题
zhang0312 共回答了14个问题 |采纳率100%解题思路:A.吸热反应实质是反应物所具有的总能量低于生成物所具有的总能量;
B.一个化学反应发生的条件与反应的热效应无关;
C.化学反应中生成物总能量不等于反应物的总能量,反应前后的能量差值为化学反应中的能量变化;
D.吸热反应在不加热的条件下也能发生.A.需要加热才能发生的反应不一定是吸热反应,如木炭的燃烧是一个放热反应,但需要点燃,点燃的目的是使其达到着火点,故A错误;
B.放热的反应在常温下不一定很容易发生.如:铝热反应2 Al+Fe2O3
高温
.
Al2O3+2Fe是放热反应,但需在高热条件下以保证足够的热量引发氧化铁和铝粉反应,故B错误;
C.放热反应是指:反应物所具有的总能量高于生成的总能量,在反应中会有一部分能量转变为热能的形式释放,反之,就是吸热反应,故C正确;
D.吸热反应在不加热的条件下也能发生,如Ba(OH)2•8H2O与NH4Cl反应常温下就能发生,故D错误.
故选C.点评:
本题考点: 吸热反应和放热反应.
考点点评: 本题考查化学反应的条件与化学反应的热效应间的关系,难度不大,需正确理解放热吸热的本质是解题的关键.1年前查看全部
- 2CO+O2=2CO2反应是放热反应,反应是等压过程,要提高CO2的产率,采取的措施.A加催化剂B加热C加
2CO+O2=2CO2反应是放热反应,反应是等压过程,要提高CO2的产率,采取的措施.A加催化剂B加热C加
C加二氧化碳D加氮气 狄琅1年前3
狄琅1年前3 -
 大硕0525 共回答了19个问题
大硕0525 共回答了19个问题 |采纳率73.7%选D.
A 加催化剂只能改变反应速率,不会改变反应平衡.
B 加热 该反应为放热反应,加热会使平衡逆向进行,CO2的产率变低.所以错
C 加CO2 导致平衡逆向进行,CO2的产率变低.错
D 加氮气 反应等压,加氮气会使反应体积增大,所以会是反应的正反应增大,即能提高CO2的产率.对1年前查看全部
- 非燃烧的发光放热反应请问,有没有什么 除了燃烧之外 的 是 发光并且放热的 只要举出一例即可,
 小丑鱼丢丢1年前1
小丑鱼丢丢1年前1 -
 琳琊锶 共回答了20个问题
琳琊锶 共回答了20个问题 |采纳率95%硫磺和钠或者和铁的反应很剧烈,有光和热发生,但一般不叫燃烧1年前查看全部
- 对于一个可逆反应,正反应为放热反应.且反应物化学计量数大于生成物计量数.若增大压强,反应会向哪边进行
 lengbinger121年前1
lengbinger121年前1 -
 我爱西芹 共回答了21个问题
我爱西芹 共回答了21个问题 |采纳率85.7%这个还要看反应物生成物的状态
如果都是气态 那么增大压强 反应物增加的速率>生成物
则反应向正反映方向进行1年前查看全部
- 在可逆N2+3H=2NH3(正反应为放热反应)的平衡体系中,当分离出氨,下列说法正确的
在可逆N2+3H=2NH3(正反应为放热反应)的平衡体系中,当分离出氨,下列说法正确的
A.平衡向逆反应方向移动 B.平衡不移动
C.正反应速率先变大后变小 D.逆反应速率先变小后逐渐变大
A是不对的,希望有分析的过程 小七19771年前1
小七19771年前1 -
 醉魂 共回答了19个问题
醉魂 共回答了19个问题 |采纳率100%我先看错题目了.
应该选D
因为分离NH3后,逆反应速度会变小(这个不要解释吧?)
正反应速率不变,所以反应右移,NH3的浓度变高,所以逆反应速率又会变大.1年前查看全部
大家在问
- 1谁能告诉我:乙酸制备乙二醇的化学方程式
- 2____ seems to be a possibility that we shall be able to affo
- 3正在被欺负的那个男孩 the boy being bullied the boy who is being bullie
- 4八只绵羊用英文表达?我指“eight()of sheep”!
- 5解决生活中的数学问题(1)某粮店上周共卖出面粉18吨,卖出的大米的吨数比面粉多 [1/6],粮店上周卖出大米多少千克?(
- 6英语,如果你保证不再烦我,我就让你走,怎么说.
- 7芒果街上的小屋作者桑德拉·希斯内罗丝Cisneros这个人名 英文怎么读啊 华兹华斯 济慈 泰戈尔 这三个人名的
- 8最难忘的事是你帮助我学习英语,并且带我参观了许多有趣的地方,用英语怎么说
- 9给我3段不少于80字的描写夏天景物的段落,要有出处,荷花就不要了
- 10加入铁屑生成氢气的共存离子组是?
- 11爱我中华用英语怎么说?
- 12《学会生存》习作,不少于500字
- 13若函数y=x^2-6x+4在区间[0,m]上是减函数,则m的取值范围是
- 14让梦想与青春起飞 作文
- 15一个圆的半径是2.5厘米,它的直径是多少厘米.某班有学生50人,期中考试有6人不及格,及格率是多少.



