金属晶体的配位数是怎么一回事呢?
 我就壹kk2022-10-04 11:39:541条回答
我就壹kk2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 乡里乡亲啊 共回答了25个问题
乡里乡亲啊 共回答了25个问题 |采纳率92%- 金属的配位数就是和金属阳离子最近的金属阳离子的个数或者紧靠他的个数!
高中只要会算个数就行! - 1年前
相关推荐
- 下列叙述正确的是 A.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物 B.原子晶体、离子晶体、金属晶体、分子晶体
下列叙述正确的是
A.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物 B.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键 C.强电解质一定为离子化合物,共价化合物一定为弱电解质 D.通常状态下,若测得纯水的PH小于7,其测定温度一定高于25℃  smothty1年前1
smothty1年前1 -
 xianzichen 共回答了17个问题
xianzichen 共回答了17个问题 |采纳率88.2%D
A 错误,二氧化氮和四氧化二氮中氮的化合价相同,氮对应着两种氧化物
B 错误,分子晶体中的稀有气体,不存在化学键
C 错误,硫酸是共价化合物,但是强酸,是强电解质
D 正确,纯水的PH小于7,水的电离程度增大,水的电离平衡右移,升温平衡右移,所以温度高于25℃1年前查看全部
- 如何判别一个东西是原子晶体,离子晶体,金属晶体还是分子晶体?
 leudy1年前1
leudy1年前1 -
 ygyj 共回答了21个问题
ygyj 共回答了21个问题 |采纳率81%首先,定义只能在做题的时候判断用,而不容易用它判断晶型.
原子晶体多由B、C 、Si构成,高中,一直到高考,只有这几个要记:金刚石、SiC、Si、SiO2、BF3(注意,考试可能会考到超纲的,但是题目会很明白地告诉你无知的组成和熔沸点,比较好判断)
离子晶体多由活泼金属和活泼非金属构成(但氯化铝AlCl3除外),离子晶体一般熔沸点较高离子晶体熔融能导电,高中主要是碱土金属(第一、二主族)和第六七主族元素的化合物,比较特殊的就是钾和钠,记住它们和氮的化合物也是离子晶体;
金属晶体:常温下所有金属都为金属晶体(除Hg汞外),金属晶体熔沸点有高(钨)有低(汞),金属晶体固体熔融都能导电
分子晶体:其余的全部都是分子晶体.分子晶体熔沸点低,硬度小,如:干冰、SO2等等1年前查看全部
- 熔沸点比较规律:原子晶体>离子晶体>分子晶体,金属晶体不一定 这句话我不太理解
 两处闲愁哦1年前2
两处闲愁哦1年前2 -
 bwbwhh 共回答了17个问题
bwbwhh 共回答了17个问题 |采纳率82.4%晶体不同,微粒间的作用力不同,所以熔化沸腾需要的能量就不同.
原子晶体,共价键,属于化学键,作用很强,熔沸点一般很高.
离子晶体,离子键,属于化学键,作用也较强,熔沸点较高.
分子晶体,分子间作用力,不是化学键,作用力较弱,熔沸点较低.
金属晶体,金属键,也属于化学键,但是不同金属之间的差异很大,所以金属的熔沸点,有特别高的,如钨、铬,也有特别低的,如汞,就没法判断了,就是不一定.
但是上面的规律,只是大致的比较,实际上同种晶体中还存在差异的,如,离子晶体中也有特别高的,甚至超过了某些原子晶体的,特例就是Al2O3.
所以,实际比较时,还要注意你对这个物质的状态的了解.1年前查看全部
- 大多数金属晶体中原子配位数大,空间利用率高,下列描述不正确是( )
大多数金属晶体中原子配位数大,空间利用率高,下列描述不正确是( )
A.Po为简单立方堆积
B.金属键没有饱和性和方向性
C.金属键不属于化学键
D.金属晶体中原子的最大配位数为12 jianzhenta1年前1
jianzhenta1年前1 -
 jh2mydr 共回答了12个问题
jh2mydr 共回答了12个问题 |采纳率100%解题思路:A.简单立方堆积(Po型)空间利用率为52%;
B.金属键没有饱和性和方向性;
C.金属键是金属阳离子和自由电子间的相互作用;
D.金属为面心立方最密堆积时,配位数最大.A.Po为简单立方堆积,故A正确;
B.金属键没有饱和性和方向性,故B正确;
C.金属键是金属阳离子和自由电子间的相互作用,属于化学键,故C错误;
D.金属为面心立方最密堆积时,配位数最大,配位数为12,故D正确;
故选:C.点评:
本题考点: 金属晶体.
考点点评: 本题主要考查了金属键的概念,金属的堆积方式,注意典型晶体晶胞结构,为学习难点.1年前查看全部
- 为什么金属晶体组成的微粒是采用密堆积方式形成晶体
为什么金属晶体组成的微粒是采用密堆积方式形成晶体
是因为这样会使晶体更稳定吗? 谁偷了我的用户名1年前1
谁偷了我的用户名1年前1 -
 Kenswind 共回答了20个问题
Kenswind 共回答了20个问题 |采纳率100%因为金属键没有饱和性和方向性,所以金属晶格的结构要求金属原子或金属正离子的紧密堆积,最紧密的堆积是最稳定的结构1年前查看全部
- 离子晶体,原子晶体,分子晶体,金属晶体的硬度导电性传热性延展性的大小
 niuwei5181年前1
niuwei5181年前1 -
 gngmng 共回答了21个问题
gngmng 共回答了21个问题 |采纳率85.7%导电导热延展性:金属晶体最好;
硬度:原子晶体最佳(部分金属晶体也不错)1年前查看全部
- 金属元素的单质在常温下均为金属晶体吗?
金属元素的单质在常温下均为金属晶体吗?
如题 shijie1481年前3
shijie1481年前3 -
 我心若玫 共回答了13个问题
我心若玫 共回答了13个问题 |采纳率92.3%不是,金属汞是液态的,不是晶体.1年前查看全部
- 关于金属物理性质原因的描述不正确的是 A.金属具有良好的导电性,是因为金属晶体中的“电子气”在电场作用下作定向移动 B.
关于金属物理性质原因的描述不正确的是
A.金属具有良好的导电性,是因为金属晶体中的“电子气”在电场作用下作定向移动 B.金属具有良好的导热性能,是因为自由电子受热后运动速率增大,与金属离子碰撞频率增大,传递了能量 C.金属晶体具有良好的延展性,是因为金属晶体中的原子层在滑动过程中金属键未破坏 D.金属一般具有银白色光泽,是物理性质,与金属键没有关系  猫咪糖豆豆1年前1
猫咪糖豆豆1年前1 -
 culturetech 共回答了17个问题
culturetech 共回答了17个问题 |采纳率94.1%D
1年前查看全部
- 下列说法中错误的是( )A.金属晶体的四种堆积模型中,六方最密堆积和面心立方最密堆积的空间利用率最高B.通过手性合成的
下列说法中错误的是( )
A.金属晶体的四种堆积模型中,六方最密堆积和面心立方最密堆积的空间利用率最高
B.通过手性合成的方法,可以只得到一种或者主要只得到一种手性分子
C.金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子
D.分子形成氢键一定使物质的熔沸点升高 盐在水中变淡了1年前1
盐在水中变淡了1年前1 -
 哼哼唧唧虫 共回答了20个问题
哼哼唧唧虫 共回答了20个问题 |采纳率100%解题思路:A、六方最密堆积和面心立方最密堆积空间利用率均为74%,空间利用率最高;
B、手性催化剂只催化或者主要催化一种手性分子的合成;
C、金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子;
D、如果形成的氢键是分子内氢键,会使物质的熔沸点降低.A、六方最密堆积和面心立方最密堆积是空间利用率最高的结构,空间利用率均为74%,故A正确;
B、手性催化剂只催化或者主要催化一种手性分子的合成,可以只得到一种或者主要只得到一种手性分子,故B正确;
C、金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子,故C正确;
D、分子间氢键使物质的熔沸点升高,分子内氢键会降低物质的熔沸点,故D错误.
故选:D.点评:
本题考点: 不同晶体的结构微粒及微粒间作用力的区别;含有氢键的物质.
考点点评: 本题考查了不同晶体结构及微粒间作用力的区别以及氢键等知识,注意分子内氢键和分子间氢键的区别,本题D选项易出错.1年前查看全部
- 金属晶体采取紧密堆积的方式,为什么啊
金属晶体采取紧密堆积的方式,为什么啊
是不是和金属键无方向性和饱和性有关? rodliu1年前2
rodliu1年前2 -
 短斤缺两 共回答了16个问题
短斤缺两 共回答了16个问题 |采纳率81.3%金属晶体中原子的半径都相等,所以金属晶体采取紧密堆积的方式
当然 和金属键无方向性和饱和性有关.一个原子尽可能多的吸引周围原子1年前查看全部
- 下列叙述中正确的是( )A.主族元素的原子核外电子最后填入的能级是d能级或f能级B.镁型和铜型金属晶体的配位数均为12
下列叙述中正确的是( )
A.主族元素的原子核外电子最后填入的能级是d能级或f能级
B.镁型和铜型金属晶体的配位数均为12
C.中心原子上的孤电子对不参与决定分子的空间结构
D.分子中键角越大,价电子对相互排斥力越大,分子越稳定 幸福有点累1年前1
幸福有点累1年前1 -
 skyfree7210 共回答了18个问题
skyfree7210 共回答了18个问题 |采纳率94.4%解题思路:A.主族元素的原子核外电子最后填入的能级为s或p;
B.均为面心立方最密堆积;
C.中心原子上的孤电子对与成键数决定分子结构;
D.键角越大,价电子对相互排斥力越小.A.主族元素在s区和p区,其原子核外电子最后填入的能级为s或p,故A错误;B.金属为面心立方最密堆积时,配位数最大,则镁型和铜型金属晶体的配位数均为12,故B正确;C.中心原子上的孤电子对与成键数决定分子结构,...
点评:
本题考点: 元素周期表的结构及其应用;不同晶体的结构微粒及微粒间作用力的区别.
考点点评: 本题考查较综合,涉及原子结构、元素周期表的结构及应用、晶体类型、杂化及分子结构、分子稳定性等,为高频考点,侧重物质结构与性质的考查,题目难度较大.1年前查看全部
- 钨的熔点为什么那么高?金属晶体的熔点差异大的根本原因是什么?高熔点金属和低熔点金属的结构有什么差异吗?
 蓝心无语1年前3
蓝心无语1年前3 -
 vivi0802 共回答了20个问题
vivi0802 共回答了20个问题 |采纳率100%不知道你学过原子结构没,熔点差异根本是他的结构.
高熔点金属 的金属阳离子与自由电子的作用力大,反之低熔点的作用力小. 作用力大小 的影响因数有很多,其中有离子大小 ,最外层电子数1年前查看全部
- 金属晶体具有光泽性的原因
 百幽灵1年前3
百幽灵1年前3 -
 healme 共回答了19个问题
healme 共回答了19个问题 |采纳率94.7%金属晶体的金属光泽是由于自由电子对光的反射形成的,不同的金属吸收一定波长的光,其余的光就反射出来,看到了金属光泽.1年前查看全部
- 有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
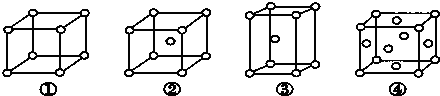
A.①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积
B.晶胞中原子的配位数分别为:①6,②8,③8,④12
C.金属镁采取③的堆积方式
D.空间利用率的大小关系为:①<②<③<④ 天泽圣1年前1
天泽圣1年前1 -
 随风而舞的天使 共回答了15个问题
随风而舞的天使 共回答了15个问题 |采纳率100%解题思路:A.②为体心立方堆积,③为六方最密堆积;
B.③为六方密集堆积,配位数为12,不是8;
C.金属镁为六方最密堆积,堆积方式为③;
D.空间利用率中,简单六方堆积的空间利用率最低,空间利用率最高的是③六方最密堆积和④面心立方最密堆积.A.②是体心立方堆积,属于钾、钠和铁型,③是六方最密堆积,属于镁、锌、钛型,故A错误;
B.③为六方最密堆积,③的配位数是12,所以晶胞中原子的配位数分别为:①6,②8,③12,④12,故B错误;
C.镁的堆积方式为六方最密堆积,所以金属镁采取③的堆积方式,故C正确;
D.①中空间利用率为51%,②中空间利用率为68%,③④中空间利用率为74%,所以空间利用率大小关系为:①<②<③=④,故D错误;
故选C.点评:
本题考点: 金属晶体的基本堆积模型.
考点点评: 本题考查了金属晶体结构,题目难度中等,注意掌握典型晶体晶胞结构,明确晶胞中配位数、原子个数的计算方法,为学习的难点.1年前查看全部
- 原子晶体,分子晶体,金属晶体,离子晶体他们的物理性质,就是导电性导热性之类的
 ZIBOAUTO1年前1
ZIBOAUTO1年前1 -
 hyl0120 共回答了20个问题
hyl0120 共回答了20个问题 |采纳率100%①根据导电性判断
熔化或固态时都不导电的一般是原子晶体或分子晶体;熔化或固态都能导电的一般为金属晶体;固态时不导电,熔化或溶于水时能导电的一般为离子晶体;熔化、固态都不能导电,但溶于水后大多导电的晶体一般是分子晶体.石墨称为过渡型或混合型晶体能导电.
②根据机械性能判断
具有高硬度的为原子晶体,较硬且脆的为离子晶体,硬度较差但较脆的为分子晶体,有延展性的为金属晶体.
③根据熔、沸点判断
离子晶体与原子晶体熔、沸点高于分子晶体.金属晶体熔沸点有的高,有的低.
四种基本晶体熔、沸点对比规律1、一般:
原子晶体>离子晶体>金属晶体>分子晶体2、各自比较:
①离子晶体:离子半径小(或阴、阳离子半径之和越小的),离子所带电荷数越多,键能越强,熔、沸点就越高.
②分子晶体:在组成结构均相似的分子晶体中,式量大的分子间作用力就大,熔沸点高;分子极性大,熔沸点高;但分子间有氢键存在的物质熔沸点偏高.
③原子晶体:成键原子半径小,键能大,熔沸点就高.
④金属晶体:金属离子半径越小,电荷数越多,其熔沸点越高.1年前查看全部
- 金属晶体熔沸点比分子晶体高?
 gelan5211年前1
gelan5211年前1 -
 telnetchen 共回答了18个问题
telnetchen 共回答了18个问题 |采纳率83.3%晶体不同,微粒间的作用力不同,所以熔化沸腾需要的能量就不同.分子晶体,分子间作用力,不是化学键,作用力较弱,熔沸点较低.金属晶体,金属键,也属于化学键,但是不同金属之间的差异很大,所以金属的熔沸点,有特别高的,如钨...1年前查看全部
- 金属晶体有分子式和化学式吗?离子晶体有分子式和化学式吗?分子晶体有分子式和化学式吗?
 风过草头平1年前3
风过草头平1年前3 -
 剑灵刀狂 共回答了19个问题
剑灵刀狂 共回答了19个问题 |采纳率84.2%一切“纯净物”都可以写它的化学式.
化学式是表示物质(纯净物)元素组成的式子.
在2000年以前的中学化学教材中,有“分子式”和“分子量”这两个名词,在2000年后,中学教材中把这两个名词改成了“化学式”和“相对分子质量”,也就是从此后分子式和分子量两个词退出了中学化学的舞台.
化学式指的是物质元素组成,所有的纯净物都可以用化学式表示.
但是分子式,其局限性就相当大.之所以教材中把分子式改成现在的化学式,就这个道理.
由分子组成的物质,象分子晶体,他们的化学式可以表示它们的一个分子,可以称为分子式;
但是象离子晶体、原子晶体,它们并不是由分子构成的,就不可能写出“分子式”.
所以现在的教材中用“化学式”,这个概念更加广泛的名词.
现在回到你的问题:
所有的晶体都可以写出“化学式”.能写分子式的,只有分子晶体.
离子晶体、原子晶体、金属晶体不能写出它们的分子式,只能写化学式.1年前查看全部
- 原子晶体 分子晶体 金属晶体 离子晶体 键能熔沸点高低
原子晶体 分子晶体 金属晶体 离子晶体 键能熔沸点高低
1怎么判断键能大小?
2怎么判断熔沸点高低?
我问的是原子晶体 分子晶体 金属晶体 离子晶体之间...还有的是原子晶体之间,分子晶体之间,金属晶体之间,离子晶体之间
还有的就是这些的判断不是多样的吗?那么什么是首先考虑的...然后次之的.
就像离子晶体会由半径和核电核数判定.
谢谢了,我要过几天任务完成才会有分,会追加的. 乖溜溜1年前2
乖溜溜1年前2 -
 mjsun115 共回答了18个问题
mjsun115 共回答了18个问题 |采纳率88.9%比较物质的熔点和沸点的高低,通常按下列步骤进行,首先比较物质的晶体类型,然后再根据同类晶体中晶体微粒间作用力大小,比较物质熔点和沸点的高低,具体比较如下:
一、判断所给物质的晶体类型,然后按晶体的熔点和沸点的高低进行比较,一般来说晶体的熔点和沸点的高低是:原子晶体>离子晶体>分子晶体.
但并不是所有这三种晶体的熔点和沸点都符合该规律,例如:氧化镁>晶体硅.而金属晶体的熔点和沸点变化太大,例如汞、铷、铯、钾等的熔点和沸点都很低,钨、铼、锇等的熔点和沸点却很高,所以不能和其它晶体进行简单的比较.
二、 当所给物质是同类晶体时,则分别按下列方式比较 .
1. 原子晶体:因为构成原子晶体的微粒是原子,微粒间的作用力是共价键,则其晶体熔点和沸点的高低则由共价键的的键长和键能决定,键长越短、键能越大,熔点和沸点就越高.
例如:金刚石>金刚砂>晶体硅.
2. 离子晶体:离子晶体的熔点和沸点的高低决定于离子晶体中离子键的强弱,一般来说离子晶体中阴阳离子核间距离越小、离子所带电荷越多的离子键能就越大,晶体的熔点和沸点越高.
例如:MgO>NaCl>NaBr
3. 金属晶体:同类金属晶体中,金属离子的半径越小、金属离子所带电荷越多,金属键越强,金属的熔点和沸点越高.
例如,Li>Na>K,Al>Mg>Na.
4. 分子晶体:分子晶体中分子间作用力越大,分子晶体的熔点和沸点就越高.分子之间作用力大小与分子的相对分子质量大小、分子的极性和分子的结构有关.
⑴组成和结构相似分子晶体,相对分子质量越大,分子间作用力越大,其晶体的熔点和沸点越高.例如,I2>Br2>Cl2,CI4>CBr4> CCl4>CF4.
⑵但如果分子之间存在氢键时,其对分子晶体的熔点和沸点的影响更大,例如,HF>HI>HBr>HCl,H2O>H2Te>H2Se>H2S,NH3>AsH3>PH3.
⑶当分子的组成相同时,其分子间作用力大小与分子的结构相关,例如,烷烃同分异构体中,分子结构中支链越多的,沸点越低,如正戊烷>异戊烷>新戊烷(但它们的熔点却不一样,三者熔点依次为-129.7℃,-159.9℃,-20℃,其熔点与分子的对称性相关,对称性越好,其熔点越高).而苯的同系物中,则是整个分子的对称性越好,其沸点越低,如,邻二甲苯>间二甲苯>对二甲苯(同样它们的熔点的变化规律也不相同,其熔点依次是25.2℃,47.9℃,13.3℃).1年前查看全部
- 范德华力存在范围?离子晶体,分子晶体,金属晶体,原子晶体,单质,化合物?
 piranha1年前2
piranha1年前2 -
 追风筝的阿米尔 共回答了17个问题
追风筝的阿米尔 共回答了17个问题 |采纳率100%分子晶体啊!1年前查看全部
- 金属元素在常温下一定是金属晶体吗?液汞是晶体吗?
 7872551年前1
7872551年前1 -
 缤纷花火 共回答了16个问题
缤纷花火 共回答了16个问题 |采纳率68.8%朋友,请记住了,晶体只能描述固体物质.而常温下的液汞,并不能称之为金属晶体1年前查看全部
- 汞为什么不是金属晶体
 声浪1年前1
声浪1年前1 -
 大侠Bryant 共回答了19个问题
大侠Bryant 共回答了19个问题 |采纳率94.7%气体要变成液体,液体要变成气体,与其所处的外在环境有关.温度,气压!
在常温下,因为水银还没达到它的凝固点,所以它还是液体,不是晶体.
水银的凝固点是:-38.87℃,当外界环境的温度低于它的凝固点后,水银一样会成为晶体的.在常温下,加压,能否凝固,没查过这方面的参数!1年前查看全部
- 金属键越强,金属晶体的溶、沸点越高,硬度越大
 英语听力教学1年前1
英语听力教学1年前1 -
 不安静的静 共回答了15个问题
不安静的静 共回答了15个问题 |采纳率86.7%一般,金属键越强,金属晶体的熔、沸点越高,硬度越大,准确.1年前查看全部
- 金属晶体有没有单个存在,意思是说金属都是以晶胞的形式,由电子和金属阳离子构成的是吗?最好有图!
 wxlly5201年前1
wxlly5201年前1 -
 酒花落满楼 共回答了11个问题
酒花落满楼 共回答了11个问题 |采纳率100%举个例子吧,
铁的密度是每立方厘米7.87克,原子量是55.85,可以估算出铁中相邻铁原子的距离平均为一百亿分之二点三米.比如一尺长的钢尺,日取其半地截了30天后,就只剩下一百亿分之三点一米长,这时就不能再截了.实际上,截了27天后,剩下的钢尺只有11个铁原子排起来长,已经难以保持钢铁原有的固体性质了.
是由原子核和一群自由电子组成,图我还真没有.1年前查看全部
- 金属晶体中的金属阳离子是几价的?
金属晶体中的金属阳离子是几价的?
也就是1摩尔金属含几摩尔电子?
尤其是铁或铜这样可变化合价的. yout0be1年前2
yout0be1年前2 -
 mm乱 共回答了17个问题
mm乱 共回答了17个问题 |采纳率76.5%孩子,单质化合价为零,不要把微观的晶体结构和宏观的化合价混为一谈!1年前查看全部
- 金属晶体一定比离子晶体导电性强吗
 小酒酿1年前1
小酒酿1年前1 -
 zhg323604 共回答了12个问题
zhg323604 共回答了12个问题 |采纳率75%离子晶体不导电,除非熔融状态或者溶液.1年前查看全部
- 金属晶体有没有单个存在,意思是说金属都是以晶胞的形式,由电子和金属阳离子构成的是吗?最好有图!
 lc84863181年前1
lc84863181年前1 -
 jeff888 共回答了20个问题
jeff888 共回答了20个问题 |采纳率90%对,是由金属阳离子和电子构成的1年前查看全部
- 为什么金的熔点比汞高?金属晶体的熔点比较和什么有关?金属键强弱怎么比较?
 ken_co1年前1
ken_co1年前1 -
 Mandy305 共回答了17个问题
Mandy305 共回答了17个问题 |采纳率88.2%和金属的晶体构型有关.
熔点和金属键有关.
强弱由离子半径和电荷数有关,与半径成反比,电荷数成正比1年前查看全部
- 金属单质金属晶体常温常压下,金属单质都形成金属晶体 这句话错在哪?
 水榜一只猪1年前1
水榜一只猪1年前1 -
 汽车轱辘 共回答了13个问题
汽车轱辘 共回答了13个问题 |采纳率92.3%晶体都是固体,而汞常温常压下是液态,液态不是晶体.这句话除汞外就对了.1年前查看全部
- 原子晶体 分子晶体 金属晶体 离子晶体怎么判断键能大小?
 出幽迁乔1年前1
出幽迁乔1年前1 -
 小雨伞1 共回答了19个问题
小雨伞1 共回答了19个问题 |采纳率84.2%见能从大到小:离子晶体、原子晶体、金属晶体、分子晶体.1年前查看全部
- 大神有没有区分·离子晶体 分子晶体·原子晶体·金属晶体,它们四个的简易方法,口诀最好了.我后天月考了,
 jr543211年前1
jr543211年前1 -
 等一开始2 共回答了21个问题
等一开始2 共回答了21个问题 |采纳率100%少年,虽然哥曾经在高三考过化学满分,但是我也一下子,总结不出什么口诀,你看看下面这一段,希望可以帮到你.(建议你平时用笔记本慢慢积累)
1、不同晶体类型的物质
(1)、一般情况下,原子晶体>离子晶体>分子晶体,而金属晶体的熔沸点差异较大,有的很高(钨),有的很低(汞).
(2)、对于有明显状态差异的物质,根据常温下状态进行判断.如NaCl>Hg>CO2
2、同种晶体类型
(1)、同属原子晶体:原子间通过共价键形成原子晶体,原子晶体的熔沸点取决于共价键的强弱.一般,原子半径越大,共价键越长,共价键就越弱,熔沸点越低.如:金刚石(C—C)>碳化硅(C—Si)>晶体硅(Si—Si)
(2)、同属离子晶体:阴阳离子通过离子键形成离子晶体,离子晶体的熔沸点取决于离子键的强弱,离子所带电荷越多,离子半径越小,则离子键越强,熔沸点越高.如:MgO>MgCl2>NaCl>CsCl
(3)、同属金属晶体:金属阳离子和自由电子通过金属键形成金属晶体,金属阳离子带的电荷越多,半径越小,金属键越强,熔沸点越高.如:Al>Mg>Na
3、分子晶体
分子之间通过分子间作用力形成分子晶体,分子晶体熔沸点比较复杂,有许多具体情况需要分别讨论.
(1)、组成和结构相似的分子晶体,一般相对分子质量越大,分子间作用力越强,熔沸点越高,如I2>Br2>Cl2>F2;CH4新戊烷
b.结构越对称,熔沸点越低.如沸点:邻二甲苯>间二甲苯>对二甲苯
(4)、若分子间存在氢键,则熔沸点会反常高,通常含有氢键的物质有氨、冰、干冰,乙醇.如HF>HI>HBr>HCl1年前查看全部
- 如何辨别晶体类型如何区分原子晶体,分子晶体,金属晶体和离子晶体.
 fkuo1年前1
fkuo1年前1 -
 顶鼓 共回答了17个问题
顶鼓 共回答了17个问题 |采纳率88.2%从组成粒子上区分,原子晶体由原子构成,分子晶体由分子构成,离子晶体由离子构成,金属晶体由金属离子和自由电子构成.从状态和性质区分,原子晶体常态多为固态,如金刚石,熔点非常高,硬度很大,不导电,分子晶体在常态时多为液态或气态,如干冰在常温下为气体,冰常态为液态,分子晶体熔点沸点很低,常态不导电,溶于水可能导电,如硫酸,熔融不导电.金属晶体多为固态,除了汞,有很好的延展性,可拉成丝,硬度较大熔点较高,常态就导电.离子晶体熔融或溶解均可导电,较脆.从粒子作用力上区分,原子晶体靠共价键,分子晶体靠范德华力或氢键,离子晶体靠离子键,金属晶体靠金属键.1年前查看全部
- 如何区分晶体的种类?晶体有离子晶体、分子晶体、原子晶体、金属晶体,但是怎样能最快得区分开这些晶体的种类?特别是原子晶体和
如何区分晶体的种类?
晶体有离子晶体、分子晶体、原子晶体、金属晶体,但是怎样能最快得区分开这些晶体的种类?特别是原子晶体和分子晶体…… 城小楼ss1年前1
城小楼ss1年前1 -
 柳DEMON 共回答了16个问题
柳DEMON 共回答了16个问题 |采纳率87.5%原子晶体就几个比较固定的 二氧化硅 硅 碳化硅
分子晶体有 稀有气体 还有氧气什么的,有水1年前查看全部
- 生铁算不算合金,如果是的话,那么它算不算金属晶体?我看金属晶体还包括合金
 popo1234001年前3
popo1234001年前3 -
 yyxjj 共回答了16个问题
yyxjj 共回答了16个问题 |采纳率87.5%生铁是合金,不是金属晶体,金属晶体一定全是金属元素1年前查看全部
- 说金属晶体是由金属离子(或金属原子)和自由电子构成的
说金属晶体是由金属离子(或金属原子)和自由电子构成的
是说金属晶体是由金属离子和自由电子或金属原子构成的呢?还是说金属晶体是由金属离子和自由电子或金属原子和自由电子构成的呢? sunkai5611年前2
sunkai5611年前2 -
 不会唱歌的小鱼 共回答了15个问题
不会唱歌的小鱼 共回答了15个问题 |采纳率93.3%金属晶体是由金属离子和自由电子构成的!
原子加电子的话整个金属显电性了1年前查看全部
- 常见的金属晶体晶格形式有哪3种,请了解的回答下,..
 度是07461年前1
度是07461年前1 -
 abs112233 共回答了29个问题
abs112233 共回答了29个问题 |采纳率82.8%体心立方晶格 面心立方晶格 密排六方晶格1年前查看全部
- 离子晶体 金属晶体都能导电为什么是错的
 不要问我为什么oO1年前2
不要问我为什么oO1年前2 -
 黑夜游魂 共回答了15个问题
黑夜游魂 共回答了15个问题 |采纳率93.3%导电的前提是有能自由移动的电荷载体
电子和离子都可以作为电荷载体,但能否导电关键在于能否自由移动
金属晶体中的电子可以自由移动
但是离子晶体中的离子是固定在晶格内的,只有在溶液中或熔融状态下离子才能自由移动
所以 金属晶体能导电,离子晶体不能1年前查看全部
- 石墨属于混合晶体,是原子晶体和金属晶体的混合吗,它为何能导电,
 yiyewumian1年前1
yiyewumian1年前1 -
 zibomfq 共回答了21个问题
zibomfq 共回答了21个问题 |采纳率100%不是,石墨就是碳,能导电就是因为它是导体,导电性强.1年前查看全部
- 高二化学选修3金属晶体配位数怎么数
 阿纳尔汗1年前3
阿纳尔汗1年前3 -
 紫艺 共回答了21个问题
紫艺 共回答了21个问题 |采纳率81%①一个金属阳离子周围离它最近的粒子的个数就是金属晶体的配位数
②常见的有(可以背下来,考试遇到速度解决)
六方最密堆积,配位数是12,举例:Zn Mg Ti
面心最密堆积,配位数是12,举例:Au Ag Cu
体心堆积,配位数是8,举例:Na K Fe
最简堆积,配位数是6,举例:Po
还有疑问请提,1年前查看全部
- 金属晶体在什么状态下能导电
 蓝悠沁雪1年前1
蓝悠沁雪1年前1 -
 scw3881 共回答了14个问题
scw3881 共回答了14个问题 |采纳率100%金属晶体在固态、液态下都能导电.
气体金属能否导电,要具体问题具体分析1年前查看全部
- 金属晶体的下列性质中,不能用金属晶体结构加以解释的是( )
金属晶体的下列性质中,不能用金属晶体结构加以解释的是( )
A. 易导电
B. 易导热
C. 有延展性
D. 密度 wcca1年前2
wcca1年前2 -
 SCHG323 共回答了17个问题
SCHG323 共回答了17个问题 |采纳率94.1%解题思路:A.金属容易导电是因为晶体中存在许多自由电子;
B.容易导热是因为自由电子在运动时经常与金属离子碰撞而引起能量的交换;
C.当金属受到外力时,晶体中的各离子层就会发生相对滑动,但由于金属离子和自由电子之间的相互作用没有方向性,受到外力后相互作用没有被破坏,故虽发生形变,但不会导致断;
D.密度与金属晶体结构无关.A.金属容易导电是因为晶体中存在许多自由电子,这些自由电子的运动是没有方向性的,但在外加电场作用下,自由电子就会发生定向移动形成电流,故A不选;
B.容易导热是因为自由电子在运动时经常与金属离子碰撞而引起能量的交换,从而能量从温度高的部分传到温度低的部分,使整块金属达到相同的温度,故B不选;
C.有延展性是因为金属离子和自由电子之间的较强作用,当金属受到外力时,晶体中的各离子层就会发生相对滑动,但由于金属离子和自由电子之间的相互作用没有方向性,受到外力后相互作用没有被破坏,故虽发生形变,但不会导致断,故C不选;
D.密度与金属晶体结构无关,故D选;
故选D.点评:
本题考点: 金属键与金属的物理性质的关系.
考点点评: 本题考查金属晶体结构,题目难度不大,注意基础知识的积累.1年前查看全部
- 关于晶体类型固态导电的一定是金属晶体,这句话为什么错?
 VIVIAN_WP1年前2
VIVIAN_WP1年前2 -
 木子陈 共回答了22个问题
木子陈 共回答了22个问题 |采纳率95.5%石墨是固态`可以导电
但他不是金属晶体
还有很多非金属固体在不同的情况下也能导电1年前查看全部
- 液汞是金属晶体吗? 不要说因为是液体.那不是金属晶体又是甚麼
 风儿轻轻0001年前1
风儿轻轻0001年前1 -
 大修厂 共回答了26个问题
大修厂 共回答了26个问题 |采纳率84.6%液态汞就是融化的汞当然不是晶体态咯.就像水一样0°c一下是冰就是晶体,以上是水是液体.只是汞的熔点低-38.8℃,要是低于这个温度才可能形成晶体咯.1年前查看全部
- 融熔状态下能导电的是离子晶体?金属晶体有没有融熔状态?离子晶体与离子化合物有什么区别?
 4154291年前4
4154291年前4 -
 郁小小飞 共回答了21个问题
郁小小飞 共回答了21个问题 |采纳率85.7%不一定是,就像你意识到的金属晶体,融熔状态下也能导电,但他是单质,没有阴离子,只有自由能自由移动的电子又称电子气,所以说他不是离子化合物1年前查看全部
- 有哪些离子晶体是不容的 举例!金属晶体哪些可以容!举例!
 qndkjm1年前1
qndkjm1年前1 -
 飞尘1116 共回答了20个问题
飞尘1116 共回答了20个问题 |采纳率90%溶于哪里呀?
比如,碳酸钙是离子晶体,不溶于水.
氯化钠是离子晶体,溶于水,不溶于大部分有机溶剂.
金属几乎都不溶于水.
但是许多金属都能溶于液态汞中.
溶解是个相对概念,一般只讨论与水的溶解情况,但是特殊情况,要说清楚溶剂.1年前查看全部
- 1.金属的导电性是因为金属晶体内存在自由移动的价电子,而其导热性是因为存在自由移动的金属阳离子?
1.金属的导电性是因为金属晶体内存在自由移动的价电子,而其导热性是因为存在自由移动的金属阳离子?
2.晶体中存在离子的一定是离子晶体?
3.在相同条件下甲跟稀硝酸反应有硝酸铵生成,而乙没有,为什么能证明甲还原性比乙强?
4.下列能与铝粉组成铝热剂的是?
A.Cr2O3 B.MnO2 C.MgO D.V2O5
答案c但是什么物质才能做铝热剂?
5怎样制备单质钠?用电解食盐水不行?
6.苯酚溶液中滴加FeCl3溶液有什么颜色变化?
4.下列(不)能与铝粉组成铝热剂的是? 93291年前3
93291年前3 -
 CXR1103 共回答了17个问题
CXR1103 共回答了17个问题 |采纳率94.1%1.金属的导电性是因为金属晶体内存在自由移动的价电子,而其导热性是因为存在自由移动的金属阳离子?
金属导电是因为金属原子会失去电子形成可自由移动的电子,所以可以导电;但是金属导体的热传导主要是通过电子的运动,而绝缘体的热传导主要依靠格波的传导.
2.晶体中存在离子的一定是离子晶体?
错误,比如金属晶体,也有离子,但是金属晶体.
3.在相同条件下甲跟稀硝酸反应有硝酸铵生成,而乙没有,为什么能证明甲还原性比乙强?
硝酸中N是+5价的,甲将+5价的N还原为-3价的,有强的还原性;乙没有说明乙不能将N还原为-3价,所以还原性差,、
有个前提,甲和乙中不能有-3价的N
4.下列能与铝粉组成铝热剂的是?
A.Cr2O3 B.MnO2 C.MgO D.V2O5
答案c但是什么物质才能做铝热剂?
铝热反应是铝粉把某些金属氧化物当中的金属置换出来的反应.该反应将会放出大量的热.其中铝粉和金属氧化物作为铝热剂,镁条和氯酸钾作为引燃剂.
这些常见的可以和铝粉作为铝热剂的金属氧化物有:氧化铁、氧化亚铁、四氧化三铁、五氧化二钒、三氧化二铬、二氧化锰
答案是除了C
5怎样制备单质钠?用电解食盐水不行?
电解熔融氯化钠,不行,NA的活泼型太强,电解只能生成NAOH.
6.苯酚溶液中滴加FeCl3溶液有什么颜色变化?
变紫,生成配位离子,基本的显色反应之一1年前查看全部
- 组成元素相同而结构不同的各金属晶体就是同素异构体对吗
 敏儿妹妹1年前2
敏儿妹妹1年前2 -
 bingleishi 共回答了18个问题
bingleishi 共回答了18个问题 |采纳率100%同素异构体:同一种元素组成的不同的晶体结构的金属晶体叫做金属的同素异构体(同素异晶体).例如纯铁的同素异晶体有:δ-Fe、γ-Fe、α-Fe.1年前查看全部
- .在下列有关晶体的叙述中错误的是 A.离子晶体中,一定存在离子键 B.原子晶体中,只存在共价键 C.金属晶体的熔、沸点均
.在下列有关晶体的叙述中错误的是
A.离子晶体中,一定存在离子键 B.原子晶体中,只存在共价键 C.金属晶体的熔、沸点均很高 D.分子晶体中不一定含化学键  小鬼苹果1年前1
小鬼苹果1年前1 -
 ren313250965 共回答了17个问题
ren313250965 共回答了17个问题 |采纳率94.1%C
C、金属晶体的晶胞结构复杂,熔沸点差异很大。例如Hg的熔点低于0℃,W的熔点三千多摄氏度。1年前查看全部
- 最小微粒只有离子的晶体是 金属晶体还是离子晶体?
最小微粒只有离子的晶体是 金属晶体还是离子晶体?
RT,求详解 一帆风顺01年前1
一帆风顺01年前1 -
 梅魂 共回答了18个问题
梅魂 共回答了18个问题 |采纳率94.4%是离子晶体.
金属晶体的最小微粒 除了 离子 外还有自由电子.1年前查看全部
- 下列叙述不正确的是( )A.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键B.向煤中加入生石灰可减少对大气的
下列叙述不正确的是( )
A.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
B.向煤中加入生石灰可减少对大气的污染
C.完全由非金属元素组成的化合物可以形成离子化合物
D.由氮气为原料合成氨是氮的固定 股神大哥8881年前1
股神大哥8881年前1 -
 科比没ff 共回答了14个问题
科比没ff 共回答了14个问题 |采纳率92.9%解题思路:A.分子晶体中不一定含有化学键;
B.生石灰和二氧化硫反应生成亚硫酸钙;
C.完全由非金属元素组成的化合物可能是离子化合物,也可能是共价化合物;
D.氮元素由游离态转化为化合态为氮的固定.A.分子晶体中不一定含有化学键,如稀有气体中不含化学键,故A错误;
B.生石灰和二氧化硫反应生成亚硫酸钙,从而减少二氧化硫的排放,能减少大气污染,故B正确;
C.完全由非金属元素组成的化合物可能是离子化合物,如铵盐,故C正确;
D.氮元素由游离态转化为化合态为氮的固定,所以由氮气为原料合成氨是氮的固定,故D正确;
故选A.点评:
本题考点: 化学键;氮的固定;离子化合物的结构特征与性质;常见的生活环境的污染及治理.
考点点评: 本题考查了化学键、物质间的反应、氮的固体等知识点,根据物质中微粒间作用力、物质的构成微粒、基本概念等知识点来分析解答即可,易错选项是A,稀有气体是氮原子分子,所以不存在化学键,但存在范德华力,为易错点.1年前查看全部
大家在问
- 1生铁是纯金属还是合金
- 2固溶胶,合金是晶体吗?为什么?
- 31.沉船上有一只体积为0.02立方米、重为500牛的密闭保险箱,现用绳子将保险箱从江底匀速向上拉,在50秒内提升10米,
- 4没什么事是重要的英文翻译
- 5也许对我来说没什么重要了英文怎么些
- 6铝常用来炼高熔点金属 ,这是利用了铝的什么性
- 7铝的熔点很高,可用作耐高温材料
- 8土壤 是固溶胶吗?如题,
- 9形容防御保护的词语是?最好四个字要霸气的。
- 10"初中同学"英语单词怎么讲
- 11彩虹形成的原理是什么?
- 12碳酸氢钡是否沉淀?
- 13细胞在分化过程中细胞器的种类与数量是否改变?
- 14NK与 CTL细胞区别?医学免疫学
- 15若函数y=f(x)满足x=sinb+cosb y=sinbcosb 则f(x)=
