(2009•河西区模拟)在同一地点有两个静止的声源,发出声波1和声波2.在同一空间的空气中沿同一方向传播,如图所示为某时
 cobra_j2022-10-04 11:39:541条回答
cobra_j2022-10-04 11:39:541条回答 (2009•河西区模拟)在同一地点有两个静止的声源,发出声波1和声波2.在同一空间的空气中沿同一方向传播,如图所示为某时刻这两列波的图象,则下列说法中正确的是( )
(2009•河西区模拟)在同一地点有两个静止的声源,发出声波1和声波2.在同一空间的空气中沿同一方向传播,如图所示为某时刻这两列波的图象,则下列说法中正确的是( )A.波1速度比波2速度大
B.相对于同一障碍物,波1比波2更容易发生衍射现象
C.在这两列波传播的方向上,不会产生稳定的干涉现象
D.在这两列波传播的方向上运动的观察者,听到的这两列波的频率可以相同

已提交,审核后显示!提交回复
共1条回复
 dongqinger 共回答了21个问题
dongqinger 共回答了21个问题 |采纳率90.5%- 解题思路:波速是由介质决定的,两列声波在同一空间的空气中沿同一方向传播,波速相同.由图读出波长关系,由v=λf研究频率关系.根据干涉和衍射产生的条件分析能否产生稳定的干涉现象和衍射现象.
A、两列声波在同一空间的空气中沿同一方向传播,波速相同.故A错误.
B、由图读出声波1和声波2波长之比为λ1:λ2=2:1.波长越长,波动性越强,所以相对于同一障碍物,波1比波2更容易发生衍射现象.故B正确.
C、由v=λf得到两波频率之比为f1:f2=1:2.耐两列波发生干涉的必要条件是频率相同,所以在这两列波传播的方向上,不会产生稳定的干涉现象.故C正确.
D、由于波2的频率大于波1的频率,在这两列波传播的方向上运动的观察者,听到的这两列波的频率不会相同.故D错误.
故选BC点评:
本题考点: 波长、频率和波速的关系;横波的图象.
考点点评: 本题考查基本的读图能力.对于波的三个物理量抓住:波速是由介质决定的,频率是由波源决定的.波长由介质和波源共同决定. - 1年前
相关推荐
- (2012•河西区一模)下列对实验现象的描述,正确的是( )
(2012•河西区一模)下列对实验现象的描述,正确的是( )
A.取适量无色的碳酸饮料,滴加紫色石蕊溶液,然后再加热,溶液颜色先变蓝后变紫
B.向滴有酚酞溶液的氢氧化钠溶液中滴加过量的盐酸,溶液由红色变为无色
C.硫在氧气中燃烧产生微弱的淡蓝色火焰,并生成有刺激性气味的气体
D.细铁丝在空气中剧烈燃烧,火星四射,生成黑色固体 zpp4024231年前1
zpp4024231年前1 -
 毕宗远 共回答了19个问题
毕宗远 共回答了19个问题 |采纳率94.7%解题思路:A、根据碳酸的酸性及不稳定性分析;
B、根据氢氧化钠溶液的碱性分析;
C、根据硫磺在空气及氧气中燃烧的现象分析;
D、根据铁丝燃烧的现象及注意事项分析.A、碳酸饮料显酸性,滴加紫色石蕊溶液,溶液颜色先变红;然后再加热,碳酸不稳定分解为水和二氧化碳,酸性消失,溶液颜色又变成紫色;故选项错误;
B、氢氧化钠溶液显碱性,能够使无色的酚酞试液变成红色,滴加过量的盐酸会把氢氧化钠溶液反应使溶液呈现酸性,酚酞试液在酸性溶液中呈现无色;故选项正确;
C、硫在氧气中燃烧产生明亮的蓝紫色火焰,并生成有刺激性气味的气体;故选项错误;
D、细铁丝在空气中不能燃烧;故选项错误.
故选项为:B.点评:
本题考点: 二氧化碳的化学性质;氧气与碳、磷、硫、铁等物质的反应现象;中和反应及其应用.
考点点评: 本题常见的反应现象的描述,属于基础性的考查,但要求学生能够熟练理解并运用.1年前查看全部
- (2013•河西区二模)将一定量的氢氧化钠和氯化铵固体混合物加热,测得反应前后各物质的质量如下表.
(2013•河西区二模)将一定量的氢氧化钠和氯化铵固体混合物加热,测得反应前后各物质的质量如下表.
下列判断正确的是( )物质 NaOH NH4Cl NaCl H2O X 反应前质量/g 8.0 10.7 0 0 0 反应后质量/g 0 0 11.7 3.6 a
A.表中a的值为2.8
B.X不一定是化合物
C.X可能是该反应的催化剂
D.X中一定含有氢元素 windsurf20461年前1
windsurf20461年前1 -
 粉豹 共回答了18个问题
粉豹 共回答了18个问题 |采纳率83.3%解题思路:A、根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和,则可求出a的质量;
B、根据质量守恒定律反应前后元素的质量不变来完成解答;
C、根据A中解答,比较X的质量是否发生改变,从而做出判断;
D、根据质量守恒定律,反应前后元素的质量不变,比较反应前后出现的物质中氢元素的质量,可以完成解答.A、根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和,则可求出a的质量为:8.0g+10.7g-11.7g-3.6g=3.4g,故A错误;
B、根据反应前后元素的种类不变可以知道在X中一定含有氮元素,其中氮元素的质量与氯化铵中氮元素的质量相等,为:10.7g×[14/14+4+35.5]×100%=2.8g<3.4g,所以可以判断在X中还含有其他元素,即X为化合物,故B错误;
C、X反应前质量为0,而反应后质量为3.4g,所以X不可能为催化剂,故C错误;
D、氯化铵中氢元素的质量为:10.7g×[4/14+4+35.5]×100%=0.8g,而水中氢元素的质量为:3.6g×[2/18]×100%=0.4g,根据反应前后氢元素的质量相等,可以判断在X中一定含有氢元素,故D正确.
故选D.点评:
本题考点: 质量守恒定律及其应用;催化剂的特点与催化作用;单质和化合物的判别.
考点点评: 本题是运用化学中的基本思想质量守恒思想,通过归纳不同物质或不同变化过程中相同点和不同点,有效地寻找出它们之间的内在联系以及融合点和嫁接点,从而培养了学生的创新思维能力.1年前查看全部
- (2009•河西区)一次登山探险活动,小李上、下山共用了5小时,已知他上山的速度是每小时2千米,下山的速度是每小时3千米
(2009•河西区)一次登山探险活动,小李上、下山共用了5小时,已知他上山的速度是每小时2千米,下山的速度是每小时3千米.如果上、下山走的是同一条路,那么他上山走了______千米.
 juraljh1年前1
juraljh1年前1 -
 dy0124 共回答了20个问题
dy0124 共回答了20个问题 |采纳率90%解题思路:根据关系式:路程=时间×速度,路程一定,速度和时间成反比,知道速度比可求出时间的比,即可求出上山的时间.然后根据关系式:路程=时间×速度列式解答即可.上山与下山的速度比为2:3,
时间比为3:2,
2+3=5,
上山时间:5×[3/5]=3(小时),
上山路程:3×2=6(千米),
答:他上山走了6千米.
故答案为:6.点评:
本题考点: 简单的行程问题.
考点点评: 此题主要根据路程一定,速度和时间成反比例,先求出时间比,即可求出上山时间,进而求得路程.1年前查看全部
- (2013•河西区二模)如图所示,烛焰通过凸透恰好在光屏上呈现出一个清晰倒立,缩小的像,若保持透镜位置不变,把烛焰与光屏
 (2013•河西区二模)如图所示,烛焰通过凸透恰好在光屏上呈现出一个清晰倒立,缩小的像,若保持透镜位置不变,把烛焰与光屏的位置对调一下,则下列说法正确的是( )
(2013•河西区二模)如图所示,烛焰通过凸透恰好在光屏上呈现出一个清晰倒立,缩小的像,若保持透镜位置不变,把烛焰与光屏的位置对调一下,则下列说法正确的是( )
A.光屏上仍能呈现出一个清晰倒立、缩小的像
B.光屏上将呈现出一个清晰倒立、放大的像
C.光屏上不能呈现出像,但眼睛透过透镜能看到像
D.光屏上没有像,需调节光屏的位置像才能呈现出来 省锡中校友追击令1年前1
省锡中校友追击令1年前1 -
 妩媚的飘逸 共回答了10个问题
妩媚的飘逸 共回答了10个问题 |采纳率100%解题思路:根据光路的可逆性结合凸透镜成像特点进行分析,当物距大于2倍焦距时,成倒立缩小的实像,此时像距处于1倍和2倍焦距之间;
若物距处于1倍和2倍焦距之间,则成倒立放大的实像,此时像距大于2倍焦距.烛焰通过凸透恰好在光屏上呈现出一个清晰倒立,缩小的像,说明此时物距大于2倍焦距,像距处于1倍和2倍焦距之间;
把烛焰与光屏的位置对调一下,则根据折射光路的可逆性,像成在蜡烛原来的位置,此时物距处于1倍和2倍焦距之间,则成倒立放大的实像,像距应大于2倍焦距.
所以ACD错误,B正确.
故选B.点评:
本题考点: 凸透镜成像规律及其探究实验.
考点点评: 此题考查了凸透镜成像的规律,要解决此题关键是掌握成像特点与物距、像距的关系,同时还涉及到了折射光路的可逆性.1年前查看全部
- (2012•河西区二模)已知下面三个关于x的一元二次方程ax2+bx+c=0,bx2+cx+a=0,cx2+ax+b=0
(2012•河西区二模)已知下面三个关于x的一元二次方程ax2+bx+c=0,bx2+cx+a=0,cx2+ax+b=0恰好有一个相同的实数根a,则a+b+c的值为( )
A.0
B.1
C.3
D.不确定 mylove12341年前1
mylove12341年前1 -
 安静1028 共回答了17个问题
安静1028 共回答了17个问题 |采纳率82.4%解题思路:把x=a代入3个方程得出a•a2+ba+c=0,ba2+ca+a=0,ca2+a•a+b=0,3个方程相加即可得出(a+b+c)(a2+a+1)=0,即可求出答案.把x=a代入ax2+bx+c=0,bx2+cx+a=0,cx2+ax+b=0得:
a•a2+ba+c=0,ba2+ca+a=0,ca2+a•a+b=0,
相加得:(a+b+c)a2+(b+c+a)a+(a+b+c)=0,
(a+b+c)(a2+a+1)=0,
∵a2+a+1=(a+[1/2])2+[3/4]>0,
∴a+b+c=0,
故选A.点评:
本题考点: 一元二次方程的解.1年前查看全部
- (2013•河西区一模)现有一包含有氯化钠和碳酸钠的固体化合物,为测定其成分,取一定质量的化合物于试管中,加入103g稀
(2013•河西区一模)现有一包含有氯化钠和碳酸钠的固体化合物,为测定其成分,取一定质量的化合物于试管中,加入103g稀盐酸,恰好完全反应,生成的气体全部逸出,得到4.4g气体.将所得溶液冷却至t℃,恰好成为该温度下的饱和溶液,经测定溶液中的溶质含钠元素的质量为13.8g.求反应后所得溶液中溶质的质量分数.(最后计算结果精确到0.1%)
 qqklpa1年前1
qqklpa1年前1 -
 yoyokong 共回答了21个问题
yoyokong 共回答了21个问题 |采纳率90.5%解题思路:根据溶液中溶质的质量分数计算方法可以知道,欲求反应后所得溶液中溶质的质量分数,必须先求出溶液的质量和溶质的质量,根据题给条件可以知道应该先计算出加入的固体的质量,而溶液中溶质的质量可以根据钠元素的质量守恒计算出来,进而求出其溶液中溶质的质量分数即可.设碳酸钠的质量为x,生成氯化钠的质量为y,所得溶液中溶质的质量为z.
Na2CO3+2HCl═2NaCl+H2O+CO2↑
10611744
xy4.4g
[106/x]=[117/y]=[44/4.4g]
解得:x=10.6g,y=11.7g
设反应后的溶液中氯化钠的质量为z,则根据钠元素的质量守恒可得:
Na~NaCl
2358.5
13.8gz
[23/13.8g]=[58.5/z]
解得:z=35.1g
原混合物中NaCl的质量为:35.1g-11.7g=23.4g
所得溶液的质量为:23.4g+10.6g+103g-4.4g=132.6g;
所得溶液中溶质的质量分数为:[35.1g/132.6g]×100%=26.5%;
答:所得溶液中溶质的质量分数为26.5%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 此题是对化学方程式以及溶液相关问题的考查,利用质量守恒定律,计算出反应后溶液的质量是解决问题的关键.1年前查看全部
- (2010•河西区二模)在物理实验中,很多时候都需要对相关物理量进行多次测量,其中有的是为了通过多次测量寻找规律,有的是
(2010•河西区二模)在物理实验中,很多时候都需要对相关物理量进行多次测量,其中有的是为了通过多次测量寻找规律,有的是为了通过多次测量减少误差.下面四个实验中哪些是通过多次测量寻找规律的:①用刻度尺多次测量某一物体的长度;②在做“探究凸透镜成像”实验时,多次改变物距观察成像情况;③在“研究杠杆平衡条件”时,多次调节钩码的个数及位置;④在做“伏安法测电阻”实验时,调节滑动变阻器,测量对应的多组数据( )
A.①②
B.③④
C.②③
D.①④ 熊猫二1年前1
熊猫二1年前1 -
 jxz2007b 共回答了16个问题
jxz2007b 共回答了16个问题 |采纳率93.8%解题思路:本题把测量分成了两类:一类是提高精度,一类是寻找规律.因此,我们只要明确所给实验测量该物理量的目的,就能恰如其分的进行归类了.①其目的是多次测量物体长度求平均值,提高精度.
②目的是为了得出凸透镜成像的规律,找寻规律.
③目的是找出杠杆平衡条件,找寻规律.④目的是多次测量求电阻的平均值,提高精度.
A、①②,其中①是提高精度,②是寻找规律,故不符合题意.
B、③④,③是寻找规律的,④是提高精度,故不符合题意.
C、②③,两者都是寻找规律的,故符合题意.
D、①④,两者都是提高精度,故不符合题意.
故选C.点评:
本题考点: 物理学方法.
考点点评: 本题考查学对各个实验的实验目的是否清楚,要求学学生对实验要非常熟悉,明确实验中每一步实验的目的.1年前查看全部
- (2009•河西区二模)在下列指定容器中,有关水的主要作用的说法,不正确的是( )
(2009•河西区二模)在下列指定容器中,有关水的主要作用的说法,不正确的是( )
A.
铁丝在氧气中燃烧.集气瓶中的水:冷却溅落的熔融物,防止集气瓶炸裂
B.
硫在氧气中燃烧.集气瓶中的水:吸收反应放出的热量
C.
探究燃烧的条件.烧杯中的水:升高铜片温度,使烧杯中的白磷与空气隔绝
D.
测定空气中氧气含量.量筒中的水:通过水体积的变化得出空气中O2体积分数 uu洗头用飘柔1年前1
uu洗头用飘柔1年前1 -
 一次性的cc 共回答了19个问题
一次性的cc 共回答了19个问题 |采纳率94.7%解题思路:A、铁丝在氧气中燃烧时,集气瓶底部放少量的水,是为了防止铁的熔化物温度过高而炸裂集气瓶;
B、硫在氧气中燃烧生成的二氧化硫气体有毒,扩散到空气中会污染空气,水能够吸收二氧化硫生成亚硫酸,从而防止了二氧化硫向外扩散;
C、在探究燃烧条件时,为了说明空气的重要性,我们可以借助温同样能达到着火点的水来作对比实验;
D、测定空气成分时,往往标注不是很准确,借助于量筒可以很好的来完成该实验.A、铁在氧气中燃烧时,水的用途是冷却溅落的熔化物,防止炸裂集气瓶,该选项体现了水的主要作用,不符合题意;
B、硫在氧气中燃烧生成的二氧化硫气体有毒,扩散到空气中会污染空气,水能够吸收二氧化硫生成亚硫酸,从而防止了二氧化硫向外扩散.水的主要作用是吸收二氧化硫.因此,该选项没有体现水的主要作用,符合题意;
C、探究燃烧条件,燃烧杯中的水是提供热量,使温度达到可燃物着火点,因此,该选项体现了水的主要作用,不符合题意;
D、测定空气中氧气的体积分数时,通过量筒中水的体积变化可知氧气的体积,水的主要作用是间接测定氧气的体积.因此,该选项体现了水的主要作用,不符合题意;.
故选B.点评:
本题考点: 氧气的化学性质;空气组成的测定;燃烧与燃烧的条件.
考点点评: 水的作用很多,具体的实验具体分析它的作用,但是往往有些同学基于思维定势,而把有些作用张冠李戴,这一点我们同学要注意,在解题时一定要对实验过程中的现象及产物仔细分析以期得出正确结论.1年前查看全部
- (2009•河西区一模)一个口袋装有编号分别为1,2,3,4,5,6的6个球,从中任取3个球.
(2009•河西区一模)一个口袋装有编号分别为1,2,3,4,5,6的6个球,从中任取3个球.
(1)求3个球中最大编号为4的概率;
(2)求3个球中至少有1个编号为3的概率. asdfasdfqwegtfeq1年前1
asdfasdfqwegtfeq1年前1 -
 jj52511 共回答了15个问题
jj52511 共回答了15个问题 |采纳率73.3%解题思路:(1)先求出6个球中任取3个球,共20种,再求出3个球中最大编号为4,共3种,从而可得结论;
(2)求对立事件的概率,即3个球中没有编号为3的概率,我们可得结论.(1)从6个球中任取3个球,共
C36=20种,最大编号为4时,从1,2,3号球中,取出两个球,共
C23=3种,所以3个球中最大编号为4的概率为[3/20]
(2)求对立事件的概率,即3个球中没有编号为3的概率为
C35
20=
10
20=
1
2
所以3个球中至少有1个编号为3的概率是1−
1
2=[1/2]点评:
本题考点: 列举法计算基本事件数及事件发生的概率.
考点点评: 本题考查等可能事件的概率,考查基本事件的确定,属于基础题.1年前查看全部
- (2014•河西区模拟)如图,在△ABC中,∠C=90°,点D在CB上,DE⊥AB,若DE=2,CA=4,则[DB/AB
 (2014•河西区模拟)如图,在△ABC中,∠C=90°,点D在CB上,DE⊥AB,若DE=2,CA=4,则[DB/AB]=( )
(2014•河西区模拟)如图,在△ABC中,∠C=90°,点D在CB上,DE⊥AB,若DE=2,CA=4,则[DB/AB]=( )
A.[1/4]
B.[1/3]
C.[1/2]
D.[2/3] 弈_缭子1年前1
弈_缭子1年前1 -
 乌恩巴图 共回答了22个问题
乌恩巴图 共回答了22个问题 |采纳率86.4%解题思路:先判断△BAC∽△BDE,然后根据相似三角形的对应边成比例即可得出答案.由题意得,∠B=∠B,∠DEB=∠ACB=90°,
故可得△BAC∽△BDE,
从而有:[DB/AB]=[DE/AC]=[1/2].
故选C.点评:
本题考点: 相似三角形的判定与性质.
考点点评: 此题考查了相似三角形的判定和性质,得出△BAC∽△BDE,掌握相似三角形对应边成比例的性质是解答本题的关键.1年前查看全部
- (2005•河西区模拟)一些食物的近似pH如下:葡萄3.5-4.5,苹果2.9-3.3,牛奶6.3-6.6,鸡蛋清7.6
(2005•河西区模拟)一些食物的近似pH如下:葡萄3.5-4.5,苹果2.9-3.3,牛奶6.3-6.6,鸡蛋清7.6-8.0.下列说法正确的是( )
A.胃酸过多的人应多食苹果
B.葡萄汁能使紫色石蕊变红
C.牛奶和鸡蛋清为碱性物质
D.苹果汁的酸性比葡萄汁弱 开心就好21年前1
开心就好21年前1 -
 波龙 共回答了16个问题
波龙 共回答了16个问题 |采纳率87.5%解题思路:当溶液的pH等于7时,呈中性.当溶液的pH大于7时,呈碱性.当溶液的pH小于7时,呈酸性.
石蕊试液遇酸性溶液变红,遇碱性溶液变蓝,遇中性溶液不变色.
当溶液的pH小于7时,随着pH的减小酸性增强.A、苹果的pH小于7,显酸性,胃酸过多的人应少食苹果,错误;
B、葡萄汁的pH小于7,显酸性,能使紫色石蕊试液变红,正确;
C、牛奶的pH小于7,显酸性,鸡蛋清的pH大于7,为碱性物质,错误;
D、苹果汁的pH小于葡萄汁的pH,酸性比葡萄汁强,错误.
故选:B.点评:
本题考点: 溶液的酸碱性与pH值的关系.
考点点评: 解答本题要掌握溶液的酸碱性和溶液pH大小之间的关系,然后再根据具体物质的水溶液的酸碱性进行分析、判断,从而得出正确的结论.1年前查看全部
- (2014•河西区模拟)某研究性学习小组研究 NaOH溶液与H2SO4溶液是否恰好中和,取少量反应后的溶液于试
(2014•河西区模拟)某研究性学习小组研究 NaOH溶液与H2SO4溶液是否恰好中和,取少量反应后的溶液于试管中,分别用不同试剂进行实验.下列方法及结论错误的是( )
实验序号 所用试剂 现象和结论 A pH试纸 pH=7,恰好中和 B 锌粒 有气泡产生,则H2SO4过量 C CuSO4溶液 有蓝色沉淀,则NaOH过量 D Ba(NO3)2溶液 有白色沉淀,则H2SO4溶液过量
A.A
B.B
C.C
D.D redarrowmissile1年前1
redarrowmissile1年前1 -
 可怜快乐 共回答了10个问题
可怜快乐 共回答了10个问题 |采纳率90%解题思路:硫酸与氢氧化钠反应生成硫酸钠和水,硫酸钠呈中性,当硫酸剩余时呈酸性,可根据酸的化学性质来检验硫酸是否有剩余,当氢氧化钠有剩余时可根据氢氧化钠的性质检验.A、硫酸与氢氧化钠恰好完全反应生成硫酸钠和水,硫酸钠呈中性,pH为7,故A正确;
B、只有当硫酸剩余时,硫酸与锌粒反应才产生气泡,故B正确;
C、只有氢氧化钠过量时,硫酸铜与氢氧化钠反应生成蓝色沉淀,故C正确;
D、当硫酸不过量时,硫酸与氢氧化钠反应生成的硫酸钠也会和氯化钡反应生成硫酸钡白色沉淀,故D错误;
故选D.点评:
本题考点: 中和反应及其应用;酸的化学性质;碱的化学性质.
考点点评: 本题考查酸碱中和反应后溶液中溶质的判断,掌握酸碱盐的化学性质是解答本题的关键,检验剩余物质时注意干扰离子的存在.1年前查看全部
- 河西区2011~2012的高二下学期期末化学卷子答案
河西区2011~2012的高二下学期期末化学卷子答案
下列物质是烃的衍生物
最好有过程的图 麦兜pp1年前1
麦兜pp1年前1 -
 我的裤袜 共回答了17个问题
我的裤袜 共回答了17个问题 |采纳率94.1%看不到题目.1年前查看全部
- (2014•河西区三模)甲乙两个同学进行定点投篮游戏,已知他们每一次投篮投中的概率均为[2/3],且各次投篮的结果互不影
(2014•河西区三模)甲乙两个同学进行定点投篮游戏,已知他们每一次投篮投中的概率均为[2/3],且各次投篮的结果互不影响.甲同学决定投5次,乙同学决定投中1次就停止,否则就继续投下去,但投篮次数不超过5次.
(1)求甲同学至少有4次投中的概率;
(2)求乙同学投篮次数ξ的分布列和数学期望. 宠瓜皮一辈子1年前1
宠瓜皮一辈子1年前1 -
 openwing 共回答了17个问题
openwing 共回答了17个问题 |采纳率94.1%解题思路:(1)甲同学至少有4次投中的概率P=P(x=4)+P(x=5);
(2)由题意知x=1,2,3,4,5,分别求出相应的概率,即可得到ξ的分布列与期望.(1)设甲同学在5次投篮中,有x次投中,“至少有4次投中”的概率为P,则
P=P(x=4)+P(x=5)=
C45(
2
3)4(1−
2
3)+
C55(
2
3)5=[112/243].…(4分)
(2)由题意ξ=1,2,3,4,5.
P(ξ=1)=[2/3],P(ξ=2)=[1/3×
2
3]=[2/9],P(ξ=3)=[1/3]×[1/3×
2
3]=[2/27],P(ξ=4)=[1/3]×[1/3]×[1/3×
2
3]=[2/81],P(ξ=5)=(
1
3)4=[1/81].
ξ的分布列为
ξ 1 2 3 4 5
P [2/3] [2/9] [2/27] [2/81] [1/81]…(8分)
ξ的数学期望Eξ=1×[2/3]+2×[2/9]+3×[2/27]+4×点评:
本题考点: 离散型随机变量的期望与方差;等可能事件的概率.
考点点评: 本题考查离散型随机变量的分布列与期望,解题的关键是确定变量的取值,理解变量取值的含义,属于中档题.1年前查看全部
- (2012•河西区模拟)关于声现象,下列说法正确的是( )
(2012•河西区模拟)关于声现象,下列说法正确的是( )
A.声音在不同介质中的传播速度相同
B.声音是电磁波,它可以在真空中传播
C.用超声波能粉碎人体内的结石,说明声波具有能量
D.高速公路两旁安装的隔音板是为了减弱噪声的传播 casdhy1年前1
casdhy1年前1 -
 不识相逢 共回答了22个问题
不识相逢 共回答了22个问题 |采纳率81.8%解题思路:(1)声音在不同介质中传播的速度是不同的,同一种介质中,温度对声音的传播速度有影响.
(2)声音的传播需要介质,声音不能在真空中传播,电磁波可以在真空中传播.
(3)声音既能够传递信息,也能够传递能量.
(4)防治噪声的途径,从三方面考虑:①在声源处;②在传播过程中;③在人耳处.A、不同的介质中,声音传播的速度是不同的,一般情况下,声音在固体中传播的最快,在气体中传播的最慢;同一种介质中,温度不同时声音的传播速度也不同.故错误.
B、声音不是电磁波,不能在真空中传播.故错误.
C、医生用超声波粉碎人体内的结石,说明声波能够传递能量.故正确.
D、道路旁安装隔音板是在传播过程中减弱噪声;故正确.
故选C、D.点评:
本题考点: 声音在不同介质中的传播速度;声音的传播条件;防治噪声的途径;声与能量.
考点点评: 此题考查了声音的传播、声音具有能量、减弱噪声的方法,是一道声学基础题.1年前查看全部
- (2012•河西区模拟)下列四个实例中,能够使蒸发减慢的是( )
(2012•河西区模拟)下列四个实例中,能够使蒸发减慢的是( )
A.将新收获的玉米摊开晾晒
B.将湿手伸到干手器下方吹
C.将湿衣服晾在通风向阳处
D.将新鲜的黄瓜装入塑料袋 紫枫01041年前1
紫枫01041年前1 -
 simonsaid 共回答了13个问题
simonsaid 共回答了13个问题 |采纳率100%A、将新收获的玉米摊开,增大了物体的表面积,会加快蒸发;故本选项不合题意.
B、干手器下吹出的是热风,可以提高湿手上水分的温度,可以加快湿手上方的空气流动速度,会加快蒸发.故本选项不合题意.
C、把湿衣服放在通风处,加快了液体表面空气的流动,向阳,提高了液体的温度,这些措施,加快了液体的蒸发.故本选项不合题意.
D、用塑料袋把新鲜的黄瓜装起来,黄瓜表面的空气不再流动,从而减慢蒸发;故本选项符合题意.
故选D.1年前查看全部
- (2014•河西区三模)光的偏振现象说明光是横波,下列现象中能反映光的偏振特性的是( )
(2014•河西区三模)光的偏振现象说明光是横波,下列现象中能反映光的偏振特性的是( )
A. 一束自然光相继通过两个偏振片,以光束为轴旋转其中一个偏振片,透射光的强度发生变化
B. 一束自然光入射到两种介质的分界面上,当反射光与折射光线之间的夹角恰好是90°时,反射光是偏振光
C. 日落时分,拍摄水面下的景物,在照相机镜头前装上偏振光片可以使景象更清晰
D. 通过手指间的缝隙观察日光灯,可以看到彩色条纹 tiaotiao11年前1
tiaotiao11年前1 -
 幽幽小虫 共回答了19个问题
幽幽小虫 共回答了19个问题 |采纳率89.5%解题思路:偏振光具有的性质是光子的振动具有方向性.当两个偏振片的偏振方向夹角增大时,透射光的强度减弱.A、一束自然光相继通过两个偏振片,以光束为轴旋转其中一个偏振片,当看到透射光的强度发生变化时,则说明光的振动方向与传播方向相垂直.能反映光的偏振特性,故A正确;
B、一束自然光入射到两种介质的表面时,一定有反射光线.如果折射光线与反射光线垂直,反射光为偏振光.故B正确;
C、在日落时分,拍摄水面下的景物,在照相机镜头前装上偏振光片,由于反射光太强,偏振光强,加偏振片可以将反射的偏振光过滤,使图象清晰.故C正确;
D、通过手指间缝隙观察日光灯,看到彩色条纹是光的衍射现象,而不是偏振现象,所以D是错误.
故选:ABC.点评:
本题考点: 光的偏振;光的衍射.
考点点评: 通过日常生活中的事实,让我们更能理解光的偏振与光的衍射.1年前查看全部
- (2012•河西区模拟)弟弟是2003年2月29日出生的.______.
 136653204431年前1
136653204431年前1 -
 aplib 共回答了25个问题
aplib 共回答了25个问题 |采纳率80%解题思路:先判断出2003年是闰年还是平年,平年二月份只有28天,由此判断.2003÷4=500…3;
有余数,2003年是平年,这一年的2月份只有28天,没有2月29日.
故答案为:错误.点评:
本题考点: 平年、闰年的判断方法.
考点点评: 本题主要考查了平年和闰年的判断方法:年份除以4(整百的年份除以400),如果有余数就是平年,没有余数就是闰年.1年前查看全部
- (2014•河西区二模)某家庭用一个标有“220V 1000W”的电热水器来烧水,该电热水器正常工作1200
(2014•河西区二模)某家庭用一个标有“220V 1000W”的电热水器来烧水,该电热水器正常工作1200s,可将质量为5kg温度为20℃的水加热到40℃.求这段时间内[水的比热容为4.2×103J/(kg•℃)]
(1)水吸收的热量;
(2)电热水器消耗的电能;
(3)电热水器加热时的热效率. lily1109001年前1
lily1109001年前1 -
 黑色的恨 共回答了15个问题
黑色的恨 共回答了15个问题 |采纳率80%解题思路:(1)知道水的质量和比热容以及温度的变化,根据Q吸=cm(t-t0)求出水吸收的热量;
(2)电热水器正常工作时的功率和额定功率相等,根据W=Pt求出消耗的电能;
(3)根据η=
×100%求出电热水器加热时的热效率.Q吸 W (1)水吸收的热量:
Q吸=cm(t-t0)
=4.2×103J∕(kg•℃)×5kg×(40℃-20℃)
=4.2×105J;
(2)电热水器消耗的电能:
W=Pt=1000W×1200s=1.2×106J;
(3)电热水器加热时的热效率:
η=
Q吸
W×100%=
4.2×105J
1.2×106J×100%=35%.
答:(1)水吸收的热量为4.2×105J;
(2)电热水器消耗的电能为1.2×106J;
(3)电热水器加热时的热效率为35%.点评:
本题考点: 电功与热量的综合计算.
考点点评: 本题考查了电功与热量的综合计算,涉及到吸热公式和电功公式、效率公式的应用,要注意用电器正常工作时的功率和额定功率相等.1年前查看全部
- (2014•河西区一模)下列4个图象中,能正确反映对应变化关系的是( )
(2014•河西区一模)下列4个图象中,能正确反映对应变化关系的是( )
A.
向一定量稀盐酸中加入氢氧化钠溶液
B.
向一定量硫酸和硫酸铜混合溶液中加入过量的氢氧化钠溶液
C.
用等质量、等溶质质量分数的双氧水制取氧气
D.
向饱和澄清石灰水中加入固体CaO(恢复至原温度) 3712510151年前1
3712510151年前1 -
 昱昊炅昊 共回答了18个问题
昱昊炅昊 共回答了18个问题 |采纳率83.3%解题思路:A、考虑酸碱中和反应;
B、硫酸和硫酸铜溶液中逐滴加入氢氧化钠溶液,开始由于硫酸的存在,不会生成沉淀;只有在硫酸不剩的情况下,硫酸铜才会和氢氧化钠反应生成氢氧化铜沉淀;
C、用等质量、等浓度的双氧水制取氧气,产生氧气的质量相同,而加入催化剂则反应速率大.
D、掌握氢氧化钙的溶解度受温度的变化趋势、氧化钙的化学性质等并能灵活运用.A、向一定量稀盐酸中加入氢氧化钠溶液,图形正确.故A正确;
B、硫酸和硫酸铜溶液中逐滴加入氢氧化钠溶液,开始由于硫酸的存在,不会生成沉淀;只有在硫酸不剩的情况下,硫酸铜才会和氢氧化钠反应生成氢氧化铜沉淀.应该开始一段无沉淀,之后沉淀生成,最后水平.故B错误;
C、用等质量、等浓度的双氧水制取氧气,产生氧气的质量相同,加入催化剂则反应速率大,不会出现氧气质量不同的情况.故C错误.
D、向饱和石灰水中加入生石灰后,充分搅拌后,使温度恢复到原温度,CaO与H2O生成Ca(OH)2,溶剂水的质量减少;因为温度不变,溶剂减少,溶质析出,溶液质量减少,故D错误.
故选:A.点评:
本题考点: 中和反应及其应用;催化剂的特点与催化作用;生石灰的性质与用途;碱的化学性质.
考点点评: 掌握质量守恒定律的内容及其应用;掌握金属活动性顺序及其应用;了解溶液的酸碱性与PH值的关系.1年前查看全部
- (2011•河西区一模)在一个密闭的钢筒内有甲、乙、丙、丁四种物质,在电火花作用下,发生充分反应,测得反应前后各物质的质
(2011•河西区一模)在一个密闭的钢筒内有甲、乙、丙、丁四种物质,在电火花作用下,发生充分反应,测得反应前后各物质的质量如下:
已知甲的相对分子质量为丁的2倍,则该反应的化学方程式中甲与丁的化学计量数之比为( )甲 乙 丙 丁 反应前质量/g 64 10 1 25 反应后质量/g 54 37 9
A.1:2
B.1:1
C.2:1
D.2:3 求知小生1年前1
求知小生1年前1 -
 allmoneygomyhome 共回答了15个问题
allmoneygomyhome 共回答了15个问题 |采纳率100%解题思路:根据质量守恒定律,由物质质量的增减可确定反应物和生成物;由增减量的多少可确定反应物和生成物的质量关系,再结合甲、丁的相对分子质量关系得出本题答案.根据质量守恒定律,由表中乙、丙质量增加,可确定乙、丙为生成物,共增加了(54-10)g+(37-1)g=80g,
丁减少了(25-9)g=16g,减少的质量还差(80-16)g=64g,由此可知64g甲完全反应无剩余.即甲、丁反应时的质量比为64g:16g=4:1.
设该反应的化学方程式中甲与丁的化学计量数的比为m:n,又知甲的相对分子质量为丁的2倍,则2m:n=4:1,解得m:n=2:1.
故选C.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题主要考查质量守恒定律,通过反应中物质的质量变化确定了反应物和生成物,再结合物质的相对分子质量关系,得出反应中物质的化学计量数之比,从而加深了对质量守恒定律的理解和应用.1年前查看全部
- (2009•河西区)求未知数x.
(2009•河西区)求未知数x.
12×3+5x=56
7x+[1/5]=[2/3]
[8/9x−
x=275 9  heatedspring1年前0
heatedspring1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2009•河西区一模)下面列举的事例中正确的是( )
(2009•河西区一模)下面列举的事例中正确的是( )
A.开普勒发明,万有引力定律和行星的运动规律
B.爱因斯坦发明了光子学说和相对论
C.亚里士多德认为物体下落的快慢与物体的轻重无关
D.普朗克在前人研究电磁感应理论的基础上建立了完善的电磁理论 RainBabe1年前1
RainBabe1年前1 -
 wcpzy 共回答了28个问题
wcpzy 共回答了28个问题 |采纳率89.3%解题思路:正确解答本题的关键是:了解高中的重要物理学史,知道各个重要规律的发现者以及重要规律发现的历史背景、使用条件等.A、开普勒发现行星的运动规律,牛顿发现万有引力定律.故A错误
B、爱因斯坦发明了光子学说和相对论,故B正确
C、亚里士多德认为物体下落的快慢与物体的轻重有关,故C错误
D、麦克斯韦在前人研究电磁感应理论的基础上建立了完善的电磁理论,故D错误
故选B.点评:
本题考点: 物理学史.
考点点评: 对于物理学史部分,在平时学习中不可忽视,要不断的积累和平时注意多加记忆,否则很容易出错.1年前查看全部
- (2014•河西区三模)光的偏振现象说明光是横波,下列现象中能反映光的偏振特性的是( )
(2014•河西区三模)光的偏振现象说明光是横波,下列现象中能反映光的偏振特性的是( )
A.一束自然光相继通过两个偏振片,以光束为轴旋转其中一个偏振片,透射光的强度发生变化
B.一束自然光入射到两种介质的分界面上,当反射光与折射光线之间的夹角恰好是90°时,反射光是偏振光
C.日落时分,拍摄水面下的景物,在照相机镜头前装上偏振光片可以使景象更清晰
D.通过手指间的缝隙观察日光灯,可以看到彩色条纹 fyt1234561年前1
fyt1234561年前1 -
 野鹤zaihu 共回答了19个问题
野鹤zaihu 共回答了19个问题 |采纳率94.7%解题思路:偏振光具有的性质是光子的振动具有方向性.当两个偏振片的偏振方向夹角增大时,透射光的强度减弱.A、一束自然光相继通过两个偏振片,以光束为轴旋转其中一个偏振片,当看到透射光的强度发生变化时,则说明光的振动方向与传播方向相垂直.能反映光的偏振特性,故A正确;
B、一束自然光入射到两种介质的表面时,一定有反射光线.如果折射光线与反射光线垂直,反射光为偏振光.故B正确;
C、在日落时分,拍摄水面下的景物,在照相机镜头前装上偏振光片,由于反射光太强,偏振光强,加偏振片可以将反射的偏振光过滤,使图象清晰.故C正确;
D、通过手指间缝隙观察日光灯,看到彩色条纹是光的衍射现象,而不是偏振现象,所以D是错误.
故选:ABC.点评:
本题考点: 光的偏振;光的衍射.
考点点评: 通过日常生活中的事实,让我们更能理解光的偏振与光的衍射.1年前查看全部
- (2013•河西区一模)如图所示,压缩弹簧,弹簧可以将小球弹起.谭索同学就“弹簧将小球弹起的高度与哪些因素有关?”提出了
 (2013•河西区一模)如图所示,压缩弹簧,弹簧可以将小球弹起.谭索同学就“弹簧将小球弹起的高度与哪些因素有关?”提出了如下猜想:(以下所有弹簧被压缩后都未超过其弹性的限度)
(2013•河西区一模)如图所示,压缩弹簧,弹簧可以将小球弹起.谭索同学就“弹簧将小球弹起的高度与哪些因素有关?”提出了如下猜想:(以下所有弹簧被压缩后都未超过其弹性的限度)
猜想一:弹簧将小球弹起的高度可能与被压缩弹簧的材料有关;
猜想二:弹簧将小球弹起的高度可能与小球的质量有关;
猜想一:弹簧将小球弹起的高度可能与弹簧被压缩的长度有关;
(1)为了验证猜想一,实验器材有质量不同的小球若干个和材料不同、外形完全相同的弹簧多根,此外还需要的测量工具是______.他设计的探究猜想一的方案如下:
①将A、B两根外形完全相同,材料不同的弹簧分别置于水平桌面上;
②将小球置于弹簧A的上端,按下小球,使弹簧被压缩的长度为5cm,松手后小球被弹起,记下小球弹起的高度h1;
③再将同一小球置于弹簧B的上端,按下小球,使弹簧被压缩的长度为6cm,松手后小球被弹起,记下小球弹起的高度h2;
④比较h1、h2的大小,就可初步得出弹簧将小球弹起的高度是否与被压缩弹簧的材料有关了.
谭索同学探究方案中存在的主要问题是:______
(2)请你说出在小球被弹起的过程中能量是如何转化的(不计空气阻力).______. sky10m1年前1
sky10m1年前1 -
 风之子55 共回答了17个问题
风之子55 共回答了17个问题 |采纳率82.4%解题思路:(1)由实验的要求可以看出,实验过程中需要测量弹簧压缩的长度以及小球被弹起的高度,因此还需要测量长度的工具--刻度尺;
从猜想中可以看出,小球弹起的高度可能与多个因素有关,因此,应从控制变量法的角度进行分析,看实验过程是否符合要求;
(2)在小球能量的转化过程中,主要包括弹性势能、动能和重力势能,根据其变化情况进行分析即可.(1)因为实验中要测量小球弹起的高度和弹簧压缩的长度,所以还需要增加一样测量工具,即刻度尺;
从实验过程可以看出,A弹簧被压缩的长度为5cm,而B弹簧被压缩的长度为6cm,这不符合控制变量法的要求,所以存在的主要问题是:没有控制弹簧两次被压缩的长度相等(或没有将弹簧压缩相同的长度).
(2)在小球被弹起的过程中,小球一开始由于被压缩形变而具有了弹性势能,弹起过程中,弹性势能转化为动能、在上升过程中动能再逐渐转化为重力势能.
故答案为:
(1)刻度尺; 没有控制弹簧两次被压缩的长度相等(或没有将弹簧压缩相同的长度);
(2)弹簧的弹性势能转化为小球的动能,小球的动能再转化为重力势能.点评:
本题考点: 控制变量法与探究性实验方案.
考点点评: (1)首先要明确本实验中一共提出了三个猜想,即三个因素都有可能影响小球弹起的高度,因此,在实验中要注意运用控制变量法;同时,刻度尺是本实验中必不可少的测量工具.
(2)在本实验的整个过程中,主要是机械能之间的转化,包括弹性势能、动能和重力势能,分析时一定要从小球、弹簧的形状和运动状态角度进行分析,防止混乱.1年前查看全部
- (2006•河西区二模)下列做法中符合安全用电常识的是( )
(2006•河西区二模)下列做法中符合安全用电常识的是( )
A.用湿抹布擦试亮着的电灯泡
B.有人触电时,马上用手将触电者拉开
C.保险丝烧断后可用铜丝代替
D.不能用剪刀或没有绝缘套的钳子剪带电的电线 优子19831年前1
优子19831年前1 -
 Jr_o7 共回答了18个问题
Jr_o7 共回答了18个问题 |采纳率77.8%解题思路:(1)安全用电的原则是:不靠近高压带电体(室外、高压线、变压器旁),不接触低压带电体;
(2)人体触电的途径有直接触电或间接触电.A、因为湿抹布是导体,当用湿抹布接触带电体时,可能会使电源通过人体与大地形成通路,不符合安全用电原则;
B、发现有人触电应立即切断电源或用干燥的木杆将人与火线分开,不符合安全用电原则;
C、用铜丝代替保险丝,会使得当家庭电路中电流过大时不能熔断起不到切断电路的作用,不符合安全用电原则;
D、剪刀或没有绝缘套的钳子都属于导体,当用剪刀或没有绝缘套的钳子剪带电的电线,会发生触电事故,因此不能用剪刀或没有绝缘套的钳子剪带电的电线,符合安全用电原则.
故选D.点评:
本题考点: 安全用电原则.
考点点评: 本题考查的是日常生活中的一些安全用电常识,要掌握安全用电的原则:不接触低压带电体,不靠近高压带电体.1年前查看全部
- (2011•河西区二模)2011年安徽春晚舞台上,广州军区战士杂技团表演的《东方天鹅》将芭蕾舞的高雅、优美与杂技的高难度
 (2011•河西区二模)2011年安徽春晚舞台上,广州军区战士杂技团表演的《东方天鹅》将芭蕾舞的高雅、优美与杂技的高难度技巧揉为一体,赢得了观众的阵阵掌声.如图所示是“天鹅”轻盈立在“王子”肩上的情景.若女演员的质量为45kg,脚尖与男演员肩膀接触面积约为1×10-3m2,男演员的质量为65kg,双脚与地面的接触面积约为3.5×10-2m2.
(2011•河西区二模)2011年安徽春晚舞台上,广州军区战士杂技团表演的《东方天鹅》将芭蕾舞的高雅、优美与杂技的高难度技巧揉为一体,赢得了观众的阵阵掌声.如图所示是“天鹅”轻盈立在“王子”肩上的情景.若女演员的质量为45kg,脚尖与男演员肩膀接触面积约为1×10-3m2,男演员的质量为65kg,双脚与地面的接触面积约为3.5×10-2m2.
求:
(1)女演员的重力;
(2)图中所示情况男演员对地面的压强. fenfyudeng1年前0
fenfyudeng1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2012•河西区一模)某同学探究发酸性干电池内黑色固体物质的组成并回收利用,实验过程如下图所示.
(2012•河西区一模)某同学探究发酸性干电池内黑色固体物质的组成并回收利用,实验过程如下图所示.
下列有关叙述正确的是( )
A.①、②、③、④中玻璃棒均起到搅拌作用
B.取少许②所得滤液于试管中,滴加硝酸银溶液,产生白色沉淀,可推知黑色固体中含有氯化钠
C.取少许②所得滤液于试管中,滴加氢氧化钠溶液,试管口处湿润的红色石蕊试纸未变蓝色,可推知黑色固体中不含铵盐
D.取少许④所得滤渣于试管中,现象如图⑤所示,可推知黑色固体中含有MnO2 4g5fg1年前1
4g5fg1年前1 -
 yuzhiwei1985 共回答了24个问题
yuzhiwei1985 共回答了24个问题 |采纳率91.7%解题思路:A.根据玻璃棒的作用判断;
B.能和硝酸银反应生成白色沉淀的物质中含有氯元素;
C.向含有铵根离子的溶液中滴加氢氧化钠溶液,如果不加热,则氮元素以一水合氨形式存在;
D.二氧化锰是黑色固体,能作双氧水的催化剂.A.②、③中玻璃棒起引流作用,故A错误;
B.能和硝酸银反应生成白色沉淀,说明滤液中含有氯离子,而不能确定黑色固体中含氯化钠,故B错误;
C.向含有铵根离子的溶液中滴加氢氧化钠溶液,如果不加热,则氮元素以一水合氨形式存在,所以取少许②所得滤液于试管中,滴加氢氧化钠溶液,试管口处湿润的红色石蕊试纸未变蓝色,不能推知黑色固体中不含铵盐,故C错误;
D.二氧化锰是黑色固体,能作双氧水的催化剂,灼烧后的滤渣能加快双氧水分解产生氧气,所以黑色固体是二氧化锰,故D正确;
故选D.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了基本实验操作及离子的检验,难度不大,熟悉中学阶段常见阴阳离子的检验方法,如氯离子、硫酸根离子、钠离子、钾离子、铵根离子等.1年前查看全部
- (2012•河西区一模)如图为实验室常用的制备和收集气体的装置,根据所学知识回答下列问题.
(2012•河西区一模)如图为实验室常用的制备和收集气体的装置,根据所学知识回答下列问题.

(1)实验室用加热高锰酸钾的方法制备并收集到干燥的氧气时,应选用的装置是______(填序号),反应的化学方程式为2KMnO4
K2MnO4+MnO2+O2↑△ .2KMnO4;检验集气瓶中氧气已集满的方法为______.
K2MnO4+MnO2+O2↑△ .
(2)B是实验室制备二氧化碳气体的装置图,写出仪器a的名称:______.检查此装置的气密性时,关闭弹簧夹,从仪器a注入一定量的______使a中的液面高于试管内的液面,静止一段时间后,若看到仪器a内______,则表明B装置气密性良好.
(3)图F所示装置可用来测量生成CO2的体积,其中在水面上放一层植物油的目的是______,植物油上方原有的空气对实验的结果______(填“有”或“没有”)明显影响.
(4)做空气中氧气含量测定的实验装置如G图所示,下列说法正确的是______(填序号).
A、选用红磷是因为反应可以耗尽氧气,生成固态的五氧化二磷
B、燃烧匙中的红磷可以换成硫和木炭
C、燃烧匙中的红磷越多,水位升高越高
D、本实验可以证明空气中含有N2、O2、CO2和稀有气体. 苹果香蕉梨1年前1
苹果香蕉梨1年前1 -
 洋洋61 共回答了19个问题
洋洋61 共回答了19个问题 |采纳率89.5%解题思路:(1)根据反应物的状态和反应条件选择发生装置,根据气体的溶解性和密度选择合适的收集方法;加热高锰酸钾产生锰酸钾、二氧化锰和氧气;验满氧气的方法是:将带火星的木条放置在集气瓶口,看木条能否复燃;
(2)熟练掌握常见的化学仪器名称及用途;检验此套装置气密性的方法是:“两孔变一孔法”,即:关闭弹簧夹,从长颈漏斗注入一定量的水使长颈漏斗中的液面高于试管内的液面,静止一段时间后,若看到长颈漏斗内液面没有下降,则表明装置气密性良好;
(3)根据实验目的及二氧化碳的水溶性进行分析植物油的作用,根据排水法测气体的体积的原理判断空气的影响;
(4)根据空气中氧气含量测定的原理在密闭容器内消耗氧气,测量容器内气体体积的减少量确定氧气的含量.因此在选择消耗氧气的药品时,应考虑能与空气中的氧气反应而不与空气中的其他成分反应,生成物不能为气体;还应注意装置不漏气,药品的量要足,读数时温度要回到原来的温度等.(1)用加热高锰酸钾的方法制备氧气的发生装置的特点属于固体加热型的A装置;而要收集到干燥的氧气,则采用向上排空气法(D)收集,而不能采用排水法;
加热高锰酸钾产生锰酸钾、二氧化锰和氧气,反应的化学方程式为:2KMnO4
△
.
K2MnO4+MnO2+O2↑;
检验集气瓶中氧气已集满的方法为:将带火星的木条放置在集气瓶口,如果能够复燃,说明氧气已集满;
(2)a是长颈漏斗;检验此套装置气密性的方法是:关闭弹簧夹,从长颈漏斗注入一定量的水使长颈漏斗中的液面高于试管内的液面,静止一段时间后,若看到长颈漏斗内液面没有下降,则表明装置气密性良好;
(3)图F是采用排水法测二氧化碳的体积,用量筒测量水的体积从而测二氧化碳的体积;二氧化碳能溶于水,所以要在水的上方放一层植物油,防止二氧化碳溶于水.排水法测气体体积的原理是利用排出水的体积和进入装置中的气体的体积相等的原理进行的,所以在没有二氧化碳生成时,盛水的集气瓶中压强和外界大气压是相等,当有二氧化碳气体生成时,集气瓶内气体压强增大,将水排出,所以油上方的空气对实验结果没有影响;
(4)A、因红磷能与空气中的氧气反应生成固态P2O5,固体生成物的体积对实验结果几乎没有影响,因此A正确;
B、因硫或木炭与氧气反应生成物都为气体,不能用于该实验,故B不正确.
C、红磷的量足,能耗尽氧气,当氧气耗尽后,反应停止,水位不会继续上升,故C不正确;
D、该实验中红磷只与空气中氧气反应,所以只能确定空气中有氧气,剩余气体的成分不能确定,因此D不正确.
故选A.
故答案为:(1)AD2KMnO4
△
.
K2MnO4+MnO2+O2↑将带火星的木条放置在集气瓶口,如果能够复燃,说明氧气已集满
(2)长颈漏斗水液面没有下降
(3)防止因CO2 溶于水而引起体积测量结果不准确(偏小)没有
(4)A点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;空气组成的测定;实验室制取氧气的反应原理;氧气的检验和验满;二氧化碳的实验室制法.
考点点评: 本题主要考查学生对实验室制备氧气和二氧化碳的反应原理、发生装置的选择、收集装置的选择及有关气体体积测定方法的掌握情况.1年前查看全部
- (2014•河西区二模)某同学将15.0g碳酸钙粉末置于250mL、87.0g的烧杯中,向其中加入105.4g某浓度的稀
(2014•河西区二模)某同学将15.0g碳酸钙粉末置于250mL、87.0g的烧杯中,向其中加入105.4g某浓度的稀盐酸,充分反应后,称得烧杯及其剩余物的总质量为203.0g.则:
(1)反应生成的二氧化碳的质量为______g;
(2)烧杯内各物质的名称分别为______;
(3)列式计算所得溶液的溶质质量分数. BB宝贝1年前1
BB宝贝1年前1 -
 迎接dddd 共回答了18个问题
迎接dddd 共回答了18个问题 |采纳率94.4%解题思路:(1)根据总质量守恒来计算产生的二氧化碳的质量;
(2)因烧杯中有剩余物,则可判断碳酸钙与酸反应时酸不足,然后利用化学反应来判断烧杯中的物质;
(3)利用二氧化碳的质量代入化学反应方程式进行计算生成的氯化钙的质量,根据总质量守恒来计算溶液的质量,再计算溶质的质量分数.(1)该反应中只有二氧化碳是气体,则二氧化碳的质量为15.0g+87.0g+105.4g-203.0g=4.4g,故答案为:4.4;
(2)因烧杯中有固体剩余,即碳酸钙有剩余,碳酸钙和盐酸反应生成氯化钙的溶液,则烧杯中的物质有碳酸钙、氯化钙、水,故答案为:碳酸钙、氯化钙、水;
(3)设生成的氯化钙的质量为x,反应的碳酸钙的质量为y,则
CaCO3+2HCl═CaCl2+CO2↑+H2O
100111 44
y x4.4g
[111/x=
44
4.4g],[100/y=
44
4.4g]
解得x=11.1g,y=10g,
反应后溶液的质量为10g+105.4g-4.4g=111g,
所得溶液的溶质质量分数为[11.1g/111g]×100%=10%,
答:所得溶液的溶质质量分数为10%.点评:
本题考点: 根据化学反应方程式的计算;溶液的概念、组成及其特点;有关溶质质量分数的简单计算;质量守恒定律及其应用.
考点点评: 本题考查利用化学反应方程式的计算,二氧化碳的质量是解答的关键,学生应学会利用质量守恒的方法来解答.1年前查看全部
- (2013•河西区一模)下列实验操作中,不正确的是( )
(2013•河西区一模)下列实验操作中,不正确的是( )
A.
稀释浓硫酸
B.
检查装置气密性
C.
加热液体
D.
蒸发食盐水 桃桃天使1年前1
桃桃天使1年前1 -
 芝道64 共回答了20个问题
芝道64 共回答了20个问题 |采纳率100%解题思路:A、根据浓硫酸的稀释方法进行分析判断.
B、根据检查装置气密性的方法进行分析判断.
C、根据给试管中的液体加热的方法进行分析判断.
D、根据蒸发操作的注意事项进行分析判断.A、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;一定不能把水注入浓硫酸中;图中所示操作错误.
B、检查装置气密性的方法:把导管的一端浸没在水里,双手紧贴容器外壁,若导管口有气泡冒出,装置不漏气;图中所示操作正确.
C、给试管中的液体加热时,用酒精灯的外焰加热试管里的液体,且液体体积不能超过试管容积的[1/3],图中所示操作正确.
D、蒸发时,应用玻璃棒不断搅拌,以防液体受热不均匀,造成液体飞溅,图中所示操作正确.
故选A.点评:
本题考点: 浓硫酸的性质及浓硫酸的稀释;给试管里的液体加热;蒸发与蒸馏操作;检查装置的气密性.
考点点评: 本题难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操作的注意事项是解答此类试题的关键.1年前查看全部
- (2012•河西区模拟)甲数除以乙数,商是1.2,乙数和甲数的比是______,甲数比乙数多[1/5][1/5].
 唐选的qq1年前1
唐选的qq1年前1 -
 永远的直球投手 共回答了17个问题
永远的直球投手 共回答了17个问题 |采纳率88.2%解题思路:根据甲数除以乙数,商是1.2,可把乙数看作“1”,则甲数为(1×1.2),进而写出乙数与甲数的比,再化成最简比;要求甲数比乙数多几分之几,也就是求甲数比乙数多的部分占乙数的几分之几;据此列式解答.乙数和甲数的比:
1:(1×1.2),
=1:1.2,
=10:12,
=5:6;
甲数比乙数多:
(6-5)÷5,
=1÷5,
=[1/5];
故答案为:5:6,[1/5].点评:
本题考点: 比的意义;分数除法.
考点点评: 解答此题应先判断出“1”,进而得出另一个数,然后根据比的意义进行解答;注意:求一个数比另一个数多(或少)几(或百)分之几,也就是求一个数比另一个数多(或少)的部分占另一个数的几(或百)分之几.1年前查看全部
- (2012•河西区模拟)列式计算
(2012•河西区模拟)列式计算
(1)一个数的80%比2.5的4倍少2,这个数是多少?
(2)甲数的[2/3]和乙数的[7/8]相等,乙数是[4/7],甲数是多少? hf_zhuzhu1年前1
hf_zhuzhu1年前1 -
 zuoren08 共回答了15个问题
zuoren08 共回答了15个问题 |采纳率73.3%解题思路:(1)比2.5的4 倍少2的数是2.5×4-2=8,也就是一个数的80%是8,求这个数,列式为8÷80%,计算即可;
(2)由题意,甲数×[2/3]=乙数×[7/8],把甲数看作单位“1”,则乙数相当于甲数的[2/3]÷[7/8]=[16/21],已知乙数是[4/7],那么甲数是[4/7]÷[16/21],计算即可.(1)(2.5×4-2)÷80%,
=(10-2)÷0.8,
=8÷0.8,
=10;
答:这个数是10.
(2)[4/7]÷([2/3]÷[7/8]),
=[4/7]÷[16/21],
=[4/7]×[21/16],
=[3/4];
答:甲数是[3/4].点评:
本题考点: 整数、分数、小数、百分数四则混合运算;分数的四则混合运算.
考点点评: 第(1)题,关键是求出比2.5的4 倍少2的数是多少,然后根据“已知一个数的几分之几是多少,求这个数”的应用题的方法解答;
第(2)题,关键的是把谁看作单位“1”计算较简便,在本题中,求的是甲数,因此,把甲数看作单位“1”较简便.1年前查看全部
- (2014•河西区三模)已知函数f(x)=[1/3ax3−14x2+cx+d(a,c,d∈R)满足f(0)=0,f′(1
(2014•河西区三模)已知函数f(x)=[1/3ax3−
x21 4  澈澈8151年前1
澈澈8151年前1 -
 aliciaicecream 共回答了10个问题
aliciaicecream 共回答了10个问题 |采纳率100%解题思路:(1)待定系数法求函数解析式,由f(0)=0,f'(1)=0,且f'(x)≥0在R上恒成立列出三个方程,解出a、b、c
(2)一元二次不等式解法,注意根之间比较,考查分类讨论思想
(3)考查二次函数最值问题,考查分类讨论思想,对m进行讨论,看对称轴与区间的关系.(1)∵f(0)=0,∴d=0
∴f′(x)=ax2−
1
2x+c及f'(1)=0,有a+c=
1
2
∵f'(x)≥0在R上恒成立,即ax2−
1
2x+c≥0恒成立
显然a=0时,上式不能恒成立∴a≠0,函数f'(x)=ax2−
1
2x+
1
2−a是二次函数
由于对一切x∈R,都有f'(x)≥0,于是由二次函数的性质可得
a>0
(−
1
2)2−4a(
1
2−a)≤0.
即
a>0
a2−
1
2a+
1
16≤0,即
a>0
(a−点评:
本题考点: 导数的运算;函数恒成立问题;利用导数求闭区间上函数的最值;其他不等式的解法.
考点点评: 本题考查导数的综合运用,具体包含导数的计算、恒成立问题、不等式的解法、待定系数法求函数解析式、二次函数最值问题,分类讨论思想,对学生有一定的能力要求,属于难题.1年前查看全部
- (2011•河西区一模)甲、乙两种物质的溶解度曲线如图所示,回答下列问题:
 (2011•河西区一模)甲、乙两种物质的溶解度曲线如图所示,回答下列问题:
(2011•河西区一模)甲、乙两种物质的溶解度曲线如图所示,回答下列问题:
(1)40℃时,50g水中最多可溶解甲物质______g.
(2)______℃时,甲、乙两种物质的溶解度相等.
(3)将30℃时,甲、乙二种物质各自的饱和溶液的温度均升高到40℃后,______ (填“甲”或“乙”)的溶液中溶质的质量分数小.
(4)将40℃时,分别装有甲、乙两种物质饱和溶液的试管同时放入装有冷水的烧杯中,出现如图现象,则B试管中是______(填“甲”或“乙”)物质. on-the-way1年前1
on-the-way1年前1 -
 niangmen 共回答了22个问题
niangmen 共回答了22个问题 |采纳率95.5%解题思路:(1)固体物质的溶解度是指一定温度下,100g水中最多溶解某物质的质量;
(2)交点表示该温度下两物质的溶解度相同;
(3)根据溶解度曲线可知:甲的溶解度随温度的升高而增大,乙的溶解度随温度的升高而减小;
(4)甲的溶解度随温度的升高而增大,乙的溶解度随温度的升高而减小;B有溶质析出,说明B的溶解度随温度的降低而减小.(1)40℃时甲的溶解度是30g,即100g水中最多溶解30g甲,所以50g水中最多可溶解甲物质15g;
(2)由图知:30℃时甲、乙两种物质的溶解度相等;
(3)甲的溶解度随温度的升高而增大,乙的溶解度随温度的升高而减小;30℃时二者的溶解度相同,则其饱和溶液中溶质的质量分数也相同;将30℃时,甲、乙二种物质各自的饱和溶液的温度均升高到40℃后,甲变为不饱和溶液,溶质的质量分数不变,与30℃时相同;乙有溶质析出,故溶质的质量分数变小;
(4)B有溶质析出,说明B的溶解度随温度的降低而减小,而甲的溶解度曲线与此吻合;
故答案为:
(1)15;(2)30;(3)乙;(4)甲.点评:
本题考点: 固体溶解度曲线及其作用;溶质的质量分数、溶解性和溶解度的关系.
考点点评: 了解溶解度的概念、明确交点的含义、物质的溶解度随温度的变化趋势,并能灵活应用是解答此题的关键.1年前查看全部
- (2012•河西区一模)相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g)⇌2XY
(2012•河西区一模)相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g)⇌2XY3(g)△H=-92.6kJ•mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
下列叙述不正确的是( )容器
编号起始时各物质物质的量/mol 达平衡时体系能量的变化 X2 Y2 XY3 ① 1 3 0 放热 23.15kJ ② 0.6 1.8 0.8 Q(Q>0)
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量为Q
C.达平衡时,两个容器中XY3的物质的量浓度均为2 mol•L-1
D.若容器①体积为0.20 L,则达平衡时放出的热量大于23.15 kJ admw1年前1
admw1年前1 -
 joe6000 共回答了20个问题
joe6000 共回答了20个问题 |采纳率85%解题思路:A.平衡常数只与温度有关;
B.由达平衡时①放出的热为23.15 kJ,计算平衡时X2、Y2和XY3的物质的量,分析②是否处于平衡状态或是向哪个方向进行,判断②是吸热还是放热,再根据转化率计算具体的值;
C.由达平衡时①放出的热为23.15 kJ,计算平衡时XY3的物质的量浓度,再根据两平衡是完全等效平衡解答;
D.从平衡移动的角度比较反应放出的热量与23.15kJ的关系.A.衡常数只与温度有关,温度不变,对同一反应平衡常数不变,故A正确;
B.①容器中放出23.15kJ热量,则生成氨气的物质的量为:[23.15kJ/92.6kJ/mol×2=0.5mol,
X2(g)+3Y2(g)⇌2XY3(g)
起始(mol):13 0
转化(mol):0.25 0.75 0.5
平衡(mol):0.75 2.25 0.5
可知平衡时①容器中X2、Y2和XY3的物质的量分别为0.75mol、2.25mol和0.5mol,②与①为完全等效平衡,所以,平衡时②容器中X2、Y2和XY3的物质的量也分别为0.75mol、2.25mol和0.5mol,可知②的反应向逆反应方向进行,反应过程需要吸收热,故B错误;
C.由B计算可知此时XY3的物质的量浓度均为
0.5mol
0.25L]=2mol/L,将②按化学计量数比换算成左边与①对应的物质的物质的量相等,恒温恒容下,两平衡是完全等效平衡,平衡时各物质的浓度相等,故C正确;
D.若容器①体积为0.20L,增大压强平衡向正反应方向移动,放出热量多,故D正确.
故选B.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡移动问题、等效平衡、反应热等问题,题目难度不大,注意B项根据计算分析,从等效平衡的角度判断反应进行的方向是解答该题的关键.1年前查看全部
- (2013•河西区二模)下列各组物质,按化合物、单质、混合物顺序排列的是( )
(2013•河西区二模)下列各组物质,按化合物、单质、混合物顺序排列的是( )
A.干冰、铁片、乙醇
B.空气、氮气、合金
C.烧碱、液氧、浓盐酸
D.纯碱、石墨、小苏打 寒监1年前1
寒监1年前1 -
 skya123 共回答了17个问题
skya123 共回答了17个问题 |采纳率76.5%解题思路:物质分为混合物和纯净物,混合物是由两种或两种以上的物质组成;纯净物是由一种物质组成.纯净物又分为单质和化合物.由同种元素组成的纯净物叫单质;由两种或两种以上的元素组成的纯净物叫化合物.A、干冰是固态的二氧化碳,属于化合物;铁片属于单质;乙醇属于化合物,故选项错误;
B、空气属于混合物;氮气属于单质;合金属于混合物,故选项错误;
C、烧碱是氢氧化钠的俗称,属于化合物;液氧属于单质;浓盐酸属于混合物,故选项正确;
D、纯碱是碳酸钠的俗称,属于化合物;石墨属于单质;小苏打是碳酸氢钠的俗称,属于化合物,故选项错误.
故选C.点评:
本题考点: 单质和化合物的判别;纯净物和混合物的判别.
考点点评: 本考点考查了物质的分类,要加强记忆混合物、纯净物、单质、化合物、氧化物等基本概念,并能够区分应用.1年前查看全部
- (2014•河西区模拟)硼化钒一空气电池是目前储电能力最高的电池,其示意图如图所示,该电池工作时的反应为4VB2+11O
 (2014•河西区模拟)硼化钒一空气电池是目前储电能力最高的电池,其示意图如图所示,该电池工作时的反应为4VB2+11O2═4B2O3+2V2O5.下列说法正确的是( )
(2014•河西区模拟)硼化钒一空气电池是目前储电能力最高的电池,其示意图如图所示,该电池工作时的反应为4VB2+11O2═4B2O3+2V2O5.下列说法正确的是( )
A.电极X为电池负极
B.OH-向电极X移动
C.1mol VB2反应转移的电子数目是锂电池1mol Li反应转移的11倍
D.VB2极的电极反应为2VB2+22e-+11H2O═2B2O3+V2O5+22OH- 换个MJ再来1年前1
换个MJ再来1年前1 -
 cat6 共回答了18个问题
cat6 共回答了18个问题 |采纳率88.9%解题思路:A、根据原电池中负极失电子来判断;
B、原电池溶液中阴离子向负极移动;
C、根据电池总反应判断1mol VB2转移的电子,根据Li的化合价变化判断Li转移的电子数;
D、负极上是VB2失电子发生氧化反应.A、硼化钒-空气燃料电池中,VB2在负极失电子,氧气在正极上得电子,所以X为正极,故A错误;
B、原电池中,阴离子向负极移动,阳离子向正极移动,所以溶液中的OH-向另一极移动,故B错误;
C、硼化钒一空气电池反应为4VB2+11O2═4B2O3+2V2O5,1mol VB2反应消耗[11/4]molO2转移电子数为11mol,1mol Li反应转移1mol电子,所以1mol VB2反应转移的电子数目是锂电池1mol Li反应转移的11倍,故C正确;
D、负极上是VB2失电子发生氧化反应,则VB2极发生的电极反应为:2VB2+22OH--22e-═V2O5+2B2O3+11H2O,故D错误.
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池的工作原理,题目难度中等,本题注意把握电极反应式的书写和电子守恒的应用,正确判断离子的定向移动.1年前查看全部
- (2009•河西区二模)回答下列问题.
(2009•河西区二模)回答下列问题.
(1)利用新技术能将不锈钢加工成柔软的金属丝,它可以和棉纤维一起编织成防辐射的服装,这是利用了金属的______ (填序号).①延展性;②导电性;③导热性;④熔沸点高;⑤耐腐蚀性
(2)工业上冶炼铁原理之一是用一氧化碳还原氧化铁,该反应的化学方程式为3CO+Fe2O3
2Fe+3CO2高温 .3CO+Fe2O3.目前世界上每年因锈蚀而报废的金属设备和材料相当于钢铁年产量的20%~40%.防止钢铁锈蚀的措施是______(填一种).
2Fe+3CO2高温 .
(3)对X、Y、Z三种金属活动性的实验探究过程如下:①取大小相等的三种金属片,分别放入相同的CuSO4溶液中,一段时间后,X、Z表面出现红色物质,Y没有现象.②取大小相等的X、Z两种金属片,分别放入相同的稀盐酸中,X、Z表面都产生气泡,但X产生气泡的剧烈程度比Z明显的多.则X、Y、Z三种金属的活动性顺序是______. 甜甜教教主1年前1
甜甜教教主1年前1 -
 飞羊11 共回答了21个问题
飞羊11 共回答了21个问题 |采纳率90.5%解题思路:(1)根据金属的用途考虑它的性质;(2)根据方程式的写法和防锈措施考虑;(3)根据金属与盐反映的条件和金属与酸反应的比较考虑本题.解;(1)将不锈钢加工成柔软的金属丝是利用了延展性,和棉纤维一起编织成防辐射的服装是利用了耐腐蚀性;
(2)一氧化碳还原氧化铁反应物是一氧化碳和氧化铁,生成物是铁和二氧化碳,用观察法配平即可,反应条件是高温;防锈措施有保持铁制品表面洁净干燥,在表面形成一层保护膜如:刷油、涂漆镀上一层其它金属,改变内部结构形成合金;
(3)取大小相等的三种金属片,分别放入相同的CuSO4溶液中,一段时间后,X、Z表面出现红色物质,Y没有现象,说明X、Z排在了铜的前面,Y排在了铜的后面;取大小相等的X、Z两种金属片,分别放入相同的稀盐酸中,X、Z表面都产生气泡,但X产生气泡的剧烈程度比Z明显的多,说明X比Z活泼.
故答案为:(1)①⑤;(2)3CO+Fe2O3
高温
.
2Fe+3CO2;保持铁制品表面洁净干燥,在表面镀一层保护膜等;(3)X>Z>Y.点评:
本题考点: 金属的物理性质及用途;金属活动性顺序及其应用;铁的冶炼;金属锈蚀的条件及其防护.
考点点评: 通过回答本题知道了防止生锈的方法,熟悉了方程式的书写,知道了金属与盐反应时说明金属排在了盐中金属的前面,金属与酸反应越剧烈金属越活泼.1年前查看全部
- (2014•河西区三模)设Sn为等比数列{an}的前n项和,8a2+a5=0,则S5S2等于( )
(2014•河西区三模)设Sn为等比数列{an}的前n项和,8a2+a5=0,则
等于( )S5 S2
A. 11
B. 5
C. -8
D. -11 hslhaha41年前1
hslhaha41年前1 -
 张王李 共回答了11个问题
张王李 共回答了11个问题 |采纳率90.9%解题思路:由题意可得数列的公比q,代入求和公式化简可得.设等比数列{an}的公比为q,(q≠0)
由题意可得8a2+a5=8a1q+a1q4=0,解得q=-2,
故
S5
S2=
a1(1−q5)
1−q
a1(1−q2)
1−q=
1−q5
1−q2=
1−(−2)5
1−(−2)2=-11
故选D点评:
本题考点: 等比数列的性质.
考点点评: 本题考查等比数列的性质,涉及等比数列的求和公式,属中档题.1年前查看全部
- (2012•河西区模拟)李阿姨家买来一桶金龙油,一月份用去这桶油的[7/20],二月份用去这桶油的[2/5],剩[5/2
(2012•河西区模拟)李阿姨家买来一桶金龙油,一月份用去这桶油的[7/20],二月份用去这桶油的[2/5],剩[5/2]千克.这桶油原来有多少千克?
 taotaoyang12121年前1
taotaoyang12121年前1 -
 me_lyf 共回答了25个问题
me_lyf 共回答了25个问题 |采纳率84%解题思路:把这桶油的总重量看成单位“1”,先求出还剩下这桶油的几分之几,它对应的数量是[5/2]千克,由此用除法求出原来的重量.[5/2]÷(1-[7/20]-[2/5]),
=[5/2]÷[1/4],
=10(千克);
答:这桶油原来有10千克.点评:
本题考点: 分数四则复合应用题.
考点点评: 本题的关键是找出单位“1”,并找出数量对应的单位“1”的几分之几,用除法就可以求出单位“1”的量.1年前查看全部
- (2009•河西区二模)用四个相同的等腰梯形拼成如图所示的四边形ABCD,则∠A=______度.
 hkdtj1年前1
hkdtj1年前1 -
 退休老vv007 共回答了16个问题
退休老vv007 共回答了16个问题 |采纳率100%解题思路:设∠A为x,则可用式子表示出其它三个角,根据四边形的内角和公式即可求得∠A的度数.设等腰梯形底角为x,A处度数为x,B处度数为x,C处度数为2x,D处度数为2x,
则6x=360°,∴x=60°,∴∠A=60°.点评:
本题考点: 等腰梯形的性质.
考点点评: 本题涉及等腰梯形和四边形内角和的理解及运用.1年前查看全部
- (2014•河西区一模)如图所示,LOM为一45°角折线,折线内有一方向垂直于纸面向里的匀强磁场,一边长为l的正方形导线
 (2014•河西区一模)如图所示,LOM为一45°角折线,折线内有一方向垂直于纸面向里的匀强磁场,一边长为l的正方形导线框沿垂直于OM的方向以速度v作匀速直线运动,在t=0的刻恰好位于图中所示位置.以逆时针方向为导线框中电流的正方向,在下面四幅图中能够正确表示电流-时间(I-t)关系的是(时间以[l/v]为单位)( )
(2014•河西区一模)如图所示,LOM为一45°角折线,折线内有一方向垂直于纸面向里的匀强磁场,一边长为l的正方形导线框沿垂直于OM的方向以速度v作匀速直线运动,在t=0的刻恰好位于图中所示位置.以逆时针方向为导线框中电流的正方向,在下面四幅图中能够正确表示电流-时间(I-t)关系的是(时间以[l/v]为单位)( )
A.
B.
C.
D.
 异日丹青1年前1
异日丹青1年前1 -
 谈心妍 共回答了15个问题
谈心妍 共回答了15个问题 |采纳率100%解题思路:分三段时间研究感应电动势和感应电流:由楞次定律判断出感应电流的方向.根据E=BLv分析感应电动势与时间的关系,再由欧姆定律分析感应电流与时间的关系.在0-1s内,线框产生的感应电动势不变,感应电流也不变,由楞次定律判断可知感应电流的方向为逆时针,为正值;
在1-2s内,线框上边出磁场到线框的对角线经过磁场的上边界,此过程由楞次定律判断可知感应电流的方向为顺时针,为负值,t时刻线框中电流为 I=-
Bv(t−1)•v
R,t增大,I增大;
在2-3s内,线框的对角线经过磁场的上边界到完全出磁场,此过程由楞次定律判断可知感应电流的方向为顺时针,为负值,t时刻线框中电流为 I=-
B[l−v(t−2)]v
R,t增大,I减小;由数学知识可知,C正确.
故选C点评:
本题考点: 导体切割磁感线时的感应电动势;闭合电路的欧姆定律.
考点点评: 本题是楞次定律和E=BLv的综合应用,公式E=Blv中,l是有效的切割长度.1年前查看全部
- (2014•河西区模拟)尺规作图作∠AOB的平分线方法如下:以O为圆心,任意长为半径画弧交OA,OB于C,D,再分别以点
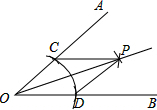 (2014•河西区模拟)尺规作图作∠AOB的平分线方法如下:以O为圆心,任意长为半径画弧交OA,OB于C,D,再分别以点C,D为圆心,以大于[1/2]CD长为半径画弧,两弧交于点P,作射线OP.由作法得△OCP≌△ODP的根据是( )
(2014•河西区模拟)尺规作图作∠AOB的平分线方法如下:以O为圆心,任意长为半径画弧交OA,OB于C,D,再分别以点C,D为圆心,以大于[1/2]CD长为半径画弧,两弧交于点P,作射线OP.由作法得△OCP≌△ODP的根据是( )
A.SAS
B.ASA
C.AAS
D.SSS 宗大师门下一cc1年前1
宗大师门下一cc1年前1 -
 lvan521 共回答了12个问题
lvan521 共回答了12个问题 |采纳率100%解题思路:认真阅读作法,从角平分线的作法得出△OCP与△ODP的两边分别相等,加上公共边相等,于是两个三角形符合SSS判定方法要求的条件,答案可得.∵以O为圆心,任意长为半径画弧交OA,OB于C,D,即OC=OD;
以点C,D为圆心,以大于[1/2]CD长为半径画弧,两弧交于点P,即CP=DP;
在△OCP和△ODP中,
OC=OD
OP=OP
CP=DP,
∴△OCP≌△ODP(SSS).
故选D.点评:
本题考点: 作图—基本作图;全等三角形的判定.
考点点评: 本题考查三角形全等的判定方法,判定两个三角形全等的一般方法有:SSS、SAS、ASA、AAS、HL.注意:AAA、SSA不能判定两个三角形全等,判定两个三角形全等时,必须有边的参与,若有两边一角对应相等时,角必须是两边的夹角1年前查看全部
- (2009•河西区一模)A,B两名同学在5次数学考试中的成绩统计如下面的茎叶图所示,若A,B两人的平均成绩分别是xA,x
 (2009•河西区一模)A,B两名同学在5次数学考试中的成绩统计如下面的茎叶图所示,若A,B两人的平均成绩分别是xA,xB,观察茎叶图,下列结论正确的是( )
(2009•河西区一模)A,B两名同学在5次数学考试中的成绩统计如下面的茎叶图所示,若A,B两人的平均成绩分别是xA,xB,观察茎叶图,下列结论正确的是( )
A.xA<xB,B比A成绩稳定
B.xA>xB,B比A成绩稳定
C.xA<xB,A比B成绩稳定
D.xA>xB,A比B成绩稳定 mm永远对1年前1
mm永远对1年前1 -
 2006200620062006 共回答了16个问题
2006200620062006 共回答了16个问题 |采纳率93.8%解题思路:根据所给的茎叶图,看出甲和乙的成绩,算出两个人的平均分,结果平均分甲大于乙,再算出两个人的成绩单方差,乙的方差大于甲的方差,得到结果.由茎叶图知,可知道甲的成绩为96、91、92、103、128,平均成绩为102;
乙的成绩为99、108、107、114、112、,平均成绩为106;
从茎叶图上可以看出B的数据比A的数据集中,B比A成绩稳定,
故选A.点评:
本题考点: 茎叶图;众数、中位数、平均数;极差、方差与标准差.
考点点评: 本题考查茎叶图,考查平均数和方差,是一个统计问题,茎叶图的优点是可以保存数据的原始状态,没有数据损失,从茎叶图上可以看出两组数据的稳定程度.1年前查看全部
- (2008•河西区三模)甲、乙、丙三所中学分别有学生1200人,1500人,1800人,现用分层抽样的方法抽出一个容量为
(2008•河西区三模)甲、乙、丙三所中学分别有学生1200人,1500人,1800人,现用分层抽样的方法抽出一个容量为n的样本,样本中甲学校有40人,那么此样本的容量n=______.
 cheerupray1年前1
cheerupray1年前1 -
 朝阳sa 共回答了13个问题
朝阳sa 共回答了13个问题 |采纳率100%解题思路:由题意可得,每个个体被抽到的概率为 [40/1200]=[1/30],再由 [n/1200+1500+1800]=[1/30 ],可得n的值.由题意可得,每个个体被抽到的概率为 [40/1200]=[1/30],
再由 [n/1200+1500+1800]=[1/30 ],可得n=150,
故答案为 150.点评:
本题考点: 分层抽样方法.
考点点评: 本题主要考查分层抽样的定义和方法,抽样过程中每个个体被抽到的可能性相同,这是解决一部分抽样问题的依据,样本容量、总体个数、每个个体被抽
到的概率,这三者可以知二求一,属于基础题.1年前查看全部
- (2013•河西区二模)用电压为220V的电源向远处某工地的一盏标着“PZ200V 60W”的电灯L供电.由于导线很长
 (2013•河西区二模)用电压为220V的电源向远处某工地的一盏标着“PZ200V 60W”的电灯L供电.由于导线很长,电阻不能忽略,其等效电阻记为R,如图所示,此时灯泡L消耗的实验功率为55W,则导线消耗的实验功率等于还是小于5W?请你利用所学的物理知识分析说明.(电源电压保持不变,不考虑温度对灯泡电阻的影响)
(2013•河西区二模)用电压为220V的电源向远处某工地的一盏标着“PZ200V 60W”的电灯L供电.由于导线很长,电阻不能忽略,其等效电阻记为R,如图所示,此时灯泡L消耗的实验功率为55W,则导线消耗的实验功率等于还是小于5W?请你利用所学的物理知识分析说明.(电源电压保持不变,不考虑温度对灯泡电阻的影响)  da1531年前1
da1531年前1 -
 xiaoyao0111 共回答了19个问题
xiaoyao0111 共回答了19个问题 |采纳率94.7%解题思路:已知导线和灯泡串联,导线电阻较大,说明电路电阻变大,根据公式P=
可知,电路的总功率变小,已知灯泡的实际功率从而可以判断导线消耗的功率.U2 R 如果导线电阻忽略时,灯接在恒定电压的电源上功率是60W;
因为导线和灯泡串联,当导线上电阻较大时,即电路中的电阻变大,
由P=
U2
R可知电路消耗的总功率变小,即小于60W,
而灯泡的实际功率是55W,所以此时导线消耗功率只能小于5W.点评:
本题考点: 电功率的计算;电阻的串联.
考点点评: 本题考查了电阻的串联特点和电功率公式的灵活运用,关键是能把灯泡和导线转化为串联电路来处理.1年前查看全部
- (2014•河西区模拟)现取含有氯化钠杂质的纯碱样品25g放入烧杯中,向烧杯中加入167g水使样品全部溶解,向向烧杯中加
(2014•河西区模拟)现取含有氯化钠杂质的纯碱样品25g放入烧杯中,向烧杯中加入167g水使样品全部溶解,向向烧杯中加入100g,氯化钙溶液,恰好完全反应,然后过滤,称得滤液的质量为272g,试计算:
(1)纯碱样品中氯化钠的质量分数.
(2)所得滤液中溶质的质量分数. scalyhugh1481年前1
scalyhugh1481年前1 -
 sofangbin 共回答了13个问题
sofangbin 共回答了13个问题 |采纳率92.3%解题思路:(1)据氯化钠、碳酸钠的性质,氯化钠不能与加入的氯化钙发生反应,碳酸钠与氯化钙生成碳酸钙沉淀和氯化钠,溶液减少的质量就是生成的碳酸钙的质量.根据生成沉淀碳酸钙的质量可计算样品中所含碳酸钠的质量,据此解答即可;
(2)恰好完全反应后所得溶液为氯化钠溶液,此时溶液中的溶质氯化钠由原固体中的氯化钠和反应后生成的氯化钠两部分构成,反应后溶液的质量可使用质量守恒定律的方法进行解决,以简化计算过程.由质量守恒定律可知,生成的碳酸钙的质量为:25g+167g+100g-272g=20g
设恰好完全反应时参加反应的碳酸钠的质量为x,反应生成的氯化钠质量为y
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100 117
x 20g y
[106/100=
x
20g]
x=21.2g
[100/20g=
117
y]
y=23.4g
(1)则纯碱中氯化钠的质量分数为:[25g−21.2g/25g]×100%=15.2%;
(2)反应后所得滤液中溶质的质量分数是:
23.4g+(25g−21.2g)
272g×100%=10%
答案:
(1)纯碱样品中氯化钠的质量分数为15.2%;
(2)反应后所得滤液中溶质的质量分数为10%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 在计算反应后所得溶液的溶质质量分数时,原混合固体中的氯化钠不要忘记算入溶质的质量,此题在这个地方设置一个小陷阱,这也是学生经常出错的地方.1年前查看全部
- (2014•河西区二模)要组织一次排球邀请赛,参赛的每两个各队之间都要比赛一场,根据场地和时间等条件,赛程计划安排7天,
(2014•河西区二模)要组织一次排球邀请赛,参赛的每两个各队之间都要比赛一场,根据场地和时间等条件,赛程计划安排7天,每天安排4场比赛,比赛组织者应邀请多少个队参赛?若设应邀请x个队参赛,可列出的方程为( )
A.x(x+1)=28
B.x(x-1)=28
C.[1/2]x(x+1)=28
D.[1/2]x(x-1)=28 陈金华1年前1
陈金华1年前1 -
 双月孤鸿 共回答了16个问题
双月孤鸿 共回答了16个问题 |采纳率93.8%解题思路:关系式为:球队总数×每支球队需赛的场数÷2=4×7,把相关数值代入即可.每支球队都需要与其他球队赛(x-1)场,但2队之间只有1场比赛,
所以可列方程为:[1/2]x(x-1)=28.
故选D.点评:
本题考点: 由实际问题抽象出一元二次方程.
考点点评: 本题考查了由实际问题抽象出一元二次方程,解决本题的关键是得到比赛总场数的等量关系,注意2队之间的比赛只有1场,最后的总场数应除以2.1年前查看全部
大家在问
- 1小学语文课怎样上才能算高效?
- 2求微积分方程xyy'=1_x的平方,的通解
- 31.某物质R和硫酸钠组成的固体混合物放入足量水,充分搅拌过滤后的到白色沉淀11.65g,经实验该白色沉淀不溶于稀硝酸,加
- 4两句名言我有2句名言不知道意思.一句是书犹药也,善读之可以医愚.--刘向 另一句是我扑在书上,就像饥饿的人扑在面包上.-
- 5(2014•吉林三模)抛物线y=4x2的焦点到准线的距离为[1/8][1/8].
- 6有35支铅笔和42本练习本,平均奖给三好学生,结果铅笔缺一支,练习本多2本,得奖的三好学生最多有多少人?
- 7定语从句 选哪个?为什么?The newly-founded company is faced with lots of
- 8负9的三次幂乘(负三分之二)的6次方乘(1+二分之三)的3次方 的解 带过程
- 9若[X]表示不超过X的最大整数,画出Y=[X](-3
- 10护士怎么用英语翻译
- 11突触在传递信号时,实现了电信号->化学信号->电信号的传换和传导,使下一个神经元产生?答案是兴奋...
- 12如何认识洋务运动的历史作用
- 13甲列车从A地开往B地,速度是60Km/h,乙列车同时从B地开往A地,速度是90km/h,已知A,B两地相距200Km,两
- 14请给我15篇英语作文吧,我初一人教.50词左右,带翻译最好,
- 15几道三元一次方程数学题1、有甲,乙,丙三种货物,若购甲4件、乙5件、丙1件共需要230元;若购甲7件、乙9件、丙1件共需
