电离能 :K+> Ar> Cl-?
 细薄阳光2022-10-04 11:39:542条回答
细薄阳光2022-10-04 11:39:542条回答为什么?

已提交,审核后显示!提交回复
共2条回复
 桃花劫 共回答了18个问题
桃花劫 共回答了18个问题 |采纳率77.8%- 最外层结构相同,正电荷数越多,电子就越难电离咯.
- 1年前
 without_you930 共回答了6个问题
without_you930 共回答了6个问题 |采纳率- 最外层结构相同,正电荷数越多,电子就越难电离咯.你说得对
- 1年前
相关推荐
- 第一电离能,第二电离能,第三电离能,分别在元素周期表上如何增大减小
第一电离能,第二电离能,第三电离能,分别在元素周期表上如何增大减小
最重要的是,特例!有些元素并不遵守趋大趋小的原则 jing03181年前2
jing03181年前2 -
 青城雪狼 共回答了25个问题
青城雪狼 共回答了25个问题 |采纳率84%全充满:s2、p6、d10、f14
半充满:p3、d5、f7
全空:s0、p0、d0、f0
凡是生成上述三种状态的,都相对较容易;
凡是破坏上述三种状态的,都相对较难.
它们是构成电离能反常的特例.
如第一电离能反常:N大于O,N是破坏p3半充满,而O是形成p3半充满;
再如,第一电离能反常:Mg大于Al,Mg是破坏s2全充满,而Al是形成s2半充满.1年前查看全部
- 电离能与元素最外层电子有什么关系
 山核桃20031年前1
山核桃20031年前1 -
 爱你的小狼狗 共回答了20个问题
爱你的小狼狗 共回答了20个问题 |采纳率90%电离能可以定量的比较气态原子失去电子的难易,电离能越大,原子越难失去电子,其金属性越弱;反之金属性越强.所以它可以比较元素的金属性强弱.影响电离能大小的因素是:有效核电荷、原子半径、和原子的电子构型.
电离能与电子层数有一定关系,电子数越多,说明原子半径越大,板子核对最外层电子的吸引力降低,容易电离失去,电离能较低;电离能与最外层电子数也有关,如:同一p轨域中的两个电子间存在一定的排斥作用,这种排斥作用有利于电子脱离原子;所以同一p轨域中的配对电子比单个电子更容易被电离.1年前查看全部
- 如何根据电离能来判断元素化合价如何根据电离能的数据表来判断这个元素为几价?
 zhaopuyue1年前1
zhaopuyue1年前1 -
 kiteinshy 共回答了15个问题
kiteinshy 共回答了15个问题 |采纳率86.7%一般来说,元素的电离能按照第一、第二……的顺序逐渐增加,如果突然增加的比较多,电离的难度增大,这里就是元素的通常的化合价.1年前查看全部
- Mg和Ca为什么有第五电离能
 xusong198504021年前1
xusong198504021年前1 -
 yyxx4230 共回答了12个问题
yyxx4230 共回答了12个问题 |采纳率91.7%有多少个电子就有第几电离能,只是像镁钙的第五电离能没有多大意义而已1年前查看全部
- 请回答下列问题:(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下: 电离能
请回答下列问题:
(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:电离能I 1 I 2 I 3 I 4 … In/kJ.mol -1 5781817274511578…
则该元素是 (填写元素符号)。
(2)基态锗(Ge)原子的电子排布式是 ,Ge的最高价氯化物分子式是 ,该元素可能的性质或应用有 ;
A.是一种活泼的金属元素 B.其电负性大于硫
C.其单质可作为半导体材料 D.其最高价氯化物的沸点低于其溴化物的沸点
(3)关于化合物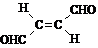 ,下列叙述正确的有
,下列叙述正确的有
A.分子间可形成氢键
B.分子中既有极性键又有非极性键
C.分子中有7个σ键和1个π键
D.该分子在水中的溶解度大于2-丁烯
(4)NaF的熔点 的熔点(填>、=或<),其原因是 。
的熔点(填>、=或<),其原因是 。 ZhengYuH1年前1
ZhengYuH1年前1 -
 westlife12 共回答了17个问题
westlife12 共回答了17个问题 |采纳率88.2%(1)Al
(2)1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 2 ;GeCl 4 ;CD
(3)BD
(4)>;两者均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,因此熔点较低
(1)从表中原子的第一至第四电离能可以看出,元素的第一、第二、第三电离能都较小,可失去3个电子,最高化合价为+3价,即最外层应有3个电子,应为铝元素。
(2)镓是32号元素,核外有32个电子,基态锗(Ge)原子原子的电子排布式为1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 2 ,Ge的最高价为+4价,氯化物分子式是GeCl 4 。
A.Ge是一种金属元素,但最外层电子数为4,金属性不强,故A错误;B.硫的其电负性大于硅,硅的电负性大于锗,所以锗的电负性小于硫,故B错误;C.锗单质是一种半导体材料,故C正确; D.氯化锗和溴化锗都是分子晶体,但氯化锗的相对分子质量小于溴化锗,则氯化锗沸点低于溴化锗的沸点。
(3)A.分子中不存在与电负性强的元素相连的氢原子,所以不存在氢键,故A错误;B.分子中碳碳键是非极性键,碳氢键、碳氧键是极性键,故B正确;C.1个单键是1个σ键,一个双键是1个σ键和1个π键,所以分子中有9个σ键和3个π键,故C错误;D.根据醛基比甲基更溶于水,所以分子红两个甲基被醛基取代,溶解度增大,故D正确。
(4)两者均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,因此熔点较低。1年前查看全部
- 化学;电负性和电离能既然电负性是得电子能力,电离能是失电子能力一般情况下,得电子能力与失电子能力相反,那么电负性和电离能
化学;电负性和电离能
既然电负性是得电子能力,电离能是失电子能力
一般情况下,得电子能力与失电子能力相反,那么电负性和电离能的递变规律怎么能相同呢 邦儿1年前2
邦儿1年前2 -
 DDMNLYX 共回答了18个问题
DDMNLYX 共回答了18个问题 |采纳率83.3%电负性是得电子能力,电离能是失电子能力
得电子能力越强的,失电子能力就越弱啊.
电离能分第一,第二等等,你的意思是.1年前查看全部
- 通过电离能,分析Mg和Al金属性的比较问题
通过电离能,分析Mg和Al金属性的比较问题
Mg和Al第一至第四电离能数据如下:Mg:738,1451,7733,10540;Al:578,1817,2745,11578.比较气态Mg原子和al原子的金属性.
答案上说Mg元素第一、第二电离能之和小于Al元素第一第二第三电离能之和,所以金属性Mg大于Al.但是书上讲的时候是说一般比较金属性(失电子的难易程度)只看第一电离能.那什么时候只需看第一电离能,什么时候还需要看后面的电离能呢?(如果只看第一电离能的话似乎就成了Al的金属性大于Mg了). ypcol1年前1
ypcol1年前1 -
 zxvcl2k3jlkgjsal 共回答了17个问题
zxvcl2k3jlkgjsal 共回答了17个问题 |采纳率94.1%Mg离子带正二价,AI离子带正三价
因为镁和铝原子成为离子失去的电子数不同
所以所需看的电离能层数不同1年前查看全部
- 为什么C的半径小于Cl,但C的电负性和第一电离能小于Cl
 tebeidewo1年前2
tebeidewo1年前2 -
 黄耀旭 共回答了15个问题
黄耀旭 共回答了15个问题 |采纳率80%氯的外层电子共7个,碳有4个,由于强烈的形成稳定的八隅体的倾向,氯具有强烈的得到一个电子的倾向,电负性较大.当然也不易失去电子,所以第一电离能也高.1年前查看全部
- 镁和铝的金属性强弱问题,看最高价碱性氧化物碱性强弱来判断,是Mg>Al,但是,金属性强弱,不应该是以电离能为判断依据的么
镁和铝的金属性强弱问题,
看最高价碱性氧化物碱性强弱来判断,是Mg>Al,但是,金属性强弱,不应该是以电离能为判断依据的么?可是Al的电离能要小于Mg啊?所以,物质性质上来判断,应该是Al>Mg啊?这是为什么? 粉红涟漪1年前2
粉红涟漪1年前2 -
 hhhyyy6666 共回答了17个问题
hhhyyy6666 共回答了17个问题 |采纳率94.1%Al的第二电离能大于Mg的(不能光看第一电离能的,还是电负性比较靠谱)
你去查查电负性表,鲍林标度Al是1.61,Mg是1.31,Al金属性弱些.
第一电离能是指一个气态原子失去一个电子形成一个气态离子所吸收的能量
根据这个定义可以看出,第一电离能越大,失去电子的能力就越弱,说明这种元素的还原性越弱,金属性也越弱
但是也不尽然,镁和铝就是一个典型的例外,
铝核外本来是3s2 3p1,失去一个电子后,核外电子变成 3s2
这是一种稳定的结构,物质当然趋向于形成稳定的结构,所以铝失去第一个电子比镁要容易,但是以后的第二电离能,就是铝比镁大了
这种特例,还有O<N ,S<P 原因与上面所说的相似
熔点是由晶格能所决定的,镁和铝的晶体结构不一样,原子半径也不一样,因此造成了他们熔沸点的不同.
所以不能看他们的第一电离能1年前查看全部
- 处于基态的氢原子的电离能是多少ev?如何计算电离能?
 20岁女人1年前1
20岁女人1年前1 -
 shuang3xia 共回答了14个问题
shuang3xia 共回答了14个问题 |采纳率92.9%基态氢原子的电离能是 13.59844ev.
H及类H元素 电离能计算公式:
E =[13.6085(z+0) -0.0075](z-0) -0.003 (z为核电荷数,当z=7时,误差率 -0.04%)1年前查看全部
- 金属非金属划分标准 根据电负性还是电离能
 yangleilei1631年前1
yangleilei1631年前1 -
 nihong1983 共回答了23个问题
nihong1983 共回答了23个问题 |采纳率100%一般认为,电负性大于1.8的是非金属元素,小于1.8的是金属元素,在1.8左右的元素既有金属性又有非金属性,在过渡元素中这个规律不适用.1年前查看全部
- 电负性 电离能 电子亲合能 以及 氧化性 还原性之间的关系.
 密码小于61年前2
密码小于61年前2 -
 mxl_gxm 共回答了21个问题
mxl_gxm 共回答了21个问题 |采纳率85.7%原子半径与非金属性,电离能等关系不大.只是电离能同周期自左至右增大,与原子半径减小的趋势一致,同族自上至下减小,与原子半径增大的趋势一致.
电负性大的元素通常是那些电子亲和能大的元素(非金属性强的元素),电负性小的元素通常是那些电离能小的元素(金属性强的元素).
电负性与电离能和电子亲和能之间的确存在某种联系,但不意味着可以混用.
摘自《无机化学》
微粒的化合价处于元素价态的最高价,只有氧化性,化合价处于最低价态只有还原性,处于中间价态的在一定条件下,一般来说既有氧化性又有还原性1年前查看全部
- 原子中电子在不同能级的电离能,和光电效应中的溢出功有什么联系吗?
 sys16161年前1
sys16161年前1 -
 51704452 共回答了15个问题
51704452 共回答了15个问题 |采纳率93.3%应该是一样的值.1年前查看全部
- 何谓电离能?何谓电负性?如题
 wawaw2281年前2
wawaw2281年前2 -
 liyukangken 共回答了11个问题
liyukangken 共回答了11个问题 |采纳率90.9%使气态的基态原子失去一个电子,变成带一个正电荷的气态离子所需的最低能量,称为该元素原子的第一电离能(I1);使气态的基态正一价离子失去一个电子,变成气态正二价离子所需的最低能量,称为第二电离能(I2);依次类推,还有第三、第四电离能I3、I4等,电离能的单位常用kJ/mol.例如:
电离能就是原子失去电子所吸收的能量 由失去的电子数分为第一、第二...电离能 电离能越大 原子活跃性越小
元素的原子吸引成键电子的相对能力可以用该元素的相对电负性来表示,简称电负性(X).原子吸引成键电子的能力越强,其电负性就越大;原子吸引成键电子的能力越弱,电负性就越小1年前查看全部
- 还有什么是基态的电离能,说 已知基态HE+的电离能为E=54.4EV.为使基态HE+进入激发态,入射光子所需最小能量为多
还有什么是基态的电离能,说 已知基态HE+的电离能为E=54.4EV.为使基态HE+进入激发态,入射光子所需最小能量为多少EV?若用该光照射逸出功为3.34ev的ZN板,逸出的光电子的最大初动能为多少ev?
我不明白这里说的基态电离能是指什么?这两问完全不会分析啊,说得详细一些,因为真的不懂 richardzhu1年前5
richardzhu1年前5 -
 zgdlzj 共回答了20个问题
zgdlzj 共回答了20个问题 |采纳率90%我就帮你解释这道题吧.
原子中电子的定态包括能级1、2、3..
其中1级是基态,其他的能级是激发态.
电子吸收能量从低能级跃迁到高能级,释放能量从高能级跃迁到低能级(这里吸收和释放的能量都是光子的形式,满足E=mc^2).如果吸收的能量高到使电子脱离了原子核的束缚,那么电子发生了电离,这个能量就是电离能(正值).我们说某个能级的能量就是电子从自由状态被原子核俘获到该能级所放出的能量的相反数(所以都是负值)
那么看你的问题
1.已知基态HE+的电离能为E=54.4EV.为使基态HE+进入激发态,入射光子所需最小能量为多少EV?
由 En=E1/(n^2) 其中E1是基态能量 -54.4EV(题中给的是电离能,就是定态能量的相反数),可以求出离他最近的激发态,也就是第二能级的能量E2(令n=2就好),然后ΔE=E2-E1就是增加的能量,也就是至少要吸收的啦.
2.若用该光照射逸出功为3.34ev的ZN板,逸出的光电子的最大初动能为多少ev?
该光的能量等于你在第一题中求出的ΔE.最大初动能 Ek=ΔE-W W是逸出功(这是课本上的公式啦,
所以你这两题就都做完啦.
看在我一字一句都是自己给你打出来的份上,支持我一下吧,1年前查看全部
- 电离能大小的问题Mg的电离能为什么大于Al的,可以用钻穿效应解释么?还有,S的电离能为什么比P的稍小些?
 dj96341年前1
dj96341年前1 -
 fg9326 共回答了23个问题
fg9326 共回答了23个问题 |采纳率95.7%你说的是第一电离能把.Mg第一电离能是失去S电子的,而Al是P电子的.当n相同时,P电子的能量高于S电子,所以n相同的P电子比S电子更容易失去,即此时P电子的电离能小于S电子.
S的电离能为什么比P的稍小些呢.因为磷的P电子排布是:↑ ↑ ↑,而硫的是↑↓ ↑ ↑.即磷是一种“半满”的相对稳定结构.如果失去一个电子,这中稳定结构就被破坏,所以电离时需要的能量高.而硫失去一个电子后就成了:
↑ ↑ ↑这样的相对稳定结构,所以电离需要的能量低.这样S的第一电离能就小于P.1年前查看全部
- 电子亲和能、电离能、电负性的关系?
电子亲和能、电离能、电负性的关系?
一直搞不懂,觉得好像电负性和电子亲和能不就是一样的么,都是反映得电子的能力啊,为什么氯比氟电子亲和能大,而氟的电负性又比氯大呢?不都是的电子能力么? 太平天子朝元日1年前2
太平天子朝元日1年前2 -
 fjtx021324 共回答了20个问题
fjtx021324 共回答了20个问题 |采纳率95%一个是指基态原子的吸引能力,一个是指在化合物中对电子的吸引能力1年前查看全部
- 已知X、Y是主族元素,I为电离能,单位是kJ•mol-1.请根据下表所列数据判断,错误的是( )
已知X、Y是主族元素,I为电离能,单位是kJ•mol-1.请根据下表所列数据判断,错误的是( )
元素 I1 I2 I3 I4 X 500 4 600 6 900 9 500 Y 580 1 800 2 700 11 600
A.元素X的常见化合价是+1价
B.元素Y是ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应 指间沙6171年前1
指间沙6171年前1 -
 lxwsq 共回答了13个问题
lxwsq 共回答了13个问题 |采纳率92.3%解题思路:由电离能数据可知,X可失去1个电子,原子最外层电子数为1,Y可失去3个电子,原子最外层有3个电子,Z难以失去电子,应为稀有气体元素.A.由电离能数据可知,X可失去1个电子,原子最外层电子数为1,常见化合价是+1,故A正确;
B.Y可失去3个电子,原子最外层有3个电子,是ⅢA族元素,故B正确;
C.X可失去1个电子,原子最外层电子数为1,与氯形成化合物时,化学式可能是XCl,X的化合价是+1,故C正确;
D.若Y为Al,与冷水不反应,故D错误.
故选D.点评:
本题考点: 元素电离能、电负性的含义及应用.
考点点评: 本题考查元素的电离能知识,题目难度不大,注意第一电离能与核外最外层电子的关系.1年前查看全部
- 化学中常见元素的电离能请给出序数1~20号的元素的电离能,还有Mn,Fe,Zn,Br,Rb,Sr,Ag,Ba,Pt,Au
化学中常见元素的电离能
请给出序数1~20号的元素的电离能,还有Mn,Fe,Zn,Br,Rb,Sr,Ag,Ba,Pt,Au,Hg,I,这些元素的电离能~同时也给出每个元素各自的第一,第二,第三……级电离能~还有,从这上面能发现什么规律吗? dxm1y71年前1
dxm1y71年前1 -
 青春远离地球 共回答了15个问题
青春远离地球 共回答了15个问题 |采纳率66.7%化学元素的电离能,你可到下面的网址看看.
http://www.hxu.edu.cn/partwebs/huaxuexi/qt/hxys/element-dln.htm
电离能也是可以计算的,只是现在教科书里还没有,具体你可上http://hi.baidu.com/lyglwc/blog/item/167701d2d20aaf269b5027b2.html 看看.1年前查看全部
- 化学的量子数,电离能.离子半径的题
化学的量子数,电离能.离子半径的题
1.np2np3与np2np4为什么np2np3第一电离能大?
2.一个元素的L层P级有一个电子.另一个元素M层P级有一个电子.为什么性质不相似?
3.第三周期中简单离子半径最小的为什么是Al? 近来过的好吗1年前2
近来过的好吗1年前2 -
 we_ui 共回答了13个问题
we_ui 共回答了13个问题 |采纳率92.3%这位同学我估计你是搞竞赛的,我给你点播一下吧,具体工作还得由你完成
1用slater规则计算就可以得出答案
2这个答案你也可以从量子数来解释,或者你也可以举出具体的例子来反驳,比如碳1S2,2S2,2P2和Al
1s2,2s2,2p6,3s2,3p1.,两个元素P电子的性质肯定不同
3,第三周期简单离子的最小半径,只需考虑金属元素,不用考虑非金属元素的,答案是Al3+1年前查看全部
- 存在两次电离,但一级电离能完全进行,二级电离是可逆的,这样的电解质是不是弱电解质
 rr秋1年前4
rr秋1年前4 -
 szdaveenglish 共回答了14个问题
szdaveenglish 共回答了14个问题 |采纳率100%一般看成是,这种物质比较常见的是硫酸和硒酸,通常情况下是把他们当成强电解质处理(两者二级电离的平衡常数的数量级都是10^-2,比较大).
希望对你有所帮助!1年前查看全部
- 第二电离能是指失去外层第二个电子放出的能量还是失去外层两个电子放出的能量?
 周球球1年前1
周球球1年前1 -
 二问 共回答了19个问题
二问 共回答了19个问题 |采纳率94.7%是第二个电子1年前查看全部
- 同周期中第一电离能有逐渐升高的趋势.那么其原子的能量越来越低吗?
同周期中第一电离能有逐渐升高的趋势.那么其原子的能量越来越低吗?
同周期中第一电离能有逐渐升高的趋势.是由于半径越来越小.原子核对其束缚能力越来越强.那么同周期原子能量越来越低吗?因为能量越低越稳定...所以才会有这种想法...这种想法成立吗?如果成立的话.为什么会出现能量越来越低的现象?但原子核电荷数不是越来越大吗? 紫紫ss1年前2
紫紫ss1年前2 -
 laozhizhi 共回答了16个问题
laozhizhi 共回答了16个问题 |采纳率87.5%首先,能量越低越稳定指的是电子.其次,没有原子能量这种说法.再次,就算有原子能量这种说法,氟会说,哥作为最强的氧化剂表示压力很大.所以第一电离能逐渐升高,只是说明其失去一个电子的能力越来越差,不能说明别的问题.1年前查看全部
- 如果氢离子的电离能是13.6ev,则Li2+的电离能是多少?
如果氢离子的电离能是13.6ev,则Li2+的电离能是多少?
求详细计算过程 我跋扈我嚣张1年前2
我跋扈我嚣张1年前2 -
 yangzhuonan 共回答了18个问题
yangzhuonan 共回答了18个问题 |采纳率88.9%9倍
能级是-R*Z^2/(n^2) R是常数,Z是质子数,n是能级
氢原子和锂2+离子电子能级相同n=1,所以电离能的比例等于质子数的平方比1年前查看全部
- 用电离能如何说明核外电子是分层排布的?
用电离能如何说明核外电子是分层排布的?
好像是因为能量突变什么的.麻烦说具体点 今世他生1年前1
今世他生1年前1 -
 smithr 共回答了18个问题
smithr 共回答了18个问题 |采纳率100%从一个主量子数到另一个主量子数时,电子能量相差大,即电离时能量突然增大很多.
而同一层中的电子能量相差要小很多,电离能相差就小很多.
有电离能突然增大的现象则是分层的.1年前查看全部
- (1)铝的第一电离能______铝的第二电离能(填等于、大于或小于)
(1)铝的第一电离能______铝的第二电离能(填等于、大于或小于)
(2)在同一个原子中,离核越近、n越小的电子层能量______.在同一电子层中,各亚层的能量按s、p、d、f的次序依次______.原子第三能层的能级分别为______. newhilton1年前1
newhilton1年前1 -
 liujing1017ai 共回答了18个问题
liujing1017ai 共回答了18个问题 |采纳率83.3%解题思路:(1)随着电子的逐个失去,阳离子所带正电荷变多,再失去一个电子需克服的电性引力增大,消耗的能量增多;
(2)离核较近的电子层有较低的能量,随着电子层数的增加,电子层的能量越来越大.(1)随着电子的逐个失去,阳离子所带正电荷变多,再失去一个电子需克服的电性引力增大,消耗的能量增多,所以铝的第一电离能小于铝的第二电离能,
故答案为:小于;
(2)离核较近的电子层有较低的能量,随着电子层数的增加,电子层的能量越来越大,所以在同一个原子中,离核越近、n越小的电子层能量越低;在同一电子层中,各亚层的能量按s、p、d、f的次序依次增大;原子第三能层的能级分别为s、p、d,
故答案为:越低;增大;s、p、d.点评:
本题考点: 元素电离能、电负性的含义及应用;原子核外电子排布.
考点点评: 本题考查了电离能、原子核外电子分层排布与能量关系,题目难度不大,注意对基础知识的积累.1年前查看全部
- 钠离子的电离能问题设Na原子到Na+离子所需第一电离能为E1,由Na+到Na2+所需第二电离能为E2,由Na2+到Na3
钠离子的电离能问题
设Na原子到Na+离子所需第一电离能为E1,由Na+到Na2+所需第二电离能为E2,由Na2+到Na3+所需第三电离能为E3,则问E2:E1与E3:E2那个更大? 布林1年前1
布林1年前1 -
 docaju 共回答了18个问题
docaju 共回答了18个问题 |采纳率94.4%E2:E1 > E3:E2
1到2是跨层,所以2可能是1的5-10倍
2、3是同层,虽然数值大,但几乎没有倍数关系
你问的是比值,所以看的是谁和谁差别更大!1、2差别大1年前查看全部
- (2009•海口模拟)Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:
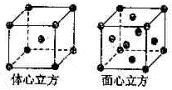 (2009•海口模拟)Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:
(2009•海口模拟)Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:
回答下列问题:元素 Mn Fe 电离能/kJ•mol-1 I1 717 759 I2 1509 1561 I3 3248 2957
(1)Mn元素价电子层的电子排布式为______,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是______.
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物,则与Fe原子或离子形成配合物的分子或离子应具备的条件是______.
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,据此判断三氯化铁晶体为______晶体.
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为______,其中体心立方晶胞空间利用率为______. 半空烟火1年前1
半空烟火1年前1 -
 308783365 共回答了17个问题
308783365 共回答了17个问题 |采纳率88.2%解题思路:(1)根据核外电子排布规律书写;原子轨道处于半满、全满、全空时能量更低稳定;
(2)①根据配位键形成条件分析,由Fe原子或离子的核外电子排布图可知,Fe原子或离子含有空轨道,配位体中的中心原子含有孤对电子;
(3)根据信息可知三氯化铁的晶体为分子晶体;
(4)利用均摊法计算.(1)Mn元素为25号元素,核外电子排布式为[Ar]3d54s2,所以价层电子排布式为3d54s2,
由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少,
故答案为:3d54s2;由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少;
(2)Fe原子或离子含有空轨道.所以,与Fe原子或离子形成配合物的分子或离子应具有孤对电子,故答案为:具有孤对电子;
(3)三氯化铁,其熔点:282℃,沸点315℃,在300℃以上升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.符号分子晶体的特征,故为三氯化铁分子晶体,
故答案为:分子;
(4)面心立方结构晶胞中铁原子数为1+6×[1/2]=4;体心立方结构晶胞中铁原子数为1+8×[1/8]=2,属于两种结构的铁原子数之比为4:2=2:1,体心立方晶胞空间利用率为68%,
故答案为:2:1;68%.点评:
本题考点: 晶体的类型与物质熔点、硬度、导电性等的关系;配合物的成键情况;晶胞的计算.
考点点评: 本题考查电子排布式、电离能、晶体性质、晶胞等,难度较大,是对知识与能力综合考查,(4)是学生解答的难点.1年前查看全部
- 第一电离能中,总共有哪几个反常的现象?请分别列举出来(如氧的电离能小于氮)
 LJHZL1年前1
LJHZL1年前1 -
 xmvl8_02yc6147 共回答了24个问题
xmvl8_02yc6147 共回答了24个问题 |采纳率83.3%镁和铝,氮和氧,也就是第二主族与第三主族,第五主族与第六主族,分别是因为电子轨道全满和半充满,希望楼主满意1年前查看全部
- 原子半径和电离能的条形,折线统计图
 hj53010201年前1
hj53010201年前1 -
 ttee 共回答了20个问题
ttee 共回答了20个问题 |采纳率100%http://web.stteresa.edu.hk/~kfyuen/s6ch510.jpg
http://web.stteresa.edu.hk/~kfyuen/s6ch503.jpg
http://wps.prenhall.com/wps/media/objects/602/616516/Media_Assets/Chapter06/Text_Images/FG06_03.JPG1年前查看全部
- 化学计算题:求Ti(钛)的第一电离能和第二电离能
化学计算题:求Ti(钛)的第一电离能和第二电离能
要求写好具体过程,解题思路
 CYCLONE风1年前1
CYCLONE风1年前1 -
 01103415 共回答了20个问题
01103415 共回答了20个问题 |采纳率90%SORRY 看错了1年前查看全部
- 原子相邻电离能之间的突变是什么意
原子相邻电离能之间的突变是什么意
原子电离能之间的突变是什么意思?如锂离子第一电离能和第二电离能之间发生突变是什么意思? 安_释1年前1
安_释1年前1 -
 skybaby1020 共回答了13个问题
skybaby1020 共回答了13个问题 |采纳率92.3%一般情况下,同一元素相邻电离能之间相差一倍左右.
所谓突变就是相邻电离能之间相差幅度异常增大,一般在数倍甚至十倍左右.
具体来说就是,锂的第二电离能高于第一电离能几倍甚至十倍,这是由于Li的化合价为+1价,在失去第二个电子时,将要失去第一层的电子,这是较困难的.1年前查看全部
- 氢原子跃迁问题跃迁到定态k可发射一个光子.已知定态l的电离能为0.85 eV,又知从基态使氢原子激发到定态k所需能量为1
氢原子跃迁问题
跃迁到定态k可发射一个光子.已知定态l的电离能为0.85 eV,又知从基态使氢原子激发到定态k所需能量为10.2 eV,则在上述跃迁中氢原子所发射的光子的能量为__________eV
2.55ev
请问这个过程是怎么样呀? marco00301年前1
marco00301年前1 -
 天堂追梦 共回答了28个问题
天堂追梦 共回答了28个问题 |采纳率92.9%是从定态I跃迁到定态K吧,氢原子能级En=-13.6/n^2(ev),基态能量-13.6ev,定态I能量-0.85ev,从基态到定态K需10.2ev能量,则定态k能量-13.6+10.2=-3.4ev,则从定态I跃迁到定态K释放的能量为-0.85+3.4=2.55ev,即为光子能量.1年前查看全部
- 下表是第三周期部分元素的电离能[单位:eV(电子伏特)]数据,下列说法正确的是 [ &
下表是第三周期部分元素的电离能[单位:eV(电子伏特)]数据,下列说法正确的是 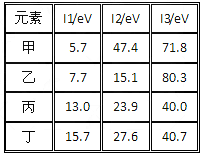 [ ]
[ ]A甲的金属性比乙强
B乙的化合价为+1价
C 丙一定为非金属元素
D 丁一定是金属元素 粱溪人家1年前1
粱溪人家1年前1 -
 boris_zhou 共回答了13个问题
boris_zhou 共回答了13个问题 |采纳率100%AC1年前查看全部
- RT.一个原子有几个电子就最多有几级电离能?只是后面的难以达到?
 asfd243231年前3
asfd243231年前3 -
 了解了解 共回答了17个问题
了解了解 共回答了17个问题 |采纳率94.1%是的.里层电子电离能非常大.1年前查看全部
- 第一电离能介于B与N之间的第二周期元素
 flanceX1年前1
flanceX1年前1 -
 茫茫沧海一声笑 共回答了24个问题
茫茫沧海一声笑 共回答了24个问题 |采纳率87.5%因 N 的最外层轨道电子数处于半充 满的稳定状态,因此 N 的第一电离能反常大于 O,Be 的价层 电子排布处于全满的稳定结构,其第 一电离能大于 B,因此第一电离能介于在 B、 N 间的第二周期元素有 Be、 C、 O 三种元素.1年前查看全部
- 怎么计算第二电离能?我们要求求氦原子的第二电离能,
 山里的花花1年前2
山里的花花1年前2 -
 黄爱姿 共回答了24个问题
黄爱姿 共回答了24个问题 |采纳率87.5%氦原子的第二电离能就是从一价氦离子上取走一个电子所需的能量.
而一价氦离子是类氢离子(只有1个电子),它的电子能量可以严格计算出来.
类氢体系的电子能量E正比于核电荷的平方,因此一价氦离子的电子能量是氢原子的电子能量的4倍.
氢原子的电子能量13.6eV,因此一价氦离子的电子能量13.6×4=54.4eV
氦原子的第二电离能就是54.4eV
同理可以计算锂原子的第三电离能、铍原子的第四电离能等等.1年前查看全部
- 根据化学元素周期表判断各种性质比方说电负性 原子半径 电离能等等 高中的(高二期末考试)什么从左到右依次怎么变化总记不住
 amily_lin1年前1
amily_lin1年前1 -
 AnnLONG 共回答了22个问题
AnnLONG 共回答了22个问题 |采纳率100%元素周期表中,从左到右,原子半径、电离能逐渐减小,电负性逐渐增强(稀有气体除外);元素金属性,失电子能力逐渐减弱,非金属性,得电子能力逐渐增强;
从上到下,原子半径、电离能逐渐增强,电负性逐渐减弱(稀有气体除外);元素金属性,失电子能力逐渐增强,非金属性,得电子能力逐渐减弱;1年前查看全部
- 根据电离能如何判断元素所在族
 曹东明的粉丝1年前2
曹东明的粉丝1年前2 -
 逗妞仕 共回答了14个问题
逗妞仕 共回答了14个问题 |采纳率85.7%第一电离能大小和金属性非金属性相关,非金属性强的第一电离能越大,金属性强的第一电离能越小,但是同周期稀有气体最大,第三主族、第六主族由于全空、半充满规则会比它左边的同周期主族第一电离能小1年前查看全部
- 电离能和电子亲和能的区别
 是不是陌生人1年前1
是不是陌生人1年前1 -
 doudoulove 共回答了16个问题
doudoulove 共回答了16个问题 |采纳率93.8%电离能就是基态气体原子失去电子成为带一个正电荷的气态正离子所需要的能量;电子亲和能就是元素的气态原子在基态时获得一个电子成为一价气态负离子所放出的能量.
从这里就明显看出其区别了,这是我从大一的无机化学课本找到的,希望对你有所帮助~1年前查看全部
- 想问一个关于原子半径与电离能、电负性关系的问题
想问一个关于原子半径与电离能、电负性关系的问题
首先是原子半径。在同周期中,因为同一层电子间的相互屏蔽作用较小,有效核电荷数增加,核对电子吸引增强,导致原子半径减小;同一族中由上到下,电子层数增多,尽管核电荷数依次增加,但由于内层电子屏蔽作用,对原子半径的影响没有电子层数增加的大,所以同一族中由上到下半径逐渐增加。问题:元素周期表中向右,向上原子半径减少,那么一个元素右边和上面的原子的半径谁大谁小呢?比如Mg和Li,As和Si.
第二是第一电离能的数值大小主要取决于原子的核电荷数、原子半径以及原子的价电子构型。价电子构型是因为如Be和Mg有全充满S轨道,N和P有半充满P轨道,不易失电子,有较高的电离能;B和Al失去P轨道上的一个电子后,有S轨道全充满的稳定构型;O和S失去一个电子后,有P轨道半充满的稳定构型,所以它们的第一电离能会不按“常规”,比它们左边的元素要小。问题是:如果不考虑与价电子构型有关的元素,那么剩余的元素原子可不可以理解为,第一电离能越大,原子半径越小?
第三问题是:可不可以理解为电负性是原子对电子吸引的能力,电离能是原子失电子的能力?那么电负性越大的原子,是电子能力越弱,第一电离能也越大? 边城老刀1年前2
边城老刀1年前2 -
 一见一见 共回答了19个问题
一见一见 共回答了19个问题 |采纳率84.2%第一个问题,通常情况下是右边的大,你举得例子即是Mg和As大,因为通常认为电子层数的增大对半径的影响远无法被内层电子的屏蔽效应拉平,当然,讨论到镧系和锕系元素是会有特殊性;
第二个问题,可以这样简单的记忆,但分析的时候不能这么简单的考虑,电离能尤其是第一电离能分析起来还是比较复杂综合的;
第三个问题,不好这样理解,与第一电离能相对的表征是第一电子亲和能,电负性虽然反映了原子核束缚电子的能力,但往往是在成建的基础上分析电子对偏移使用,而这与气态条件下的电子得失还是有差别的,但刨除个例,简化记忆还是可以的,不过用来分析问题逻辑上啊,包括实际情况还是容易出问题的.1年前查看全部
- 镁离子的第三电离能为什么比氖的第一电离能要低
镁离子的第三电离能为什么比氖的第一电离能要低
镁离子的电子组态和氖的一样
给两个原因, y2k10251年前2
y2k10251年前2 -
 afei5 共回答了23个问题
afei5 共回答了23个问题 |采纳率95.7%因为镁失去两个电子后最外层已经达到8电子稳定结构,和氖的电子结构相似,镁的原子核电荷数比氖多两个,所以镁原子核对核外电子的吸引力大于氖原子核对核外电子的吸引力,所以镁离子的第三电离能比氖的第一电离能要低.1年前查看全部
- 元素周期律请进来的高手帮忙讲一下电离能与电负性怎样比较元素的第二电离能
 汀溪兰香A1年前2
汀溪兰香A1年前2 -
 eckx6j 共回答了12个问题
eckx6j 共回答了12个问题 |采纳率83.3%电离能(I)
基态的气态原子失去一个电子形成气态一价正离子时所需能量称为元素的第一电离能(I1).元素气态一价正离子失去一个电子形成气态二价正离子时所需能量称为元素的第二电离能(I2).第三、四电离能依此类推,并且I1<I2<I3….由于原子失去电子必须消耗能量克服核对外层电子的引力,所以电离能总为正值,SI单位为J• mol-1,常用kJ•mol-1.通常不特别说明,指的都是第一电离能.
电离能可以定量的比较气态原子失去电子的难易,电离能越大,原子越难失去电子,其金属性越弱;反之金属性越强.所以它可以比较元素的金属性强弱.影响电离能大小的因素是:有效核电荷、原子半径、和原子的电子构型.
(1)同周期主族元素从左到右作用到最外层电子上的有效核电荷逐渐增大,电离能也逐渐增大,到稀有气体由于具有稳定的电子层结构,其电离能最大.故同周期元素从强金属性逐渐变到非金属性,直至强非金属性.
(2)同周期副族元素从左至右,由于有效核电荷增加不多,原子半径减小缓慢,有电离能增加不如主族元素明显.由于最外层只有两个电子,过渡元素均表现金属性.
(3)同一主族元素从上到下,原子半径增加,有效核电荷增加不多,则原子半径增大的影响起主要作用,电离能由大变小,元素的金属性逐渐增强.
(4)同一副族电离能变化不规则.
电负性
周期表中各元素的原子吸引电子能力的一种相对标度 .又称负电性.元素的电负性愈大,吸引电子的倾向愈大,非金属性也愈强.电负性的定义和计算方法有多种,每一种方法的电负性数值都不同,比较有代表性的有3种:
① L.C.鲍林提出的标度.根据热化学数据和分子的键能,指定氟的电负性为3.98,计算其他元素的相对电负性.
②R.S.密立根从电离势和电子亲合能计算的绝对电负性.
③A.L.阿莱提出的建立在核和成键原子的电子静电作用基础上的电负性.利用电负性值时,必须是同一套数值进行比较.
电负性综合考虑了电离能和电子亲合能,首先由莱纳斯·鲍林于1932年提出.它以一组数值的相对大小表示元素原子在分子中对成键电子的吸引能力,称为相对电负性,简称电负性.元素电负性数值越大,原子在形成化学键时对成键电子的吸引力越强.
同一周期从左至右,有效核电荷递增,原子半径递减,对电子的吸引能力渐强,因而电负性值递增;同族元素从上到下,随着原子半径的增大,元素电负性值递减.过渡元素的电负性值无明显规律.就总体而言,周期表右上方的典型非金属元素都有较大电负性数值,氟的电负性值数大(4.0);周期表左下方的金属元素电负性值都较小,铯和钫是电负性最小的元素(0.7).一般说来,非金属元素的电负性大于2.0,金属元素电负性小于2.0.
电负性概念还可以用来判断化合物中元素的正负化合价和化学键的类型.电负性值较大的元素在形成化合物时,由于对成键电子吸引较强,往往表现为负化合价;而电负性值较小者表现为正化合价.在形成共价键时,共用电子对偏移向电负性较强的原子而使键带有极性,电负性差越大,键的极性越强.当化学键两端元素的电负性相差很大时(例如大于1.7)所形成的键则以离子性为主.
常见元素电负性(鲍林标度)
氢 2.2 锂 0.98 铍 1.57 硼 2.04 碳 2.55 氮 3.04 氧 3.44 氟 3.98
钠 0.93 镁 1.31 铝 1.61 硅 1.90 磷 2.19 硫 2.58 氯 3.16
钾 0.82 钙 1.00 锰 1.55 铁 1.83 镍 1.91 铜 1.9 锌 1.65 镓 1.81 锗 2.01 砷 2.18 硒 2.48 溴 2.96
铷 0.82 锶 0.95 银 1.93 碘 2.66 钡 0.89 金 2.54 铅 2.331年前查看全部
- 电离能不是指气态原子失去电子的能力,又和金属的活泼性有关.那么Na也有电离能,但是电离能不是指气态吗?
电离能不是指气态原子失去电子的能力,又和金属的活泼性有关.那么Na也有电离能,但是电离能不是指气态吗?
金属难道都很容易变成气态的吗? 龍城閃客1年前1
龍城閃客1年前1 -
 sbihibi 共回答了16个问题
sbihibi 共回答了16个问题 |采纳率87.5%电离能是说明金属活泼性质的一个指标,表述的金属的失电子性质,非金属活泼性质是用电子亲和能来表述的.
电离能是指基态的气态原子失去电子变成气态阳离子所需要的能量.所以,一定得是气态,不管该元素容不容易变成气态,呵呵.电离能的单位是千焦/摩尔,失去第一个电子所需要的能量叫第一电离能,失去第二个电子所需要的能量叫第二电离能,依次类推.任何一种元素,第一电离能总是最小的,失去后面的电子所需要的能量都会变大.
比如钠,11号元素,第一电离能比较小,失去第一个电子后变成了+1的离子,外围电子构形就变成了跟前面的10号元素氖一样的S2P6的电子层全充满的稳定结构了,再失去电子就变得很困难了,第二电离能就特别大,好象是差不多相差了10倍.同理,后面的12号元素镁,第一第二电离能相差比较小,第三电离能就变得很大.非金属元素不容易失电子,所以第一电离能都非常大,后面的更大.
总而言之,一定得是气态,否则这么多种元素有的是气态,有的是液态,有的是固态,跑步的,穿旱冰鞋的,骑车的,虽然咱比的都是体力,比起来也会乱套的,呵呵1年前查看全部
- 我们化学书上说同一周期从左到右第一电离能一次变大,那为什么镁的第一电离能比铝大?
 好想摆脱1年前1
好想摆脱1年前1 -
 kuge31 共回答了8个问题
kuge31 共回答了8个问题 |采纳率87.5%镁的电子排布是[Ne]3s^2,3p轨道全空较稳定,而铝是[Ne]3s^2 3p^1则不是全满,全空,半空中任意一种情况,不稳定,故铝的第一电离能比镁小.1年前查看全部
- 电离能是指由蒸气状态的孤立原子失去形成阳离子需要的能量.从中性原子中移去第一个电子所需的能量为第一电离能(I1),移去第
电离能是指由蒸气状态的孤立原子失去形成阳离子需要的能量.从中性原子中移去第一个电子所需的能量为第一电离能(I1),移去第二个电子所需要的能量成为第二个电离能(I2),依次类推.
元素 I1/eV I2/eV I3/eV
A 13.0 23.9 40.0
B 4.3 31.9 47.8
C 5.7 47.4 71.8
D 7.17 15.1 80.3
E 21.6 41.1 65.2
现在五种元素.A、B、C、D、E,其中 I1~I3 分别如上表.根据表中数据判断其中的稀有气体元素有_______,最活泼的金属元素是________. sadfouawrgjtrh1年前3
sadfouawrgjtrh1年前3 -
 lipanda 共回答了22个问题
lipanda 共回答了22个问题 |采纳率95.5%稀有气体元素有___E、A____,
最活泼的金属元素是___B_____.1年前查看全部
- 高中化学,砷硒溴的第二电离能比较,最好能推广一下,比如到第三电离能,谢谢
 ㄘㄠㄎㄌ1年前1
ㄘㄠㄎㄌ1年前1 -
 idf4455 共回答了19个问题
idf4455 共回答了19个问题 |采纳率100%第一电离能(I1)
I1 I2 I3
砷 947 1798 2735
硒 941 2045 2973.7
溴 1139.9 2103 3470
砷As大于硒Se大于溴Br
在周期表中第二主族和第三主族、五六主族反过来1年前查看全部
- 为什么同元素的第一电离能小于第二电离能小于第三电离能?
为什么同元素的第一电离能小于第二电离能小于第三电离能?
不是说同元素的原子半径 负价态>中性>正价态
那么假设Mg 则原子半径Mg>Mg1+>Mg2+
那么Mg失去了一个电子后变成Mg1+时半径变大,原子核对它的束缚力不是变小了吗? song2001sg1年前1
song2001sg1年前1 -
 jacc 共回答了20个问题
jacc 共回答了20个问题 |采纳率95%因为第二和第三个电子距离原子核更近,所以原子核对它们的束缚更强,所以第一电离能比第二第三电离能要小.1年前查看全部
- 电离能 与元素半径大小的关系为什么?
 龙心凤胆1年前1
龙心凤胆1年前1 -
 deathclock2 共回答了19个问题
deathclock2 共回答了19个问题 |采纳率94.7%半径越大电离能越小
电磁力是随距离增大而减小的
因为半径大,最外层电子与原子核距离大
受到的电磁力(吸引)就小
需要的电离能就小1年前查看全部
大家在问
- 1(2001•上海)物体放在凸透镜前12cm处,在透镜另一侧的光屏上成一个倒立放大的像.当物体距凸透镜8cm时,所成的像(
- 2一道证券试题(要求给出详细解答过程)
- 3文言文阅读,完成问题。 (甲) 十年春,齐师伐我。公将战,曹刿请见。其乡人曰:“肉食者谋之,又何间焉?”刿曰:“肉食
- 4如图,在平行六面体ABCD-A1B1C1D1中,已知AB=5,AD=4,AA1=3,AB⊥AD,∠A1AB=∠A1AD=
- 5我说过、我们之间的距离只有一个转身 、 我会等你 用英文怎么讲
- 6若点P是第一、三象限角平分线上的点,它与A(-2,-3)的距离为1,则P的坐标为
- 7I just want to be friends with
- 8一个梯形果园的上底与下底的和是160米,高是45米,这个果园的面积是(3600)平方米.如果按每8平方米种一棵
- 93 3 8 8 这4个数字可以用加减乘除括号,使答案等于24.
- 10【英语作文求帮助】图书义卖的英语作文怎么写 要求:上周五我校组织了一次全校性义卖活动谈谈活动的目的,时间,地方,方式和感
- 11已知log以3为底x的对数=-1/log以2为底3的对数,求x+x平方+x立方+...+x的n次方的前n项和
- 12如图,在正方形ABCD中,对角线AC与BD交于点O,AE平分∠BAC交BC于E,交BO于F,求证:EC=2FO
- 13(2005•辽宁)关于生活中的一些电路连接,下列判断正确的是( )
- 14金属与人类的生活和生产密切相关.
- 153(x-根号2)=5x+1解方程
