(2008•金城江区)今年北京奥运传递火炬叫“祥云”,它的上半部分是用高品质的铝合金制成,下半部分涂有手感极好的合成涂料
 mvp4915418032022-10-04 11:39:541条回答
mvp4915418032022-10-04 11:39:541条回答(1)写出该铝合金中铝的化学式______;
(2)丙烷属于(填“无机物”或“有机物”)______;
(3)从以上描述,我们知道,丙烷的化学性质有①______,②______.
(4)如果不用铝合金,而是铁合金,时间长了容易产生红棕色锈斑,这红棕色锈斑的主要成分是(填化学式)______.

已提交,审核后显示!提交回复
共1条回复
 狂狷生 共回答了23个问题
狂狷生 共回答了23个问题 |采纳率95.7%- 解题思路:(1)根据元素符号的书写方法考虑;(2)根据有机物的判断方法考虑;(3)物理性质是指物质不需要发生化学变化就表现出来的性质.化学性质是指物质在化学变化中表现出来的性质.而化学变化的本质特征是变化中有新物质生成,因此,判断物理性质还是化学性质的关键就是看表现物质的性质时是否有新物质产生;(4)根据铁锈的成分考虑.
(1)铝由两个字母组成,要一大二小,由原子直接构成,所以化学式用元素符号表示就行,所以化学式是Al;
(2)含碳的化合物属于有机物(一氧化碳、二氧化碳、碳酸盐等除外),丙烷中含有碳元素,属于有机物;
(3)物质的颜色、状态、气味、熔点、沸点、硬度、密度、溶解性、挥发性等性质,不需要发生化学变化就表现出来,因此,都属于物理性质;丙烷的易燃性是通过丙烷燃烧表现出来的,丙烷燃烧生成二氧化碳和水,所以易燃性属于化学性质;由丙烷在650℃时就分解为乙烯和乙烷,有新物质生成,属于化学变化,所以丙烷受热易分解属于化学性质;
(4)铁锈的主要成分是Fe2O3.
故答案为:(1)Al;(2)有机物;(3)①易燃性;②受热易分解;(4)Fe2O3.点评:
本题考点: 化学性质与物理性质的差别及应用;铁锈的主要成分;有机物与无机物的区别;化学式的书写及意义.
考点点评: 解答本题关键是要知道化学式的书写方法,有机物的判断方法,化学性质和物理性质的鉴别方法,熟悉铁锈的主要成分. - 1年前
相关推荐
- (2008•金城江区)小明用分子的观点解释下列现象,其中错误的是( )
(2008•金城江区)小明用分子的观点解释下列现象,其中错误的是( )
A.物体热胀冷缩-分子的大小随温度的变化而变化
B.花香四溢-分子在不停运动
C.食物变质-分子发生了变化
D.酒精挥发-分子之间的间隔变大 killplay1年前1
killplay1年前1 -
 kang_ta 共回答了12个问题
kang_ta 共回答了12个问题 |采纳率83.3%解题思路:根据分子的基本性质回答,分子是构成物质的一种粒子,它体积很小,不断运动,分子间有一定间隔;物质发生物理变化时,构成物质的分子不发生改变,物质发生化学变化时,构成物质的分子发生改变.A、热胀冷缩是因为分子间的间隔随温度变化而改变,分子的大小不发生变化,故此项说法错误.
B、花香四溢是因为分子在不停运动,花香的分子运动到空气中,进入人们的鼻孔,便感觉的香味,故此项解释正确.
C、食物变质发生的是化学变化,物质发生化学变化时,构成物质的分子发生变化,故此项解释正确.
D、酒精挥发是因为分子的不断运动,使酒精分子间的间隔变大.故此项解释正确.
故选:A.点评:
本题考点: 利用分子与原子的性质分析和解决问题.
考点点评: 能准确利用分子的各种性质来解释日常现象,主要是分子的运动和分子的间隔用的比较多.1年前查看全部
- (2013•金城江区一模)进入防汛期后,某地对河堤进行了加固.该地驻军在河堤加固的工程中出色地完成了任务,这是记者与驻军
(2013•金城江区一模)进入防汛期后,某地对河堤进行了加固.该地驻军在河堤加固的工程中出色地完成了任务,这是记者与驻军工程指挥官的一段对话:
记者:你们是怎样用9天时间完成4800米长的大坝加固任务呢?
指挥官:我们在加固600米后,采用新的加固模式,这样每天加固长度是原来的2倍.
通过这段对话,请你求出该地驻军原来每天加固多少米? 稍微有点软1年前1
稍微有点软1年前1 -
 jojotalk 共回答了23个问题
jojotalk 共回答了23个问题 |采纳率78.3%解题思路:设原来每天加固x米,则采用新的加固模式后每天加固2x米,由时间关系可得出关于x的分式方程,解此方程可得x的值,即该地驻军原来每天加固的距离.设原来每天加固x米,则采用新的加固模式后每天加固2x米,前600米,每天加固x米,则用天数=[600/x],剩下的(4800-600)米,每天加固2x,用的天数是[4200/2x],而总天数是9天.所以可列方程如下:
600
x+
4800−600
2x=9,
解这个方程得:x=300,
经检验x=300是原方程的根,
答:该地驻军原来每天加固300米.点评:
本题考点: 分式方程的应用.
考点点评: 本题主要考查了分式方程在工程问题中的运用,分析题意,找到关键描述语,找到合适的等量关系是解决问题的关键.1年前查看全部
- (2008•金城江区)下列关于溶液pH的说法,正确的是( )
(2008•金城江区)下列关于溶液pH的说法,正确的是( )
A.酸和碱混合后,溶液pH一定等于7
B.氢氧化钠溶液加水后,pH降低
C.用pH试纸测定溶液的酸碱度时,先用水湿润试纸
D.在pH=2的盐酸中加入等体积pH=3的盐酸,混合后溶液pH=5 lakin0011年前1
lakin0011年前1 -
 zhaoxiaobo2086 共回答了17个问题
zhaoxiaobo2086 共回答了17个问题 |采纳率82.4%解题思路:A、根据酸和碱混合后生成盐和水,酸碱不一定恰好反应,即使恰好反应生成盐和水,有的盐不一定呈中性进行解答;
B、根据氢氧化钠溶液显碱性,加水后碱性变弱,pH降低进行解答;
C、根据测定溶液的pH时,不能先将pH试纸湿润进行解答;
D、根据在pH=2的盐酸中加入等体积pH=3的盐酸,相当于把pH=2的盐酸稀释,酸性减弱,所以溶液的pH值应该在2-3之间进行解答.A、酸和碱混合后生成盐和水,酸碱不一定恰好反应,即使恰好反应生成盐和水,有的盐不一定呈中性,所以酸和碱混合后,溶液pH不一定等于7,故A错误;
B、氢氧化钠溶液显碱性,加水后碱性变弱,pH降低,故B正确;
C、测定溶液的pH时,不能先将pH试纸湿润,故C错误;
D、在pH=2的盐酸中加入等体积pH=3的盐酸,相当于把pH=2的盐酸稀释,酸性减弱,所以溶液的pH值应该在2-3之间,故D错误.
故选:B.点评:
本题考点: 溶液的酸碱性与pH值的关系;溶液的酸碱度测定.
考点点评: 本题考查了溶液的酸碱性与pH的关系,完成此题,可以依据已有的知识进行.1年前查看全部
- (2013•金城江区二模)碘是人体所需的微量元素,缺乏它会患地方甲状腺肿大,如图是周期 表中提供的碘元素的部分
 (2013•金城江区二模)碘是人体所需的微量元素,缺乏它会患地方甲状腺肿大,如图是周期 表中提供的碘元素的部分信息及碘原子结构示意图,下列说法错误的是( )
(2013•金城江区二模)碘是人体所需的微量元素,缺乏它会患地方甲状腺肿大,如图是周期 表中提供的碘元素的部分信息及碘原子结构示意图,下列说法错误的是( )
A.碘的相对原子质量为126.9,原子核内质子数为53
B.碘原子核外共有53个电子,最外层有7个电子
C.碘元素属于非金属元素,碘原子在化学反应中容易失去电子
D.碘盐中含有碘酸钾(KIO3),KIO3中碘元素的化合价为+5价 rbfmb1年前1
rbfmb1年前1 -
 刘备是贼 共回答了16个问题
刘备是贼 共回答了16个问题 |采纳率93.8%解题思路:A、由元素周期表中提供的碘元素的部分信息及碘原子的结构示意图,可知碘的相对原子质量、原子核内质子数;
B、由碘原子的结构示意图,可知碘原子核外电子数,最外层电子数;
C、由汉语名称“碘”,可知其元素种类;由碘原子的结构示意图,可知在化学反应中失去电子情况;
D、根据化合价原则“正负化合价的代数和为零”,可以求出KIO3中碘元素的化合价.A、由元素周期表中提供的碘元素的部分信息及碘原子的结构示意图,可知碘的相对原子质量为126.9,原子核内质子数为53,故A正确;
B、由碘原子的结构示意图,可知碘原子核外共有53个电子,最外层有7个电子,故B正确;
C、由汉语名称“碘”,可知其为非金属元素;由碘原子的结构示意图,可知最外层有7个电子,在化学反应中容易得到1个电子,故C错误;
D、根据化合价原则“正负化合价的代数和为零”,设KIO3中碘元素的化合价为x,则(+1)+x+3×(-2)=0,故x=+5价,故D正确.
故选C.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图;有关元素化合价的计算.
考点点评: 了解元素周期表的特点及其应用;了解原子结构示意图与离子结构示意图的区别和联系;掌握核外电子在化学变化中的作用和得失电子的规律特点.1年前查看全部
- (2008•金城江区)下列各物质中,属于合成材料的是( )
(2008•金城江区)下列各物质中,属于合成材料的是( )
A.陶瓷
B.铝合金
C.塑料
D.棉花 5170980061年前1
5170980061年前1 -
 xiangxiang香 共回答了15个问题
xiangxiang香 共回答了15个问题 |采纳率80%A、陶瓷是用泥土烧制而成的,属于无机非金属材料,故选项错误.
B、铝合金属于合金,合金属于金属材料,故选项错误.
C、塑料属于三大合成材料之一,故选项正确.
D、棉花属于天然材料,故选项错误.
故选:C.1年前查看全部
- (2013•金城江区二模)某兴趣小组的同学在实验室配制溶质质量分数为8%的NaOH溶液,并用其测定某稀盐酸中溶质的质量分
 (2013•金城江区二模)某兴趣小组的同学在实验室配制溶质质量分数为8%的NaOH溶液,并用其测定某稀盐酸中溶质的质量分数.
(2013•金城江区二模)某兴趣小组的同学在实验室配制溶质质量分数为8%的NaOH溶液,并用其测定某稀盐酸中溶质的质量分数.
(1)配制20g溶质质量分数为8%的NaOH溶液,需要NaOH固体的质量为______g
(2)向20g溶质质量分数为8%的NaOH溶液中滴加稀盐酸,溶液的PH变化及消耗稀盐酸的质量如图所示,求:
①当加入稀盐酸溶液的质量为______g时,酸和碱恰好完全反应.
②求该稀盐酸中溶质的质量分数. 誘惑乖乖1年前1
誘惑乖乖1年前1 -
 mhj96431 共回答了24个问题
mhj96431 共回答了24个问题 |采纳率83.3%解题思路:(1)利用溶质质量=溶液质量×溶质质量分数计算配制溶液时所需氢氧化钠的质量;
(2)
①当pH=7时,氢氧化钠化与盐酸恰好完全反应;
②需要根据盐酸与氢氧化钠反应生成氯化钠和水,利用恰好完全反应时所消耗氢氧化钠的质量计算反应消耗盐酸的质量.(1)①根据图示可知:pH=7时,氢氧化钠化与盐酸恰好完全反应,加入稀盐酸溶液的质量为20g;
②设20g稀盐酸溶液中含溶质HCl的质量为x
NaOH+HCl═NaCl+H2O
4036.5
1.6 gx
[40/1.6g=
36.5
x]
x═1.46g
该稀盐酸中溶质的质量分数═[1.46g/20g]×100%=7.3%
答案:
(1)1.6
(2)①20 ②该稀盐酸中溶质的质量分数7.3%点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 做这类题目要会看折点,折点是指图象在变化过程中方向发生了大的转变的那个点.它的出现往往是两个变量中某一变量单方面停止造成的.如果图象涉及化学反应,折点通常是该反应的结束点.1年前查看全部
- (2008•金城江区)甲、乙、丙三位同学分别用如图装置测定空气中氧气的体积分数,实验中所用红磷、木炭均过量,待反应完全且
(2008•金城江区)甲、乙、丙三位同学分别用如图装置测定空气中氧气的体积分数,实验中所用红磷、木炭均过量,待反应完全且冷却到室温后才打开止水夹.请描述三位同学在实验中观察到的现象:
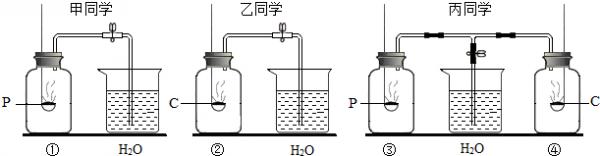
(1)甲中的现象:红磷燃烧产生大量的白烟,冷却后打开止水夹进入水的体积约为容积的[1/5]红磷燃烧产生大量的白烟,冷却后打开止水夹进入水的体积约为容积的[1/5];
(2)乙中的现象:______;
(3)丙中的现象:红磷燃烧放出白烟,待完全冷却后打开止水夹.观察到右侧集气瓶几乎无水进入,而左侧集气瓶进水量约为容积的[1/5]红磷燃烧放出白烟,待完全冷却后打开止水夹.观察到右侧集气瓶几乎无水进入,而左侧集气瓶进水量约为容积的[1/5].
(4)请你简述乙同学实验中现象产生的原因:______. 我就是一一叶子啊1年前1
我就是一一叶子啊1年前1 -
 倪式yy 共回答了19个问题
倪式yy 共回答了19个问题 |采纳率89.5%解题思路:本题考查的是空气中氧气的体积分数的实验.在本实验中应用的原理就是改变集气瓶的压强,达到实验的目的.(1)红磷燃烧产生大量的白烟,同时消耗了空气中的氧气使集气瓶内的压强减小;因为进入水的体积约为容积的[1/5].
(2)木炭和氧气反应又生成二氧化碳,没有改变集气瓶内的压强,冷却后打开止水夹无水进入.
(3)红磷燃烧放出白烟,待完全冷却后打开止水夹.观察到右侧集气瓶几乎无水进入,而左侧集气瓶进水量约为容积的[1/5].
(4)乙同学实验木炭和氧气反应又生成二氧化碳,没有改变集气瓶内的压强.
故答案为:(1)红磷燃烧产生大量的白烟,冷却后打开止水夹进入水的体积约为容积的[1/5]
(2)冷却后打开止水夹无水进入.
(3)红磷燃烧放出白烟,待完全冷却后打开止水夹.观察到右侧集气瓶几乎无水进入,而左侧集气瓶进水量约为容积的[1/5].
(4)木炭和氧气反应又生成二氧化碳,没有改变集气瓶内的压强.点评:
本题考点: 空气组成的测定.
考点点评: 在做测定空气中氧气的体积分数实验时选择的药品只能跟空气中的氧气反应不能跟其它物质发生反应,同时还不能产生气体.1年前查看全部
- (2008•金城江区)某同学在实验室发现一瓶标签残缺(如图所示)的溶液.为了测定此溶液的溶质质量分数,他取出20g该溶液
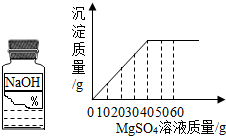 (2008•金城江区)某同学在实验室发现一瓶标签残缺(如图所示)的溶液.为了测定此溶液的溶质质量分数,他取出20g该溶液,向其中逐滴加入溶质质量分数为15%的MgSO4溶液,反应过程中生成沉淀的质量与所用MgSO4溶液质量的关系如图所示.请计算此溶液的溶质质量分数.
(2008•金城江区)某同学在实验室发现一瓶标签残缺(如图所示)的溶液.为了测定此溶液的溶质质量分数,他取出20g该溶液,向其中逐滴加入溶质质量分数为15%的MgSO4溶液,反应过程中生成沉淀的质量与所用MgSO4溶液质量的关系如图所示.请计算此溶液的溶质质量分数.  pzine1年前1
pzine1年前1 -
 ee海盗 共回答了15个问题
ee海盗 共回答了15个问题 |采纳率93.3%解题思路:标签上可以看出该溶液是氢氧化钠溶液,向氢氧化钠溶液中加入硫酸镁溶液会发生如下反应:MgSO4+2NaOH=Na2SO4+Mg(OH)2↓.但必须注意的是,参加反应的只是溶液中的溶质,而溶剂水是不参加反应的.我们再来看看关系图,发现:当加入硫酸镁溶液的质量是40g时,两者恰好完全反应.则参加反应的硫酸镁的质量是(注意参加两个字)40g×15%,由参加反应的硫酸镁的质量就可以求出参加反应的氢氧化钠的质量(即氢氧化钠溶液中溶质的质量).反应恰好完成时所用硫酸镁的质量:40g×15%=6g
设20g氢氧化钠溶液中溶质的质量为x
MgSO4+2NaOH═Na2SO4+Mg(OH)2↓
120 80
6gx
[120/6g=
80
x]
x=4g
氢氧化钠溶液中溶质质量分数为:[4g/20g]×100%=20%
答:该氢氧化钠溶液中溶质质量分数为20%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 溶液和化学反应融合的题目,是综合性的题型,要求比较高.通常学生在计算时常常会忽视了实际参加反应的是溶液中溶质的质量,而往往会把40g直接代入化学方程式进行计算.这就要求学生足够细心、会分析、且条理分明.1年前查看全部
- (2008•金城江区)国家决定推广乙醇汽油的应用,所谓乙醇汽油就是在汽油中加入适量乙醇混合而成的一种燃料.下列有关叙述错
(2008•金城江区)国家决定推广乙醇汽油的应用,所谓乙醇汽油就是在汽油中加入适量乙醇混合而成的一种燃料.下列有关叙述错误的是( )
A.乙醇汽油是一种新型化合物
B.汽车使用乙醇汽油能减少有害气体排放
C.用石油可以制得汽油
D.用玉米、高粱发酵可以制得乙醇 CANDY361年前1
CANDY361年前1 -
 daxiao009 共回答了19个问题
daxiao009 共回答了19个问题 |采纳率94.7%解题思路:乙醇汽油是在汽油中加入乙醇,燃烧时能减少有害气体的排放,乙醇可以使用粮食发酵法制得.A、乙醇汽油是在汽油中加入乙醇,属于混合物,故A错误;
B、汽车使用乙醇汽油能减少有害气体排放,故B正确;
C、石油分馏可以制得汽油,故C正确;
D、乙醇可以使用粮食发酵法制得,故D正确,
故选:A.点评:
本题考点: 常用燃料的使用与其对环境的影响;纯净物和混合物的判别;资源综合利用和新能源开发.
考点点评: 本题考查了乙醇汽油的有关知识,完成此题,可以依据已有的知识结合选项的叙述进行.1年前查看全部
- (2008•金城江区)有人认为:人体实际上是一部缓慢燃烧的“高级机器”,人体在生命活动过程中也需要不断补充“燃料”.按照
(2008•金城江区)有人认为:人体实际上是一部缓慢燃烧的“高级机器”,人体在生命活动过程中也需要不断补充“燃料”.按照这种观点,你认为人们通常摄入的下列物质不能看作“燃料”的是( )
A.淀粉类物质
B.水
C.蛋白质
D.脂肪类物质 redson陈1年前1
redson陈1年前1 -
 szkc 共回答了15个问题
szkc 共回答了15个问题 |采纳率100%解题思路:“燃料”的含义是指能在人体内反应并提供能量的物质.A.淀粉属于糖类,糖类是人体的主要供能物质,故A不符合题意;
B.水在人体内主要是做溶剂,不能为人体提供能量,故B符合题意;
C.食物中的蛋白质在体内被水解为氨基酸后才能吸收,一部分氨基酸再重新合成人体的蛋白质,另一部分氨基酸氧化分解释放能量,供生命活动需要,故C不符合题意;
D、脂肪能在体内发生氧化反应提供能量,故D不符合题意;
故选:B.点评:
本题考点: 生命活动与六大营养素.
考点点评: 本题考查基本营养物质在人体的反应,难度不大,注意理解题意是解题的关键.1年前查看全部
- (2008•金城江区)请在下表中填写相应的物质名称、化学式、物质类别(指单质、氧化物、酸、碱、盐)
(2008•金城江区)请在下表中填写相应的物质名称、化学式、物质类别(指单质、氧化物、酸、碱、盐)
物质名称 氢气 氢氧化铜 氯化铁 化学式 HCl CaO 物质类别 酸 氧化物  tracylove131年前1
tracylove131年前1 -
 sjmzjj 共回答了20个问题
sjmzjj 共回答了20个问题 |采纳率85%解题思路:根据单质(金属单质、固态非金属单质、稀有气体单质,直接用元素符号表示其化学式;气态非金属单质,在元素符号的右下角写上表示分子中所含原子数的数字)和化合物(金属在前,非金属在后;氧化物中氧在后,原子个数不能漏,正负化合价代数和为零)化学式的书写方法进行分析解答即可.
化合物化学式的读法:一般是从右向左读,读作“某化某”,有时还要把元素符号右下角的数字读出来,如SO2、P2O5等,据此进行分析解答.
由同种元素组成的纯净物是单质;氧化物是只含有两种元素且其中一种元素是氧元素的化合物;酸是指在电离时产生的阳离子全部是氢离子的化合物;碱是指在电离时产生的阴离子全部是氢氧根离子的化合物;盐是由金属离子(或铵根离子)和酸根离子组成的化合物.氢气属于气态非金属单质,在元素符号的右下角写上表示分子中所含原子数的数字,其化学式为:H2;氢气是由一种元素组成的纯净物,属于单质.
氢氧化铜中铜元素显+2价,氢氧根显-1价,其化学式为Cu(OH)2;氢氧化铜是由钠离子和氢氧根离子组成的化合物,属于碱.
氯化铁中铁元素显+3价,氯元素显-1价,其化学式为FeCl3;是由铁离子和氯离子组成的化合物,属于盐.
HCl是盐酸的化学式,读作盐酸.
CaO从右向左读,读作氧化钙.
故答案为:
物质名称 氢气 氢氧化铜 氯化铁 盐酸 氧化钙
化学式 H2 Cu(OH)2 FeCl3 HCl CaO
物质类别 单质 碱 盐 酸 氧化物点评:
本题考点: 化学式的书写及意义;单质和化合物的判别;常见的氧化物、酸、碱和盐的判别.
考点点评: 本题难度不大,掌握单质和化合物化学式的书写方法与读法,抓住单质、氧化物、酸、碱、盐的特征是正确解答此类题的关键.1年前查看全部
- (2008•金城江区)除去下列物质中所含杂质(括号内为少量杂质),所选用的试剂及操作方法错误的是( )
(2008•金城江区)除去下列物质中所含杂质(括号内为少量杂质),所选用的试剂及操作方法错误的是( )
A.待提纯的物质:MnO2(KCl);选用的试剂:水;操作方法:溶解、过滤、洗涤、干燥
B.待提纯的物质:CO(CO2);选用的试剂:NaOH溶液;操作方法:通过洗气瓶后再干燥
C.待提纯的物质:Cu(CuO);选用的试剂:稀盐酸;操作方法:搅拌、过滤、洗涤、干燥
D.待提纯的物质:CuSO4(Na2SO4);选用的试剂:氢氧化钠溶液;操作方法:溶解、过滤、洗涤、干燥 myazhong1年前1
myazhong1年前1 -
 huanzi1128 共回答了18个问题
huanzi1128 共回答了18个问题 |采纳率83.3%解题思路:根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.A、KCl易溶于水,MnO2难溶于水,可采取加水溶解、过滤、洗涤、干燥的方法进行分离除杂,故选项所采取的方法正确.
B、CO2能与氢氧化钠溶液反应生成碳酸钠和水,CO不与氢氧化钠溶液反应,再干燥,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确.
C、CuO能与稀盐酸反应生成氯化铜和水,铜不与稀盐酸反应,再过滤、洗涤、干燥,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确.
D、CuSO4能与NaOH溶液反应生成氢氧化铜沉淀和硫酸钠,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
故选:D.点评:
本题考点: 物质除杂或净化的探究;混合物的分离方法;常见气体的检验与除杂方法;盐的化学性质.
考点点评: 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.1年前查看全部
- (2008•金城江区)根据下列实验装置(如图)回答有关问题:
(2008•金城江区)根据下列实验装置(如图)回答有关问题:

(1)实验室制取氧气常用KMnO4,它的发生装置可用______(填序号);工业上通过______方法制取氧气;自然界氧气主要来源于______.
(2)用B装置制取气体时,为了节约药品和便于控制化学反应速率,应如何对装置进行改进?______
(3)二氧化氮气体是一种有毒气体,其密度比空气大,易溶于水和碱溶液.实验室常用铜片和浓硝酸(HNO3)在常温下反应制得.①制取二氧化碳气体时应选用的发生装置是______(填序号)②收集二氧化氮气体可用的装置是______(填序号),请简述使用此收集装置的原因:______. tkdal1年前1
tkdal1年前1 -
 流浪狗666 共回答了19个问题
流浪狗666 共回答了19个问题 |采纳率84.2%解题思路:工业上制取氧气的原料是空气,是通过分离液态空气法得到氧气的,自然界氧气主要来源于绿色植物的光合作用;制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.用B装置制取气体时,为了节约药品和便于控制化学反应速率,只要把长颈漏斗改为分液漏斗即可;实验室常用铜片和浓硝酸(HNO3)在常温下反应制得,因此不需要加热;收集二氧化氮气体可用的装置是D,因为二氧化氮气体的密度比空气大,因此应该从长管进入;二氧化氮气体是一种有毒气体、易溶于水和碱溶液,因此应该用水或碱溶液制取.(1)如果用高锰酸钾制氧气就需要加热,工业上制取氧气的原料是空气,是通过分离液态空气法得到氧气的,自然界氧气主要来源于绿色植物的光合作用;
故答案为:A;分离液态空气法;绿色植物的光合作用;
(2)用B装置制取气体时,为了节约药品和便于控制化学反应速率,只要把长颈漏斗改为分液漏斗即可;
故答案为:把长颈漏斗改为分液漏斗;
(3)实验室常用铜片和浓硝酸(HNO3)在常温下反应制得,因此不需要加热;收集二氧化氮气体可用的装置是D,因为二氧化氮气体的密度比空气大,因此应该从长管进入;二氧化氮气体是一种有毒气体、易溶于水和碱溶液,因此应该用水或碱溶液制取;
故答案为:B;D;二氧化氮气体的密度比空气大,因此应该从长管进入;二氧化氮气体是一种有毒气体、易溶于水和碱溶液,因此应该用水或碱溶液制取;点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;氧气的工业制法;实验室制取氧气的反应原理.
考点点评: 本考点主要考查了氧气的工业制法、气体的制取装置和收集装置的选择,同时也考查了装置的改进等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.1年前查看全部
- (2008•金城江区)在已调平衡的托盘天平两边各放一个等质量的烧杯,向烧杯中各倒入质量相等、质量分数也相等的足量稀硫酸,
(2008•金城江区)在已调平衡的托盘天平两边各放一个等质量的烧杯,向烧杯中各倒入质量相等、质量分数也相等的足量稀硫酸,分别在左、右两盘的烧杯中同时放入等质量的金属粉末X、Y.待两个烧杯中的物质反应结束后观察到天平的指针偏向左边.则金属X、Y分别是( )
A.X:Mg Y:Fe
B.X:Zn Y:Mg
C.X:Mg Y:Zn
D.X:Zn Y:Fe 飞的手机链1年前1
飞的手机链1年前1 -
 songkunliang 共回答了25个问题
songkunliang 共回答了25个问题 |采纳率96%解题思路:根据铁、镁、锌三种物质的相对原子质量考虑,质量相同的金属,相对原子质量越大的金属置换出的氢的质量越少.据此答题.由铁、镁、锌三种金属分别与足量的稀硫酸反应的化学方程式Zn+H2SO4═ZnSO4+H2↑,Fe+H2SO4=FeSO4+H2↑,Mg+H2SO4=MgSO4+H2↑可知,每生成一克氢分子与需要这几种物质的比为:Zn为1:32.5,镁为1:12,Fe为1:28,因为金属质量相同,所以相同质量的金属中镁置换的氢的质量最多,铁次之,锌最少.
由题意可知,托盘天平的指针偏向左边,说明左边反应生成的氢气质量比右边少,在所给的四个答案中,符合这个条件的是BD.
故选:BD.点评:
本题考点: 金属的化学性质.
考点点评: 本题主要考查学生灵活运用化学方程式和物质的相对原子质量来解决实际问题的能力.1年前查看全部
- (2008•金城江区)请你根据质量守恒定律来推断X的化学式,向Na2CO3溶液中滴加少量盐酸,所发生的化学反应为:Na2
(2008•金城江区)请你根据质量守恒定律来推断X的化学式,向Na2CO3溶液中滴加少量盐酸,所发生的化学反应为:Na2CO3+HCl═X+NaCl.其中X是( )
A.H2O
B.CO
C.H2CO3
D.NaHCO3 yuzhang200220081年前1
yuzhang200220081年前1 -
 纤手凭栏 共回答了17个问题
纤手凭栏 共回答了17个问题 |采纳率88.2%解题思路:由质量守恒定律:反应前后原子种类、数目均不变,据此由反应的化学方程式推断生成物X的化学式.根据质量守恒定律可知:反应前后原子种类、数目均不变,由题干中的化学方程式可以看出反应前有2个钠原子、1碳原子、3个氧原子、1个氢原子和1个氯原子,反应后除X外有1个钠原子和1个氯原子,则X中有1个钠原子、1个氢原子、1个碳原子和3个氧原子,则X是NaHCO3.
故选:D.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题难度不大,利用化学反应前后元素守恒、原子守恒来确定物质的化学式是解题的关键.1年前查看全部
- (2013•金城江区二模)A、B、C三种固体物质的溶解度曲线如图所示:
 (2013•金城江区二模)A、B、C三种固体物质的溶解度曲线如图所示:
(2013•金城江区二模)A、B、C三种固体物质的溶解度曲线如图所示:
(1)t1℃时,A、B、C的溶解度大小关系是(用“>”“<”或“=”表示)______,它们的饱和溶液中,溶质质量分数最大的物质是______;
(2)t2℃时,将A、B、C各25g分别放入100g水中,能形成饱和溶液的物质是______,将其转化为不饱和溶液的方法有①______②______. luojingming1年前1
luojingming1年前1 -
 pink水蜜桃 共回答了18个问题
pink水蜜桃 共回答了18个问题 |采纳率100%解题思路:(1)据溶解度曲线可比较同一温度下不同物质的溶解度大小,并据饱和溶液中溶质的质量分数计算方法分析解答;
(2)据该温度下三物质的溶解度分析解答,饱和溶液变为不饱和溶液的方法有增加溶剂,升温.(1)t1℃时,A、B、C的溶解度大小关系是B>A=C,饱和时质量分数的计算式[溶解度/溶解度+100g]×100%,即溶解度越大质量分数也就越大,所以它们的饱和溶液中,溶质质量分数最大的物质是B;
(2)t2℃时只有C的溶解度小于25g,所以将A、B、C各25g分别放入100g水中,能形成饱和溶液的物质是C,由于C的溶解度随温度升高而减小,所以将其转化为不饱和溶液的方法有增加溶剂,降温;
故答案为:(1)B>A=C;B;(2)C;降温.点评:
本题考点: 固体溶解度曲线及其作用;饱和溶液和不饱和溶液相互转变的方法;溶质的质量分数、溶解性和溶解度的关系.
考点点评: 本题考查了学生依据溶解度曲线分析、解答问题的能力,难度不大.1年前查看全部
大家在问
- 1改成过去分词做状语或定语1、After she was accused of stealing the mobile p
- 2英文的时间问题!急9:1010:1511:2612:3013:4014:4515:56分别用英语怎么表示?而且 每一个
- 3空间四点若不在同一个平面内,则其中任意三点不在同一条直线上,对的错的?
- 4I have been in China for a few days这句语法错在哪里啊?
- 5三相电机7500瓦用多大平方的BVR芯线?怎么计算电流值?
- 6晚上,在桌面上铺一张白纸,把一块小平面镜放在白纸上(镜面朝上),让手电筒的光正对白纸和平面镜照射,从侧面看去(
- 7在用科学计数法表示的数:3.16×10的七次方,2.41× 10的八次方,1.31×10的七次方,4.78×10的八次方
- 8关于描写太阳公公带给益处的英语作文不少于50个英语单词
- 9蛋白质在细胞器中合成过程蛋白质在各个细胞器中如何合成?从氨基酸到多肽再到蛋白质是如何变化的.在各个细胞器中如何转变?
- 10几道科学题7上年级1、赤道的周长约为多少?量一量自己的两臂展开的长度,如果大家手拉手绕地球赤道一周,大概需要多少人?2、
- 11请大家帮助写一篇关于初二英语十单元的英语作文
- 121.请问:出现“落红”两个字的诗句?分别表示什么?
- 13初二英语作文植物对我们有什么好处谁能帮我写一篇《植物对我们有什么好处》60词左右.谢啦.
- 14某食品工厂生产的酱油中氯化钠的质量分数为15%-18%,该厂生产15t酱油,式计算该厂每月(30天)消耗质量
- 15第一题是:I am Gina(改为同义句)
