把Ba(OH)2溶液滴入明矾溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
 zhuzi19802022-10-04 11:39:541条回答
zhuzi19802022-10-04 11:39:541条回答A.Al3+
B.Al(OH)3
C.AlO2-
D.Al3+和Al(OH)3

已提交,审核后显示!提交回复
共1条回复
 54639457 共回答了15个问题
54639457 共回答了15个问题 |采纳率86.7%- 解题思路:明矾的化学式为KAl(SO4)2•12H2O,设明矾为1mol,则溶液中含有1molAl3+,2molSO42-,根据反应:SO42-+Ba2+=BaSO4↓、Al3++4OH-=AlO2-+2H2O判断.
明矾的化学式为KAl(SO4)2•12H2O,设明矾为1mol,则溶液中含有1molAl3+,2molSO42-,由反应SO42-+Ba2+=BaSO4↓可知,使SO42-全部转化成BaSO4沉淀,需要2molBa(OH)2,则加入4molOH-,则发生Al3++4OH-=AlO2-+2H2O,所以最后溶液中存在AlO2-,
故选C.点评:
本题考点: 离子方程式的有关计算.
考点点评: 本题考查离子方程式的书写,题目难度中等,本题中注意判断使SO42-全部转化成BaSO4沉淀需要Ba(OH)2的物质的量,根据Al3+和OH-物质的量的关系判断反应产物. - 1年前
相关推荐
- 等物质的量的ba(oh)2与明矾加入足量的水中,的离子方程式
 babytiger211791年前1
babytiger211791年前1 -
 我爱飙拖拉机 共回答了13个问题
我爱飙拖拉机 共回答了13个问题 |采纳率84.6%oH+Al=AL(OH)3 Ba+so4=ba(so4)21年前查看全部
- 下列除杂方案中正确的是1.NaOH溶液中混有的Ba(OH)2(CuSO4)2.CO2中混有的CO(炽热的木炭)3.CO2
下列除杂方案中正确的是
1.NaOH溶液中混有的Ba(OH)2(CuSO4)
2.CO2中混有的CO(炽热的木炭)
3.CO2中混有的HCl(NaOH溶液)
4.Cu(NO3)2溶液中混有的AgNO3(Cu粉)
选什么?为什么? 512vod1年前2
512vod1年前2 -
 阿里阿朵 共回答了16个问题
阿里阿朵 共回答了16个问题 |采纳率93.8%第四个正确.
1.在消除Ba(OH)2的同时引入了新的杂质:Na2SO4,更不易除去.
2.在CO2中加炽热的木炭不会除去CO,反而有可能让CO2变成CO.
3.NaOH溶液在消除HCl的同时也消灭了CO2.1年前查看全部
- 用一种试剂鉴别NaCl、AlCl3、Ba(OH)2、HCl,可以加热
 突围行动1年前4
突围行动1年前4 -
 彪彪_ff 共回答了16个问题
彪彪_ff 共回答了16个问题 |采纳率93.8%NaHco3.因它加入到NaCl中,无现像;加入AlCl3中,有气泡和沉淀(双水解反应);加入Ba(OH)2中,只有沉淀;加入HCl中,只有气泡.此题很多人会选 Na2co3,但如果Na2co3量控制不好,加入HCl中,会没有现像的.1年前查看全部
- 有四种物质的溶液1 .Ba(OH)2 2.Na2SO4 3.HNO3 4.FeCl3 不用其他试剂就能逐一鉴别出来,其鉴
有四种物质的溶液1 .Ba(OH)2 2.Na2SO4 3.HNO3 4.FeCl3 不用其他试剂就能逐一鉴别出来,其鉴别顺序是
 laoyang11271年前1
laoyang11271年前1 -
 ana-shuier 共回答了21个问题
ana-shuier 共回答了21个问题 |采纳率95.2%1.4能看出来~是黄色的液体
2.FeCL3+Ba(oh)2=Fe(OH)3(沉淀)+BaCL3
3.Ba(OH)2+Na2SO4=Baso4+ NaOH
4 剩下是硝酸~1年前查看全部
- Ba(OH)2、Na2SO4 、MgCl2、FeCl3四种物质不用其他试剂可以鉴别吗?
 一定要惩戒申通1年前3
一定要惩戒申通1年前3 -
 twpma 共回答了20个问题
twpma 共回答了20个问题 |采纳率100%加水,+3铁离子黄色,盯着他看看出来了FeCl3.然后用这个试其它三种溶液,有沉淀的是Ba(OH)2,然后用Ba(OH)2试其它两种,有沉淀是,Na2SO4,然后最后的就是MgCl21年前查看全部
- CU ,CH3COOH,HCI ,BA(OH)2,NACI ,CO2,哪些是强电解质,哪些是弱电解质,那
 gmtg1年前2
gmtg1年前2 -
 巧克力6719 共回答了20个问题
巧克力6719 共回答了20个问题 |采纳率80%CU CO2不是电解质
CH3COOH是弱电解质
其他都是强电解质1年前查看全部
- CU ,CH3COOH,HCI ,BA(OH)2,NACI ,CO2,哪些是强电解质,哪些是弱电解质,那些不是电解质
CU ,CH3COOH,HCI ,BA(OH)2,NACI ,CO2,哪些是强电解质,哪些是弱电解质,那些不是电解质
快 耳朵养小鱼LEE1年前3
耳朵养小鱼LEE1年前3 -
 情殇浪子 共回答了14个问题
情殇浪子 共回答了14个问题 |采纳率100%强电解质Hcl Nacl Ba(oH)2
弱电解质CH3COOH
非电解质CO2
Cu即不是电解质也不是非电解质,因为它不是化合物.1年前查看全部
- 进行Ba(OH)2溶液的导电性实验时,如果在Ba(OH)2溶液中逐渐加入(或通入)下列物质,能观察到灯光“亮-暗-亮”变
进行Ba(OH)2溶液的导电性实验时,如果在Ba(OH)2溶液中逐渐加入(或通入)下列物质,能观察到灯光“亮-暗-亮”变化的是( )
A. NaOH溶液
B. CO2
C. HCl溶液
D. Na2CO3溶液 宜兴蛟龙1年前3
宜兴蛟龙1年前3 -
 光速飛翔 共回答了19个问题
光速飛翔 共回答了19个问题 |采纳率94.7%解题思路:溶液导电的原因是溶液中存在能自由移动的离子,由题意可知,向一定量的Ba(OH)2,溶液中分别滴加一种物质,灯泡会出现“亮→暗→熄灭→亮”现象,即溶液导电性越来越差,直至导电能力为零,到最后灯泡又发光(溶液中又有自由移动的离子),据此分析溶液中离子的变化进行解答即可.A、NaOH溶液与氢氧化钠溶液不反应,在Ba(OH)2溶液中逐渐加入NaOH溶液,溶液中始终存在能自由移动的离子,灯泡不会熄灭,故选项错误.
B、二氧化碳与Ba(OH)2溶液反应生成碳酸钡沉淀和水,随着反应的进行溶液中的能自由移动的离子越来越少,灯光越来越暗,至恰好完全反应时溶液中没有自由移动的离子,灯熄灭,继续通入二氧化碳,二氧化碳与水反应生成碳酸,则溶液中存在中氢离子和碳酸根离子,从而灯泡又会发光,能观察到灯光“亮-暗-亮”变化,故选项正确.
C、HCl溶液与Ba(OH)2溶液反应生成氯化钡和水,溶液中始终存在能自由移动的离子,灯泡不会熄灭,故选项错误.
D、碳酸钠与Ba(OH)2溶液反应生成碳酸钡沉淀和氢氧化钠,溶液中始终存在能自由移动的离子,灯泡不会熄灭,故选项错误.
故选:B.点评:
本题考点: 溶液的导电性及其原理分析;碱的化学性质.
考点点评: 本题难度不大,熟练掌握碱的化学性质、溶液导电的原因(必需符合两点:①物质溶解在水中形成溶液;②能得到自由移动的离子)并能灵活运用是正确解答本题的关键.1年前查看全部
- NaHSO4和Ba(OH)2反应方程式为什么有两个?
 紫范1年前1
紫范1年前1 -
 valenx88 共回答了22个问题
valenx88 共回答了22个问题 |采纳率90.9%酸式盐和碱反应,
当碱过量时[Ba(OH)2和NaHSO4物质的量比大于1:2],酸式盐中的酸根完全反应;
当碱少量时[Ba(OH)2和NaHSO4物质的量比小于1:2],酸式盐中的酸根未完全反应;1年前查看全部
- NaH2PO4 和Ba(OH)2反应 方程式
NaH2PO4 和Ba(OH)2反应 方程式
NaH2PO4溶液和 Ba(OH)2溶液反应(分足量和少量的情况),请写出方程式,以及离子方程式
NaH2PO4溶液足量或少量是什么样子的啊 弟弟121年前1
弟弟121年前1 -
 yarrowtan 共回答了20个问题
yarrowtan 共回答了20个问题 |采纳率95%(1)NaH2PO4溶液和 Ba(OH)2溶液反应(足量)
2NaH2PO4 + 3Ba(OH)2 == Ba3(PO4)2 + 4H2O + 2NaOH
2H2PO4- + 3Ba2+ + 4OH- == Ba3(PO4)2 + 4H2O
(2)NaH2PO4溶液和 Ba(OH)2溶液反应(少量)
2NaH2PO4 + Ba(OH)2 == BaHPO4 + Na2HPO4 + 2H2O
2H2PO4- + Ba2+ + 2OH- == BaHPO4 + HPO42- + 2H2O
.1年前查看全部
- 为什么鉴别硫酸根不能用Ba(OH)2?
 E-make1年前1
E-make1年前1 -
 nnjwq 共回答了25个问题
nnjwq 共回答了25个问题 |采纳率100%可能有亚硫酸根,碳酸根干扰1年前查看全部
- 用一种试剂鉴别NaCl、AlCl3、Ba(OH)2、HCl四种物质
 logoswords1年前3
logoswords1年前3 -
 憔悴的胖子 共回答了18个问题
憔悴的胖子 共回答了18个问题 |采纳率94.4%NaHCO3
1,在NaCl中物现象
2,在AlCl3中有气泡和沉淀
3,在Ba(OH)2中有沉淀
4,在HCl中有气体
不懂再问,
补充下,说Na2CO3的那个
如果Na2co3量控制不好,加入HCl中,会没有现像1年前查看全部
- 世界上最强的碱是Ba(OH)2吗?如果不是请告诉我最强的碱是什么.
 hongjia_5171年前4
hongjia_5171年前4 -
 bapf 共回答了16个问题
bapf 共回答了16个问题 |采纳率93.8%CsOH 因为Cs的金属性最强(在自然界中)1年前查看全部
- A和E溶液显碱性,为碱或强碱弱酸盐.根据离子共存可知二者为Ba(OH)2、Na2CO3,由于0.1mol/L的A溶液的p
A和E溶液显碱性,为碱或强碱弱酸盐.根据离子共存可知二者为Ba(OH)2、Na2CO3,由于0.1mol/L的A溶液的pH小于13,所以A是Na2CO3;不明白请高人指点
 lifete1年前1
lifete1年前1 -
 星星草儿 共回答了9个问题
星星草儿 共回答了9个问题 |采纳率77.8%由于0.1mol/L的A溶液的pH小于13,所以A是Na2CO3;
Ba(OH)2是强碱,完全电离,其碱性来源就是自身电离出来的氢氧根离子,如果由于0.1mol/L的A溶液是Ba(OH)2的话,PH肯定是等于13,而不是小于13
Na2CO3是强碱弱酸盐,其碱性来源于CO3根离子的水解,水解肯定不会完全的,所以PH小于131年前查看全部
- 向明矾溶液里滴加Ba(OH)2溶液,当SO42-离子恰好沉淀完全时,铝元素的存在形式是( )
向明矾溶液里滴加Ba(OH)2溶液,当SO42-离子恰好沉淀完全时,铝元素的存在形式是( )
A. 一部分为Al(OH)3沉淀,一部分以Al3+存在于溶液中
B. 一部分为Al(OH)3沉淀,一部分以[Al(OH)4]-形式存在于溶液中
C. 全部为Al(OH)3沉淀
D. 几乎全部以[Al(OH)4]-形式存在于溶液中 asda0ggh01年前2
asda0ggh01年前2 -
 毛毛西西 共回答了11个问题
毛毛西西 共回答了11个问题 |采纳率90.9%解题思路:向明矾溶液中滴加Ba(OH)2溶液,当SO42-沉淀完全时,KAl(SO4)2与Ba(OH)2以1:2反应,以此来解答.向明矾溶液中滴加Ba(OH)2溶液,当SO42-沉淀完全时,KAl(SO4)2与Ba(OH)2以1:2反应,
该反应为KAl(SO4)2+2Ba(OH)2═2BaSO4↓+K[Al(OH)4],
即铝元素全部以[Al(OH)4]-形式存在,
故选D.点评:
本题考点: 镁、铝的重要化合物.
考点点评: 本题考查物质之间的反应,明确硫酸根离子全部沉淀时发生的化学反应是解答本题的关键,注意氢氧化铝的两性来解答,题目难度不大.1年前查看全部
- 明矾溶液中加入Ba(OH)2至生成的沉淀的物质的量最多的离子方程式?
明矾溶液中加入Ba(OH)2至生成的沉淀的物质的量最多的离子方程式?
明矾溶液中加入Ba(OH)2至生成的沉淀的质量最多的离子方程式? betaaduck1年前1
betaaduck1年前1 -
 食果果 共回答了21个问题
食果果 共回答了21个问题 |采纳率71.4%KAl(SO4)2和Ba(OH)2反应历程说先是Al3+与OH-形成氢氧化铝沉淀,等Al3+完全沉淀后Ba2+与SO42-再完全形成沉淀,等SO42-也都沉淀了氢氧化铝再与OH-溶解.KAl(SO4)2 设1mol的KAl(SO4)2 ,含1molAl3+和2mol的SO42-1步,首先Al3...1年前查看全部
- 鉴别Na2CO3与NaHCO3的方法 可以用BaCl2 或者CaCl2吗 BaCl2和Ba(OH)2都可以与Na2CO3
鉴别Na2CO3与NaHCO3的方法 可以用BaCl2 或者CaCl2吗 BaCl2和Ba(OH)2都可以与Na2CO3反应吗?
 你想去的1年前1
你想去的1年前1 -
 357953324 共回答了20个问题
357953324 共回答了20个问题 |采纳率95%说的对,可以鉴定的.
CO32-+Ba2+=BaCO3↓
CO32-+Ca2+=CaCO3↓
但是HCO3-就不行啦,不能反应的,就算是你认为有HCO3-=CO32-+H+,那么也会生成HCl,还是会溶解地.
后面那个问题也是可以的.但是我要提醒Ba(OH)2或者是Ca(OH)2不能鉴定Na2CO3与NaHCO3的,因为它会与HCO3-=CO32-+H+生成的H+作用,不但避免了HCl的生成,还且不断促进该反应生成CO32-,结果是Na2CO3与NaHCO3都能反应.
不知道你还有别的问题吗1年前查看全部
- 如图所示,烧杯中装有稀硫酸,利用此装置制成过量反应指示器,当闭合开关S后,向烧杯中逐渐滴入Ba(OH)2
如图所示,烧杯中装有稀硫酸,利用此装置制成过量反应指示器,当闭合开关S后,向烧杯中逐渐滴入Ba(OH)2
溶液时弹簧测力计的示数将-----,完全反应时,弹簧测力计的示数与------------时相同,当继续滴入BaOH)2时,示数将-----?

 核战kk1年前1
核战kk1年前1 -
 朕晓仁 共回答了23个问题
朕晓仁 共回答了23个问题 |采纳率91.3%溶液时弹簧测力计的示数将---减小,完全反应时,弹簧测力计的示数与------断开--时相同,当继续滴入BaOH)2时,示数将-----增加
看溶液中的带电离子多----电阻小---线圈电流大---读数打1年前查看全部
- (1)25℃时,浓度为0.1mol•L-1的6种溶液:①HCl,②CH3OOH,③Ba(OH)2,④Na 2C
(1)25℃时,浓度为0.1mol•L-1的6种溶液:①HCl,②CH3OOH,③Ba(OH)2,④Na 2CO3,⑤KCl,
⑥NH4Cl溶液pH由小到大的顺序为______(填写编号).
(2)25℃时,醋酸的电离常数Ka=1.7×10-5mol/L,则该温度下CH3COONa的水解平衡常数Kh=______mol•L-1(保留到小数点后一位).
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈______(填“酸性”,“中性”或“碱性”),请写出溶液中离子浓度间的一个等式:______.
(4)25℃时,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中
c(CH3COO-)+c(CH3COOH)=______,m与n的大小关系是m______n(填“>”“=”或“<”).
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3•H2O的电离常数Ka=______. beilei19191年前1
beilei19191年前1 -
 三月人面桃花 共回答了13个问题
三月人面桃花 共回答了13个问题 |采纳率100%解题思路:(1)先将物质的按照碱、盐、酸的顺序分类,再根据盐的水解和弱电解质的电离特点比较pH;
(2)CH3COONa的水解平衡常数Kh=
=c(CH3COOH).c(OH−) c(CH3COO−)
=c(CH3COOH).c(H+).c(OH−) c(CH3COO−).c(H+)
;Kw Ka
(3)pH=3的醋酸和pH=11的氢氧化钠溶液中,醋酸浓度大于氢氧化钠,二者等体积混合,醋酸过量,溶液中存在物料守恒和电荷守恒;
(4)醋酸钠是强碱弱酸盐,其溶液呈碱性,要使醋酸和氢氧化钠混合溶液呈中性,则醋酸应该稍微过量,溶液中存在物料守恒;
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,说明醋酸根离子和铵根离子水解程度相等,则醋酸和一水合氨电离程度相等.(1)盐酸和醋酸为酸,氢氧化钡为碱,碳酸钠、氯化钾和氯化铵为盐,碳酸钠为强碱弱酸盐,其溶液呈碱性,氯化钾为强酸强碱盐,为中性,氯化铵为强酸弱碱盐,其溶液为酸性,相同浓度的盐酸和醋酸,醋酸中氢离子浓度小于盐酸,所以pH盐酸小于醋酸,则这几种溶液的pH由小到大的顺序是①②⑥⑤④③,
故答案为:①②⑥⑤④③;
(2)CH3COONa的水解平衡常数Kh=
c(CH3COOH).c(OH−)
c(CH3COO−)=
c(CH3COOH).c(H+).c(OH−)
c(CH3COO−).c(H+)=
Kw
Ka=
10−14
1.7×10−5=5.9×10-10,故答案为:5.9×10-10;
(3)pH=3的醋酸和pH=11的氢氧化钠溶液中,醋酸浓度大于氢氧化钠,二者等体积混合,醋酸过量,导致混合溶液呈酸性,溶液中存在物料守恒和电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),
故答案为:酸性;c(Na+)+c(H+)=c(CH3COO-)+c(OH-);
(4)醋酸钠是强碱弱酸盐,其溶液呈碱性,要使醋酸和氢氧化钠混合溶液呈中性,则醋酸应该稍微过量,所以m>n,二者混合时溶液体积增大一倍,溶液中存在物料守恒,根据物料守恒得c(CH3COO-)+c(CH3COOH)=0.5mmol/L,
故答案为:0.5mmol/L;>;
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,说明醋酸根离子和铵根离子水解程度相等,则醋酸和一水合氨电离程度相等,其电离平衡常数相等,即NH3•H2O的电离常数Ka=1.7×10-5mol/L,故答案为:1.7×10-5mol/L.点评:
本题考点: 弱电解质在水溶液中的电离平衡;盐类水解的应用;酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查了弱电解质的电离,涉及pH大小的判断、酸碱混合溶液定性判断等知识点,明确物质的性质及弱电解质电离特点是解本题关键,难点是(2),会根据微粒间的关系进行公式转换,难度较大.1年前查看全部
- 下列化学方程式正确的是( )A. Cu+2HCl=CuCl2+H2↑B. BaCl2+2KOH=Ba(OH)2↓+2K
下列化学方程式正确的是( )
A. Cu+2HCl=CuCl2+H2↑
B. BaCl2+2KOH=Ba(OH)2↓+2KCl2
C. Fe+2KNO3=2K+Fe(NO3)2
D. NaOH+HNO3═NaNO3+H2O 鱼lin1年前4
鱼lin1年前4 -
 405888 共回答了17个问题
405888 共回答了17个问题 |采纳率82.4%解题思路:判断方程式正误要根据写方程式的步骤去考虑,每一步注意事项,首先考虑该反应是否能够发生,再考虑具体步骤中哪一项错误.A、铜排在金属活动顺序表中氢的后面,不能与酸反应,故A错误;
B、首先氢氧化钡溶于水,这个反应不能发生,再者氯化钾的化学式书写错误,故B错误;
C、此反应不能发生,铁排在钾的后面,不能置换出钾,故C错误;
D、反应原理和化学方程式都正确,故D正确;
故选D点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 在解此类题时,首先分析应用的原理是否正确,然后再根据方程式的书写规则进行判断.1年前查看全部
- 下列反应是吸热反应的是( )A.铝片与稀盐酸反应B.NH4Cl与Ba(OH)2•8H2O的反应C.灼热的碳在足量O2中
下列反应是吸热反应的是( )
A.铝片与稀盐酸反应
B.NH4Cl与Ba(OH)2•8H2O的反应
C.灼热的碳在足量O2中燃烧
D.酸碱中和反应 你们大笑1年前1
你们大笑1年前1 -
 yuvee 共回答了19个问题
yuvee 共回答了19个问题 |采纳率78.9%解题思路:常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应、所有中和反应、绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、少数分解、置换以及某些复分解反应(如铵盐和强碱).A.铝片与稀盐酸反应制取H2属于放热反应,故A错误;
B.Ba(OH)2•8H2O与NH4Cl反应属于吸热反应,故B正确;
C.灼热的碳在足量O2中燃烧,燃烧是氧化反应,属于放热反应,故C错误;
D.酸碱中和反应,属于放热反应,故D错误,
故选B.点评:
本题考点: 吸热反应和放热反应.
考点点评: 本题考查吸热反应,难度不大.抓住中学化学中常见的吸热或放热的反应是解题的关键.1年前查看全部
- 现有100m/ll明矾溶液,向其中滴加1mol/l的Ba(oh)2溶液,欲使产生的沉淀的质量最大,应加入Ba(OH)2溶
现有100m/ll明矾溶液,向其中滴加1mol/l的Ba(oh)2溶液,欲使产生的沉淀的质量最大,应加入Ba(OH)2溶液的体
求大大详细回答 老师讲课时说 AL(OH)2的摩尔质量应为78*2 ,为什么 要乘以2
100ML 2mol/l 明矾 sh_wb03211年前1
sh_wb03211年前1 -
 xin_fulin 共回答了16个问题
xin_fulin 共回答了16个问题 |采纳率81.3%首先要知道沉淀最大时的反应 设 KAl(SO4)2 为 1mol
则当Al3+全部沉淀时,3 mol OH- 即 1.5 mol Ba(OH)2
此时SO42-沉淀了 1.5 mol 还剩下2-1.5=0.5 mol
继续加入0.5 Ba(OH)2 时 生成 0.5 BaSO4 溶解 1mol Al(OH)3
0.5 BaSO4 质量为 233*0.5 1 mol Al(OH)3 质量为 78
生成的BaSO4沉淀比溶解的Al(OH)3沉淀质量大.
因此沉淀质量最大时,就是 SO42- 全部沉淀时的情况,
即 1 mol KAl(SO4)2 加入 2 mol Ba(OH)2 时沉淀质量最大,
沉淀就是BaSO4 此时Al(OH)3全部溶解了.
反应为 Al3+ +2SO42- +2Ba2+ +4OH- ==AlO2- +2BaSO4 +2H2O
所以 Ba(OH)2体积是明矾体积的两倍1年前查看全部
- Ba(OH)2溶液与过量和不过量的NaHCO3溶液混合地离子反应式是什么?
 xuanyuan991年前2
xuanyuan991年前2 -
 dazhfp 共回答了20个问题
dazhfp 共回答了20个问题 |采纳率85%过量
那么 Ba(2+)+2OH(-)+2HCO3(-)BaCO3(沉淀)+H2O1年前查看全部
- Ba(OH)2溶液与过量和不过量的NaHCO3溶液混合的离子反应式各是什么?
 吃了13个小笼包1年前4
吃了13个小笼包1年前4 -
 lss1980xx 共回答了22个问题
lss1980xx 共回答了22个问题 |采纳率95.5%Ba(OH)2+ NaHCO3(少量)= H2O +BaCO3(沉淀)+NaOH
Ba2+ + OH- + HCO3-=H2O +BaCO3(沉淀)
Ba(OH)2+ 2NaHCO3(过量)= 2H2O +BaCO3(沉淀)+Na2CO3
Ba2+ + 2OH- + 2HCO3= 2H2O +BaCO3(沉淀)+CO32-1年前查看全部
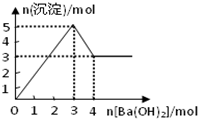
- 如图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是(
如图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )
 A. MgSO4
A. MgSO4
B. KAl(SO4)2
C. Al2(SO4)3
D. NaAlO2 snowno0011年前2
snowno0011年前2 -
 lxl747 共回答了20个问题
lxl747 共回答了20个问题 |采纳率95%解题思路:A、氢氧化镁不溶于氢氧化钡溶液;
B、由图可知溶解氢氧化铝需要1mol氢氧化钡,由Al(OH)3+OH-=AlO2-+2H2O可知沉淀中Al(OH)3为2mol,加入3mol氢氧化钡沉淀最大,再加入氢氧化钡,又生成硫酸钡,且氢氧化铝会逐渐溶解,最终沉淀为4mol;
C、先发生反应Ba2++SO42-=BaSO4↓、Al3++3OH-═Al(OH)3↓,然后发生Al(OH)3+NaOH═NaAlO2+2H2O,由图可知溶解氢氧化铝需要1mol氢氧化钡,由Al(OH)3+OH-=AlO2-+2H2O可知沉淀中Al(OH)3为2mol,结合加入3mol氢氧化钡沉淀最大判断;
D、偏铝酸钠与氢氧化钡不反应.A、氢氧化镁不溶于氢氧化钡溶液,沉淀量达最大后,再加氢氧化钡溶液,沉淀量不变,故A错误;
B、由图可知溶解氢氧化铝需要1mol氢氧化钡,由Al(OH)3+OH-=AlO2-+2H2O可知沉淀中Al(OH)3为2mol,故KAl(SO4)2为2mol,加入3mol氢氧化钡,可以生成硫酸钡3mol,n(Al3+):n(OH-)=2mol:6mol=1:3,发生反应Al3++3OH-═Al(OH)3↓,可以得到2molAl(OH)3,沉淀为3mol+2mol=5mol,再加入氢氧化钡,又生成硫酸钡,且氢氧化铝会逐渐溶解,最终沉淀为4mol,故B错误;
C、由图可知溶解氢氧化铝需要1mol氢氧化钡,由Al(OH)3+OH-=AlO2-+2H2O可知沉淀中Al(OH)3为2mol,故Al2(SO4)3为1mol,加入3mol氢氧化钡,可以生成硫酸钡3mol,n(Al3+):n(OH-)=2mol:6mol=1:3,发生反应Al3++3OH-═Al(OH)3↓,可以得到2molAl(OH)3,沉淀为3mol+2mol=5mol,故C正确;
D、偏铝酸钠与氢氧化钡不反应,不能产生沉淀,故D错误;
故选C.点评:
本题考点: 镁、铝的重要化合物.
考点点评: 本题以图象为载体考查镁铝化合物的性质,难度中等,明确发生的化学反应是解答的关键,反应发生的先后顺序是学生解答中的难点,注意图象比例关系.1年前查看全部
- 已知某温度下水离子积Kw=2.5*10-13,将30ml,0.2mol/L的Ba(OH)2溶液与20ml,0.2mol/
已知某温度下水离子积Kw=2.5*10-13,将30ml,0.2mol/L的Ba(OH)2溶液与20ml,0.2mol/L的Na2CO3溶液混合,充分反应后变浑浊,求1、沉淀质量 2、滤液PH值
 大大庭1年前2
大大庭1年前2 -
 昆山小笨笨 共回答了10个问题
昆山小笨笨 共回答了10个问题 |采纳率80%1、沉淀质量,根据反应Ba(OH)2 + Na2CO3 === BaCO3 + 2NaOH,Ba(OH)2过量,所以沉淀=0.2mol/L*0.02L=0.004mol,乘BaCO3摩尔质量就欧了.
2、滤液PH值,Ba(OH)2过量的=0.2mol/L*0.01L=0.002mol,所以c(OH-)=0.002mol*2 / 0.05L=0.08mol/L.又:Kw=2.5*10-13=c(H+)*c(OH-),所以c(H+)可得了吧,最后算pH值,你会的.OK
追点分嘛 嘿嘿1年前查看全部
- 下列溶液中,碱性最强的是A、0.005mol/L的Ba(OH)2溶液B、PH=11的碳酸钠溶液C、c(H+)=2X10^
下列溶液中,碱性最强的是
A、0.005mol/L的Ba(OH)2溶液
B、PH=11的碳酸钠溶液
C、c(H+)=2X10^-4mol/L
D、c(OH-)=1X10^-13mol/L double831年前2
double831年前2 -
 Darkblue_ 共回答了15个问题
Darkblue_ 共回答了15个问题 |采纳率100%A C(OH-)=0.01mol/L
B C(OH-)=0.001mol/L
C C(OH-)=5*10^-9mol/L
D c(OH-)=1X10^-13mol/L
选A1年前查看全部
- A和E溶液显碱性,为碱或强碱弱酸盐.根据离子共存可知二者为Ba(OH)2、Na2CO3,由于0.1mol/L的A溶液的p
A和E溶液显碱性,为碱或强碱弱酸盐.根据离子共存可知二者为Ba(OH)2、Na2CO3,由于0.1mol/L的A溶液的pH小于13,所以A是Na2CO3;E是Ba(OH)2不明白
 lixi04141年前1
lixi04141年前1 -
 fengcai1976 共回答了14个问题
fengcai1976 共回答了14个问题 |采纳率78.6%因为氢氧化钡是强碱在水中完全电离 碳酸钠是强碱弱酸盐 是弱电解质啊在水中没法完全电离1年前查看全部
- 一些 水电离的 急.常温下 关于溶液的稀释,下列说法正确的是:A 将1mol/l的Ba(OH)2溶液加水稀释为2L,pH
一些 水电离的 急.
常温下 关于溶液的稀释,下列说法正确的是:
A 将1mol/l的Ba(OH)2溶液加水稀释为2L,pH=13
B pH=6的盐酸加水稀释10倍 pH=7
C pH=4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的c(H+)=0.000006mol/l
D pH=8的NaOH溶液加水稀释100倍 pH=6
常温下某溶液中由水电离的氢离子浓度为十的负十三次方摩尔每升,则该溶液可能是1:二氧化硫溶液 2 氯化铵水溶液 3 硝酸钠水溶液 4 氢氧化钠水溶液
A :1 、4 B:1 、2 C:2 、3 D:3 、4
对室温pH 相同体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是:
A 加适量的醋酸钠晶体后,两溶液的pH均增大
B 使温度都升高20度后,两溶液的pH均不变
C 加水稀释两倍后,两溶液的pH均减小
D 加足量的锌充分反映后,两溶液产生的氢气一样多 中它个500万1年前3
中它个500万1年前3 -
 lxxldd 共回答了16个问题
lxxldd 共回答了16个问题 |采纳率87.5%最终答案均为A
1、A的条件不足,应该指明是多少升溶液稀释为2L.
B错,酸稀释后仍然是酸性,PH1年前查看全部
- 某温度下,水的离子积常数K=10-13,将此温度下pH=11的Ba(OH)2溶液aL与pH=1的H2SO4溶液bL混合(
某温度下,水的离子积常数K=10-13,将此温度下pH=11的Ba(OH)2溶液aL与pH=1的H2SO4溶液bL混合(1)若...
某温度下,水的离子积常数K=10-13,将此温度下pH=11的Ba(OH)2溶液aL与pH=1的H2SO4溶液bL混合(1)若所得混合溶液为中性,则a:b= ,生成沉淀的物质的量为 mol.(2)若a:b=9:2,则所得溶液pH= ,该混合溶液最多能够溶解铁粉 g. chongxue021年前1
chongxue021年前1 -
 陷入迷茫的人 共回答了18个问题
陷入迷茫的人 共回答了18个问题 |采纳率100%H+为0.1mol/L OH-为0.01mol/L
则a:b=10:1沉淀的物质的量为0.05b mol(沉淀的物质的量和H2SO4量一样)
(2)则c(H+)=(2×0.1-9×0.01)/11=0.01mol/L
则PH=2 则m(Fe)=56×0.5×n(H+)1年前查看全部
- 物质的量浓度相同的200mL Ba(OH)2溶液和150mL NaHCO3混合后,最终溶液中离子的物
物质的量浓度相同的200mL Ba(OH)2溶液和150mL NaHCO3混合后,最终溶液中离子的物质的量浓度关系正确的是( )
A. c(OH-)>c(Ba2+)>c(Na+)>c(CO32-)
B. c(OH-)>c(Na+)>c(Ba2+)>C(H+)
C. c(OH-)=c(Ba2+)+c(Na+)+c(H+)
D. c(H+)+c(Na+)+2c(Ba2+)=c(OH-) 39005481年前4
39005481年前4 -
 lenoven 共回答了23个问题
lenoven 共回答了23个问题 |采纳率73.9%解题思路:物质的量浓度相同的200mL Ba(OH)2溶液和150mL NaHCO3混合后,Ba(OH)2+NaHCO3=BaCO3↓+H2O+NaOH,最终溶液中NaOH和Ba(OH)2,依据溶液中的离子比较离子浓度大小;A、溶液中溶质为氢氧化钠和氢氧化钡,离子浓度大小为:c(OH-)>c(Na+)>c(Ba2+)>C(H+),故A错误;
B、溶液中溶质为氢氧化钠和氢氧化钡,离子浓度大小为:c(OH-)>c(Na+)>c(Ba2+)>C(H+),故B正确;
C、溶液中存在电荷守恒:c(OH-)+2c(CO32-)=2c(Ba2+)+c(Na+)+c(H+),故C错误;
D、溶液中存在电荷守恒:c(OH-)+2c(CO32-)=2c(Ba2+)+c(Na+)+c(H+),故D错误;
故选B.点评:
本题考点: 离子浓度大小的比较;离子方程式的有关计算.
考点点评: 本题考查了化学方程式的计算应用,溶液中离子浓度大小比较的方法判断,溶液中电荷守恒的计算应用.题目难度中等.1年前查看全部
- (2011•广东)某同学进行试验探究时,欲配制1.0mol•L-1Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(O
(2011•广东)某同学进行试验探究时,欲配制1.0mol•L-1Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2•8H2O试剂(化学式量:315).在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物.为探究原因,该同学查得Ba(OH)2•8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6.
(1)烧杯中未溶物仅为BaCO3,理由是______.
(2)假设试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,设计试验方案,进行成分检验,在答题卡上写出实验步骤、预期现象和结论.(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
(3)将试剂初步提纯后,准确测定其中Ba(OH)2•8H2O的含量.实验如下:实验步骤 预期现象和结论 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. 步骤2:取适量滤液于试管中,滴加稀硫酸. 步骤3:取适量步骤1中的沉淀于是试管中,______ 步骤4:
①配制250ml 约0.1mol•L-1Ba(OH)2•8H2O溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,______,将溶液转入______,洗涤,定容,摇匀.
②滴定:准确量取25.00ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将______ (填“0.020”、“0.05”、“0.1980”或“1.5”)mol•L-1盐酸装入50ml酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗盐酸Vml.
③计算Ba(OH)2•8H2O的质量分数=
×100%0.25L×
mol×315g/mol0.198V 50 wg (只列出算式,不做运算)
×100%0.25L×
mol×315g/mol0.198V 50 wg
(4)室温下,______(填“能”或“不能”) 配制1.0mol•L-1Ba(OH)2溶液. mf5021年前1
mf5021年前1 -
 水88 共回答了17个问题
水88 共回答了17个问题 |采纳率88.2%解题思路:(1)Ba(OH)2•8H2O与CO2作用转化为BaCO3;
(2)步骤2:预期现象和结论:有白色沉淀生成,说明有Ba2+;
步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中.
预期现象和结论:试管中有气泡生成,烧杯中的澄清石灰水变浑浊,结合步骤2说明沉淀是BaCO3;
步骤4:取适量滤液于烧杯中,用pH计测其pH值;
预期现象和结论:pH>9.6,说明有大量的OH-,综合上面步骤可知试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,假设成立,
(3)①将样品在烧杯中溶解后,过滤,将滤液移入250mL容量瓶中,洗涤将洗涤液移入容量瓶,定容、摇匀;
②盐酸体积最多不能多于50ml,根据50mL计算盐酸的最小浓度,应该是选大于最小浓度而且接近的;
③令250mL溶液中氢氧化钡的浓度为cmol/L,根据消耗的盐酸列方程计算c的值,进而计算250mL溶液中氢氧化钡的物质的量,据此计算样品中Ba(OH)2•8H2O的质量分数.
(4)根据氢氧化钡的溶解度估算饱和溶液的物质的量浓度,据此判断.(1)烧杯中未溶物仅为BaCO3,则由于Ba(OH)2•8H2O与CO2作用转化为BaCO3,
故答案为:Ba(OH)2•8H2O与CO2作用转化为BaCO3;
(2)步骤2:预期现象和结论:有白色沉淀生成,说明有Ba2+;
步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中,
预期现象和结论:试管中有气泡生成,烧杯中的澄清石灰水变浑浊,结合步骤2说明沉淀是BaCO3;
步骤4:取适量滤液于烧杯中,用pH计测其pH值.预期现象和结论:pH>9.6,说明有大量的OH-,综合上面步骤可知试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,假设成立,
故答案为:步骤2:预期现象和结论:有白色沉淀生成,说明有Ba2+;
步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中;
预期现象和结论:试管中有气泡生成,烧杯中的澄清石灰水变浑浊,结合步骤2说明沉淀是BaCO3;
步骤4:取适量滤液于烧杯中,用pH计测其pH值;
预期现象和结论:pH>9.6,说明有大量的OH-,综合上面步骤可知试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,假设成立;
(3)①将样品在烧杯中溶解后,过滤,将滤液移入250mL容量瓶中,洗涤将洗涤液移入容量瓶,定容、摇匀,
故答案为:溶解、过滤;250ml的容量瓶中;
②盐酸体积最多不能多于50ml,根据50mL计算盐酸的最小浓度,令盐酸的最小浓度为amol/L,则:
0.025L×0.1mol/L×2=amol/L×0.05L,解得a=0.1mol/L,应该是选大于最小浓度而且接近的,故选择0.1980mol/L的盐酸,
故答案为:0.1980;
③令250mL溶液中氢氧化钡的浓度为cmol/L,则:
0.025L×cmol/L×2=0.1980mol/L×V×10-3L,解得c=[0.198V/50],
故Ba(OH)2•8H2O的质量分数=
0.25L×
0.198V
50mol×315g/mol
wg×100%,
故答案为:
0.25L×
0.198V
50mol×315g/mol
wg×100%;
(4)室温下,氢氧化钡的溶解度为3.9g,溶液的物质的量浓度约是
3.9g
171g/mol
0.1L=0.23mol/L,故室温下,不能配制1.0mol•L-1Ba(OH)2溶液,
故答案为:不能.点评:
本题考点: 探究物质的组成或测量物质的含量;溶解度、饱和溶液的概念;配制一定物质的量浓度的溶液.
考点点评: 本题考查物质成分与含量测定、对实验方案的理解与设计、溶液配制、中和滴定、化学计算等,题目综合性较大,难度中等,侧重对实验方案设计与化学计算,是对学生综合能力的考查.1年前查看全部
- (2006•黄石)用一种试剂来鉴别NaOH、Ba(OH)2、稀HCl三种溶液,这种试剂是( )
(2006•黄石)用一种试剂来鉴别NaOH、Ba(OH)2、稀HCl三种溶液,这种试剂是( )
A.Na2CO3溶液
B.无色酚酞试液
C.石蕊试液
D.MgCl2溶液 ddswing1年前1
ddswing1年前1 -
 自我的狮子 共回答了17个问题
自我的狮子 共回答了17个问题 |采纳率88.2%解题思路:一剂鉴别(即限用一种试剂来鉴别多种物质),其原理是选择一种试剂,分别加入到待测物质中,会出现明显不同的现象;分析所给物质的性质及反应的现象进行解答.A、将碳酸钠溶液分别滴加到三种溶液中,有沉淀生成的是Ba(OH)2,有气体生成的是稀HCl,无现象的是NaOH,现象不同,可以鉴别,正确;
B、将无色酚酞试液分别滴加到三种溶液中,不变色的是稀盐酸,变红的是氢氧化钠和氢氧化钡溶液,氢氧化钠和氢氧化钡溶液现象相同,无法鉴别,错误;
C、将石蕊试液分别滴加到三种溶液中,变红的是稀盐酸,变蓝的是氢氧化钠和氢氧化钡溶液,氢氧化钠和氢氧化钡溶液现象相同,无法鉴别,错误;
D、将氯化镁溶液分别滴加到三种溶液中,无现象的是稀盐酸,有白色沉淀生成的是氢氧化钠和氢氧化钡溶液,氢氧化钠和氢氧化钡溶液现象相同,无法鉴别,错误;
故选A.点评:
本题考点: 酸、碱、盐的鉴别.
考点点评: 在解答一剂鉴别题时,首先分析要鉴别的物质的酸碱性,若分别为酸性、碱性、中性,可用石蕊试液鉴别;若不是,依据物质间的相互反应,根据生成气体、沉淀或变色等现象进行鉴别.1年前查看全部
- 如图所示,在烧杯中装入50mL浓度为0.01mol•L-1的Ba(OH)2溶液,连接好导线,将开关闭合,然后向Ba(OH
 如图所示,在烧杯中装入50mL浓度为0.01mol•L-1的Ba(OH)2溶液,连接好导线,将开关闭合,然后向Ba(OH)2溶液中滴加0.2mol•L-1H2SO4溶液至过量,则实验过程中烧杯内的液体导电能力变化为( )
如图所示,在烧杯中装入50mL浓度为0.01mol•L-1的Ba(OH)2溶液,连接好导线,将开关闭合,然后向Ba(OH)2溶液中滴加0.2mol•L-1H2SO4溶液至过量,则实验过程中烧杯内的液体导电能力变化为( )
A.先减弱,后增强
B.先增强,后减弱
C.一直增强
D.几乎不改变 jjj_ppp1年前1
jjj_ppp1年前1 -
 sadlfkjklwrgetg 共回答了23个问题
sadlfkjklwrgetg 共回答了23个问题 |采纳率87%解题思路:溶液混合后导电能力变化的大小,取决于溶液中自由移动的离子浓度的变化,Ba(OH)2是强电解质,H2SO4是强电解质,向Ba(OH)2溶液中滴加0.2mol•L-1H2SO4溶液至过量,当生成的硫酸钡时难电离,则离子浓度很小,导电能力减小,然后硫酸过量时,离子浓度又增大,导电性增强.氢氧化钡是强电解质,加入硫酸后,反应生成硫酸钡沉淀和水,导电能力下降直至为零,然后随着H2SO4溶液的滴入,离子浓度又增大,导电性又增强,
则实验过程中烧杯内的液体导电能力变化为先减弱后增强,
故选A.点评:
本题考点: 电解质溶液的导电性.
考点点评: 本题考查溶液的导电性,题目难度不大,明确电解质的强弱、发生的化学反应及溶液中自由移动的离子浓度的变化即可解答.1年前查看全部
- 已知某硫酸和盐酸的混合溶液中,H+的浓度为0.1mol/L,将50mL上述混合溶液与50mLBa(OH)2溶液混合,充分
已知某硫酸和盐酸的混合溶液中,H+的浓度为0.1mol/L,将50mL上述混合溶液与50mLBa(OH)2溶液混合,充分反应后过滤,得0.466g沉淀,溶液(100mL)中OH-的浓度为0.1mol/L.试求:
(1)原混合溶液中SO42-、Cl-的物质的量.
(2)Ba(OH)2溶液的物质的量浓度. http563com1年前2
http563com1年前2 -
 azny 共回答了18个问题
azny 共回答了18个问题 |采纳率94.4%解题思路:(1)0.466g沉淀为硫酸钡,根据n=[m/M]计算n(BaSO4),根据SO42-~BaSO4计算n(SO42-),根据n=cV计算n(H+),由电荷守恒可知n(H+)=2n(SO42-)+n(Cl-),据此计算n(Cl-);
(2)根据Ba(OH)2~2H+计算参加反应n[Ba(OH)2],根据n=cV计算反应后溶液中n(OH-),进而计算剩余n[Ba(OH)2],再计算氢氧化钡总物质的量,再根据c=[n/V]计算Ba(OH)2溶液的物质的量浓度.反应后碱有剩余,酸完全反应,硫酸根完全沉淀,n(BaSO4)=[0.466g/233g/mol]=0.002mol,则:
SO42-~BaSO4
1 1
n(SO42-) 0.002mol
故n(SO42-)=[0.002mol×1/1]=0.002mol,
原混合反应中氢离子的物质的量为:n(H+)=c•V=0.05L×0.1mol/L=0.005mol,
由电荷守恒可得:n(H+)=2n(SO42-)+n(Cl-),
则:n(Cl-)=0.005mol-0.002mol×2=0.001mol,
答:原混合液中SO42-的物质的量为0.002mol、Cl-的物质的量为0.001mol;
(2)原混合反应中n(H+)=c•V=0.05L×0.1mol/L=0.005mol,
设参加反应的氢氧化钡的物质的量为y,则:
Ba(OH)2~2H+
1 2
y0.005mol
则:y=[0.005mol×1/2]=0.0025mol,
反应后溶液中:n(OH-)=c•V=0.1L×0.1mol/L=0.01moL,
故n剩余[Ba(OH)2]=0.01mol×[1/2]=0.005mol,
故混合前Ba(OH)2溶液的物质的量:0.005mol+0.0025mol=0.0075mol,
所以混合前Ba(OH)2溶液的物质的量浓度为:c=[0.0075mol/0.05L]=0.15mol/L,
答:混合前Ba(OH)2溶液的物质的量浓度为0.15mol/L.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物反应的有关计算,题目难度不大,试题侧重基础知识的考查,明确发生的反应原理是解答关键,试题有利于培养学生的分析、理解能力及化学计算能力.1年前查看全部
- 已知某硫酸和盐酸组成的混合溶液中c(H+)=0.1mol•L-1,将50mL上述混合溶液与50mL Ba(OH)2溶液混
已知某硫酸和盐酸组成的混合溶液中c(H+)=0.1mol•L-1,将50mL上述混合溶液与50mL Ba(OH)2溶液混合,充分反应后过滤,得0.466g沉淀,此时溶液中OH-的浓度为0.1mol•L-1(设此时溶液体积为100mL).试计算:
(1)原混合液中SO42-、Cl-的物质的量;
(2)混合前Ba(OH)2溶液的物质的量浓度. weihuan31年前1
weihuan31年前1 -
 g002 共回答了25个问题
g002 共回答了25个问题 |采纳率88%解题思路:(1)0.466g沉淀为硫酸钡,根据n=[m/M]计算n(BaSO4),根据SO42-~BaSO4计算n(SO42-),根据n=cV计算n(H+),由电荷守恒可知n(H+)=2n(SO42-)+n(Cl-),据此计算n(Cl-);
(2)根据Ba(OH)2~2H+计算参加反应n[Ba(OH)2],根据n=cV计算反应后溶液中n(OH-),进而计算剩余n[Ba(OH)2],再计算氢氧化钡总物质的量,再根据c=[n/V]计算.反应后碱有剩余,酸完全反应,硫酸根完全沉淀,n(BaSO4)=[0.466g/233g/mol]=0.002mol,则:
SO42-~BaSO4
1 1
n(SO42-) 0.002mol
故n(SO42-)=[0.002mol×1/1]=0.002mol
原混合反应中n(H+)=c•V=0.05L×0.1mol/L=0.005mol
由电荷守恒可知n(H+)=2n(SO42-)+n(Cl-),n(Cl-)=0.005mol-0.002mol×2=0.001mol,
答:原混合液中SO42-的物质的量为0.002mol、Cl-的物质的量为0.001mol.
(2)原混合反应中n(H+)=c•V=0.05L×0.1mol/L=0.005mol,
令参加反应的氢氧化钡的物质的量为y,则:
Ba(OH)2~2H+
1 2
y0.005mol
y=0.005mol÷2=0.0025mol
反应后溶液中:n(OH-)=c•V=0.1L×0.1mol/L=0.01moL,故n剩余[Ba(OH)2]=0.01mol÷2=0.005mol,故混合前Ba(OH)2溶液的物质的量:0.005mol+0.0025mol=0.0075mol,故混合前Ba(OH)2溶液的物质的量浓度:C=[0.0075mol/0.05L]=0.15mol/L,
答:混合前Ba(OH)2溶液的物质的量浓度为0.15mol/L.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物计算,难度不大,清楚发生的反应是关键,注意根据方程式计算.1年前查看全部
- 在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时
在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则NaHSO4溶液的pH是(已知lg2=0.3)( )
A. 2
B. 2.3
C. 2.6
D. 2.9 hunan2371年前1
hunan2371年前1 -
 cougarui_kaka 共回答了22个问题
cougarui_kaka 共回答了22个问题 |采纳率95.5%解题思路:氢氧化钡和硫酸氢钠反应钡离子恰好沉淀,需要Ba(OH)2和NaHSO4按照物质的量1:1反应,设出氢氧化钡溶液、硫酸氢钠溶液的体积,然后结合溶液的pH列式计算出二者体积之比,再计算出硫酸氢钠溶液中氢离子浓度浓度、溶液的pH.pH=12的Ba(OH)2溶液中c(OH-)=10-2mol/L,设溶液体积为x,得到氢氧根离子物质的量为x×10-2mol,
反应消耗的硫酸氢钠物质的量为:0.5x×10-2mol,
设硫酸氢钠溶液体积为y,
依据反应Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH,混合后溶液pH=11,反应后的溶液中氢氧根离子浓度为:10-3mol/L,
则:
x×10−2−0.5x×10−2
x+y=10-3,
解得:x:y=1:4,
即硫酸氢钠溶液的体积y=4x,
则硫酸氢钠的物质的量浓度为:c(NaHSO4)=
0.5x×10−2
4x=1.25×10-3mol/L,
该硫酸氢钠溶液中氢离子浓度为:c(H+)=c(NaHSO4)=1.25×10-3mol/L,
溶液的pH=-lg1.25×10-3mol/L=3-lg[10/8]=3+3lg2-1=2+0.9=2.9,
故选D.点评:
本题考点: pH的简单计算.
考点点评: 本题考查了溶液pH的计算方法,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,正确分析、理解题干信息,求算出两溶液的体积之比为解答本题的关键.1年前查看全部
- 向100g质量分数分别为3.65%盐酸和12%MgSO4的混合溶液中,滴加质量分数为3.42%的Ba(OH)2溶液至过量
 向100g质量分数分别为3.65%盐酸和12%MgSO4的混合溶液中,滴加质量分数为3.42%的Ba(OH)2溶液至过量.(为便于计算设溶液的密度为1g/cm3)
向100g质量分数分别为3.65%盐酸和12%MgSO4的混合溶液中,滴加质量分数为3.42%的Ba(OH)2溶液至过量.(为便于计算设溶液的密度为1g/cm3)
(1)请将产生不同沉淀阶段的沉淀的化学式与加入Ba(OH)2溶液体积(V)间的关系填入下表:
(2)请在下面坐标系中完成沉淀的质量和Ba(OH)2溶液体积(V)间的关系图线.Ba(OH)2溶液体积(V)/mL 沉淀的化学式  想的亲1年前1
想的亲1年前1 -
 yxuny 共回答了19个问题
yxuny 共回答了19个问题 |采纳率73.7%(1)100g质量分数分别为3.65%盐酸和12%MgSO4的混合溶液中,氯化氢的质量=100g×3.65%=3.65g,硫酸镁的质量=100g×12%=12g;向盐酸和MgSO4溶液中加入Ba(OH)2后,Ba2+与溶液中的SO42-反应生成既不溶于水又不溶于酸的BaSO4沉淀,OH-先跟盐酸的H+发生中和反应,待H+完全反应,OH-与Mg2+开始生成Mg(OH)2沉淀;
设与3.65g氯化氢完全反应,需要质量分数为3.42%的Ba(OH)2的体积为V,
2HCl+Ba(OH)2═BaCl2+H2O
73 171
3.65g V×1g/mL×3.42%
73
171=
3.65g
V×1g/mL×3.42%
解得:v=250mL
因为:BaCl2+MgSO4═BaSO4↓+MgCl2,由以上两个方程式得出关系式:2HCl~BaSO4~MgSO4~MgCl2
设生成硫酸钡的质量为x,反应掉的硫酸镁的质量为y,生成的氯化镁质量为z
所以:2HCl~BaSO4~MgSO4~MgCl2
73233 120 95
3.65g x y z
73
233=
3.65g
x
73
120=
3.65g
y
73
95=
3.65g
z
解得:x=11.65g y=6g z=4.75g
这时的溶液是硫酸镁和氯化镁的混合溶液,当加入氢氧化钡溶液时产生了硫酸钡沉淀和氢氧化镁沉淀;当硫酸镁完全反应后,再加入氢氧化钡溶液时只产生氢氧化镁沉淀,当氯化镁完全反应后再加入氢氧化钡溶液时 不再产生沉淀.溶液中硫酸镁的质量为12g-6g=6g;
设6g的硫酸镁与氢氧化钡反应生成的生成的硫酸钡为p,氢氧化镁为q,氢氧化钡溶液的体积为m
MgSO4+Ba(OH)2═BaSO4↓+Mg(OH)2↓
120 171 233 58
6g m×1g/mL×3.42% pq
120
171=
6g
m×1g/mL×3.42%
120
233=
6g
p
120
58=
6g
q
解得:m=250mL p=11.65g q=2.9g
再设4.75g的氯化镁与氢氧化钡溶液反应,需氢氧化钡溶液的体积为n,生成的氢氧化镁沉淀的质量为r
MgCl2+Ba(OH)2═BaCl2+Mg(OH)2↓
95 171 58
4.75g n×1g/mL×3.42% r
95
171=
4.75g
n×1g/mL×3.42%
95
58=
4.75g
r
解得:n=250mL r=2.9g
所以:(1)加入0~250mL质量分数为3.42%的Ba(OH)2溶液时,只产生硫酸钡沉淀,沉淀质量为0~11.65g;当加入250~500mL的Ba(OH)2溶液时产生的是硫酸钡和氢氧化镁沉淀,沉淀质量为11.65g~26.2g;当加入500~750mL的Ba(OH)2溶液时,只产生氢氧化镁沉淀,沉淀质量为26.2g~29.1g;当加入Ba(OH)2溶液大于750mL时,不产生沉淀,得出下表:
Ba(OH)2溶液体积(V)/mL (0~250] (250~500] (500~750] (750-
沉淀的化学式 BaSO4 BaSO4、Mg(OH)2 Mg(OH)2 -(2)根据上述数据可作出沉淀的质量和Ba(OH)2溶液体积(V)间的关系图线: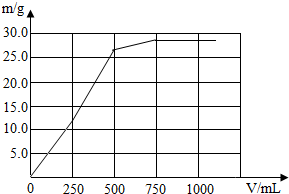 1年前查看全部
1年前查看全部
- (2010•白云区一模)分别将SO2,CuO,Na2CO3,NaCl,K2O,Ba(OH)2,H2SO4等7种物质加水溶
(2010•白云区一模)分别将SO2,CuO,Na2CO3,NaCl,K2O,Ba(OH)2,H2SO4等7种物质加水溶解,所得溶液pH大于7的有( )
A.三种
B.两种
C.一种
D.无法判断 ww7117111年前1
ww7117111年前1 -
 hzddcc 共回答了26个问题
hzddcc 共回答了26个问题 |采纳率76.9%解题思路:根据加水后溶液中的溶质进行判断.二氧化硫和水反应能生成亚硫酸;氧化铜不溶于水;碳酸钠的水溶液显碱性;氧化钾和水反应能生成氢氧化钾;氢氧化钡属于碱;硫酸属于酸.二氧化硫、硫酸溶于水后溶液显酸性;碳酸钠、氧化钾、氢氧化钡溶于水后溶液显碱性,pH大于7.
故选A.点评:
本题考点: 溶液的酸碱性与pH值的关系.
考点点评: 解答本题要掌握溶液的酸碱性与溶液PH大小之间的关系,只有这样才能对相关方面的问题做出正确的判断.1年前查看全部
- 在烧杯里加入20mL 0.1mol•L-1的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物
 在烧杯里加入20mL 0.1mol•L-1的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物质的量浓度的NaHSO4溶液.实验装置如图(夹持仪器已去掉):
在烧杯里加入20mL 0.1mol•L-1的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物质的量浓度的NaHSO4溶液.实验装置如图(夹持仪器已去掉):
实验现象如下:
①灯泡逐渐变暗;②烧杯中有白色沉淀生成,溶液红色变浅甚至消失.请依据实验现象回答下列问题:
(1)灯泡变暗的原因是______.
(2)有白色沉淀生成,说明______,红色变浅说明______.
(3)当Ba2+恰好完全沉淀时,消耗NaHSO4溶液的体积为______mL,溶液呈______色,离子反应方程式为______.
(4)若向(3)得到的溶液中,继续滴加NaHSO4溶液到恰好变为无色,此阶段的离子反应方程式为______. 轻吟狂啸1年前1
轻吟狂啸1年前1 -
 bdlzdq 共回答了14个问题
bdlzdq 共回答了14个问题 |采纳率78.6%解题思路:Ba(OH)2与NaHSO4发生反应:①Ba2+沉淀完全:Ba2++OH-+SO42-+H+═BaSO4↓+H2O;②溶液呈中性:Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O;反应过程中,溶液中离子的浓度减小,其导电能力减弱,灯泡变暗,以此来解答.(1)反应生成硫酸钡,使溶液中可自由移动离子的浓度变小,导电性减弱,则灯泡变暗,故答案为:溶液中可自由移动离子的浓度变小;
(2)白色沉淀为硫酸钡,是Ba2+与SO42-发生了反应,红色变浅,氢氧根离子浓度减小,发生了H+与OH-发生了反应,使溶液碱性减弱,
故答案为:Ba2+与SO42-发生了反应;发生了H+与OH-发生了反应,使溶液碱性减弱;
(3)当Ba2+恰好完全沉淀时,发生Ba2++OH-+SO42-+H+═BaSO4↓+H2O,以1:1反应,浓度相等,则体积相同,即NaHSO4溶液的体积为20mL,碱性减弱,颜色变浅,
故答案为:20;浅红;Ba2++OH-+SO42-+H+═BaSO4↓+H2O;
(4)向(3)得到的溶液中,继续滴加NaHSO4溶液到恰好变为无色,只发生H+与OH-的反应,离子反应为H++OH-═H2O,故答案为:H++OH-═H2O.点评:
本题考点: 离子方程式的书写;电解质溶液的导电性.
考点点评: 本题考查离子反应方程式的书写,为高考常见题型,明确发生的化学反应为解答的关键,把握反应的先后顺序及现象与导电性的关系,题目难度不大.1年前查看全部
- (2011•道里区一模)学完酸碱盐的化学性质后,同学们向老师借了Ba(OH)2 溶液、Na2CO3溶液、稀硫酸
(2011•道里区一模)学完酸碱盐的化学性质后,同学们向老师借了Ba(OH)2 溶液、Na2CO3溶液、稀硫酸等药品以及若干仪器进行性质实验.如图:A、B、c三支试管中分别盛有一定量的Ba(OH)2液、Na2CO3溶液、稀硫酸,甲乙同学一同将上述三种溶液注入烧杯D中,充分搅拌待完全反应后烧杯D中出现白色沉淀,同学们对沉淀的成分进行了如下猜想:甲BaSO4,BaCO3;乙:BaSO4
你认为甲、乙的猜想是否合理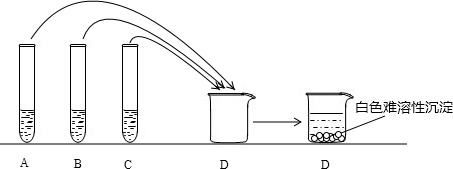
(1)______(是或否)如何判断实际为哪一种猜想,请简要说明过程:______
(2)甲、乙同学又继续对溶液中的溶质进行猜想和探究,猜想溶质一定有NaOH、Na2CO3一定无H2SO4;乙猜想溶液可能为:①Na2CO3②Na2CO3、Na2SO4 ③Na2SO4、H2SO4 请评价乙同学的猜想.
(3)乙同学的猜想是否全面,若不全面还有哪些可能请说出你认为的一种情况并设计实验,验证你的猜想
猜想 实验操作 现象 结论 ______ ______ ______ ______  SphinxEGO1年前1
SphinxEGO1年前1 -
 huahaoyueyuan 共回答了25个问题
huahaoyueyuan 共回答了25个问题 |采纳率84%解题思路:(1)根据碳酸根离子、硫酸根离子会与钡离子生成沉淀进行分析,
根据碳酸钡会溶于酸进行分析,
(2)根据氢氧化钡会与碳酸钠反应生成氢氧化钠,硫酸也可能过量进行分析.
(3)根据生成物的组合进行分析.(1)氢氧化钡会与碳酸钠生成碳酸钡沉淀,会与硫酸生成硫酸钡沉淀.
故答案为:是,
碳酸钡会溶于酸而硫酸钡不会,故答案为:取样品滴加稀盐酸,若有气泡,则沉淀为BaSO4,BaCO3,若无现象,则为BaSO4.
(2)氢氧化钡会与碳酸钠反应生成氢氧化钠,硫酸也可能过量,故答案为:不正确,氢氧化钠和碳酸钠都可能存在,硫酸的量也可能有剩余.
(3)生成物有硫酸钠、碳酸钠的组合,还可能只有硫酸钠,故答案为:也可能只有硫酸钠,
猜想 实验操作 现象 结论
可能是硫酸钠 取样品滴加紫色石蕊试液, 若紫色石蕊溶液不变色, 证明是硫酸钠.点评:
本题考点: 酸、碱、盐的鉴别.
考点点评: 在解此类题时,首先要分析该题考查的知识,然后结合复分解反应的原理和组合知识进行分析解答.1年前查看全部
- (2005•广州)甲、乙、丙、丁分别是HNO3、Ba(OH)2、Na2CO3、NaOH四种溶液中的一种.已知乙和丙能反应
(2005•广州)甲、乙、丙、丁分别是HNO3、Ba(OH)2、Na2CO3、NaOH四种溶液中的一种.已知乙和丙能反应、乙和丁也能反应、乙和甲不反应,下列说法正确的是(BaCO3不溶于水)( )
A.乙一定是HNO3
B.丁一定是Na2CO3
C.丙不可能是Ba(OH)2
D.甲不可能是HNO3 一块腊肉1年前1
一块腊肉1年前1 -
 快要当ss了 共回答了17个问题
快要当ss了 共回答了17个问题 |采纳率94.1%解题思路:从复分解反应的条件入手进行分析,若物质间能结合成水、沉淀或气体,则物质可以反应.从给出的物质可以看出,硝酸与其他三种物质都能反应,氢氧化钡能与硝酸、碳酸钠两种物质反应,碳酸钠可以与硝酸和氢氧化钡两种物质反应,氢氧化钠只能与硝酸一种物质反应,已知乙和丙可以反应,乙和丁也可以反应,乙和甲不反应,能与两种物质反应的一定是氢氧化钡或碳酸钠,氢氧化钡或碳酸钠都与氢氧化钠不反应,故甲一定是氢氧化钠,乙是氢氧化钡或碳酸钠,但乙一定不是硝酸(硝酸与其他三种物质都能反应),丙、丁无法确定,故D说法正确;
故选D点评:
本题考点: 复分解反应及其发生的条件;酸、碱、盐的鉴别.
考点点评: 本题考查了复分解反应的应用,完成此题,可以依据复分解反应的条件进行,即物质间若能结合成沉淀、气体或水,则物质间可以发生复分解反应.1年前查看全部
- 向明矾溶液中逐滴加入Ba(OH)2溶液至铝离子刚好沉淀完全时,溶液PH______7(填>、<、=),离子反应总方程式:
向明矾溶液中逐滴加入Ba(OH)2溶液至铝离子刚好沉淀完全时,溶液PH______7(填>、<、=),离子反应总方程式:______
向明矾溶液中逐滴加入Ba(OH)2溶液至硫酸根离子刚好沉淀完全时,溶液PH______7(填>、<、=),离子反应总方程式:______. 雾中de风景1年前1
雾中de风景1年前1 -
 恒思远 共回答了22个问题
恒思远 共回答了22个问题 |采纳率90.9%解题思路:(1)假设明矾的物质的量为1mol,水溶液中Al3+恰好沉淀时,需氢氧根离子3mol,所以明矾与Ba(OH)2的物质的量之比为1:3,进而书写反应的离子方程式,并判断溶液的酸碱性;
(2)假设SO42-的物质的量为2mol,判断完全反应需要其它离子的物质的量,进而书写反应的离子方程式,并判断溶液的酸碱性.明矾的电离方程式为:KAl(SO4)2═K++Al3++2SO42-.
(1)假设明矾的物质的量为1mol,水溶液中含1molAl3+,明矾水溶液中Al3+恰好沉淀时,需氢氧根离子3mol,所以明矾与Ba(OH)2的物质的量之比为1:3,离子反应为2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓,此时溶液呈中性,PH=7,
故答案为:=;2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓;
(2)假设SO42-的物质的量为2mol,则明矾溶液中含有2molSO42-,1molAl3+,向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全时,需要2molBa(OH)2,即加入的Ba2+为2mol,OH-为4mol,生成2molBaSO4,1molAl3+与4molOH-反应生成1molAlO2-,反应的离子方程式为Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,反应后溶液呈碱性,pH>7,
故答案为:>;Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查离子反应方程式的书写,明确信息中Al3+恰好沉淀、硫酸根离子完全沉淀是解答本题的关键,题目难度中等.1年前查看全部
- (1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:______.
(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:______.
(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式:______. 爱喝可乐的顽皮猫1年前3
爱喝可乐的顽皮猫1年前3 -
 远方的孤独 共回答了15个问题
远方的孤独 共回答了15个问题 |采纳率100%解题思路:(1)加入Ba(OH)2溶液至中性时,其反应式为:2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,以此书写离子方程式;
(2)至中性时溶液中溶质只有Na2SO4,加入Ba(OH)2溶液生成BaSO4沉淀.(1)NaHSO4是二元强酸的酸式盐,可以理解为全部电离.当反应后溶液呈中性时,其反应式为:2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,那么,
离子反应方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故答案为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;
(2)此时溶液中溶质只有Na2SO4,加入Ba(OH)2的离子反应方程式为:Ba2++SO42-=BaSO4↓,故答案为:Ba2++SO42-=BaSO4↓.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查离子方程式的书写,题目难度不大,注意根据物质的量判断反应的程度并书写相关离子方程式,注意与量有关的离子方程式的书写方法.1年前查看全部
- 有一混合溶液由稀HNO3、K2CO3、H2SO4、CuCl2四种物质中的二种混合而成.向该混合溶液中滴入Ba(OH)2溶
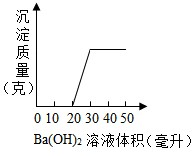 有一混合溶液由稀HNO3、K2CO3、H2SO4、CuCl2四种物质中的二种混合而成.向该混合溶液中滴入Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液体积的关系如图所示.判断:该混合物是由______组成.
有一混合溶液由稀HNO3、K2CO3、H2SO4、CuCl2四种物质中的二种混合而成.向该混合溶液中滴入Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液体积的关系如图所示.判断:该混合物是由______组成.  123zky1年前1
123zky1年前1 -
 dabaobao88 共回答了16个问题
dabaobao88 共回答了16个问题 |采纳率93.8%解题思路:碳酸钾和氢氧化钡生成碳酸钡沉淀和氢氧化钾;硫酸和氢氧化钡生成硫酸钡沉淀和水;氯化铜和氢氧化钡生成氯化钡和氢氧化铜沉淀.根据图象分析可知,加入20mL氢氧化钡溶液,没有沉淀出现,说明混合溶液中有硝酸.因为硝酸和碳酸钾不能同时存在,所以溶液中没有碳酸钾.因为硫酸钡不会被硝酸溶解,所以溶液中没有硫酸.根据图象分析可知,加入20mL氢氧化钡溶液,没有沉淀出现,说明混合溶液中有硝酸.因为硝酸和碳酸钾不能同时存在,所以溶液中没有碳酸钾.因为硫酸钡不会被硝酸溶解,所以溶液中没有硫酸.因为氢氧化铜可以被硝酸溶解,所以溶液中有氯化铜.总上所述,溶液中的两种溶质是硝酸和氯化铜,故答案为:HNO3,CuCl2
点评:
本题考点: 物质的鉴别、推断;碱的化学性质.
考点点评: 学会分析图象并从中得到一些信息的方法,一般看图象的起点,转折点,走势等.1年前查看全部
- 在T℃下,某Ba(OH)2稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向
在T℃下,某Ba(OH)2稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=x的盐酸,测得混合溶液的部分pH如下表所示:
(1)依据题意判断,T℃______25℃(填“大于”、“小于”或“等于”),该温度下水的离子积KW=______.序号 氢氧化钡溶液的体积/mL 盐酸的体积/mL 溶液的pH ① 22.00 0.00 8 ② 22.00 18.00 7 ③ 22.00 22.00 6
(2)x=______,原Ba(OH)2稀溶液的物质的浓度为______.
(3)该温度下,向1L硫酸与硫酸钠的混合溶液中加入3L该Ba(OH)2稀溶液时,沉淀正好达到最大值,从所得溶液中取出4mL并加水稀释至20mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为______,Na2SO4的物质的量浓度为______. 落地怕有瓦1年前1
落地怕有瓦1年前1 -
 丢丢841101 共回答了22个问题
丢丢841101 共回答了22个问题 |采纳率90.9%解题思路:(1)溶液中的离子积Kw=c(H+)×c(OH-)=10-a×10-b=10-(a+b)=10-12;水的电离是吸热过程,升高温度,促进电离,Kw增大;
(2)根据实验①可知,氢氧化钡中c(OH-)=
=0.0001mol•L-1,则c[Ba(OH)2]=[1/2]c(OH-);再根据表中③的数据求出氢离子浓度;1×10−12 1×10−8
(3)根据硫酸根离子和氢氧化钡的关系式计算n(SO42-)总,根据混合溶液的pH计算原来溶液中c(H+),从而得出其pH;
根据硫酸根离子守恒计算硫酸钠的物质的量浓度.(1)溶液中的离子积Kw=c(H+)×c(OH-)=10-a×10-b=10-(a+b),已知a+b=12,所以Kw=10-12;
水的电离是吸热过程,升高温度,促进电离,Kw增大,而25℃时Kw=10-14,所以当Kw=10-12时温度大于25℃,
故答案为:大于;10-12;
(2)根据实验①可知,当氢氧化钡溶液中没加盐酸时,溶液的pH=8,则溶液中c(OH-)=
1×10−12
1×10−8=0.0001mol•L-1,所以c[Ba(OH)2]=[1/2]c(OH-)=5×10-5mol•L-1;
根据实验③可知,当氢氧化钡和盐酸的体积相同时,溶液的PH=6,即盐酸与氢氧化钡恰好反应,所以c(H+)=c(OH-)=0.0001mol•L-1,则原来盐酸中溶液的pH=4,即x=4;
故答案为:4;5×10-5mol•L-1;
(3)据题意知n(SO42-)总=n[Ba(OH)2]=3L×5×10-5 mol/L=1.5×10-4 mol,
据完全反应时,c(OH-)过=
5×10−5mol/L×2×3L−1×c(H+)
4L×[4mL/20mL]=
10−12
10−7mol/L=10-5 mol/L,
解得:c(H+)=1×10-4 mol/L,pH=4;
n(Na2SO4)=n(SO42-)总-n(H2SO4)=1.5×10-4 mol-[1/2]×10-4 mol×1 L=1×10-4 mol,
所以:c(Na2SO4)=1×10-4 mol/L,
故答案为:4;1×10-4 mol/L.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算;物质的量浓度的相关计算;pH的简单计算.
考点点评: 本题考查了水溶液中的离子积常数应用、酸碱混合的定量判断和计算、pH的简单计算等,题目难度中等,注意掌握溶液酸碱性与溶液pH的计算方法,试题侧重于对学生计算能力的考查.1年前查看全部
- 在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是( )
在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是( )
A. Fe2++SO42-+Ba2++2OH-═BaSO4↓+Fe(OH)2↓
B. NH4++Fe3++SO42-+Ba2++4OH-═BaSO4↓+Fe(OH)3↓+NH3•H2O
C. 2Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Fe(OH)3↓
D. 3NH4++Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+Fe(OH)3↓+3NH3•H2O 猴子吴1年前3
猴子吴1年前3 -
 蓝色战车 共回答了22个问题
蓝色战车 共回答了22个问题 |采纳率95.5%解题思路:在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,NH4+与OH-离子反应生成NH3•H2O,Fe3+与OH-离子反应生成Fe(OH)3,Ba2+与SO42-离子反应生成BaSO4,根据参加反应的物质的量判断可能发生的反应以及反应物的物质的量的关系.本题考查的离子方程式与加入反应物的量有关.本题加入的Ba(OH)2溶液由少到多,所以要分两种情况一种是Ba(OH)2不足,另一种情况是Ba(OH)2过量.A、复盐NH4Fe(SO4)2中Fe的化合价是+3价,故A错误;
B、在复盐NH4Fe(SO4)2溶液中,n(NH4+):n(Fe3+):n(SO42-)=1:1:2,1mol复盐完全反应时需要2molBa(OH)2,反应的离子方程式为NH4++Fe3++2SO42-+2Ba2++4OH-=2BaSO4↓+Fe(OH)3↓+NH3•H2O,故B错误;
C、当Ba(OH)2不足时,生成Fe(OH)3和BaSO4,该依据原子守恒配平书写的离子方程式为2Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Fe(OH)3↓,故C正确;
D、当加入3molBa(OH)2时,反应的n(Fe3+):n(SO42-)=1:2,离子方程式不符合反应实际,故D错误.
故选:C.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查离子方程式的正误判断,题目难度较大,注意参加反应的物质的量判断可能发生的反应以及反应物的物质的量的关系.1年前查看全部
- 1.向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至恰好不再生成沉淀为止
1.向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至恰好不再生成沉淀为止
向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至恰好不再生成沉淀为止
在以上溶液中,继续滴加NaHSO4溶液
请写出这两步的化学方程式,说明为什么, 梅开半面1年前1
梅开半面1年前1 -
 guo21000210 共回答了7个问题
guo21000210 共回答了7个问题 |采纳率85.7%向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至恰好不再生成沉淀为止
Ba(OH)2+NaHSO4=BaSO4(沉淀)+H2O+NaOH
继续滴加NaHSO4溶液
NaHSO4+NaOH=Na2SO4+H2O1年前查看全部
- 向明矾溶液中逐加入Ba(OH)2溶液至SO4-恰好沉淀完全的离子反应式怎么写?
 22sqj08091年前1
22sqj08091年前1 -
 wpf821004 共回答了21个问题
wpf821004 共回答了21个问题 |采纳率81%Al3++2SO4 2- +2Ba2+ +4OH-=BaSO4+[Al(OH)4]- 或
Al3++2SO4 2- +2Ba2+ +4OH-=BaSO4+AlO2 - +2H2O1年前查看全部
大家在问
- 11道初一的解1元1次方程题,200(1+4*X%)=115*=乘X=未知数
- 2生活一课 作文
- 3作文《堆雪人》图中有三个小朋友在堆雪人
- 4阳光碎如我手心的花瓣,
- 5甲、乙、丙、丁四人向某灾区捐款,甲的捐款数是其他三人捐款总数的[1/3],乙的捐款数是其他三人捐款总数的[1/5],丙的
- 6“学而不思则罔,思而不学则殆.”写一篇800字的作文
- 7高手帮忙分析个句子结构It entitles you to at least 50% off the regular p
- 8为什么今天太阳比昨天升的地方往左
- 9某人在两平行峭壁的山谷中放一抢,在0.2秒和0.6秒后听到前后两次回声,若当时的声速为340米每秒,求山谷的宽度.
- 10用洗耳恭听写句子
- 11one day ivisited an art museum which waiting for my husband
- 12How () the yellow one?
- 13—I’m afraid I have to leave for Miami tomorrow.
- 14人教版初中英语初二上册作文.请看问题补充,看问题补充,题补充,补充,充.
- 15请从衣、食、住、行、农、林、医或药等方面中,任选出四个方面,简要说出化学的好处.
