在Fe2(SO4)3和FeSO4组成的混合物中,经测定硫元素的质量分数为23%,则该混合物中铁元素的质量分数为_____
 小小老师2022-10-04 11:39:541条回答
小小老师2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 翻身的日子 共回答了17个问题
翻身的日子 共回答了17个问题 |采纳率100%- 解题思路:根据FeSO4和Fe2(SO4)3两物质的组成特点,可知混合物中硫元素与氧元素的质量比为1:2,混合物中硫元素的质量分数为23%,可计算出混合物中氧元素质量分数,进而可计算出该混合物中铁元素的质量分数.
在FeSO4和Fe2(SO4)3组成的混合物中,硫元素与氧元素的质量比=32:(16×4)=1:2,由于混合物中硫元素的质量分数为23%,则混合物中氧元素的质量分数=23%×2=46%,该混合物中铁元素的质量分数为1-23%-46%=31%.
故答案为:31%.点评:
本题考点: 元素的质量分数计算.
考点点评: 本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力. - 1年前
相关推荐
- 按要求完成下列填空.(1)写出下列物质的电离方程式:Fe2(SO4)3______NaHCO3______(2)写出下列
按要求完成下列填空.
(1)写出下列物质的电离方程式:
Fe2(SO4)3______NaHCO3______
(2)写出下列反应的离子方程式:
①Cl2与H2O反应______
②海带浸泡液中通入氯气______
③钠与水反应______
④NaHCO3溶液中滴入少量氢氧化钠溶液______
⑤向次氯酸钙溶液中通入过量CO2______. 可爱的小楼1年前1
可爱的小楼1年前1 -
 cgzkb 共回答了11个问题
cgzkb 共回答了11个问题 |采纳率81.8%解题思路:(1)硫酸铁电离生成硫酸根离子和铁离子,碳酸氢钠电离生成碳酸氢根离子和钠离子;
(2)①Cl2与H2O反应生成HCl和HClO;
②海带浸泡液中通入氯气,碘离子和氯气发生置换反应;
③钠与水反应生成NaOH和氢气;
④NaHCO3溶液中滴入少量氢氧化钠溶液生成碳酸钠和水;
⑤向次氯酸钙溶液中通入过量CO2碳酸氢钙和次氯酸.(1)硫酸铁电离生成硫酸根离子和铁离子,电离方程式为Fe2(SO4)3=2Fe3++3SO42-,
碳酸氢钠电离生成钠离子和碳酸氢根离子,电离方程式为NaHCO3=Na++HCO3-,
故答案为:Fe2(SO4)3=2Fe3++3SO42-;NaHCO3=Na++HCO3-;
(2)①Cl2与H2O反应生成HCl和HClO,离子方程式为Cl2+H20=H++Cl-+HCl0,故答案为:Cl2+H20=H++Cl-+HCl0;
②海带浸泡液中通入氯气,碘离子和氯气发生置换反应,离子方程式为Cl2+2I-=2Cl-+I2,故答案为:Cl2+2I-=2Cl-+I2;
③钠与水反应生成NaOH和氢气,离子方程式为2Na+2H2O=2Na++OH-+H2,故答案为:2Na+2H2O=2Na++OH-+H2;
④NaHCO3溶液中滴入少量氢氧化钠溶液生成碳酸钠和水,离子方程式为OH-+HCO3-=H2O+CO32-,故答案为:OH-+HCO3-=H2O+CO32-;
⑤向次氯酸钙溶液中通入过量CO2碳酸氢钙和次氯酸,离子方程式为ClO-+CO2+H2O=HCO3-+HClO,故答案为:ClO-+CO2+H2O=HCO3-+HClO.点评:
本题考点: 离子方程式的书写;电离方程式的书写.
考点点评: 本题考查离子方程式和电离方程式书写,明确物质的性质及离子方程式书写规则是解本题关键,注意符合客观事实、原子守恒、电荷守恒及转移电子守恒,有的离子反应还与反应物的量、浓度有关,为易错点.1年前查看全部
- 某FeSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-
某FeSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6mol/L,则此溶液最多可溶解铁粉的质量为( )
A.11.2 g
B.16.8 g
C.19.6 g
D.22.4 g 清水蜉蝣1年前1
清水蜉蝣1年前1 -
 不由你不信 共回答了16个问题
不由你不信 共回答了16个问题 |采纳率87.5%解题思路:根据H+、Fe3+都能与Fe反应生成Fe2+,最后溶液的成分为FeSO4,由硫酸根离子的物质的量可知反应后溶液中Fe2+的物质的量,减去原溶液中Fe3+、Fe2+物质的量,根据电荷守恒计算原溶液中Fe3+、Fe2+物质的量,可计算最多溶解的铁粉的质量.溶液中n(SO42-)=0.1L×6mol•L-1=0.6mol,
FeSO4、Fe2(SO4)3、H2SO4的溶液中阳离子的浓度相同,所以阳离子物质的量也相同,则有n(Fe2+)=n(H+)=n(Fe3+),设Fe2+、Fe3+、H+三种离子物质的量均为n,根据电荷守恒知道:2n+3n+n=0.6mol×2,解得n=0.2mol,
H+、Fe3+都能与Fe反应生成Fe2+,最后溶液的成分为FeSO4,则n(FeSO4)=0.6mol,根据Fe的守恒可知,此溶液最多溶解铁粉的物质的量为0.6mol-0.2mol-0.2mol=0.2mol,
则此溶液最多溶解铁粉的质量为0.2mol×56g/moL=11.2g,
故选A.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物的有关计算,题目难度中等,注意用电荷守恒和质量守恒去解答,也可以根据氢离子、铁离子计算溶解的Fe的质量.1年前查看全部
- 某FeSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-
某FeSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6mol/L,则此溶液最多可溶解铁粉的质量为( )
A. 11.2 g
B. 16.8 g
C. 19.6 g
D. 22.4 g 宿庐阳1年前1
宿庐阳1年前1 -
 幽灵_zz 共回答了19个问题
幽灵_zz 共回答了19个问题 |采纳率89.5%解题思路:根据H+、Fe3+都能与Fe反应生成Fe2+,最后溶液的成分为FeSO4,由硫酸根离子的物质的量可知反应后溶液中Fe2+的物质的量,减去原溶液中Fe3+、Fe2+物质的量,根据电荷守恒计算原溶液中Fe3+、Fe2+物质的量,可计算最多溶解的铁粉的质量.溶液中n(SO42-)=0.1L×6mol•L-1=0.6mol,
FeSO4、Fe2(SO4)3、H2SO4的溶液中阳离子的浓度相同,所以阳离子物质的量也相同,则有n(Fe2+)=n(H+)=n(Fe3+),设Fe2+、Fe3+、H+三种离子物质的量均为n,根据电荷守恒知道:2n+3n+n=0.6mol×2,解得n=0.2mol,
H+、Fe3+都能与Fe反应生成Fe2+,最后溶液的成分为FeSO4,则n(FeSO4)=0.6mol,根据Fe的守恒可知,此溶液最多溶解铁粉的物质的量为0.6mol-0.2mol-0.2mol=0.2mol,
则此溶液最多溶解铁粉的质量为0.2mol×56g/moL=11.2g,
故选A.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物的有关计算,题目难度中等,注意用电荷守恒和质量守恒去解答,也可以根据氢离子、铁离子计算溶解的Fe的质量.1年前查看全部
- 现有FeSO4,Fe2(SO4)3,H2SO4的混合溶液,其中c(H+)=0.1mol/L.取该溶液200mL,加入过量
现有FeSO4,Fe2(SO4)3,H2SO4的混合溶液,其中c(H+)=0.1mol/L.取该溶液200mL,加入过量BaCl2,充分反应后过滤,洗涤,干燥,得到沉淀27.96g;再另取该混合溶液200mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤,洗涤并灼烧说得固体,最终得固体8.00g,则原混合溶液中c(Fe2+)与c(Fe3+)之比为
1
我现在设FeSO4摩尔质量是n1,Fe2(SO4)3是n2,算出来沉淀BaSO4是0.12mol,所以n(SO4 2-)是0.12mol,n(H+)=0.02mol,根据电子守恒,2n1+6n2=0.1mol.所得固体Fe2O3是0.05mol,所以Fe(OH)3是0.1mol,然后...就没有然后了..是应该用元素守恒么?要怎么用.... fangzb1年前1
fangzb1年前1 -
 我爱我想 共回答了13个问题
我爱我想 共回答了13个问题 |采纳率84.6%电子守恒式写错了啊.2n1+6n2=0.12*2-0.02=0.22 【2n1(FeSO4) +6n2(Fe2SO4 3)=2n(SO4 2-)-n(H+)】灼烧后的固体是三氧化二铁,其摩尔质量为8/160=0.05mol,即铁元素有0.1mol所以有n1+2n2=0.1解得n1=0.08,...1年前查看全部
- 将6克铁粉加入200mLFe2(SO4)3 和CuSO4 的混合溶液,充分反应得到200mL 0.5
将6克铁粉加入200mLFe2(SO4)3 和CuSO4 的混合溶液,充分反应得到200mL 0.5mol•L-1 FeSO4溶液和5.2g固体沉淀物.试计算:
(1)反应后生成铜的质量;
(2)原Fe2(SO4)3溶液的物质的量浓度. oo招商1年前1
oo招商1年前1 -
 cad14 共回答了20个问题
cad14 共回答了20个问题 |采纳率85%解题思路:因氧化性Fe3+>Cu2+,则加入铁粉,先发生Fe+Fe2 (SO4)3=3FeSO4,5.2g固体沉淀物一定有铜,则后发生Fe+CuSO4=FeSO4+Cu,然后根据化学反应方程式即可计算.溶液中含有Fe2+:0.5mol•L-1×0.2L=0.1mol<[6g/56g/mol],
∴6g铁粉过量,设反应消耗铁的物质的量为x,生成铜的物质的量为y,
Fe+Fe2 (SO4)3=3FeSO4
1mol1mol 3mol
xmolxmol 3xmol
Fe+CuSO4=FeSO4+Cu
1mol 1mol 1mol 1mol
ymol ymol ymolymol
可得
3x+y=0.1mol
6g−56x+8y=5.2g,
解得x=0.02mol、y=0.04mol,
(1)故得生成铜质量为0.04mol×64g•mol-1=2.56g,
答:反应后生成铜的质量为2.56g;
(2)原溶液中Fe2(SO4)3物质的量浓度为[0.02mol/0.2L]=0.1mol/L,
答:原Fe2(SO4)3溶液的物质的量浓度为0.1mol/L.点评:
本题考点: 化学方程式的有关计算;物质的量浓度的相关计算;铁的化学性质.
考点点评: 本题考查学生利用化学反应方程式的计算,明确氧化性的强弱、反应的先后顺序是解答本题的关键.1年前查看全部
- 某同学选用以下部分材料进行原电池实验:①电极材料:铁、铜、石墨、锌;②电解质溶液:CuCl2溶液、Fe2(SO4)3溶液
某同学选用以下部分材料进行原电池实验:①电极材料:铁、铜、石墨、锌;②电解质溶液:CuCl2溶液、Fe2(SO4)3溶液、盐酸;③导线.请按要求回答下列问题:
(1)该同学选用锌、石墨、CuCl2溶液、导线构成原电池,则该电池的正极材料是______,电极反应式为:负极______,正极______.
(2)若该同学安装的原电池总反应离子方程式为:Cu+2Fe3+=Cu2++2Fe2+,则该原电池的负极材料是______,正极材料是______,正极电极反应式是______. dnyz1年前1
dnyz1年前1 -
 lubing541888 共回答了20个问题
lubing541888 共回答了20个问题 |采纳率85%解题思路:(1)锌为活泼金属,为原电池的负极,发生氧化反应,石墨为正极,发生还原反应;
(2)由Cu+2Fe3+=Cu2++2Fe2+可知,Cu被氧化,应为原电池负极,则电解质溶液应含Fe3+,以此解答.(1)锌为活泼金属,为原电池的负极,发生氧化反应,电极方程式为Zn-2e-=Zn2+,石墨为正极,发生还原反应,电极方程式为Cu2++2e-=Cu,
故答案为:石墨;Zn-2e-=Zn2+;Cu2++2e-=Cu;
(2)由Cu+2Fe3+=Cu2++2Fe2+可知,Cu被氧化,应为原电池负极,则电解质溶液应含Fe3+,石墨为正极,正极发生还原反应,电极方程式为Fe3++e-=Fe2+,
故答案为:Cu;石墨;Fe3++e-=Fe2+.点评:
本题考点: 设计原电池.
考点点评: 本题考查了原电池原理,为高频考点,侧重于学生的分析能力的考查,注意把握原电池构成条件以及构成原电池的反应必须是自发进行的且是放热的氧化还原反应,难度不大.1年前查看全部
- 某混合物含MgSO4和Fe2(SO4)3,其中硫元素的质量分数为25%,将它们配成500ml溶液,求最多能腐蚀多少cu粉
 心中有佛1年前1
心中有佛1年前1 -
 彪悍的撒花 共回答了16个问题
彪悍的撒花 共回答了16个问题 |采纳率87.5%题目缺少必要条件---混合物的质量.假设混合物的质量为m,那么
MgSO4含硫的质量分数是32/120
Fe2(SO4)3=96/400=24/100
MgSO4与Fe2(SO4)3的质量比为(25%-24%)/(32/120-25%)=3/5
Fe2(SO4)3的质量是5m/8=0.625m
三价铁的质量是0.625m×112/400=0.175m
根据2Fe3+ + Cu = 2Fe2+ + Cu2+
112 64
0.175m
可以腐蚀铜粉0.175m×64/112=0.1m1年前查看全部
- VL Fe2(so4)3溶液中有Fe+3离子 mg .求硫酸根的物质量的浓度?
 liyang00001年前1
liyang00001年前1 -
 _股海牛刀_ 共回答了16个问题
_股海牛刀_ 共回答了16个问题 |采纳率87.5%铁离子物质的量=m/56 mol,所以根据Fe2(so4)3中离子比例,可得硫酸根的物质的量=3m/112 mol,硫酸根的物质的量浓度=3m/112÷V=3m/112V mol/L1年前查看全部
- fe2o3与h2so4反应生成fe2(so4)3 和h2o 里 h2so4是浓的还是稀的?
fe2o3与h2so4反应生成fe2(so4)3 和h2o 里 h2so4是浓的还是稀的?
fe2o3与h2so4反应生成fe2(so4)3
和h2o 里 h2so4是浓的还是稀的? tiger20391年前1
tiger20391年前1 -
 leo_1982 共回答了18个问题
leo_1982 共回答了18个问题 |采纳率77.8%稀的,1年前查看全部
- (1)0.5摩尔每升的Fe2(SO4)3溶液中,三价铁离子的物质的量为多少?
(1)0.5摩尔每升的Fe2(SO4)3溶液中,三价铁离子的物质的量为多少?
(2)V升Fe2(SO4)3溶液中含有a克硫酸根离子,硫酸根离子的物质的量为多少?取此溶液0.5V升,三价铁离子的物质的量浓度为多少?用水稀释至2V升,稀释后三价铁离子的物质的量浓度为多少? 黄_凌云1年前1
黄_凌云1年前1 -
 linrz68 共回答了12个问题
linrz68 共回答了12个问题 |采纳率66.7%(1)0.5摩尔每升的Fe2(SO4)3溶液中,三价铁离子的物质的量【浓度】为多少?
0.5mol/L×2=1mol/L
如果不加【XX体积】,那就要加【浓度】二字.
(2)V升Fe2(SO4)3溶液中含有a克硫酸根离子,硫酸根离子的物质的量为多少?取此溶液0.5V升,三价铁离子的物质的量浓度为多少?用水稀释至2V升,稀释后三价铁离子的物质的量浓度为多少?
硫酸根离子的物质的量:a/96mol硫酸根
三价铁离子的物质的量浓度:a/(96V) ×2÷3=a/(144V)
稀释后铁离子的物质的量浓度:a/(144V) ×0.5÷2=a/(576V)1年前查看全部
- (2006•眉山)有MgSO4、Fe2(SO4)3、K2SO4三种的混合物,测得其中硫元素的质量分数为a%,则混合物中金
(2006•眉山)有MgSO4、Fe2(SO4)3、K2SO4三种的混合物,测得其中硫元素的质量分数为a%,则混合物中金属元素的质量分数为( )
A. [100−a/3]%
B. [100−3a/3]%
C.
%2(100−a) 3
D. (100-3a)% aaaa731年前1
aaaa731年前1 -
 霍宇 共回答了13个问题
霍宇 共回答了13个问题 |采纳率92.3%解题思路:根据由于混合物是由MgSO4、Fe2(SO4)3、K2SO4组成的,而每有1个S,就有4个O,所以若硫元素的质量分数为a%,则氧元素的质量分数为2a%,所以硫和氧一共的质量分数为3a%,解答本题.在MgSO4、Fe2(SO4)3、K2SO4三种的混合物中,硫元素和氧元素的原子个数比都是1:4,则硫元素和氧元素的质量比为:32:16×4═1:2,故氧元素的质量分数
为2a%,则金属元素的质量分数为:(100-3a)%,故D正确.
故选D点评:
本题考点: 元素的质量分数计算;元素质量比的计算.
考点点评: 本题考查学生根据混合物中元素之间的比进行分析解题的能力.1年前查看全部
- V 升Fe2(SO4)3溶液中汗Fe3+ m 克,则溶液中硫酸根离子的物质的量浓度为? 急!求各位高手
 topzc1年前1
topzc1年前1 -
 zmqzxb 共回答了22个问题
zmqzxb 共回答了22个问题 |采纳率90.9%一个Fe2(SO4)3 有 2个Fe3+ 和 3个SO42-
则 2Fe3+~~~~3SO42-
2*56 3
m x
x==3m/112
即SO42- 有 3m/112 mol
则物质的量浓度==物质的量/体积==3m/112/V==3m/(112V) mol/L1年前查看全部
- 已知:Fe2+结合S2-的能力大于结合OH-的能力,而Al3+则正好相反,I2的氧化性比S强.在Fe2(SO4)3和Al
已知:Fe2+结合S2-的能力大于结合OH-的能力,而Al3+则正好相反,I2的氧化性比S强.在Fe2(SO4)3和AlCl3的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是( )
A. Fe2S3和 Al(OH)3
B. Fe(OH)3和Al(OH)3
C. FeS、Al(OH)3 和S
D. Al2S3、FeS和S hjun1231年前2
hjun1231年前2 -
 james663 共回答了17个问题
james663 共回答了17个问题 |采纳率76.5%解题思路:铁离子和碘离子存在反应:2Fe3++2I-=2Fe2++I2,在Na2S溶液中,有大量S2-、OH-,Fe2+结合S2-能力强,两盐发生复分解反应,形成FeS沉淀,↓;Al3+结合OH-能力强,形成Al(OH)3沉淀,Al3++3OH-=Al(OH)3↓,同时I2的存在还会发生:I2+S2-=S↓+2I-的反应,据此回答.在Fe2(SO4)3和AlCl3溶液中加过量KI,先是Fe2(SO4)3与KI两盐发生氧化还原反应:2Fe3++2I-=2Fe2++I2,反应完后溶液中含大量Fe2+、Al3+、I2,
再加入Na2S后,由于S2-+H2O⇌HS-+OH-.在Na2S溶液中,有大量S2-、OH-,依题意知,Fe2+结合S2-能力强,两盐发生复分解反应,形成FeS沉淀,
Fe2++S2-=FeS↓;Al3+结合OH-能力强,形成Al(OH)3沉淀,Al3++3OH-=Al(OH)3↓,或理解为Al3+与S2-发生双水解反应:3Na2S+AlCl3+6H2O=2Al(OH)3↓+3H2S↑+6NaCl;但由于I2的存在发生:I2+S2-=S↓+2I-或I2+H2S=S↓+2HI,所以最终得到的沉淀是FeS、Al(OH)3和S的混合物.
故选D.点评:
本题考点: 铁盐和亚铁盐的相互转变;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题目主要考查学生对氧化还原反应的本质和特征,氧化还原反应的定义,沉淀溶解平衡等考点的理解,综合性强,难度中等.1年前查看全部
- 测知由Fe2(SO4)3和FeSO4组成混合物中含硫a%,则其含铁量应为( )
测知由Fe2(SO4)3和FeSO4组成混合物中含硫a%,则其含铁量应为( )
A. (100-4a)%
B. (100-2a)%
C. (100-a)%
D. (100-3a)% 泪月无痕1年前2
泪月无痕1年前2 -
 pauwork_jin 共回答了21个问题
pauwork_jin 共回答了21个问题 |采纳率76.2%解题思路:根据Fe2(SO4)3和FeSO4两物质的组成特点,可知混合物中硫元素与氧元素原子的个数比为1:4,则两种元素的质量比为(32×1):(16×4)=1:2,混合物中硫元素的质量分数为α%,则混合物中氧元素质量分数为2α%,则可计算混合物中铁元素质量分数.在Fe2(SO4)3和FeSO4组成的混合物中,硫元素与氧元素的质量比=32:(16×4)=1:2,
由于混合物中硫元素的质量分数为α%,则混合物中氧元素的质量分数=α%×2=2α%,
则混合物中铁元素的质量分数=1-α%-2α%=(100-3α)%.
故选D.点评:
本题考点: 元素质量分数的计算.
考点点评: 本题难度较大,根据混合物组成中两化合物的中组成元素的质量特别关系确定混合物中元素的质量分数是解答本题的捷径.1年前查看全部
- Fe2(SO4)3是沉淀吗?能与稀硫酸反应吗?有一道这样的题:小明将一定质量的氧化铁样品(杂质是铁粉)...
Fe2(SO4)3是沉淀吗?能与稀硫酸反应吗?有一道这样的题:小明将一定质量的氧化铁样品(杂质是铁粉)...
Fe2(SO4)3是沉淀吗?能与稀硫酸反应吗?有一道这样的题:小明将一定质量的氧化铁样品(杂质是铁粉)与过量的稀硫酸反应,准确称量反应前后固体和液体物质的总质量,据此可求出氧化铁的质量分数,怎样求?小明的计算原理是什么?
 沙威1年前1
沙威1年前1 -
 股慌 共回答了22个问题
股慌 共回答了22个问题 |采纳率95.5%不是沉淀如果都是氧化铁的话,那么反应前后的质量是没有变化的,现在是有杂质铁粉,则有氢气产生了,反应前后的质量差就是氢气的质量,你知道了氢气的质量就可以算出铁粉的质量,后面就OK了1年前查看全部
- 化学方程式(很简单的)Fe2(SO4)3溶液中加入Fe粉
 elementice1年前1
elementice1年前1 -
 kanewwf 共回答了27个问题
kanewwf 共回答了27个问题 |采纳率92.6%Fe2(SO4)3+Fe=3FeSO41年前查看全部
- 将6g铁粉加入200mLFe2(SO4)3和CuSO4的混合溶液中,充分反应得到200Ml0.5mol/LFeSO4溶液
将6g铁粉加入200mLFe2(SO4)3和CuSO4的混合溶液中,充分反应得到200Ml0.5mol/LFeSO4溶液和5.2g固体沉淀物
使计算:
1.反应后生成铜的质量.
2.原Fe2(SO4)3溶液的物质的量浓度.
n(FeSO4)=0.2×0.5=0.1 mol,据硫酸根离子守恒有3n(Fe2(SO4)3)+n(CuSO4)=0.1.
反应:Fe+Fe2(SO4)3=3FeSO4,表现为铁溶解,固体质量减小;Fe+CuSO4=FeSO4+Cu,变现为固体质量增加,每摩尔CuSO4反应质量增加(64-56)=8g,所以有56n(Fe2(SO4)3)-8n(CuSO4)=6-5.2=0.8,解方程组得n(Fe2(SO4)3)=1.6/80=0.02 mol,n(CuSO4)=0.04 mol
(1)m(Cu)=0.04×64=2.56 g
(2)c(Fe2(SO4)3)=0.02/0.2=0.1 mol/L.
为什么有56n(Fe2(SO4)3)-8n(CuSO4)=6-5.2=0. SSNDDT_21年前2
SSNDDT_21年前2 -
 nyhq 共回答了15个问题
nyhq 共回答了15个问题 |采纳率80%6=n【Fe2(SO4)3】*56+n(CuSO4)*56+m(Fe余)
5.2=64*n(CuSO4)+m(Fe余)1年前查看全部
- 某Fe2(SO4)3,FeSO4,H2SO4的混合溶液100mL,已知溶液中各阳离子的浓度相同(不考虑水解),且硫酸根离
某Fe2(SO4)3,FeSO4,H2SO4的混合溶液100mL,已知溶液中各阳离子的浓度相同(不考虑水解),且硫酸根离
某Fe2(SO4)3,FeSO4,H2SO4的混合溶液100mL,已知溶液中各阳离子的浓度相同(不考虑水解),且硫酸根离子的物质的量浓度为6mol/L,则此溶液最多可溶解铁粉的质量为多少?怎么算?
电中性什么的我们好像没学 懂洁1年前2
懂洁1年前2 -
 重磅**头 共回答了24个问题
重磅**头 共回答了24个问题 |采纳率87.5%何谓电中性呢?
很简单 就是任何的溶液始终是不会本身带电的 比如食盐水 NaCl的水溶液 当NaCl溶解电离的时候 是不是就是NaCl= Na + + Cl- 阳离子带电和阴离子的电荷总量是相等的 最终溶液就是不带电的 称之为电中性 也就是高二要学习的 电荷守恒的
为什么要用到电中性呢? 是因为电中性的应用会减少很多不必要的中间过程 减少计算量而已(看后边的方法二)
你不用电中性 用别的方法也可以 就是多几步计算而已
请看(方法一)
已知溶液中各阳离子的浓度相同 设阳离子的物质的量浓度为x mol/L
所以是不是要保证Fe2+ Fe3+ H+ 都是x mol/L 那么我们就得到FeSO4就是x mo/L H2SO4为X/2 mol /L Fe2(SO4)也就是x/2 mol/L
然后我们得到3种溶质分别带有的SO42-就是 x x/2 3x/2
因为 硫酸根离子的物质的量浓度为6mol/L
所以是不是就得到 x + x/2 +3x/2 = 6
两边同时乘以2就得到式子 2x + x + 3x = 6*2 是不是和方法二衔接上了
后边就和方法二一样了.
这下明白电中性的道理了~~~~~
化学要好好的多思考哦~~~
---------------------------------------------------------------------------------------------------------------------
(方法二)
因为最终加入的Fe只可与H+ Fe3+反应的
Fe+2Fe3+=3Fe2+
2H++Fe=Fe2++H2
所以我们要去寻找Fe3+与H+的物质的量 现在知道溶液体积 所以去找到Fe3+ H+物质的量浓度就可以了
已知溶液中各阳离子的浓度相同 设阳离子的物质的量浓度为x
带电就是 (3x + 2x + x )
阴离子就只有SO42-所以带电 = 6*2
则根据电中性原理:阳离子
(3x + 2x + x ) = 6*2
x=2mol/L
即:Fe3+,Fe2+,H+的物质的量浓度均为2mol/L,溶液体积为0.1L,即三种阳离子的物质的量为0.2MOL.以0.2mol带入离子方程式计算得到
2Fe3++Fe=3Fe2+
2 56
0.2 5.6
2H++Fe=Fe2++H2
2 56
0.2 5.6
共质量:5.6+5.6=11.2克1年前查看全部
- (2014•江西模拟)现有FeSO4、Fe2(SO4)3、H2SO4的混合溶液,其中c(H+)=0.10mol/L.取该
(2014•江西模拟)现有FeSO4、Fe2(SO4)3、H2SO4的混合溶液,其中c(H+)=0.10mol/L.取该溶液200mL,加入过量BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀27.96g;再另取该混合溶液200mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧所得固体,最终得固体8.00g.则原混合溶液中c(Fe2+)与c(Fe3+)之比为( )
A.4:1
B.3:1
C.2:1
D.1:1 欣欣然xr1年前1
欣欣然xr1年前1 -
 给自己阳光 共回答了13个问题
给自己阳光 共回答了13个问题 |采纳率92.3%解题思路:200mL混合溶液加入过量BaCl2溶液,充分反应后得到沉淀27.96g为BaSO4,根据电荷守恒可知2n(SO42-)=2n(Fe2+)+3n(Fe3+)+n(H+),另取该混合溶液200mL,向其中加入过量NaOH溶液充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧最终得固体8.00g为Fe2O3,根据Fe元素守恒有2n(Fe2O3)=n(Fe2+)+n(Fe3+),据此计算溶液中n(Fe2+)、n(Fe3+),溶液体积相等,浓度之比等于物质的量之比.200mL混合溶液加入过量BaCl2溶液,充分反应后得到沉淀27.96g为BaSO4,其物质的量=[27.96g/233g/mol]=0.12mol,根据电荷守恒可知2n(SO42-)=2n(Fe2+)+3n(Fe3+)+n(H+),即2n(Fe2+)+3n(Fe3+)=0.12mol×2-0.2L×0.1mol/L=0.22mol,
另取该混合溶液200mL,向其中加入过量NaOH溶液充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧最终得固体8.00g为Fe2O3,其物质的量=[8g/160g/mol]=0.05mol,根据Fe元素守恒有2n(Fe2O3)=n(Fe2+)+n(Fe3+),即n(Fe2+)+n(Fe3+)=0.05mol×2=0.1mol,
联立方程解得:n(Fe2+)=0.08mol、n(Fe3+)=0.02mol,溶液体积相等,浓度之比等于物质的量之比,则原混合溶液中c(Fe2+):c(Fe3+)=0.08mol:0.02mol=4:1,
故选A.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物计算,清楚发生反应过程是解题关键,注意利用守恒思想计算,侧重解题方法技巧与思维能力的考查,难度中等.1年前查看全部
- 某混合物中只含有Fe2(SO4)3和FeSO4,已知硫元素的质量分数为a%,则铁元素的质量分数为?
某混合物中只含有Fe2(SO4)3和FeSO4,已知硫元素的质量分数为a%,则铁元素的质量分数为?
答案是(100—3a)%,我要过程,谢谢.
 田尾竹1年前1
田尾竹1年前1 -
 godseraph 共回答了17个问题
godseraph 共回答了17个问题 |采纳率88.2%每有一个 硫 就有 4个氧 所以氧的质量是硫的2倍(16*4/32=2)
即氧的质量分数 2a%
除了氧和硫 剩下就铁了 所以答案 100%-3a%1年前查看全部
- 请将下列5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3,分别填入下面对应的横线上,组成一个
请将下列5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3,分别填入下面对应的横线上,组成一个化学方程式并配平.
(1)□______+□______=□______+□______+□______+□______H2O
(2)反应物中发生氧化反应的物质______,被还原的元素是______.
(3)反应中1mol氧化剂______(填“得到”或“失去”)______mol电子.
(4)HNO3在上述反应中表现出来的性质是______.(填选项编号)
A.酸性B.氧化性C.还原性D.热不稳定性. 郁闷的蚂蚱1年前1
郁闷的蚂蚱1年前1 -
 五0 共回答了30个问题
五0 共回答了30个问题 |采纳率76.7%解题思路:所给的物质组合中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为NO2,能将还原性的FeSO4氧化为Fe2(SO4)3,根据氢原子守恒,水在生成物中,根据化合价升降相等和原子守恒配平后发生的反应,以此解答该题.(1)所给的物质组合中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为NO2,能将还原性的FeSO4氧化为Fe2(SO4)3,根据氢原子守恒,水在生成物中,根据化合价升降相等和原子守恒配平后发生的反应为:30HNO3+24FeSO4=8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O,
故答案为:30HNO3;24FeSO4;8Fe(NO3)3;8Fe2(SO4)3;3N2O;15;
(2)还原剂FeSO4发生氧化反应,化合价降低的N元素被还原,故答案为:FeSO4;N;
(3)反应中N元素化合价由+5价降低到+1价,则1mol氧化剂得到4mol电子,故答案为:得到;4;
(4)反应硝酸被还原,生成硝酸亚铁,表现为酸性,故答案为:A、B.点评:
本题考点: 氧化还原反应;氧化还原反应方程式的配平.
考点点评: 本题考查氧化还原反应化学方程式的书写,侧重于从化合价分析氧化产物和还原产物,从原子守恒确定其他反应物或产物,根据根据电子守恒和质量守恒来配平方程式,题目难度中等.1年前查看全部
- (2013•桂林)化学兴趣小组的同学们探究用Fe从含Fe2(SO4)3和CuSO4的溶液中获取金属Cu的原理.请你一起参
(2013•桂林)化学兴趣小组的同学们探究用Fe从含Fe2(SO4)3和CuSO4的溶液中获取金属Cu的原理.请你一起参与探究.
(1)实验依据:金属活动顺序.请在下表对应的方框内填入铁和铜的元素符号.
(2)意外发现:小明将光亮的铁丝插入含Fe2(SO4)3和CuSO4的废液中,一段时间后取出,意外地发现铁丝表面没有变红.
(3)提出问题:Fe为什么没有从废液中置换出Cu?
(4)提出假设:小丽认为在铁丝表面可能有Cu析出,但被Fe2(SO4)3溶液溶解了.
(5)验证假设:提供的主要实验用品:洁净的铁丝和铜丝各两根,相同体积、相同浓度的Fe2(SO4)3溶液三份[Fe2(SO4)3溶液显黄色].
(6)实验结论:小丽的假设______(选填“成立”或“不成立”),理由是______;实验操作 实验现象和数据 结论 ①准确称量洁净的铁丝和铜丝的质量 铁丝质量为ag,
铜丝质量为bg②将铁丝插入Fe2(SO4)3溶液中,一段时间后取出、洗净、干燥、称量 铁丝质量为mg,(m<a),溶液有黄色变为浅绿色 一定有______生成(填化学式) ③将铜丝插入Fe2(SO4)3溶液中,一段时间后取出、洗净、干燥、称量 铜丝质量为ng(n<b) 铜______(填“能”或“不能”)与Fe2(SO4)3溶液反应 ④另取相同质量、相同粗细的洁净铁丝和铜丝互相缠绕,插入Fe2(SO4)3溶液中,一段时间后取出、洗净、干燥、分别称量铁丝和铜丝的质量 铁丝质量较轻
铜丝质量不变Fe、Cu共存时______优先与Fe2(SO4)3溶液反应
(7)思考与交流:
①兴趣小组的同学们通过对上述实验的分析,找到了用Fe从含Fe2(SO4)3和CuSO4的溶液中提取金属Cu的关键,并且最终实验获得了成功,其实验成功的关键是:______.并且反应充分.
②已知Fe和Fe2(SO4)3发生化合反应.请按反应顺序写出用Fe从含Fe2(SO4)3和CuSO4的溶液中获取金属Cu的化学方程式:______;______. 娃哈哈90l51年前1
娃哈哈90l51年前1 -
 xb8133 共回答了16个问题
xb8133 共回答了16个问题 |采纳率100%解题思路:(1)熟记金属活动性顺序表,铁排在氢的前面,铜排在氢的后面;
(5)②溶液由黄色变为浅绿色,是解题的突破口,得知溶液为硫酸亚铁溶液;
③根据实验现象中固体质量的减少,判断反应是否发生了;
④根据实验后的现象“铁丝质量较轻,铜丝质量不变”进行判断;
(6)实验结论“Fe、Cu共存时Fe优先与Fe2(SO4)3溶液反应”可以反驳小丽的假设;
(7)①铁先于硫酸铁溶液反应生成硫酸亚铁,再与硫酸铜溶液反应生成铜和硫酸亚铁溶液;
②已知Fe和Fe2(SO4)3发生化合反应,且生成的浅绿色溶液;铁与硫酸铜溶液的反应属于置换反应是教材上学过的反应方程式.(1)熟记金属活动性顺序表,并会写元素符号,故答案为:Fe Cu;
(5)②根据反应后铁丝的质量减少了,并且溶液由黄色变为浅绿色,确定为硫酸亚铁溶液,故答案为:FeSO4
③将铜丝插入Fe2(SO4)3溶液中,一段时间后取出、洗净、干燥、称量,铜丝质量为ng(n<b),铜能与Fe2(SO4)3溶液反应,故答案为:能;
④根据实验后的现象“铁丝质量较轻,铜丝质量不变”得知Fe、Cu共存时Fe优先与Fe2(SO4)3溶液反应,故答案为:Fe;
(6)用Fe从含Fe2(SO4)3和CuSO4的溶液中获取金属Cu,实验过程Fe没有从废液中置换出Cu,小丽认为在铁丝表面可能有Cu析出,但被Fe2(SO4)3溶液溶解了.但是根据实验探究的结果发现Fe、Cu共存时Fe优先与Fe2(SO4)3溶液反应,所以小丽的假设错误的,故答案为:不成立;Fe、Cu共存时Fe优先与Fe2(SO4)3溶液反应;
(7)①根据实验探究的结果,我们得知铁先于硫酸铁溶液反应生成硫酸亚铁,所以只有加入过量的铁才能发生铁与硫酸铜溶液的置换反应,从而生成铜,故答案为:加入过量的铁;
②已知Fe和Fe2(SO4)3发生化合反应,且生成的是浅绿色的溶液;铁与硫酸铜溶液的反应属于置换反应是教材上学过的反应方程式,故答案为:
Fe+Fe2(SO4)3=3FeSO4 Fe+CuSO4=FeSO4+Cu点评:
本题考点: 实验探究物质的性质或变化规律;金属活动性顺序及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题联系生产实际以实验探究的形式,重在考查金属的化学性质,虽难度稍大,但仍是一道不错的化学题.1年前查看全部
- 在Fe2(SO4)3和FeSO4组成的混合物中,经测定硫元素的质量分数为23%,则该混合物中铁元素的质量分数为_____
在Fe2(SO4)3和FeSO4组成的混合物中,经测定硫元素的质量分数为23%,则该混合物中铁元素的质量分数为______.
 瞿歌1年前1
瞿歌1年前1 -
 briar 共回答了25个问题
briar 共回答了25个问题 |采纳率76%解题思路:根据FeSO4和Fe2(SO4)3两物质的组成特点,可知混合物中硫元素与氧元素的质量比为1:2,混合物中硫元素的质量分数为23%,可计算出混合物中氧元素质量分数,进而可计算出该混合物中铁元素的质量分数.在FeSO4和Fe2(SO4)3组成的混合物中,硫元素与氧元素的质量比=32:(16×4)=1:2,由于混合物中硫元素的质量分数为23%,则混合物中氧元素的质量分数=23%×2=46%,该混合物中铁元素的质量分数为1-23%-46%=31%.
故答案为:31%.点评:
本题考点: 元素的质量分数计算.
考点点评: 本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- 请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3
请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3
(1)分别填入下面对应的横线上,组成一个未配平的化学方程式.
______+______→______+______+______+______H2O
(2)反应物中发生氧化反应的物质是______,被还原的元素是______.反应中1mol氧化剂______(填“得到”或“失去”)______mol电子. 行不由径1年前3
行不由径1年前3 -
 2776624 共回答了12个问题
2776624 共回答了12个问题 |采纳率100%解题思路:所给的物质组合中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为N2O,能将还原性的FeSO4氧化为Fe2(SO4)3,根据氢原子守恒,水在生成物中,根据化合价升降相等和原子守恒配平后发生的反应,以此解答该题.(1)所给的物质组合中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为NO2,能将还原性的FeSO4氧化为Fe2(SO4)3,根据氢原子守恒,水在生成物中,根据化合价升降相等和原子守恒配平后发生的反应为:30HNO3+24FeSO4=8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O,
故答案为:30HNO3;24FeSO4;8Fe(NO3)3;8Fe2(SO4)3;3N2O;15;
(2)还原剂FeSO4发生氧化反应,化合价降低的N元素被还原,反应中N元素化合价由+5价降低到+1价,则1mol氧化剂得到4mol电子,
故答案为:FeSO4;N;得到;4.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应化学方程式的书写,侧重于从化合价分析氧化产物和还原产物,从原子守恒确定其他反应物或产物,根据根据电子守恒和质量守恒来配平方程式,题目难度中等.1年前查看全部
- 按要求填写下列实验报告: 实验内容 主要实验操作 主要结论 ① 除去FeSO4溶液中的少量Fe2(SO4)3, ____
按要求填写下列实验报告:
实验内容 主要实验操作 主要结论 ① 除去FeSO4溶液中的少量Fe2(SO4)3, ______,过滤 离子方程式为: ② 证明SO2既有漂白性又有还原性 主要现象为: ③ 证明还原性:
I->Cl-取样,______
______.离子方程式为: ④ 证明CO2具有一定的氧化性(助燃性): 化学方程式为:  风舞曲1年前1
风舞曲1年前1 -
 forawhile 共回答了18个问题
forawhile 共回答了18个问题 |采纳率88.9%解题思路:①除杂时要除去杂质而不引进新的杂质,且除杂剂和主要物质不反应;
②二氧化硫能使品红溶液褪色,且也能使酸性高锰酸钾溶液褪色;
③用氯水置换碘化物中的碘,再利用碘的性质检验碘单质;
④要证明二氧化碳具有一定的氧化性,且是助燃性,利用二氧化碳和镁的反应.①要除去硫酸亚铁中的硫酸铁且不引进新的杂质,可以用过量铁粉,铁和铁离子反应生成亚铁离子,反应方程式为:
2Fe3++Fe=3Fe2+,故答案为:加入过量铁粉,2Fe3++Fe=3Fe2+;
②二氧化硫能使品红溶液褪色,说明二氧化硫具有漂白性,酸性高锰酸钾溶液具有强氧化性,二氧化硫能使酸性高锰酸钾溶液褪色,说明二氧化硫具有还原性,所以实验操作是:依次通入品红试液和酸性高锰酸钾溶液中,主要现象是:能使品红和酸性高锰酸钾溶液褪色,
故答案为:依次通入品红试液和酸性高锰酸钾溶液中,主要现象是:能使品红和酸性高锰酸钾溶液褪色;
③为证明碘离子还原性大于氯离子,可以用氯水和碘化物反应制取碘,再用淀粉溶液检验碘单质,碘遇淀粉变蓝色,或用萃取实验检验碘单质,氯水和碘的离子反应方程式为:2I-+Cl2=I2+2Cl-,
故答案为:滴加氯水,并用CCl4萃取(或加淀粉溶液),2I-+Cl2=I2+2Cl-;
④镁在二氧化碳气体中能剧烈燃烧生成氧化镁和碳,其操作是:将点燃的镁条插入盛有二氧化碳的集气瓶中,反应方程式为:2Mg+CO2
点燃
.
2MgO+C,该实验中体现了二氧化碳的氧化性和助燃性,
故答案为:将点燃的镁条插入盛有二氧化碳的集气瓶中,2Mg+CO2
点燃
.
2MgO+C.点评:
本题考点: 性质实验方案的设计.
考点点评: 本题考查了元素化合物的性质,难度不大,注意:虽然二氧化碳能灭火,但二氧化碳能和镁反应生成碳单质,所以不能用泡沫灭火器灭镁燃烧的火灾,为易错点.1年前查看全部
- 某FeSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-
某FeSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6mol/L,则此溶液最多可溶解铁粉的质量为( )
A. 11.2 g
B. 16.8 g
C. 19.6 g
D. 22.4 g wangygqg1年前2
wangygqg1年前2 -
 小伢xin 共回答了21个问题
小伢xin 共回答了21个问题 |采纳率85.7%解题思路:根据H+、Fe3+都能与Fe反应生成Fe2+,最后溶液的成分为FeSO4,由硫酸根离子的物质的量可知反应后溶液中Fe2+的物质的量,减去原溶液中Fe3+、Fe2+物质的量,根据电荷守恒计算原溶液中Fe3+、Fe2+物质的量,可计算最多溶解的铁粉的质量.溶液中n(SO42-)=0.1L×6mol•L-1=0.6mol,
FeSO4、Fe2(SO4)3、H2SO4的溶液中阳离子的浓度相同,所以阳离子物质的量也相同,则有n(Fe2+)=n(H+)=n(Fe3+),设Fe2+、Fe3+、H+三种离子物质的量均为n,根据电荷守恒知道:2n+3n+n=0.6mol×2,解得n=0.2mol,
H+、Fe3+都能与Fe反应生成Fe2+,最后溶液的成分为FeSO4,则n(FeSO4)=0.6mol,根据Fe的守恒可知,此溶液最多溶解铁粉的物质的量为0.6mol-0.2mol-0.2mol=0.2mol,
则此溶液最多溶解铁粉的质量为0.2mol×56g/moL=11.2g,
故选A.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物的有关计算,题目难度中等,注意用电荷守恒和质量守恒去解答,也可以根据氢离子、铁离子计算溶解的Fe的质量.1年前查看全部
- 下列物质分别与CuSO4、NaCl、Fe2(SO4)3、MgSO4等溶液混合时,产生的现象各不相同的是( )
下列物质分别与CuSO4、NaCl、Fe2(SO4)3、MgSO4等溶液混合时,产生的现象各不相同的是( )
A.盐酸
B.氢氧化钾溶液
C.氯化钡溶液
D.硫酸钠溶液 只爱陈文媛1年前1
只爱陈文媛1年前1 -
 wumao 共回答了21个问题
wumao 共回答了21个问题 |采纳率81%解题思路:CuSO4、NaCl、Fe2(SO4)3、MgSO4分别与KOH混合的现象为:蓝色沉淀、无现象、红褐色沉淀、白色沉淀,以此来解答.A.四种物质均不与盐酸反应,现象相同,故A不选;
B.CuSO4、NaCl、Fe2(SO4)3、MgSO4分别与KOH混合的现象为:蓝色沉淀、无现象、红褐色沉淀、白色沉淀,现象各不相同,故B选;
C.CuSO4、Fe2(SO4)3、MgSO4均与氯化钡反应生成白色沉淀,现象相同,故B不选;
D.四种物质均不与硫酸钠反应,现象相同,故D错误;
故选B.点评:
本题考点: 物质的检验和鉴别的基本方法选择及应用.
考点点评: 本题考查物质的鉴别、检验的方法及选择,为高频考点,把握物质的性质及发生的化学反应为解答的关键,注意反应与现象的关系,题目难度不大.1年前查看全部
- (2009•大连模拟)在Fe2(SO4)3溶液中,加入ag Cu,完全溶解后,又加入bg Fe,充分
(2009•大连模拟)在Fe2(SO4)3溶液中,加入ag Cu,完全溶解后,又加入bg Fe,充分反应后得到cg 残余固体,且a>c,则下列判断不正确的是( )
A.最后溶液中一定不含Fe3+
B.残余固体可能是Fe、Cu的混合物
C.最后溶液中一定含Fe2+
D.残余固体一定是Cu 月亮秋千1年前1
月亮秋千1年前1 -
 神蛋上天 共回答了17个问题
神蛋上天 共回答了17个问题 |采纳率100%解题思路:在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,向盛有FeCl3溶液的烧杯内分别加入铁粉和铜粉,铁能与氯化铁反应生成氯化亚铁,铜能与氯化铁反应生成氯化亚铁和铜,利用此知识解决即可;此题中发生的化学反应有三个,方程式如下:2FeCl3+Cu=2FeCl2+CuCl2;CuCl2+Fe=FeCl2+Cu;2FeCl3+Fe=3FeCl2
依元素守恒可知:ag铜完全溶解后,变为ag铜离子,若加入的铁足够多的话,可将溶液中的铜离子全部变回金属铜(ag)甚至还会有铁剩余,此时,残余固体(cg)应大于或等于ag,依题意:a>c可知,加入的铁是不足量的,此时溶液中还有部分铜未完全置换出来.剩余固体为Cu,不可能有Fe剩;故B错误;
根据方程式1、2、3可知,溶液中一定有Fe2+,因上述推导可知,溶液中还应有Cu2+剩余,由方程式1可知,Cu与Fe3+是不能共存的,剩余固体中有Cu,则溶液中必无Fe3+,充分反应后剩余固体为Cu,而溶液中含FeCl2和CuCl2.故A正确、C正确、D正确;
故选B.点评:
本题考点: 铁的化学性质;铁盐和亚铁盐的相互转变.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行,要注意根据铁和铜的活动性强弱确定反应的先后顺序.1年前查看全部
- M+H2SO4═Fe2(SO4)3+N (M、N分别代表一种物质)反应中M可能是下列物质中的( )
M+H2SO4═Fe2(SO4)3+N (M、N分别代表一种物质)反应中M可能是下列物质中的( )
A.Fe
B.Fe2O3
C.Fe(OH)3
D.FeCl2 寡妇烟1年前1
寡妇烟1年前1 -
 zhangwei_qm 共回答了21个问题
zhangwei_qm 共回答了21个问题 |采纳率100%解题思路:A、根据金属与稀硫酸反应时生成亚铁盐判断.
B、根据金属氧化物与酸反应的化学性质和复分解反应元素化合价不变的特点判断.
C、根据酸碱中和反应的化学性质和复分解反应元素化合价不变的特点判断.
D、根据盐和酸反应的条件判断.A、铁与硫酸反应生成硫酸亚铁,不生成硫酸铁,所以错误.
B、氧化铁与硫酸反应生成硫酸铁和水,所以正确.
C、氢氧化铁与硫酸反应生成硫酸铁和水,所以正确.
D、氯化亚铁与硫酸混合后不能生成气体或沉淀或水,不符合反应条件,二者不反应,更不会生成硫酸铁,所以错误.
故选BC.点评:
本题考点: 酸的化学性质.
考点点评: 酸、碱、盐是初中化学的重点内容,是教学难点,也是考查的重点和热点,透彻理解掌握酸、碱、盐及氧化物的化学性质,了解反应现象、物质状态和颜色,明确各类反应发生的条件,是解题的前提条件.1年前查看全部
- (2009•沈阳一模)某稀溶液中含有等物质的量的ZnSO4、Fe2(SO4)3、H2SO4、CuSO4,向其中逐渐加入铁
(2009•沈阳一模)某稀溶液中含有等物质的量的ZnSO4、Fe2(SO4)3、H2SO4、CuSO4,向其中逐渐加入铁粉,溶液中Fe2+的物质的量(纵坐标/mol)和加入铁粉的物质的量(横坐标/mol)之间的关系为( )
A.
B.
C.
D.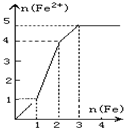
 xl67596961年前1
xl67596961年前1 -
 vooyah1 共回答了17个问题
vooyah1 共回答了17个问题 |采纳率94.1%解题思路:向含有等物质的量的ZnSO4、Fe2(SO4)3、H2SO4、CuSO4的混合溶液中逐渐加入铁粉,铁粉和各离子反应的先后顺序是:铁离子、铜离子、氢离子,根据方程式中铁和亚铁离子的关系式进行分析解答.向含有等物质的量的ZnSO4、Fe2(SO4)3、H2SO4、CuSO4的混合溶液中逐渐加入铁粉,铁粉和各离子反应的先后顺序是:铁离子、铜离子、氢离子,涉及的反应方程式为:Fe2(SO4)3+Fe=3FeSO4、CuSO4+Fe=FeSO4+Cu、H2SO4+Fe=FeSO4+H2↑,
则Fe2(SO4)3+Fe=3FeSO4
1 1 3
CuSO4+Fe=FeSO4+Cu
1 1 1
H2SO4+Fe=FeSO4+H2↑
1 1 1
所以等物质的量的ZnSO4、Fe2(SO4)3、H2SO4、CuSO4分别和等物质的量的铁完全反应生成硫酸亚铁,生成硫酸亚铁的物质的量之比是3:1:1,
故选A.点评:
本题考点: 铁的化学性质.
考点点评: 本题考查铁的性质及有关混合物反应的计算,明确离子反应先后顺序是解本题关键,把握物质间的关系式及量的关系即可解答,题目难度不大.1年前查看全部
- 在300毫升CuSO4 Fe2(SO4)3 H2SO4 三种物质的混合溶液中 阳离子的浓度相同(忽略水解) SO4离子浓
在300毫升CuSO4 Fe2(SO4)3 H2SO4 三种物质的混合溶液中 阳离子的浓度相同(忽略水解) SO4离子浓度...
在300毫升CuSO4 Fe2(SO4)3 H2SO4 三种物质的混合溶液中 阳离子的浓度相同(忽略水解) SO4离子浓度为4摩尔每升 求最多能溶解多少铁粉 ttgood6051年前1
ttgood6051年前1 -
 玻0璃0碎0片 共回答了20个问题
玻0璃0碎0片 共回答了20个问题 |采纳率95%CuSO4 xmol;Fe2(SO4)3 ymol;H2SO4 zmol
x=2y=2z
x+3y+z=41年前查看全部
- 16g Fe2O3与184g稀H2SO4恰好完全反应,求所得Fe2(SO4)3溶液的溶质质量分数?
16g Fe2O3与184g稀H2SO4恰好完全反应,求所得Fe2(SO4)3溶液的溶质质量分数?
 charmer19981年前1
charmer19981年前1 -
 xyzysl 共回答了26个问题
xyzysl 共回答了26个问题 |采纳率96.2%解题思路:首先根据反应物,生成物和反应条件正确书写方程式,再根据方程式中Fe2O3和Fe2(SO4)3的质量比求出
Fe2(SO4)3的质量,由公式溶液的溶质质量分数=[溶质的质量/溶液的质量]×100%就可以求出所得Fe2(SO4)3溶液的溶质质量分数.设反应生成的Fe2(SO4)3的质量为x
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
160400
16g x
[160/400]=[16g/x]
x=40g
[40g/16g+184g]×100%=20%
答:所得Fe2(SO4)3溶液的溶质质量分数为20%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 与方程式有关的溶质质量分数的计算经常出现在考题中,大家需仔细分析,认真计算.1年前查看全部
- VL Fe2(so4)3溶液中有Fe+3离子 mg .求硫酸根的物质量的浓度
 ww专用ee沙发1年前2
ww专用ee沙发1年前2 -
 yelion 共回答了20个问题
yelion 共回答了20个问题 |采纳率95%n(Fe3+)=m/56 mol
c(Fe3+)=n(Fe3+)/v mol/L
c(SO42+)=3*c(Fe3+)/2 =3m/112V mol/L1年前查看全部
- 体积均为aL的Fe2(SO4)3溶液、ZnSO4溶液、K2SO4溶液,均能与bL1mol•L-1的BaCl2溶液恰好完全
体积均为aL的Fe2(SO4)3溶液、ZnSO4溶液、K2SO4溶液,均能与bL1mol•L-1的BaCl2溶液恰好完全反应.则Fe2(SO4)3溶液、ZnSO4溶液、K2SO4溶液的物质的量浓度之比为( )
A. 3:2:2
B. 1:2:3
C. 1:3:3
D. 3:1:1 hongminbgz1年前1
hongminbgz1年前1 -
 mamazuiaiwo 共回答了19个问题
mamazuiaiwo 共回答了19个问题 |采纳率84.2%解题思路:等体积的Fe2(SO4)3溶液、ZnSO4溶液、K2SO4溶液,均能与bL 1mol•L-1的BaCl2溶液恰好完全反应,说明Fe2(SO4)3溶液、ZnSO4溶液、K2SO4溶液中含有SO42-的物质的量相等,令SO42-的物质的量为3mol,计算各自物质的量,溶液体积相等,则物质的量浓度之比等于其物质的量之比.等体积的Fe2(SO4)3溶液、ZnSO4溶液、K2SO4溶液,均能与bL 1mol•L-1的BaCl2溶液恰好完全反应,说明Fe2(SO4)3溶液、ZnSO4溶液、K2SO4溶液中含有SO42-的物质的量相等,令SO42-的物质的量为3mol,则:
n[Fe2(SO4)3]=[3mol/3]=1mol、n(ZnSO4)=n(SO42-)=3mol、n(K2SO4)=n(SO42-)=3mol,
溶液体积相等,则:c[Fe2(SO4)3]:c(ZnSO4):c(K2SO4)=1mol:3mol:3mol=1:3:3,
故选C.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学方程式计算,比较基础,注意利用硫酸根守恒解答.1年前查看全部
- NH3.H2O+Fe2(SO4)3=
NH3.H2O+Fe2(SO4)3=
Ca(HCO3)2+NaOH=(两种情况)
Ca(OH)2+NaHCO3=(两种情况)
在这里谢过了…… yangyanghong1年前2
yangyanghong1年前2 -
 lilydolphin 共回答了26个问题
lilydolphin 共回答了26个问题 |采纳率84.6%6NH3·H2O+Fe2(SO4)3=2Fe(OH)3↓+3NH4(SO4)2;
Ca(HCO3)2+NaOH=CaCO3↓+NaHCO3+H2O;
Ca(HCO3)2+2NaOH=CaCO3↓+Na2CO3+2H2O;
Ca(OH)2+2NaHCO3=CaCO3↓+Na2CO3+2H2O;
Ca(OH)2+2NaHCO3=Ca(HCO3)2↓(微溶形成沉淀)+2NaOH.1年前查看全部
- 高一气体摩尔体积(拜托您,)1.用10mL0.1moL/L的BaCl2溶液恰好使10mLFe2(SO4)3硫酸铁和ZnS
高一气体摩尔体积(拜托您,)
1.用10mL0.1moL/L的BaCl2溶液恰好使10mLFe2(SO4)3硫酸铁和ZnSO4和K2SO4三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度各为多少?
2.在一定温度和压强下,7g氯气占的体积为7.5L.在同样的条件下,15L某未知气体重8.5g.求该未知气体的相对分子质量.
3.标准状况下H2(氢气)和CO混合气体7L,质量2.5g,求H2(氢气)CO质量分数和体积分数. 小兔咪咪笑1年前1
小兔咪咪笑1年前1 -
 hawk44 共回答了15个问题
hawk44 共回答了15个问题 |采纳率93.3%设硫酸铁得物质的量浓度为xmol/L,硫酸锌为ymol/L,则:
3x+y=10-3 .1式
4x+2y=2*10-3.2式
说明:根据反映物质得化合价来判断,共有10-3Ba2+,就可以消耗10-3mol的硫酸很离子,氯离子也是用这个方法
2,氯气在此条件下的密度是m/v=14/15
未知气体是17/30,
( 14/15)/(17/30)=71/x,解出x=43.107143
3 c(总)=7/22.4=0.3125
设n(H2)=x,n(CO)=y,则:
X+y=0.3125.1式
2x+28y=2.5
解得x=0.240385
y=o.o72115
所以,v(H2)/v(CO)=10:3
m(H2):m(CO)=4.1999:11年前查看全部
- 配平下列的各个化学反应的方程式:1、?Zn+?HCl-?ZnCl2+?H2个 2、?Fe2(SO4)3+?NaOH-?N
配平下列的各个化学反应的方程式:1、?Zn+?HCl-?ZnCl2+?H2个 2、?Fe2(SO4)3+?NaOH-?Na2SO4+?Fe(OH)3
3、?NH3+?O2==催化剂?NO+?H2O 直来直往_271年前2
直来直往_271年前2 -
 sukiliu718 共回答了16个问题
sukiliu718 共回答了16个问题 |采纳率93.8%1、Zn+2HCl=ZnCl2+H2个
2、Fe2(SO4)3+6NaOH=3Na2SO4+2Fe(OH)3
3、4NH3+5O2==催化剂=4NO+6H2O1年前查看全部
- (2010•徐汇区二模)已知,Fe2+结合S2-的能力大于结合OH-的能力,而Al3+则正好相反.在Fe2(SO4)3和
(2010•徐汇区二模)已知,Fe2+结合S2-的能力大于结合OH-的能力,而Al3+则正好相反.在Fe2(SO4)3和AlCl3的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是( )
A.Al2S3、FeS和S
B.Fe(OH)3和Al(OH)3
C.Fe2S3和Al(OH)3
D.FeS、Al(OH)3和S 超级zz虫1年前1
超级zz虫1年前1 -
 篱东菊翁 共回答了19个问题
篱东菊翁 共回答了19个问题 |采纳率84.2%解题思路:加入碘离子后,将铁离子全部还原成亚铁离子,同时生成碘单质;
加入硫化钠,碘将氧化硫离子生成硫沉淀;
硫化钠水解,所以溶液中有硫离子和氢氧根离子,
根据题目中的提示,显然亚铁离子结合硫离子,铝离子结合氢氧根离子,
所以还要生成硫化亚铁沉淀和氢氧化铝沉淀.在Fe2(SO4)3和AlCl3溶液中加过量KI,先是Fe2(SO4)3与KI两盐发生氧化还原反应:2Fe3++2I-=2Fe2++I2,反应完后溶液中含大量Fe2+、Al3+、I2,
再加入Na2S后,由于S2-+H2O HS-+OH-.在Na2S溶液中,有大量S2-、OH-,依题意知,Fe2+结合S2-能力强,两盐发生复分解反应,形成FeS沉淀,
HS-+OH-.在Na2S溶液中,有大量S2-、OH-,依题意知,Fe2+结合S2-能力强,两盐发生复分解反应,形成FeS沉淀,
Fe2++S2-=FeS↓;Al3+结合OH-能力强,形成Al(OH)3沉淀,Al3++3OH-=Al(OH)3↓,或理解为Al3+与S2-发生双水解反应:3Na2S+AlCl3+6H2O=2Al(OH)3↓+3H2S↑+6NaCl;
但由于I2的存在发生:I2+S2-=S↓+2I-或I2+H2S=S↓+2HI,所以最终得到的沉淀是FeS、Al(OH)3和S的混合物.
故选D.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质;氧化还原反应.
考点点评: 本题考查离子反应,题目难度不大,注意分析盐与盐反应时要依次考虑能否发生氧化还原反应、能否发生双水解互促反应,以上两反应均不发生,则考虑能否发生复分解反应.这些盐之间反应的一般规律,主要决定于盐的性质.1年前查看全部
- 某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-
某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6mol•L-1,则此溶液最多溶解铁粉的质量为( )
A. 5.6g
B. 11.2g
C. 22.4g
D. 33.6g loveyafe1年前1
loveyafe1年前1 -
 我不明白的的 共回答了19个问题
我不明白的的 共回答了19个问题 |采纳率94.7%解题思路:根据Cu2+、H+、Fe3+都能与Fe反应生成Fe2+,最后溶液的成分为FeSO4,由硫酸根离子的物质的量可知反应后溶液中Fe2+的物质的量,减去原溶液中Fe3+的物质的量,可计算最多溶解的铁粉的质量.n(SO42-)=0.1L×6mol•L-1=0.6mol,CuSO4、Fe2(SO4)3、H2SO4的溶液中阳离子的浓度相同,则有n(Cu2+)=n(H+)=n(Fe3+),
由于溶液中阳离子的浓度相同,所以阳离子物质的量也相同,设Cu2+、Fe3+、H+三种离子物质的量均为n,
根据电荷守恒知道:2n+3n+n=0.6mol×2,由此解得n=0.2mol,
Cu2+、H+、Fe3+都能与Fe反应生成Fe2+,最后溶液的成分为FeSO4,则n(FeSO4)=0.6mol,
根据Fe的守恒可知,此溶液最多溶解铁粉的物质的量为0.6mol-0.2mol=0.4mol,
则此溶液最多溶解铁粉的质量为0.4mol×56g/moL=22.4g,
故选C.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物的计算,题目难度中等,本题注意用电荷守恒和质量守恒去解答.1年前查看全部
- 在有盐桥的原电池中,正极是石墨,石墨装在稀硫酸里,负极是Fe装在Fe2(SO4)3溶液中,中间连接盐桥
在有盐桥的原电池中,正极是石墨,石墨装在稀硫酸里,负极是Fe装在Fe2(SO4)3溶液中,中间连接盐桥
我们老师上课讲石墨不能换成是Cu,请问为什么 eemm1年前1
eemm1年前1 -
 3xny 共回答了9个问题
3xny 共回答了9个问题 |采纳率88.9%因为正极是 2H+ +2e-=H2 ,是H+与H2的转化
而若是Cu,就必须放入Cu2+溶液中1年前查看全部
- 硫酸铁水解方程式Fe2(SO4)3 +6H2O =2Fe(OH)3 +3H2SO4 Fe(OH)3是沉淀吗?反应可逆吗?
 zkeyess1年前1
zkeyess1年前1 -
 fanwish168 共回答了20个问题
fanwish168 共回答了20个问题 |采纳率95%大多数水解反应是很微弱的,是可逆反应,生成物如果有不溶的不能打沉淀符号
(因为量很少,不会形成沉淀)
上述反应是可逆反应,Fe(OH)3不是沉淀1年前查看全部
- 在Fe2(SO4)3和FeSO4的固体混合物中,如果硫元素的质量分数为a%,则铁元素的质量分数为( )
在Fe2(SO4)3和FeSO4的固体混合物中,如果硫元素的质量分数为a%,则铁元素的质量分数为( )
A. 0.31a%
B. (100-3a)%
C. (100-4a)%
D. 2.25a% 毛胚房1年前1
毛胚房1年前1 -
 菲羊 共回答了10个问题
菲羊 共回答了10个问题 |采纳率90%解题思路:根据FeSO4和Fe2(SO4)3两物质的组成特点,可知混合物中S元素与O元素的质量比为1:2,混合物中硫元素的质量分数为22%则混合物中O元素质量分数为44%,则可计算混合物中铁元素质量分数.在FeSO4和Fe2(SO4)3组成的混合物中,硫元素与氧元素的质量比=32:(16×4)=1:2,
由于混合物中硫元素的质量分数为a%,则混合物中氧元素的质量分数=a%×2=2a%
则混合物中铁元素的质量分数=1-a%-2a%=(100-3a)%
故选B.点评:
本题考点: 元素的质量分数计算.
考点点评: 根据混合物组成中两化合物的中组成元素的特别关系,确定混合物中元素的质量分数,此类问题通过存在这种特点.1年前查看全部
- 将6克铁粉加入200mLFe2(SO4)3 和CuSO4 的混合溶液,充分反应得到200mL 0.5
将6克铁粉加入200mLFe2(SO4)3 和CuSO4 的混合溶液,充分反应得到200mL 0.5mol•L-1 FeSO4溶液和5.2g固体沉淀物.试计算:
(1)反应后生成铜的质量;
(2)原Fe2(SO4)3溶液的物质的量浓度. jessica2513141年前2
jessica2513141年前2 -
 juvv 共回答了23个问题
juvv 共回答了23个问题 |采纳率78.3%解题思路:因氧化性Fe3+>Cu2+,则加入铁粉,先发生Fe+Fe2 (SO4)3=3FeSO4,5.2g固体沉淀物一定有铜,则后发生Fe+CuSO4=FeSO4+Cu,然后根据化学反应方程式即可计算.溶液中含有Fe2+:0.5mol•L-1×0.2L=0.1mol<[6g/56g/mol],
∴6g铁粉过量,设反应消耗铁的物质的量为x,生成铜的物质的量为y,
Fe+Fe2 (SO4)3=3FeSO4
1mol1mol 3mol
xmolxmol 3xmol
Fe+CuSO4=FeSO4+Cu
1mol 1mol 1mol 1mol
ymol ymol ymolymol
可得
3x+y=0.1mol
6g−56x+8y=5.2g,
解得x=0.02mol、y=0.04mol,
(1)故得生成铜质量为0.04mol×64g•mol-1=2.56g,
答:反应后生成铜的质量为2.56g;
(2)原溶液中Fe2(SO4)3物质的量浓度为[0.02mol/0.2L]=0.1mol/L,
答:原Fe2(SO4)3溶液的物质的量浓度为0.1mol/L.点评:
本题考点: 化学方程式的有关计算;物质的量浓度的相关计算;铁的化学性质.
考点点评: 本题考查学生利用化学反应方程式的计算,明确氧化性的强弱、反应的先后顺序是解答本题的关键.1年前查看全部
- 用一种试剂鉴别MgSO4、Al2(SO4)3、FeSO4、Fe2(SO4)3四种失去标签的稀溶液
用一种试剂鉴别MgSO4、Al2(SO4)3、FeSO4、Fe2(SO4)3四种失去标签的稀溶液
要现象、反应离子方程式 冰玉寒1年前6
冰玉寒1年前6 -
 matao111 共回答了22个问题
matao111 共回答了22个问题 |采纳率77.3%先观察颜色,淡绿色是FeSO4,黄色是Fe2(SO4)3,再用NaOH溶液,出现沉淀且不消失的是MgSO4,出现沉淀后又消失的是Al2(SO4)3
离子方程式:(1) Mg2+ +2OH-=Mg(OH)2(沉淀箭头)
(2)Al3+ +2OH-=Al(OH)3(沉淀箭头)
Al(OH)3+OH-=AlO2-+2H2O1年前查看全部
- 用化学方法区别MgSO4、Al2(SO4)3和Fe2(SO4)3三种溶液时,最好选择下列试剂中的( )
用化学方法区别MgSO4、Al2(SO4)3和Fe2(SO4)3三种溶液时,最好选择下列试剂中的( )
A.NaOH溶液
B.KSCN溶液
C.氨水
D.石蕊试液 一顶再顶1年前1
一顶再顶1年前1 -
 _依一_ 共回答了12个问题
_依一_ 共回答了12个问题 |采纳率100%解题思路:MgSO4溶液、Al2(SO4)3和Fe2(SO4)3分别与NaOH溶液的现象为:白色沉淀、先生成白色沉淀后沉淀溶解、红褐色沉淀,以此来解答.A.分别与NaOH溶液的现象为:白色沉淀、先生成白色沉淀后沉淀溶解、红褐色沉淀,现象不同,可鉴别,故A正确;
B.不能鉴别MgSO4、Al2(SO4)3,故B错误;
C.不能鉴别MgSO4、Al2(SO4)3,均生成白色沉淀,故C错误;
D.MgSO4、Al2(SO4)3和Fe2(SO4)3三种溶液均显酸性,加石蕊均变红,现象相同,不能鉴别,故D错误;
故选A.点评:
本题考点: 物质的检验和鉴别的实验方案设计.
考点点评: 本题考查物质的鉴别和检验,为高频考点,把握常见离子的检验及物质之间的反应为解答的关键,注意氢氧化铝的两性,题目难度不大.1年前查看全部
- 用方程式表示下列物质加热灼烧后的产物:NH4HCO3,Na2SO4,Fe2(SO4)3,FeCl2,KHCO3,AlCl
用方程式表示下列物质加热灼烧后的产物:NH4HCO3,Na2SO4,Fe2(SO4)3,FeCl2,KHCO3,AlCl3
为防止FeCl2,Na2S,Na2SO3,FeCl3,CuSO4水解,应该加入什么试剂? 孤贤1年前1
孤贤1年前1 -
 qiqiger 共回答了22个问题
qiqiger 共回答了22个问题 |采纳率90.9%碳酸氢铵加热出二氧化碳氨气和水
硫酸钠灼烧后还是硫酸钠
硫酸铁溶液加热后得到硫酸铁和少量氢氧化铁
再灼烧出氧化铁不过比较少
硫酸铁固体灼烧没反应
氯化亚铁溶液加热得氢氧化铁固体灼烧得氧化铁
氯化亚铁固体灼烧没反应
碳酸氢钾灼烧得碳酸钾和二氧化碳
氯化铝固体灼烧没反应
抑制水解的话
水解后显碱性的加碱
显酸性的加酸1年前查看全部
- 将6克的纯铁粉加入200mlFe2(SO4)3和CuSO4的混合溶液中,充分反应得到200ml 0.5mol/L的亚硫酸
将6克的纯铁粉加入200mlFe2(SO4)3和CuSO4的混合溶液中,充分反应得到200ml 0.5mol/L的亚硫酸铁溶液和5.2克固体沉淀物.计算
1)反应后生成cu的质量
2)加入铁粉前硫酸铁溶液的物质的量浓度. 效少1年前1
效少1年前1 -
 fengyxj 共回答了15个问题
fengyxj 共回答了15个问题 |采纳率86.7%由上述内容可是加入的铁粉过量.发生反应为:
Fe+Cu2+=Fe2++Cu,Fe+2Fe3+=3Fe2+
设原溶液中Cu2+为x mol Fe3+为y mol则:
6.0-56(y/2+x)+64x=5.2g ①
x+3y/2=0.200×0.50mol ②
联立 ①、②可得:x=0.04 mol ,y=0.04 mol
所以反应后生成铜质量为0.04×64g=2.56g
加入铁粉前Fe2(SO4)3物质的量浓度为:0.04÷2÷0.200mol/L=0.1mol/L1年前查看全部
- 已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl2溶液、Fe2(SO4)3溶液、盐酸.按要求回答下列问题:
已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl2溶液、Fe2(SO4)3溶液、盐酸.按要求回答下列问题:
(1)电工操作上规定:不能把铜导线和铝导线连接在一起使用.请说明原因______.
(2)若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池______,若能,请写出电极反应式,负极______,正极______.(若不能,后两空不填)
(3)设计一种以铁和硫酸反应为原理的原电池,要求画出装置图:(需标明电极材料及电池的正负.) hajimija1年前0
hajimija1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 将6g铁粉加入200毫升Fe2(So4)3和CuSO4的混合溶液中,充分反映后得到200毫升、05mol/LFeSo4溶
将6g铁粉加入200毫升Fe2(So4)3和CuSO4的混合溶液中,充分反映后得到200毫升、05mol/LFeSo4溶液和5.2g固体沉淀物.试计算
1,反应后生成铜的质量
2原溶液中硫酸铁的物质的量浓度. tanjingsong11221年前1
tanjingsong11221年前1 -
 吉利金刚 共回答了19个问题
吉利金刚 共回答了19个问题 |采纳率84.2%将6g纯铁粉加入200mLFe2(SO4)3和CuSO4的混合溶液中充分反应后得到200mL0.5mol/L的FeSO4溶液和5.2g固体,求:
(1)反应后生成铜多少克
(2)加入铁粉前Fe2(SO4)3物质的量浓度.
[思路]:在Fe2(SO4)3和CuSO4的混合溶液中投入铁粉后,Fe3+和Cu2+均可与铁发生反应,但由于氧化性Fe3+>Cu2+,所以Fe应首先还原Fe3+,即首先发生反应:Fe+2Fe3+=3Fe2+,但不可以只发生此反应,原因有二:第一是若只发生此反应则说明铁粉较少,已完全反应无剩余,则不可能有5.2g不溶物;第二,若只发生此反应可依此反应计算出生成的FeSO4为(6g÷56g/mol)×3=0.32mol>0.1mol.通过以上分析,可以看出,Fe在把全部的Fe3+还原后,不发生了还原Cu2+的反应,此时的Fe是否有剩余呢 也就是余5.2g固体中肯定有Cu,是否含Fe呢 这就是此题的关键所在,需通过计算推导确定.
[解析]:发生反应的化学方程式为:
①Fe+Fe2(SO4)3=3FeSO4 ②Fe+CuSO4=Cu+FeSO4
两个反应共生成FeSO4为:0.2L×0.5mol/L=0.1mol
观察两个反应不难发现,若生成同样的FeSO4,②式消耗的铁更多.假设0.1molFeSO4全部为②式产生,则此时消耗的铁将达最大量为a.
Fe FeSO4
1mol 1mol
a 0.1mol
a=0.1mol,即铁为5.6g,则5.2g固体中含Cu也含剩余的Fe,设原溶液的Fe2(SO4)3和CuSO4的物质的量分别为x和y.
Fe+Fe2(SO4)3=3FeSO4 Fe+CuSO4=Cu+FeSO4
X x 3x y y y y
由题意得 3x+y=0.1mol
6g-56g/mol×(x+y)+64g/mol×y=5.2g
解得:x=0.02mol y=0.04mol
则生成铜:0.04mol×64g/mol=2.56g
原Fe2(SO4)3和物质的量浓度为0.02mol/0.2L=0.1mol/L1年前查看全部
大家在问
- 1怎样判断分段函数的奇偶性?先要判断定义域是否对称,然后是在每个定义域内分别判断再汇总?还是不分定义域直接带f(-x)?第
- 2初三语文仿句1、阅读是快乐的,通过阅读,可以舒展心灵的翅膀,让笑容变得灿烂;阅读是幸福的,通过阅读,可以仰望思想的天空,
- 31.78升等于多少毫升 急急急急急急 快快快快快
- 4苹果们正等着你去帮他们调整一下字母顺序,使其成为正确的单词。esno.yee.llba.cefa.xis.thmou
- 5(2005•南通模拟)传感器是把非电物理量(如位移、速度、压力、角度等)转换成电学物理量(如电压、电流、电量等)的一种元
- 6《山坡羊潼关怀古》中以动写静的句 子是什么
- 7使近地面气温升高的热量传递过程(长短波辐射)
- 8复数 求z z^2+Z拔=0 用a+bi的形式
- 9四则混合运算的顺序是怎样的?如果有括号呢?
- 10图中的三角形的面积是6平方厘米,平行四边形的面积( ),平行四边形的面积与梯形的面积
- 114道六年级英语连词成句题 SOS!
- 12一道七年级数学题如图,已知长方形ABCD中,边AB=8,BC=4,以点O为原点,OA,OC所在的直线为y轴和x轴,建立平
- 13已知圆C经过p(4,-2),Q(-1,3)两点,半径小于5,且在Y轴上截得的线段常为四倍的根三求
- 14碳酸氢钠、碳酸钠、氢氧化钠的溶解性大小怎么用元素周期律来比较?
- 15服装英语中sweep与bottom都有下摆的意思,请问它们有什么区别?
