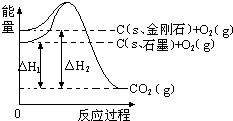
图中△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,有关说法正确的是( )
 为了顶这贴2022-10-04 11:39:541条回答
为了顶这贴2022-10-04 11:39:541条回答 图中△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,有关说法正确的是( )
图中△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,有关说法正确的是( )A.金刚石比石墨稳定性强
B.石墨变为金刚石是物理变化
C.石墨变为金刚石是放热反应
D.1mol石墨的总键能比1mol金刚石的总键能大1.9kJ

已提交,审核后显示!提交回复
共1条回复
 27970460 共回答了19个问题
27970460 共回答了19个问题 |采纳率84.2%- 解题思路:A、图象分析可知金刚石能量高于石墨;
B、石墨和金刚石为碳元素的同素异形体,相互转化为化学变化;
C、图象分析可知石墨变化为金刚石过程是吸热反应;
D、金刚石和石墨燃烧生成二氧化碳气体的焓变,结合焓变=反应物键能总和-生成物键能总和计算;A、图象分析可知金刚石能量高于石墨,能量越高越活泼,所以石墨稳定,故A错误;
B、石墨和金刚石为碳元素的同素异形体,相互转化为化学变化,故B错误;
C、图象分析可知,石墨的能量低于金刚石,石墨变化为金刚石过程是吸热反应过程,故C错误;
D、金刚石和石墨燃烧生成二氧化碳气体的焓变,结合盖斯定律分析,石墨燃烧焓变△H1=-393.5kJ•mol-1,金刚石燃烧焓变△H2=-395.4kJ•mol-1,1mol石墨的总键能比1mol金刚石的总键能大1.9kJ,故D正确;
故选D.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查了化学反应能量变化,图象分析判断,焓变与键能大小的分析判断和计算应用,掌握基础是解题关键,题目难度中等. - 1年前
相关推荐
- 如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法正确的是( )
如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法正确的是( )

A.1mol石墨的总键能比1mol金刚石的总键能小1.9kJ
B.石墨和金刚石的转化是物理变化
C.金刚石的稳定性强于石墨
D.C(s、石墨)═C(s、金刚石)△H=+1.9kJ•mol-1 aquamarine131年前1
aquamarine131年前1 -
 卸下包袱 共回答了28个问题
卸下包袱 共回答了28个问题 |采纳率96.4%解题思路:先根据图写出对应的热化学方程式,接着根据盖斯定律写出石墨转变成金刚石的热化学方程式,最后根据物质的能量越低越稳定来解答.由图得:①C(S,石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
②C(S,金刚石)+O2(g)=CO2(g)△H=-395.4kJ•mol-1,
利用盖斯定律将①-②可得:C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,
A、由 C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,1 mol石墨的总键能比1 mol金刚石的总键能大1.9 kJ,故A错误;
B、石墨和金刚石是不同的两种物质,石墨转化为金刚石属于化学变化,故B错误;
C、由C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,金刚石能量大于石墨的总能量,物质的量能量越高越不稳定,则石墨比金刚石稳定,故C错误;
D、由 C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,该反应的焓变为正值,故D正确.
故选:D.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查热化学方程式的书写及应用,题目难度不大,注意同素异形体之间的转化是化学反应和物质的能量越低越稳定.1年前查看全部
- 如图所示,△H 1 =-393.5kJ•mol -1 ,△H 2 =-395.4kJ•mol -1 ,下列说法或表示式正
如图所示,△H 1 =-393.5kJ•mol -1 ,△H 2 =-395.4kJ•mol -1 ,下列说法或表示式正确的是( ) A.C(s、石墨)═C(s、金刚石)△H=+1.9 kJ•mol -1 B.石墨和金刚石的转化是物理变化 C.金刚石比石墨稳定 D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ 
 liuyu66331年前1
liuyu66331年前1 -
 腩人 共回答了17个问题
腩人 共回答了17个问题 |采纳率94.1%由图得:①C(S,石墨)+O 2 (g)=CO 2 (g)△H=-393.5kJ•mol -1
②C(S,金刚石)+O 2 (g)=CO 2 (g)△H=-395.4kJ•mol -1 ,
利用盖斯定律将①-②可得:C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol -1 ,则
A、因C(s、石墨)=C(s、金刚石)△H=+1.9kJ•mol -1 ,故A正确;
B、石墨转化为金刚石是发生的化学反应,属于化学变化,故B错误;
C、金刚石能量大于石墨的总能量,物质的量能量越大越不稳定,则石墨比金刚石稳定,故C错误;
D、依据热化学方程式 C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol -1 ,1 mol石墨的总键能比1 mol金刚石的总键能大于1.9 kJ,故D错误;
故选A.1年前查看全部
- 已知下列热化学方程式:①C(s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1②2CO(g)+O2(g)
已知下列热化学方程式:
①C(s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-566.0kJ•mol-1
③2H2(g)+O2(g)═2H2O(l)△H3=-571.6kJ•mol-1
通过计算(要有计算过程),写出1mol C与液态H2O反应生成CO和H2的热化学方程式______. cmlxq1年前1
cmlxq1年前1 -
 世上只有你520 共回答了18个问题
世上只有你520 共回答了18个问题 |采纳率83.3%解题思路:依据热化学方程式和盖斯定律计算得到,反应焓变与反应过程无关.已知下列热化学方程式:
①C(s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-566.0kJ•mol-1
③2H2(g)+O2(g)═2H2O(l)△H3=-571.6kJ•mol-1
依据盖斯定律①-[②/2]-[③/2]得到:C(S)+H2O(l )=CO (g)+H2(g)△H=+175.3 kJ•mol-1,
故答案为:C(S)+H2O(l )=CO (g)+H2(g)△H=+175.3 kJ•mol-1.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查热化学方程式书写和盖斯定律的计算应用,题目较简单.1年前查看全部
- 如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
 A. C(s、石墨)═C(s、金刚石)△H=+1.9 kJ•mol-1
A. C(s、石墨)═C(s、金刚石)△H=+1.9 kJ•mol-1
B. 石墨和金刚石的转化是物理变化
C. 金刚石比石墨稳定
D. 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ wookk1年前1
wookk1年前1 -
 hh风云一生 共回答了19个问题
hh风云一生 共回答了19个问题 |采纳率89.5%解题思路:先根据图写出对应的热化学方程式,然后根据盖斯定律写出石墨转变成金刚石的热化学方程式,根据物质的能量越低越稳定,拆化学键吸收能量,形成化学键放出热量来解答.由图得:①C(S,石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
②C(S,金刚石)+O2(g)=CO2(g)△H=-395.4kJ•mol-1,
利用盖斯定律将①-②可得:C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,则
A、因C(s、石墨)=C(s、金刚石)△H=+1.9kJ•mol-1,故A正确;
B、石墨转化为金刚石是发生的化学反应,属于化学变化,故B错误;
C、金刚石能量大于石墨的总能量,物质的量能量越大越不稳定,则石墨比金刚石稳定,故C错误;
D、依据热化学方程式 C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,1 mol石墨的总键能比1 mol金刚石的总键能大于1.9 kJ,故D错误;
故选A.点评:
本题考点: 化学能与热能的相互转化.
考点点评: 本题考查热化学方程式的书写及应用,题目难度不大,注意物质的稳定性与能量的关系.1年前查看全部
- 如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
 如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
A.C(s、石墨)═C(s、金刚石)△H=+1.9 kJ•mol-1
B.石墨和金刚石的转化是物理变化
C.金刚石比石墨稳定
D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ 三人行全是我师11年前1
三人行全是我师11年前1 -
 smone_111 共回答了17个问题
smone_111 共回答了17个问题 |采纳率94.1%解题思路:先根据图写出对应的热化学方程式,然后根据盖斯定律写出石墨转变成金刚石的热化学方程式,根据物质的能量越低越稳定,拆化学键吸收能量,形成化学键放出热量来解答.由图得:①C(S,石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
②C(S,金刚石)+O2(g)=CO2(g)△H=-395.4kJ•mol-1,
利用盖斯定律将①-②可得:C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,则
A、因C(s、石墨)=C(s、金刚石)△H=+1.9kJ•mol-1,故A正确;
B、石墨转化为金刚石是发生的化学反应,属于化学变化,故B错误;
C、金刚石能量大于石墨的总能量,物质的量能量越大越不稳定,则石墨比金刚石稳定,故C错误;
D、依据热化学方程式 C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,1 mol石墨的总键能比1 mol金刚石的总键能大于1.9 kJ,故D错误;
故选A.点评:
本题考点: 化学能与热能的相互转化.
考点点评: 本题考查热化学方程式的书写及应用,题目难度不大,注意物质的稳定性与能量的关系.1年前查看全部
- 已知C(s)+O2(g)=CO2(g),△H=-393.5kJ•mol-1,H2+[1/2]O2=H20(l),△H=-
已知C(s)+O2(g)=CO2(g),△H=-393.5kJ•mol-1,H2+[1/2]O2=H20(l),△H=-285.8kJ•mol-1.求得相同热量时碳与氢气质量比.
 三尺春冰1年前1
三尺春冰1年前1 -
 1983lc 共回答了19个问题
1983lc 共回答了19个问题 |采纳率78.9%解题思路:假设它们都是1g,则1gH2(g)放出的热量为[285.8/2]kJ;1gC(s)放出的热量为[393.5/12]kJ,利用物质的质量=[热量/1g该物质燃烧放出的热量]解答.假设它们都是1g,则1gH2(g)放出的热量为[285.8/2]kJ;1gC(s)放出的热量为[393.5/12]kJ,欲得到相同的热量,需分别燃烧固体碳和氢气的质量比约利用物质的质量=[Q
393.5
12
Q
285.8/2]=[285.8×12/393.5×2]≈4.36:1,
答:得相同热量时碳与氢气质量比为4.36:1.点评:
本题考点: 有关反应热的计算.
考点点评: 本题主要考查了反应中热量的计算,题目难度不大,注意物质的量与热量成正比是解题的关键.1年前查看全部
- 如图所示,△H 1 =-393.5kJ•mol -1 △H 2 =-395.4kJ•mol -1 ,下列说法或表示式正确
如图所示,△H 1 =-393.5kJ•mol -1 △H 2 =-395.4kJ•mol -1 ,下列说法或表示式正确的是( ) A.C(s、石墨)=C(s、金刚石)△H=+1.9kJ•mol -1 B.石墨的能量比金刚石高 C.金刚石的稳定性强于石墨 D.金刚石燃烧的热化学方程式为:C(s、金刚石)+O 2 (g)=CO 2 (g)△H=395.4kJ•mol -1 
 lingyun31881年前1
lingyun31881年前1 -
 遥望故乡的云 共回答了21个问题
遥望故乡的云 共回答了21个问题 |采纳率95.2%由图得:①C(S,石墨)+O 2 (g)=CO 2 (g)△H=-393.5kJ•mol -1
②C(S,金刚石)+O 2 (g)=CO 2 (g)△H=-395.4kJ•mol -1 ,
利用盖斯定律将①-②可得:C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol -1 ,则
A、因C(s、石墨)=C(s、金刚石)△H=+1.9kJ•mol -1 ,故A正确;
B、石墨转化为金刚石吸热,金刚石能量大于石墨的总能量,故B错误;
C、金刚石能量大于石墨的总能量,物质的量能量越大越不稳定,则石墨比金刚石稳定,故C错误;
D、由图可知金刚石燃烧的热化学方程式为:C(S,金刚石)+O 2 (g)=CO 2 (g)△H=-395.4kJ•mol -1 ,故D错误;
故选:A.1年前查看全部
- 如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
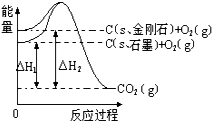 如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
A.石墨和金刚石的转化是物理变化
B.金刚石的稳定性强于石墨
C.1 mol石墨的总键能比1 mol金刚石的总键能大 1.9 kJ
D.C(s,石墨)=C(s,金刚石),该反应的焓变(△H)为正值 lzhihui1年前1
lzhihui1年前1 -
 娃哈哈b135 共回答了15个问题
娃哈哈b135 共回答了15个问题 |采纳率93.3%解题思路:先根据图写出对应的热化学方程式,接着根据盖斯定律写出石墨转变成金刚石的热化学方程式,最后根据物质的能量越低越稳定来解答.由图得:①C(S,石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
②C(S,金刚石)+O2(g)=CO2(g)△H=-395.4kJ•mol-1,
利用盖斯定律将①-②可得:C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,
A、石墨和金刚石是不同的两种物质,石墨转化为金刚石属于化学变化,故A错误;
B、由C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,金刚石能量大于石墨的总能量,物质的量能量越高越不稳定,则石墨比金刚石稳定,故B错误;
C、由 C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,1 mol石墨的总键能比1 mol金刚石的总键能大于1.9 kJ,故C正确;
D、由 C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,该反应的焓变为正值,故D正确.
故选:CD.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查热化学方程式的书写及应用,题目难度不大,注意同素异形体之间的转化是化学反应和物质的能量越低越稳定.1年前查看全部
- 如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )

A.C(s、石墨)=C(s、金刚石)△H=+1.9kJ•mol-1
B.石墨和金刚石的转化是物理变化
C.金刚石的稳定性强于石墨
D.石墨的稳定性强于金刚石 xiaonuan831年前1
xiaonuan831年前1 -
 沧海一粟5599 共回答了17个问题
沧海一粟5599 共回答了17个问题 |采纳率82.4%解题思路:先根据图写出对应的热化学方程式,然后根据盖斯定律写出石墨转变成金刚石的热化学方程式,根据物质的能量越低越稳定,拆化学键吸收能量,形成化学键放出热量来解答.由图得:①C(S,石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
②C(S,金刚石)+O2(g)=CO2(g)△H=-395.4kJ•mol-1,
利用盖斯定律将①-②可得:C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,则
A、因C(s、石墨)=C(s、金刚石)△H=+1.9kJ•mol-1,故A正确;
B、石墨转化为金刚石是发生的化学反应,属于化学变化,故B错误;
C、金刚石能量大于石墨的总能量,物质的能量越高越不稳定,则石墨比金刚石稳定,故C错误;
D、金刚石能量大于石墨的总能量,物质的能量越低越稳定,则石墨比金刚石稳定,故D正确;
故选:AD.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查热利用盖斯定律书写热化学方程式、物质的能量越低越稳定,题目难度不大,注意物质的稳定性与能量的关系.1年前查看全部
- 25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ•mol-1、285.8kJ•mol-1、89
25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ•mol-1、285.8kJ•mol-1、890.3kJ•mol-1、2 800kJ•mol-1,则下列热化学方程式正确的是( )
A.C(s)+[1/2]O2(g)═CO(g);△H=-393.5 kJ•mol-1
B.2H2(g)+O2(g)═2H2O(g);△H=+571.6 kJ•mol-1
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-890.3 kJ•mol-1
D.[1/2]C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l);△H=-1 400 kJ•mol-1 zdf77551年前1
zdf77551年前1 -
 草鞋跟 共回答了23个问题
草鞋跟 共回答了23个问题 |采纳率95.7%解题思路:燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,根据燃烧热的定义判断热化学方程式是否正确.A、C完全燃烧应生成CO2,生成CO,反应热小于393.5kJ/mol,故A错误;
B、H2完全燃烧生成的稳定的氧化物为液态水,故B错误;
C、CH4完全燃烧生成稳定的氧化物为CO2和液态水,故C错误;
D、1mol葡萄糖完全燃烧生成CO2和H2O(l),燃烧热为2800kJ/mol,则[1/2]mol葡萄糖完全燃烧放出1400kJ热量,故D正确;
故选D.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查热化学方程式,题目难度不大,本题注意把握燃烧热的概念,特别是水,稳定状态为液态.1年前查看全部
- 已知下列热化学方程式:(1)C(s,石墨)+O 2 (g)═CO 2 (g)△H=-393.5kJ•mol -1 (2)
已知下列热化学方程式:
(1)C(s,石墨)+O 2 (g)═CO 2 (g)△H=-393.5kJ•mol -1
(2)2H 2 (g)+O 2 (g)═2H 2 O(l)△H=-571.6kJ•mol -1
(3)2C 2 H 2 (g)+5O 2 (g)═4CO 2 (g)+2H 2 O(l)△H=-2599kJ•mol -1
请写出C(s,石墨)和H 2 (g)生成1mol C 2 H 2 (g)的热化学方程式______. 自己的梦1年前1
自己的梦1年前1 -
 灌一水饱 共回答了32个问题
灌一水饱 共回答了32个问题 |采纳率68.8%(1)C(s,石墨)+O 2 (g)═CO 2 (g)△H=-393.5kJ•mol -1
(2)2H 2 (g)+O 2 (g)═2H 2 O(l)△H=-571.6 kJ•mol -1
(3)2C 2 H 2 (g)+5O 2 (g)═4CO 2 (g)+2H 2 O(l)△H=-2599kJ•mol -1
利用盖斯定律将(1)-
(2)
2 -
(3)
2 可得:
2C(s,石墨)+H 2 (g)=C 2 H 2 (g)△H=(-393.5kJ/mol)-2×(-571.6kJ/mol)-(-2599 kJ/mol)=+226.7kJ•mol -1 ,
所以热化学反应方程式为:2C(s,石墨)+H 2 (g)=C 2 H 2 (g);△H=+226.7kJ•mol -1
故答案为:2C(s,石墨)+H 2 (g)=C 2 H 2 (g);△H=+226.7kJ•mol -1 .1年前查看全部
- 如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
 如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
A.C(s、石墨)═C(s、金刚石),该反应的焓变为负值
B.石墨的稳定性弱于金刚石
C.石墨和金刚石的转化是物理变化
D.1 mol石墨的总键能比1 mol金刚石的总键能大1.9 kJ camelsea1年前1
camelsea1年前1 -
 hncyq 共回答了20个问题
hncyq 共回答了20个问题 |采纳率95%解题思路:先根据图写出对应的热化学方程式,接着根据盖斯定律写出石墨转变成金刚石的热化学方程式,最后根据物质的能量越低越稳定来解答.由图得:①C(S,石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
②C(S,金刚石)+O2(g)=CO2(g)△H=-395.4kJ•mol-1,
A、利用盖斯定律将①-②可得:C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,故A错误;
B、由C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,金刚石能量大于石墨的总能量,物质的量能量越大越不稳定,则石墨比金刚石稳定,故B错误;
C、石墨和金刚石是不同的两种物质,石墨转化为金刚石属于化学变化,故C错误;
D、由 C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,1 mol石墨的总键能比1 mol金刚石的总键能大于1.9 kJ,故D正确;
故选:D.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查热化学方程式的书写及应用,题目难度不大,注意物质的能量越低越稳定.1年前查看全部
- 如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法不正确的是( )
 如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法不正确的是( )
如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法不正确的是( )
A.C(s、金刚石)C═(s、石墨)△H=-1.9 kJ•mol-1
B.石墨和金刚石的转化是化学变化
C.1mol金刚石完全燃烧放出的能量比1mol石墨完全燃烧放出的能量多
D.金刚石的稳定性强于石墨 爱跳树坑的筒子1年前1
爱跳树坑的筒子1年前1 -
 vv浮影 共回答了17个问题
vv浮影 共回答了17个问题 |采纳率88.2%解题思路:先根据图写出对应的热化学方程式,然后根据盖斯定律写出石墨转变成金刚石的热化学方程式,根据物质的能量越低越稳定,拆化学键吸收能量,形成化学键放出热量来解答.由图得:①C(S,石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
②C(S,金刚石)+O2(g)=CO2(g)△H=-395.4kJ•mol-1,
利用盖斯定律将①-②可得:C(S,金刚石)=C(S,石墨)△H=-1.9kJ•mol-1,则
A、因C(s、金刚石)=C(s、石墨)△H=-1.9kJ•mol-1,故A正确;
B、石墨转化为金刚石是发生的化学反应,属于化学变化,故B正确;
C、据反应①②的热化学方程式可知,1mol金刚石燃烧比1mol石墨燃烧放热多1.9KJ,故C正确;
D、金刚石能量大于石墨的总能量,物质的量能量越大越不稳定,则石墨比金刚石稳定,故D错误.
故选:D.点评:
本题考点: 反应热和焓变.
考点点评: 本题通过图象考查了金刚石和石墨能量高低与稳定性及键能的关系,题目难度不大,注意物质的稳定性与能量的关系.1年前查看全部
- 如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
 A. C(s、石墨)═C(s、金刚石)△H=+1.9 kJ•mol-1
A. C(s、石墨)═C(s、金刚石)△H=+1.9 kJ•mol-1
B. 石墨和金刚石的转化是物理变化
C. 金刚石比石墨稳定
D. 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ yhh5005201年前1
yhh5005201年前1 -
 感冒的鱼520 共回答了26个问题
感冒的鱼520 共回答了26个问题 |采纳率96.2%解题思路:先根据图写出对应的热化学方程式,然后根据盖斯定律写出石墨转变成金刚石的热化学方程式,根据物质的能量越低越稳定,拆化学键吸收能量,形成化学键放出热量来解答.由图得:①C(S,石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
②C(S,金刚石)+O2(g)=CO2(g)△H=-395.4kJ•mol-1,
利用盖斯定律将①-②可得:C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,则
A、因C(s、石墨)=C(s、金刚石)△H=+1.9kJ•mol-1,故A正确;
B、石墨转化为金刚石是发生的化学反应,属于化学变化,故B错误;
C、金刚石能量大于石墨的总能量,物质的量能量越大越不稳定,则石墨比金刚石稳定,故C错误;
D、依据热化学方程式 C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,1 mol石墨的总键能比1 mol金刚石的总键能大于1.9 kJ,故D错误;
故选A.点评:
本题考点: 化学能与热能的相互转化.
考点点评: 本题考查热化学方程式的书写及应用,题目难度不大,注意物质的稳定性与能量的关系.1年前查看全部
大家在问
- 1谢谢你的上封来信 _____ _____ _____ your last letter
- 2填表比较 磁现象 发现者 条件 结果 能量转化 (1)电流磁效应 (2)电磁感应 (3)磁场对电流的作用
- 3化学实验中仪器短进长出和长进短出都指的什么啊
- 4氢氧化钠加硫酸铜加双氧水.这是 氧化铜?
- 5正电荷和负电荷之间有什么区别?请通俗一点,最好有列子
- 6the greatest show on earth
- 7小学一年级暑假手抄报重要的是内容啊!谢谢
- 8月亮上的足迹有什么含义
- 9这张图怎么看.
- 10学校买回1000本新图书,准备把其中的五分之二借给高年级同学,剩下的书按3:2借给中年级、低年级同学?
- 11起重机用恒力F把质量为1t的货物以2m/s的速度匀速提升了4m,则在这一过程中
- 12方程X²+Y²=5m表示圆的前提条件除了5m>0外,需不需要m∈R?
- 13可口可乐是一种世界闻名的饮料,起源於一八八六年美国佐治亚州亚特兰大城一家药品店.店裏的药剂师约翰?彭伯敦,自制一种有提神
- 14给下面的句子选择恰当的关联词。
- 15It can keep our body ( )[good/unhealthy/active/beautiful]
