镁铝合金5.1g溶于过量的盐酸中,完全反应后在标准状况下放出气体5.6L,该合金一共失电子0.5mol的原因
 faguangti2022-10-04 11:39:542条回答
faguangti2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 zonlin 共回答了17个问题
zonlin 共回答了17个问题 |采纳率94.1%- 生成n(H2)=5.6/22.4=0.25mol那么可知该合金一共失电子0.5mol,那么该合金一共得到氢氧根0.5mol.
- 1年前
 西佬 共回答了4个问题
西佬 共回答了4个问题 |采纳率- n(H2)=5.6/22.4=0.25mol生成1mol H2金属失去2mol电子所以金属共失去电子 = 0.25*2=0.5mol
- 1年前
相关推荐
- 称取2.1g镁铝合金投入100ml 2mol/l的盐酸中,恰好完全反对.问,能得到标准状况下的气体多少毫升?合金总镁
 Echo宝贝1年前2
Echo宝贝1年前2 -
 hongych 共回答了17个问题
hongych 共回答了17个问题 |采纳率88.2%设与镁反应的盐酸物质的量为x,则与铝反应的盐酸的物质的量为0.1L*2mol/L--x =(0.2-x)mol
Mg + 2HCl = MgCl2 + H2
1mol 2mol 1mol
x/2 x x/2
2Al + 6HCl = 2AlCl3 +3H2
2mol 6mol 3mol
(0.2-x)/3 0.2-x 0.2-x/2
x/2*24+(0.2-x)/3*27=2.1g x=0.1mol 则生成气体物质的量:x/2+(0.2-x)/2=0.1mol
气体体积:0.1mol*22.4L/mol=2.24L1年前查看全部
- 有一块镁铝合金21g与足量盐酸反应共成氢气22.4L(标准状况).求合金中镁铝的物质的量之比?计算详解 谢
 gongtaogt1年前1
gongtaogt1年前1 -
 guosheng234 共回答了16个问题
guosheng234 共回答了16个问题 |采纳率75%这个题目也简单
设Mg为Xmol,Ymol为Al .XmolMg产生XmolH2,YmolAl产生1.5YmolH2,所以24X+27Y=21
X+1.5Y=1 解方程,X=0.5mol,Y=1/3mol 所以物质的量之比为3比21年前查看全部
- 在标准状况下进行甲、乙、丙三组实验,三组各取30 mL同浓度的盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如
在标准状况下进行甲、乙、丙三组实验,三组各取30 mL同浓度的盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
实验序号 甲 乙 丙
合金质量(mg) 255 385 459
生成气体体积(mL) 280 336 336
(1)甲组实验中,盐酸____(填“过量”“适量”或“不足量”),理由是____ .乙组实验中,盐酸____(填“过量”“适量”或“不足量”),理由是 ____ .要算出盐酸的物质的量浓度,题中可作计算依据的数据是____,求得的盐酸的物质的量浓度为____
(2)求合金中Mg、Al的物质的量之比,题中可作计算依据的数据是 ____ ,求得的Mg、Al的物质的量之比为 ____ bey0o0nd1年前1
bey0o0nd1年前1 -
 栗子印记 共回答了16个问题
栗子印记 共回答了16个问题 |采纳率87.5%甲加了255,放出280
乙呢,可以看成在甲的基础上又加入了金属,结果生成气体多了,
也就是说,甲反应完了,如果再加金属,还会有气体生成.
这就说明甲中有盐酸剩余,要不然加入金属是不会生成气体的.
乙加了385,放了336,
丙加的金属比乙多,可是气体一样,这就说明,如果再向乙中加金属,也不会有气体生成,所以乙中的盐酸一定没有了,否则加入金属怎么没气体.
以上是第1问前4个空(理由最好自己写,我只是写思考过程)
要求盐酸浓度,首先要选盐酸完全反应的那组,要不然,选的那组盐酸还没反应完,怎么算一共有多少盐酸.
所以要选盐酸反应完了的那组,就是乙组.
有生成的气体的体积,可以求出物质的量 ,根据方程式,1mol氢气要2mol盐酸,所以氢气的物质的量乘以2就是反应了的盐酸的物质的量,因为乙组完全反应,所以反应了的就是总的.再用物质的量除以体积就是浓度.
(2)要求金属的量的比,应该选金属完全反应的那组,就是甲组.
设甲组中镁为xmol,铝为ymol,
列方程组,合金的质量为255,据此列一个方程.
生成气体的体积知道了,可以求出物质的量,
镁可以生成2xmol气体,铝可以生成1.5ymol气体,
再列方程2x+1.5y=气体的物质的量
将两个方程组联立,求出x,y,就是镁铝的物质的量.1年前查看全部
- 1.在标准状况下进行下列实验:甲、乙、丙各取300mL同浓度的盐酸,加入不同质量的同一镁铝合金粉末,有关数据如下:
1.在标准状况下进行下列实验:甲、乙、丙各取300mL同浓度的盐酸,加入不同质量的同一镁铝合金粉末,有关数据如下:
实验序号 甲 乙 丙
合金质量mg 510 765 918
气体体积mL 560 672 672
问:(1)盐酸的物质的量浓度是多少?
(2)求合金中镁铝的质量分数各是多少?
2.将足量的金属钠投入到100gt℃的水中,恰好得到t℃的138.5gNaOH的饱和溶液,则t℃时NaOH的溶解度是多少? 张瀛-0071年前1
张瀛-0071年前1 -
 sirène 共回答了19个问题
sirène 共回答了19个问题 |采纳率94.7%由乙丙反应情况知
盐酸反应完全产生氢气为672ml ,换算为物质量为0.672/22.4=0.03mol H2
则原来盐酸HCl物质量为0.03*2=0.06mol
盐酸的物质的量浓度0.06/0.3=0.2 mol/L
由甲反应情况知,镁铝合金已反应完全
生成H2量为0.56/22.4=0.025mol 质量为0.025*2=0.05g
Mg+2HCl=H2+MgCl2
24x 2x
2Al+6HCl=3H2+2AlCl3
54y 6y
24x+54y=0.51
2x+6y=0.05
解得 x=0.01 y=0.005
Mg质量为24x=0.24g 质量分数0.24/0.51=47.059%
Al质量为54y=0.27g 质量分数0.27/0.51=52.941%
设t℃时该溶液中NaOH的质量为 X g
2Na+2H2O=H2+2NaOH
X/40 X/40
参加反应的水的质量为 X/4*18=4.5X g
反应后水的质量为 (100-4.5X)g
则有 X+(100-4.5X)=138.5 g
解得 X=11 g
水的质量 100-4.5X=50.5 g
t℃时NaOH的溶解度 11/50.5*100=21.782 g1年前查看全部
- 在标准状况下进行甲乙丙三组实验在标准状况下进行甲、乙、丙3组实验:各取30mL同浓度的盐酸溶液加入不同质量的同一镁铝合金
在标准状况下进行甲乙丙三组实验
在标准状况下进行甲、乙、丙3组实验:各取30mL同浓度的盐酸溶液加入不同质量的同一镁铝合金粉末,产生气体,将实验数据记录如下:
实验序号
甲
乙
丙
合金质量/g
甲 0.255
乙0.385
丙 0.459
生成气体体积/mL
甲280
乙336
丙336
回答:
(1)甲组实验中,盐酸( ) ,理由是________________________;乙组实验中,盐酸 ( ),理由是___________________________ .(均填“过量”、“适量”、“不足量”).
(2)、要推导出盐酸的物质的量浓度,所提供的数据中作计算依据的是 ( ) ,计算出盐酸的物质的量浓度为( ) .
(3)要求出合金中镁铝的物质的量之比,所提供的数据中做计算依据的是( ) ,镁和铝的物质的量之比为 ( ). lj_eve1年前1
lj_eve1年前1 -
 梅尧木 共回答了23个问题
梅尧木 共回答了23个问题 |采纳率91.3%首先,可以看到乙和丙生成一样体积的气体,因此可以断定,丙组实验中的固体量有多,丙的酸绝对不足,而乙的酸刚好适量,因此也可以推到出甲的酸过量;
由于乙的酸量刚好,因此要推算出盐酸物质的量浓度,就必须根据乙组产生的气体量来算.将产生的336mL气体换算成标准状况下下氢气的物质的量为0.015mol,就可以得出盐酸的量浓度为:1mol/L;
同样根据乙组产生的气体量来算,由于1mol镁产生1mol氢气,1mol铝产生1.5mol氢气,因此,设镁有x mol,铝有y mol,则有 x+1.5 y = 0.015,求出x比y,即为镁铝的物质的量之比.1年前查看全部
- 镁铝合金门7.8克,投入到足量的稀硫酸溶液中,收集到0.8克的氢气,合金中镁铝的质量比?3Q
 摸到伤口想起你1年前1
摸到伤口想起你1年前1 -
 lhliyong 共回答了13个问题
lhliyong 共回答了13个问题 |采纳率92.3%镁:2.4克,铝:5.4克 镁:铝==12:271年前查看全部
- 取7.8 g镁铝合金样品,投入到足量的稀硫酸溶液中,共收集得到氢气0.8如何解
取7.8 g镁铝合金样品,投入到足量的稀硫酸溶液中,共收集得到氢气0.8如何解
问合金中镁和铝的比例 清秋诗社1年前2
清秋诗社1年前2 -
 竹性清凉 共回答了23个问题
竹性清凉 共回答了23个问题 |采纳率91.3%2Al--3H2
54 6
7.8g x
x=13/15g
Mg--H2
24 2
7.8g y
y=13/20g
Al:13/15 3/20 45 9
0.8
Mg:13/20 1/15 20 4
所以Al质量=7.8g*9/13=5.4g
所以Mg质量=7.8g*4/13=2.4g
【解答完毕】1年前查看全部
- 为测定某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100 mL 0.3 mol•L-1稀硫酸
为测定某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100 mL 0.3 mol•L-1稀硫酸,
01,我想知道元素守恒的解法
题目没打完:为测定某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100 mL 0.3 mol•L-1稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560 mL;再加入0.2 mol•L-1 NaOH溶液至沉淀质量恰好不再变化,用去350 mL NaOH溶液。则所取样品中铝的物质的量为 金华婺剧网1年前1
金华婺剧网1年前1 -
 zhuimengxinghun 共回答了15个问题
zhuimengxinghun 共回答了15个问题 |采纳率86.7%其实这道题只需要求Al的量,并不需要用到生成氢气的体积这一条件.
加硫酸将合金全部溶解,故金属都变为相应的硫酸盐,硫酸被还原生成氢气.Al~1.5 H2,Mg~H2.这里没有提到“恰好完全溶解”,因此硫酸可能过量.
加入氢氧化钠,一方面NaOH与可能多余的硫酸反应,一方面与金属离子反应.这里很巧妙的一点是,若想象氢氧化钠使得所有金属生成对应的氢氧化物沉淀,同时中和多余的硫酸,这时氢氧化钠与硫酸的量是相当的(这里的相当是氢离子、氢氧根离子数相同,二者物质的量比是2:1).
进一步,实际上生成的Al(OH)3会与氢氧化钠进一步反应,Al(OH)3+OH-=AlO2 - +2H2O.正因为这一步反应,使得“沉淀质量恰好不再变化”时,氢氧化钠用量超过了硫酸用量的2倍.根据上述方程,可知多出的氢氧化钠与氢氧化铝按1:1进行反应.
经过分析,求Al的物质的量,思路很明确了.设其物质的量为a.
算得氢氧根离子(来自氢氧化钠)比氢离子(来自硫酸)多出的物质的量,多出的量全部用来和Al(OH)3反应.
有守恒,Al~Al(OH)3~AlO2 OH-(超出量).
因此,OH-超出H+的物质的量等于Al的物质的量
a=0.35L*(0.2 mol•L-1)*1 - 01L*( 0.3 mol•L-1)*2=0.01 mol
上式中,减号后面一项,最后乘以2代表一个硫酸含有两个氢离子1年前查看全部
- 镁铝合金放入氢氧化钠溶液中,形成的原电池负极是什么
镁铝合金放入氢氧化钠溶液中,形成的原电池负极是什么
原电池形成的条件之一是有活性不同的金属或金属与非金属作两极,其中活泼金属作负极,被消耗.但镁铝合金放入氢氧化钠溶液中铝与氢氧化钠反应,镁活泼性比铝强,究竟那种金属作负极 huang1983yi1年前3
huang1983yi1年前3 -
 网易直播 共回答了25个问题
网易直播 共回答了25个问题 |采纳率96%形成原电池的条件中有一条是要求电极中的至少一级能和电解质溶液发生反应,在这里,铝与氢氧化钠反应,而镁不与氢氧化钠反应,所以要用铝作为负极.
考虑这样的问题的时候,不能简单的根据金属性来进行判断,对于一些有特殊性质的金属(比如两性金属)出现的地方要特别留心1年前查看全部
- 镁铝合金5.1g与足量盐酸反应,生成0.5g氢气,计算合金的质量组成?
 Google测试员13751年前1
Google测试员13751年前1 -
 广州一梦醒 共回答了15个问题
广州一梦醒 共回答了15个问题 |采纳率86.7%设Mg Xmol Al Y mol
则:24X+27Y=5.1
X+3Y/2=0.5/2
X=0.1 mol
Y=0.15 mol
Mg的质量分数:0.1*24/5.1=47%
AL的质量分数:1-0.47=53%1年前查看全部
- 为测定某镁铝合金样品 为测定某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100 mL 0.3 mol·L
为测定某镁铝合金样品
为测定某镁铝合金样品中铝的含量,进行了下列实验:
取一定量合金,加入100 mL 0.3 mol·L -1 稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560 mL;再加入0.2 mol·L -1 NaOH溶液至沉淀质量恰好不再变化,用去350 mL NaOH溶液.则所取样品中铝的物质的量为[ ] A.0.005 mol
B.0.01 mol
C.0.025 mol
D.0.03 mol xiaxuhui1年前1
xiaxuhui1年前1 -
 巴巴闭查笃撑 共回答了17个问题
巴巴闭查笃撑 共回答了17个问题 |采纳率70.6%B1年前查看全部
- 镁铝合金共7.8克,与足量盐酸反应,放出H2在标况下体积为8.96L,求合金中镁、铝的物质的量之比
 yanjinqiao1年前1
yanjinqiao1年前1 -
 shijietongyi 共回答了20个问题
shijietongyi 共回答了20个问题 |采纳率95%设7.8克中镁得物质的量为x mol,铝的为y mol.
由题可列方程组24x+27y=7.8 (1)
x+1.5y=0.8/2 (2)
(1molMg产生1molH2,1molAl产生1.5molH2,故有(2)式)
解得x=0.1 y=0.2
合金中镁、铝的物质的量之比1:21年前查看全部
- 3.9g镁铝合金与盐酸反映,当加到100ml时,合金恰好溶解,标准状况下收集气体4.48ml,求镁铝合金质量
3.9g镁铝合金与盐酸反映,当加到100ml时,合金恰好溶解,标准状况下收集气体4.48ml,求镁铝合金质量
过程 mongney1年前1
mongney1年前1 -
 提灯上街 共回答了16个问题
提灯上街 共回答了16个问题 |采纳率87.5%设镁X摩,铝Y摩
24X+27Y=3.9 (金属质量)
X+3/2Y=4.48/22.4 (H2)
答案自己求吧1年前查看全部
- 将3.9克镁铝合金跟某浓度盐酸反应,当加到100ml时,合金恰好溶解,并收集到标准状况下的气体4.48ml.
将3.9克镁铝合金跟某浓度盐酸反应,当加到100ml时,合金恰好溶解,并收集到标准状况下的气体4.48ml.
求:(1)合金中镁、铝的质量.
(2)该盐酸的物质的量的浓度.
(3)像上述反应后的溶液中应加多少毫升5mol/L的NaOH溶液后,才能得到纯净的Mg(OH)2沉淀. 对着电视搓麻将1年前2
对着电视搓麻将1年前2 -
 深圳小喇叭 共回答了14个问题
深圳小喇叭 共回答了14个问题 |采纳率92.9%1.设镁有x摩尔铝有y摩尔
24x+27y=3.9--------质量和
x+3/2y=(4.48*10^-3)/22.4-----------产生氢气物质的量
解得x=0.05y=0.1; 即铝2.7克镁1.2克.
2.氢气由盐酸恰好完全反应而得到,氢气有(4.48*10^-3)/22.4=0.0002摩尔,所以氯化氢有0.0001摩尔,所以盐酸浓度为0.0001/0.1=0.001mol/L
3.要生成纯净Mg(OH)2沉淀,必须使氢氧化钠过量,将氢氧化铝转变成偏铝酸根,铝与氢氧化钠比例是1:4(看化学方程式就知道了),而镁的比例是1:2,所以要氢氧化钠为0.05*4+0.1*2=0.4mol.所以应加(0.4/5)*1000=80毫升.1年前查看全部
- 2.1g镁铝合金完全溶于足量盐酸,生成氢气2.24L(标准状况下),再向溶液中加入氢氧化钠溶液,生成沉淀的质量最大是(
2.1g镁铝合金完全溶于足量盐酸,生成氢气2.24L(标准状况下),再向溶液中加入氢氧化钠溶液,生成沉淀的质量最大是( )
A. 2.9g
B. 4.6g
C. 5.5g
D. 6.9g imzjk1年前1
imzjk1年前1 -
 西柚的秋 共回答了15个问题
西柚的秋 共回答了15个问题 |采纳率86.7%解题思路:2.1g镁铝合金完全溶于足量盐酸,生成氢气2.24L(标准状况下),物质的量为0.1mol,所以得到的氯化镁、氯化铝中的氯离子共为0.2mol,镁离子、铝离子全部转变成沉淀时,相当于氯离子全部被OH-代替,所以析出的沉淀中OH-的物质的量为0.2mol,沉淀质量等于金属质量加氢氧根的质量.2.1g镁铝合金完全溶于足量盐酸,生成氢气2.24L(标准状况下),氢气的物质的量为[2.24L/22.4L/mol]=0.1mol,得到的氯化镁、氯化铝中的氯离子共为0.1mol×2=0.2mol,镁离子、铝离子全部转变成沉淀时,相当于氯离子全部被OH-代替,所以析出的沉淀中OH-的物质的量为0.2mol,所以得到的沉淀质量为2.1g+0.2mol×17g/mol=5.5g.
故选:C.点评:
本题考点: 镁、铝的重要化合物;化学方程式的有关计算.
考点点评: 考查镁铝化合物性质、混合物的计算,清楚反应过程、判断沉淀中氢氧根的物质的量是解题关键.1年前查看全部
- 镁铝合金M克和足量的盐酸反应生成氢气0.1克,则M为几克?
镁铝合金M克和足量的盐酸反应生成氢气0.1克,则M为几克?
镁铝合金M克和足量的盐酸反应生成氢气0.1克,则M为几克?A.0.8B.1C.1.5D无法确定 wjf1161年前2
wjf1161年前2 -
 qiqi772 共回答了25个问题
qiqi772 共回答了25个问题 |采纳率84%选B
范围是0.91年前查看全部
- 现有镁铝合金共7mol溶于足量的盐酸中,生成的氢气在标准状况下体积为179.2l,则合金
 博睬众长1年前1
博睬众长1年前1 -
 冰心之猫 共回答了12个问题
冰心之猫 共回答了12个问题 |采纳率100%设镁铝合金中铝为xmol
根据反应式2AL+6HCL=3H2+2ALCL3
Mg+2HCL=H2+MgCL2
知2mol铝反应产生3mol氢气
2mol铝反应产生3mol氢气
所以
3/2*x+(7-x)=8
x/2=1
x=2mol
镁铝合金中镁为7-2=5mol1年前查看全部
- 将6.3g镁铝合金(不含其他杂质)放入过量的氢氧化钠溶液中,充分反应放出H2 3.36L(标准状况)求:(1)要完全溶解
将6.3g镁铝合金(不含其他杂质)放入过量的氢氧化钠溶液中,充分反应放出H2 3.36L(标准状况)求:(1)要完全溶解相同质量的镁铝合金需1mol/L的稀盐酸的体积,同时产生气体的体积
再具体点可以吗 yyykaokao1年前1
yyykaokao1年前1 -
 pengs1985 共回答了21个问题
pengs1985 共回答了21个问题 |采纳率95.2%2Al+2NaOH+2H2O=2NaAlO2+3H2
2 3
X 0.15 X=0.1 原合金中有2.7gAl 3.6gMg
Mg---2HCl---H2 2 Al-----6HCl-----3H2
1 2 2 6
0.15 X 0.1 Y X+Y=0.6 盐酸体积为0.6L 同样可以算出H2体积1年前查看全部
- 取一定量的镁铝合金,用足量的盐酸溶解后,再加入过量的NaOH溶液,然后滤出沉淀物,火匀烧,最后得白色粉末,干燥后称量,这
取一定量的镁铝合金,用足量的盐酸溶解后,再加入过量的NaOH溶液,然后滤出沉淀物,火匀烧,最后得白色粉末,干燥后称量,这些粉末与原合金质量相同,则合金中铝的质量分数为?
AlCl3也可以和烧碱反映啊?怎么? sym48841年前1
sym48841年前1 -
 悬林木 共回答了20个问题
悬林木 共回答了20个问题 |采纳率75%多步反应计算的典型方法——画流程图,找关系式
Mg,Al———Mg2+,Al3+———Mg(OH)2(沉淀),AlO2-
加热Mg(OH)2生成MgO,氧化镁的质量和原混合物质量相等,因为Mg无损失,故MgO中O的质量分数就是原混合物中Al的质量分数,答案应该是40%
另:楼主题目中的加热步骤是“灼烧” 念作“zhuo(二声) shao”1年前查看全部
- 取一种镁铝合金10g,用足量稀盐酸溶解后
 252512421年前1
252512421年前1 -
 南北ww 共回答了17个问题
南北ww 共回答了17个问题 |采纳率88.2%会产生氢气,根据氢气量不同能大概算出该合金中镁铝比,嗯.1年前查看全部
- 将一块3.9克的镁铝合金溶于200毫升的稀硫酸中恰好完全反应,共放出4.48升气体.(1)求铝的质量分数
将一块3.9克的镁铝合金溶于200毫升的稀硫酸中恰好完全反应,共放出4.48升气体.(1)求铝的质量分数
(2)求稀硫酸的物质的量浓度 lixuyan59001年前1
lixuyan59001年前1 -
 sourgrapes 共回答了16个问题
sourgrapes 共回答了16个问题 |采纳率93.8%写出反应方程式后可得以下数量关系:1mol氢气—2/3mol铝—1mol镁,4.48升算出来是0.5mol氢气,可以设铝的物质的量为x,则镁的物质的量为(3.9-27x)/24,可以解出x的值,质量分数也就好算了
第二步反而简单些,直接用氢气的物质的量除以体积,因为1mol氢气对应1mol硫酸1年前查看全部
- 为什么镁不和KOH反应生成氢气 而铝和KOH反应生成氢气呢?而且6MOL/L KOH溶液和镁铝合金粉末反应
为什么镁不和KOH反应生成氢气 而铝和KOH反应生成氢气呢?而且6MOL/L KOH溶液和镁铝合金粉末反应
(继续上面)放出氢气为什么没有2MOL/L H2SO4多呢 miee501年前2
miee501年前2 -
 无言20060330 共回答了21个问题
无言20060330 共回答了21个问题 |采纳率95.2%镁的金属性比铝强,金属一般是和酸反应放出氢气.常见的金属中只有铝和碱溶液反应.与6mol/LKOH反应的也是合金粉中的铝1年前查看全部
- 镁铝合金5.1g,与100ml稀盐酸正好完全反应,生成标准状况下的H2 5.6L,求合金中镁铝的质量及盐酸的物质的
镁铝合金5.1g,与100ml稀盐酸正好完全反应,生成标准状况下的H2 5.6L,求合金中镁铝的质量及盐酸的物质的
镁铝合金5.1g,与100ml稀盐酸正好完全反应,生成标准状况下的H2 5.6L,求合金中镁铝的质量及盐酸的物质的量的浓度 fantasy蓝1年前2
fantasy蓝1年前2 -
 limi30 共回答了16个问题
limi30 共回答了16个问题 |采纳率87.5%n(H2)=5.6L/22.4Lmol-1=0.25mol
Mg+2HCl=MgCl2+H2
2Al+6HCl=2AlCl3+3H2
镁铝合金的质量
m(合金)=n(Mg)*24gmol-1+n(Al)*27gmol-1=5.1g
生成H2物质的量
n(H2)=n(Mg)+1.5n(Al)=0.25mol
两式联立,解得
n(Mg)=0.1mol,n(Al)=0.1mol
镁的质量m(Mg)=24gmol-1*0.1mol=2.4g
铝的质量m(Al)=27gmol-1*0.1mol=2.7g
盐酸的物质的量n(HCl)=2n(Mg)+3n(Al)=0.5mol
盐酸的物质的量浓度
c(HCl)=0.5mol/100mL=5mol/L1年前查看全部
- 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:
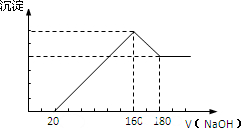
①合金中Mg的质量?
②所用HCl的物质的量浓度?
 lssx1年前2
lssx1年前2 -
 福哥10 共回答了21个问题
福哥10 共回答了21个问题 |采纳率85.7%解题思路:①由图可知,从加入20m氢氧化钠溶液L开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,该阶段消耗氢氧化钠140mL,由氢氧根守恒可知3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH)=(0.16L-0.02L)×5mol/L=0.7mol.从加入氢氧化钠溶液160mL~180mL溶解氢氧化铝,该阶段发生反应Al(OH)3+NaOH=NaAlO2+2H2O,所以n[Al(OH)3]=(0.18L-0.16L)×5mol/L=0.1mol,代入上式计算n[Mg(OH)2],由元素守恒可知n(Mg)=n[Mg(OH)2],再利用m=nM计算Mg的质量.
②加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH),据此计算出n(HCl),再利用c=[n/V]计算盐酸的物质的量浓度.①由图可知,从加入20mL氢氧化钠溶液开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,该阶段消耗氢氧化钠140mL,由氢氧根守恒可知3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH)=(0.16L-0.02L)×5mol/L=0.7mol.从加入氢氧化钠溶液160mL~180mL溶解氢氧化铝,该阶段发生反应Al(OH)3+NaOH=NaAlO2+2H2O,所以n[Al(OH)3]=(0.18L-0.16L)×5mol/L=0.1mol,故3×0.1mol+2n[Mg(OH)2]=0.7mol,解得n[Mg(OH)2]=0.2mol,由元素守恒可知n(Mg)=n[Mg(OH)2]=0.2mol,所以Mg的质量为0.2mol×24g/mol=4.8g,
答:合金中Mg的质量为4.8g.
②加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH)=0.16L×5mol/L=0.8mol,根据氯元素守恒n(HCl)=0.8mol,故盐酸的物质的量浓度为[0.8mol/0.1L]=8mol/L.
答:盐酸的物质的量浓度为8mol/L.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查镁铝化合物性质、混合物的计算,以图象题的形式考查,题目难度中等,分析图象各阶段的发生的反应是解题关键,再利用守恒计算.1年前查看全部
- 将一定质量的镁铝合金投入100ml一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol•L-1 N
 将一定质量的镁铝合金投入100ml一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol•L-1 NaOH溶液至过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示.求:
将一定质量的镁铝合金投入100ml一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol•L-1 NaOH溶液至过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示.求:
(1)原合金中镁、铝的质量各是多少?______
(2)盐酸的物质的量浓度为多少?______. 清风668881年前1
清风668881年前1 -
 binmiao 共回答了20个问题
binmiao 共回答了20个问题 |采纳率90%解题思路:(1)由图可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O.继续滴加NaOH溶液,到沉淀量最大,此时为Mg(OH)2和Al(OH)3,二者质量之和为19.4g,溶液为氯化钠溶液.再继续滴加NaOH溶液,到沉淀量开始进行,到沉淀量最小时,沉淀为Mg(OH)2,质量为11.6g,故到沉淀量最大,Al(OH)3的质量为19.4g-11.6g=7.8g,
由元素守恒可知,n(Al)=n[Al(OH)3],n(Mg)=n[Mg(OH)2],再利用m=nM计算Al、Mg的质量;
(2)加入20mLNaOH溶液,恰好中和剩余的盐酸,此时溶液中溶质为AlCl3、MgCl2、NaCl,根据氯元素守恒有n(HCl)=3n(AlCl3)+2n(MgCl2)+n(NaCl),根据钠元素守恒此时溶液中n(NaCl)=n(NaOH),据此计算出n(HCl),再利用c=[n/V]计算盐酸的物质的量浓度.(1)由图可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O.继续滴加NaOH溶液,到沉淀量最大,此时为Mg(OH)2和Al(OH)3,二者质量之和为19.4g,溶液为氯化钠溶液.再继续滴加NaOH溶液,到沉淀量开始进行,到沉淀量最小时,沉淀为Mg(OH)2,质量为11.6g,故到沉淀量最大,Al(OH)3的质量为19.4g-11.6g=7.8g.
由元素守恒可知,n(Al)=n[Al(OH)3]=[7.8g/78g/mol]=0.1mol,所以m(Al)=0.1mol×27g/mol=2.7g,
n(Mg)=n[Mg(OH)2]=[11.6g/58g/mol]=0.2mol,所以m(Mg)=0.2mol×24g/mol=4.8g,
故答案为:m(Mg)=4.8g,m(Al)=2.7g;
(2)加入20mLNaOH溶液,恰好中和剩余的盐酸,此时溶液中溶质为AlCl3、MgCl2、NaCl,根据氯元素守恒有n(HCl)=3n(AlCl3)+2n(MgCl2)+n(NaCl),根据钠元素守恒此时溶液中n(NaCl)=n(NaOH)=0.02L×5mol/L=0.1mol,所以n(HCl)=3n(AlCl3)+2n(MgCl2)+n(NaCl)=3×0.1mol+2×0.2mol+0.1mol=0.8mol,原盐酸的物质的量浓度为[0.8mol/0.1L]=8mol/L.
故答案为:8mol/L.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查镁铝化合物性质、混合物的计算,以图象题的形式考查,题目难度中等,分析图象各阶段的发生的反应是解题关键,再利用守恒计算.1年前查看全部
- 镁铝合金是常见的铝合金之一.为测定其组成,进行如下实验将3.9g镁铝合金跟某浓度的盐酸溶液反应,当加到100ml时,合金
镁铝合金是常见的铝合金之一.为测定其组成,进行如下实验将3.9g镁铝合金跟某浓度的盐酸溶液反应,当加到100ml时,合金恰好溶解,并收集到标准状况下的气体4.48ml.
求:
1.合金中镁,铝的质量
2.该盐酸的物质的量的浓度
3.向上述反应后的溶液中,至少应加多少毫升5mol/l的NaOH溶液后,才能得到纯净的Mg(OH)2沉淀 ss说事1年前1
ss说事1年前1 -
 liaiguo 共回答了25个问题
liaiguo 共回答了25个问题 |采纳率96%1.收集到的气体氢气是4.48/22.4=0.2mol.不妨设原合金中有镁Mmol,铝Nmol.就有两个式子,M+3N/2=0.2 24M+27N=3.9解得M=0.05,N=0.1.所以有镁的质量是0.05*24=1.2克,铝的质量是0.1*27=2.7克.
2.用去盐酸的物质的量是2M+3N=0.4mol,所以有原盐酸的浓度是0.4/0.1=4mol/L
3.要使得到纯净的氢氧化镁就必须使铝全部转变成偏铝酸根,需要2M+4N=0.5mol的氢氧化钠,就至少要氢氧化钠V=0.5/5=0.1L=100mL.
答:合金中镁铝的质量分别是1.2克,2.7克,盐酸的物质的量浓度是4mol/L,至少需要加100mL的5mol/l的NaOH才能得到纯净的氢氧化镁沉淀.1年前查看全部
- 1.将一块质量为5g的镁铝合金放入100mL 1mol/L的NaOH溶液中,参加反应的物质恰好完全反应,计算:
1.将一块质量为5g的镁铝合金放入100mL 1mol/L的NaOH溶液中,参加反应的物质恰好完全反应,计算:
(1)生成H2(标况)的体积.
(2)合金中镁的质量分数.
2.有一表面被氧化成氧化钠的金属钠样品5.22g,投入到适量水中,产生气体2.24L(标况),所得溶液的体积为100mL.
求:(1)此样品中单质钠的物质的量.
(2)所得溶液中溶质的物质的量浓度?
3.将一块质量为5.1gde 镁铝合金放入200mL盐酸中,合金和盐酸都恰好完全反应,生成H2(标况)的体积为5.6L.计算:
(1)合金中镁、铝物质的量.
(2)盐酸物质的量浓度. wqswqswqs1年前1
wqswqswqs1年前1 -
 小破孩色 共回答了18个问题
小破孩色 共回答了18个问题 |采纳率83.3%1、2Al+2NaOH+2H2O=2NaAlO2+3H2,NaOH物质的量为0.1mol,则生成H2物质的量为0.15mol,体积(标况)为3.36L,反应掉Al的质量为2.7g,合金中镁的质量分数为46%
2、2Na+2H2O=2NaOH+H2,生成H2体积(标况)为2.24L,则Na的物质的量为0.2mol,质量为4.6g,Na2O的质量为0.62g、0.01mol,最终生成NaOH物质的量为0.2+0.01*2=0.22mol,溶液的物质的量浓度为2.2mol/L
3、Mg+2HCl=MgCl2+H2,2Al+6HCl=2AlCl3+3H2
24n(Mg)+27n(Al)=5.1,n(Mg)+n(Al)*3/2=5.6/22.4=0.25
解得n(Mg)=0.1mol,n(Al)=0.1mol
2HCl~H2,n(HCl)=2n(H2)=0.5mol
c(HCl)=2.5mol/L1年前查看全部
- 镁铝合金10.2g与足量稀硫酸作用,在标准状态下H211.2L,求原合金中镁和铝的质量?
 胖胖虫11221年前1
胖胖虫11221年前1 -
 害虫吆儿 共回答了18个问题
害虫吆儿 共回答了18个问题 |采纳率100%解题思路:发生反应:Mg+H2SO4=MgSO4+H2↑、2Al+2H2SO4=Al2(SO4)3+3H2↑,设Mg的物质的量为xmol,Al的物质的量为ymol,表示出各自生成氢气的物质的量,再根据二者质量与体积列方程解答.设Mg的物质的量为x,Al的物质的量为y,有:
Mg+H2SO4=MgSO4+H2↑
1mol1mol
xmolxmol
2Al+2H2SO4=Al2(SO4)3+3H2↑
2mol 3mol
ymol 1.5ymol
由题意可知:
24x+27y=10.2
x+1.5y=
11.2
22.4
解得x=0.2 y=0.2
故m(Mg)=0.2mol×24g/mol=4.8g
m(Al)=0.2mol×27g/mol=5.4g
答:原合金中镁的质量为4.8g、铝的质量为5.4g.点评:
本题考点: 化学方程式的有关计算;有关混合物反应的计算.
考点点评: 本题考查化学方程式计算、混合物计算,比较基础,有利于基础知识的巩固.1年前查看全部
- 将5.1g镁铝合金全部溶于100ML的6mol/L的盐酸溶液中,再逐渐加入3mol/L的氢氧化钠溶液至沉淀质量最大,将所
将5.1g镁铝合金全部溶于100ML的6mol/L的盐酸溶液中,再逐渐加入3mol/L的氢氧化钠溶液至沉淀质量最大,将所得沉淀经过滤,洗涤,烘干,称重得到13.6g,则该过程中转移的电子数为多少mol
 hurenzhilu1年前0
hurenzhilu1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 把一块镁铝合金投入200ml一定物质的量浓度的盐酸中,合金全部溶解,向该溶液中滴加5mol/L的NaOH溶液至过量,生成
把一块镁铝合金投入200ml一定物质的量浓度的盐酸中,合金全部溶解,向该溶液中滴加5mol/L的NaOH溶液至过量,生成沉淀的质量与加入的NaoH溶液的体积关系如图,求
(1)合金中Mg、Al质量为多少克
(2)盐酸的物质的量浓度(用横坐标来求)
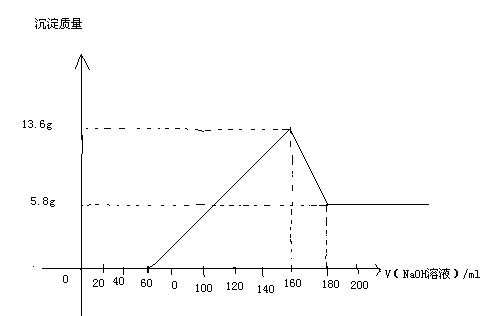
 paoshou1年前4
paoshou1年前4 -
 钟宇欣 共回答了23个问题
钟宇欣 共回答了23个问题 |采纳率91.3%给你说说方法吧,用沉淀下降消耗的NaOH求出氢氧化铝的量,也就知道Al.再用沉淀最大量求出氢氧化镁的量,知Mg.
而沉淀最大时,消耗的NaOH的物质的量等于一开始HCl的物质的量,因为沉淀最大时溶液只是NaCl,用元素守恒知NaOH=HCl.完毕
5.8g是氢氧化镁的,所以0.1molMg,2.4g.13.6-5.8=7.8g是氢氧化铝的,所以Al为0.1mol,为2.7g.
沉淀最大时,NaOH用了0.8mol,所以HCl为0.8mol,4mol/L
其实这个图拉低了这种题的难度,因为给的信息太多了,很多办法都能做出来.搞定1年前查看全部
- 把5.1g镁铝合金的粉末放入过量的盐酸中,得到5.6L H2 (标准情况下).试计算:
把5.1g镁铝合金的粉末放入过量的盐酸中,得到5.6L H2 (标准情况下).试计算:
1 该合金中铝的质量分数
2 该合金中铝和镁的物质的量的比 goodlk1年前1
goodlk1年前1 -
 卡西330 共回答了22个问题
卡西330 共回答了22个问题 |采纳率95.5%标况下5.6L H2 的物质的量为0.25mol
1.设镁的物质的量为x,铝的物质的量为y
由题意有
24x+27y=5.1
x+1.5y=0.25
解得x=0.1,y=0.1
∴该合金中铝的质量分数为27×0.1/5.1=9/17
2.由1题可知该合金中铝和镁的物质的量的比为1:11年前查看全部
- 等量镁铝合金粉末分别与下列四种过量的溶液充分反应,放出氢气最多的是 A.2mol/L的硫酸溶液 B.18mol/L硫酸溶
等量镁铝合金粉末分别与下列四种过量的溶液充分反应,放出氢气最多的是 A.2mol/L的硫酸溶液 B.18mol/L硫酸溶液 C.6mol/L硝酸钾溶液 D.3mol/L硝酸溶液
 小鸟很oo81年前1
小鸟很oo81年前1 -
 wanzhenghan 共回答了19个问题
wanzhenghan 共回答了19个问题 |采纳率84.2%镁铝都可与稀硫酸反应放出氢气,但与浓硫酸,铝在常温下发生钝化,镁虽反应但不产生氢气.与氢氧化钾只有铝反应.与硝酸反应,硝酸为强氧化性酸,都不会产生氢气.选A A:Mg+H2SO4=MGSO4=H2 2AL+3H2SO4=AL2(SO4)3+3H2 B:2AL+2H2O+2KOH=2KALO2+3H2 可以看出A和B中的AL都是以2比3的关系置换H2 当然下面的不是置换反应,所以A多了MG的H2.够详细了吧 追问:A.B都是 硫酸 ,只是浓度不同,对这题有着什么影响呢?为什么不选B1年前查看全部
- 将5.1g镁铝合金溶于60ml 5.0mol/L H2SO4溶液中,完全溶解后再加入65mL 10.0mol/L NaO
将5.1g镁铝合金溶于60ml 5.0mol/L H2SO4溶液中,完全溶解后再加入65mL 10.0mol/L NaOH溶液,得到沉淀9.7g 继续滴加NaOH溶液时沉淀会减少.
(1)当加入___ml NaOH溶液时,可使溶解在硫酸中的Mg和Al恰好完全沉淀
(2)合金溶于硫酸时所产生的氢气在标准状况下的体积为_____L 瑞溪幻灵兄1年前1
瑞溪幻灵兄1年前1 -
 看季节的暗影 共回答了17个问题
看季节的暗影 共回答了17个问题 |采纳率88.2%设合金中含有镁、铝的物质的量分别为x mol、y mol,
24x + 27y=5.1
当加入的OH-与原来H2SO4溶液中的H+的物质的量相等时,Mg2+、Al3+恰好沉淀完全,
此时加入的NaOH溶液的体积为0.060×5.0×2÷100=0.06L=60mL,
再多加5mLNaOH溶液所溶解的Al(OH)3的质量为0.005×10×783.9g,
即沉淀的最大值为3.9g+9.7g=13.6g.
58x + 78y = 13.6g
x=0.1mol,y=0.1mol,
产生H2的物质的量=0.1 + 0.1×1.5=0.25mol.
所产生的氢气在标准状况下的体积=0.25×22.4=5.6L1年前查看全部
- 等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是( )
等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是( )
A. 2mol/L-1 H2SO4 溶液
B. 18mol/L-1 H2SO4溶液
C. 6mol/L-1 KOH 溶液
D. 3mol/L-1 HNO3溶液 蓝灵1年前4
蓝灵1年前4 -
 jackybe 共回答了21个问题
jackybe 共回答了21个问题 |采纳率95.2%解题思路:等量的镁铝合金分别与不同的溶液反应,只有两种金属都和该溶液反应,且都生成氢气,这样才能产生最多的氢气,据此分析解答.A、镁、铝都和稀硫酸反应生成氢气;
B、镁与浓硫酸(18mol/LH2SO4)反应生成SO2气体,铝与浓硫酸发生钝化(常温);
C、镁不能和氢氧化钾反应,铝和氢氧化钾反应生成氢气;
D、硝酸为强氧化性酸,和镁、铝反应不产生氢气;
根据以上分析知,生成氢气最多的是稀硫酸,故选A.点评:
本题考点: 镁的化学性质;铝的化学性质;有关混合物反应的计算.
考点点评: 本题考查金属的性质,主要考查学生运用所学化学知识综合分析和解决实际问题的能力,该题溶液的浓度不是计算的数据,而是判断溶液属于“浓”或是“稀”,8mol/L以上的HCl、H2SO4、HNO3通常认为是浓酸.1年前查看全部
- 一道化学问题1.镁铝合金广泛用于火箭、导弹和飞机制造业等.某兴趣小组为探究镁铝合金的组成,取16克镁铝合金样品,把60克
一道化学问题
1.镁铝合金广泛用于火箭、导弹和飞机制造业等.某兴趣小组为探究镁铝合金的组成,取16克镁铝合金样品,把60克氢氧化钠溶液平均分成三份一次加入样品中(铝与氢氧化钠溶液反应的化学方程式为(2Al+2NaOH+2H2O===2NaAlO2+3H2↑,镁与氢氧化钠溶液不反应.),充分反应后,过滤出固体,将其洗涤、干燥、称量,得实验数据如下:
所加氢氧化钠溶液的次数:第一次 第二次 第三次
剩余固体的质量/克:10.6 5.2 4.0
从以上数据可知,该合金中,镁元素与铝元素的质量比为?.
所用氢氧化钠溶液的质量分数为?.
请写出计算过程和结果并说明理由好吗?
 sunhapv1年前2
sunhapv1年前2 -
 谁才是好人 共回答了12个问题
谁才是好人 共回答了12个问题 |采纳率58.3%1.剩余4克是镁,所以镁铝质量比是4:(16-4)=1:3
Mg不会与NaOH反应
Al的反应为:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2
第一次到第二次,固体质量递减5.4克,说明5.4克能与20克NaOH溶液恰好完全反应
而第三次固体质量减少了1.2克,所以说明这次反应中Al已经反应完全,剩下的4克物质就是Mg
2A...1年前查看全部
- 将3.9g镁铝合金,投入到500mL2mol/L的盐酸中,金属完全溶解,再加入4mol/L的NaOH溶液,若要生成的沉淀
将3.9g镁铝合金,投入到500mL2mol/L的盐酸中,金属完全溶解,再加入4mol/L的NaOH溶液,若要生成的沉淀最多
加入的这种NaOH溶液的体积是?速求 桃源梦雨1年前1
桃源梦雨1年前1 -
 璞0o0玉 共回答了15个问题
璞0o0玉 共回答了15个问题 |采纳率86.7%设需要加入氢氧化钠溶液的体积为X
根据题意可知:若要生成的沉淀最多,氢氧化钠应全部转化为氯化钠,所以根据氯原子和钠原子守恒得到如下关系式:
HCl NaCl NaOH
1 1
2mol/L*0.5L 4mol/L*X
X=0.25L=250ml
答:加入的这种NaOH溶液的体积是250毫升.1年前查看全部
- 将0.51g镁铝合金溶于100ml盐酸中,然后逐滴加入足量1mol/L的NAOH溶液,最后得到的白色沉淀质量为0.87g
将0.51g镁铝合金溶于100ml盐酸中,然后逐滴加入足量1mol/L的NAOH溶液,最后得到的白色沉淀质量为0.87g,求镁铝合金中铝的质量
 hillon1年前1
hillon1年前1 -
 城中游离人 共回答了11个问题
城中游离人 共回答了11个问题 |采纳率100%方程式:Mg+2NaOH=Mg(OH)2↓+H2O
2Al+2NaOH+2H2O=2NaAlO2+3H2↑(氢氧化钠过量)
分步:2Al+2NaOH+2H2O=2Al(OH)3+3H2 ↑
Al(OH)3 + NaOH = NaAlO2 + 2H2O
可知 最后得到的沉淀为氢氧化镁
Mg Mg(OH)2
24 58
24*0.87/58 0.87g
可以得到 Mg的质量为0.36g
所以铝的质量为0.51g-0.36g=0.15g1年前查看全部
- 2.1g镁铝合金完全溶于足量盐酸,生成氢气2.24L(标准状况下),再向溶液中加入氢氧化钠溶液,生成沉淀的质量最大是(
2.1g镁铝合金完全溶于足量盐酸,生成氢气2.24L(标准状况下),再向溶液中加入氢氧化钠溶液,生成沉淀的质量最大是( )
A. 2.9g
B. 4.6g
C. 5.5g
D. 6.9g xx85281年前1
xx85281年前1 -
 fl45680 共回答了22个问题
fl45680 共回答了22个问题 |采纳率95.5%解题思路:2.1g镁铝合金完全溶于足量盐酸,生成氢气2.24L(标准状况下),物质的量为0.1mol,所以得到的氯化镁、氯化铝中的氯离子共为0.2mol,镁离子、铝离子全部转变成沉淀时,相当于氯离子全部被OH-代替,所以析出的沉淀中OH-的物质的量为0.2mol,沉淀质量等于金属质量加氢氧根的质量.2.1g镁铝合金完全溶于足量盐酸,生成氢气2.24L(标准状况下),氢气的物质的量为[2.24L/22.4L/mol]=0.1mol,得到的氯化镁、氯化铝中的氯离子共为0.1mol×2=0.2mol,镁离子、铝离子全部转变成沉淀时,相当于氯离子全部被OH-代替,所以析出的沉淀中OH-的物质的量为0.2mol,所以得到的沉淀质量为2.1g+0.2mol×17g/mol=5.5g.
故选:C.点评:
本题考点: 镁、铝的重要化合物;化学方程式的有关计算.
考点点评: 考查镁铝化合物性质、混合物的计算,清楚反应过程、判断沉淀中氢氧根的物质的量是解题关键.1年前查看全部
- 一块镁铝合金溶于盐酸后,加入过量NAOH溶液,此时溶液中存在什么物质?
一块镁铝合金溶于盐酸后,加入过量NAOH溶液,此时溶液中存在什么物质?
答案是NAALO2,但是为什么?麻烦知道的具体, huxiaoli9281年前4
huxiaoli9281年前4 -
 wtb1980 共回答了19个问题
wtb1980 共回答了19个问题 |采纳率84.2%镁铝合金与盐酸反应后是生成氯化镁,氯化铝;
在加入过量NaOH溶液,镁被沉淀,而铝一开始也被沉淀,但NaOH过量又会溶解氢氧化铝:NaOH + Al(OH)3 ==== NaAlO2 + 2H2O 因为氢氧化铝是两性氢氧化物,既可以表现碱性,又可以表现出酸性,可以与强碱反应.(类似的还有氢氧化锌之类的)
所以最后溶液中应含有NaAlO2,NaOH,NaCl,H2O1年前查看全部
- 答对重谢把a克镁铝合金粉末溶于足量盐酸中,加入过量的氢氧化钠溶液.过滤出沉淀,经过洗涤、干燥、灼烧,得到白色粉末的质量仍
答对重谢
把a克镁铝合金粉末溶于足量盐酸中,加入过量的氢氧化钠溶液.过滤出沉淀,经过洗涤、干燥、灼烧,得到白色粉末的质量仍为a克,则原来合金中镁的质量分数为多少.A.百分之八十 B百分之六十 C百分之四十 D百分之二十 yujane821年前1
yujane821年前1 -
 OHO123 共回答了20个问题
OHO123 共回答了20个问题 |采纳率75%最终白色粉末是氧化镁,也就是氧化镁中美的质量比,B1年前查看全部
- 镁铝合金与过量稀盐酸溶液反应后,再与过量NaOH溶液反应,过滤,洗涤,干燥后的沉淀是
镁铝合金与过量稀盐酸溶液反应后,再与过量NaOH溶液反应,过滤,洗涤,干燥后的沉淀是
为什么是氢氧化镁呢 yuanshanya1年前3
yuanshanya1年前3 -
 cchi 共回答了19个问题
cchi 共回答了19个问题 |采纳率94.7%只有Mg(OH)2
.第一步生成 氯化镁,氯化铝,加入氢氧化钠后,氢氧化镁沉淀,氢氧化铝是2性,溶于过量的氢氧化钠中.所以干燥之后只有Mg(OH)21年前查看全部
- 镁铝合金的熔点a.高于铝b.高于镁c.低于镁和铝d.高于镁和铝
 shenxin1981年前1
shenxin1981年前1 -
 xiaoqingercn 共回答了20个问题
xiaoqingercn 共回答了20个问题 |采纳率90%合金后的某物理性质一定是介于合金前各物质此物理性质之间.
选b.1年前查看全部
- 把5.1g镁铝合金的粉末放入过量的盐酸中,得到5.6L H2(标准状况下).试计算:(1)该合金中铝的质量分数;(2)该
把5.1g镁铝合金的粉末放入过量的盐酸中,得到5.6L H2(标准状况下).试计算:(1)该合金中铝的质量分数;(2)该合金中铝和镁的物质的量之比.
 yukang861年前1
yukang861年前1 -
 文之大者 共回答了22个问题
文之大者 共回答了22个问题 |采纳率100%设该合金中有铝a mol,有镁b mol.
由合金质量为5.1g可得:27a+24b=5.1【1】
2Al------3H2 Mg--------H2
2mol 3mol 1mol 1mol
amol 3/2amol bmol bmol
氢气的总物质的量为:5.6L/(22.4L/mol)=0.25mol
所以3/2a+b=0.25【2】
由【1】【2】可以解得a=0.1,b=0.1
(1)Al的质量分数=2.7g/5.1g*100%=52.94%
(2)铝的物质的量:镁的物质的量=0.1mol:0.1mol=1:1
希望对你能有所帮助.
另外教你一点小窍门:学会培养自己的数感,看到5.1可以马上想到5.1=2.4+2.7,这样可以加快解题速度,提高准确率.
如有不懂,1年前查看全部
- 将3.9g镁铝合金投入到500ml 2mol.-1 的盐酸中,
将3.9g镁铝合金投入到500ml 2mol.-1 的盐酸中,
金属完全溶解,再加入4mol l-1 的NaOH 溶液,若要生成的沉淀最多.则加入NaOH溶液体积为多少? xeabay1年前1
xeabay1年前1 -
 爱生活nn米 共回答了19个问题
爱生活nn米 共回答了19个问题 |采纳率89.5%其实要加的NaOH的物质的量就等于盐酸的物质的量,所以要加250mL
如果想不明白的话,还可以计算下.
3.9/24=0.1625 mol Mg需要 0.3250mol盐酸
一共有盐酸0.5*2=1mol
所以剩余盐酸0.6750mol
所以要加NaOH 0.6750+0.1625*2=1mol
即250mL1年前查看全部
- 1.焰火的主要原料是黑火药,还有草酸钠、碳酸铜(发出绿色的光)等发色剂和氯酸钾、镁铝合金粉等添加剂.下列说法正确的是
1.焰火的主要原料是黑火药,还有草酸钠、碳酸铜(发出绿色的光)等发色剂和氯酸钾、镁铝合金粉等添加剂.下列说法正确的是
A.碳酸铜因为受热分解才发出绿色的光 B.氯酸钾的主要用途是产生紫色的焰火
C.镁铝合金粉在焰火中发出耀眼的白光 D.黑火药的主要成分是木炭、硫磺
答案选什么,为什么.O(∩_∩)O谢谢 an00111年前1
an00111年前1 -
 小余子 共回答了11个问题
小余子 共回答了11个问题 |采纳率90.9%4D,焰火发光原理为焰色反应,氯酸钾能放氧气,镁铝能提供高温1年前查看全部
- 在标准状况下进行下列试验:甲、乙、丙三位同学各取300ml同浓度的 盐酸,加入不同质量的 同一镁铝合金粉末,有关数据列表
在标准状况下进行下列试验:甲、乙、丙三位同学各取300ml同浓度的 盐酸,加入不同质量的 同一镁铝合金粉末,有关数据列表如下:问:(1)盐酸的物质的量浓度是多少?
(2)求合金中镁、铝的质量分数是多少?
(3)在丙实验之后,还 需向容器中加入1.00mol.L-1的NaOH溶液多少毫升才能使剩余合金中的 铝全部溶解?(设剩余的 合金与原合金成分相同)
 4114441年前1
4114441年前1 -
 yyxmm 共回答了16个问题
yyxmm 共回答了16个问题 |采纳率93.8%解析:(1)甲中盐酸过量,丙中合金过量
n(H2)==0.03 mol
c(HCl)==0.2 mol·L-1
(2)甲中盐酸过量,设甲中合金镁、铝的物质的量分别为x、y,有
解得
则w(Mg)=×100%=47.1%,
w(Al)=1-47.1%=52.9%。
(3)丙中含镁:=0.018 mol,
含铝:0.018 mol。1年前查看全部
- 把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol•L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积
 把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol•L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示,下列叙述不正确的是( )
把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol•L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示,下列叙述不正确的是( )
A.盐酸的物质的量浓度为0.5mol•L-1
B.合金中铝的物质的量为0.01mol
C.合金中镁的物质的量为0.005mol
D.B点与C点沉淀的物质的量之比为2:1 木偶人的恋爱史1年前1
木偶人的恋爱史1年前1 -
 VV是我梦中ll 共回答了19个问题
VV是我梦中ll 共回答了19个问题 |采纳率89.5%解题思路:由图可知,从开始至加入NaOH溶液10mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后盐酸有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O,继续滴加NaOH溶液,到氢氧化钠溶液为50mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液.再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)3+NaOH=NaAlO2+2H2O.(1)由图可知,从加入10m氢氧化钠溶液开始产生沉淀,加入氢氧化钠溶液为50mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,该阶段消耗氢氧化钠40mL,由氢氧根守恒可知3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH)=(0.06L-0.02L)×1mol/L=0.04mol.从加入氢氧化钠溶液50mL~60mL溶解氢氧化铝,该阶段发生反应Al(OH)3+NaOH=NaAlO2+2H2O,所以n[Al(OH)3]=(0.06L-0.05L)×1mol/L=0.01mol,代入上式计算n[Mg(OH)2],由元素守恒可知n(Mg)=n[Mg(OH)2],再利用m=nM计算Mg、Al的质量;(2)加入氢氧化钠溶液为60mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH),据此计算出n(HCl),再利用c=nV计算盐酸的物质的量浓度.BC、由图可知,从开始至加入NaOH溶液10mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后盐酸有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O.继续滴加NaOH溶液,到氢氧化钠溶液为50mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液.再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)3+NaOH=NaAlO2+2H2O.由图可知,从加入10m氢氧化钠溶液开始产生沉淀,加入氢氧化钠溶液为50mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,该阶段消耗氢氧化钠40mL,由氢氧根守恒可知3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH)=(0.06L-0.02L)×1mol/L=0.04mol.从加入氢氧化钠溶液50mL~60mL溶解氢氧化铝,该阶段发生反应Al(OH)3+NaOH=NaAlO2+2H2O,所以n[Al(OH)3]=(0.06L-0.05L)×1mol/L=0.01mol,故3×0.01mol+2n[Mg(OH)2]=0.04mol,解得n[Mg(OH)2]=0.005mol,由元素守恒可知n(Mg)=n[Mg(OH)2]=0.005mol,故BC正确;
A、加入氢氧化钠溶液为50mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH)=0.05L×1mol/L=0.05mol,根据氯元素守恒n(HCl)=0.05mol,故盐酸的物质的量浓度为[0.05mol/0.1L]=0.5mol/L,故A正确;
D、B点到沉淀量最大,此时为Mg(OH)2和Al(OH)3,n[Mg(OH)2]=0.005mol,n[Al(OH)3]=0.01mol,m(沉淀)=m[Mg(OH)2]+m[Al(OH)3]=0.005mol×58g/mol+0.01mol×78g/mol=1.07g,C点沉淀是氢氧化镁,质量是0.29g,质量之比不是2:1,故D错误.
故选D.点评:
本题考点: 铝的化学性质;离子方程式的有关计算;镁的化学性质.
考点点评: 本题考查镁铝化合物性质、混合物的计算,以图象题的形式考查,题目难度中等,分析图象各阶段的发生的反应是解题关键,再利用守恒计算.1年前查看全部
- (2011•南京模拟)将5.1g镁铝合金溶于60mL 5mol•L-1的H2SO4溶液中,完全溶解
(2011•南京模拟)将5.1g镁铝合金溶于60mL5mol•L-1的H2SO4溶液中,完全溶解后再加入65mL10.0mol•L-1 的NaOH溶液,得到沉淀的质量为9.7g,继续滴加NaOH溶液时沉淀会减少.
(1)当加入6060mL NaOH溶液时,可使溶液在硫酸中的Mg和Al恰好完全沉淀.
(2)计算合金溶于硫酸时所产生的氢气在标准状况下的体积5.6L5.6L. liqian40081年前1
liqian40081年前1 -
 juran 共回答了14个问题
juran 共回答了14个问题 |采纳率100%所发生的反应为:Mg+H2SO4=MgSO4+H2↑,2Al+3H2SO4=Al2(SO4)3+3H2↑,MgSO4+2NaOH=Mg(OH)2↓+Na2SO4,
Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4,
(1)n(H2SO4)=0.06L×5mol/L=0.3mol,当硫酸中的Mg和Al恰好完全沉淀时,溶液成分为Na2SO4,
此时n(NaOH)=2n(H2SO4)=2×0.3mol=0.6mol,
所以V(NaOH)=
0.6mol
10mol/L=0.06L=60ml,
故答案为:60;
(2)当加入60mlNaOH溶液时,镁铝恰好沉淀,当加入n(NaOH)=0.065L×10mol/L=0.65mol时,
NaOH过量:0.65mol-0.6mol=0.05mol,发生:Al(OH)3+NaOH=NaAlO2+2H2O,
则溶解的n(Al(OH)3)=0.05mol,m(Al(OH)3)=0.05mol×78g/mol=3.9g,
所以硫酸中的Mg和Al恰好完全沉淀的质量应为3.9g+9.7g=13.6g,
设混合物中含有xmolMg,ymolAl,则
24x+27y=5.1
58x+78y=13.6,解之得:x=0.1,y=0.1,
Mg+H2SO4=MgSO4+H2↑
0.1mol 0.1mol
2Al+3H2SO4=Al2(SO4)3+3H2↑
0.1mol 0.15mol
n(H2)=0.1mol+0.15mol=0.25mol,
V(H2)=0.25mol×22.4L/mol=5.6L,
故答案为:5.6L.1年前查看全部
- 取50毫升稀硫酸与一定质量的镁铝合金反应,合金全部溶解,向所得溶液中滴加5mol/L的氢氧化钠溶液至过量,
取50毫升稀硫酸与一定质量的镁铝合金反应,合金全部溶解,向所得溶液中滴加5mol/L的氢氧化钠溶液至过量,
生成沉淀质量与加入氢氧化钠溶液体积关系如图,则原合金中镁的质量为?(沉淀最大值19.4克,沉淀最大值对应氢氧化钠的量为160毫升,最后沉淀为11.6克,对应氢氧化钠的量为180毫升.) 爱情三分球1年前1
爱情三分球1年前1 -
 习他们的 共回答了13个问题
习他们的 共回答了13个问题 |采纳率92.3%最后的沉淀为氢氧化镁,可以算出氢氧化镁物质的量为 11.6/58=0.2mol 所以Mg为0.2mol,为4.8g 沉淀最大时,应该是氢氧化铝和氢氧化镁共存,所以氢氧化铝质量为19.4-11.6=7.8g 其物质的量为 7.8/78=0.1mol 所以铝为2.7g1年前查看全部
大家在问
- 1酸雨往往含有硫酸、盐酸和硝酸等三种成分,但地区不同,成分也不同,要治理酸雨,先要确定其组成,兴趣小组对当地的酸雨进行探究
- 2学校新买来一批图书,其中文艺书占九分之四,数学书占余下的二十五分之十八,已知数学书比文艺书少20本,这批图书一共多少本?
- 3初二英语完形填空 速度啊There are two boys from two families.They are Ke
- 4某服装店有一种优惠卡.花200元买这种卡后,凭卡可以在这家店按8这购物,真么情况下买卡购物合算?
- 5event planner翻译成什么 是一种职业
- 6某村欲购买甲乙丙三种树,已知甲乙丙三种树的价格之比为2:2:3,甲种每颗200元,现计划用210000元资金,购买这三种
- 7碧玉妆成一树,高万条垂下绿丝绦.不知细叶谁裁出,二月春风似剪刀.(诗人赞美了什么?)
- 8三千一百九十四,写作:______; 八千零八,写作:______.
- 9sin(α+β)=sinα+sinβ是真命题吗?为什么?
- 10长方体长二分之一米,宽五分之一米,高五分之一米,求它的体积和表面积
- 11梯形的高一定,上底和面积成不成正比例? 哪位好心人帮忙解答一下,要说明
- 12初一数学公式归纳
- 13概率积分指数看不清的地方是x的平方.知道一知半解的就不要急着回答了./>
- 14英语翻译原文:王戎七岁,尝与诸小儿游,看道边李树多子折枝,诸小儿竞走取之,唯戎不动.人问之,答曰:“树在道旁而多子,此必
- 15英语语法 过去完成时的详解我想要 语法 过去完成时的详解.希望可以帮忙、 最好有例句,还有帮我解释下 与一般过去时有什么
