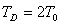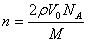热力学温度的起点为什么是零下273摄氏度
 xdcainiao2022-10-04 11:39:544条回答
xdcainiao2022-10-04 11:39:544条回答
已提交,审核后显示!提交回复
共4条回复
 draegerman 共回答了16个问题
draegerman 共回答了16个问题 |采纳率87.5%- 热力学温度,又叫热力学标温,符号T,单位K(开尔文,简称开).早在1787年法国物理学家查理(J.Charles)就发现,在压力一定时,温度每升高1℃,一定量气体的体积的增加值(膨胀率)是一个定值,体积膨胀率与温度呈线性关系.起初的实验得出该定值为气体在0℃时的体积的1/269,后来经许多人历经几十年的实验修正,其中特别是1802年法国人盖•吕萨克(J.L.Gay-Lussac)的工作,最后确定该值1/273.15.将上述气体体积与温度的关系用公式来表示,形式如下:V=V0(1+t/273.15)=V0(t+273.15)/273.15 式中V是摄氏温度为t/℃时的气体体积.若定义t+273.15≡T(于是0℃+273.15=T0),上述关系就可以用形式更简单的公式来表达:V/T=V0/T0,进一步看,V1/T1=V0/T0,V2/T2=V0/T0,……,自然有V1/T1=V2/T2,即在任何温度下一定量的气体,在压力一定时,气体的体积V与用T为温标表示的温度成反比.这叫做查理-盖•吕萨克定律.事实上这种关系只适用于理想气体.为此,人们起先把T称为理想气体温度(温标),又叫绝对温度(温标).在热力学形成后,发现该温标有更深刻的物理意义,特别是克劳修斯(Claosius)和开尔文(Kelvin)论证了绝对零度不可达到,便改称热力学温度(温标),并用Kelvin第一个字母K为其单位.物体的温度是构成物体的大量微粒运动(热运动)的激烈程度的宏观体现.例如由单原子分子构成的气体的大量分子的平均动能Ek与它的温度T的关系经统计热力学理论推导为:E(—)k=3/2kT 其中k=1.391×10-23J/K,被称为玻尔兹曼(Boltzmann)常量,等于气体常量R与阿伏加德罗常量N0之比.
- 1年前
 雪不在飞扬 共回答了257个问题
雪不在飞扬 共回答了257个问题 |采纳率- 这是通过一些实验,总结出规律,然后再经过严格的理论计算得来的。
涉及到大学物理的一些内容。 - 1年前
 hxzy328 共回答了15个问题
hxzy328 共回答了15个问题 |采纳率- -273摄氏度就是绝对零度,-273摄氏度相当于热力学温度的零K
只不过是两种方式表达温度,坐标起点不一样。 - 1年前
 兰宾 共回答了14个问题
兰宾 共回答了14个问题 |采纳率78.6%- 因为科学家们验证的,最低温度是-273℃,这就是绝对零度。爱因斯坦说过,物体的最低温度是-273℃。而且听说-273℃可以将黄金圣衣打碎
- 1年前
相关推荐
- 某物体的温度是零下173摄氏度,则相当于热力学温度的多少K,热力学温度为200K,相
 小狐貍玥玥1年前1
小狐貍玥玥1年前1 -
 玻璃樽 共回答了16个问题
玻璃樽 共回答了16个问题 |采纳率100%零下273摄氏度是0k
所以零下173摄氏度就是100k
热力学温度为200K是零下73摄氏度
欢迎提问1年前查看全部
- 热力学温度比如298K,其中K是读成什么的?就是英文字母K的发音吗?
 八闽闲人1年前2
八闽闲人1年前2 -
 zjnbsy 共回答了15个问题
zjnbsy 共回答了15个问题 |采纳率93.3%一般和英文发音一样
如果想装的专业一些,可以说:298开尔文 或 热力学温度为298 kei1年前查看全部
- 下列关于热力学温度的说法中,正确的是( )
下列关于热力学温度的说法中,正确的是( )
A.热力学温度的零值等于-273.15℃
B.热力学温度的1K的大小和摄氏温度的1℃的大小是相等的
C.绝对零度是低温的极限,永远达不到
D.1℃就是1K 右手无名1年前1
右手无名1年前1 -
 netsyj 共回答了20个问题
netsyj 共回答了20个问题 |采纳率90%解题思路:识记热力学温标与摄氏温标的概念与区别,便可解答此题,两者大小关系为T=273.15(K)+tA、热力学温度的零度是宇宙所能无限接近的绝对零度,此温度不可达到,为-273.15℃,故A正确;
B、摄氏温度与热力学温度的差别为所选的零值的起点不同,单位不同;但热力学温度的1K的大小和摄氏温度的1℃的大小是相等的,故B正确;
C、绝对零度不可达到,只能无限接近,故C正确;
D、在数值上T=273.15(K)+1℃=274.15(K),所以1℃对应274.15K,故D错误.
故选:ABC.点评:
本题考点: 温度是分子平均动能的标志.
考点点评: 解热力学问题关键要知道两种温标的区别与联系,概念要理解透彻.1年前查看全部
- 已知:△G=△H-T△S,△G为自由能变化,△H为焓变,T为热力学温度,△S熵变.当△G<0时反应能自发进行,△G>0时
已知:△G=△H-T△S,△G为自由能变化,△H为焓变,T为热力学温度,△S熵变.当△G<0时反应能自发进行,△G>0时反应不能自发进行.据此下列叙述中正确的是( )
A.熵变大于零的反应肯定能自发进行
B.焓变小于零的反应肯定能自发进行
C.焓变大于零的反应肯定不能自发进行
D.焓变小于零且熵变大于零的反应一定能自发进行 lrh1501年前1
lrh1501年前1 -
 dgd9zjld 共回答了21个问题
dgd9zjld 共回答了21个问题 |采纳率85.7%解题思路:已知:△G=△H-T△S,△G为自由能变化,△H为焓变,T为热力学温度,△S熵变.当△G<0时反应能自发进行,△G>0时反应不能自发进行,据此分析判断选项.A、熵变大于零的反应,△S>0,若△H>0低温下,可以△G>0时反应不能自发进行,故A错误;
B、焓变小于零的反应,△H<0,若△S<0,高温下可以△G>0,反应不能自发进行,故B错误;
C、焓变大于零的反应,△H>0,△S>0高温下可以△G<0,反应能自发进行,故C错误;
D、焓变小于零且熵变大于零的反应,△H<0,△S>0,△G<0时反应一定能自发进行,故D正确;
故选D.点评:
本题考点: 焓变和熵变.
考点点评: 本题考查了化学反应自发进行的判断依据,注意自发进行的判断依据是熵变,焓变和温度,题目较简单.1年前查看全部
- 谁知道热力学温度的"开尔文"相关的知识?
 浇汁抹布1年前1
浇汁抹布1年前1 -
 kxf520 共回答了21个问题
kxf520 共回答了21个问题 |采纳率95.2%开尔文 英文是 Kelvin 简称开,国际代号K,热力学温度的单位.开尔文是国际单位制(SI)中7个基本单位之一,以绝对零度(0K)为最低温度,规定水的三相点的温度为 273.16K,1K等于水三相点温度的1/273.16.热力学温度T与人们惯用的摄氏温度t的关系是T=t+273.15,因为水的冰点温度近似等于 273.15K,并规定热力学温度的单位开(K)与摄氏温度的单位摄氏度(℃)完全相同.开尔文是为了纪念英国物理学家Lord Kelvin而命名的.
热力学温度单位开尔文(K)是国际单位制(SI)基本单位之一.其他基本单位是米、千克、秒、安培、摩尔和坎德拉.
开尔文的定义(K):
开尔文(K)是热力学温度单位,等于水的三相点热力学温度的(1/273.16).上述定义以物理常量:水三相点热力学温度Tt
r为基础,而Tt r国际上已于1967年协议,精确地等于273.16K.(图略)
1K=1/273.16 Tt r
开尔文是用英国科学家开尔文的名字命名的.
威廉·汤姆森(William·Thom?鄄son),后来的开尔文勋爵(Lord·Kelvin of
Largs),1824年6月26日生于英国北爱尔兰贝尔法斯特.他的特殊天赋和理解力很早就表现出来了,以致他在10岁就被格拉斯哥大学注册录取.16 岁他作为大学生来到剑桥,在剑桥他所有功课成绩都很优秀.汤姆森作为格拉斯哥大学物理学教授从1846年开始从事教学和科学研究.人们说,在他那儿,计划 1小时的课经常持续3个小时.
汤姆森的兴趣一向在热力学和电学方面.热能的研究使他认识了一个可能最低的温度,即温度的绝对零度.他把这个-273.15℃的温度点当作一个新的温度和温标(图略)的出发点.他与一位英国物理学家詹姆斯·普雷斯科特·焦尔(James·Prescott·Joule
1818~1889)一起发现了用他们两人名字命名的“焦尔-汤姆森效应”.它表明,理想气体在没有外界做功而膨胀时,使其冷却到足够低的温度.发生冷却是由于膨胀时必须通过内部做功以克服气体的分子力.*1856年汤姆森认识到按照他的名字命名的热电“汤姆森效应”,它包含,当一个电流通过,在一个均匀的电导体中存在一个温度落差按照它的方向产生热或取走热.
“汤姆森热”和一个导电体的焦耳电流热(它取决于导体的电阻和电流强度)是不能混淆的.另外汤姆森还认识到可以转化为机械功的热能.作为热力学过程不可逆性的一个量,用熵的概念他与鲁道夫·克劳西乌斯(Rudolf·Claustus1822~1888)同时创立了热力学第二定律,亦即所有的热力机只能把它从一种热材料取走的热能的一部分转换成机械功.这个热能的剩余部分又总是被散发给冷材料.
在电学领域按照他的名字命名的开尔文电流天平属于最重要的发明.它可以确定机械力和电流强度之间的关系.电流天平特别在测量电流和检定电流计中得到应用.值得一提的是他还研制了静电伏特计,它能够相当精确的测量当时最高大约10kV的电压.此外汤姆森改进了许多测量方法并且发明了无数其他的测量仪器,比如说精确测定很小电阻的测量电桥,它现在被称作为汤姆森测量电桥.汤姆森通过参与实现大不列颠和美国之间首次海底电缆连接名扬国外.他是这个项目的发起人之一,并计算了电缆.经海底电缆的第一次通话是1858年8月17日通过北大西洋从大不列颠通往美国.无可置疑,这项海底电缆的连接是19世纪最大的技术贡献.遗憾的是,因为出现了故障,用这个电缆向大西洋另一方大约只通了700次话.跨越大西洋持续的通信直到1866年初才在两洲之间建起,这项工作汤姆森同样参与并起了决定性的作用.
威廉·汤姆森1882年被授予贵族称号后被尊称为拉格斯的开尔文勋爵.1907年12月17日死于苏格兰拉格斯附近的内斯霍尔(Netherhall),享年84岁.他的成就得到了承认,他是19世纪杰出的和受人尊敬的自然科学家.他把最后的长眠之处选在伊萨克·牛顿爵士(1643-1727)旁边的威斯敏斯特尔教堂.
*焦尔-汤姆森效应:气体经历焦尔-汤姆森膨胀时温度随压强的变化.
绝对零度是指-273.15度,在这个温度下的物体不包含热量,气体的体积将减小到零.在此温度下,构成物质的所有分子和原子均停止运动.所谓运动,系指所有空间、机械、分子以及振动等运动.还包括某些形式的电子运动,然而它并不包括量子力学概念中的“零点运动”.除非瓦解运动粒子的集聚系统,否则就不能停止这种运动.从这一定义的性质来看,绝对零度是不可能在任何实验中达到的,但已达到绝对零度以上百万分之一度内的低温.若用分子运动论来解释,理想气体分子的平均平动动能由温度T确定,则可将绝对零度与“理想气体分子停止运动时的温度”等同看待.事实上一切实际气体在温度接近-273.15℃时,早已变成液态或固态,它的温度趋于一个极限值,这个极限值就称为绝对零度.绝对零度是温度的最低点,实际上永远也不会达到的.
初学查理定律时,我们知道,一定质量的气体,在体积一定时,压强与摄氏温度不成正比.那么,怎样才能使一定质量的气体在体积一定时,它的压强与温度成正比呢?
很自然地,我们用“外推法”,将等容线反向延长与横坐标(t轴)交于一点(如图),令P=0时,Pt=P0(1+1/273°C)=0由得出t= -273°C.经过精确的实验证明,上述的t=-273°C应为-273.15°C.早在19世纪末,英国科学家威廉·汤姆(开尔文)首先创立了以t=- 273.15°C为零度的温标,称之为热力学温标(即绝对温标),t=-273.15°C定义为OK,即绝对零度.
绝对零度到达:人们是从液化气开始,十步步地逼近它的.早在19世纪末,许多科学家利用加压法对氨气进行液化,得出了-110°C(163K 的温度.利用这种方法以及后来的级联法(即采用临界温度下气体逐渐蒸发冷却而获得较低温度),在-140°C(133K)液化了氧气,-183°C (90k)液化了氮,在-195°C(78K)液化了一氧化碳.1898年,英国人杜瓦用多孔塞膨胀法在-240°C(33k)的低温下液化了氢气,随着固化氢的成功,得出了18世纪的最低温度-259°C(14k).
进入20世纪后,随着科技的发展和仪器的更新,我们离绝对零度越来越近:1908年,荷兰物理学家昂尼斯成功地实现了4.2k的低温把自然界中最轻的隋性气体氦液化了.随后,昂尼斯又叩开1k的大门,获得0.7k的低温.
在通往绝对零度的道路上,科学家发现了许多经典物理学无法解释的现象,如超导电性,超流动性等.为使这些有用的技术造福人类,科学家继续前进. 1926年,德拜与吉奥克用磁冷却法达到了10-3k,后来又攻破了10-6k,离绝对零度仅有一步之遥了,但人们感到,越是逼近它,达到它的希望越是遥远,这正如一条双曲线,它只能是无限地接近坐标轴,而绝对零度这个宇宙低温的极限,只能是可望不可及的.绝对零度绝对零度表示那样一种温度,在此温度下,构成物质的所有分子和原子均停止运动.所谓运动,系指所有空间、机械、分子以及振动等运动.还包括某些形式的电子运动,然而它并不包括量子力学概念中的“零点运动”.除非瓦解运动粒子的集聚系统,否则就不能停止这种运动.从这一定义的性质来看,绝对零度是不可能在任何实验中达到的,但已达到绝对零度以上百万分之一度内的低温.所有这些在物质内部发生的分子和原子运动统称为“热运动”,这些运动是肉眼看不见的,但是我们会看到,它们决定了物质的大部分与温度有关的性质.正如一条直线仅由两点连成的一样,一种温标是由两个固定的且可重复的温度来定义的.最初,在一标准大气压(760毫米水银柱,或760托)时,摄氏温标是定冰之熔点为0℃和水之沸点为100℃,绝对温标是定绝对零度为oK和冰之熔点为273K,这样,就等于有三个固定点而导致温度的不一致,因为科学家希望这两种温标的度数大小朝等,所以,每当进行关于这三点的相互关系的准确实验时,总是将其中一点的数值改变达百分之一度.现在,除了绝对零度外,仅有一固定点获得国际承认,那就是水的“三相点”.1948年确定为273.16K,即绝对零度以上273.16度.当蒸气压等于一大气压时,水的正常冰点略低,为273.15K(=o℃=320°F),水的正常沸点为373.15K(=100℃=212°F).这些以摄氏温标表示的固定点和其他一些次要的测温参考点(即所谓的国际实用温标)的实际值,以及在实验室中为准确地获得这些值的度量方法,均由国际权度委员会定期公布.
1848年,英国科学家威廉·汽姆逊·开尔文勋爵(1824~1907)建立了一种新的温度标度,称为绝对温标,它的量度单位称为开尔文(K).这种标度的分度距离同摄氏温标的分度距离相同.它的零度即可能的最低温度,相当于摄氏零下273度(精确数为-273.15℃),称为绝对零度.因此,要算出绝对温度只需在摄氏温度上再加273即可.那时,人们认为温度永远不会接近于0K,但今天,科学家却已经非常接近这一极限了.
物体的温度实际上就是原子在物体内部的运动.当我们感到一个物体比较热的时候,就意味着它的原子在快速动动:当我们感到一个物体比较冷的时候,则意味着其内部的原子运动速度较慢.我们的身体是通过热或冷来感觉这种运动的,而物理学家则是绝对温标或称开尔文温标来测量温度的.
按照这种温标测量温度,绝对温度零度(0K)相当于摄氏零下273.15度(-273.15℃)被称为“绝对零度”,是自然界中可能的最低温度.在绝对零度下,原子的运动完全停止了,并且从理论上讲,气体的体积应当是零.由此,人们就会明白为什么温度不可能降到这个标度之下,为什么事实上甚至也不可能达到这个标度,而只能接近它.
自然界最冷的地方不是冬季的南极,而是在星际空间的深处,那里的温度是绝对温度3度(3K),即只比绝对零度高3度.
这个“热度”因为实际上我们谈到的温度总是在绝对零度之上)是作为宇宙起源的大爆炸留存至今的热度,事实上,这是证明大爆炸理论最显著有效的证据之一.
在实验室中人们可以做得更好,能进一步地接近于绝对零度,从上个世纪开始,人们就已经制成了能达到3K的制冷系统,并且在10多年前,在实验室里达到的最低温度已是绝对零度之上1/4度了,后来在1995年,科罗拉多大学和美国国家标准研究所的两位物理学家爱里克·科内尔和卡尔威曼成功地使一些铷原子达到了令人难以置信的温度,即达到了绝对零度之上的十亿分之二十度(2×10-8K).他们利用激光束和“磁陷阱”系统使原子的运动变慢,我们由此可以看到,热度实际上就是物质的原子运动.非常低的温度是可以达不到的,而且还要以寻求“阻止”每一单个原子运动,就像打台球一样,要使一个球停住就要用另一个球去打它.这了弄明白这个道理,只要想一想下面这个事实就够了.在常温下,气体的原子以每小时1600公里的速度运动着,而在3K的温度下则是以每小时1米的速度运动着,而在20nK(2×10-8K)的情况下,原子运动的速度就慢得难以测量了.在20nK下还可以发现物质呈现的新状态,这在70年前就被爱因斯坦和印度物理学家玻色(1894~1974)预见了.
事实上,在这样的非常温度下,物质呈现的既液体状态,也不是固体状态,更不是气体状态,而是聚集成唯一的“超原子”,它表现为一个单一的实体.计量上的零点有时是可以任意选取的,例如,经度零度是任意确
定的.温度的零点也是一样.在摄氏温标中,将冰的熔点取作零碎度;
而在华氏温标中,零碎度则处于冰的熔点以下.这两种温标中,温度
都可以低于零度.将近18世纪末的时候,人们开始觉得热是无尽头的,
但冷似乎是有极限的.既然冷有尽头,那么,这个尽头就是一种不可
超越的“零度”,于是,开尔文引进了开氏温标.开氏温标中的零度
是不可超越的,因而叫做“绝对零度”.这是“绝对”二字的一种物
理涵义.
1787年,法国物理学家查理发现,理想气体每冷却1摄氏度,其
体积就缩小它处于0℃时体积的1/273,这就是著名的查理定律.如
果理想气体被冷却的过程一直继续下去,那么它的温度降到-273℃时,
气体的体积岂非缩小到“零”了?在物理上,体积为零意味着气体完
全消失了,这当然是不会发生的.这是“绝对”的第二种涵义.实际
情况是,当气体冷却到一定温度后它总是先变为液体,然后又在更低
的温度下变为固体.
英国物理学家开尔文把温度作为物质分子运动速度的一种表述方
式,物质越冷其分子运动就越慢,分子运动中最最慢的就是完全不运
的分子,因此也不会有比它更低的温度.于是-273℃这个温度便是
一种真正的零度.这就是绝对零度“绝对”的第三层涵义.
绝对零度绝对零度表示那样一种温度,在此温度下,构成物质的所有分子和原子均停止运动.所谓运动,系指所有空间、机械、分子以及振动等运动.还包括某些形式的电子运动,然而它并不包括量子力学概念中的“零点运动”.除非瓦解运动粒子的集聚系统,否则就不能停止这种运动.从这一定义的性质来看,绝对零度是不可能在任何实验中达到的,但已达到绝对零度以上百万分之一度内的低温.所有这些在物质内部发生的分子和原子运动统称为“热运动”,这些运动是肉眼看不见的,但是我们会看到,它们决定了物质的大部分与温度有关的性质.正如一条直线仅由两点连成的一样,一种温标是由两个固定的且可重复的温度来定义的.最初,在一标准大气压(760毫米水银柱,或760托)时,摄氏温标是定冰之熔点为0℃和水之沸点为100℃,绝对温标是定绝对零度为oK和冰之熔点为273K,这样,就等于有三个固定点而导致温度的不一致,因为科学家希望这两种温标的度数大小朝等,所以,每当进行关于这三点的相互关系的准确实验时,总是将其中一点的数值改变达百分之一度.现在,除了绝对零度外,仅有一固定点获得国际承认,那就是水的“三相点”.1948年确定为273.16K,即绝对零度以上273.16度.当蒸气压等于一大气压时,水的正常冰点略低,为273.15K(=o℃=320°F),水的正常沸点为373.15K(=100℃=212°F).这些以摄氏温标表示的固定点和其他一些次要的测温参考点(即所谓的国际实用温标)的实际值,以及在实验室中为准确地获得这些值的度量方法,均由国际权度委员会定期公布.
绝对零度就是-273.16摄氏度.
这是现今技术所能测得的最低温度,但是在地球上还制造不出来,只有在冥王星由于距离太阳太远,才拥有这种温度.
在这种温度下,只存在固体.生命和思想都不能运行.
这是八年级物理第一册中的第三章的问题
绝对零度绝对零度表示那样一种温度,在此温度下,构成物质的所有分子和原子均停止运动.所谓运动,系指所有空间、机械、分子以及振动等运动.还包括某些形式的电子运动,然而它并不包括量子力学概念中的“零点运动”.除非瓦解运动粒子的集聚系统,否则就不能停止这种运动.从这一定义的性质来看,绝对零度是不可能在任何实验中达到的,但已达到绝对零度以上百万分之一度内的低温.所有这些在物质内部发生的分子和原子运动统称为“热运动”,这些运动是肉眼看不见的,但是我们会看到,它们决定了物质的大部分与温度有关的性质.正如一条直线仅由两点连成的一样,一种温标是由两个固定的且可重复的温度来定义的.最初,在一标准大气压(760毫米水银柱,或760托)时,摄氏温标是定冰之熔点为0℃和水之沸点为100℃,绝对温标是定绝对零度为oK和冰之熔点为273K,这样,就等于有三个固定点而导致温度的不一致,因为科学家希望这两种温标的度数大小朝等,所以,每当进行关于这三点的相互关系的准确实验时,总是将其中一点的数值改变达百分之一度.现在,除了绝对零度外,仅有一固定点获得国际承认,那就是水的“三相点”.1948年确定为273.16K,即绝对零度以上273.16度.当蒸气压等于一大气压时,水的正常冰点略低,为273.15K(=o℃=320°F),水的正常沸点为373.15K(=100℃=212°F).这些以摄氏温标表示的固定点和其他一些次要的测温参考点(即所谓的国际实用温标)的实际值,以及在实验室中为准确地获得这些值的度量方法,均由国际权度委员会定期公布.
1848年,英国科学家威廉·汽姆逊·开尔文勋爵(1824~1907)建立了一种新的温度标度,称为绝对温标,它的量度单位称为开尔文(K).这种标度的分度距离同摄氏温标的分度距离相同.它的零度即可能的最低温度,相当于摄氏零下273度(精确数为-273.15℃),称为绝对零度.因此,要算出绝对温度只需在摄氏温度上再加273即可.那时,人们认为温度永远不会接近于0K,但今天,科学家却已经非常接近这一极限了.
物体的温度实际上就是原子在物体内部的运动.当我们感到一个物体比较热的时候,就意味着它的原子在快速动动:当我们感到一个物体比较冷的时候,则意味着其内部的原子运动速度较慢.我们的身体是通过热或冷来感觉这种运动的,而物理学家则是绝对温标或称开尔文温标来测量温度的.
按照这种温标测量温度,绝对温度零度(0K)相当于摄氏零下273.15度(-273.15℃)被称为“绝对零度”,是自然界中可能的最低温度.在绝对零度下,原子的运动完全停止了,并且从理论上讲,气体的体积应当是零.由此,人们就会明白为什么温度不可能降到这个标度之下,为什么事实上甚至也不可能达到这个标度,而只能接近它.
自然界最冷的地方不是冬季的南极,而是在星际空间的深处,那里的温度是绝对温度3度(3K),即只比绝对零度高3度.
这个“热度”因为实际上我们谈到的温度总是在绝对零度之上)是作为宇宙起源的大爆炸留存至今的热度,事实上,这是证明大爆炸理论最显著有效的证据之一.
在实验室中人们可以做得更好,能进一步地接近于绝对零度,从上个世纪开始,人们就已经制成了能达到3K的制冷系统,并且在10多年前,在实验室里达到的最低温度已是绝对零度之上1/4度了,后来在1995年,科罗拉多大学和美国国家标准研究所的两位物理学家爱里克·科内尔和卡尔威曼成功地使一些铷原子达到了令人难以置信的温度,即达到了绝对零度之上的十亿分之二十度(2×10-8K).他们利用激光束和“磁陷阱”系统使原子的运动变慢,我们由此可以看到,热度实际上就是物质的原子运动.非常低的温度是可以达不到的,而且还要以寻求“阻止”每一单个原子运动,就像打台球一样,要使一个球停住就要用另一个球去打它.这了弄明白这个道理,只要想一想下面这个事实就够了.在常温下,气体的原子以每小时1600公里的速度运动着,而在3K的温度下则是以每小时1米的速度运动着,而在20nK(2×10-8K)的情况下,原子运动的速度就慢得难以测量了.在20nK下还可以发现物质呈现的新状态,这在70年前就被爱因斯坦和印度物理学家玻色(1894~1974)预见了.
事实上,在这样的非常温度下,物质呈现的既液体状态,也不是固体状态,更不是气体状态,而是聚集成唯一的“超原子”,它表现为一个单一的实体.
绝对零度绝对零度表示那样一种温度,在此温度下,构成物质的所有分子和原子均停止运动.所谓运动,系指所有空间、机械、分子以及振动等运动.还包括某些形式的电子运动,然而它并不包括量子力学概念中的“零点运动”.除非瓦解运动粒子的集聚系统,否则就不能停止这种运动.从这一定义的性质来看,绝对零度是不可能在任何实验中达到的,但已达到绝对零度以上百万分之一度内的低温.所有这些在物质内部发生的分子和原子运动统称为“热运动”,这些运动是肉眼看不见的,但是我们会看到,它们决定了物质的大部分与温度有关的性质.正如一条直线仅由两点连成的一样,一种温标是由两个固定的且可重复的温度来定义的.最初,在一标准大气压(760毫米水银柱,或760托)时,摄氏温标是定冰之熔点为0℃和水之沸点为100℃,绝对温标是定绝对零度为oK和冰之熔点为273K,这样,就等于有三个固定点而导致温度的不一致,因为科学家希望这两种温标的度数大小朝等,所以,每当进行关于这三点的相互关系的准确实验时,总是将其中一点的数值改变达百分之一度.现在,除了绝对零度外,仅有一固定点获得国际承认,那就是水的“三相点”.1948年确定为273.16K,即绝对零度以上273.16度.当蒸气压等于一大气压时,水的正常冰点略低,为273.15K(=o℃=320°F),水的正常沸点为373.15K(=100℃=212°F).这些以摄氏温标表示的固定点和其他一些次要的测温参考点(即所谓的国际实用温标)的实际值,以及在实验室中为准确地获得这些值的度量方法,均由国际权度委员会定期公布.
1848年,英国科学家威廉·汽姆逊·开尔文勋爵(1824~1907)建立了一种新的温度标度,称为绝对温标,它的量度单位称为开尔文(K).这种标度的分度距离同摄氏温标的分度距离相同.它的零度即可能的最低温度,相当于摄氏零下273度(精确数为-273.15℃),称为绝对零度.因此,要算出绝对温度只需在摄氏温度上再加273即可.那时,人们认为温度永远不会接近于0K,但今天,科学家却已经非常接近这一极限了.
物体的温度实际上就是原子在物体内部的运动.当我们感到一个物体比较热的时候,就意味着它的原子在快速动动:当我们感到一个物体比较冷的时候,则意味着其内部的原子运动速度较慢.我们的身体是通过热或冷来感觉这种运动的,而物理学家则是绝对温标或称开尔文温标来测量温度的.
按照这种温标测量温度,绝对温度零度(0K)相当于摄氏零下273.15度(-273.15℃)被称为“绝对零度”,是自然界中可能的最低温度.在绝对零度下,原子的运动完全停止了,并且从理论上讲,气体的体积应当是零.由此,人们就会明白为什么温度不可能降到这个标度之下,为什么事实上甚至也不可能达到这个标度,而只能接近它.
自然界最冷的地方不是冬季的南极,而是在星际空间的深处,那里的温度是绝对温度3度(3K),即只比绝对零度高3度.
这个“热度”因为实际上我们谈到的温度总是在绝对零度之上)是作为宇宙起源的大爆炸留存至今的热度,事实上,这是证明大爆炸理论最显著有效的证据之一.
在实验室中人们可以做得更好,能进一步地接近于绝对零度,从上个世纪开始,人们就已经制成了能达到3K的制冷系统,并且在10多年前,在实验室里达到的最低温度已是绝对零度之上1/4度了,后来在1995年,科罗拉多大学和美国国家标准研究所的两位物理学家爱里克·科内尔和卡尔威曼成功地使一些铷原子达到了令人难以置信的温度,即达到了绝对零度之上的十亿分之二十度(2×10-8K).他们利用激光束和“磁陷阱”系统使原子的运动变慢,我们由此可以看到,热度实际上就是物质的原子运动.非常低的温度是可以达不到的,而且还要以寻求“阻止”每一单个原子运动,就像打台球一样,要使一个球停住就要用另一个球去打它.这了弄明白这个道理,只要想一想下面这个事实就够了.在常温下,气体的原子以每小时1600公里的速度运动着,而在3K的温度下则是以每小时1米的速度运动着,而在20nK(2×10-8K)的情况下,原子运动的速度就慢得难以测量了.在20nK下还可以发现物质呈现的新状态,这在70年前就被爱因斯坦和印度物理学家玻色(1894~1974)预见了.
事实上,在这样的非常温度下,物质呈现的既不是液体状态,也不是固体状态,更不是气体状态,而是聚集成唯一的“超原子”,它表现为一个单一的实体.:1年前查看全部
- (2012•广州二模)一定质量的理想气体由状态A变化到状态B,气体的压强随热力学温度变化如图所示,则此过程( )
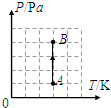 (2012•广州二模)一定质量的理想气体由状态A变化到状态B,气体的压强随热力学温度变化如图所示,则此过程( )
(2012•广州二模)一定质量的理想气体由状态A变化到状态B,气体的压强随热力学温度变化如图所示,则此过程( )
A.气体的密度增大
B.外界对气体做功
C.气体从外界吸收了热量
D.气体分子的平均动能增大 Belle19841年前1
Belle19841年前1 -
 妙居阿九 共回答了19个问题
妙居阿九 共回答了19个问题 |采纳率94.7%解题思路:由图象可知,由A到B过程,气体温度不变,压强变大,由玻意耳定律可以判断出气体体积如何变化;气体体积变大,气体对外做功,体积减小,外界对气体做功;温度是分子平均动能的标志,理想气体内能由温度决定.由图线可知,在从A到B的过程中,气体温度不变,压强变大,由玻意耳定律可知,气体体积变小,VB<VA;
A、气体质量不变,体积变小,由密度公式可知气体密度变大,故A正确;
B、气体体积变小,外界对气体做功,故B正确;
C、气体温度不变,内能不变,△U=0,外界对气体做功,W>0,由热力学第一定律△U=Q+W可知:Q<0,气体要放出热量,故C错误;
D、气体温度不变,分子平均动能不变,故D错误;
故选AB.点评:
本题考点: 理想气体的状态方程;热力学第一定律.
考点点评: 根据图象,应用玻意耳定律判断出气体体积如何变化是正确解题的前提与关键,判断气体是吸热还是放热,要注意热力学第一定律的应用.1年前查看全部
- 我们现在常用的温度单位是______,它的符号是______.实际上,国际单位制中采用热力学温度,这种温度的单位名称叫_
我们现在常用的温度单位是______,它的符号是______.实际上,国际单位制中采用热力学温度,这种温度的单位名称叫______,符号是______.
 bjsindy1年前1
bjsindy1年前1 -
 ceman 共回答了20个问题
ceman 共回答了20个问题 |采纳率75%解题思路:根据温度的常用单位和国际单位以及符号填空.们现在常用的温度单位是摄氏度,符号是℃;
国际单位制中,温度的单位是开尔文,符号是K.
故答案为:摄氏度;℃;开尔文;K.点评:
本题考点: 摄氏温度及其计算.
考点点评: 本题考查了温度单位的相关知识,都是比较基本的内容,属于基础知识的考查.1年前查看全部
- 某物体的温度是零下173摄氏度,则相当于热力学温度的多少K,
 薛鹤林1年前2
薛鹤林1年前2 -
 第十三个勇士 共回答了20个问题
第十三个勇士 共回答了20个问题 |采纳率95%某物体的温度是零下173摄氏度,则相当于热力学温度的多少100K.
说明:
摄氏温度与热力学温度之间的关系式是:
T=(273.15+t)K (其中,T为热力学温度;t为摄氏温度)1年前查看全部
- 使用温度计时应使被测物体-----,其中被测物体的温度不能超过---.热力学温度与摄氏度的关系是---,热力学温度的单位
使用温度计时应使被测物体-----,其中被测物体的温度不能超过---.热力学温度与摄氏度的关系是---,热力学温度的单位是---,用---,43℃合热力学温度是----.
 200301299931年前2
200301299931年前2 -
 张嘎zz 共回答了21个问题
张嘎zz 共回答了21个问题 |采纳率95.2%使用温度计时应使被测物体 与温度计的玻璃泡充分接触,
其中被测物体的温度不能超过 温度计的量程.
热力学温度与摄氏度的关系是: 热力学温度=摄氏温度+273.15 ,
热力学温度的单位是 开尔文 ,用 K表示,43℃合热力学温度是 316.15K.1年前查看全部
- 1、国际单位制中采用热力学温度,这种温度的单位名称叫作( ),符号是( ).
1、国际单位制中采用热力学温度,这种温度的单位名称叫作( ),符号是( ).
2、使用温度计测量液体温度时,温度计的玻璃泡要( )被测液体中,但不能使玻璃泡碰到( )或( ).
3、温度是表示物体( )的物理量.
4、使用温度计前应观察它的:(1) (1) .
5、晶体熔化的特点是:给晶体加热在没有达到它的熔化温度(熔点)之前,他的温度是( )的,但并不熔化.当温度达到它的熔点时,继续加热,晶体渐渐熔化,但温度( ).当晶体全部熔化成液体后,继续加热,他的温度( ).这说明了晶体是在( ).
6、根据晶体熔化的特点,可以归纳出晶体熔化必须满足的两个条件:一是必须是它的温度达到( ),二是必须对它继续加热,他的温度( ).这说明了晶体是在( ).
1、国际单位制中采用热力学温度,这种温度的单位名称叫作( ),符号是( ).
2、使用温度计测量液体温度时,温度计的玻璃泡要( )被测液体中,但不能使玻璃泡碰到( )或( ).
3、温度是表示物体( )的物理量.
4、使用温度计前应观察它的:(1) (1) .
5、晶体熔化的特点是:给晶体加热在没有达到它的熔化温度(熔点)之前,他的温度是( )的,但并不熔化.当温度达到它的熔点时,继续加热,晶体渐渐熔化,但温度( ).当晶体全部熔化成液体后,继续加热,他的温度( ).这说明了晶体是在( ).
6、根据晶体熔化的特点,可以归纳出晶体熔化必须满足的两个条件:一是必须是它的温度达到( ),二是必须对它继续( ),这说明熔化过程是吸热的过程. 日暮织姬1年前1
日暮织姬1年前1 -
 三十rr 共回答了23个问题
三十rr 共回答了23个问题 |采纳率91.3%1、国际单位制中采用热力学温度,这种温度的单位名称叫作( 开尔文),符号是(K ).
2、使用温度计测量液体温度时,温度计的玻璃泡要(浸入 )被测液体中,但不能使玻璃泡碰到(容器底 )或( 容器壁).
3、温度是表示物体( 内能)的物理量.
4、使用温度计前应观察它的:(1量程) (1型式) .
5、晶体熔化的特点是:给晶体加热在没有达到它的熔化温度(熔点)之前,
他的温度是( 升高)的,但并不熔化.当温度达到它的熔点时,继续加热,
晶体渐渐熔化,但温度(不变 ).当晶体全部熔化成液体后,继续加热,他的温度(升高 ).这说明了晶体是在( ).
6、根据晶体熔化的特点,可以归纳出晶体熔化必须满足的两个条件
:一是必须是它的温度达到( 熔点),二是必须对它继续加热,他的温度(不变 ).
这说明了晶体是在(熔化过程中温度不变的固体 ).1年前查看全部
- 为什么在理想气体状态方程中要用热力学温度
 xiaolingzi1021年前1
xiaolingzi1021年前1 -
 专业看客 共回答了16个问题
专业看客 共回答了16个问题 |采纳率81.3%还能使用理想气体状态方程 PV=nRT,在加热的过程中,P、V、R都不变,(注意T用热力学温度,T=t+273) 当作一个整体,研究127度时的体积是,1年前查看全部
- 下列各图中,P表示压强,V表示体积,T表示热力学温度,t表示摄氏温度,各图中正确描述一定质量理想气体等压变化规律的是(
下列各图中,P表示压强,V表示体积,T表示热力学温度,t表示摄氏温度,各图中正确描述一定质量理想气体等压变化规律的是( ) A. 
B. 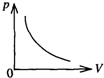
C. 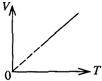
D. 
 nnsteed1年前1
nnsteed1年前1 -
 songdeng 共回答了22个问题
songdeng 共回答了22个问题 |采纳率95.5%气体做等压变化,B、D图象中的压强变化,故A正确,BD错误;
根据气态方程:
PV
T =C (常数),有 V=
C
P T 由于是等压变化,故
C
P 为常数,因此V-T图为过原点的直线,故C正确.
故选AC.1年前查看全部
- 以下说法不正确的是:( ) A.布朗运动和扩散现象都是分子的运动; B.热力学温度的单位“K”是国
以下说法不正确的是:()
A.布朗运动和扩散现象都是分子的运动; B.热力学温度的单位“K”是国际单位制中的基本单位 C.液体表面张力的作用是使液体表面收缩; D.液晶是介于固态和液态之间的中间态;  adenxiao1年前1
adenxiao1年前1 -
 wanpaizz 共回答了16个问题
wanpaizz 共回答了16个问题 |采纳率87.5%A
布朗运动是微笑颗粒的运动,扩散运动是分子的运动,所以A错误。热力学温度的单位“K”是国际单位制中的基本单位,B正确。液体表面张力的作用是使液体表面收缩,C正确。液晶是介于固态和液态之间的中间态,D正确。1年前查看全部
- (2010•长宁区二模)下列两图中,P表示压强,T表示热力学温度,t表示摄氏温度,甲图反映的是一定质量气体的状态变化规律
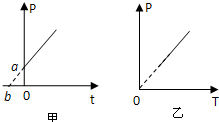 (2010•长宁区二模)下列两图中,P表示压强,T表示热力学温度,t表示摄氏温度,甲图反映的是一定质量气体的状态变化规律,a、b分别是图线与两坐标的交点,现将纵坐标向左平移至b,得到图乙.则下列说法错误的是( )
(2010•长宁区二模)下列两图中,P表示压强,T表示热力学温度,t表示摄氏温度,甲图反映的是一定质量气体的状态变化规律,a、b分别是图线与两坐标的交点,现将纵坐标向左平移至b,得到图乙.则下列说法错误的是( )
A.甲图中a表示气体在零摄氏度时的压强
B.甲图中b表示气体的实际温度可以达到-273℃
C.单从甲图不能判断气体是否作等容变化
D.气体压强P随温度t发生变化,且体积保持不变 uzb6z1年前1
uzb6z1年前1 -
 某杨 共回答了14个问题
某杨 共回答了14个问题 |采纳率100%解题思路:甲图是P-t图,乙图是P-T图,结合盖-吕萨克定律PT=C分析即可.A、甲图中,可以看出横坐标为零时纵坐标为a,故a表示气体在零摄氏度时的压强大小,故A正确;
B、甲图中,当纵坐标为零时,横坐标为b,故b表示温度-273℃,但这个温度永远达不到,故B错误;
C、由于不知道b是否等于-273°C,故单从甲图不能判断气体是否作等容变化,故C正确;
D、从乙图可以看出,
P
T=C,故气体体积保持不变,故D正确;
本题选错误的,故选B.点评:
本题考点: 理想气体的状态方程.
考点点评: 本题是P-t图与P-T图的比较,也是热力学温标定义的依据,不难.1年前查看全部
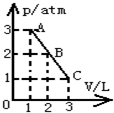
- 一定质量的理想气体体积V与热力学温度T的关系图象如图所示,气体在状态A时的压强p 0 =1.0×10 5 Pa,线段AB
一定质量的理想气体体积V与热力学温度T的关系图象如图所示,气体在状态A时的压强p 0 =1.0×10 5 Pa,线段AB与V轴平行.
(1)求状态B时的压强.
(2)气体从状态A变化到状态B过程中,对外界做的功为10J,求该过程中气体吸收的热量.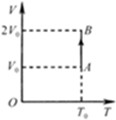
 记得爱1年前1
记得爱1年前1 -
 思媚儿_ss 共回答了19个问题
思媚儿_ss 共回答了19个问题 |采纳率89.5%(1)A→B过程,气体发生等温变化,体积增加为2倍,根据玻意耳定律得:
p 0 V 0 =p B (2V 0 )
则:p B =
1
2 p 0 =5×10 4 Pa
(2)A→B过程,气体的内能不变,即△U=0,由热力学第一定律得:
△U=Q+W,
则得Q=-W=10J
答:(1)状态B时的压强为5×10 4 Pa.
(2)气体从状态A变化到状态B过程中,吸收的热量为10J.1年前查看全部
- 封闭在气缸内一定质量的理想气体由状态A变到状态D,其体积V与热力学温度关T系如图所示,该气体的摩尔质量为M,状态A的体积
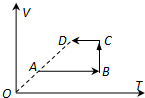 封闭在气缸内一定质量的理想气体由状态A变到状态D,其体积V与热力学温度关T系如图所示,该气体的摩尔质量为M,状态A的体积为V0,温度为T0,O、A、D三点在同一直线上,阿伏伽德罗常数为NA.由状态A变到状态D过程中( )
封闭在气缸内一定质量的理想气体由状态A变到状态D,其体积V与热力学温度关T系如图所示,该气体的摩尔质量为M,状态A的体积为V0,温度为T0,O、A、D三点在同一直线上,阿伏伽德罗常数为NA.由状态A变到状态D过程中( )
A.气体从外界吸收热量,内能增加
B.气体体积增大,分子的密集程度增大
C.气体温度升高,每个气体分子的动能都会增大
D.气体的密度不变 我喜欢美食1年前1
我喜欢美食1年前1 -
 dougeloul 共回答了17个问题
dougeloul 共回答了17个问题 |采纳率94.1%解题思路:气体由状态A变到状态D过程中,温度升高,内能增大;体积增大,气体对外做功,由热力学第一定律分析吸放热情况.温度是分子平均动能的标志,温度升高,分子的平均动能增大.根据体积变化,分析密度变化.A、气体由状态A变到状态D过程中,温度升高,内能增大;体积增大,气体对外做功,由热力学第一定律分析得知,气体从外界吸收热量.故A正确.
B、由图看出气体的体积增大,单位体积内的分子数=
n总
V,分子总数不变、体积增大时分子密集程度减小,故B错误.
C、气体温度升高,分子的平均动能增大,但不是每个气体分子的动能都会增大.故C错误.
D、气体的质量一定,体积增大,则密度减小.故D错误.
故选:A.点评:
本题考点: 理想气体的状态方程.
考点点评: 本题关键是知道分子的密集程度和气体的密度的计算公式,基础题.1年前查看全部
- 常人的体温为37℃,则此时的华氏温度约为 ,热力学温度约为 .
常人的体温为37℃,则此时的华氏温度约为 ,热力学温度约为 .
它们之间的换算过程是怎样了? xtj32411781年前2
xtj32411781年前2 -
 暗暖 共回答了26个问题
暗暖 共回答了26个问题 |采纳率100%37摄氏度=98.6华氏度
摄氏度,用符号“℃”表示,摄氏温度与华氏温度的换算式是:5(F- 50º)= 9(C-10º) ,式中F-华氏温度,C-摄氏温度.
热力学温度为37+273=3101年前查看全部
- 物理题目关于摄氏温度和热力学温度的
物理题目关于摄氏温度和热力学温度的
下列哪种说法正确( )
A.100℃比100K温度低
B.-119℃比54K温度低
C.-272℃比2K温度高
D.就每一度的大小来说,热力学温度和摄氏温度是相同的.
怎么来判断呐 郁闷有理1年前5
郁闷有理1年前5 -
 笑脸盈盈 共回答了21个问题
笑脸盈盈 共回答了21个问题 |采纳率100%答案是 D
由于 T{K}=t{℃}+273.15
所以,可以得知,A、B、C均不对.
对于 D ,显然有 △T{K}=△t{℃},即增加1K(或减少1K),摄氏度也会增加1℃(或减少1℃).因而 D 是对的.
其实,这道题如果是单项选择的话,D肯定是对的,是可以不用计算A、B、C的.1年前查看全部
- 物理中的T=273+t为什么是用摄氏度加0度热力学温度而不是别的
 江小篱1年前2
江小篱1年前2 -
 lulu_meiqiu 共回答了30个问题
lulu_meiqiu 共回答了30个问题 |采纳率86.7%这是物理学的规定啊,约定俗成摄氏温度是以纯水结冰的温度作为0度,纯水沸腾的温度作为100度,直接平均分成100份,每一份就是1摄氏度开氏温度是以最低温度-273度作为起点,即0K(注:0K是理论温度,实际中只能无限接近OK,不能达到),每1K就是1摄氏度.开氏温度没有负数,同时开氏温度也是温度的基本单位1年前查看全部
- 摄氏度与热力学温度的关系?
 w0sh1kge1年前4
w0sh1kge1年前4 -
 xj艳子 共回答了13个问题
xj艳子 共回答了13个问题 |采纳率76.9%热力学温度 = 摄氏温度+273 .151年前查看全部
- 封闭在气缸内一定质量的理想气体由状态A变到状态D,其体积V与热力学温度T的关系如图所示,该气体的摩尔质量为M,状态A的体
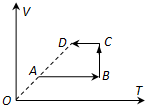 封闭在气缸内一定质量的理想气体由状态A变到状态D,其体积V与热力学温度T的关系如图所示,该气体的摩尔质量为M,状态A的体积为V0,温度为T0,O、A、D三点在同一直线上,阿伏伽德罗常数为NA.
封闭在气缸内一定质量的理想气体由状态A变到状态D,其体积V与热力学温度T的关系如图所示,该气体的摩尔质量为M,状态A的体积为V0,温度为T0,O、A、D三点在同一直线上,阿伏伽德罗常数为NA.
(1)在上述过程中,气体对外做功为5J,内能增加9J,则气体______(选填“吸收”或“放出”)热量______J.
(2)在状态D,该气体的密度为ρ,体积为2V0,则状态D的温度为多少?该气体的分子数为多少? 苦仔1年前1
苦仔1年前1 -
 彩虹涟漪 共回答了25个问题
彩虹涟漪 共回答了25个问题 |采纳率88%解题思路:(1)根据热力学第一定律求解气体的吸或放热量.
(2)根据气态方程求解状态D的温度.求出摩尔数,可求得分子数.①气体对外做功为5J,则W=-5J,内能增加9J,则△U=9J,由热力学第一定律△U=W+Q得,Q=14J,即吸热14J.②由题意可知,A、D两状态的压强相等,则v0T0=2v0TD,解得TD=2T0气体的摩尔数n=ρ2v0M分子个数为N=nNA=2ρv0NA...
点评:
本题考点: 理想气体的状态方程;热力学第一定律.
考点点评: 本题运用热力学第一定律和气态方程结合,分析气体状态的变化及变化过程中能量的变化.1年前查看全部
- 为什么摄氏温度与热力学温度都不可能取负值
 GLOVERDONG1年前3
GLOVERDONG1年前3 -
 冰来酱档 共回答了19个问题
冰来酱档 共回答了19个问题 |采纳率84.2%摄氏温度可以取负的阿,不过不能负过273.15.
热力学温度是不能取负没错,因为他的零点本来就是标在绝对零度.温度代表的是微粒运动的剧烈程度,而绝对零度就是"不动",所以不会有更低的了.1年前查看全部
- 一定质量的某种理想气体的体积V与热力学温度T的关系图象如图所示,气体在状态A 时压强p0=1.0×105Pa、
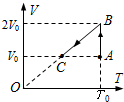 一定质量的某种理想气体的体积V与热力学温度T的关系图象如图所示,气体在状态A 时压强p0=1.0×105Pa、体积V0=800cm3,线段AB与V轴平行,BC延长线过坐标原点O.
一定质量的某种理想气体的体积V与热力学温度T的关系图象如图所示,气体在状态A 时压强p0=1.0×105Pa、体积V0=800cm3,线段AB与V轴平行,BC延长线过坐标原点O.
①求该气体状态B时的压强;
②已知该气体从状态B变化到状态C过程中,向外界放热60J,求该过程中气体内能的变化量. shengming1年前1
shengming1年前1 -
 yingying_426 共回答了23个问题
yingying_426 共回答了23个问题 |采纳率95.7%解题思路:①从A→B过程,气体发生等温变化,根据玻意耳定律求状态B时的压强.②从B→C过程,气体的压强不变,根据热力学第一定律求气体内能的变化.①A到B是等温变化,压强和体积成反比,根据玻意耳定律有:
pAVA=pBVB
解得:pB=5×104 Pa
②状态B至状态C过程是等压压缩过程,外界对气体做功:
W=pB△V=40J
根据热力学第一定律有:
△U=W+Q=40J+(-60J)=-20J,即内能减小20J.
答:①该气体状态B时的压强5×104 Pa;
②该过程中气体内能减小20J.点评:
本题考点: 热力学第一定律;气体的等容变化和等压变化.
考点点评: 本题第一问关键根据玻意耳定律列式求解,第二问关键根据热力学第一定律列式求解,注意理想气体的内能与热力学温度成正比.1年前查看全部
- 热力学温度与摄氏温度换算公式0℃=( )k 100k=( )℃ -273℃=( )k273k=( )℃
 wcfwch1年前2
wcfwch1年前2 -
 鹏鹏9595 共回答了18个问题
鹏鹏9595 共回答了18个问题 |采纳率94.4%0℃=( 273 )k 100k=( -173 )℃ -273℃=( 0 )k[顺便说下 是绝对0度 ]
273k=( 0 )℃
公式就是热力学温度=摄氏温度+2731年前查看全部
- 热力学温度与摄氏度的关系
 howieyung1年前1
howieyung1年前1 -
 jan10 共回答了11个问题
jan10 共回答了11个问题 |采纳率81.8%摄氏温度t与热力学温度T的换算关系是
t = T-273.15℃.1年前查看全部
- 一容器贮有某种理想气体,其分子平均自由程为 ,若气体的热力学温度降到原来的一半,但体积不变,分子作用
一容器贮有某种理想气体,其分子平均自由程为 ,若气体的热力学温度降到原来的一半,但体积不变,分子作用
一容器贮有某种理想气体,其分子平均自由程为 X,若气体的热力学温度降到原来的一半,但体积不变,分子作用球半径不变,则此时平均自由程为

 弟弟12号1年前2
弟弟12号1年前2 -
 yjsydh 共回答了18个问题
yjsydh 共回答了18个问题 |采纳率100%(B)不变1年前查看全部
- (热力学温度和摄氏温度)科学题初一的科学题:比如(1)某电视台报道,今天的气温是18℃,这里表示温度用的是哪一种表示方法
(热力学温度和摄氏温度)科学题
初一的科学题:比如(1)某电视台报道,今天的气温是18℃,这里表示温度用的是哪一种表示方法?
(2)上题中如果用热力学温度来表示今天的气温,应该是多少?
第二提请说明计算过程,谢谢!
希望大家尽快给我答复~!
THANKS! 胡同抬扛狂1年前1
胡同抬扛狂1年前1 -
 现代女性 共回答了18个问题
现代女性 共回答了18个问题 |采纳率94.4%(1)当然是用的摄氏温标(欧美的很多用华氏温标,摄氏温标单位是℃,华氏温标℉)
(2)热力学温度T与摄氏温标t的换算关系:T=273+t
所以t=18℃,T=291K(T的单位是开尔文,简称开,符号K,热力学温标与摄氏温标的变化梯度是相同的。。)
这是高中物理的内容,现在初中的热学是不学的。。高中的热力学第三定律就指出热力学零度即T=0K是不能达到的。。热力学很多地方都要用的。。1年前查看全部
- (8分)封闭在气缸内一定质量的理想气体由状态A变到状态D,其体积V与热力学温度关T系如图所示,该气体的摩尔质量为M,状态
(8分)封闭在气缸内一定质量的理想气体由状态A变到状态D,其体积V与热力学温度关T系如图所示,该气体的摩尔质量为M,状态A的体积为V 0 ,温度为T 0 ,O、A、D三点在同一直线上,阿伏伽德罗常数为N A 。

(1)由状态A变到状态D过程中
A.气体从外界吸收热量,内能增加
B.气体体积增大,单位时间内与器壁单位面积碰撞的分子数减少
C.气体温度升高,每个气体分子的动能都会增大
D.气体的密度不变
(2)在上述过程中,气体对外做功为5J,内能增加9J,则气体 (选“吸收”或“放出”)热量 J。 x的不好请原谅1年前1
x的不好请原谅1年前1 -
 babybluesx 共回答了16个问题
babybluesx 共回答了16个问题 |采纳率93.8%(1)AB (4分)(2)吸收;14J (各2分)
由状态A变到状态D,体积增大,对外做功,温度升高,内能增大,则从外界吸收热量,A正确;体积增大,压强不变,则单位时间内与器壁单位面积碰撞的分子数减少,B正确;气体温度升高,并不是每个气体分子的动能都增大,C正确;质量不变,体积变大,则密度变小,D错误。1年前查看全部
- 据热力学温度T和摄氏度t之间的数据关系,做以下换算
据热力学温度T和摄氏度t之间的数据关系,做以下换算
(1)室温为27℃,和多少K?固态氧的熔点为-259℃,和多少k?
(2)固态水银的熔点为234K,和多少摄氏度?太阳表面温度为6000K,和多少摄氏度?
(3)早晚气温差为10℃,和多少K? chris小新1年前4
chris小新1年前4 -
 番薯灌水专用 共回答了26个问题
番薯灌水专用 共回答了26个问题 |采纳率88.5%T=(9/5)t+32,这个是摄氏温标与华氏温标的换算
T=273+t,T是热力学温度,t摄氏度,没有带单位
室温为27℃,和300K.固态氧的熔点为-259℃,和14k
(2)固态水银的熔点为234K,和-39摄氏度?太阳表面温度为6000K,和5727摄氏度
(3)早晚气温差为10℃,和10K1年前查看全部
- 封闭在气缸内一定质量的理想气体由状态A变到状态D,其体积V与热力学温度关T系如图所示,该气体的摩尔质量为M,状态A的体积
封闭在气缸内一定质量的理想气体由状态A变到状态D,其体积V与热力学温度关T系如图所示,该气体的摩尔质量为M,状态A的体积为V 0 ,温度为T 0 ,O、A、D三点在同一直线上,阿伏伽德罗常数为N A 。 
(1)由状态A变到状态D过程中 [ ]A.气体从外界吸收热量,内能增加
B.气体体积增大,单位时间内与器壁单位面积碰撞的分子数减少
C.气体温度升高,每个气体分子的动能都会增大
D.气体的密度不变
(2)在上述过程中,气体对外做功为5J,内能增加9J,则气体____________(选“吸收”或“放出”)热量____________J。
(3)在状态D,该气体的密度为ρ,体积为2V 0 ,则状态D的温度为多少?该气体的分子数为多少? w844702461年前1
w844702461年前1 -
 一碗面汤 共回答了23个问题
一碗面汤 共回答了23个问题 |采纳率95.7%1年前查看全部
- 43℃合热力学温度是多少
 恋宇迷迷1年前2
恋宇迷迷1年前2 -
 benmouse98 共回答了20个问题
benmouse98 共回答了20个问题 |采纳率90%热力学温度是开尔文k
(T)k=273.15+(T)c
为43+273.151年前查看全部
- T=t+273K西安市气温是18摄氏度,用热力学温度表示是多少
 霍小乱1年前1
霍小乱1年前1 -
 马肿背001 共回答了25个问题
马肿背001 共回答了25个问题 |采纳率96%18+273=2911年前查看全部
- 封闭在气缸内一定质量的理想气体由状态A变到状态D,其体积V与热力学温度关T系如图所示,该气体的摩尔质量为M,状态A的体积
 封闭在气缸内一定质量的理想气体由状态A变到状态D,其体积V与热力学温度关T系如图所示,该气体的摩尔质量为M,状态A的体积为V0,温度为T0,O、A、D三点在同一直线上,阿伏伽德罗常数为NA.
封闭在气缸内一定质量的理想气体由状态A变到状态D,其体积V与热力学温度关T系如图所示,该气体的摩尔质量为M,状态A的体积为V0,温度为T0,O、A、D三点在同一直线上,阿伏伽德罗常数为NA.
(1)由状态A变到状态D过程中______
A.气体从外界吸收热量,内能增加
B.气体体积增大,单位时间内与器壁单位面积碰撞的分子数减少
C.气体温度升高,每个气体分子的动能都会增大
D.气体的密度不变
(2)在上述过程中,气体对外做功为5J,内能增加9J,则气体______(选“吸收”或“放出”)热量______J. 3326094931年前1
3326094931年前1 -
 aabule 共回答了16个问题
aabule 共回答了16个问题 |采纳率100%解题思路:(1)气体由状态A变到状态D过程中,温度升高,内能增大;体积增大,气体对外做功,由热力学第一定律分析吸放热情况.温度是分子平均动能的标志,温度升高,分子的平均动能增大.根据体积变化,分析密度变化.(2)根据热力学第一定律求解气体的吸或放热量.(3)根据气态方程求解状态D的温度.求出摩尔数,可求得分子数.(1)A、气体由状态A变到状态D过程中,温度升高,内能增大;体积增大,气体对外做功,由热力学第一定律分析得知,气体从外界吸收热量.故A正确.
B、由图看出气体的体积增大,由图看出,两个状态的V与T成正比,由气态方程[PV/T]=C分析得知,两个状态的压强相等,体积增大时,单位时间内与器壁单位面积碰撞的分子数减少.故B正确.
C、气体温度升高,分子的平均动能增大,但不是每个气体分子的动能都会增大.故C错误.
D、气体的质量一定,体积增大,则密度减小.故D错误.
故选AB
(2)气体对外做功为5J,则W=-5J,内能增加9J,则△U=9J,由热力学第一定律△U=W+Q得,Q=14J,即吸热14J.
故答案为:
(1)AB
(2)吸收,14点评:
本题考点: 理想气体的状态方程.
考点点评: 本题运用热力学第一定律和气态方程结合,分析气体状态的变化及变化过程中能量的变化.1年前查看全部
- 热力学温度与摄氏度的关系是?热力学温度的单位是?来表达
 专门来抢沙发1年前1
专门来抢沙发1年前1 -
 callinsoul 共回答了11个问题
callinsoul 共回答了11个问题 |采纳率100%一热力学温度单位等于一摄氏度单位.热力学温度单位开尔文,用K表示.1K=1°C1年前查看全部
- 关于热力学温度,下列说法中正确的是 [ ] A.一般近似认为-33 ℃=
关于热力学温度,下列说法中正确的是 [ ]A.一般近似认为-33 ℃=240K
B.温度变化1 ℃,也就是温度变化1K
C.摄氏温度与热力学温度都可能取负值
D.温度由t ℃升至2t ℃,对应的热力学温度升高了t+273K ruruzheng1年前1
ruruzheng1年前1 -
 七月冬 共回答了22个问题
七月冬 共回答了22个问题 |采纳率90.9%AB1年前查看全部
- 关于热力学温度越高内能越大 内能越大温度越高哪种说法正确
 厌厌kongkong1年前4
厌厌kongkong1年前4 -
 sun陈瑾 共回答了22个问题
sun陈瑾 共回答了22个问题 |采纳率77.3%第一对,冰在融化过程中吸热内能增大而温度不变.1年前查看全部
- 1.一个系统中的气体温度为30度,体积为0.08m3,气体的质量为0.062kg,求气体的热力学温度、密度和比体积.
 fatfishson1年前2
fatfishson1年前2 -
 ytmlwgk520 共回答了15个问题
ytmlwgk520 共回答了15个问题 |采纳率93.3%热力学温度 273+30K273为热力学与摄氏温度的换算关系 密度为0、775Kg/m3 比体积是密度的倒数 1、271年前查看全部
- (2013•淮安模拟)一定质量的理想气体压强p与热力学温度T的关系图象如图,AB、BC分别与p轴、T轴平行,气体在状态A
 (2013•淮安模拟)一定质量的理想气体压强p与热力学温度T的关系图象如图,AB、BC分别与p轴、T轴平行,气体在状态A时体积为V0,则在状态C时的体积为______;从状态A经状态B变化到状态C的过程中,气体对外界做功为W,内能增加了△U,则此过程中该气体吸收的热量为______.
(2013•淮安模拟)一定质量的理想气体压强p与热力学温度T的关系图象如图,AB、BC分别与p轴、T轴平行,气体在状态A时体积为V0,则在状态C时的体积为______;从状态A经状态B变化到状态C的过程中,气体对外界做功为W,内能增加了△U,则此过程中该气体吸收的热量为______.  jetguitar1年前1
jetguitar1年前1 -
 混口饭吃撒 共回答了18个问题
混口饭吃撒 共回答了18个问题 |采纳率94.4%解题思路:根据气体方程求解气体在状态C时的体积.
气体从状态A经状态B变化到状态C的过程中,应用热力学第一定律△U=W+Q求解.气体在状态A时压强为P0,体积为V0,温度为T0;
气体在状态C时压强为2P0,温度为2T0,体积设为V,则由理想气体状态方程[PV/T=C
可得:
P0V0
T0=
2P0V
2T0],解得:V=V0
气体从状态A经状态B变化到状态C的过程中,应用热力学第一定律△U=W+Q得
△U=-W+Q
所以Q=△U+W,即此过程气体吸收的热量为△U+W.
故答案为:V0,W+△U.点评:
本题考点: 理想气体的状态方程;热力学第一定律.
考点点评: 本题考查了理想状态方程的应用和热力学第一定律的应用,难度中等.1年前查看全部
- 在热力学温度中0K应为
 被骗人之一1年前1
被骗人之一1年前1 -
 务我 共回答了24个问题
务我 共回答了24个问题 |采纳率100%可望不可即的温度.是一个理想中的温度.永远无法达到1年前查看全部
- 液氮的凝固点为-210摄氏度,那么用热力学温度表示应该是( )k
 syx10261年前1
syx10261年前1 -
 rose_370 共回答了15个问题
rose_370 共回答了15个问题 |采纳率100%热力学温度T和摄氏温度t的关系是:T=t+273.15K 0℃=273.15K,往里面加减就是.零摄氏度以下为减,上为加.1年前查看全部
- 假定氧气的热力学温度提高一倍,氧分子全部离解为氧原子,
假定氧气的热力学温度提高一倍,氧分子全部离解为氧原子,
则氧原子的平均速率是氧分子平均速率的多少倍?为什么 小子快跑1年前1
小子快跑1年前1 -
 lwone 共回答了12个问题
lwone 共回答了12个问题 |采纳率66.7%温度提高一倍平均平动能增大一倍.E=1/2 mv^2,其中E为平均平动能,v为方均根速率,E增大为原来两倍,而m减小一半,故v增大一倍.而方均根速率与平均速率成正比,故平均速率同样变化.
如有不明欢迎追问.1年前查看全部
- 热力学温度(T)与摄氏温度(t)的关系式的易错陷阱是什么?
 l35241061年前1
l35241061年前1 -
 满汉全席来了啦 共回答了17个问题
满汉全席来了啦 共回答了17个问题 |采纳率88.2%热力学温度(T)与摄氏温度(t)的关系式:T=t+273.15 K
(1)公式解读
已知摄氏温度,通过热力学温度与摄氏温度的关系式T=t+273.15 K就可以求出其对应的热力学温度.同样,已知热力学温度T,根据公式的变形式t=T-273.15℃ 就可求出对应的摄氏温度.热力学温度是以绝对零度为起点的,其值只有正值,没有负值.
(2)运用技巧
摄氏温标的单位“℃”是温度的常用单位,但不是国际制单位,温度的国际制单位是开尔文,符号为K.在今后各种有关热力学计算中,一定要通过热力学温度(T)与摄氏温度(t)的关系式T=t+273.15 K 将温度单位转换为热力学温度即开尔文.
你这种类型的疑问在由湖南大学出版社出版、湘教出版事业有限公司策划的《高中物理问答词典》一书中有很详细地介绍,并且这本书具有跟字典的功能,希望能给你的学习带来很大的收获.1年前查看全部
- 如图示,是一个质量的理想气体状态变化的过程中密度随热力学温度T变化的曲线,由图线知 [
如图示,是一个质量的理想气体状态变化的过程中密度随热力学温度T变化的曲线,由图线知 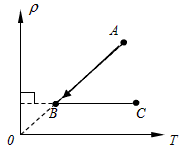 [ ]
[ ]A、过程中气体的压强与其热力学温度的平方成正比
B、过程中气体的体积不变
C、过程中气体的压强减小
D、过程中气体没有做功 aaron1389011年前1
aaron1389011年前1 -
 zengqi26 共回答了22个问题
zengqi26 共回答了22个问题 |采纳率90.9%AD1年前查看全部
- 一定质量的理想气体,从状态A经状态B变化到C,如图所示,则气体在状态A、B、C时热力学温度之比为(填选项前的编号)(
 一定质量的理想气体,从状态A经状态B变化到C,如图所示,则气体在状态A、B、C时热力学温度之比为(填选项前的编号)( )
一定质量的理想气体,从状态A经状态B变化到C,如图所示,则气体在状态A、B、C时热力学温度之比为(填选项前的编号)( )
A.3:2:1
B.4:3:4
C.3:4:3
D.1:2:3 cswfb4bxz77b_1_1年前1
cswfb4bxz77b_1_1年前1 -
 花猫花 共回答了14个问题
花猫花 共回答了14个问题 |采纳率85.7%A到B过程,根据理想气体状态方程:
P1V1
T1=
P2V2
T2
代入数据:[3×1
T1=
2×2
T2
得:
T1
T2=
3/4]
A与C相比,有P1V1=P3V3
则A与C温度相同,
故三状态温度之比为:3:4:3;
故选:C.1年前查看全部
- 一定质量的理想气体,其压强p与热力学温度T的关系图象如图所示,AB、BC分别与p轴、T轴平行,气体从状态A经状态B变化到
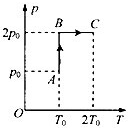 一定质量的理想气体,其压强p与热力学温度T的关系图象如图所示,AB、BC分别与p轴、T轴平行,气体从状态A经状态B变化到状态C,已知在整个变化过程中,气体内能增加了△U,外界对气体做功为W0,在状态A时气体的摩尔体积为V0,阿伏伽德罗常数N=6.02×1023mol-1,试求:
一定质量的理想气体,其压强p与热力学温度T的关系图象如图所示,AB、BC分别与p轴、T轴平行,气体从状态A经状态B变化到状态C,已知在整个变化过程中,气体内能增加了△U,外界对气体做功为W0,在状态A时气体的摩尔体积为V0,阿伏伽德罗常数N=6.02×1023mol-1,试求:
(1)整个过程中气体吸收的热量Q;
(2)气体在状态C时的摩尔体积VC;
(3)若V0=22.4L,一个肺活量为3360mL(吸入气体的最大体积)的人,最多能吸入A状态时气体分子的个数n.(结构保留1位有效数字) luoxi12291年前1
luoxi12291年前1 -
 lux21 共回答了12个问题
lux21 共回答了12个问题 |采纳率83.3%解题思路:(1)由热力学第一定律可以求出吸收的热量.(2)由理想气体状态方程可以求出气体体积.(3)应用阿伏伽德罗常数求出分子个数.(1)对气体,由热力学第一定律得:△U=W+Q,
则气体吸收的热量:Q=△U-W0;
(2)以状态A时1mol的气体为研究对象,由图示图象可知:pA=p0,VA=V0,TA=T0,
在状态C:pC=2p0,VC=?,TC=2T0,
由理想气体状态方程得:
pAVA
TA=
pCVC
TC,
代入数据解得:VC=V0;
(3)吸入气体分子的个数:n=
V
V0NA,
代入数据解得:n=9×1022个;
答:(1)整个过程中气体吸收的热量为:△U-W0;
(2)气体在状态C时的摩尔体积为:V0;
(3)最多能吸入A状态时气体分子的个数为9×1022个.点评:
本题考点: 理想气体的状态方程;封闭气体压强.
考点点评: 本题考查了求吸收的热量、求摩尔体积、求分子个数问题,应用热力学第一定律、理想气体状态方程、阿伏伽德罗常数即可正确解题.1年前查看全部
- 为什么有摄氏温度,华氏温度,热力学温度之分
 wdcd1年前1
wdcd1年前1 -
 bearyuan 共回答了19个问题
bearyuan 共回答了19个问题 |采纳率78.9%这是不同科学家研究出来的适合不同情况下使用的热力学单位.1年前查看全部
- 华氏温度 和热力学温度 有什么区别?
华氏温度 和热力学温度 有什么区别?
今天学的 看单位一样的 有区别么? lyfinnj1年前2
lyfinnj1年前2 -
 sunxx1218 共回答了16个问题
sunxx1218 共回答了16个问题 |采纳率100%最低的温度是0K,也就是-273.15摄氏度,不存在-273.16摄氏度,所以要是有人对你提到零下300度,那你就可以嘲笑一下他了!1K=-272.15 2K=-271.15 ...明白了吗1年前查看全部
- 关于热力学温度与摄氏温度,下列说法中正确的是( )
关于热力学温度与摄氏温度,下列说法中正确的是( )
A.-33.15℃=240K
B.温度变化1℃,也就是温度变化1K
C.摄氏温度与热力学温度的零度是相同的
D.温度由t℃升到2t℃时,对应的热力学温度由TK升至2TK brave_ghos1年前1
brave_ghos1年前1 -
 喀挲 共回答了20个问题
喀挲 共回答了20个问题 |采纳率85%解题思路:识记热力学温标与摄氏温标的概念与区别,便可解答此题,两者大小关系为T=273.15(K)+tA、热力学温度与摄氏温度之间的关系是T=273.15(K)+t,所以-33.15℃=240K.故A正确;
B、摄氏温度与热力学温度的差别为所选的零值的起点不同,单位不同;但每一度表示的冷热差别是相同的,热力学温度的每1K大小和摄氏温度的每1℃的大小相同.故B正确;
C、热力学温度的零度是-273.15℃,叫做绝对零度,故C错误;
D、温度由t℃升到2t℃时,对应的热力学温度由TK升至(T+t)K.故D错误.
故选:AB.点评:
本题考点: 温度、气体压强和内能.
考点点评: 解热力学问题关键要知道两种温标的区别与联系,概念要理解透彻.1年前查看全部
- 热力学温度的疑问衡量一个问题的温度 本质是 该物体分子的平均动能(动量)的大小 那么 假如我以高速移动一个物体 没有丝毫
热力学温度的疑问
衡量一个问题的温度 本质是 该物体分子的平均动能(动量)的大小
那么 假如我以高速移动一个物体 没有丝毫阻力 该物体本来分子的动量叠加分子移动的动量
则温度就会升高?
显然这是不正确的 要如何理解 laolaiye1年前2
laolaiye1年前2 -
 凌晨滨海大道边 共回答了19个问题
凌晨滨海大道边 共回答了19个问题 |采纳率100%物体是宏观上的,而分子是微观上的,宏观物体动量增加不一定分子的动量也增加,因为分子运动向各个方向,所以当物体延某一方向运动时,对于分子而言,有的方向速度增加,有的就减小,所以微观跟宏观表现不同1年前查看全部
大家在问
- 1已知函数f﹙x﹚=x﹙e的x次方﹣1﹚-ax²
- 2把一块棱长为40厘米的正方体钢块,融成一根长80厘米厚40厘米的钢条,这个钢条宽多少厘米
- 3把一块棱长为40厘米的正方体钢块,熔成一根长80厘米,厚40厘米的钢条.钢条的宽
- 4把一块棱长为40cm的正方体钢块融成一根长80厘米,厚20厘米的钢条,这个钢条多少厘米?
- 5cl-离子还原性显著吗,具体哪些酸根离子与阳离子之间会发生氧化还原反应
- 6把一块棱长为40厘米的正方体钢块,熔成一根长80厘米,厚40厘米的钢条.这根钢条宽多少厘米?
- 7高一英语怎样提至90分(满分100分)
- 8求下列函数的单调区间(1) y=2sin(π/4-x) (2) y=cos2x
- 9二次函数中h值和k值的求法公式
- 10这道题怎么算x²-2x
- 11一个大气压等于多少hpa
- 12有一个游泳池,匀速注水5小时放满,打开下部排水孔6小时排空,若同时注水排水,几
- 13配置200g20%的稀H2SO4,需98%的浓硫酸多少毫升?(密度为1.84g/ml ,水多少克?)配制过程
- 14瘦的的英文单词别推荐金山词霸!看不懂!直接写单词!
- 15《登泰山记》的第三段写泰山日出,是文章一重点,它的描写好在哪些地方?